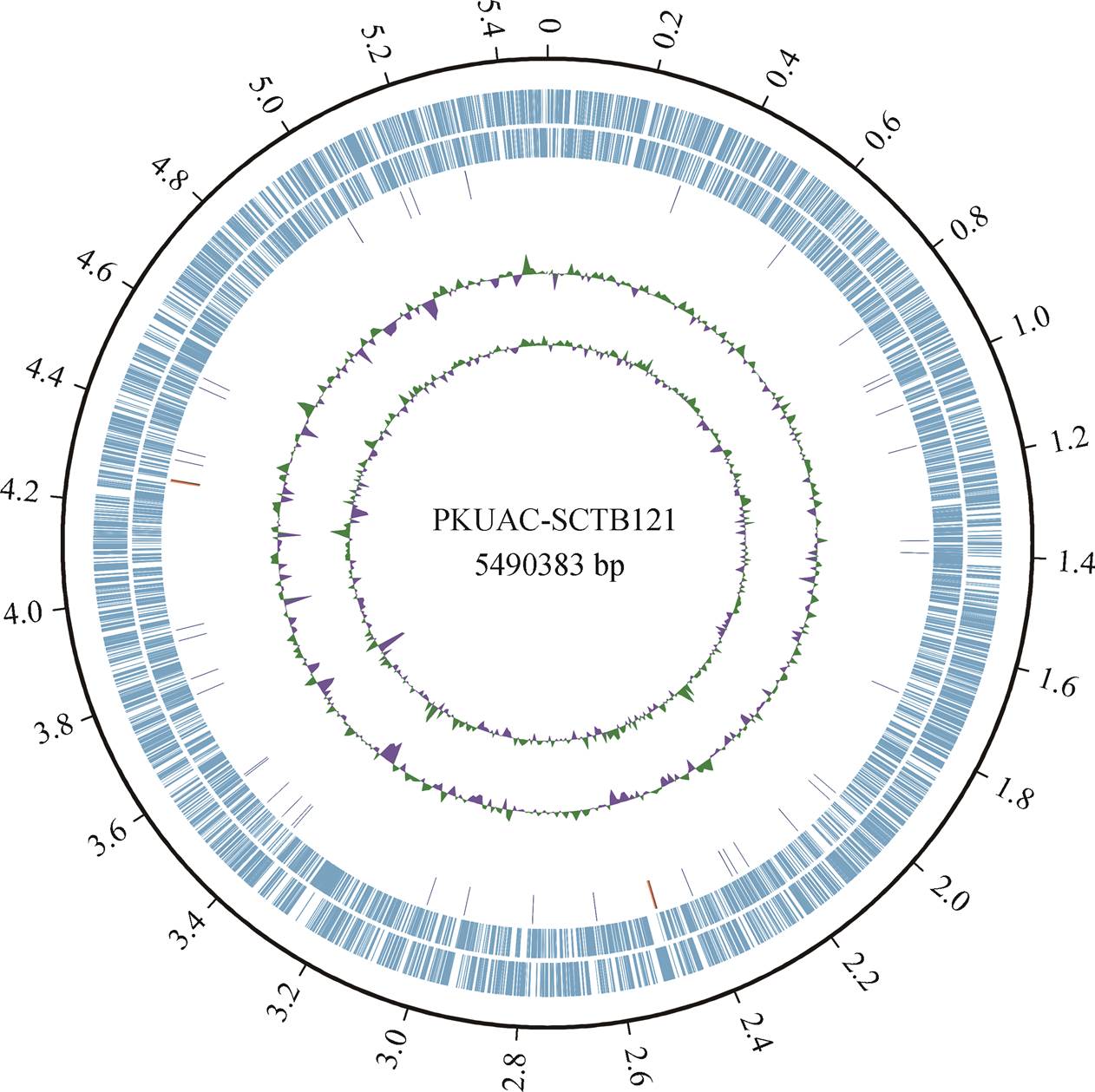
圆环由外到里分别表示正链编码序列、负链编码序列、rRNA和tRNA (均用橙色表示)、GC含量、GC偏移(GC skew); 刻度单位为 Mb
图1 B121菌株基因组环状图谱
Fig. 1 Circular plot of B121 genome
摘要 为了确定分离自四川甘孜地区温泉的嗜热丝状菌株 B121 的分类信息, 为探索其应用价值提供遗传学分析基础, 对其进行基因组分析、系统发育分析、二级结构预测、形态学鉴定以及结合菌株钠盐耐受性和固氮能力的整体分析。在 16S rRNA 的系统发育分析中, 发现菌株 B121 与菌株 Thermoleptolyngbya oregonensis PCC 8501, Thermoleptolyngbya albertanoae ETS-08和Thermoleptolyngbya sp.O-77 等嗜热鞘丝藻属菌株有较好的聚类。在 16S-23S ITS 二级结构预测分析中, 菌株 B121 的 D1-D1'区域与属内参考菌株有一定的相似性, 序列同一性也较高, 但都没有到达广义的同种物种标准, 并且 V2, BoxB 及 V3 区域与其他对照菌株的差异较大。结合形态学分析, 确定菌株 B121 是 Thermoleptolyngbya 属下的一个新种。菌株 B121 可在最高浓度为0.5M 的 NaCl 和 NaNO3 培养基中生存, 也可在浓度为1 M的NaCl培养基中存活。当气相条件为 Ar:N2: CO2=79:20:1 (体积比)时, 菌株B121的乙炔还原速率可以达到2564.1 nmol/(g∙h)。
关键词 嗜热蓝细菌; 16S rRNA; 16S-23S ITS; 系统发育分析; 二级结构
蓝细菌(Cyanobacteria)是一类分布广泛的光合自养原核生物, 通过生物固碳、释放氧气和固氮作用等生理过程, 在维持生态系统生产力平衡和生产可再生能源方面发挥重要作用[1–2]。有些蓝细菌中存在重氮营养体, 其固氮酶基因已被完整描述, 并应用于新型固氮植物的改造中[3]。蓝细菌具有极强的适应性, 能抵御不同的环境变化, 广泛分布于各种水体中, 其中嗜热蓝细菌生存在温度较高的温泉中。嗜热蓝细菌的最适生长温度在 45°C 以上, 通常可在高达 60°C 的环境下生存, 菌株 Synechococcus OH28 可以在 73°C 的环境中存活[4]。近年来, 分离自世界各地不同温泉(如黄石国家公园[5])的嗜热菌株不断地得到深入的研究。与生活在非温泉环境中的蓝细菌相比, 温泉环境中的嗜热蓝细菌有相对较小的基因组以及帮助适应温暖环境的蛋白质, 同时基因组的 GC 含量相对较高[5–6]。另外, 嗜热蓝细菌的基因组显示更高的无机离子转运和氨基酸代谢丰度以及蛋白质编码序列中较少的复制和转录功能[6]。这些基因组特性可能帮助蓝细菌更好地适应温泉环境[6]。从高温环境中分离和鉴定这些蓝细菌非常重要, 这些分离物在生产生物活性分子和有用的耐高温酶(如磷酸酶和激酶)方面具有巨大的生物技术潜力。在 Sciuto 等[7]关于两株分离自温泉的丝状蓝细菌的研究中, 建立了一个新的丝状蓝细菌类群, 即嗜热鞘丝藻属(Thermoleptolyngbya), 包含 T. orego-nensis PCC 8501, T. albertanoae ETS-08 和后来鉴定的 Thermoleptolyngbya sp.O-77 (简称 Tl.O-77)[8]等菌株。这个属种的建立为更好地分离和鉴定高温环境下生存的蓝细菌奠定了基础。
16SrRNA 基因是原核微生物分类系统中常用的标记, 是基于形态学的分类单元, 也是进一步检测新进化枝的重要工具[7]。然而, 16S rRNA 在物种水平上的分辨能力可能因谱系不同而有所差异, 且存在诸多限制[9]。近年来, 通过对二级结构的分析, 科学家们在蓝细菌系统中评估了另一个基因组区域: 16S-23S ITS 区域[10]。16S rRNA 系统发育分析与 16S-23S ITS 二级结构预测分析相结合, 是鉴定新物种和新的蓝细菌属非常有用的方法。过去的几年中, 研究者使用该方法将一些蓝细菌新属与其他属分离开, 并在该属内描述了新物种的存在[8]。
本文对从四川省甘孜地区温泉环境中分离出的嗜热丝状蓝细菌菌株 B121[11]进行 16S rRNA 系统发育分析, 并对其进行 16S-23S ITS 区域的二级结构预测分析和系统发育分析, 同时结合形态学分析, 对其分类进行较为完整的鉴定, 为探究其应用价值提供理论基础。
实验所用菌株 PKUAC-SCTB121 采集自甘孜州地区的温泉地带, 地理位置为北纬 30°15′57″, 东经101°52′24″, 环境温度为40.8~85.0°C (菌株 B121 可在最高温度为 50°C 的环境中生存), 环境 pH 值为 6.35~8.50。菌株保存于北京大学环境与能源学院生物能源实验室藻种库[11]。
使用 BG-11 培养基培养菌株 B121, 并将其放置于恒温光照培养箱中保存。培养条件是本研究组根据菌株分离环境的情况以及在实验室中对其进行耐温性实验[11]确定的: 温度为 45°C, 光照强度为 2000lux, 光暗比为 16 小时(光照) : 8 小时(黑暗)。
菌株 B121 的 gDNA 通过 GeneStar Kit 提取, 提取步骤按照试剂盒说明书进行。此步骤由 CTAB 提取法改进优化而来, 采用机械破碎植物细胞, 然后加入分离缓冲液, 将 DNA 溶解出来, 再经氯仿-异戊醇抽提除去蛋白质, 得到 DNA, 并使用纯化柱(OMEGA)进行纯化。使用 Illumina 平台和 ONT 平台, 对提取的 gDNA 进行测序。基于测序结果, 使用软件 Geneious (Geneious Prime® 2020.2.2)和 Un-icyler (Unicycler v0.4.8, Linux), 将两次测序的数据进行基因组组装, 获得菌株 B121 的基因组数据。然后, 使用 Kostas Lab 开发的在线工具[12], 将其与菌株 Tl. O-77 进行 Average Nucleotide Identity (ANI)分析, 因 ANI 分析需要菌株的全基因组数据。菌株Tl. O-77 已有公开发表的全基因组数据, 并且在使用NCBI 数据库对菌株 B121 的 16S rRNA 序列进行在线 BlastN 分析时, 菌株 Tl. O-77 的 16S rRNA 序列与菌株 B121 的 16S rRNA 序列具有最高的同一性(Identity = 98.90%)。在系统发育分析中, 菌株 Tl. O-77 也与菌株 B121 聚类在一起, 故选择菌株 Tl. O-77进行菌株 B121 的 ANI 分析。使用软件 Geneious (Geneious Prime® 2020.2.2)绘制菌株 B121 和 Tl. O-77 的共线性图。
基于菌株 B121 的基因组测序组装, 在 NCBI 数据库中对 16S rRNA 和 16S-23S ITS 序列数据进行在线 BlastN 分析, 检测出与菌株 B121 序列高度相似的参考菌株序列, 初步确定菌株 B121 的种属信息。使用 MEGA-X 软件进行 16S rRNA 和 16S-23S ITS的系统发育分析, 并在 GenBank 检索出菌株 B121与参考序列之间的对比情况, 使用最大似然(ma-ximum likelihood)运算, 采用 Tang 等[13]设定的参数, 最终构建出系统发育树。同时, 构建 NJ (neighbor-joining)和 MP (maximum parsimony)方法的系统发育树, 与使用最大似然方法构建的系统发育树一起进行分析。
基于 16S-23S ITS 的系统发育分析结果, 对菌株 B121 和 Thermoleptolyngbya 属中其他代表菌株的16S-23S ITS 序列进行二级结构分析。采用 Clustal Omega 鉴定 16S-23S ITS 序列中 D1-D1', V2, BoxB和 V3 区域, 并使用软件 RNAstructure (Version 6.2)对相关区域序列进行二级结构预测, 参数设置为默认值。
使用光学显微镜(LM, DP72; OLYMPUS, 日本)观察菌株 B121。将 50μL 悬浮藻液滴到载玻片上制备切片, 通过物镜与目镜放大 40 倍观察, 使用照相机(U-TV0.63XC; OLYMPUS, 日本)获得图像。
菌株 B121 的扫描电子显微镜(SEM)备样方法如下。用 PBS (Servicebio, G0002)轻轻洗涤经离心分离的菌株 B121, 加入电子显微镜固定剂(Ser-vicebio, G1102)固定 2 小时。然后, 在室温下用 1MOsO4(TedPellaInc)溶于 0.1MPB (pH=7.4)中固定 1~2小时。固定的材料在梯度乙醇系列(30%, 50%, 70%, 80%, 90%, 95%和 100%)(Sinaopharm)和乙酸异戊酯(Sinaopharm)中脱水 15 分钟。用临界点干燥器(Quorum, K850)干燥样品。接下来, 使用碳贴纸将标本附着到金属桩上, 并用金喷镀 30 秒。最后, 直接在扫描电子显微镜(HITACHI, SU8100)下观察涂层样品, 得到放大 3000 倍的菌株 B121 图像。
菌株 B121 的透射电子显微镜(TEM)备样方法如下。将电子显微镜固定剂(Servicebio, G1102)添加到经离心分离的菌株 B121 中, 并使沉淀的菌株重新悬浮在固定剂中, 用冷却的 1%琼脂糖溶液与细胞混合, 将琼脂糖块和样品在 0.1MPB (pH 7.4)中用 1%OsO4 固定 2 小时。然后, 按前面所述步骤将细胞脱水, 并包埋在纯 EMBed 812 树脂(SPI, 90529-77-4)中, 将其移入 65°C 烘箱中聚合 48 小时以上。接下来, 用超薄切片机(Leica, LeicaUC7)切成 60~80nm 的薄片, 用 2%乙酸铀饱和醇溶液和柠檬酸铅染色 8 分钟。最后, 用透射电子显微镜(HI-TACHI, HT7800)进行观察拍摄, 得到放大 4000 倍和 7000 倍的菌株 B121 图像。
在 BG-11 培养基中添加不同质量的 NaNO3, NaHCO3, Na2SO4, NaHSO4和NaHSO4等盐类, 测试菌株 B121 对不同浓度(0.1, 0.3, 0.5, 1.0 M)盐溶液的耐受性。实验开始一周后, 观察菌株 B121 的存活情况。菌株的培养条件如下: 温度为 45°C, 光暗比为 12小时(光照):12 小时(黑暗), 光强为 30μmol/ (m2∙s)。
取处在对数生长期的菌株 B121 进行乙炔还原实验, 测试菌株的固氮能力。用不含硝酸盐的培养基, 将在含硝酸盐培养基中培养的菌株 B121 洗涤多次, 洗涤过的细胞可在下述所有实验条件下使用。
在无硝酸盐的条件下, 将菌株放在惰性气体与3 种不同氮气含量(体积百分比)的混合物中生长: Ar:N2:CO2 = 79:20:1; Ar:N2:CO2 = 90:9:1; Ar:CO2 =99:1。
用橡胶塞密封包含 20mL 菌株的培养瓶(总体积为 60mL), 用每种不同的气体混合物冲洗 5 分钟后, 注射 2 mL 乙炔气体。菌株的培养条件如下: 温度为45°C, 光暗比为 12 小时(光照) : 12 小时(黑暗), 光强为 30μmol/(m2∙s)。培养 72 小时后, 测量乙炔的还原情况。
通过 1.3 节所述方法, 得到嗜热蓝细菌 B121 的全基因组环状图谱(图 1)。菌株 B121 环状基因组GC 含量为 56.03%, 长度 5490383 bp。
Illumina 平台测序所得数据量为 1795543950 bp。ONT 平台测序所得数据量为 3654912177bp, 其中, N50 为 26836, N90 为 5134。通过 Geneious 软件, 将短序列与 ONT 数据组装的基因组进行比对, 完成菌株 B121 基因组的最终组装, 得到序列长度为 5490383bp 的 B121 环状基因组, 其中约有 4535个 CDS (蛋白质编码区), 45 个 tRNA。此环状基因组的相关信息已上传到 NCBI 数据库, GenBank 登录号为 CP070366。

圆环由外到里分别表示正链编码序列、负链编码序列、rRNA和tRNA (均用橙色表示)、GC含量、GC偏移(GC skew); 刻度单位为 Mb
图1 B121菌株基因组环状图谱
Fig. 1 Circular plot of B121 genome
接下来, 对菌株 B121 和菌株 Tl. O-77 的全基因组进行 ANI 分析, 查看其基因组水平差异, 结果见附录 1 (访问 http://xbna.pku. edu.cn 查看附录)。
在分类生物学鉴定中, 对于 ANI 分析, 蓝细菌样品菌株与鉴定菌株的同一性不小于 95%时, 两者可被认定为同一物种[14]。根据附录 1 中数据, 菌株B121 与菌株 Tl. O-77 的 ANI 分析值为 93.46%, 说明菌株 B121 与菌株 Tl. O-77 不是同一物种, 更可能属于同种属。图 2 显示, 两株菌株具有一定的共线性。
同时, 在已公开发表的数据中, 菌株 Tl. O-77是 Thermoleptolyngbya (嗜热鞘丝藻属)内蓝细菌中唯一具有全基因组数据的, 因此菌株 B121 与其他基因组的关系无法通过 ANI 分析来判定, 需要进一步做其他鉴定工作。
选取 67 株菌株的 16SrRNA 基因序列作为参考序列, 与菌株 B121 构建 16SrRNA 系统发育树(图3)。使用 NJ (neighbor-joining)和 MP (maximum par-simony)方法构建的系统发育树见附录 2 和 3。
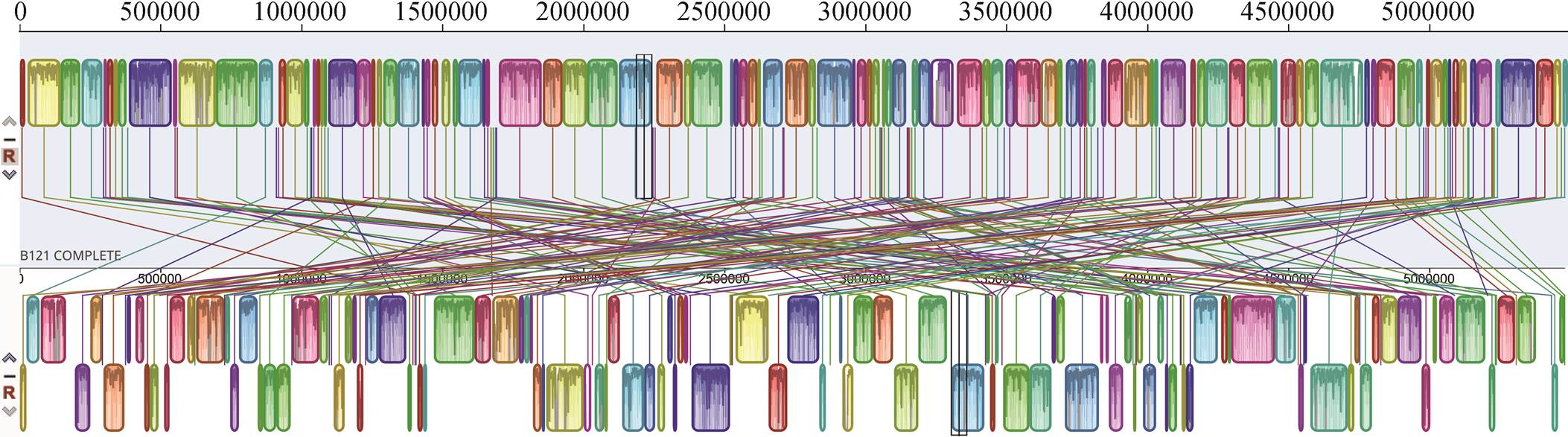
图2 菌株B121与Thermoleptolyngbyasp. O-77的共线性图
Fig. 2 Multiple synteny plot of strain B121 and Thermoleptolyngbya sp. O-77
在用 3 个方法构建的系统发育树中, 菌株 B121都与 Thermoleptolyngbya 的菌株聚类在一起, 包括Thermoleptolyngbya 的两个模式菌株 T. oregonensis PCC 8501 和 T. albertanoae ETS-08。其中, 菌株 T. albertanoae ETS-08 分离于意大利 Padua 地区温泉的底部热泥, 温泉的水温范围为 30~50°C, pH 范围是 6.8~7.0[15]; 菌株 T. oregonensis PCC8501 分离自美国俄亥俄州的 Geyser 温泉, 环境温度为 45°C, 在实验室的培养温度也是 45°C[7], 其他大部分 Ther-moleptolyngbya的菌株也分离自热环境[5,7]。
在对这些菌株进行物种分类信息查询时, 我们发现其分类信息不一致, 主要的分歧在于这些菌株的属的分类。在最新的研究中, Thermoleptolyngbya被分类在 Oculatellaceae 科[7], 而不是 Leptolyngbya-ceae 科, 而 Thermoleptolyngbya 这一簇菌株中, 有一些菌株的属分类依旧是 Leptolyngbyaceae 科的Leptolyngbya 属, 或者没有明确的科属信息。在Thermoleptolyngbya这一簇与菌株 B121 聚类的菌株附近, 有 CLADE C 以及 Oculatellaceae 科的 Pege-thrix 属和 Oculatella 属; 在 Sciuto 等[7]的工作中, CLADE C 对应发育树中的两株菌株。
这些菌株分类信息的不一致, 与后续研究的不完善有关。菌株 T. oregonensis PCC8501 于 1966 年从美国俄亥俄州的 Geyser 温泉中分离, 最初被鉴定为 Phormidiumlaminosum strain OH-1-p, 后被错误地鉴定为 Geitlerinema sp. PCC 8501, 直到 2016 年才被鉴定为 T. oregonensis PCC 8501[7]。所以, 其余与菌株 B121 聚类的菌株的准确分类信息, 还需要未来更多的研究来确定。
根据现有的几株Thermoleptolyngbya菌株的信息, 以及它们与菌株 B121 的序列的同一性比较数据, 我们还是可以在 16S rRNA 水平上初步鉴定菌株 B121 的分类情况。
对于 16S rRNA 分析, 当蓝细菌样品菌株与模式菌株的同一性不小于 97%时, 两者可被认定为同一物种; 同一性介于 93%~97%之间时, 两者仅可被认定为同一属; 同一性小于 93%时, 两者为不同属。经过计算, 数据库中几个 Thermoleptolyngbya菌株序列与菌株 B121 的同一性均超过 97%, 可以初步确定它们为同一属, 即菌株 B121 在 16SrRNA水平上属于 Thermoleptol-yngbya。但是, 利用 16S rRNA 对 Thermoleptol-yngbya 菌株进行物种水平的分类并不完全可靠。如果参考菌株 T. albertanoae ETS-08 和 T. oregonensis PCC 8501, 它们的 16S rRNA 同一性达到 99.45%。然而, 经过 16S-23S ITS二级结构以及形态学等综合分析后, 又被鉴定为Thermoleptolyngbya 中的不同物种。因此, 进一步确定菌株 B121 的分类学地位, 必须对其 16S-23S ITS 区域进行系统发育分析。
此外, 发育树也展示了多个不同的进化分支, 除 Thermoleptolyngbya 外, 其余的分枝还有 Ocula-tella, Pegethrix, Plectolyngbya, Alkalinema, Phormi-desmis, Leptolyngbya, Halomicronema 和 Nodosili-nea等[7]。
基于 16S rRNA 系统发育树和 16S-23S ITS 序列的可用性, 选取 30 株蓝细菌与 B121 共同构建 16S-23S ITS 系统发育树(图 4)。用NJ 和 MP 方法构建的系统发育树见附录 4 和 5。
用 3 个方法构建的系统发育树都展示出几个进化分枝: Oculatella, Phormidesmis, Kovacikia, Lepto-lyngbya sensu stricto 和 Alkalinema。Thermolepto-lyngbya 分枝下有菌株 B121, Tl. O-77, T. oregonensis PCC 8501 和 T. albertanoae ETS-08。在 16S-23S ITS的系统发育分析中, 我们发现菌株 B121 与菌株 Tl. O-77 聚类在一起, 其次, 菌株 B121 与 T. oregonensisPCC8501 和 T. albertanoae ETS-08进一步聚类。16S rRNA 的系统发育分析初步确定, 菌株 B121 属于 Thermoleptolyngbya分类下的蓝细菌, 而在 16S-23S ITS 的系统发育分析中, 菌株 B121 与这个属内的菌株也聚成一个分支, 由此可以确定菌株 B121属于 Thermoleptolyngbya。
在 Thermoleptolyngbya 内, 只有 T. albertanoae ETS-08, T. oregonensis PCC8501 以及菌株 Tl. O-77具有公开发表的 16S-23S ITS 序列, 因此使用它们与菌株 B121 的 16S-23S ITS 序列进行比对。使用tRNAscan-SE 检测菌株 B121 及所有参考菌株序列结果显示它们的 16S-23S ITS 中同时存在高度保守的 tRNAAla 和 tRNAIle 片段。各区域的二级结构如图5~8 所示。D1-D1'区域二级结构的预测结果如图 5 所示。菌株B121 与 Thermoleptolyngbya 分类下的 3 株菌株具有相同的 D1-D1'区域结构, 只是在序列上存在一定的差异。D1-D1'区域的整体结构中, 所有菌株具有相同的基茎结构(GACCU-AGGUC), 从基底茎开始, 有 7 个碱基在右部凸起; 接下来有 1 个对称的内环, 该内环包含 2 个残基; 其后有单个碱基的左凸起; 最后, 有包含 10 个残基的对称内部环和包含 3 个碱基的发夹环。
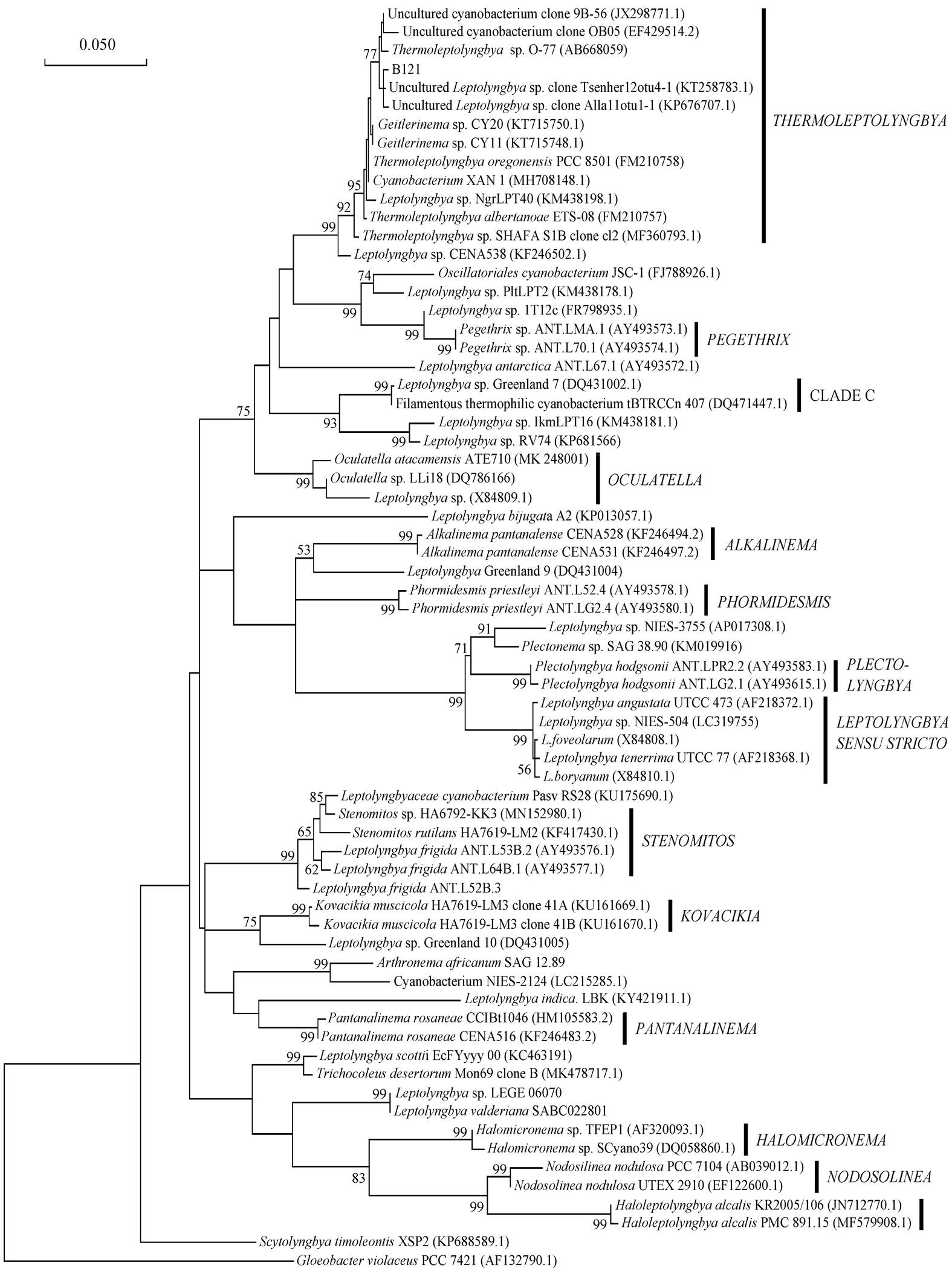
图3 嗜热蓝细菌B121的16SrRNA系统发育树
Fig. 3 Maximum-likelihood phylogenetic tree of 16S rRNA gene sequences
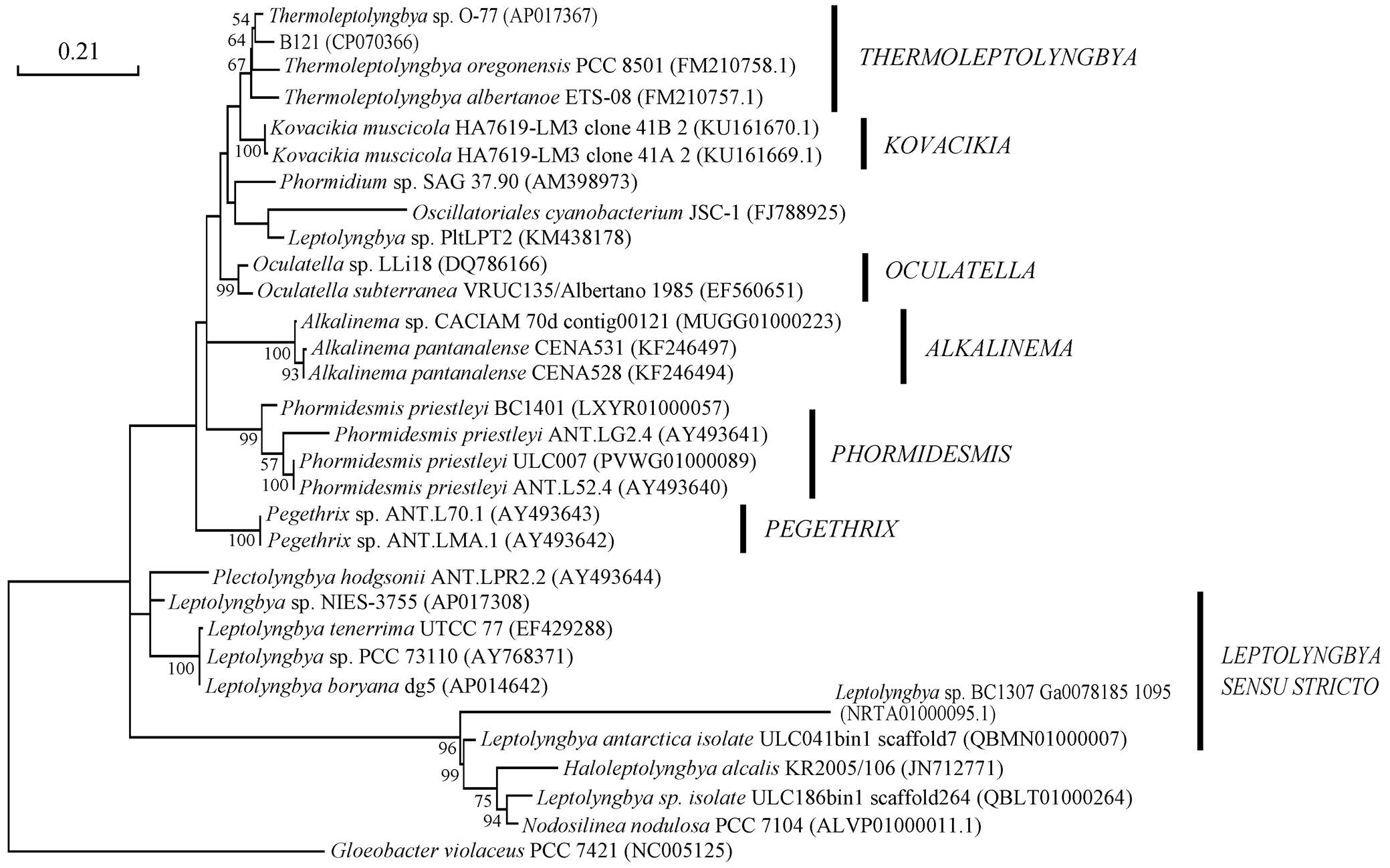
图4 嗜热蓝细菌B121的16S-23SITS系统发育树
Fig. 4 Maximum-likelihood phylogenetic tree of 16S-23S ITS sequences
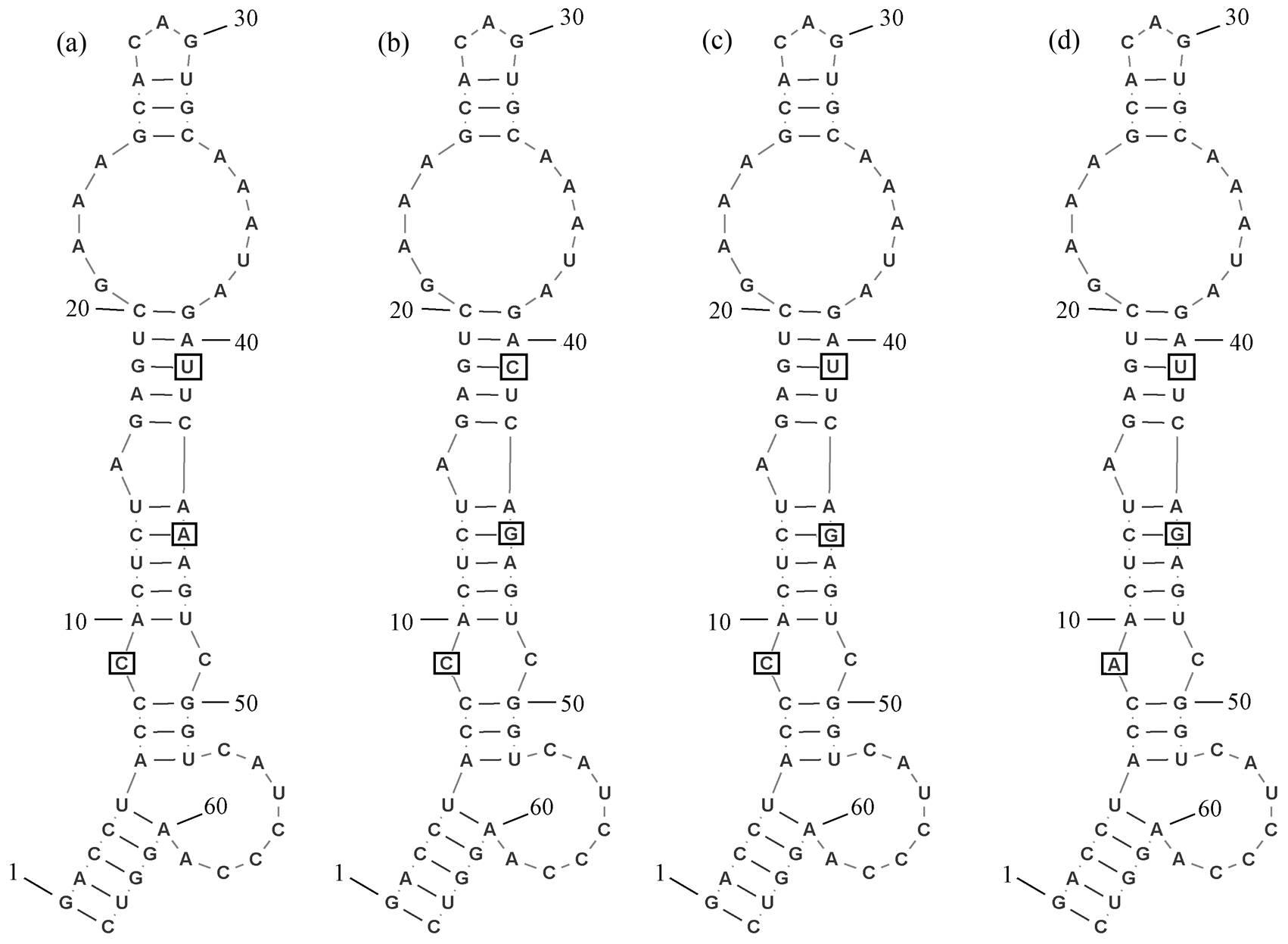
(a) B121, (b) T. albertanoae ETS-08, (c) Tl. O-77, (d) T. oregonensis PCC8501, 方框标注3处序列差异
图5 菌株B121和比较菌株的D1-D1'区域二级结构预测
Fig. 5 Prediction of secondary structure of D1-D1' region of strain B121 and other comparative strains
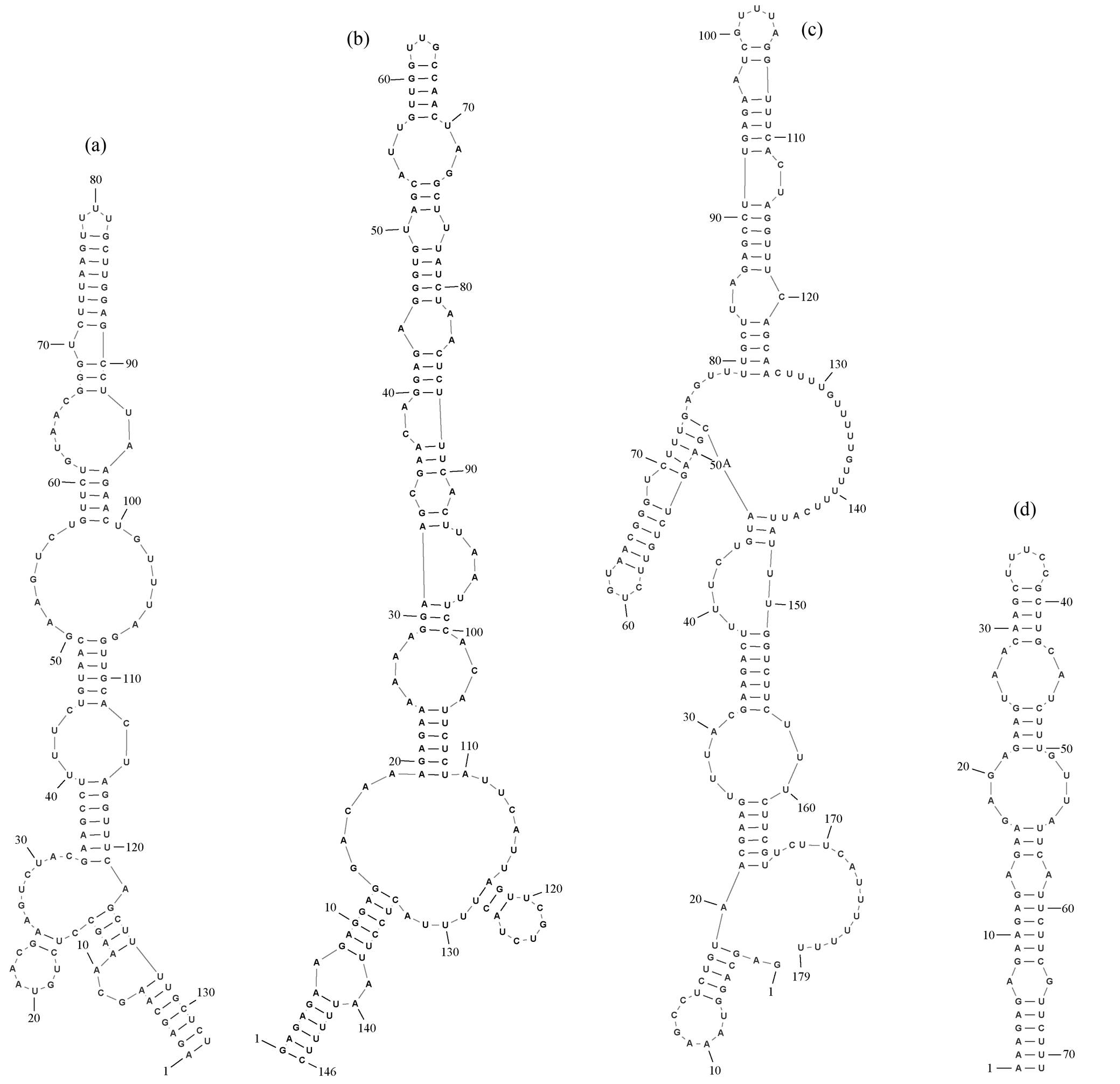
(a) B121; (b) T. albertanoae ETS-08; (c) Tl. O-77; (d) T. oregonensis PCC8501
图6 菌株B121和比较菌株的V2区域二级结构预测
Fig. 6 Prediction of secondary structure of V2 region of strain B121 and other comparative strains
如表 1 所示, 4 株菌株的 D1-D1'区域的序列长度都是 64bp, 序列同一性皆高于 93%。作为高度保守的 D1-D1'区域, 相同的序列长度和预测结构以及较高的同一性说明它们是同一属。
图 6 展示预测得到的 V2 区域结构。菌株 B121与比较菌株没有相同的 V2 预测结构, 此区域结构有较大不同, 它们没有共同的基础一级结构。菌株B121 具有较长的 V2 预测结构, 菌株 T. albertanoae ETS-08 拥有最复杂的 V2 预测结构。
表 1 中 4 株菌株的 V2 区域序列长度有较大差异, 序列同一性较低。与菌株 B121 同一性最高的是菌株 Tl.O-77, 两者 V2 区域序列的同一性为87.88%。这些不能进一步说明它们之间的物种关系。
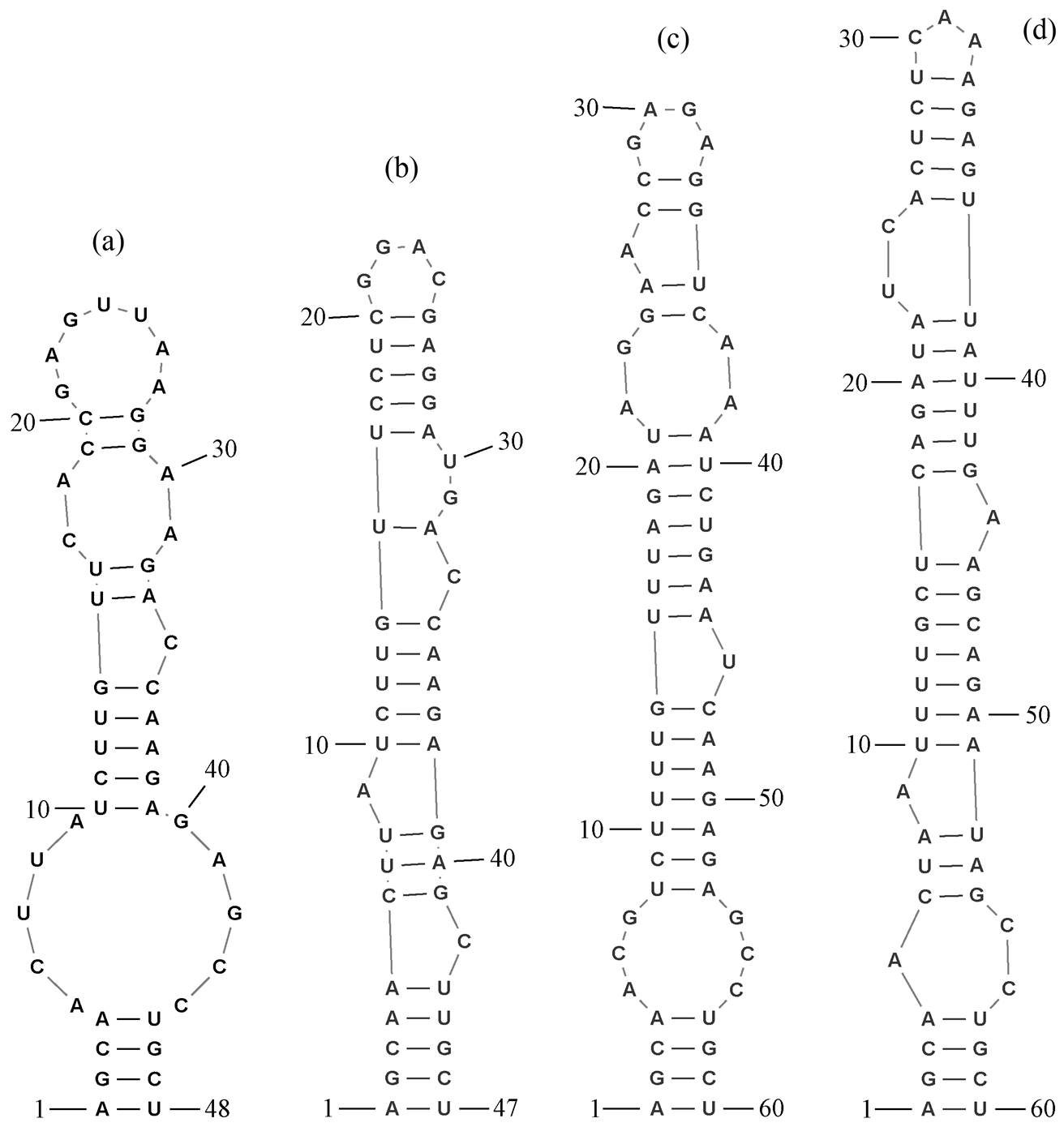
(a) B121, (b) T. albertanoae ETS-08, (c) Tl. O-77, (d) T. oregonensis PCC8501
图7 菌株B121和比较菌株的BoxB区域二级结构预测
Fig. 7 Prediction of secondary structure of BoxB region of strain B121 and other comparative strains
图 7 显示菌株 B121 和比较菌株的 BoxB 区域结构。菌株 B121 与比较菌株没有同样的预测结构, 但菌株 B121 与菌株 T. albertanoae ETS-08 的 BoxB区域结构长度接近, 序列中的碱基有所不同。菌株B121, Tl. O-77 和 T. oregonensis PCC8501具有相同的基础茎结构(AGCA-UGCU), T. albertanoae ETS-08 的基础茎结构为 AGCAA-UUGCU。菌株 B121的 BoxB 区域结构如下: 首先, 茎结构的前端中, 1个碱基左侧凸起, 与两个碱基从右侧凸起形成 1 个不对称内环, 随后的单个碱基右侧凸起, 与 2 个碱基左侧凸起形成不对称内环, 之后是 1 个单碱基右侧凸起形成的不对称内环, 最后有 1 个包含 4 个碱基的对称内部环和包含 7 个残基的末端发夹环。菌株 T. albertanoae ETS-08 具有 4 个不对称内环以及包含 4 个碱基的末端发夹环。菌株 Tl. O-77的 BoxB结构是 1 个含 6 个碱基的对称内环, 1 个碱基右凸起的不对称内环, 一个含 4 个碱基的对称内环, 以及 1个碱基左凸起的不对称内环和含 4 个碱基的末端发夹环。菌株 T. oregonensis PCC8501 包含 4 个不对称内环以及 1 个含有 3 个碱基的末端发夹环。
图 8 显示菌株 B121 和比较菌株的 V3 区域二级预测结构。菌株 B121 与 T. oregonensis PCC8501 以及 T. albertanoae ETS-08 的 V3 结构序列中, 碱基稍有不同, 从表 1 可知, 它们之间的同一性不高。它们都具有相同的基础茎结构(GUC-GAC), 并伴有2 个不对称内环、2 个对称内环和包含 9 个残基的末端发夹环。这 3 株菌株在第 2 个不对称内环处稍有不同, 菌株 B121 和 T. oregonensis PCC8501具有单个碱基右侧凸起和 2 个碱基左侧凸起形成的不对称内环, T. albertanoae ETS-08 则具有单个碱基左凸起的不对称内环; B121 的 V3 结构中, 第 1 个对称内环有 6 个碱基, T. albertanoae ETS-08 的第 1 个对称内环有 8 个碱基, T. oregonensis PCC8501 的第 1 个对称内环有 4 个碱基。另外, 菌株 B121 与菌株 Tl. O-77 的 V3 预测结构稍有不同, 后者在末端多出 1 个不对称内环, 并且末端发夹环由 4 个碱基组成。
从整体上看, 所有分析序列 D1-D1', V2, BoxB和 V3 结构域的长度不尽相同。由表 1 可知, 包括菌株 B121 在内的 5 个菌株的 D1-D1' 结构域序列长度均为 64bp。V2 结构域的长度差别较大, 其中区域序列最长的是菌株 Tl. O-77, V2 结构域序列长度为178bp; 菌株 B121 的 V2 结构域序列长度为 133bp。菌株 Tl. O-77 和 T. oregonensis PCC8501 的 Box B 结构域序列长度最大, 为 60bp, 其余菌株该结构域序列长度均不超过 60bp。菌株 B121, T. albertanoae ETS-08 和 T. oregonensis PCC8501 拥有相同序列长度的 V3 结构域。
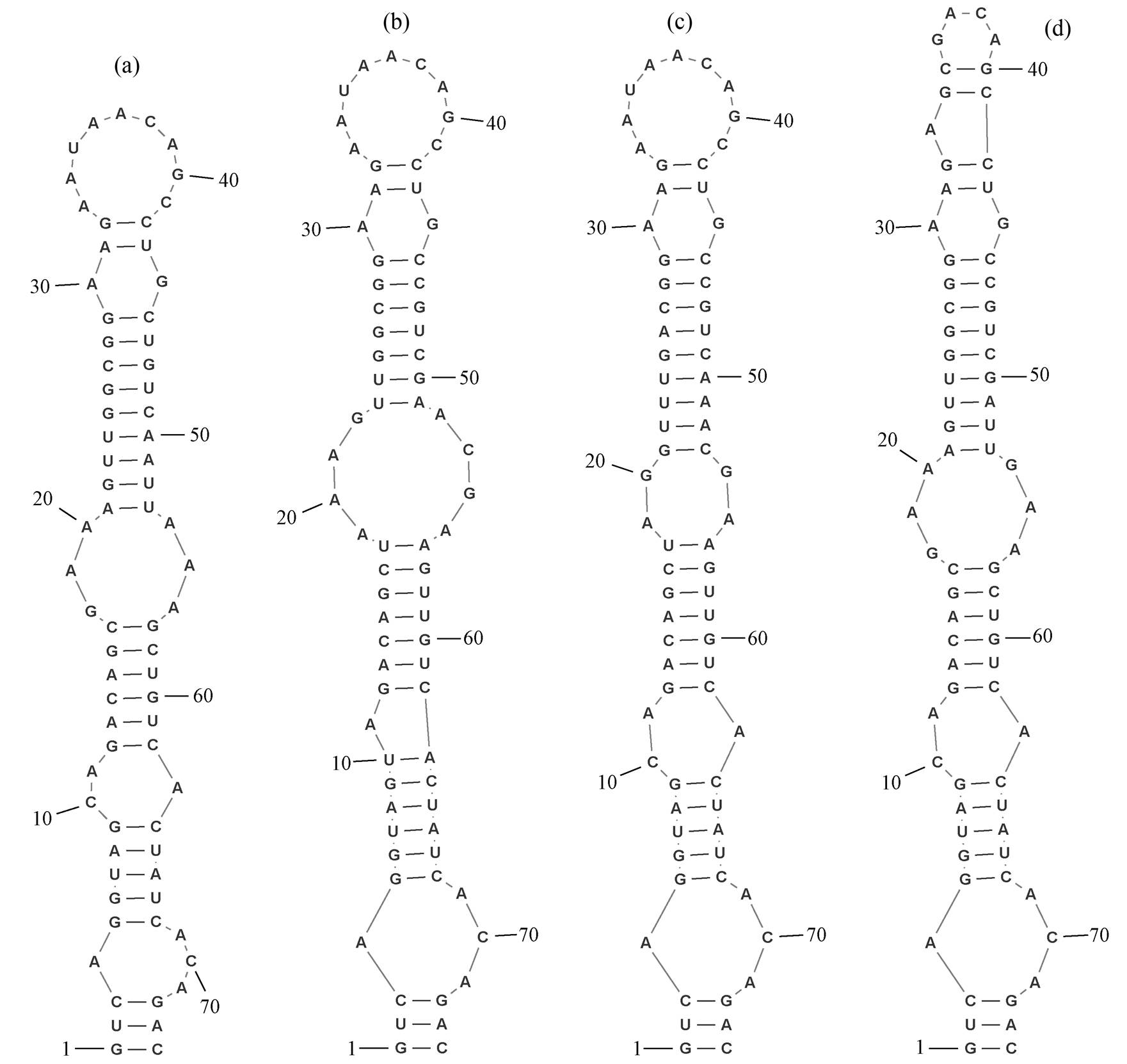
图8 菌株B121和比较菌株的V3区域二级结构预测
Fig. 8 Prediction of secondary structure of V3 region of strain B121 and other comparative strains
表1 B121和参考菌株16S-23SITS各结构域的序列长度及其同一性
Table 1 Length of B121 and reference strains’ domain helix in 16S-23S ITS, and the identities between B121 and reference strains in 16S-23S ITS
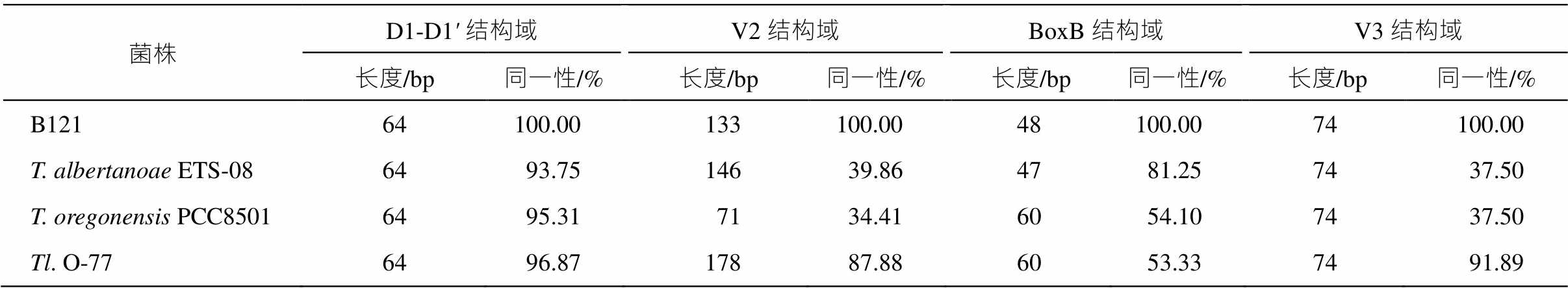
菌株D1-D1' 结构域V2 结构域BoxB 结构域V3 结构域 长度/bp同一性/%长度/bp同一性/%长度/bp同一性/%长度/bp同一性/% B12164100.00133100.0048100.0074100.00 T. albertanoae ETS-086493.7514639.864781.257437.50 T. oregonensis PCC85016495.317134.416054.107437.50 Tl. O-776496.8717887.886053.337491.89
在对 D1-D1' 区域的分析中, 菌株 B121 有 3 个碱基与参考菌株有所差异, 但菌株 B121 与参考菌株有相同的二级结构, 且菌株 B121 与菌株 Tl. O-77, T. albertanoae ETS-08 和 T. oregonensis PCC8501 的序列同一性较高, 均处在 93%~97%区间, 这也佐证了 16S 和 16S-23S ITS 的系统发育分析结果, 即菌株 B121 是 Thermoleptolyngbya分类下的蓝细菌; 然而, 在对 V2, BoxB 和 V3 等区域的分析中, 菌株B121 与菌株 Tl. O-77, T. albertanoae ETS-08 和 T. oregonensis PCC8501 等在二级结构、序列同一性和序列长度等方面差异较大。由表 1 可知, V2, BoxB 和 V3 区域的基因序列与菌株 B121 的同一性均不超过 93%, 最低为 34.41% (B121 和 PCC8501的 V2 区域)。因此, 对 V2, BoxB 和 V3 等区域的分析将菌株 B121 与参考菌株分离开来, 菌株 B121 与它们不是同一物种。
图 9(a)是对菌株 B121 放大 40 倍后的光学显微镜(LM)图像, 图 9(b)是放大 3000 倍的扫描电子显微镜(SEM)图像, 图 9(c)和(d)分别是放大 4000 倍和7000 倍的透射电子显微镜(TEM)图像。SEM 图像显示, 丝状菌株 B121 由细长的毛状体组成, 毛状体由 10~25 个桶形的单个细胞组成, 无分支, 毛状体有笔直、波浪形以及弯曲 3 种形态。通过纵向观察可以发现毛状体是由长圆柱形细胞组成的单生细丝, 在横壁处有收缩(图 9(b))。TEM 图像展示菌株B121 的超微结构特征, 支持 SEM 的结果, 单个细胞的长度为 2.0~3.6μm, 宽度为 0.5~0.9μm (图 9(b)和(c))。长圆柱形细胞之间通过细胞壁的向心内陷将细胞分开, 且未观察到细胞之间存在细胞内部连接(图 9(d))。类囊体的层数 3~5 不等, 在细胞的内周平行排列。大多数细胞的细胞质中都存在鞘、隔膜、羧酶体、藻青素颗粒和多磷酸盐小体等结构。
菌株 B121 的形态学特征表明它与先前描述的Thermoleptolyngbya 分类下的蓝细菌有许多相似之处。它们之间的形态学特征和超微结构比较如表 2所示。光学显微镜结果显示, 菌株 B121, T. alber-tanoae ETS-08 和 T. oregonensis PCC8501 都是蓝绿色的丝状细胞, 且类囊体数目相差不大。然而, 菌株 B121 的形态特征与 T. albertanoae ETS-08 不有所同。菌株 B121 以及 T. oregonensis PCC8501 的鞘是未分层的, 而 T. albertanoae ETS-08 显示出外皮的多层结构。其次, 在菌株 B121 和 T. albertanoae ETS-08 中, 大多数细胞的细胞质中都存在羟酶体、藻青素颗粒和少量的多磷酸盐小体。在菌株 B121和 T. albertanoae ETS-08 内部的交叉壁上可以观察到颗粒, 而在 T.oregonensis PCC8501 内部的交叉壁上没有发现颗粒。此外, 菌株 B121 的单个细胞长度为 2.0~3.6μm, 宽度为 0.5~0.9μm, 菌株 T. al-bertanoae ETS-08 的单个细胞长度为 1.5~3.0μm, 宽度值最大为 1.0μm, 而菌株 T. oregonensis PCC-8501 的单个细胞长度为 2.0~6.5μm, 宽度为 0.8~1.8 μm, 3 个菌株在细胞尺寸上有差异。
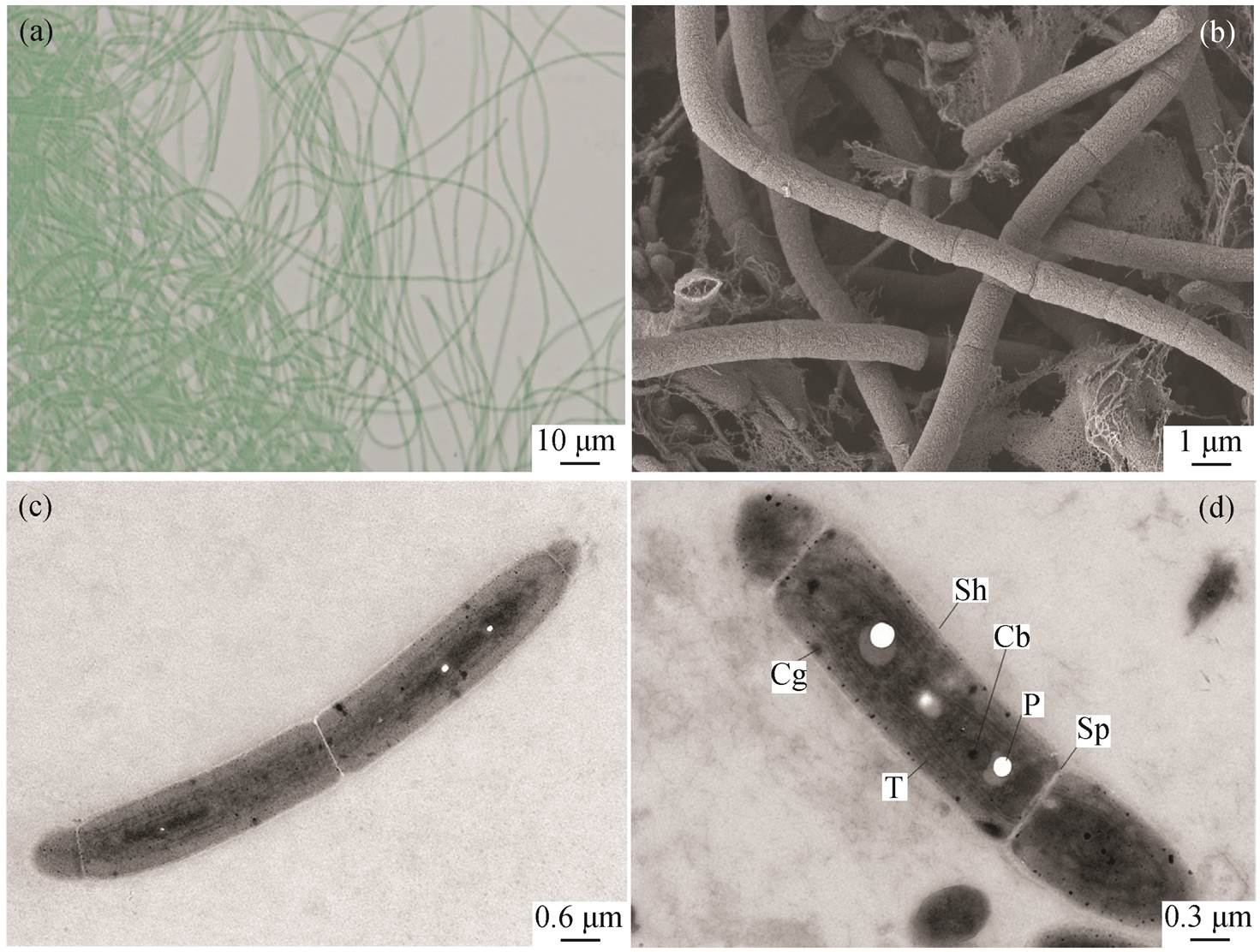
Cb:羧酶体; Cg:藻青素颗粒; P:多磷酸盐小体; Sh:鞘; Sp:隔膜; T:类囊体
图9 光学显微镜(a)、扫描电镜(b)及透射电镜((c)和(d))实验结果
Fig. 9 Pictures of light microscope (LM) (a), scanning electron microscope (SEM) (b), and transmission electron microscope (TEM) ((c) and (d))
表2 菌株B121与参考菌株的形态学特征及超微结构比较
Table 2 Morphological and ultrastructural comparison between strain B121 and reference strains
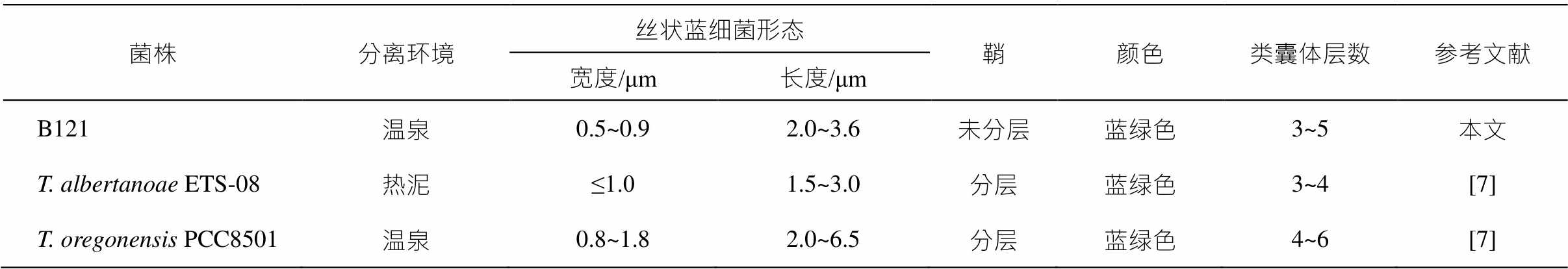
菌株分离环境丝状蓝细菌形态鞘颜色类囊体层数参考文献 宽度/μm长度/μm B121温泉0.5~0.92.0~3.6未分层蓝绿色3~5本文 T. albertanoae ETS-08热泥≤1.01.5~3.0分层蓝绿色3~4[7] T. oregonensis PCC8501温泉0.8~1.82.0~6.5分层蓝绿色4~6[7]
由于缺乏足够的 Thermoleptolyngbya 蓝细菌形态学数据, 菌株 B121 的形态学研究受到一定程度的限制, 未来应对其进行更深入的形态学分析比较研究。
菌株 B121 的钠盐耐受性情况如表 3 所示。菌株 B121 对 NaHSO4 的耐受性较差, 即使盐浓度为0.1M, 也无法存活。对于 NaNO3 和 NaCl, 菌株B121 有较好的耐受性, 可以在盐浓度为 0.5M 的条件下存活。菌株 B121 对 Na2SO4 的耐受性最好, 在盐浓度为 1 M 时仍然存活。
菌株 B121 的固氮情况如表 4 所示, 气相条件中, 氮气的比例对固氮酶的活动有较大的影响。气相条件为 Ar:N2:CO2=79:20:1 时, 乙炔还原速率最大(即固氮酶活性最高), 达到 2546.1nmol/(g∙h)。气相条件为 Ar:CO2 =99:1时, 乙炔还原速率最低。
表3 菌株B121的钠盐耐受性
Table 3 Sodium salt tolerance of strain B121

浓度/MNaNO3Na2SO4NaHSO4NaCl 0.1++‒+ 0.3++‒+ 0.5++‒+ 1.0‒+‒‒
表4 菌株B121在不同气相条件中的固氮酶活性
Table 4 Effects of the gas phase for the induction of nitrogenase activity in B121

气相条件乙炔还原速率/(nmol∙g‒1∙h‒1) Ar : N2 : CO2 = 90 : 9 : 11127.2 Ar : N2 : CO2 = 79 : 20 : 12564.1 Ar : CO2 = 99 : 1 608.1
首先, 根据 16S rRNA 的系统发育分析结果及其与参考菌株的同一性, 初步确定菌株 B121 为Thermoleptolyngbya 分类下的蓝细菌。菌株 B121 的实验室培养温度为 45°C, 且在此温度下生长情况良好, 与其聚类的菌种中, 菌株 T.oregonensis PCC-8501 的分离环境温度和实验室培养温度都为 45°C, 菌株 Tl.O-77 可以在 25~60°C 之间生存, 最适生长温度为 55°C, 菌株 T.albertanoae ETS-08 则可以在25~55°C 之间生存[7]。可见菌株 B121 与 Thermole-ptolyngbya 分类下的蓝细菌具有较为相近的生长温度。上述 3 株菌株都可以在较高的温度下生存, 但是与 T. albertanoae ETS-08 有较近亲缘关系的菌株可以在更高的环境中生存。菌株 ST7S_1CY, 分离自阿尔及利亚的温泉, 可在温度最高为 70°C 的环境中生存[7]。
对 16S-23S ITS 序列的系统发育分析中, 菌株B121 与 Thermoleptolyngbya 内的菌株聚成一个分支, 由此确定菌株 B121 属于 Thermoleptolyngbya。
在对 16S-23S ITS 序列的分析中, 进一步考虑了菌株 B121 和比较菌株的预测二级结构对比, 因为该区域包含高度可变的区域和保守的结构域, 深入观察不同区域传递的物种关系信息是必要的。
从表 1 中可以看出, 在对 16S-23S ITS 序列的二级结构预测分析中, 菌株 B121 与菌株 Tl.O-77, T. albertanoae ETS-08 以及 T. oregonensis PCC8501 的D1-D1'序列有较高的同一性, 与 16S rRNA 的系统发育分析的结果相吻合。因此, D1-D1'序列的分析结果可以佐证菌株 B121 与 T. albertanoae ETS-08以及 T. oregonensis PCC8501 等同属 Thermolepto-lyngbya分类下的蓝细菌。
另一方面, 与其他相关菌株相比, 对菌株 B121 的二级结构预测分析证实了新物种存在的可能性。实际上, 所有被分析的区域(特别是 V2, BoxB 和 V3区域), 菌株 B121 与参考菌株在区域结构和序列同一性等方面的差异都将菌株 B121 与其他已报道的菌株清晰地区分开来。虽然 16S-23S ITS 序列中各区域同一性指示的分类学结论并不是很明确, 然而这些差异的确传递出新物种存在的可能性。Sciuto等[7]对菌株 T. albertanoae ETS-08 和 T. oregonensisPCC8501 的二级结构预测研究在 Thermoleptolyngbya属的确立中起到非常重要的作用。
在本文分析的结构域中, V2 区域是变化最多、分类信息较少的区域。这一发现与 Iteman 等[10]的观察一致, 他们认为该区域的高度可变性以及某些蓝细菌在这一区域的缺失表明其“没有任何基本功能”。在菌株 B121 中, D1-D1'区域的二级结构显示出一些变异, 但基本结构与比较菌株一致。BoxB区域显示出较多的变异, V3区域的结构则显示出较多的碱基的不同, 后两者的结构比较中, 菌株 B121与比较菌株也有较大的差异。
从形态学的角度分析, 菌株 B121 与 Thermo-leptolyngbya 分类下的蓝细菌有较多相似之处, 可以支持通过 16S rRNA 和 16S-23S ITS 的系统发育分析对菌株 B121 属于 Thermoleptolyngbya 的鉴定。然而, 在细胞大小和鞘的结构等方面也有不同之处, 因此形态学分析不支持菌株 B121 与菌株 T. orego-nensis PCC8501 及 T. albertanoae ETS-08 等为同一物种。结合对 16S-23S ITS 序列的二级结构预测分析和同一性数据, 可以判断菌株 B121 是不同于其他参考菌株的 Thermoleptolyngbya 分类下的一个新物种。
在钠盐耐受性方面, 本文关注菌株 B121 对 4种钠盐的耐受性。本研究组的前期研究表明, 菌株B121 还可以耐受钠盐 NaHCO3 浓度为 0.3M 的生存环境[11]。综合来看, 菌株 B121 具有一定程度的盐耐受性。
在固氮潜力方面, 我们使用经典的乙炔还原方法, 发现气相中氮气的比例对固氮酶的活性影响显著, 与 Yoon 等[16]对菌株 Tl. O-77 的固氮研究结果有相似之处, 菌株 Tl. O-77 的乙炔还原速率也随氮气比例的变化而改变。不同的是, 菌株 Tl. O-77 在Ar:N2:CO2 =90:9:1 条件下固氮酶活性最高, 而菌株B121 在 Ar:N2:CO2 = 79:20:1 的条件下乙炔还原速率最高。
对蓝细菌进行分类是复杂且困难的, 特别是在可能与菌株 B121 同源的比较菌株缺乏更多研究报道和公开数据的情况下。因此, 细菌分类学状态的最终确定需要多相分类分析, 包括生化特征以及多位点基因组分析等。
根据 16S rRNA 的系统发育分析, 初步判定菌株 B121 在 16S rRNA 水平上属于 Thermoleptolyngbya; 16S-23S ITS 序列的系统发育分析确认菌株 B121 属于 Thermoleptolyngbya。在 16S-23S ITS 序列的二级结构预测分析中, 菌株 B121 与比较菌株在 V2, BoxB以及 V3 区域的序列同一性和结构上有较大的差异, 可以初步判定菌株 B121 与比较菌株并非同一物种, 高度保守区域的二级结构预测依旧支持系统发育分析对菌株属分类的结果。此外, 在形态学分析结果中, 菌株 B121 与 Thermoleptolyngbya 分类下的蓝细菌有较多相似之处, 同时在细胞大小和形态结构等方面有一些不同, 结合二级结构预测分析的结果, 判定菌株 B121 与已报道的 Thermoleptolyngbya 内蓝细菌不是同一物种。且具有一定的钠盐耐受能力和固氮能力。
综上所述, 我们确定菌株 B121 是 Thermolep-tolyngbya (嗜热鞘丝藻属)分类下的一个新种。
参考文献
[1]Schirrmeister B E, Gugger M, Donoghue P C J. Cyanobacteria and the great oxidation event: evidence from genes and fossils. Palaeontology, 2015, 56(5): 769–785
[2]Issa A A, Abd-Alla M H, Ohyama T. Nitrogen fixing cyanobacteria: future prospect [C/OL] // Ohyama T. Advances in Biology and Ecology of Nitrogen Fixa-tion. (2014–01–29) [2021–03–01]. https://www.intech open.com/books/advances-in-biology-and-ecology-of-nitrogen-fixation/nitrogen-fixing-cyanobacteria-future-prospect
[3]Nonaka A, Yamamoto H, Kamiya N, et al. Accessory proteins of the nitrogenase assembly, NifW, NifX/ NafY, and NifZ, are essential for diazotrophic growth in the nonheterocystous cyanobacterium Leptolyngbya boryana. Frontiers in Microbiology, 2019, 10(3): 1–10
[4]Cox A, Shock E L, Havig J R. The transition to microbial photosynthesis in hot spring ecosystems. Chemical Geology, 2011, 280(3/4): 344–351
[5]Hall J R, Mitchell K R, Jackson-Weaver O, et al. Molecular characterization of the diversity and distri-bution of a thermal spring microbial community by using rRNA and metabolic genes. Applied and Envi-ronmental Microbiology, 2008, 74(15): 4910–4922
[6]Alcorta J, Alarcón-Schumacher T, Salgado O, et al. Taxonomic novelty and distinctive genomic features of hot spring cyanobacteria. Frontiers in Genetics, 2020(11): 568223
[7]Sciuto K, Moro I. Detection of the new cosmopolitan genus Thermoleptolyngbya (cyanobacteria, Leptolyng-byaceae) using the 16S rRNA gene and 16S–23S ITS region. Molecular Phylogenetics and Evolution, 2016, 105: 15–35
[8]Nakamori H, Yatabe T, Yoon K S, et al. Purification and characterization of an oxygen-evolving photosy-stem II from Leptolyngbya sp. strain O-77. Journal of Bioscience and Bioengineering, 2014, 118(2): 119–124
[9]Engene N, Cameron-Coates R, Gerwick W H. 16S rRNA gene heterogeneity in the filamentous marine cyanobacterial genus lyngbya. Journal of Phycology, 2010, 46(3): 591–601
[10]Iteman I, Rippka R, Tandeau de Marsac N, et al. Comparison of conserved structural and regulatory domains within divergent 16S rRNA-23S rRNA spa-cer sequences of cyanobacteria. Microbiology, 2000, 146(6): 1275–1286
[11]Tang J, Jiang D, Luo Y F, et al. Potential new genera of cyanobacterial strains isolated from thermal sp-rings of western Sichuan, China. Algal Research, 2017, 31(11): 14–20
[12]Rodriguez-R L M, Konstantinidis K T. The enveomics collection: a toolbox for specialized analyses of mic-robial genomes and metagenomes, PeerJ Preprints, 2016, 4: e1900v1
[13]Tang J, Bromfield E S P, Rodrigue N, et al. Micro-evolution of symbiotic Bradyrhizobium populations associated with soybeans in east North America. Ecology and Evolution, 2012, 2(12): 2943–2961
[14]Goris J, Konstantinidis K T, Klappenbach J A, et al. DNA-DNA hybridization values and their relationship to whole-genome sequence similarities. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(1): 81–91
[15]Moro I, Rascio N, La Rocca N, et al. Polyphasic characterization of a thermo-tolerant filamentous cyanobacterium isolated from the Euganean thermal muds (Padua, Italy). European Journal of Phycology, 2010, 45(2): 143–154
[16]Yoon K S, Nguyen N T, Tran K T, et al. Nitrogen fixation genes and nitrogenase activity of the non-heterocystous cyanobacterium thermoleptolyngbya sp. O-77. Microbes and Environments, 2017, 32(4): 324–329
Identification and Characterization of a New Species of Thermoleptolyngbya Isolated from Hot Springs in Sichuan
Abstract The objective of the study is to characterise the taxonomy of the thermophilic filamentous strain B121 isolated from the hot springs in Ganzi, Sichuan, and provide insight into its genetic basis for future application. The taxonomy of strain B121 was analyzed by using polyphasic approach encompassing genome analysis, phylogenetic analysis, secondary structure prediction, and overall analysis of morphology, sodium salt tolerance test combined nitrogen fixation ability. Phylogenetic analysis of 16S rRNA indicated that strain B121 closely clustered with strains Thermoleptolyngbya oregonensis PCC 8501, Thermoleptolyngbya albertanoae ETS-08 and Thermolepto-lyngbya sp.O-77; the 16S-23S ITS secondary structure prediction showed that the D1-D1' region of strain B121 has certain similarity and high sequence identity with reference strains, but they have not reached the generalized threshold for the same species. Additionally, the secondary structures of V2, BoxB and V3 regions are quite different between B121 and other reference strains. Combined with the analysis of morphological investigation, strain B121 was identified as a new species of the genus Thermoleptolyngbya. In addition, the strain B121 can survive in NaCl and NaNO3modified BG-11 medium with a concentration of 0.5 M, and it can also survive in NaCl modified BG-11 medium with a concentration of 1 M. When the gas phase condition is Ar:N2:CO2 =79:20:1 (v:v:v), the acetylene reduction rate of strain B121 can reach 2564.1 nmol/(g∙h).
Key words thermophilic cyanobacteria; 16S rRNA; 16S-23S ITS; phylogenetic analysis; secondary structure
doi: 10.13209/j.0479-8023.2022.029
国家自然科学基金(32071480)和深圳市基础研究项目(GXWD20201231165807007-20200806170221001)资助
收稿日期: 2021-05-28;
修回日期: 2021-06-15