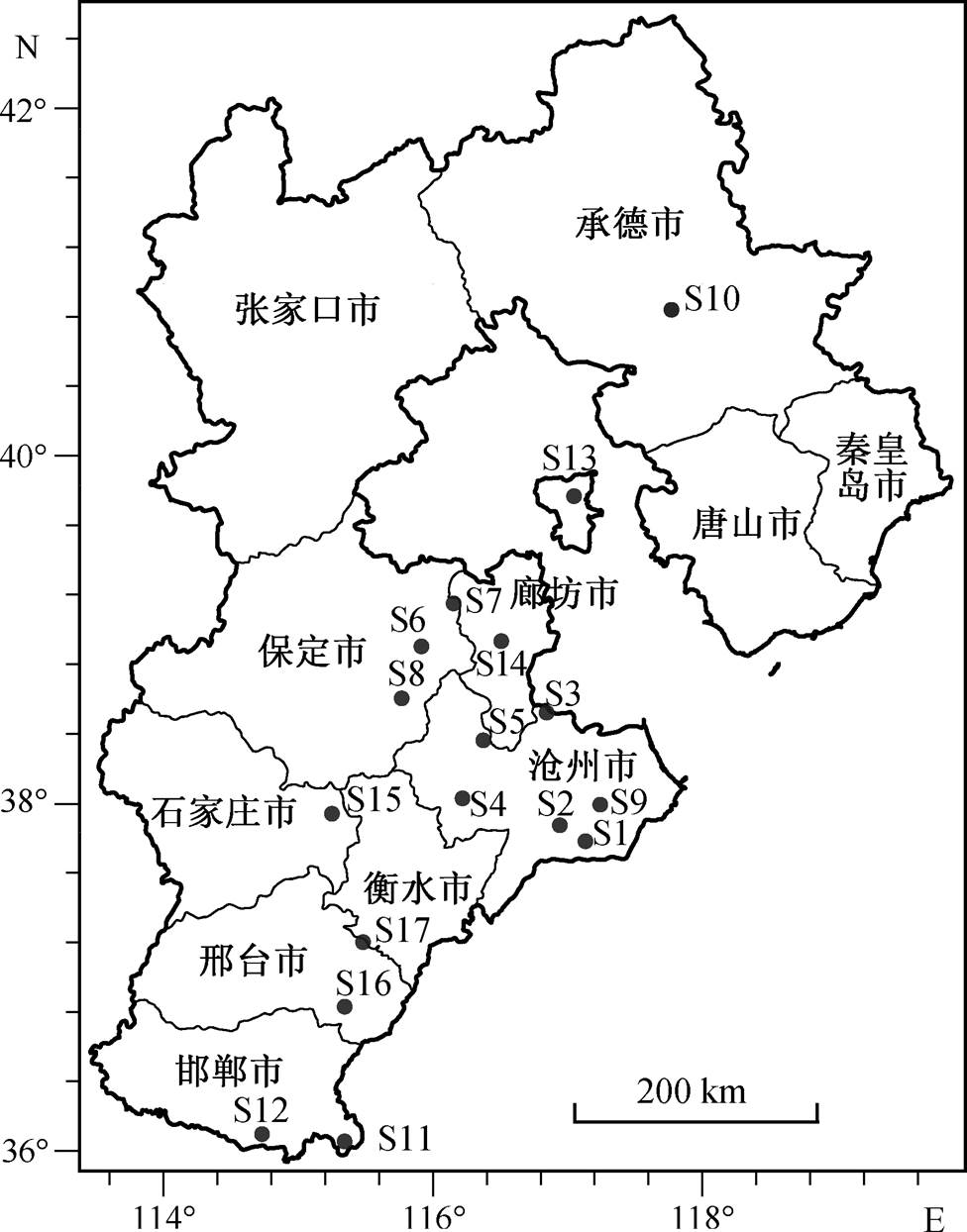
图1 17口采样井分布
Fig. 1 Distribution of 17 sampling sites
摘要 联合高分辨质谱和碘化消毒副产物(I-DBPs)的特征质谱性质, 建立一套完整的非靶向分析方法。以河北省 17 口监测井为研究对象, 筛查地下水样品中 I-DBPs 的种类、数量及分布。共筛选出含有同分异构体的I-DBPs 疑似离子 2408 种, 其中不同质荷比的数量为 839, 远高于以往研究报道的 I-DBPs 数量。疑似 I-DBPs离子中, 对碘离子响应强度排前十位的离子进行结构鉴定, 其中响应强度排前两位的两种离子被鉴定为酚类I-DBPs, 其发育毒性比对应的脂肪族 I-DBPs 高数十至数百倍。进一步的分析结果表明, 酚类 I-DBPs 是样品中主要的 I-DBPs 类型之一。最后, 通过主成分分析, 讨论 2408 种疑似 I-DBPs 的分布特征。根据主成分分数, 筛选出明显偏离其他采样点的 3 个采样点。根据装载因子, 通过高斯混合模型对疑似 I-DBPs 进行聚类, 得到4 类离子, 其中 3 类离子分别属于 3 个离群采样点的特征污染物。这些结果表明, I-DBPs 的分布在河北省内的不同地区具有明显的差异性和复杂性。
关键词 碘化消毒副产物(I-DBPs); 非靶向筛查; 高分辨质谱; 地下水; 主成分分析
通过杀死病原体, 水处理中的消毒过程大大降低了各类介水传染病的发病率, 添加含氯消毒剂(如氯气和氯胺)的消毒过程已成为现代水处理工艺中的重要环节。然而, 消毒过程和消毒后的余氯均可以与被处理水体中溶解性有机质(dissolved organic matter, DOM)反应生成种类众多的消毒副产物(dis-infection byproducts, DBPs)[1]。有研究表明, DBPs具有多种毒性(如生殖、发育和基因毒性)以及致癌性[2–5]。当水体中存在卤素离子(氯、溴和碘)时, DBPs 倾向于进一步生成更加复杂的卤化 DBPs。其中碘化消毒副产物(iodinated DBPs, I-DBPs)的细胞和基因毒性显著高于对应的氯化和溴化 DBPs[6], I-DBPs 中的碘元素可来自无机含碘化合物(如碘化物和碘酸盐)和各类碘化有机化合物[7], 消毒过程中氧化生成的次碘酸也可进一步与 DOM 反应生成 I-DBPs[8]。I-DBPs 在饮用水(特别是自来水)中已有检出。另外, 由于家庭加碘食盐的使用, 可能会生成更多种类和数量的 I-DBPs[9]。DOM 组成复杂, 生成的 I-DBPs 种类众多, 结构复杂, 分析难度较高, 现有的研究方法很难对样品中 I-DBPs 进行全面的分析。
基于高分辨质谱的非靶向筛查是近年来分析环境样品中未知污染物的主要方法[10–15]。高分辨质谱通常会生成海量的数据, 其中包括大量的背景干扰离子[16]。从海量数据中定向地筛选出疑似目标物离子, 是非靶向筛查鉴定未知污染物的第一步。碘离子可作为特征碎片离子用于疑似 I-DBPs 的筛选。以往研究中, 低分辨质谱条件下的母离子扫描(pre-cursor ion scan, PIS)已成功地用于筛查 I-DBPs[9,17]。筛选疑似目标物后, 后续鉴定过程包括分子式计算和结构解析两步。分子式计算的主要依据为质谱检测的离子质荷比。一般情况下, 质荷比精确度越高, 在误差范围内的可能元素组成个数越少, 越有可能确定分子式[18]。高分辨质谱的一大优势即为质荷比检测的高精确度(一般小于 5Í10‒6)[19]。同时, 一些辅助手段如特征同位素峰以及碎片离子信息可帮助缩小元素组成范围。
由于 I-DBPs 的生成与消毒过程十分相关, 以往的 I-DBPs 研究通常关注污水处理过程 [6,8–9,20], 对天然水体关注较少。另一方面, 受限于分析仪器和分析方法, 通常只能分析有限数量的 I-DBPs, 覆盖度不够。本文通过 Orbitrap 高分辨质谱和自建的非靶向筛查方法, 较为全面地分析地下水中 I-DBPs 的种类、数量和分布, 以期为地下水 I-DBPs 污染防控以及优先控制污染物的筛选提供数据支撑。
充分考虑风向、地下水补给模式、土壤性状及类型等因素, 选定河北省 17 口监测井为采样点。地下水样品采集于 2017 年 5 月, 每个采样点采集两个平行样, 同时设置一个空白样。采样容器为 4.5L的聚丙烯采样瓶, 采样后在避光和 4°C 条件下保存, 运回实验室后 24 小时内处理完毕。采样点分布如图 1 所示。
本研究利用固相萃取法富集样品中的有机污染物。在进行固相萃取之前, 样品经多层玻璃纤维滤膜(GF/C 1.2μm 和 GF/F 0.7μm, 1.2μm 滤膜在上面; 英国 Whatman 公司)过滤。Oasis HLB 固相萃取柱(500mg, 6mL; 美国 Waters 公司)先用 6mL 甲醇(色谱纯; 德国 Merck 公司)和 6mL 超纯水(电阻率 18.2mΩ/cm, 美国 Millipore 公司)活化。样品经过萃取柱后, 使用 5mL 超纯水淋洗, 去除样品中的亲水杂质, 并在真空下抽干 2 小时。然后使用 10mL 甲醇洗脱样品, 洗脱液用 15mL 聚丙烯离心管收集, 在氮吹仪中吹至近干, 再用甲醇定容至 1mL。最后, 溶液通过 0.22μm 针头过滤器(中国 Anpel 公司)过滤, 移入聚丙烯进样小瓶, 放入−20°C 冰箱保存。

图1 17口采样井分布
Fig. 1 Distribution of 17 sampling sites
本研究的分析平台为 Dionex UltiMate 3000 超高效液相色谱串联 Q-Exactive Focus 高分辨质谱系统(美国 Thermo Fisher 公司)。液相色谱选用 ZOR-BAX Extend plus C18 色谱柱(2.1×100mm, 1.8μm; 美国 Agilent 公司), 并连接一个 ZORBAX Extend C18 保护柱(2.1×100mm, 1.8μm; 美国 Agilent 公司)。
色谱系统流动相 A 是 2 mM 醋酸铵(中国百灵威公司)水溶液, 并用氨水调节 pH 至 10.25。流动相 B由 5mM N-甲基哌啶(中国百灵威公司)的甲醇/乙腈(体积比为 1:1, 色谱纯; 德国 Merck 公司)溶液组成。流速为 0.25mL/min, 柱温为 40°C。初始流动相比例为 A:B = 90%:10%, 持续 2 分钟后, 溶液 B的比例在 6 分钟内提高到 95%, 并持续 7 分钟, 之后溶液 B 的比例在 0.2 分钟内降低到 10%, 并持续 3.8分钟, 直到结束。
质谱的离子源采用负模式的电喷雾电离(elec-trospray ionization, ESI), 质谱数据采集模式为 full scan MS/data-dependent MS/MS (dd-ms2)。其中二级质谱母离子选择范围为当前时刻前三强离子, 母离子分步加热碰撞能(15, 30 和 45eV)碎裂, 最终二级质谱为 3 种碰撞能情形下离子碎裂结果的加权平均植。一级质谱分辨率为 70000 (质荷比=200 时), 扫描范围为 150~1000; 二级质谱分辨率为 17500 (质荷比=200 时), 扫描范围为 60~750。
如图 2 所示, 本研究针对 I-DBPs 质谱特征, 建立一套完整的非靶向筛查流程。按顺序, 流程可分为数据预处理、I-DBPs 疑似离子筛查和 I-DBPs 鉴定三部分。
数据预处理的第一步为数据格式转换。仪器分析的原始数据为 raw 格式文件, 为了满足后续分析需求, 要将其转换为 mzXML 格式文件。本研究使用 Protewizard 软件[21]进行格式转换, 同时将原始文件质谱格式从 profile 转换为 centroid, 从而减小输出文件的大小, 提高后续数据处理效率。格式转换后进行峰提取, 使用 R (3.5.2 版本, R Development Core Team)环境下的 XCMS (3.4.2 版本)[22]作为峰提取工具。峰提取主要依赖 XCMS 提供的 centwave函数, 主要参数设置为 peakwidth=c(5,20), noise= 5000, ppm=5, mzdiff=0.003。上述参数是根据实验数据迭代处理优化而设置的, 其中 peakwidth 接近本实验中大部分色谱峰的峰宽, noise 和 ppm 基于质谱的检测能力设置, 主要用于筛除干扰数据, 而mzdiff 的设置值(0.003)与仪器分辨率接近, 经数据处理验证可以有效地避免错误的峰合并。输出文本数据, 进一步通过 CAMERA (1.38.1 版本)[23]进行峰合并, 用来检测来源于同一分子的不同色谱峰。CAMERA 在默认参数条件下运行。最终的峰提取结果输出为 CSV 文件。峰提取后, 数据文件通过PeakDensity 算法进行峰匹配, 提取特征(Fea-tures)。另外, 本研究基于 XCMS 提供的 chrom-PeakSpectra 函数, 编写 R 脚本来提取二级质谱, 并输出为 CSV 文件。经过以上步骤后, 进一步通过MySQL (Community Server 8.0.11)将峰表和二级质谱转换为本地关系数据库。得到数据库文件后, 通过 SQL 脚本即可实现筛查需求。与纯 CSV 文件或其他软件相比, 通过 SQL 检索数据库速度更快、灵活性更高。
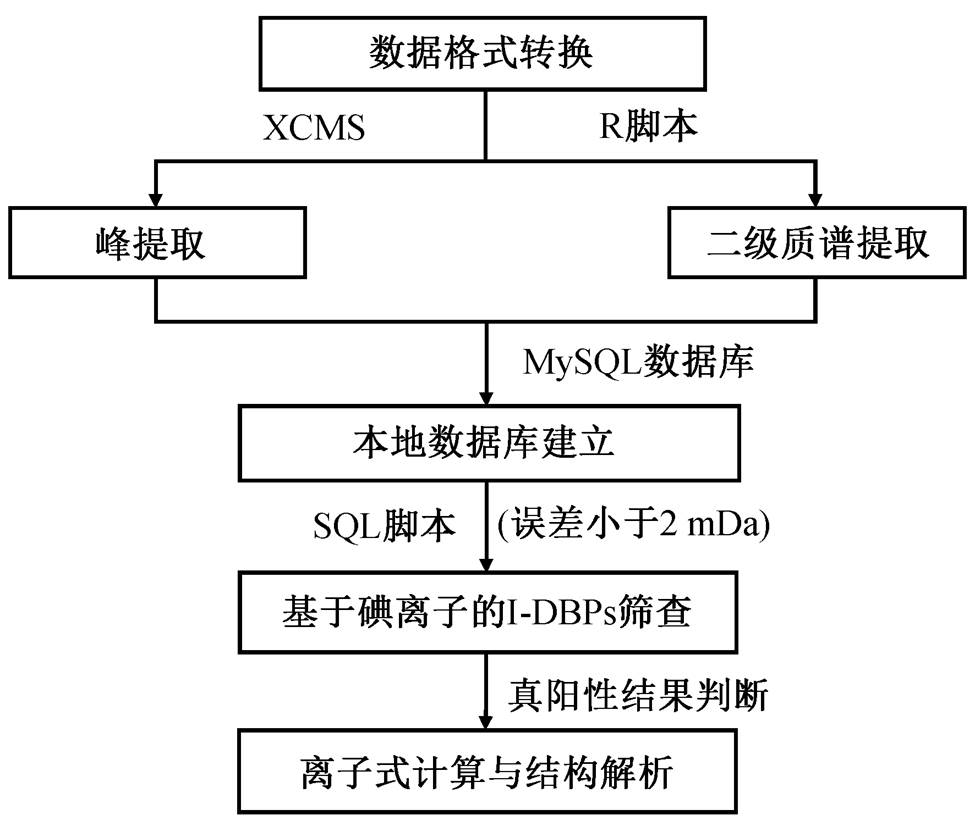
图2 针对I-DBPs建立的非靶向筛查流程
Fig. 2 Workflow of nontarget screening for I-DPBs
数据预处理后, 进行 I-DBPs 疑似离子的筛查。在上述数据库基础上, 通过 SQL 脚本实现基于碘离子的非靶向筛查, 即通过筛选二级质谱存在碘离子碎片(质荷比=126.9044)的离子, 定向地获取 I-DBPs。筛查过程中, 规定碎片离子质荷比误差应小于 2mDa。另外, 由于碘离子显著的质量亏损(negative mass defect)[24], 在常见的有机物组成元素限制下, 质荷比为 126.9044 的离子在高分辨质谱的误差范围内(一般小于 5Í10‒6), 碘离子是唯一可能的选项, 因此可以准确地筛查I-DBPs。
在鉴定疑似 I-DBPs 前需要进行数据检查来过滤背景干扰[25], 提高分析准确性。过滤标准包括平行样间离子响应相对标准偏差小于 30%, 样品平均响应大于空白样品对应离子响应的 10 倍。鉴定过程中, 分子式通过 ChemCalc[26]在线工具计算, 设定的元素组成范围为 C = 1~20, H = 0~50, O = 0~10, N = 0~10, P = 0~5, S = 0~5, I=0~5。另外, 特征同位素峰[27]也用于辅助判断分子式。结构解析依赖二级质谱, 碎片离子元素组成计算方法如上所述。
非靶向筛查的结果可信度一般通过赋予置信等级来判断, 本文使用 Schymanski 等[28]提出的五等级判断标准, 该标准在非靶向筛查中使用最为广泛。
本研究 17 个采样点的 34 个样品中检测到峰的平均数量为 9304 个, 峰匹配后检测到的特征总数为49909 个, 高于以往文献报道的峰或特征数量[29–30]。通过基于碘离子搜索的非靶向筛查, 在 17 个采样点的 34 个样品中共检测到含碘离子的母离子 7732 个, 扣除质荷比重复的母离子后, 剩余 1200 个离子。这些离子中可能包含背景离子或仪器数据采集误差导致的假阳性结果以及由于同位素分布、不同加和物形式或中性损失形成的同源峰, 因此实际 I-DBPs应小于此数字。17 个采样点检测到的疑似 I-DBPs离子数量及相对丰度(用仪器响应表示)如图 3 所示。与峰数量相比, 采样点间 I-DBPs 疑似离子数量差别更大, 每个采样点平均检测到 227 个 I-DBPs 疑似离子, 其中采样点 10 检测到的疑似离子最多, 达到 429 个(取平行样的最大值), 采样点 8 仅检测到39 个疑似离子。由图 3 可知, 疑似离子检测数量越多, 其响应总和越高, 但图中越靠近右上角(即离子数量多、响应高的采样点), 采样点分布越稀疏, 显示出不同采样点间 I-DBPs 种类和数量的差异性, 具体分布情况将在 2.3 节讨论。
在进行进一步鉴定前, 需要对数据进行清洗, 过滤掉背景干扰离子。在初步观察数据时, 我们发现大量液相色谱中常见的干扰离子被鉴定为 I-DBPs 疑似离子, 如质荷比为 263.1393 (离子式 C14H21O5− )、263.1288 (离子式 C15H19O4− )和 277.1445 (离子式C16H21O4− )的离子。这些离子及其碎片离子不可能含有碘离子, 只是因为对应的二级质谱中检测到碘离子碎片而被筛选为疑似离子, 出现这种现象主要是由于对应的干扰离子保留时间附近存在真实的含碘化合物, 这些含碘化合物碎裂后生成的碘离子即是这些干扰离子中碘离子的来源。一般的含碘化合物在ESI−条件下非常容易脱离母离子, 因此碘离子响应强度较高, 而这些干扰离子的二级质谱中碘离子响应强度普遍很低。因此, 我们首先设定疑似 I-DBPs 离子中, 只保留二级质谱中碘离子响应强度至少达到母离子响应 20%的离子。此外, 由于 I-DBPs大多带有较高的质量亏损, 本文设置分段的质量亏损过滤器, 对于质荷比<350 的离子, 要求质量亏损必须为负, 其余离子要求质量亏损<0.15。
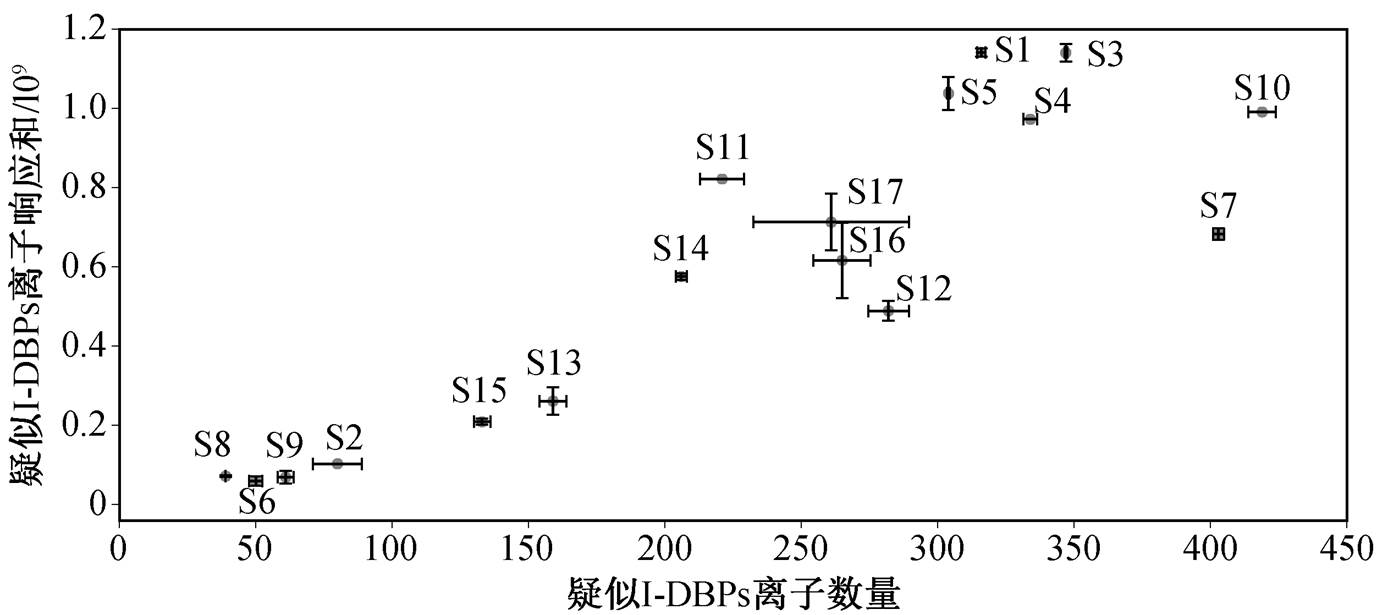
图3 17个采样点的疑似I-DBPs数量以及相对丰度(误差棒基于平行样计算)
Fig. 3 Number and relative abundance of suspect I-DBPs in 17 sampling sites (error bars were calculated based on replicates)
经过以上两步过滤后, 1200 个疑似离子最终剩余 839 个离子用于后续分析, 分布如图 4 所示。839个离子对应的实际特征总数为 2408 个, 这是因为一些离子的同分异构体被色谱分开, 从而被识别为不同的特征。由图 4 可看出, 大部分 I-DBPs 疑似离子的质荷比集中在 400 左右, 保留时间则明显存在两个聚集区, 分别为 1 分钟和 6 分钟附近, 根据本研究的实验条件, 可推测保留时间的两个聚集区分别对应极性强(1 分钟)和极性一般(6 分钟)的两类物质。
由于疑似 I-DBPs 数量极大, 难以对其中每个离子进行细致的结构鉴定, 本研究仅对其中较为重要的离子进行鉴定。由于二级质谱中碘离子碎片为 I-DBPs 的质谱特征, 我们以碘离子响应强度为标准, 筛选用于结构鉴定的离子。首先按 839 个疑似 I-DBPs 离子二级质谱中碘离子响应强度从高到低排序, 然后取响应最强的前 10 种不同质荷比的离子用于分析, 这 10 种离子的基本信息及可能离子结构如表 1 所示。可以看出, 10 种主要离子中, 除质荷比为 403.0409 的离子(离子式 C16H20IO4−, 质量误差为0.27mDa)外, 均有显著的质量亏损, 可根据 1.4 节的方法准确地确定其离子组成。对于质荷比为403.0409 的离子, 在设置的元素组成及误差范围内存在超过 10 种可能组成, 但通过搜索同源峰, 仅观察到一个质荷比等于[M+1.003]−的峰(即 13C 同源峰), 排除离子中含硫、氯和溴元素的可能。另外, 由于离子由分子脱氢生成, 排除不饱和度为整数的结果, 最后仅剩 C16H20IO4−这一种结果。因此, 所有 10 种 I-DBPs 疑似离子的离子式都可确认。10 种离子中包含不属于 I-DBPs 类物质的三碘阴离子 I3−。
除 I3−离子外, 其余 9 种离子均可认定为 I-DBPs物质, 可基于它们的离子组成和二级质谱谱图, 可对其离子结构进行分析。以质荷比为 402.8332 的离子(离子式 C8H5I2O3−, 0.39mDa)为例, 采样点 3 是此离子响应强度最高的采样点, 其提取离子图(图 5 (a))显示, 在保留时间 0.5~7 分钟内存在大量分离度高的色谱峰, 表示存在多种同分异构体。图 5(a)中色谱峰较明显地聚集在 2 分钟和 5 分钟附近, 分别以其中具代表性的 B 和 C 峰为例(图 5(b)和(c))提取二级质谱, 可观察到不同的碎裂性质。图 5(b)和(c)均显示检测到显著的碘离子(质荷比 126.9050, 误差0.60mDa)和母离子(质荷比 402.8333, 误差 0.40mDa)。图 5(c)显示同时检出 358.8437 离子, 对应母离子脱去一个CO2 基团后的质量(0.72mDa)。另外, 根据母离子的离子式 C8H5I2O3−, 5.5 的不饱和度, 最可能的来源为苯环结构, 因此可推断图 5(c)中的同分异构体应为碘酚酸结构, 其可能的结构在表 1 中给出。然而, 根据现有数据, 碘原子、羟基和羧酸基团均不能确认其位置, 因此置信等级仅为 3。5 分钟附近的其他同分异构体的二级质谱与图 5(c)相同, 无法进一步分析。从图 5(b)中可观察到一种响应微弱的质荷比为 246.9262 的离子, 通过计算得到其离子式为 C7H4IO2−(0.60mDa), 是在母离子的基础上脱去 COHI−形成的。另外, 图 5(b)中完全检测不到[M-CO2]−碎片。以上两点特征暗示, 图 5(b)代表的同分异构体并不是碘酚酸结构。考虑到其显著短的保留时间, 更可能是极性更强的脂肪族化合物结构, 但具体结构尚无法确定。其他离子的结构鉴定过程与质荷比为402.8333的离子类似。
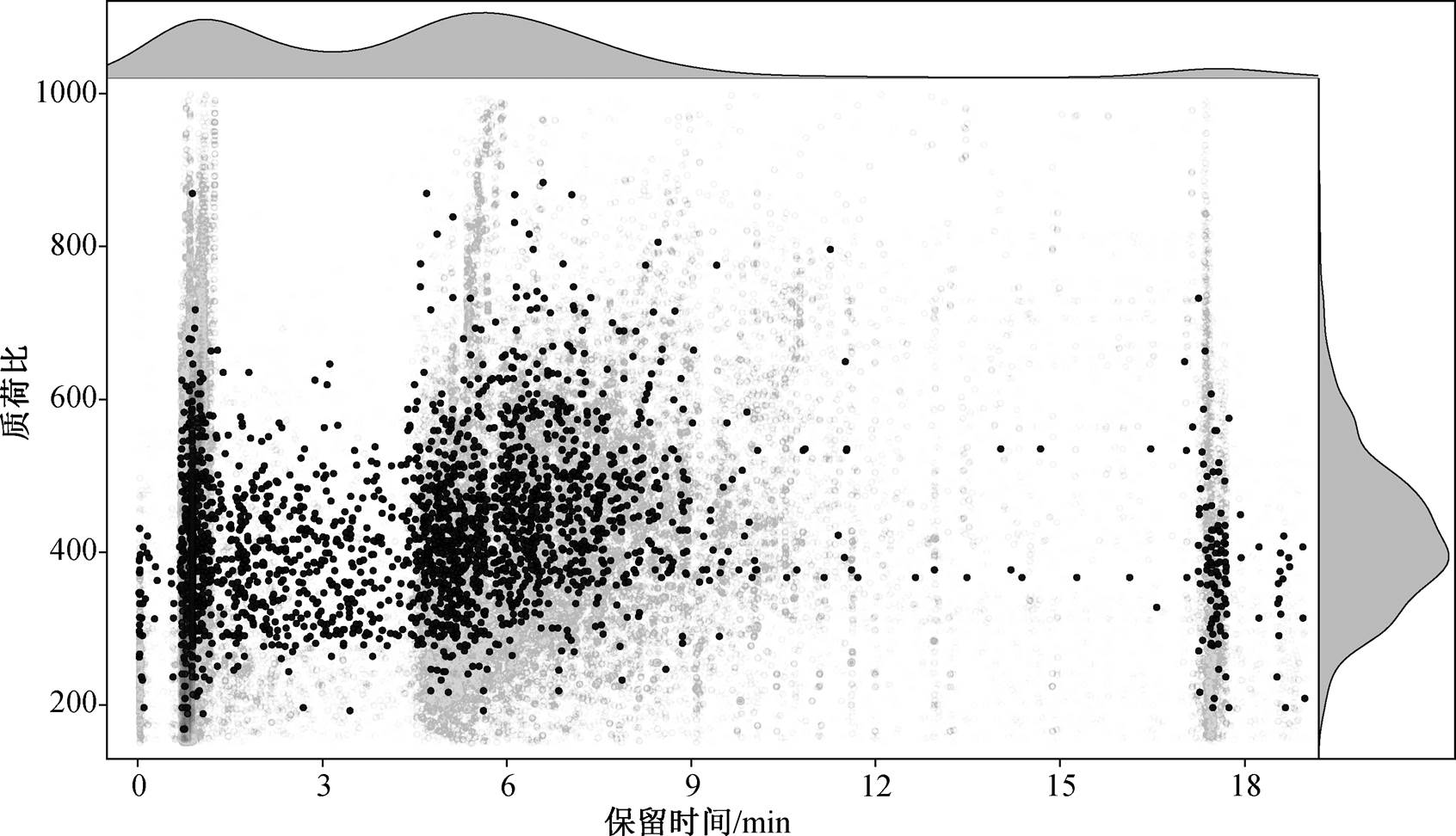
黑色圆点代表疑似I-DBPs离子, 灰色圆点代表其他离子, 上方和右方的核密度图为疑似I-DBPs的分布特征
图4 疑似I-DBPs离子分布
Fig. 4 Distribution of suspect I-DBPs
表1 二级质谱中碘离子响应强度前10位的含碘离子对应的母离子信息
Table 1 Information of precursors detected with top 10 iodide ion abundances in their MS/MS spectra

质荷比离子式质量误差/mDa保留时间/min可能结构检出率/% 388.8177C7H3I2O3−0.555.88, 0.72, 4.76, 1.7794.12 402.8332C8H5I2O3−0.395.97, 5.73, 5.30, 5.10, 0.90, 2.25, 8.4188.24 345.8231C5H2I2NO−0.532.75, 1.63, 5.13, 0.90, 6.5464.71 380.7141I3−0.700.83100.00 339.9064C5H12I2N−0.490.78无法判断100.00 362.8022C5HI2O3−0.701.40, 0.89, 3.12, 2.13, 4.6876.47 389.8129C6H2I2NO3−0.555.38, 1.33, 5.92, 4.6594.12 471.7196C5HI3NO−0.435.34, 6.02无法判断35.29 438.8001C7H5I2O4S−0.315.82, 4.65, 0.9488.24 403.0409C16H20IO4−0.275.78, 7.33, 6.43无法判断76.47
说明: 一些离子的多个保留时间对应不同的同分异构体的保留时间; 列出可能结构的离子置信等级为3, 其余离子无法判断结构, 离子置信等级为4。
除质荷比为 402.8332 的离子属于碘酚类 I-DBPs 外, 碘离子响应前 10 位的离子中还有质荷比为388.8177 (离子式 C7H3I2O3−, 0.55mDa)、438.8001 (离子式 C7H5I2O4S−, 0.30mDa)和 389.8129 (离子式C6H2I2NO3−, 0.55mDa)的 3 种离子也属碘酚类结构。4 种离子中除质荷比为 438.8001 的离子 (离子结构中带有磺酸基团)外, 其余 3 种离子均在饮用水中有过报道[9,17], 且存在多种同分异构体, 本研究结果与文献[9,17]类似。另据报道, 芳香族 I-DBPs的发育毒性比对应的脂肪族 I-DBPs 高十甚至几百倍[31]。这里的 4 种芳香族 I-DBPSs 离子检出率均大于 85%, 且其中质荷比为 388.8177 和 402.8332 的两种芳香族 I-DBPs 是检测响应强度最高的两种 I-DBPs。样品中还存在更多不同离子式的芳香族 I-DBPs, 是某些采样点 I-DBPs中的特征离子。
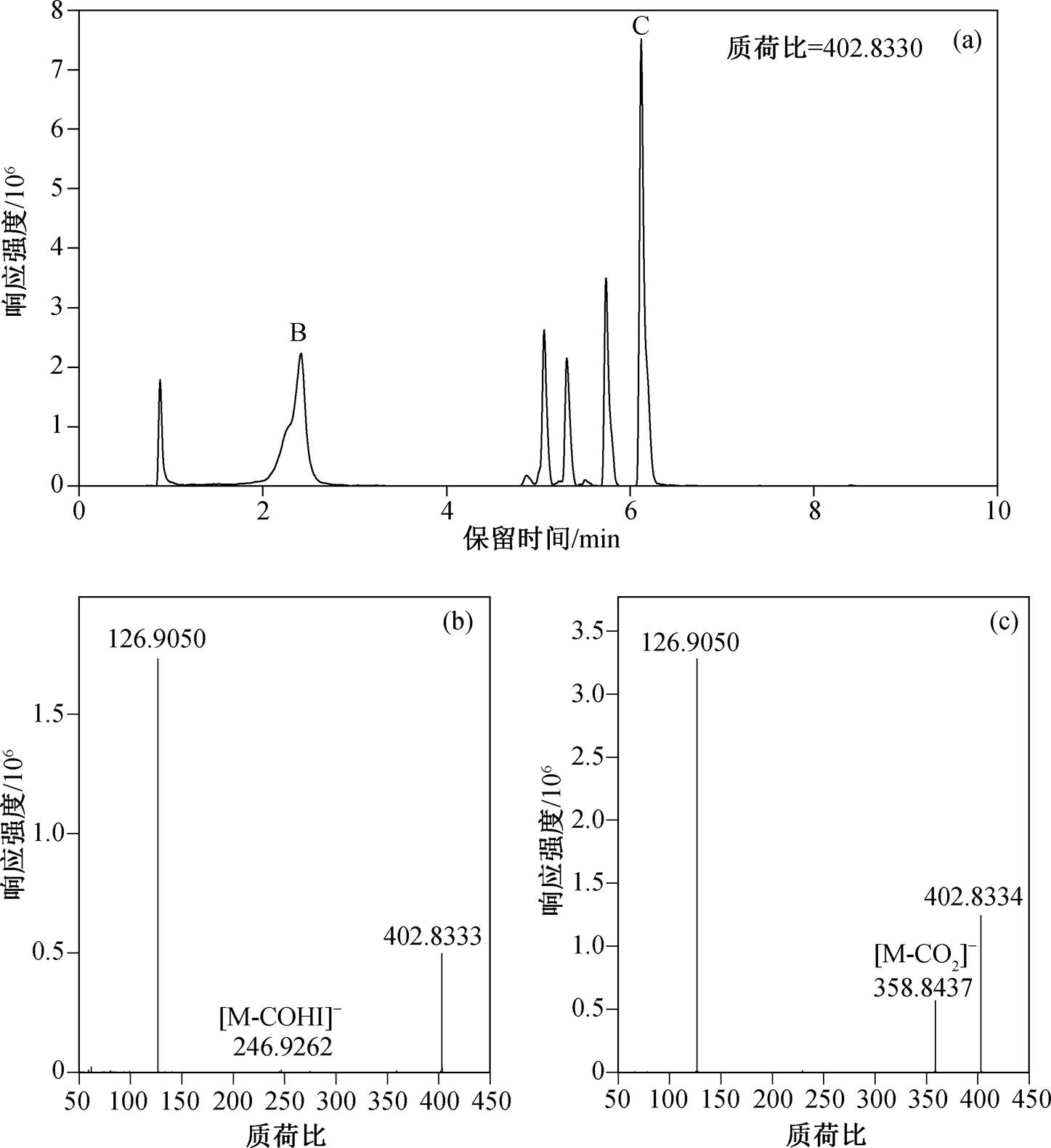
图5 采样点3中的C8H5I2O3‒提取离子色谱图(a)和两种同分异构体的二级质谱图((b)和(c))
Fig. 5 Extracted ion chromatograph of C8H5I2O3‒ in site 3 (a) and MS/MS spectra from two different isomers ((b) and (c))
本研究筛查出的疑似 I-DBPs 种类、数量众多, 本文通过主成分分析将数据降维, 可视化地展现样品间 I-DBPs 的分布特征。由于不同疑似 I-DBPs 离子的响应强度差异巨大(105~109), 如果直接使用原始响应强度, 降维结果将主要受高响应离子影响, 掩盖其他离子的分布特征。因此, 在进行主成分分析前, 我们对原始数据矩阵进行归一化, 使得每个疑似离子在样品间的平均值为 0, 标准差为 1。主成分分析中主成分个数取最大值 17。
提取 17 个采样点的前 3 个主成分后, 绘制散点图(图 6(a))。除采样点 1, 3 和 7 外, 其他 14 个采样点有明显的聚集性, 在 3 个主成分方向没有观察到明显的分布趋势。采样点 1, 3 和 7 分别在第 2, 1 和 3主成分方向上明显地偏离其他采样点, 说明这 3 个采样点有显著不同的污染特征。进一步提取所有主成分的方差解释率, 结果如图 6(b)所示。第一主成分仅能解释 16%的方差, 而前 3 个主成分总共只能解释 40%的方差, 充分说明样品中 I-DBPs 组成的复杂性, 不同采样点间 I-DBPs 包含的种类差异较大。由于 I-DBPs 疑似离子数量庞大, 检出率不一, 不适合进行相关性及类似的分析。综上所述, 前 3 个主成分可分别代表采样点 1, 3 和 7 的分布特点。
我们提取 2408 个疑似离子在前 3 个主成分上的装载因子得分(loading scores), 结果见图 6(c)。由三维散点图可观察到, 2408 个疑似离子存在明显的分离和聚集。本文通过高斯混合模型, 对这些离子进行聚类。高斯混合模型是常用的聚类算法, 其类别的分界线可以是非线性的曲线。本文数据复杂度较高, 因此适用于高斯混合模型。聚类过程尝试设置分类数分别为 3~6, 最终确认分类数为 4, 聚类后画出各采样点 4 类离子的响应强度(图 6(d))。4 类离子中, 第 1 类离子明显以原点(0, 0, 0)为中心聚集, 代表对前 3 个主成分几乎没有贡献的那些离子, 2.2 节中鉴定的 10 种主要 I-DBPs 离子中, C7H3I2O3− (0.55 mDa)、C5H2I2NO− (0.42mDa)和 C6H2I2NO3− (0.69mDa) 3 种离子的某个同分异构体属于第 1 类。第一主成分上, 第 3 类离子是主要的贡献者, 之前鉴定的 C7H3I2O3−和 C5H12I2N−属于此类。第 1 类离子也包括的 C7H3I2O3−在此处属于同分异构体, 其第 1 类和第 3 类离子的保留时间分别为 1 分钟和 5 分钟, 很可能分属于脂肪和芳香族 I-DBPs, 因此其分布也有较大的差异。第 3 类离子按照第三主成分装载因子得分排序, 前五位的离子式分别为 C11H10IN2O4− (0.77mDa)、C5H2I2NO− (0.42mDa)、C6H3I3NO2− (0.81mDa)、C8H4I3O4S− (1.16mDa)和 C7H5I2O3S− (0.42mDa), 其中 4 种均为芳香族 I-DBPs, 且这些第 3 类中的显著离子在采样点 3 检测到更高的响应强度, 这正是采样点 3 在第三主成分方向上偏离其他采样点的原因。第 2 类和第 4 类离子的分析方法与第 3类相似。第 2 类和第 4 类中显著的离子分别在采样点 7 和 1 检测到更高的响应, 其中第 2 类中的显著离子大多数带有较弱的质量亏损, 导致离子式不能完全确定, 如分数在前两位的质荷比为 384.9579 (离子式可能为 C14H10IO5‒, 0.61mDa)和 334.976852 (离子式不确定)的离子。第 4 类中最显著的离子为C12H12IO4− (0.57mDa)的两种同分异构体。如图 6(b)所示, 第 4~6 主成分仍然对方差有不小的贡献度, 但在数据分析中, 这些主成分并不存在突出的采样点, 故不详细讨论。
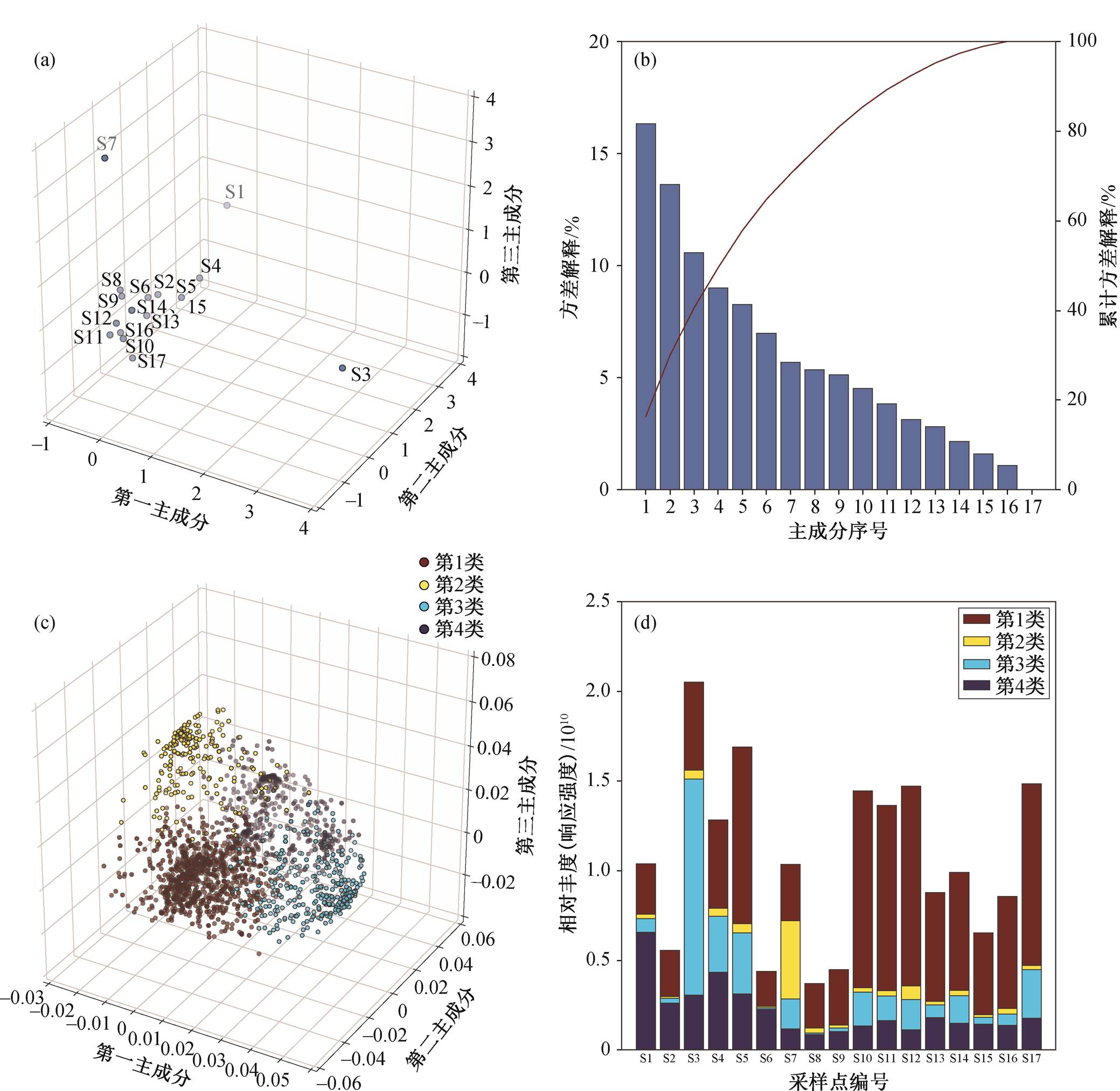
(a)样品前 3 个主成分分数; (b)蓝色柱表示各主成分的样品方差解释率, 红色折线表示累计的方差解释率; (c)2408种疑似I-DBPs 在前三主成分的装载因子, 通过高斯混合模型可明显分为 4 类; (d) 4 类疑似 I-DBPs 在各采样点中的响应占比
图6 主成分分析结果
Fig. 6 Results of principal component analysis
不同采样点间(特别是采样点 1, 3 和 7)占主导的 I-DBPs 有很大的差异性, 前 3 个主成分仅能解释40%的方差, 若考虑更多的主成分, 剩余 14 个采样点间同样存在很大的差异。
1)基于碘离子搜索的非靶向筛查, 辅以建立本地数据库的方法, 可以全面而快速地筛选 I-DBPs, 也可筛查其他卤素元素取代的消毒副产物。
2)本文研究的样品中 I-DBPs 数量庞大, 其中存在大量不同结构的毒性较强的酚类 I-DBPs。在17 个采样点中共检测到不同质荷比的 I-DBPs 疑似离子 839 种, 考虑同分异构体共有 2408 种, 远多于传统靶向方法能分析的化合物数量。酚类 I-DBPs是主要的 I-DBPs 类型之一, 也是一些采样点的特征I-DBPs 离子, 并且在碘离子响应强度前 10 的离子中, 有 4 种属于酚类 I-DBPs。酚类 I-DBPs 的毒性更强, 但在环境中的检测报道较少或尚未报道。未来, 对环境中酚类 I-DBPs 进行更细致的结构解析及生态效应研究十分必要。
3)I-DBPs 种类繁多, 结构复杂, 不同采样点存在不同的主要 I-DBPs 类型, 差异明显。通过主成分分析, 可筛选出 3 个具有独特污染特征的采样点, 进而筛选出特征 I-DBPs, 显示这些采样点的主导 I-DBPs 有很大的差异。本文将 I-DBPs 疑似离子按采样点特征分为 4 类, 其中 3 类分别属于这 3 个采样点的特征污染物。另外, 每一类都包括不同结构的酚类 I-DBPs, 说明这些物质在自然环境中的存在形式具有复杂性, 急需更多的检测数据来明晰 I-DBPs在环境中的赋存形式。
参考文献
[1]Wang X S, Song H, Zhang J, et al. Chlorination decreases acute toxicity of iodophenols through the formation of iodate and chlorinated aliphatic disinfec-tion byproducts. Water Research, 2021, 194: 116951
[2]Andrzejczyk N E, Greer J B, Nelson E, et al. Novel disinfection byproducts formed from the pharmaceu-tical gemfibrozil are bioaccumulative and elicit in-creased toxicity relative to the parent compound in marine polychaetes (Neanthes arenaceodentata). En-vironmental Science & Technology, 2020, 54(18): 11127–11136
[3]Han J, Zhang X. Evaluating the comparative toxicity of DBP mixtures from different disinfection scen-arios: a new approach by combining freeze-drying or rotoevaporation with a marine polychaete bioassay. Environmental Science & Technology, 2018, 52(18): 10552–10561
[4]Yang J, Li W, Zhu Q, et al. Identification, formation, and predicted toxicity of halogenated DBPs derived from tannic acid and its biodegradation products. Environmental Science & Technology, 2019, 53(22): 13019–13030
[5]Tang H, Zhong H, Pan Y, et al. A new group of he-terocyclic nitrogenous disinfection byproducts (DBPs) in drinking water: role of extraction pH in unknown DBP exploration. Environmental Science & Techno-logy, 2021, 55(10): 6764–6772
[6]Dong H, Qiang Z, Richardson S D. Formation of iodi-nated disinfection byproducts (I-DBPs) in drinking water: emerging concerns and current issues. Acco-unts of Chemical Research, 2019, 52(4): 896–905
[7]Ding S, Deng Y, Li H, et al. Coagulation of iodide-containing resorcinol solution or natural waters with ferric chloride can produce iodinated coagulation byproducts. Environmental Science & Technology, 2019, 53(21): 12407–12415
[8]Hu J, Xu Y, Chen Y, et al. Formation of carbonaceous and nitrogenous iodinated disinfection byproducts from biofilm extracellular polymeric substances by the oxidation of iodide-containing waters with lead dioxide. Water Research, 2021, 188: 116551
[9]Pan Y, Zhang X, Li Y. Identification, toxicity and control of iodinated disinfection byproducts in coo-king with simulated chlor(am)inated tap water and iodized table salt. Water Research, 2016, 88: 60–68
[10]Hollender J, Schymanski E L, Singer H P, et al. Non-target screening with high resolution mass spectro-metry in the environment: ready to go?. Environ-mental Science & Technology, 2017, 51(20): 11505–11512
[11]Wang L, Kang Q, Jia Y, et al. Identification of three novel chloroalkyl organophosphate triesters in house dust using halogenation-guided nontarget screening combined with suspect screening. Environmental Science & Technology, 2021, 55(4): 2482–2490
[12]Qiu M, Hu A, Huang Y M, et al. Elucidating deg-radation mechanisms of florfenicol in soil by stable-isotope assisted nontarget screening. Journal of Ha-zardous Materials, 2021, 403: 123974
[13]Wu H, Chen J, Peng J, et al. Nontarget screening and toxicity evaluation of diol esters of okadaic acid and dinophysistoxins reveal intraspecies difference of Prorocentrum lima. Environmental Science & Techno-logy, 2020, 54(19): 12366–12375
[14]Washington J W, Rosal C G, McCord J P, et al. Nontargeted massspectral detection of chloroper-fluoropolyether carboxylates in New Jersey soils. Science, 2020, 368: 1103–1107
[15]Renaguli A, Fernando S, Hopke P K, et al. Non-targeted screening of halogenated organic compounds in fish fillet tissues from the Great Lakes. Environ-mental Science & Technology, 2020, 54(23): 15035–15045
[16]Hollender J, van Bavel B, Dulio V, et al. High reso-lution mass spectrometry-based non-target screening can support regulatory environmental monitoring and chemicals management. Environmental Sciences Eu-rope, 2019, 31(1): 1–11
[17]Pan Y, Li W, An H, et al. Formation and occurrence of new polar iodinated disinfection byproducts in drin-king water. Chemosphere, 2016, 144: 2312–2320
[18]De Vijlder T, Valkenborg D, Lemiere F, et al. A tutorial in small molecule identification via electros-pray ionization-mass spectrometry: the practical art of structural elucidation. Mass Spectrometry Reviews, 2018, 37(5): 607–629
[19]Liu Y, D’Agostino L A, Qu G, et al. High-resolution mass spectrometry (HRMS) methods for nontarget discovery and characterization of poly- and per-fluoroalkyl substances (PFASs) in environmental and human samples. TrAC Trends in Analytical Chemis-try, 2019, 121: 115420
[20]Gilca A F, Teodosiu C, Fiore S, et al. Emerging disinfection byproducts: a review on their occurrence and control in drinking water treatment processes. Chemosphere, 2020: 127476
[21]Chambers M C, Maclean B, Burke R, et al. A cross-platform toolkit for mass spectrometry and proteo-mics. Nature Biotechnology, 2012, 30(10): 918–920
[22]Smith C A, Want E J, O’Maille G, et al. XCMS: processing mass spectrometry data for metabolite profiling using nonlinear peak alignment, matching, and identification. Analytical Chemistry, 2006, 78(3): 779–787
[23]Kuhl C, Tautenhahn R, Bottcher C, et al. CAMERA: an integrated strategy for compound spectra extrac-tion and annotation of liquid chromatography/mass spectrometry data sets. Analytical Chemistry, 2012, 84(1): 283–289
[24]Zhang H, Zhang D, Ray K, et al. Mass defect filter technique and its applications to drug metabolite identification by high-resolution mass spectrometry. Journal of Mass Spectrometry, 2009, 44(7): 999–1016
[25]Want E J, Masson P, Michopoulos F, et al. Global metabolic profiling of animal and human tissues via UPLC-MS. Nature Protocols, 2013, 8(1): 17–32
[26]Patiny L, Borel A. ChemCalc: a building block for tomorrow’s chemical infrastructure. Journal of Che-mical Information and Modeling, 2013, 53(5): 1223–1228
[27]Washington J W, Rosal C G, Ulrich E M, et al. Use of carbon isotopic ratios in nontargeted analysis to screen for anthropogenic compounds in complex environmental matrices. Journal of Chromatography A, 2019, 1583: 73–79
[28]Schymanski E L, Jeon J, Gulde R, et al. Identifying small molecules via high resolution mass spectro-metry: communicating confidence. Environmental Sci-ence & Technology, 2014, 48(4): 2097–2098
[29]Kutarna S, Tang S, Hu X, et al. Enhanced nontarget screening algorithm reveals highly abundant chlorina-ted azo dye compounds in house dust. Environmental Science & Technology, 2021, 55(8): 4729–4739
[30]Purschke K, Vosough M, Leonhardt J, et al. Evalu-ation of nontarget long-term LC-HRMS time series data using multivariate statistical approaches. Analy-tical Chemistry, 2020, 92(18): 12273–12281
[31]Yang M, Zhang X, Liang Q, et al. Application of (LC/)MS/MS precursor ion scan for evaluating the occurrence, formation and control of polar haloge-nated DBPs in disinfected waters: a review. Water Research, 2019, 158: 322–337
Identification of Iodinated Disinfection Byproducts in Groundwater from Hebei Province Using Iodide-Based Nontarget Screening
Abstract A complete set of nontargeted analysis method was established by combining the high-resolution MS and the characteristic mass spectrometry properties of iodinated disinfection byproducts (I-DBPs). Groundwater samples were collected from 17 sites in Hebei Province, and an integrated nontarget screening workflow was developed and implemented to identify the category, quantity and distribution of I-DBPs in the groundwater samples. As a result, a total of 2408 suspect I-DBPs ions including isomers were screened, of which 839 unique mass-to-charge ratios were identified, much higher than the numbers reported by previous studies. Among the suspect I-DBPs ions, the structures were carefully analyzed for precursors which were detected with top 10 the most abundant iodide ions in their MS/MS spectra, and the top 2 suspect ions were identified as phenolic I-DBPs, whose developmental toxicity are tens to hundreds of times higher than the corresponding aliphatic DBPs.Further analysis confirmed that the phenolic I-DBPs were one of the main categories of all the I-DBPs detected in samples. Finally, the distribution characteristics of 2408 suspect ions were analyzed based on principal component analysis (PCA). According to the PCA, 3 sites significantly different from other sampling sites were screened as outlier sites. The suspect ions were clustered into 4 classes using Gaussian mixture model according to their loading scores, and ions from 3 of 4 classes were identified as the diagnostic pollutants for 3 outlier sites respectively. The results highlighted the differences and complexity of I-DBPs in groundwater of Hebei Province.
Key words iodinated disinfection byproducts (I-DBPs); nontarget screening; high-resolution mass spectrometry; groundwater; principal component analysis
doi: 10.13209/j.0479-8023.2022.027
国家自然科学基金(51879003)和深圳市科技计划(JCYJ20200109140616774, GXWD20201231165807007-20200810165349001)资助
收稿日期: 2021-05-19;
修回日期: 2021-06-04