
平均值±标准误差, 不同小写字母表示不同处理间差异显著, p < 0.05 , 下同
图1 氮添加对土壤养分影响
Fig. 1 Effects of nitrogen addition on soil nutrient content
摘要 以福建省武夷山亚热带常绿阔叶米槠林为研究对象, 开展氮添加实验。采用 4 个氮添加梯度(CK, N50, N100 和 N150, 分别表示氮添加 0, 50, 100 和 150kg/(hm2·a))模拟自然氮沉降变化, 探究氮添加对土壤有机碳及土壤呼吸的影响。结果表明, 氮添加对表层土壤(0~20cm)总有机碳的影响不显著, 对颗粒态有机碳(POC)和矿物结合态有机碳(MAOC)两种不同碳组分含量的影响不同。其中, N100 和 N150 处理分别使土壤 POC 含量显著上升 110.7%和 147.9% ( p1 = 0.024, p2 < 0.001); 土壤 MAOC 含量则随氮添加量升高呈下降趋势, 但差异不显著。土壤呼吸速率的年际波动呈单峰式, 且在不同观测时间内, 各样地土壤呼吸速率对氮添加的响应不同。通过土壤呼吸速率与土壤温度的拟合方程计算, 得到 2018—2020 年 CK, N50, N100 和 N150样地土壤呼吸年均碳排放量分别为 1205.31, 1191.56, 1287.56 和 1128.61 g C/m2。其中, N50 样地与 CK 样地无显著差异, N100 样地显著上升 6.82% (p<0.001), N150 显著下降 6.8% (p<0.001), 即 N100 可以促进土壤呼吸年碳排放, 而 N150 对土壤呼吸年碳排放有抑制作用。
关键词 氮沉降; 亚热带常绿阔叶林; 土壤有机碳; 土壤呼吸
随着工农业的快速发展, 人类活动导致大气中活性氮化合物含量迅速上升, 改变了全球和区域的氮循环过程[1–3]。我国森林氮沉降以 NH4+和 NO3− 为主, 自然氮沉降速率从 20 世纪 80 年代的 13.2kg N/(hm2·a)增加到 21 世纪初的 21.1kgN/(hm2·a), 并仍以 0.17~0.41kgN/(hm2·a)的速度增加[4–5]; 根据模型预测, 到 2030 年, 我国东南部分地区氮沉降速率将会高达 45~50kgN/(hm2·a)[6]。
土壤碳库是陆地生态系统中最大的碳储库, 可利用性氮含量的改变将对土壤碳库的循环产生深刻的影响[3]。鲁显楷等[7]指出, 一方面, 氮沉降通过影响凋落物的生物量和质量(如碳含量)等来调节土壤碳库的输入; 另一方面, 通过影响土壤中微生物生物量及其活性来控制土壤碳库中各种碳组分间的转化及碳排放(如有机碳分解和土壤呼吸), 进而影响土壤碳库的碳储量。目前, 关于土壤碳库对氮添加响应的研究结果争议较大。Mack 等[8]发现, 氮添加改变了苔原地区植物群落的组成, 并促进了凋落物分解, 从而使土壤有机碳储量减少。Cleveland 等[9]发现, 氮添加通过促进土壤呼吸而减小土壤有机碳库储量。此外, 也有较多研究显示氮添加增加了土壤有机碳储量。例如, Zak 等[10]发现, 氮添加(30kg N/(hm2·a))处理的森林土壤有机碳含量显著高于对照土壤, 增幅约为 12%; 氮添加同样促进了北欧云杉林和松树林土壤的碳吸收, 碳汇增量为 11gC/N [11]。根据周转速率和稳定性的不同, 土壤有机碳(soil organic carbon, SOC)可以分为颗粒态有机碳(par-ticulate organic carbon, POC)和矿物结合态有机碳(Mineral-associated organic carbon, MAOC)。一般认为, POC 是与砂粒相结合的有机碳, 通常包括未分解和半分解的动植物残体等, 易受环境因素影响, 在土壤中具有较快的周转速率, 可以作为 SOC 变化的敏感指标。MAOC 通常被认为是有机质分解的最终产物, 具有较高的稳定性, 周转速度较慢, 氮添加对这两种土壤有机碳含量的影响并不相同[12–13]。
森林土壤呼吸主要包括土壤动物呼吸、自养呼吸和异养呼吸三部分, 占森林生态系统总呼吸量的 2/3 以上[14], 是土壤碳排放的主要形式。目前, 针对北方针叶林和温带森林的研究较多, 通常认为氮添加会对土壤呼吸起到抑制作用[15–17]。对于热带和亚热带森林的研究较少, 尚无一致的结论。根据已有结果, 可分为促进[12,18]、没有响应[19]或抑制[20–21]三类。例如, 氮添加会引起土壤微生物生物量、凋落物产量和土壤有机碳库的变化, 进而导致土壤异养呼吸速率改变, 并在总体上表现为降低土壤呼吸[21]。Wang 等[22]在鼎湖山的氮添加实验中发现, 氮添加样地内植物生长加快, 细根生物量增加, 土壤中自养呼吸的速率显著提高。
本研究在亚热带常绿阔叶林地区开展4种不同梯度的氮添加模拟实验, 分析氮添加对土壤有机碳、土壤呼吸速率及土壤年碳排放的影响, 以期为探究全球氮沉降增加背景下的土壤碳库变化提供数据支撑。
研究区域位于福建省武夷山国家公园亚热带森林生态定位研究站(117°57′E, 27°39′N)。该区域拥有世界上同纬度带现存面积大、保存完整的亚热带森林生态系统。样地为典型的亚热带常绿阔叶米槠(Castanopsis carlesii)林, 是北京大学中国东部森林氮添加研究网络(NEECF)的一部分。样地海拔为700m, 近 10 年平均气温为 18.3°C, 年平均降水量为 1889mm, 雨季多集中在 3—9 月。土壤为黄壤和红壤, pH 值为 4.7。土壤总碳(C)、氮(N)和磷(P)的含量分别为 47.80, 2.93 和 0.24g/kg, 自然氮沉降速率为 16 kg/(hm2·a) [5]。
样地内共设 12 个样方。样方大小为 20m×20m, 相邻样方间设置 5m 的缓冲带。样方中心划分为 9 个 5m×5m 的小样格, 从底部自东向西依次编号为 1~9。为避免施氮处理后地表和地下径流中氮养分对对照样地的影响, 3 个对照样地(CK)设置在氮添加样地上部。样地底部自西向东, 低氮(N50, 50kgN/(hm2·a))、中氮(N100, 100kgN/(hm2·a)))和高氮(N150, 150kgN/(hm2·a)) 9 个氮处理样方依次排列, 每种处理各有 3 个重复样方。在每年生长季(3-11 月)的各月初, 将相应质量的硝酸铵(NH4NO3)溶于 30L 水中, 用肩背式喷雾器在对应施氮样方内来回均匀地喷洒, 对照样方施以相同体积的水。
土壤样品采集于 2019 年 7 月。用直径为 5cm的土钻, 在各样方的 1, 5 和 9 号样格内由上向下分别采集 0~5, 5~10 和 10~20cm 新鲜土壤样品, 同一样地内同层土壤混合为一个样品, 鲜土取回后过 2mm 筛。
土壤速效氮测定: 取新鲜土壤 25g, 加入 50mL浓度为 2mol/L 的氯化钾溶液, 震荡后过滤, 用流动分析仪测定滤液中硝态氮和氨态氮的含量。
土壤有效磷测定: 称取过 20 目筛的风干土样, 加入 50mL 浓度为 0.5mol/L 的碳酸氢钠溶液, 再加活性碳, 振荡后用无磷滤纸过滤, 用钼锑分光光度法(LY/T 1233-1999, HJ704-2014)测定。
土壤 pH 值测定: 取 10g 风干土于锥形瓶中, 加入 25mL 去离子水, 充分震荡后静置 30 分钟, 用pH计 (Model PHS-2, INESA Instrument, 上海) 进行测量。
土壤有机碳分组: 用土壤有机质湿筛法[23–25],将土壤有机碳分为颗粒态有机碳(POC)和矿物结合态有机碳(MAOC)两部分。
土壤呼吸速率的测定: 亚热带地区气候较为稳定, 相邻月份水热条件相似, 因此从 2019 年 11 月初开始, 每两个月进行一次测定, 持续一年。采用Li-8100A 土壤碳通量测试系统 (LI-COR, Inc, Lincoln, 美国), 在每个样方的 1, 5 和 9 号样格内, 取每个呼吸环测定 3 次。同时使用 Li-8100A 自带的温、湿度探针测定土壤 5cm 处的土壤温度和土壤湿度。为减少土壤呼吸速率受气温日变化的影响, 测量均在气温较高且稳定的时段(10:00—14:00)完成。
利用实际测量所得的土壤呼吸速率及 5cm 处土壤温度, 拟合土壤呼吸速率与温度的关系, 如下式所示:
R = R0 ekT, (1)
其中, R 为实际测得的土壤呼吸速率, T 为对应的 5cm 土壤温度, R0 为拟合得到的特征参数, k 为温度敏感性。
利用实际测量所得的土壤呼吸速率及 5cm 处土壤含水率, 拟合土壤呼吸速率与含水率的关系, 如下式所示:
R = aX + b, (2)
其中, R 为实际测得的土壤呼吸速率, X 为对应的 5cm 土壤含水率, a 和 b 为拟合得到的特征参数。
本文使用 EM50 土壤温度湿度记录仪(Decagon, Pullman, 美国)记录样地内全年土壤温湿度, 利用下式计算一年内土壤呼吸所排放的碳总量:
Fc= 12×600×10‒6∑R0ekt, (3)
其中, 12 表示碳元素原子质量, t 表示每次记录的土壤 5cm 温度, 600 表示时间常数(EM50 每 间隔 600秒记录一次)。计算 2018—2020 共 3 年的土壤呼吸碳排放总量。
使用单因素方差分析(ANOVA)方法比较氮添加对土壤主要理化性质、土壤有机碳和土壤呼吸等指标的影响。方差分析后, 进行 HSD (Tukey’s honest significant difference tests)显著性检验, 以便确定上述变量之间是否存在差异。所有统计分析均在 R版本 3.6.0 [26]中进行, 并使用软件 GraphPad Prism 8.0作图。
氮添加对 0~10cm 土壤养分的影响如图 1 所示。在 N150 样地中, 土壤 pH 值仅为 4.24, 比 CK 样地显著降低(图 1 (a), p = 0.039)。各氮添加样地中NO3−-N 含量均有所上升, 其中 N50 和 N150 样地分别比 CK 样地显著升高 175.8%和 176%。土壤 NH4+-N 含量对氮添加的响应不明显, 导致土壤总有效氮含量的变化不显著(图 1(c), (d)和(f))。此外, 氮添加样地内土壤有效磷含量均呈下降趋势, 并导致土壤有效 N:P 上升(图 1 (b)和(e))。
为了进一步研究氮添加对土壤有机碳的影响, 使用有机质湿筛法, 将土壤有机碳分为颗粒态有机碳(POC)和矿物结合态有机碳(MAOC), 分别进行称重和碳含量测定, 得到总重量和总碳含量的回收率(表 1)。可以看出, 2019 年各氮添加样地土壤总质量和总碳含量的回收率均高于 97%, 表明实验操作导致的误差较小, 结果可信。
不同氮添加样地内, 2019 年表层 0~20cm 土壤有机碳含量的变化情况如图 2(a)所示。氮添加总体上略微增加了土壤表层有机碳含量, 但不同处理间的差异不显著, 有机碳含量基本上保持稳定。N100和 N150 样地土壤表层 SOC 含量分别为 35 和 33.3mg/g, 比 CK 样地的 31.9mg/g 分别提高 9.49%和4.03%。氮添加对土壤有机碳不同组分呈现相反的影响趋势, 总体上表现为氮添加显著地提高土壤中 POC 含量, 但对 MAOC 含量没有影响(图 2 (b)和(c))。N100 和 N150 样地土壤 POC 的含量分别为15.19 和 17.87mgC/g, 比 CK 的 7.21 mgC/g 分别显著上升 110.7%和 147.9% (图 2 (b); p1 = 0.024, p2 < 0.001)。对于土壤中 MAOC 的含量, 2019 年 N150样地土壤 MAOC 含量为 18.48mgC/g, 比 CK样地的24.05mgC/g下降 20.1% (图 2 (c))。

平均值±标准误差, 不同小写字母表示不同处理间差异显著, p < 0.05 , 下同
图1 氮添加对土壤养分影响
Fig. 1 Effects of nitrogen addition on soil nutrient content
表1 用土壤湿筛法进行有机碳分组后总质量和总碳含量的回收率(%)
Table 1 Recovery of mass and carbon during SOM fractionation by wet sieving (%)
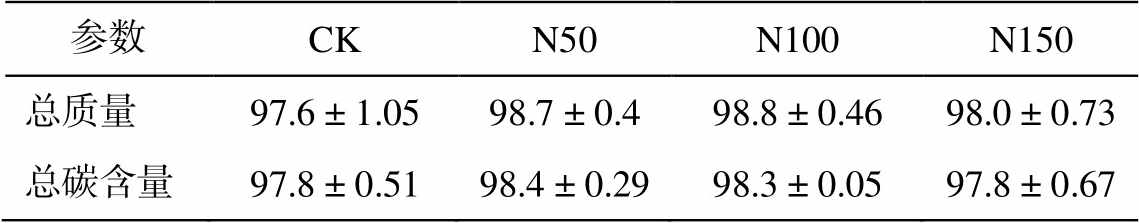
参数CKN50N100N150 总质量97.6 ± 1.0598.7 ± 0.498.8 ± 0.4698.0 ± 0.73 总碳含量97.8 ± 0.5198.4 ± 0.2998.3 ± 0.0597.8 ± 0.67
土壤呼吸速率的季节变化规律如图 3(a)所示。可以发现, 不同氮添加样地内土壤呼吸速率的变化趋势相同, 1~3 月较低, 从 3 月起逐渐上升, 在 7 月达到峰值后逐渐下降。
不同梯度氮添加处理对土壤呼吸速率的影响如图 3(b)所示。不同观测时段内, 各样地内土壤呼吸速率对氮添加的响应不同。N50 样地土壤呼吸速率在 1, 3 和 11 月均高于 CK 样地, 其中 1 月 N50 样地土壤呼吸速率为 2.37μmol/(m2·s), 显著高出 CK 样地 16.18% (p = 0.01); 在 5 月和 9 月, N50 样地土壤呼吸速率则低于 CK 样地, 其中 9 月 N50 样地土壤呼吸速率为 3.56μmol/(m2·s), 比 CK 样地显著下降32.81% (p=0.041)。N100 样地土壤呼吸速率在观测期内均高于其他样地, 其中 7 月 N100 样地土壤呼吸速率为 5.34μmol/(m2·s), 显著高出 CK 样地 13.97% (p=0.037); 9 月 N100 样地土也显著高于 N50 和N150 样地(p1 = 0.014, p2 = 0.047)。N150 样地的土壤呼吸速率在观测期均比其他样地低, 5 月 N150 样地的土壤呼吸速率为 4.17μmol/(m2·s), 比 CK 样地下降 12.22%; 7 月 N150 样地的土壤呼吸速率为 5.4μmol/ (m2·s), 比 CK 样地 5.66μmol/(m2·s)下降4.71%。

图2 氮添加对亚热带常绿阔叶林土壤有机碳组分的影响
Fig. 2 Different fractions of soil organic carbon (SOC) in response to N addition in the subtropical evergreen broadleaved forest

• 表示异常值; 星号表示不同处理间差异显著, *p<0.05, **p<0.01, ***p<0.001
图3 氮添加对亚热带常绿阔叶林土壤呼吸速率的影响
Fig. 3 Effect of nitrogen addition on soil respiration rate in the subtropical evergreen broadleaved forest
如图 4 所示, 土壤呼吸速率与土壤温度呈较好的指数关系(r2 均大于 0.5), 各氮添加样地内土壤呼吸速率均随土壤温度升高而上升, 但其温度敏感性略有不同, CK, N50, N100 和 N150 样地土壤呼吸速率与土壤温度拟合方程中 k 值分别为 0.096, 0.073, 0.098 和 0.084。N100 样地 k 值最高为 0.098, 表明在温度升高时, N100 样地土壤呼吸速率上升最快。此外, 各氮添加样地土壤呼吸速率与土壤含水率之间均呈现微弱的正相关关系, 但拟合方程的 r2 均小于0.05, 即土壤含水率对土壤呼吸速率的季节变化解释度较低(图5)。

图4 不同氮添加样地土壤呼吸速率与土壤温度的关系
Fig. 4 Relationship between soil respiration rate and soil temperature in different nitrogen addition plots
利用土壤呼吸速率与土壤温度的拟合方程, 结合 2018—2020 年连续 3 年 EM50 记录的土壤 5cm 深度处温度, 计算各氮添加样地土壤呼吸的年均碳排放量。2018—2020 年 CK, N50, N100 和 N150 样地土壤呼吸年均碳排放量分别为 1205.31 ± 102.11, 1191.56 ± 103.32, 1287.56 ± 108.84 和 1128.61 ± 96.82gC/m2。其中, N50 样地与 CK 样地土壤呼吸年均碳排放量之间无显著差异; N100 样地的土壤呼吸年均碳排放量显著高出 CK 样地 6.82% (图 6; p<0.001); N150 样地土壤呼吸年均碳排放量比 CK 样地显著下降 6.8% (图 6; p<0.001)。也就是说, N50 处理对土壤呼吸年碳排放量没有显著影响, N100 处理显著地提高了土壤呼吸年碳排放量, N150 处理则对土壤呼吸年碳排放量产生明显的抑制作用。
土壤有机碳在土壤的生态过程和功能中起着至关重要的作用, 与土壤中各种物理、化学和生物学特性密切相关, 其含量是维持生态系统长期稳定的关键因素[27]。本研究中, 氮添加略微提高了表层(0~20cm)土壤的总有机碳含量, 但影响并不显著, 与之前研究结果相似[28–29]。张秀兰等[30]在为期三年的亚热带杉木林氮添加实验中发现, 虽然土壤SOC 含量在不同氮添加水平下无明显差异, 但土壤有机碳各组分的比例显著改变。因此, 我们不仅需要关注氮添加对总有机碳含量的影响, 也需要特别关注易受外界因素影响的不同组分的含量。
本文实验结果表明, 氮添加显著地提高了亚热带常绿阔叶林土壤中 POC 的含量, 即提高了土壤中碳的可利用性; MAOC 的含量呈现下降趋势, 但不显著。氮添加导致土壤 POC 含量上升的报道较多[31–33], 通常认为受到外源碳输入(如凋落物和细根等)增多以及 POC 分解速度下降两方面因素的影响[29]。例如, 樊廷录等[31]在长达 31 年的甘肃平凉黄土高原土壤施肥实验中发现, 施加有机肥和秸秆还田处理使土壤中 POC 含量显著上升。Chen 等[29]在亚热带常绿阔叶林氮添加实验中发现, 土壤 POC与土壤中微生物生物量碳(microbial biomass carbon, MBC)显著负相关, MAOC 则与 MBC 显著正相关, 而氮添加会导致样地内土壤中 MBC 含量显著下降。土壤 MAOC 含量对氮添加的响应在不同实验中并不一致。例如, 王朔林等[34]自 1988 年起在山西省河曲县进行土壤养分添加实验, 分析发现氮磷共同添加使土壤中 MAOC 的含量下降 14%。但是, 在甘肃定西市进行的为期 4 年的氮添加实验, 却使得不同深度土壤中 MAOC 的含量均随氮添加量的升高而升高[35]。有研究表明, 氮添加导致土壤酸化所引起的 Ca2+离子流失、土壤中微生物生物量下降、活性降低及其群落结构改变, 会影响土壤有机质的分解过程, 降低 MAOC 的含量[33]。由于其具有较高的稳定性和较低的周转速率, 氮添加时间较短可能是本实验中 MAOC 含量变化不显著的主要因素。

图5 不同氮添加样地土壤呼吸速率与土壤含水率的关系
Fig. 5 Relationship between soil respiration rate and soil moisture in different nitrogen addition plots
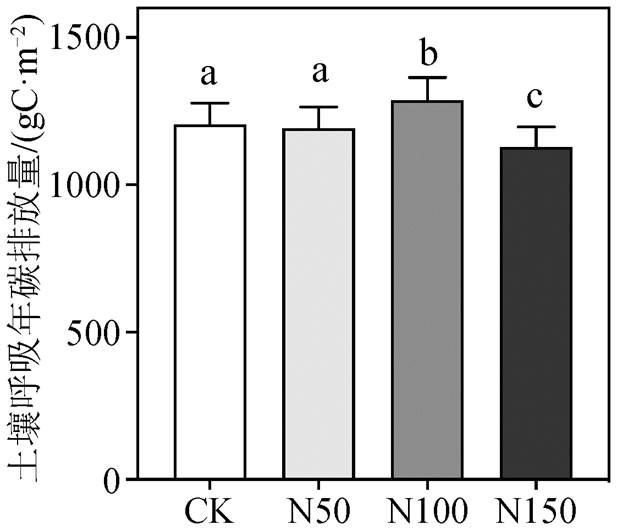
图6 氮添加对亚热带常绿阔叶林 2018—2020 年年均土壤呼吸碳排放量的影响
Fig. 6 Effect of nitrogen addition on the average annual carbon efflux of soil respiration in the subtropical evergreen broad-leaved forest in 2018–2020
在本实验中, 土壤呼吸的年动态呈现明显的单峰型, 与土壤温度的年变化趋势吻合, 但与土壤含水率的关系不明显。土壤温度和土壤含水率是影响土壤呼吸速率的两个重要因素, 对北方和温带森林而言, 这两个因素往往具有很好的共线性[36]。对于热带和亚热带地区, 土壤湿度受降水影响, 导致年际变化幅度较小, 没有明显的季节差异, 土壤温度则成为影响土壤呼吸速率的主要原因。Yan 等[17]和Kukumägi 等[37]的研究表明, 土壤温度变化对土壤呼吸速率的影响远大于土壤含水率的变化。因此, 我们仅通过土壤呼吸速率与温度的拟合方程来估算土壤呼吸的年碳排放量。
分析结果表明, 亚热带常绿阔叶林土壤呼吸速率对不同梯度的氮添加响应不同, 并最终导致不同实验样地内土壤呼吸年碳排放量具有显著差异。具体表现为 N50 样地土壤呼吸年碳排放量与 CK 样地相比没有显著的变化, N100 样地比 CK 样地显著上升, N150 样地则比 CK 样地显著下降。N100 样地内土壤细根生长、土壤微生物生物量及活性的提高, 可能是提高土壤呼吸速率, 增加土壤呼吸年碳排放的原因之一。张蔷等[38]在亚热带杜鹃灌丛的氮添加实验中发现, 100kg/(hm2·a)的氮添加量使根系生物量上升 61.63%。N150 样地内过高的氮添加引发的土壤酸化会导致细根生物量减少和土壤微生物微生物量和活性降低, 抑制土壤有机质的分解, 并降低土壤呼吸的年碳排放。Mo 等[20]在鼎湖山的氮添加实验中发现, 150kg/(hm2·a)的氮养分添加使土壤细根生物量和土壤微生物碳含量均比对照样地显著下降。
本研究在武夷山亚热带常绿阔叶林内开展野外氮添加模拟实验, 分析不同梯度对土壤有机碳及土壤呼吸的影响, 主要结论如下。
1)氮添加对表层土壤(0~20cm)总有机碳的影响不显著, 对不同碳组分含量的影响不同。氮添加提高了土壤中 POC 含量, N150 样地土壤 POC含量显著上升 147.9%; MAOC 含量随氮添加呈下降趋势, N150 样地土壤 MAOC 含量下降20.1%。
2)亚热带常绿阔叶林土壤呼吸速率的年际波动规律为 1—3 月较低, 从 3 月起逐渐上升, 在 7 月达到峰值后逐渐下降。在不同的观测时段, 氮添加梯度对土壤呼吸速率的影响不一致, 但总体上无显著差异。
3)土壤呼吸速率与土壤温度呈较好的指数关系, 土壤含水率对土壤呼吸的解释度较低。最终, 利用土壤呼吸与温度拟合方程计算得到 CK, N50, N100 和 N150 样地土壤呼吸年均碳排放量分别为1205.31, 1191.56, 1287.56 和 1128.61gC/m2。N100处理显著地提高了土壤呼吸年碳排放量, N150处理则对土壤呼吸年碳排放量产生明显的抑制作用。
参考文献
[1] Vitousek P M, Aber J D, Howarth R W, et al. Human alteration of the global nitrogen cycle: sources and consequences. Ecological Applications, 1997, 7(3): 737–750
[2] Galloway J N, Aber J D, Erisman J W, et al. The nitrogen cascade. BioScience, 2003, 53(4): 341–356
[3] Galloway J N, Townsend A R, Erisman J W, et al. Transformation of the nitrogen cycle: recent trends, questions, and potential solutions. Science, 2008, 320: 889–892
[4] Liu Z, Guan D, Wei W, et al. Reduced carbon emis-sion estimates from fossil fuel combustion and cement production in China. Nature, 2015, 524: 335–338
[5] Du E, Jiang Y, Fang J, et al. Inorganic nitrogen de-position in China’s forests: status and characteristics. Atmospheric Environment, 2014, 98: 474–482
[6] Reay D S, Dentener F, Smith P, et al. Global nitrogen deposition and carbon sinks. Nature Geoscience, 2008, 1(7): 430–437
[7] 鲁显楷, 莫江明, 张炜, 等. 模拟大气氮沉降对中国森林生态系统影响的研究进展. 热带亚热带植物学报, 2019, 27(5): 500–522
[8] Mack M C, Schuur E A G, Bret-Harte M S, et al. Ecosystem carbon storage in arctic tundra reduced by long-term nutrient fertilization. Nature, 2004, 431: 440–443
[9] Cleveland C C, Townsend A R. Nutrient additions to a tropical rain forest drive substantial soil carbon dio-xide losses to the atmosphere. Proceedings of the Na-tional Academy of Sciences, 2006, 103(27): 10316–10321
[10] Zak D R, Holmes W E, Burton A J, et al. Simulated atmospheric NO3− deposition increases soil organic matter by slowing decomposition. Ecological Applica-tions, 2008, 18(8): 2016–2027
[11] Hyvönen R, Persson T, Andersson S, et al. Impact of long-term nitrogen addition on carbon stocks in trees and soils in northern Europe. Biogeochemistry, 2008, 89(1): 121–137
[12] Cusack D F, Silver W L, Torn M S, et al. Effects of nitrogen additions on above- and belowground carbon dynamics in two tropical forests. Biogeochemistry, 2011, 104(1): 203–225
[13] Chen Y, Liu X, Hou Y, et al. Particulate organic carbon is more vulnerable to nitrogen addition than mineral-associated organic carbon in soil of an alpine meadow. Plant and Soil, 2021, 458(1): 93–103
[14] Lindroth A, Grelle A, MorÉN A S. Long-term mea-surements of boreal forest carbon balance reveal large temperature sensitivity. Global Change Biology, 1998, 4(4): 443–450
[15] Janssens I A, Dieleman W, Luyssaert S, et al. Reduction of forest soil respiration in response to nitrogen deposition. Nature Geoscience, 2010, 3(5): 315–322
[16] Zhong Y, Yan W, Shangguan Z. The effects of nitro-gen enrichment on soil CO2 fluxes depending on tem-perature and soil properties. Global Ecology and Bio-geography, 2016, 25(4): 475–488
[17] Yan T, Qu T, Sun Z, et al. Negative effect of nitrogen addition on soil respiration dependent on stand age: evidence from a 7-year field study of larch planta-tions in northern China. Agricultural and Forest Me-teorology, 2018, 262: 24–33
[18] 余景松, 付若仙, 俞元春, 等. 氮沉降对北亚热带麻栎林土壤呼吸及其温湿度敏感性的影响. 生态学杂志, 2021, 40(4): 1029–1037
[19] Deng Q, Zhou G, Liu J, et al. Responses of soil res-piration to elevated carbon dioxide and nitrogen addi-tion in young subtropical forest ecosystems in China. Biogeosciences, 2010, 7(1): 315–328
[20] Mo J, Zhang W, Zhu W, et al. Nitrogen addition reduces soil respiration in a mature tropical forest in southern China. Global Change Biology, 2008, 14(2): 403–412
[21] Zhou L, Zhou X, Zhang B, et al. Different responses of soil respiration and its components to nitrogen ad-dition among biomes: a meta-analysis. Global Change Biology, 2014, 20(7): 2332–2343
[22] Wang C, Lu X, Mori T, et al. Responses of soil mic-robial community to continuous experimental nitro-gen additions for 13 years in a nitrogen-rich tropical forest. Soil Biology and Biochemistry, 2018, 121: 103–112
[23] Cambardella C A, Elliott E T. Particulate soil organic-matter changes across a grassland cultivation sequ-ence. Soil Science Society of America Journal, 1992, 56(3): 777–783
[24] Six J, Elliott E T, Paustian K, et al. Aggregation and soil organic matter accumulation in cultivated and native grassland soils. Soil Science Society of Ameri- ca Journal, 1998, 62(5): 1367–1377
[25] Bradford M A, Fierer N, Reynolds J F. Soil carbon stocks in experimental mesocosms are dependent on the rate of labile carbon, nitrogen and phosphorus inputs to soils. Functional Ecology, 2008, 22(6): 964–974
[26] R Core Team. R: A Language and Environment for Statistical Computing. Vienna, 2013
[27] Carter M R. Soil Quality for Sustainable Land Man-agement: organic matter and aggregation interactions that maintain soil functions. Agronomy Journal, 2002, 94(1): 38–47
[28] Cusack D, Torn M S, Mcdowell W, et al. The response of heterotrophic activity and carbon cycling to nitro-gen additions and warming in two tropical soils. Glo-bal Change Biology, 2010, 16(9): 2555–2572
[29] Chen J, Xiao W, Zheng C, et al. Nitrogen addition has contrasting effects on particulate and mineral-associa-ted soil organic carbon in a subtropical forest. Soil Biology and Biochemistry, 2020, 142: 107708
[30] 张秀兰, 王方超, 方向民, 等. 亚热带杉木林土壤有机碳及其活性组分对氮磷添加的响应. 应用生态学报, 2017, 28(2): 449–455
[31] 樊廷录, 王淑英, 周广业, 等. 长期施肥下黑垆土有机碳变化特征及碳库组分差异. 中国农业科学, 2013, 46(2): 300–309
[32] Song B, Niu S, Li L, et al. Soil carbon fractions in grasslands respond differently to various levels of nitrogen enrichments. Plant and Soil, 2014, 384(1): 401–412
[33] Ye C, Chen D, Hall S J, et al. Reconciling multiple impacts of nitrogen enrichment on soil carbon: plant, microbial and geochemical controls. Ecology Letters, 2018, 21(8): 1162–1173
[34] 王朔林, 王改兰, 赵旭, 等. 长期施肥对栗褐土有机碳含量及其组分的影响. 植物营养与肥料学报, 2015, 21(1): 104–111
[35] 张世汉, 武均, 张仁陟, 等. 施氮对陇中黄土高原旱作农田土壤颗粒态有机碳的影响. 水土保持研究, 2019, 26(6): 7–11
[36] Wu J, Guan D, Wang M, et al. Year-round soil and ecosystem respiration in a temperate broad-leaved Korean Pine forest. Forest Ecology and Management, 2006, 223: 35–44
[37] Kukumägi M, Ostonen I, Uri V, et al. Variation of soil respiration and its components in hemiboreal Norway spruce stands of different ages. Plant and Soil, 2017, 414(1): 265–280
[38] 张蔷, 李家湘, 谢宗强. 氮添加对亚热带山地杜鹃灌丛土壤呼吸的影响. 植物生态学报, 2017, 41(1): 95–104
Effects of Nitrogen Addition on Soil Organic Carbon and Soil Respiration in Subtropical Evergreen Broad-Leaved Forest
Abstract In order to simulate changes in natural nitrogen deposition and explore the effects of nitrogen addition on soil organic carbon and soil respiration, four treatments (CK (control), N50 (50 kg/(hm2·a) of N), N100 (100 kg/(hm2·a) of N) and N150 (150 kg/(hm2·a) of N)) were conducted in a subtropical evergreen broad-leaved forest in Wuyi mountain, Fujian Province. The results showed that the effect of nitrogen addition on the TOC of the surface soil (0–20 cm) was not significant, and the effect on the content of its different components is different. Compared to the CK, N100 and N150 significantly increased the soil POC content by 110.7% and 147.9% (p1 = 0.024, p2 <0.001). The content of soil MAOC tended to decrease with the increase of nitrogen addition, but the difference was not significant. The annual dynamic of soil respiration rate was unimodal distribution, and nitrogen treatments had different effects on soil respirationin different observation time. Based on fitting equations of soil respiration rate and soil temperature, the annual average carbon efflux of soil respiration in CK, N50, N100, and N150 plots from 2018 to 2020 were 1205.31, 1191.56, 1287.56 and 1128.61 g C/m2, respectively. Compared to the CK, annual average carbon efflux of soil respiration did not change significantly in N50, significantly increased by 6.82% in N100 (p<0.001), and significantly reduced by 6.8% in N150 (p<0.001), which meaned that N100 promoted annual carbon efflux from soil respiration, while N150 had an inhibitory effect on it.
Key words nitrogen deposition; subtropical evergreen broad-leaved forest; soil organic carbon (SOC); soil respiration
doi: 10.13209/j.0479-8023.2022.017
国家重点研发计划(2017YFC0503903)资助
收稿日期: 2021-05-10;
修回日期: 2021-05-25