杨亚馨1王虹1赵华章2,3,†
1.北京化工大学化学工程学院, 北京 100029; 2.北京大学环境科学与工程学院, 北京 100871; 3.北京市新型污水深度处理工程技术研究中心, 北京 100871; †通信作者, E-mail: zhaohuazhang@pku.edu.cn
摘要以有机硅季铵盐和活性炭为原料, 利用硅烷化反应, 制备一种新型吸附材料——共价键型季铵化活性炭(CQA)。通过FTIR, SEM 和 BET 对 CQA 进行表征, 验证季铵盐能够通过共价键结合, 成功地负载到活性炭表面, 并对活性炭的形貌结构产生重要影响。CQA 对硝氮和磷酸盐的吸附能力都大大提高, 对含硝氮和磷酸盐的溶液的吸附实验表明: CQA对硝氮和磷酸盐的吸附机理均符合拟二级反应模型, 说明吸附过程主要由化学吸附控制; 吸附过程可以用 Langmuir 和 Freundlich 等温吸附模型较好地进行描述, 最大吸附容量分别为 14.829 和8.442 mg/g。最后考察 pH 对硝氮和磷酸盐吸附行为的影响, 结果表明, 当 pH 为 4~9 时, 比较适宜CQA对硝氮和磷酸盐同时去除。
关键词活性炭; 硝氮; 磷酸盐; 改性; 吸附
目前, 我国城镇排放的生活污水中含有一定浓度的氮磷。在缺水少雨的地区, 城镇污水处理厂的一级 A 标准出水常作为回用水, 如果不加以深度处理, 会大大增加水体富营养化风险。常见的污水脱氮除磷的方法主要有生物法、离子交换法、电渗析法和吸附法等[1]。吸附法由于操作方便、工艺简单和效果稳定等, 被证实是一种经济可行的方法[2]。
活性炭的比表面积非常高, 表面存在大量功能基团, 广泛地应用于去除水中各种有机和无机污染物[3]。但是, 普通活性炭对无机阴离子的吸附容量有限[4–5], 故新型高效吸附剂的开发成为研究热点。为了有效地吸附目标污染物, 以材料的构效关系为基础, 研究者将多种功能基团灵活地接枝到活性炭上。季铵盐因为在水中带强烈的正电, 常用于改性吸附剂, 去除水中污染物。陈维芳等[6]将活性炭用十六烷基三甲基氯化铵(CTAC)季铵化后, 用于去除水中的砷。谭绍早等[7]利用十四烷基二甲基苄基季铵阳离子改性蒙脱土, 作为一种新的复合抗菌剂。他们采取的是浸渍改性方法, 季铵盐与吸附剂的结合不牢固, 容易流失, 从而对水体造成二次污染。Shi 等[8]通过接枝的方式, 将 3-(三甲氧基硅烷基)丙基十八烷基二甲基氯化铵(QAS)用于改性活性炭, 改性后的活性炭具有良好的抗菌能力, 并且不容易发生泄漏。采用有机硅季铵盐作为改性剂, 在与活性炭表面形成共价键的同时, 能够提高活性炭对硝氮和磷酸盐的亲和性。
本文以共价键型季铵化活性炭(CQA)为研究对象, 对改性后的活性炭进行表征, 证明季铵盐能够通过共价键牢固地结合在活性炭表面。在此基础上研究 CQA 对水中硝氮和磷酸盐的吸附行为, 考察pH、吸附剂投加量、硝氮和磷酸盐初始浓度等对CQA吸附性能的影响。
材料: 商品级活性炭粉(河南海韵环保科技有限公司), 3-(三甲氧基硅烷基)丙基十八烷基二甲基氯化铵(有机硅季铵盐溶液, 40%乙醇溶液, 广州市诺康化工有限公司), 乙醇(分析纯)、硝酸钾(分析纯)、磷酸二氢钾(分析纯)、盐酸和氢氧化钠均购自国药集团化学试剂有限公司, 实验室用水均为去离子水。
仪器: 培英牌 DDHZ-300 恒温振荡器, 雷磁ZD-2 自动电位滴定仪, UV-1750 紫外–可见光分光光度计(岛津企业管理(中国)有限公司), 傅立叶变换红外光谱仪(Magna-IR 750, 美国 Nicolet 公司), 扫描电子显微镜(JSM-7800F), 比表面积和孔径分布测定仪(ASAP 2010, 美国)。
1.2.1 共价键型季铵化活性炭的制备
取适量活性炭, 使其分散于去离子水中, 然后将此混合液放置于摇床中, 在 25℃下, 以 200 r/min的转速振荡 0.5 小时后, 将其过滤。重复此过程两次后, 于 105℃下烘干至恒重待用。
称取一定量洗净的活性炭于 500 mL 的圆底烧瓶中, 依次向烧瓶中加入适量的有机硅季铵盐和去离子水。在室温下, 于圆底烧瓶中以适当速度搅拌2 小时后, 转移至烧杯中待用。用无水乙醇对混合液清洗两次, 再用去离子水清洗, 重复洗涤至溶液上方无明显的泡沫状物质时, 过滤, 然后于 60℃下烘干至恒重待用, 所得的固体样品即为CQA。
1.2.2 改性前后活性炭的表征
对改性前后的活性炭进行 FTIR 分析, 表征改性前后其表面基团的变化; 进行 BET 分析和 SEM测试, 表征活性炭形貌结构的变化。
1.2.3 吸附实验
硝氮溶液和磷酸盐溶液分别由溶解磷酸二氢钾(KH2PO4)和硝酸钾(KNO3)于去离子水中制得。N和 P 的储备液浓度均为 1000 mg/L (分别以硝酸盐氮和总磷计)。硝氮的测定方法为抗坏血酸法; 磷酸盐的测定方法为钼酸盐法。
分别称量0.1, 0.5, 0.8和1 g改性前后的活性炭, 投入含 5 mg/L 的磷酸盐和 15 mg/L 的硝氮的50 mL 混合配水中。将该混合液置于摇床中, 在(25±1)℃下, 以 200 r/min 的速度振荡 90 分钟后, 取水样过 0.45μm 的一次性水系滤头(混合纤维), 经过紫外–分光光度计测试, 分别测定硝氮和磷酸盐的浓度。
称取0.2 g的CQA, 置于12个100 mL锥形瓶中, 再分别加入50 mL初始浓度为20 mg/L的硝氮溶液和 10 mg/L 的磷酸盐溶液, 并用 0.1 mol/L 的HCl溶液或 0.1 mol/L的NaOH溶液调节溶液的pH至一定值, 放入恒温摇床中, 在(25±1)℃下, 用 200 r/min 的频率振荡, 反应达到平衡后, 分别测定硝氮和磷酸盐的浓度, 以便考察 pH 对吸附过程的 影响。
1.2.4 CQA吸附硝氮和磷酸盐的动力学实验
分别配制20和30 mg/L的硝氮溶液, 10 和 15 mg/L 的磷酸盐溶液 200 mL, 置于 500 mL 的烧杯中, 在每组吸附瓶中分别加入 0.8 g CQA, 密封后置于恒温摇床中, 在 25℃和 200 r/min 的条件下振荡吸附, 每隔一定时间取样, 分别测定水中剩余的硝氮和磷酸盐浓度, 绘制吸附量随时间变化的曲线。
1.2.5 CQA吸附硝氮和磷酸盐等温吸附曲线
称取 CQA 0.2 g, 分别加入已知浓度为10, 20, 30, 40, 50和60 mg/L的硝氮溶液以及5, 8, 10, 15, 18和20 mg/L的磷酸盐溶液中, 密封后置于恒温摇床中。在25℃下, 分别振荡40和90分钟, 使吸附达到平衡, 分别测定剩余的硝氮和磷酸盐浓度。
CQA 吸附的硝氮和磷酸盐的量, 可以通过溶液中硝氮和磷酸盐的最初浓度和平衡浓度相减得到; CQA 对溶液中硝氮和磷酸盐的吸附容量(qe, mg/g), 可以通过式(1)得出(这个吸附容量的值也可以用在吸附等温线中):
Ci和Ce分别为硝氮和磷酸盐的初始浓度和平衡浓度(mg/L);V是硝氮或者磷酸盐溶液的体积(L);W是加入的吸附剂活性炭的质量(g)。
图 1 为活性炭改性前后的 FTIR 谱图, 可以看出这两条谱线在 2920, 2850, 1463 和 1038 cm–1处有明显的区别。
在2920 和 2850 cm–1处的吸收峰归因于C—H振动, 且它们分别与 CH2的不对称伸缩振动和对称伸缩振动一致[9]; 1463 cm–1处的吸收峰由CH2的反对称弯曲振动产生[9]; 1038 cm–1处的强吸收峰由C—O—Si振动或Si—O—Si的不对称振动产生[10]。综上可知, 活性炭改性后出现大量的季铵盐特征基团, 表明季铵盐成功地负载到活性炭的表面, 且季铵盐与活性炭是以 C—O—Si 的共价键键接方式而结合, 这种结合方式非常牢固, 季铵盐不易脱落。
表1 改性前后活性炭的比表面积和孔结构参数
Table 1 Specific surface area and pore structure parameters of activated carbon before and after modification
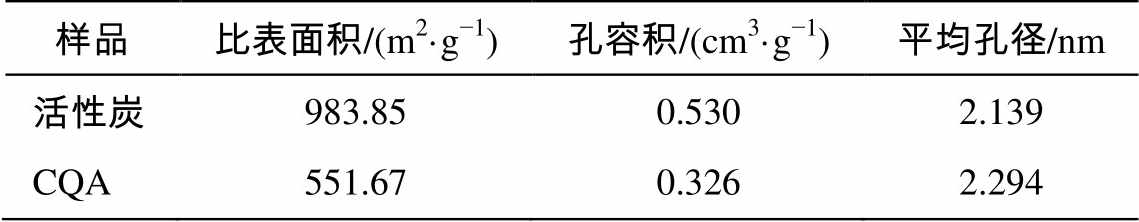
图 2(a)和(b)为改性前后的活性炭在 1000 放大倍率下的 SEM 图像; 图 2(c)和(d)为改性前后的活性炭在 10000 放大倍率下的 SEM图像。可以看出, 改性前的活性炭棱角分明, 呈多孔结构; 改性后的活性炭表面覆盖一层较为疏松的物质, 呈蜂窝状。改性前后活性炭的形貌结构发生明显的改变, 证明改性成功, 且季铵盐较均匀地结合于活性炭表面。
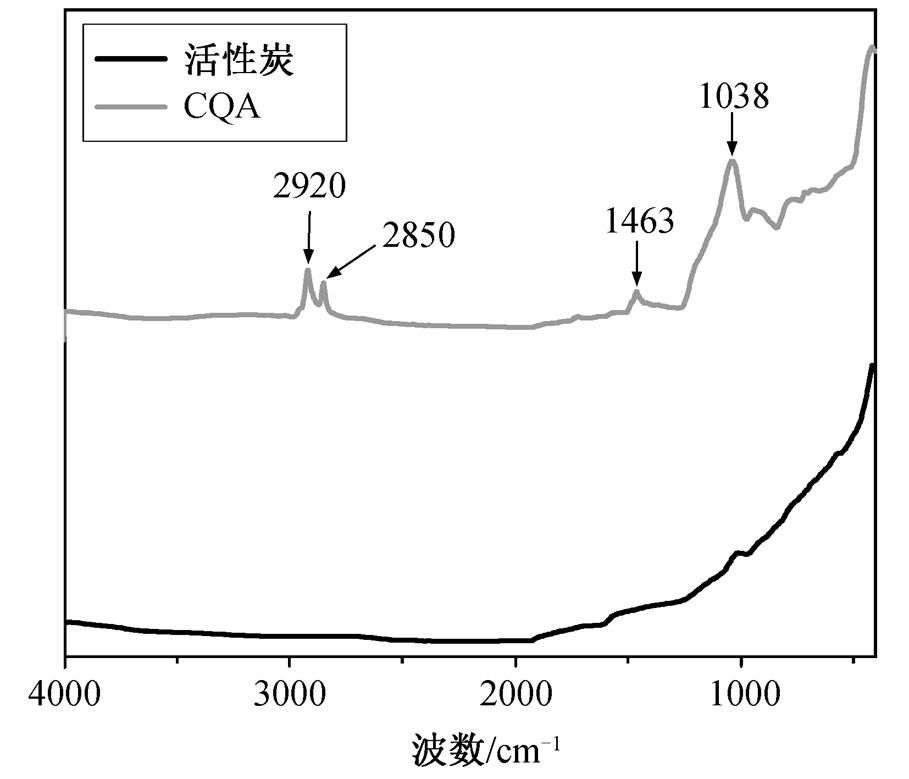
图1 活性炭改性前后FTIR谱图
Fig. 1 FTIR spectra of the activated carbon before and after modification
表 1 给出改性前后活性炭的结构参数。可以看出, 季铵盐改性后活性炭的比表面积和孔体积显著降低。结合 SEM 图像可知, 由于季铵盐基团附着在活性炭表面和孔道内, 导致孔道堵塞以及样品颗粒团聚, 从而引起比表面积和孔体积减小[11–12]。同时由于季铵盐基团团聚形成部分较大的孔, 使得平均孔径增大[11–12]。
根据城镇污水处理厂污染物排放标准中的一级A 标准(即 GB18918—2002), 配制含 15 mg/L 硝氮和 5 mg/L 磷酸盐的混合溶液, 并进行不同吸附剂投加量的吸附实验, 结果如图3所示。
从图 3 可以看到, 随着 CQA 的投加量从 2 到16 g/L, 对硝氮和磷酸盐的去除率也随之增加, 分别从 36%增加到 97%, 从 27%增加到 92%。在一 个固定初始浓度的溶液中, 去除率会随着吸附剂的投加量增加而增加。原因是在固定初始吸附质浓度的溶液中, 随着吸附剂投加量的增加, 能够得到更大的比表面积和更多的吸附位点; 此外, 也归因于活性炭上的功能基团季铵盐与吸附质的结合[13]。在投加量为10 g/L时, CQA对硝氮和磷酸盐的去除率比活性炭有明显的增加, 说明季铵盐能大幅度地提高活性炭对硝氮和磷酸盐的亲和性。当投加量达到 16 g/L 时, CQA 对硝氮和总磷的去除率均达到较高值, 故最佳CQA投加量为16 g/L。

(a)和(c)为未改性的活性炭, (b)和(d)为CQA
图2 活性炭改性前后SEM图
Fig. 2 SEM images of the activated carbon before and after modification
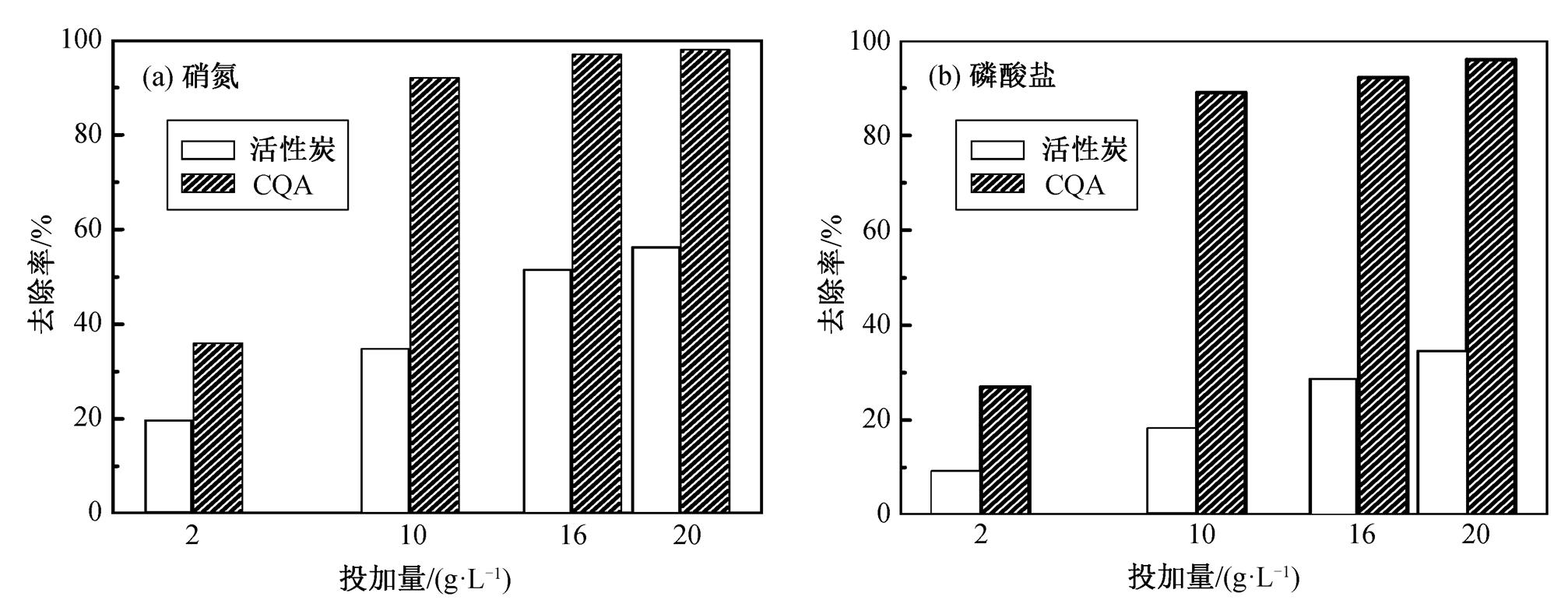
图3 混合溶液中投加量对硝酸盐氮和总磷的去除的影响
Fig. 3 Effects of adsorbent doses on removed amount of nitrate and phosphate in mixing solution
在不同 pH 值下, CQA 对硝氮和磷酸盐的吸附容量见图4。从图 4(a)可见, 随着 pH 值增大, CQA对硝氮的吸附容量逐渐减小, 在 pH 值为 3 时, 吸附剂的吸附容量较大。原因是, 在较低的 pH 值下, 溶液中充斥的 H+会增多, 从而导致活性炭上带正电的位点增加, 硝酸根与带正电的位点之间的静电吸引作用有利于 CQA 对硝氮的吸附[14]。在 pH 值为 11 时, 吸附剂的吸附容量较小。原因是, 在较高的 pH 值下, 溶液中 OH-增多, 导致活性炭上带正电的位点减少, 且 OH-会与 NO3-竞争活性炭上的吸附位点, 最终造成吸附剂对硝氮的吸附容量减小[15]。从图 4(b)可见, 在 pH 值较低和较高时, CQA对磷酸盐的吸附容量均很小。在较低的 pH 值下, 溶液中的磷酸盐主要以 H3PO4的形式存在, H2PO4-和 HPO42-的数量大大减少, 导致吸附剂对磷酸盐的吸附容量减小[16]; 在较高的 pH 值下, 溶液中OH-中增多, 并且 OH-会与 PO43-竞争活性炭上的吸附位点, 故此时对磷酸盐的吸附容量大大减 小[16]。所以, 当pH 为 4~9时, 比较适宜 CQA 对硝氮和磷酸盐的同时去除。
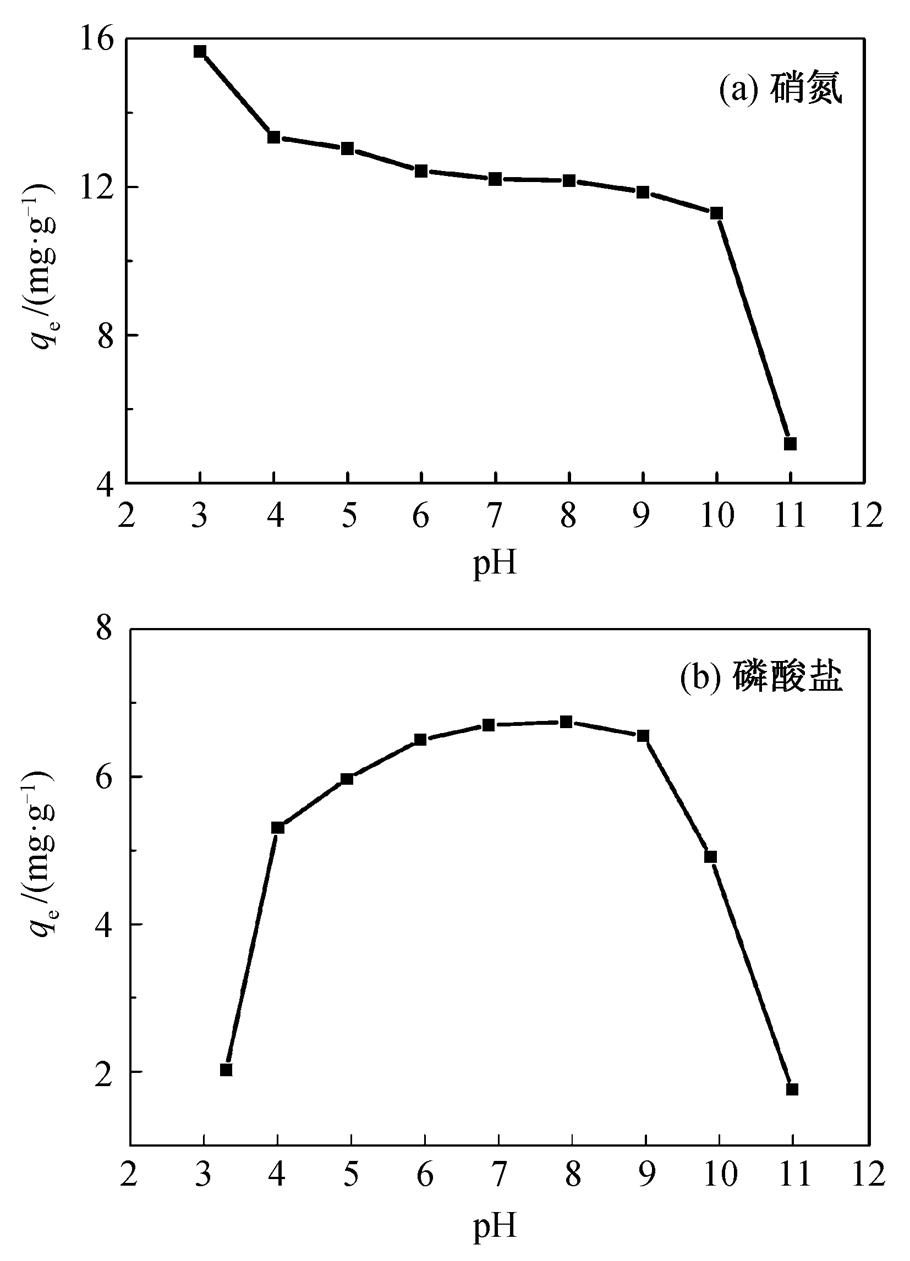
图4 溶液的pH对共价键型季铵化活性炭吸附硝氮和磷酸盐的影响
Fig. 4 Effects of initial solution pH on the nitrate and phosphate uptakes by CQA
对于液固体系, 吸附平衡是描述吸附行为的重要理化性质之一。吸附等温线描述溶液中吸附剂的浓度与界面吸附量之间的关系[17]。CQA 吸附硝氮和磷酸盐的吸附等温线见图 5。可以观察到, 随着溶液中硝氮和磷酸盐的平衡浓度升高, CQA 对硝氮和磷酸盐的吸附容量也随之上升。
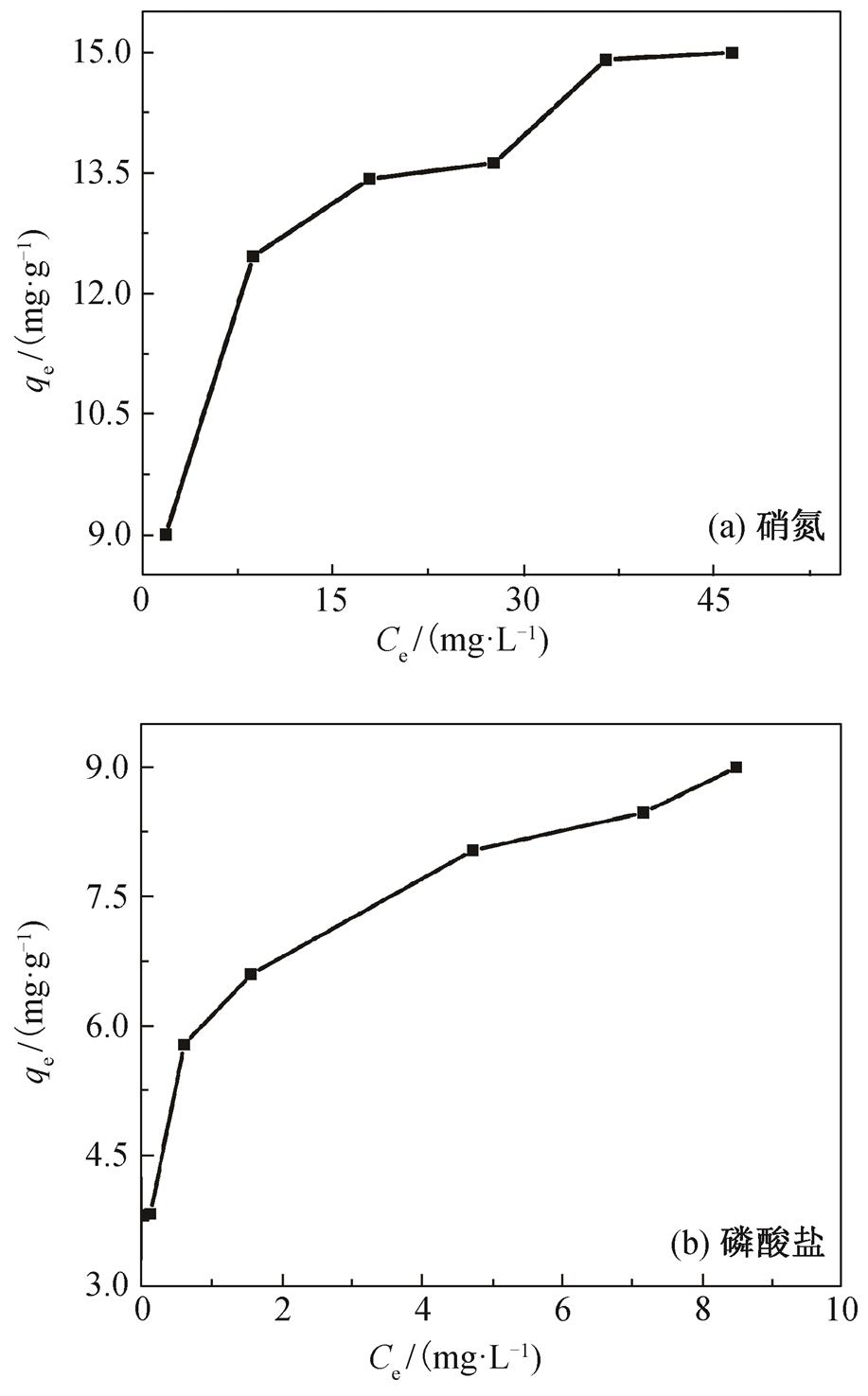
图5 硝氮和磷酸盐的吸附等温线
Fig. 5 Adsorption isotherms of nitrate and phosphate on CQA
Langmuir和Freundlich等温吸附模型均适用于高度非均匀表面。Langmuir等温吸附模型为
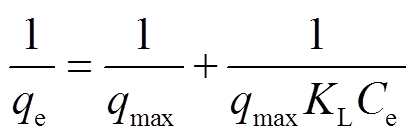 , (2)
, (2)Freundlich等温吸附模型为
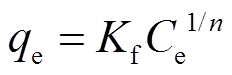 , (3)
, (3)
qe是吸附达到平衡状态时吸附剂对水中硝氮和磷酸盐的吸附值(mg/g);qmax是硝氮和磷酸盐在该吸附剂上的最大吸附容量(mg/g);Ce是硝氮和总磷在溶液中的平衡浓度(mg/L);KL是Langmuir吸附常数, 与吸附能有关;Kf和n是Freundlich常数, 分别与吸附容量和吸附强度有关。
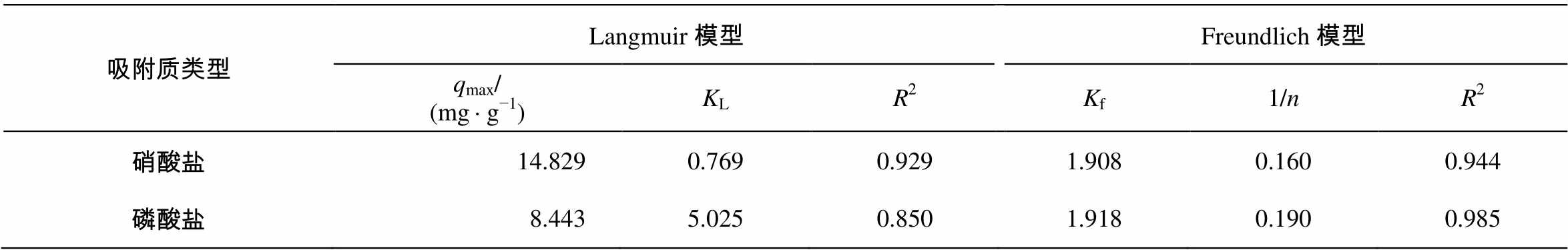
通过 Langmuir 和 Freundlich 等温吸附模型, 对CQA吸附硝氮和磷酸盐的实验数据进行分析。从表 2 可见, 两种模型的拟合相关系数均大于 0.85, 说明这两个等温吸附模型都能较好地描述硝氮和磷酸盐在CQA上的吸附过程。
表2 Langmuir和Freundlich等温吸附模型拟合参数
Table 2 Results and parameters associated with Langmuir and Freundlich models
Langmuir 等温线的重要参数可以表示为一个无量纲的常数, 即分离因子RL, 其定义式[16]如下:
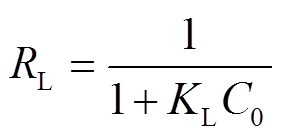 , (4)
, (4)C0代表硝氮和磷酸盐的最高的初始浓度(mg/L);RL代表等温线类型, 0<RL<1时良好吸附,RL=0时为不可逆吸附,RL=1 时为线性吸附,RL>1 时不利于吸附[18]。经计算, 硝氮和磷酸盐的RL分别为 0.005 和0.003, 共价键型季铵化活性炭对硝氮和磷酸盐均为良好吸收[18]。
CQA 吸附水溶液中的磷酸盐和硝氮的动力学实验结果见图 6。可以看出, 硝氮的吸附速率非常快, 5分钟即达到吸附平衡; 而磷酸盐在 90 分钟时才达到吸附平衡。
为了更好地理解吸附机理和动力学, 利用准二级动力学模型分析实验结果。准二级动力学方程如下所示:
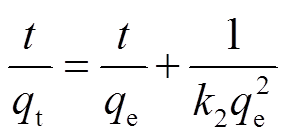 , (5)
, (5)其中,t为反应时间(min);qt和qe是在t时刻和吸附达到平衡状态时, 吸附剂对硝氮和磷酸盐的吸附容量(mg/g);k2为准二级速率常数(g/(mg·min))。通过绘制t/qt与t的曲线, 能够确定k和qe的值。CQA吸附水中的硝氮和磷酸盐的动力学参数和速率常数见表3。

图6 硝酸盐和磷酸盐的吸附动力学
Fig. 6 Adsorption kinetics of nitrate and phosphate on CQA
由表 3 可知, 准二级动力学模型对季铵盐改性活性炭吸附水中的磷酸盐和硝氮的拟合相关系数非常高, 均达到0.999, 说明硝氮和磷酸盐的吸收符合准二级动力学模型, 且吸附过程主要是由化学吸附控制[19]。
表3 季铵盐改性活性炭吸附硝氮和磷酸盐的动力学模型参数
Table 3 Kinetic model parameters of nitrate and phosphate on CQA

说明: 硝氮的初始浓度以硝酸盐氮计, 磷酸盐的初始浓度以总磷计。
1)本实验利用硅烷化反应制备的 CQA, 经过FTIR, BET 和 SEM 测试, 证实季铵盐能够成功地通过共价键结合在活性炭表面, 且对活性炭形貌产生巨大影响。改性后的活性炭仍具有较高的孔体积(0.326 cm3/g)和较大的比表面积(551.67m2/g)。
2)随着 pH 值的增加, CQA 对硝酸盐的吸附逐渐减小。在 pH 值较低和较高时, CQA 对磷酸盐的吸附容量均很小。pH 为 4~9 时, 比较适宜 CQA 对硝酸盐和磷酸盐的同时去除。
3)季铵盐能够显著地增加活性炭对硝酸盐和磷酸盐的吸收。在 25±1℃, pH 为 7 时, CQA 对硝酸盐和磷酸盐的最大吸附容量分别为 14.829 和8.442 mg/g。CQA对硝酸盐和磷酸盐的吸附过程能够较好地由 Langmuir 和 Freundlich 等温吸附模型描述, 并且对硝酸盐和磷酸盐的吸收均为良好吸收。CQA 对硝酸盐和磷酸盐的吸附过程很好地符合准二级动力学模型, 且吸附过程主要由化学吸附控制。
4)新制备的 CQA 吸附剂可用于水中氮和磷的深度去除, 并具有较广阔的应用前景。
参考文献
[1]常望霓, 杨华南. 城市污水脱氮除磷方法探讨. 环境保护, 2000(11): 19–20
[2]段金明, 林建清, 方宏达, 等. 改性沸石同步深度脱氮除磷的实验研究. 环境工程学报, 2009, 3(5): 829–833
[3]Rivera U J, Sanchez P M, Gomez S V, et al. Activated carbon modifications to enhance its water treatment applications: an overview. J Hazard Mater, 2011, 187: 1–23
[4]Parette R, Cannon F S. The removal of perchlorate from groundwater by activated carbon tailored with cationic surfactants. Water Res, 2005, 39(16): 4020–4028
[5]魏峣, 程诚, 吕龙, 等. 交联壳聚糖季铵盐对水体中硝酸盐的吸附去除研究. 水处理技术, 2012, 38 (9): 21–25
[6]陈维芳, 程明涛, 张道方. CTAC改性活性炭去除水中砷(V)的柱实验吸附和再生研究. 环境科学学报, 2012, 32(1): 150–156
[7]谭绍早, 马文石, 刘应亮. 新型改性蒙脱土复合抗菌剂的制备及抗菌性能. 华南理工大学学报(自然科学版), 2006, 34(8): 94–99
[8]Shi Z, Neoh K G, Kang E T. Antibacterial and adsorp-tion characteristics of activated carbon functionalized with quaternary ammonium moieties. Ind Eng Chem Res, 2006, 46(2): 439–445
[9]Zhu J, He H, Zhu L, et al. Characterization of organic phases in the interlayer of montmorillonite using FTIR and13C NMR. Immunological Journal, 2005, 286(1): 239–244
[10]Vityazev F V, Fedyuneva M I, Golovchenko V V, et al. Pectin-silica gels as matrices for controlled drug release in gastrointestinal tract. Carbohydrate Poly-mers, 2016, 157: 9–20
[11]Javadian H, Koutenaei B B, Shekarian E, et al. App-lication of functionalized nano HMS type mesoporous silica with N-(2-aminoethyl)-3-aminopropyl methyl-dimethoxysilane as a suitable adsorbent for removal of Pb (II) from aqueous media and industrial wastewater. Journal of Saudi Chemical Society, 2017, 21: S219–S230
[12]Hou P, Cannon F S, Brown N R, et al. Granular acti-vated carbon anchored with quaternary ammonium/ epoxide-forming compounds to enhance perchlorate removal from groundwater. Carbon, 2013, 53(1): 197–207
[13]Rao M M, Ramana D K, Seshaiah K, et al. Removal of some metal ions by activated carbon prepared from Phaseolus aureus hulls. J Hazard Mater, 2009, 166 (2/3): 1006–1013
[14]Demiral H, Gunduzoglu G. Removal of nitrate from aqueous solutions by activated carbon prepared from sugar beet bagasse. Bioresour Technol, 2010, 101(6): 1675–1680
[15]Nunell G V, Fernández M E, Bonelli P R, et al. Conversion of biomass from an invasive species into activated carbons for removal of nitrate from waste-water. Biomass and Bioenergy, 2012, 44: 87–95
[16]Kumar P, Sudha S, Chand S, et al. Phosphate removal from aqueous solution using coir-pith activated car-bon. Separation Science and Technology, 2009, 45(10): 1463–1470
[17]Salem M A, Elsharkawy R G, Hablas M F. Adsorption of brilliant green dye by polyaniline/silver nanocom-posite: kinetic, equilibrium, and thermodynamic stu-dies. European Polymer Journal, 2016, 75: 577–590
[18]Bagherifam S, Komarneni S, Lakzian A, et al. Highly selective removal of nitrate and perchlorate by or-ganoclay. Applied Clay Science, 2014, 95: 126–132
[19]Cui J J, Niu C G, Wang X Y, et al. Facile preparation of magnetic chitosan modified with thiosemicarbazide for adsorption of copper ions from aqueous solution. Journal of Applied Polymer Science, 2017, 134(9): 44528
Research on Adsorption of Nitrate and Phosphate from Aqueous Solution by Covalently Bounded Quaternary Ammonium Activated Carbon
YANG Yaxin1, WANG Hong1, ZHAO Huazhang2,3,†
1. College of Chemical Engineering, Beijing University of Chemical Technology, Beijing 100029; 2. College of Environmental Sciences and Engineering, Peking University, Beijing 100871; 3. Beijing Engineering Research Center for Advanced Wastewater Treatment, Beijing 100871; † Corresponding author, E-mail: zhaohuazhang@pku.edu.cn
AbstractA novel adsorbent of covalently bounded quaternary ammonium activated carbon (CQA) was prepared by silylation reaction with both organosilicon quaternary ammonium salt (QA) and activated carbon (AC) as raw materials. The CQA was characterized by FTIR, SEM and BET. The results showed that QA was successfully loaded on the surface of AC by covalent binding, and had an important influence on the morphology and structure of AC. The nitrate and phosphate adsorption capacities for CQA were greatly improved. The adsorption behaviors of nitrate and phosphate from aqueous solutions on CQA were investigated using batch experiments. The kinetics study revealed that adsorption of nitrate and phosphate onto CQA followed the pseudo-second-order kinetic model, indicating that the adsorption process was mainly controlled by the chemisorptions. The adsorption data fitted Langmuir and Freundlich isotherm models well, and the maximum nitrate and phosphate adsorption capacities for CQA were 14.829 and 8.442 mg/g, respectively. The effects of pH on the adsorption of nitrate and phosphate were also investigated. The results showed that when pH was from 4 to 9, it was suitable for simultaneous removal of nitrate and phosphate fromaqueous solution by CQA.
Key wordsactivated carbon; nitrate; phosphate; modification; adsorption:
中图分类号X52
doi:10.13209/j.0479-8023.2018.039
国家自然科学基金(51578006, 51378020)资助
收稿日期:2017-06-06;
修回日期:2017-07-25;
网络出版日期:2018-06-08