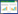文章信息
- 林笠, 王其兵, 贺金生
- LIN Li, WANG Qibing, HE Jinsheng
- 青藏高原高寒草甸土发生季节性潜育化及其生态学意义
- Soil Seasonal Gleization and Its Ecological Implications in the Alpine Meadow on the Tibetan Plateau
- 北京大学学报(自然科学版), 2016, 52(6): 1161-1166
- Acta Scientiarum Naturalium Universitatis Pekinensis, 2016, 52(6): 1161-1166
-
文章历史
- 收稿日期: 2015-05-24
- 修回日期: 2015-06-09
- 网络出版日期: 2016-11-05
2. 中国科学院植物研究所, 植被与环境变化国家重点实验室, 北京 100093
2. State Key Laboratory of Vegetation and Environmental Change, Institute of Botany, Chinese Academy of Sciences, Beijing 100093
土壤潜育化是所有水成土共同经历的过程之一, 主要受淹水程度、淹水类型以及母质性质等环境因素影响[1], 导致水成土发育成不同类型的潜育土[2]。土壤潜育化一般发生在具有充足的水分、丰富的有机质以及兼性或嫌气性微生物区系的区域。在我国南方地区, 潜育化水稻土广泛分布, 特别是江苏、江西、浙江、广西等省[3]。水稻土潜育化已经严重影响到农业生产。潜育化的水稻土还原性物质多, 重金属活性增强, 土壤微生物活性下降, 易导致作物幼苗发僵或坐蔸。研究表明, 潜育化的水稻土每公顷产量比一般稻田低1500~2250 kg[2]。目前关于土壤潜育化过程的研究集中在水稻田、湿地以及南方丘陵地区[4-5], 对于高寒地区土壤潜育化的野外观测以及潜育化过程的研究则很少。
高寒草甸土是青藏高原高寒地区的重要土壤类型之一。由于受地下水浸没的影响, 使其形成半水成土, 同时存在潜育化现象[6]。对于不受地下水影响的高寒草甸土壤, 普遍认为不存在潜育化。我们在2013年12月至2014年3月非生长季的野外观测过程中发现, 虽然高寒草甸非水成化土壤不受地下水影响, 但由于受土壤季节性冻融过程影响[7-8]以及土壤有机质含量高的特点, 高寒草甸土也发生潜育化。
本文选取青藏高原高寒草甸非水成化潜育化土壤作为研究对象, 利用土壤剖面法和微根管观察法相结合的技术手段, 比较发生季节性潜育化土壤的剖面, 研究发生季节性潜育化的形成原因, 探讨其对非生长季地下生态学过程的可能影响, 为该地区生态系统稳定和地球化学循环研究提供科学数据和理论支持。
1 材料和方法 1.1 研究地点概况本实验完成于中国科学院海北高寒草甸生态系统研究站(海北站)。海北站位于青藏高原东北部的祁连山谷地(101°12′E, 37°30′N, 海拔3200 m), 该区域属于典型的高原大陆性气候, 夏季受东南季风气候影响, 冬季受西伯利亚寒流影响。年平均温度为-2 ℃, 年平均降水量为500 mm, 超过80%的降水分配到生长季[9]。土壤为草毡寒冻雏形土(即高寒草甸土)[10], 有机质及全量养分丰富。在0~10 cm和10~20 cm土层, 土壤有机质含量分别为63和36 g/kg, 容重分别为0.82和0.98 g/cm3, 土壤pH值分别为7.86和7.96。该地区为典型的高寒草甸生态系统, 植被类型主要为青藏高原典型的地带性植被--以金露梅为建群种的高寒灌丛草甸和以嵩草属植物为建群种的高寒嵩草草甸, 主要物种有Kobresia humilis, Festuca ovina, Elymus nutans, Poa pratensis, Carex scabrirostris, Scripus distigmaticus和Gentiana straminea[11-12]。样地的具体信息参见文献[13]。
1.2 研究方法 1.2.1 土壤剖面观察及理化性质测定 每个时期随机挖取海北站综合观测场土壤剖面(长0.5 m, 宽0.5 m, 深1 m) 5个。按照土层的形态特征, 自上而下划分土壤各层分布, 观察并记录各层土壤颜色、潜育程度及结核分布情况(包括颜色、丰度、分布面积以及结核大小等), 取样测定土壤pH和质地。 2014年1月采集腐殖质层、潜育层和淋溶层的土壤样品, 在实验室自然风干后, 研磨过10目和100目筛。土壤Ph采用pH计法测定, 水土比为5:1;土壤有机碳含量采用重铬酸钾氧化滴定法测定; 土壤Eh采用电极法测定; 阳离子交换量采用NH4Cl-NH4Oac法测定; 土壤还原态活性铁和锰含量采用DTPA溶液浸提-原子吸收光谱法测定; 土壤速效磷含量采用Olsen-P法测定; 土壤微生物生物量碳含量采用氯仿-熏蒸法测定(Kec=0.45)。以上土壤理化性质的测定方法参照文献[14]。 1.2.2 冻融层观测 采用微根管法观测冻融层的厚度。2012年10月在海北站综合观测区野外随机安装5根微根管, 管径为7 cm, 深度为80 cm。2013年10月至2014年4月, 采用CI-600仪器(CID, Camas, Wash., 美国)每隔1个月扫描1次, 得到土壤剖面图片。用Photoshop CS5软件(Adobe Systems, Inc. 2010)对观测到的冻融层动态划定冻融层上线、下线位置(靠近地面为冻融层上线, 远离地面为冻融层下线), 计算冻融层厚度。 1.3 统计与绘图土壤不同层间各理化指标差异的分析统计采用单因素方差分析和最小显著差异法(LSD)多重比较分析方法。土壤冻融层与潜育层厚度关系分析采用一元线性回归。所有数据处理采用SPSS软件(Version 20), 作图采用Sigmaplot 10.0软件(Systat Software, Inc. 2005)。
2 结果与分析 2.1 潜育化土壤剖面形态特征在12月下旬至3月上旬, 我们在海北站观测场发现土壤存在潜育层(图 1)。潜育化只发生在冬季, 呈现明显的季节性(图 2)。

|
| 图 1. 青藏高原高寒草甸土出现季节性潜育化(2014年1月6日拍摄) Figure 1. Seasonal soil gleization of alpine grassland on the Tibetan plateau on Jan. 6, 2014 |
|
| 图 2. 青藏高原高寒草甸季节性潜育化土壤剖面构型示意图 Figure 2. Pattern of the soil seasonal gleization along soil profile of alpine meadow on the Tibetan Plateau |
根据土壤剖面各层形态特征以及理化性质进行分层[15], 可大致分为4层: A, Ag, Br, C, 即腐殖质层、潜育层(锈斑层)、砾幂淀积层和母质层。
1) 腐殖质层:土体颜色偏黑, 腐殖化程度较差, 位于土壤剖面0~40 cm, 该层存在大量活根和死根残体, 土壤有机质含量较高。
2) 潜育层:即氧化还原淀积层, 土体颜色偏青灰, 位于土壤剖面10~25 cm, 位于土壤腐殖质层中间位置。该层具有灰蓝色的铁锰结核和胶膜层。
3) 砾幂淀积层:土体偏黄, 位于土壤剖面40~70 cm。该层黏土颗粒多, 土壤有机质含量低。
4) 母质层:有部分的白色母质出现, 位于土壤剖面约70 cm以下。
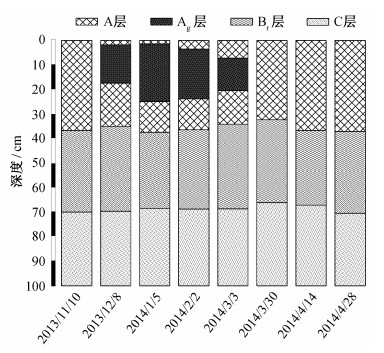
2.2 潜育层与冻融层的关系高寒草甸地区由于非生长季气温低且土壤含水量高, 土壤0~40 cm存在季节性冻土。微根管观测结果表明(图 3), 非生长季冻土层存在150天左右。2013年12月8日, 开始观测到土壤冻土层; 2014年4月28日, 土壤冻土层完全消失。土壤冻土层的厚度在1月达到最厚, 为42.7 cm。2013年11月至2014年1月, 土壤下层不断冻结, 冻土层厚度不断增加。2014年2月至4月, 土壤表层和底层同时解冻。我们通过土壤剖面观测到, 2014年1-2月出现的潜育化程度最高, 潜育层厚度最大, 分别达到23.5和20.3 cm; 新生体结核分布面积大, 颜色呈青灰色偏蓝(见图 1和2)。
|
| 图 3. 青藏高原高寒草甸土壤出现潜育期与冻融期的关系 Figure 3. Relationship between the period of the seasonal soil gleization and soil freezing thawing on the alpine grassland on the Tibetan plateau |
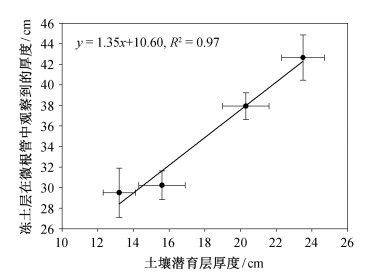
数据分析结果表明, 高寒草甸土壤冻土层与土壤潜育层出现在同一时期, 并且二者的厚度之间极显著地正相关(R2=0.97, P < 0.05)(图 4)。高寒草甸土壤冻融过程与潜育化之间存在密切的关系。
|
| 图 4. 土壤潜育层与冻融层厚度的关系 Figure 4. Relationship between the thickness of the soil gleiza-tion layer and that of soil freezing thawing layer |
2.3 土壤分层理化性质
实验结果表明, 高寒草甸土壤浅层具有较高的土壤有机质含量(表 1)。潜育层和腐殖质层有机碳含量均显著高于淋溶层, 腐殖质层高达46.7 g/kg, 潜育层高达32.4 g/kg。潜育层土壤阳离子交换量、有效铁和有效锰含量显著增加, 分别高出腐殖质层和淋溶层16.8%~45.0%, 8.7%~24.6%, 20.22%~30.3%。潜育层土壤pH为8.05, 比腐殖质层高0.1。潜育层土壤Eh为167 mV, 显著低于腐殖质层69.5%。低于200 mV, 说明土壤处于还原状态。潜育层土壤有效磷含量高达2.49 mg/kg, 显著高于腐殖质层12.9%。潜育层土壤微生物生物量碳为177.6 mg/kg, 显著低于腐殖质层43%。
| 土壤层 | 深度/cm | pH (H2O) | 土壤有机 碳/(g·kg-1) |
Eh/mV | 阳离子交换量/ (mmol (+)·kg-1) |
有效Fe/ (mg·kg-1) |
有效Mn/ (mg·kg-1) |
速效磷/ (mg·kg-1) |
微生物生物量碳 /(mg·kg-1) |
| 腐殖质层 | 0~40 | 7.95(0.05)b | 46.7(9.4)a | 383.0(15.1)a | 507.9(52.4)b | 1.78(0.36)b | 0.71(0.08)b | 2.17(0.13)b | 254.4(7.9)a |
| 潜育层 | 10~25 | 8.05(0.02)b | 32.4(7.3)b | 167.0(35.7)b | 610.2(42.4)a | 1.95(0.49)a | 0.99(0.07)a | 2.49(0.09)a | 177.6(12.3)b |
| 淋溶层 | 40~70 | 8.12(0.02)a | 10.1(1.1)c | 145.7(27.8)b | 335.4(10.5)c | 1.47(0.37)c | 0.62(0.04)c | 1.04(0.11)c | 83.5(3.5)c |
| 注:不同字母表示显著性差异(p < 0.5)。 | |||||||||
潜育化土壤有两种分类方法。一种是根据潜育层发生环境的不同, 划分为矿质潜育土、潜育土、假潜育土与滞水潜育土等[1]。潜育土与矿质潜育土主要受地下水影响发育而成, 假潜育土与滞水潜育土则主要受表层潜水层影响发育而成。按照高寒草甸土潜育的形成原因, 我们判断其为假潜育土。另一种是根据土壤潜育化程度的强弱划分为沼泽型潜育土、重潜育型潜育土、中轻度潜育型潜育土和潴育型潜育土4种类型[2]。按照高寒草甸土养分含量以及潜育程度因素, 我们判断其属于轻潜型潜育土。
3 讨论 3.1 非水成化土发生季节性潜育化的成因Von Brümmer等[16]通过总结190多篇文献, 认为土壤潜育化发生的必须条件是具有充足的水分、丰富的有机质以及兼性或嫌气性微生物区系。青藏高原高寒草甸非水成土虽然不受地下水浸没的影响, 但受季节性冻融影响。季节性冻结和融化过程使表层土浸没在冰水中, 造成土壤与大气无法进行气体交换, 不能形成良好的封闭层, 为潜育化的过程提供天然的还原条件[17-20]。潜育化发生的另一个重要成因是土壤有机质含量足够高。我们发现潜育层只发生在腐殖质层, 即使冻融层出现在腐殖质层与淋溶层的过渡位置, 但是由于40 cm以下土层有机质含量低, 土壤也不发生潜育化。
高寒草甸非水成化土壤与半水成化土壤发生潜育的成因、部位与程度明显不同。长期受地下水影响的高寒草甸土, 潜育化发生在淋溶层, 终年出现锈色斑纹层或铁锰结核等特征[6]。不受地下水影响的高寒草甸土潜育只发生在地表和冬季。并且在土壤的淋溶层, 由于富集钙及三氧化物, 潜育化作用受到抑制[21], 因此, 高寒草甸非水成化土壤淋溶层不会形成潜育层。
3.2 非水成化土发生季节性潜育化的形成过程青藏高原高寒草甸土壤潜育化过程分成3个阶段:潜育初期、中期和后期。在潜育初期, 土壤冻土层使土壤与大气的气体交换受阻, 导致土体内的氧气被好氧微生物消耗尽, 形成缺氧还原性厌氧环境; 在潜育中期, 土壤中丰富的有机质在厌氧细菌的作用下产生大量还原性物质[22], 使土壤中稳定态的三价铁离子和四价锰离子还原成活性态的二价铁离子和二价锰。土壤中的氧化物与活性态铁锰离子结合, 形成土壤新生体铁锰结核和铁锰氧化物, 使土体层呈现青色和青蓝色; 在潜育后期, 土壤冻土层解冻, 结束厌氧封闭状态, 铁锰结核重新被氧化, 潜育层逐渐消失。
3.3 季节性潜育化的生态学意义大量农田和湿地潜育化研究结果表明, 土壤潜育化影响多种生态过程[23-24], 比如抑制植物生长[25]、改变微生物群落[26-27]等。在高寒草甸土潜育层土壤中, 有效铁锰的含量显著高于其他土层, 大量稳定的Fe3+和Mn4+转变成具有活性的Fe2+和Mn2+, 大大增加了形成铁锰毒害的可能性。Laan等[28]和Batty等[29]研究表明, 铁锰毒最直接伤害的部位是根分生区。铁锰毒使根分生区表面形成铁氧化物和锰氧化物, 进而可能导致多年生根系在冬季大量死亡。
活性态铁锰含量的增加降低了微生物生物量碳含量, 说明可能改变了微生物的群落结构和功能[30-31]。在厌氧环境下, 好氧性微生物活动受到抑制, 厌氧微生物的数量和活性增加, 可能会改变物质循环(例如有机质分解矿化等过程)[32-33]。同时, 土壤铁锰浓度的增加能够促进土壤氧化物溶解度提高和有效磷的释放。这种养分浓度升高现象可能会在早春期间为植物萌发、返青和生长提供更多的养分。
4 结论青藏高原高寒草甸非水成化土壤潜育化只发生在非生长季腐殖质层, 主要原因是季节性冻土层产生的厌氧环境以及腐殖质层高含量土壤有机质。潜育化显著降低土壤微生物生物量碳, 提高了土壤pH值、CEC、还原态铁锰含量以及有效磷含量, 进而可能影响微生物群落结构、根系周转以及土壤养分循环等生态学过程。因此, 研究青藏高原高寒草甸土壤潜育化具有重要的生态学意义。
致谢:中国科学院西北高原生物研究所在野外研究期间给予支持, 中国科学院植物研究所对样品采集与分析给予帮助, 北京大学朱彪研究员, 中国科学院西北高原生物研究所张振华、陈立同助理研究员以及北京大学宋维民博士、王永慧博士、杨新宇硕士在文章修改方面提出建议, 在此一并致谢。
| [1] | 董元华, 徐琪. 土壤潜育化作用的特点及其研究进展. 土壤学进展, 1990, 18(1): 9–14. |
| [2] | 熊明彪, 舒芬, 宋光煜, 等. 南方丘陵区土壤潜育化的发生与生态环境建设. 土壤与环境, 2002, 11(2): 197–201. |
| [3] | Zeng Z, Pan X. Study on soil gleization in subtropic region of China using LBV transformed landsat images. Pedosphere, 1997, 7(3): 219–224 . |
| [4] | 龚子同, 韦启潘, 黄俄, 等. 关于水稻土的次生潜育化问题. 土壤学报, 1981, 18(2): 122–138. |
| [5] | Takai Y, Kamura T. The mechanism of reduction in waterlogged paddy soil. Folia Mierobiologic, 1996, 11(4): 304–313 . |
| [6] | 乐炎舟. 海北高寒草甸生态系统定位站的土壤类型及其基本特点. 北京: 科学出版社, 1982. |
| [7] | 刘宗香, 苏珍, 姚檀栋, 等. 青藏高原冰川资源及其分布特征. 资源科学, 2000, 22(5): 49–52. |
| [8] | 蒲健辰, 姚檀栋, 王宁练, 等. 近百年来青藏高原冰川的进退变化. 冰川冻土, 2004, 26(5): 517–522. |
| [9] | Zhao X, Zhou X. Ecological basis of Alpine meadow ecosystem management in Tibet Haibei Alpine Meadow Ecosystem Research Station. Allen Press on behalf of Royal Swedish Academy of Sciences, 1999, 28(8): 642–647 . |
| [10] | Group of Chinese Soil Taxonomy Research. Chinese soil taxonomy. Beijing: Science Press, 1995. |
| [11] | 赵新全. 高寒草甸生态系统与全球变化. 北京: 科学出版社, 2009. |
| [12] | Wang S, Duan J, Xu G, et al. Effects of warming and grazing on soil N availability, species composition, and ANPP in an alpine meadow. Ecology, 2012, 93(11): 2365–2376 DOI:10.1890/11-1408.1 . |
| [13] | Luo C, Xu G, Chao Z, et al. Effect of warming and grazing on litter mass loss and temperature sensitivity of litter and dung mass loss on the Tibetan plateau. Global Change Biology, 2010, 16(5): 1606–1617 DOI:10.1111/gcb.2010.16.issue-5 . |
| [14] | Robertson G P, Coleman D C, Bledsoe C S, et al. Standard soil methods for long-term ecological research. New York: Oxford University Press, 1999. |
| [15] | 黄昌勇. 土壤学. 北京: 中国农业出版社, 2009. |
| [16] | Von Brümmer G. Redoxpotentiale und Redoxprozesse von mangan-, eisenund Schwefelverbindungen in hydromorphen Böden und Sedimenten. Geoderma, 1973, 12(3): 207–222 . |
| [17] | Müllera C, Martina M, Stevensb R J, et al. Processes leading to N2O emissions in grassland soil during freezing and thawing. Soil Biology & Biochemistry, 2002, 34(9): 1325–1331 . |
| [18] | Sharma S, Szele Z, Schilling R, et al. Influence of freeze-thaw stress on the structure and function of microbial communities and denitrifying populations in soil. Appl Environ Microbiol, 2006, 72(3): 2148–2154 DOI:10.1128/AEM.72.3.2148-2154.2006 . |
| [19] | 杨梅学, 姚檀栋, HiroseN, 等. 青藏高原表层土壤的日冻融循环. 科学通报, 2006, 51(16): 1974–1976. |
| [20] | Wang Yonghui, Liu Huiying, Chung H, et al. Non-growing-season soil respiration is controlled by freezing and thawing processes in the summer monsoon-dominated Tibetan alpine grassland. Global Biogeochemical Cycles, 2014, 28: 1–15 DOI:10.1002/2013GB004712 . |
| [21] | Zaidel'man F R, Plavinskii V A, Belyi A V. Effect of deep meliorative loosening on physical properties of soils on heavy cover rocks and on crop yields. Moscow University Soil Science Bulletin, 1986, 41(2): 233–238 . |
| [22] | Fageria N K, Rabelo N A. Tolerance of rice cultivars to iron toxicity. Journal of Plant Nutrition, 1987, 10(6): 471–504 . |
| [23] | Ponnamporuma F N. The chemistry of submerged soils. Advanced Agronomy, 1972, 24: 29–96 DOI:10.1016/S0065-2113(08)60633-1 . |
| [24] | 邹元春, 姜明. 湿地土壤铁的分析测定方法比较. 湿地科学, 2008, 6(2): 136–141. |
| [25] | 臧小平. 土壤锰毒与植物锰的毒害. 土壤学通报, 1999, 30(3): 1–6. |
| [26] | 张西科, 张福锁, 毛达如. 植物根表铁、锰氧化物胶膜及其在植物营养中的作用. 土壤学进展, 1995, 23(6): 1–8. |
| [27] | James T G, Jenna E D, Brett M P, et al. Anaerobic methanogenesis in wetland ecosystems: do cut emergent aerenchyma of Typha×glauca facilitate increased atmospheric methane emission?. Ecology, 2011, 38: 1–12 . |
| [28] | Laan P, Blom C. The relative importance of anaerobiosis and high iron levels in the flood to lerance of Rumex species. Plant and Soil, 1991, 136: 153–161 DOI:10.1007/BF02150046 . |
| [29] | Batty C, Baker A, WIeeler BD, et al. The effect of pH and Plaque on the uptake of Cu and Mn in Phragmites australis (Cav.) Trin-ex. Steudel. Annals Botany, 2000, 86: 647–653 DOI:10.1006/anbo.2000.1191 . |
| [30] | Marschner P, Fu Q L, Rengel Z. Manganese availa-bility and microbial populations in the rhizosphere of wheat genotypes differing in tolerance to Mn deficiency. Journal of Plant Nutrition and Soil Science, 2003, 166: 712–718 DOI:10.1002/(ISSN)1522-2624 . |
| [31] | Nogueira M A, Nehls U, Hampp R, et al. Mycorrhiza and soil bacteria influence extractable iron and manganese in soil and uptake by soybean. Plant and Soil, 2007, 298: 273–284 DOI:10.1007/s11104-007-9379-1 . |
| [32] | Keppler F, Hamilton J T, Brass M, et al. Methane emissions from terrestrial plants under aerobic conditions. Nature, 2006, 439: 187–191 DOI:10.1038/nature04420 . |
| [33] | Ma J, Ma E, Xu H, et al. Wheat straw management affects CH4 and N2O emissions from rice fields. Soil Biology & Biochemistry, 2009, 41(5): 1022–1028 . |
 2016, Vol. 52
2016, Vol. 52