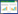文章信息
- 李昊洋, 王棋, 谈广才, 许楠
- LI Haoyang, WANG Qi, TAN Guangcai, XU Nan
- 纳米银颗粒对生菜吸收重金属镉的影响
- Effects of Silver Nanoparticles on the Accumulation of Cadmium by Lettuce (Lactuca sativa)
- 北京大学学报(自然科学版), 2016, 52(6): 1077-1084
- Acta Scientiarum Naturalium Universitatis Pekinensis, 2016, 52(6): 1077-1084
-
文章历史
- 收稿日期: 2015-05-08
- 修回日期: 2015-06-05
- 网络出版日期: 2016-11-04
纳米材料是至少有一维尺度在1~100 nm, 因而具有特殊功能的材料。纳米材料产业规模庞大, 截至2011年, 在已商品化的1317种纳米材料中, 纳米银占313种, 在纳米材料中排名第一, 远远高于文献大量报道的碳纳米管(91种)和纳米二氧化钛(59种)[1]。农业上, 纳米银广泛用于杀灭真菌与细菌[2], 已在大米、玉米、高粱[3]、黄瓜、南瓜[4]和辣椒[5]等农作物上得到应用, 最大用量可达5.4 μg/kg土壤[6]。此外, 某些农作物(如辣椒[7]、菠萝[8]等)还可在体内合成纳米银, 是公认符合绿色化学的合成方式。纳米银与农作物的相互作用不仅可能造成纳米银通过农作物的经口暴露, 也可能间接通过农作物影响其他污染物对人体的暴露。
众所周知, 镉通过稻米进入人体导致八大公害事件中的“痛痛病”。镉还可以在肾脏内积累致病, 而且很可能导致肺癌风险上升[9]。在2012年的一项调查中, 从广东省的10个地市采集12种蔬菜的共1117个样品, 检测到蔬菜中镉的平均浓度为0.0766 mg/kg (鲜重), 超过国家标准21.2%, 在镉、铅、砷、汞、铬5种重金属中危害最大, 健康风险贡献率为58.3%[10]。
生菜(Lactuca sativa)在国内外均为重要蔬菜, 既可有土栽培, 也可无土栽培。生菜为美国环境保护署(USEPA)规定的研究污染物的植物吸收与迁移的18种标准植物之一, 并且, 由于根部以上均为可食用部位, 实验只需进行至叶片质量满足分析需要即可, 周期较短[11]。纳米银对生菜的毒性[12]以及镉对生菜的毒性[13]已有文献报道。纳米材料对植物的间接影响是一个新兴研究领域, 但纳米银对生菜吸收镉的影响尚无文献报道。纳米银作为商业化产品最多的纳米材料, 在环境中特别是农田中已经广泛存在。镉是广东省超标最严重、健康风险最大的重金属, 应该得到充分关注。纳米银与镉在农业环境中的共存已是现实, 研究二者对生菜的联合毒性对评估和保障环境与食品安全有重要意义。
本文以纳米银可溶出的银离子浓度水平为对照, 在接近污染物环境浓度水平的条件下研究纳米银对生菜吸收镉的影响, 同时考察叶绿素浓度、丙二醛产生量、根长、株高、含水率等体现植物受损的指标, 进一步讨论纳米银和镉共存条件下对生菜的联合毒性以及对食品安全的影响。
1 材料与方法 1.1 仪器与材料仪器:电感耦合等离子体质谱仪(ICP-MS, X seriesⅡ, 美国Thermo Fisher公司)、可见分光光度计(UV-1800, 上海美普达仪器有限公司)、冷冻离心机(MIKRO 200R, Germany Hettich)、恒温光照培养箱(LRH-250-G韶关市泰宏医疗器械有限公司)、微波消解仪(ETHOS 1, 意大利Milestone公司)、玻璃匀浆器(2 mL, 乐倍实验器材有限公司)等。
试剂:纳米银(粒径20 nm, 购自北京凤翔科技有限公司); 银标准溶液、镉标准溶液(GSB04-1712-2004和GSB04-1721-2004, 购自国家标准物质中心), BV-Ⅲ级浓硝酸(69.9% m/m), 其他药品均为分析纯。丙二醛(MDA)试剂盒购于南京建成生物工程研究所。
Hoagland培养液[14]由如下配方组成: KNO3 1.5 mmol, Ca (NO3)2·4H2O 1.0 mmol, NH4H2PO4·7H2O 0.5 mmol, MgSO4·7H2O 0.5 mmol, Fe-EDTA 0.044 mmol, MnCl2·4H2O 0.009 mmol, H3BO3 0.046 mmol, ZnSO4·7H2O 0.0008 mmol, CuSO4·5H2O 0.0003 mmol, H2MoO4·H2O 0.0001 mmol, 用0.01 mol/L NaOH溶液和0.01 mol/L HNO3溶液调节pH至5.8。
生菜(Lactuca sativa)种子购自广东省农业科学院。生菜种子在10% (m/m)过氧化氢溶液中消毒10分钟, 然后用Milli-Q超纯水洗净。在150 mm×25 mm培养皿中放入一层滤纸, 灭菌后将消毒好的生菜种子放在滤纸上, 放入培养皿中, 置于25 ℃恒温光照培养箱, 黑暗中催芽48小时。种子出芽后, 将其播于搪瓷托盘里进行砂基培养, 托盘预先用超纯水洗净并装有分析纯石英砂。根据生长状况, 每天适时适量向砂基中喷淋Hoagland营养液, 温度调到23 ℃, 每天光照16小时。
1.2 暴露实验生菜幼苗沙基培养14天后, 长出第5片叶子。将42个500 mL烧杯用10%的浓硝酸浸泡24小时, 然后用自来水和超纯水洗净, 加入500 mL Hoagland营养液。在烧杯杯口罩一层纱布, 纱布上打孔, 起植株固定作用, 小心地将在砂基中培养的幼苗连根取出, 清洗根部后移植于烧杯中, 每杯3株, 此后适时向烧杯中补充植物营养液。水培7天后开始暴露实验。将烧杯分为两组, 向其中的21个烧杯加入镉标准溶液, 使得镉浓度为50 μg/L, 其余21个烧杯未添加镉。两组分别设置3个烧杯作为不加银离子/纳米银的空白对照, 其余分别加入0.1, 1和10 μg/L的硝酸银或10, 100和1000 μg/L的纳米银颗粒, 每个浓度的银离子或纳米银设置3个平行样, 共9株生菜(n=9)。所有烧杯在35 kHz频率下超声1小时, 每20分钟取出搅拌使之均匀分散。根据De La Torre-Roche等[15]的研究结果, 纳米银溶解少于1%, 因此每组纳米银均设置浓度为其1%的银离子组作为对照, 以表征由纳米银溶出的银离子的影响。
1.3 指标测试方法暴露35天后, 将生菜取出, 用超纯水冲洗干净, 迅速测量每株的株高与根长, 分成叶子和根两部分, 分别称量鲜重。准确称量0.200 g叶子用于叶绿素含量测定, 准确称量0.500 g叶子用于丙二醛含量测定, 其余部分在干净的铝箔上100 ℃烘箱烘干72小时。称量干重后装入塑封袋待测。
叶绿素含量测定:称取0.200 g左右叶片(记录准确值), 避开叶脉, 剪成2 mm左右碎条, 加入25 mL 1:1的丙酮+无水乙醇, 放在暗处萃取, 16小时后定容摇匀, 尽快在可见光分光光度计上测645 nm和663nm下的吸光度。
丙二醛测定:称取剪碎的生菜叶片0.500 g于预冷的2 mL匀浆器中, 加入1 mL预冷的pH为7.8的磷酸缓冲溶液, 冰浴匀浆8分钟, 之后用1 mL磷酸缓冲液分4次洗入2.5 mL塑料离心管中, 在4 ℃, 4000 r/min下离心10分钟, 上清液转移至10 mL塑料管中, 4 ℃下冷藏备用。之后按MDA试剂盒说明操作并用比色法测定。
镉金属含量测定:将烘干后的生菜叶子或根样品加入3 mL超纯水、1 mL优级纯过氧化氢(30% m/m)和5 mL优级纯浓硝酸, 200 ℃下消解30分钟, 在通风橱中250 ℃电热板上赶酸后用1% BV-Ⅲ硝酸定容到10 mL, 过0.45 μm滤膜后用ICP-MS测定样品中的镉。该方法的镉检出限为24.3 ng/g。
组间数据使用SPSS 11.5统计软件和单因素方差分析法(one-way ANOVA, Tukey检验法)进行差异显著性分析。
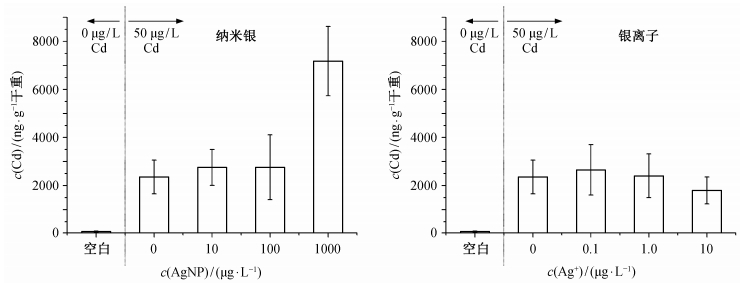
2 结果与讨论 2.1 纳米银对生菜中镉含量的影响生菜暴露于镉和纳米银或银离子35天后, 叶子中镉含量如图 1所示, 根部镉含量如图 2所示, 其中空白对照样品用于反映生菜培养过程中引入的镉吸收背景值。3个浓度的纳米银均使生菜根中镉含量上升, 其中1000 μg/L纳米银使生菜根部镉含量上升至超过7000 ng/g干重, 幅度约为200%, 非常显著地高于其他各组(p < 0.001)。其他两个浓度的纳米银引起的变化不显著。银离子对生菜根部镉浓度影响不显著。纳米银及银离子在各浓度下引起的镉含量在叶子中的变化均不显著, 但从镉含量平均值上看, 生菜叶子中的镉离子浓度有不同程度的下降, 幅度从接近0到约40%不等。总的来说, 纳米银的存在引起生菜根部镉浓度的上升, 且在1000 μg/L浓度水平上非常显著。纳米银也造成生菜叶子中的镉浓度略有下降, 但统计学上不显著。银离子没有引起生菜中镉浓度的显著变化。
|
| 图 1. 银对生菜根部镉含量的影响(n=9) Figure 1. Effect of silver on the cadmium content in lettuce roots (n=9) |
|
| 图 2. 银对生菜叶子镉含量的影响(n=9) Figure 2. Effect of silver on the cadmium content in lettuce leaves (n=9) |
2.2 纳米银和镉对生菜生物量及含水率的影响
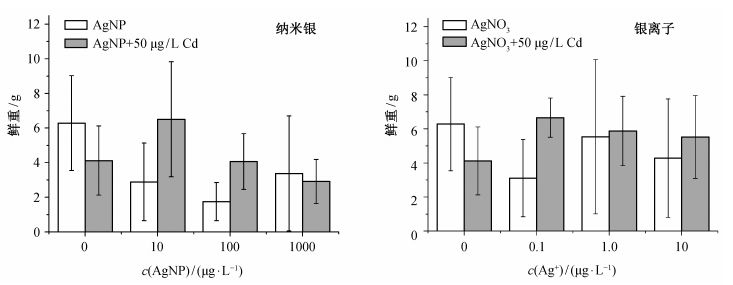
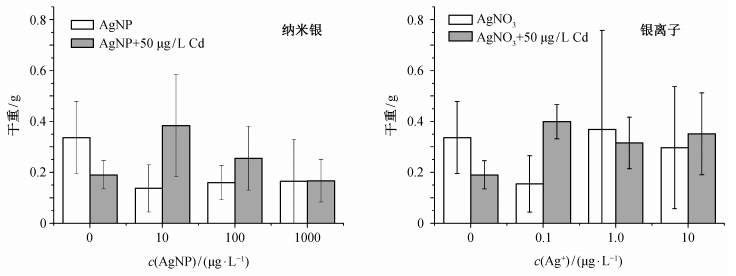
图 3和4分别是纳米银/银离子和镉单独存在或共存时对生菜鲜重和干重的影响。可以看出, 50 μg/L镉单独存在时, 生菜鲜重和干重均有一定程度的减少。纳米银单独存在时, 生物量比空白对照也有所减少; 银离子单独存在时, 除1 μg/L浓度下的生菜干重外, 生物量也有所减少。但是, 纳米银或银离子与镉同时存在时, 生物量减少的幅度比这些金属单独存在时小, 纳米银/银离子与镉在对生菜生物量的影响方面可能存在拮抗作用, 但统计学上不显著。Larue等[12]在生菜叶面施加纳米银与银离子, 同样观测到了生物量的减少, 统计学上同样不显著。
|
| 图 3. 银与镉对生菜鲜重的影响(n=9) Figure 3. Effect of silver and cadmium on the wet weight of lettuce (n=9) |
|
| 图 4. 银与镉对生菜干重的影响(n=9) Figure 4. Effect of silver and cadmium on the dry weight of lettuce (n=9) |
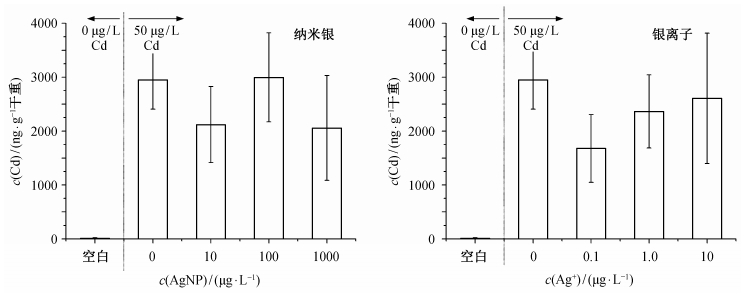
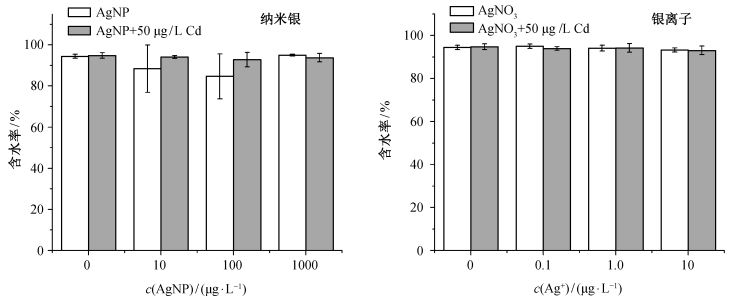
一般而言, 重金属胁迫会干扰植物的水分代谢, 造成植物含水率的降低。图 5给出各组银和镉暴露条件下生菜的含水率。在纳米银、银离子或镉单独存在的情况下, 只有100 μg/L纳米银引起生菜含水率的显著降低(p < 0.05), 其他各浓度的镉、纳米银和银离子对生菜含水率均没有显著影响。10 μg/L纳米银组含水率也略有降低, 但不具有统计学上的显著性。当纳米银/银离子与镉共存时, 生菜含水率与空白对照均没有显著差异。从100 μg/L纳米银组来看, 纳米银和镉对生菜含水率的影响也可能存在拮抗关系。总体上, 本实验浓度下的银和镉基本上没有引起含水率的显著变化。
|
| 图 5. 银与镉对生菜含水率的影响(n=9) Figure 5. Effect of silver and cadmium on the water content of lettuce (n=9) |
2.3 纳米银和镉对生菜叶绿素含量的影响
叶绿素是评价植物光合作用效率的重要指标[16]。植物在受重金属胁迫的情况下, 叶绿素可能被破坏, 但低浓度重金属反而会促进叶绿素产生。徐劼等[17]在5 mg/L的镉浓度下观察到生菜叶绿素含量的上升。本实验生菜暴露于银与镉后叶绿素含量变化如图 6所示。与空白对照组相比, 50 μg/L镉单独存在时, 叶绿素含量上升约75%;纳米银单独存在时, 叶绿素含量也有不同程度的上升, 从10%到109%, 纳米银与镉同时存在时, 叶绿素含量随加入纳米银浓度的升高而升高, 在100和1000 μg/L纳米银浓度下, 均高于纳米银或镉离子单独存在时的含量。与空白对照组相比, 单独存在的银离子也使叶绿素含量上升, 但略低于镉离子单独存在时的含量, 在银离子体系中再加入镉离子对叶绿素含量影响不大。但是, 这些趋势统计学上不显著。这一结果可能是由于本实验采用的纳米银和镉浓度接近实际环境浓度水平。Falco等[16]研究了纳米银对大豆叶绿素的影响, 纳米银浓度在0~1 mg/L及1~20 mg/L两个浓度范围均使叶绿素呈线性下降。本实验得到不同结论, 可能由于纳米银浓度较低, 且镉的存在刺激了叶绿素的产生, 大豆与生菜的种间差异也可能有一定影响。
|
| 图 6. 银与镉对生菜叶绿素含量的影响(n=3) Figure 6. Effect of silver and cadmium on the chlorophyll content of lettuce (n=3) |
2.4 纳米银和镉对生菜丙二醛含量的影响
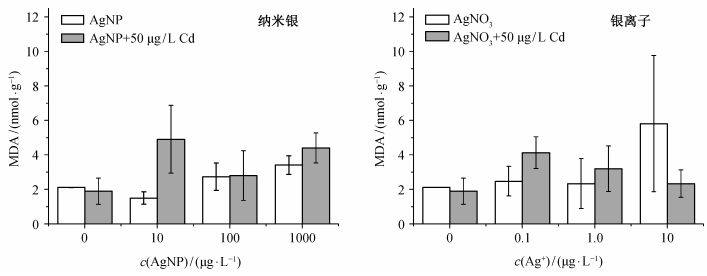
生物体内的氧自由基会攻击生物膜上的不饱和脂肪酸, 引起脂质过氧化, 丙二醛是脂质过氧化产物之一, 可以反映细胞受自由基损伤的程度, 常用于衡量重金属的毒性。本实验中生菜暴露于银与镉后丙二醛的含量变化如图 7所示。与空白对照组相比, 50 μg/L镉单独存在时, 丙二醛含量下降约10%;纳米银单独存在时, 在10 μg/L浓度下使丙二醛含量下降29%, 在100和1000 μg/L浓度下使丙二醛含量升高29%和61%, 与镉共存时丙二醛含量进一步提高。银离子单独存在以及与镉共存时, 丙二醛都有所上升。但是, 以上结果统计学上均不显著, 表明生菜在接近实际浓度的纳米银和镉暴露下, 受到一定的过氧化损伤, 但不显著。De La Torre-Roche等[15]测定了纳米银和1, 1-双(对氯苯基)-2, 2-二氯乙烯(DDE, 滴滴涕主要降解产物)共同暴露条件下西葫芦和大豆的丙二醛含量。在500和2000 mg/L的高浓度纳米银下, 大豆根部的丙二醛含量无显著变化, 但地上部分丙二醛含量显著上升; 西葫芦根部和叶子的丙二醛含量均无显著变化。本实验中纳米银浓度远低于De La Torre-Roche等[15]采用的浓度, 接近农业生产中实际的环境浓度, 丙二醛含量变化不显著属正常现象。

|
| 图 7. 银与镉对生菜丙二醛含量的影响(n=3) Figure 7. Effect of silver and cadmium on the malondialdehyde content of lettuce (n=3) |
2.5 纳米银和镉对生菜联合影响的环境意义
综上所述, 1000 μg/L纳米银引起生菜根部镉含量非常显著的上升(p < 0.001), 而生菜叶子中的镉含量受纳米银或银离子的影响不显著。由于生菜根非食用部位, 因此纳米银的添加对食品安全无明显的直接危害。单独存在的100 μg/L纳米银使生菜含水率显著降低, 但银和镉的存在对生菜的生物量以及叶绿素和丙二醛含量基本上没有造成统计学上显著的影响, 这与Larue等[12]的研究结论基本上一致。他们发现在农业实际应用的环境浓度下, 纳米银对生菜不造成显著的生理毒性。
目前关于纳米材料对植物吸收其他污染物影响方面的研究相当有限。De La Torre-Roche等[15]考察了纳米银对西葫芦(Cucurbita pepo)和大豆(Glycine max)吸收DDE的影响。纳米银在西葫芦和大豆的茎叶中都引起DDE含量的显著下降, 在西葫芦的根中引起DDE含量的显著上升, 这与本文图 1和2展现的趋势类似, 但文献[15]中的结论具有统计学意义。
纳米材料对植物吸收其他污染物的影响以及纳米材料与植物的相互作用, 仍然是一个新兴的研究方向。De La Torre-Roche等[15]认为, 关于纳米银对西葫芦和大豆造成的生理影响以及对DDE在两种植物体内积累的影响, 其背后的机理尚不明确。纳米银对植物造成的影响是多方面的, 包括植物种子的萌发、苗期的生理生化过程和细胞结构等营养生长, 以及植物的开花、结实等生殖过程[18], 还有DNA的稳定性[19]。纳米银在小麦(Triticum aestivumL.)[19]和黑麦草(Lolium multiflorum)[20]的茎与叶中都能检出, 既可能是纳米银颗粒直接进入, 也可能是银离子在植物体内直接合成纳米银, 因为在只暴露于银离子的植物体内也检出纳米银颗粒。本实验使用的纳米银颗粒直径为20 nm, 与植物细胞壁孔尺寸接近, 甚至可以通过胞间连丝被运输[18]。Larue等[12]在生菜叶面上直接施用纳米银, 在叶面表面及薄壁组织中检出银的多种形态, 包括纳米银单质、与谷胱甘肽结合的银离子、氧化银(Ⅰ和Ⅱ)、硫化银、碳酸银、磷酸银、氯化银以及溶解态的银离子等。即使在同一组织的不同部位, 各种形态的比例也有很大差别。目前研究表明, 纳米银可对植物产生多种生理影响, 在植物体内也有许多不同形态及变化, 但尚不足以明确纳米银以及共存的其他污染物对植物影响的机理。纳米银对植物多种多样的生态影响中, 有相当一部分是在高浓度纳米银条件下观察得到的, 在环境浓度下是否仍有影响尚待证实。
本实验采用的纳米银浓度为10, 100和1000 μg/L, 这一浓度梯度是为了更接近农田的实际情况。采用的镉浓度为50 μg/L, 在不加银的对照组生菜中造成的镉积累量为0.16 mg/kg (鲜重), 接近文献中2012年在广东市场0.0766 mg/kg (鲜重)的采样结果[10]。Gottschalk等[21]通过模型预测进入农田的纳米银每年大概为20 ng/kg土壤, 高暴露情景为100 ng/kg土壤。Kim等[6]使用纳米银作为抗真菌剂, 用量为每年5.4 μg/kg土壤, 是已知文献报道中最高的实际用量。由于本实验使用的生菜叶子为可食用部分, 且暴露时间超过一个月, 与实际情况接近, 从风险评估角度看不需要过高的安全系数, 因此以接近Kim等[6]的浓度为最低浓度。实际情况下的纳米银用量并不是无上限的, 农田使用的有机合成的抗真菌剂用量大概在每年37.8~2160 μg/kg土壤[22]。纳米银用量如果超过相应的有机合成的抗真菌剂, 在成本和效益上都没有优势, 因此可以粗略地认为纳米银作为抗真菌剂使用时, 植物在农田中可能的暴露量上限大概在每年1000 μg/kg土壤这一数量级。De La Torre-Roche等[15]的实验中纳米银的暴露量达到500 mg/L和2000 mg/L, 远远超过实际水平, 因此可以在植物中观察到比本实验的低浓度情景更显著的变化。
3 结论纳米银在1000 μg/L的最高浓度组引起生菜根部镉含量的显著上升, 而其他浓度下, 无论是生菜叶子或根部镉含量变化都不显著。纳米银和镉单独存在和共存的条件下, 对生菜生物量和含水率均未造成显著影响, 生菜中的叶绿素和丙二醛含量也没有统计学上显著的变化, 纳米银的影响不完全是由溶解的银离子造成的。在农业生产实际应用的浓度水平下, 纳米银与镉对生菜没有造成明显的食品安全风险。尽管纳米银在生菜内部的分布及存在形态在文献中已有报道, 但纳米银对植物的生理影响十分复杂, 与重金属镉相互作用的关键机理仍有待进一步研究。
| [1] | Project on Emerging Nanotechnologies. Consumer products inventory[EB/OL]. (2013-10-31) [2015-05-08]. http://www.nanotechproject.org/cpi/about/analysis/ |
| [2] | Gogos A, Knauer K, Bucheli T D. Nanomaterials in plant protection and fertilization: current state, foreseen applications, and research priorities. Journal of Agricultural and Food Chemistry, 2012, 60(39): 9781–9792 DOI:10.1021/jf302154y . |
| [3] | Jo Y K, Kim B H, Jung G. Antifungal activity of silver ions and nanoparticles on phytopathogenic Fungi. Plant Disease, 2009, 93(10): 1037–1043 DOI:10.1094/PDIS-93-10-1037 . |
| [4] | Lamsal K, Kim S W, Jung J H, et al. Inhibition effects of silver nanoparticles against powdery mildews on cucumber and pumpkin. Mycobiology, 2011, 39(1): 26–32 DOI:10.4489/MYCO.2011.39.1.026 . |
| [5] | Lamsal K, Kim S W, Jung J H, et al. Application of silver nanoparticles for the control of Colletotrichum species in vitro and Pepper Anthracnose disease in field. Mycobiology, 2011, 39(3): 194–199 DOI:10.5941/MYCO.2011.39.3.194 . |
| [6] | Kim H, Kang H, Chu G, et al. Antifungal effectiveness of nanosilver colloid against rose powdery mildew in greenhouses. Solid State Pheno-mena, 2008, 135: 15–18 DOI:10.4028/www.scientific.net/SSP.135 . |
| [7] | Li S, Shen Y, Xie A, et al. Green synthesis of silver nanoparticles using Capsicum annuum L extract. Green Chemistry, 2007, 9(8): 852–858 DOI:10.1039/b615357g . |
| [8] | Ahmad N, Sharma S. Green synthesis of silver nanoparticles using extracts of Ananas comosus. Green and Sustainable Chemistry, 2012, 2(4): 141–147 DOI:10.4236/gsc.2012.24020 . |
| [9] | US EPA. Cadmium compounds hazard summary [EB/OL]. (2013-10-19) [2015-05-08]. http://www.epa.gov/ttn/atw/hlthef/cadmium.html |
| [10] | 王旭.广东省蔬菜重金属风险评估研究[D].武汉:华中农业大学, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10504-1012458218.htm |
| [11] | US EPA. Ecological effects test guidelines OCSPP 850.4800: plant uptake and translocation test EPA 712-C-002 [EB/OL]. (2012-01-01) [2015-05-08]. http://www.epa.gov |
| [12] | Larue C, Castillo-Michel H, Sobanska S, et al. Foliar exposure of the crop Lactuca sativa to silver nanoparticles: evidence for internalization and changes in Ag speciation. Journal of Hazardous Materials, 2014, 264: 98–106 DOI:10.1016/j.jhazmat.2013.10.053 . |
| [13] | Jackson A P, Alloway B J. The bioavailability of cadmium to lettuce and cabbage in soils previously treated with sewage sludges. Plant and Soil, 1991, 132(2): 179–186 DOI:10.1007/BF00010398 . |
| [14] | Hoagland D R, Arnon D I. The water-culture method for growing plants without soil. California Agricul-tural Experiment Station Circular, 1950, 347(2): 2–32 . |
| [15] | De La Torre-Roche R, Hawthorne J, Musante C, et al. Impact of Ag nanoparticle exposure on p, p′-DDE bioaccumulation by Cucurbita pepo (Zucchini) and Glycine max (Soybean). Environmental Science & Technology, 2013, 47(2): 718–725 . |
| [16] | Falco W F, Queiroz A M, Fernandes J, et al. Interaction between chlorophyll and silver nanopar-ticles: a close analysis of chlorophyll fluorescence quenching. Journal of Photochemistry and Photobi-ology A: Chemistry, 2015, 299: 203–209 DOI:10.1016/j.jphotochem.2014.12.001 . |
| [17] | 徐劼, 胡博华, 戈涛, 等. 镉胁迫对生菜种子萌发及幼苗生理特性的影响. 湖北农业科学, 2014, 53(20): 4892–4896. |
| [18] | 彭小凤, 朱敏, 任洁, 等. 纳米银的植物毒性研究进展. 生态毒理学报, 2014, 9(2): 199–204. |
| [19] | Dimpka C O, McLean J E, Martineau N, et al. Silver nanoparticles disrupt wheat (Triticum aestivum L.) growth in a sand matrix. Environmental Science & Technology, 2013, 47(2): 1082–1090 . |
| [20] | Yin L, Cheng Y, Espinasse B, et al. More than ions: the effects of silver nanoparticles on Lolium multiflorum. Environmental Science & Technology, 2011, 45(6): 2360–2367 . |
| [21] | Gottschalk F, Sonderer T, Scholz R W, et al. Modeled environmental concentrations of engineered nanoma-terials (TiO2, ZnO, Ag, CNT, fullerenes) for different regions. Environmental Science & Technology, 2009, 43(24): 9216–9222 . |
| [22] | The Government of British Columbia, Canada. Grape diseases [EB/OL]. (2012-01-16) [2015-05-08]. http://www.agf.gov.bc.ca/cropprot/grapeipm/mildew.htm |
 2016, Vol. 52
2016, Vol. 52