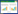文章信息
- 曾亚琼, 王斌伟, 李杰, 许楠
- ZENG Yaqiong, WANG Binwei, LI Jie, XU Nan
- 生物电Fenton氧化法去除水体中雌二醇的研究
- Removal of 17β-estradiol in a Bio-electro-Fenton System
- 北京大学学报(自然科学版), 2016, 52(5): 939-948
- Acta Scientiarum Naturalium Universitatis Pekinensis, 2016, 52(5): 939-948
-
文章历史
- 收稿日期: 2015-04-28
- 修回日期: 2015-05-11
- 网络出版日期: 2016-09-01
环境雌激素(environmental estrogens)是内分泌干扰效应最强的一类物质, 进入机体后干扰机体内内分泌物质的合成、释放、运转、代谢、结合等过程, 激活或抑制内分泌系统的功能, 或者通过改变神经[1]、免疫[2]和内分泌系统的正常调控功能, 从而破坏机体的稳定性和调控功能[3]。环境中的雌激素主要来源于人和动物新陈代谢产生的排泄物(如尿液和粪便), 排泄物随废水经过污水处理厂处理后, 未被降解的雌激素进入自然水体中。雌二醇(17β-estradiol, E2)作为动物和人体分泌的雌激素之一, 因其较强的雌激素活性而备受关注[4-6]。
Logan等[7]以市政和工业废水为底物, 用厌氧污泥接种, 构建新型的生物电化学系统--微生物燃料电池, 实现同步处理废水和生物发电。生物电化学系统不仅可以用于低成本降解高浓度生物可降解有机物(如生活污水[8]、动物养殖废水[9]等), 还可以利用阴极还原反应还原某些金属(如Cu[10]和Ag[11]等)。生物电Fenton是利用生物电化学系统O2在阴极接收阳极产生的电子生成H2O2, 与外加的Fe2+构成Fenton试剂, 是生物电化学与电Fenton系统的结合体。这一体系将生物电化学系统产生的电能应用于电Fenton系统中, 改善了电Fenton需要输入大量外电压的缺点。
Feng等[12]用PPy/AQDS导电膜修饰MFC电极, 加入γ-FeOOH, 在中性条件下降解偶氮染料。Zhuang等[13]提出用Fe@Fe2O3/carbon felt (CF)复合材料作为阴极, 其中Fe@Fe2O3可作为Fenton铁试剂, 氧气在碳毡(carbon felt)表面得到电子, 产生H2O2, 在该系统中, 12小时后RhB的降解率达95%, TOC去除率达90%。
目前, 利用生物电Fenton氧化法去除水体中常规难降解有机废水的研究较多[12-14], 而采用生物电Fenton氧化去除痕量有机污染物的研究较少。本文利用以Fe@Fe2O3/NCF为阴极的生物电Fenton (BEF)系统去除痕量E2, 研究吸附作用和化学氧化作用对E2去除的贡献, 并对该BEF系统去除E2的影响因素进行优化, 为开发含痕量雌激素的污水处理厂出水的深度处理技术提供实验依据。
1 材料和方法 1.1 实验试剂实验中使用的E2标准品和内标物(E2-d2)(纯度99%以上)、所有有机试剂(甲醇、正己烷, HPLC级)以及衍生化试剂(含1%三甲基氯硅烷(trimethyl-chlorosilane, TMCS)的N, O-双(三甲基硅烷基)乙酰胺(N, O-Bis (trimethylsiyl) acetamide, BSTFA)全部购自美国Sigma-Aldrich公司。其他化学试剂为分析纯, 购自天津大茂化学品有限公司。
以甲醇为溶剂, 分别配制0.4 mg/mL的E2储备液和2 ng/μL的内标液, 并保存在-20°C冰箱中备用。实验中所有水溶液均使用超纯水(18 MΩ, Millipore, USA)配制。
1.2 电极的制作电极制作方法参考文献[13]。
无催化碳毡电极(NCF)的制作:将两片用钛丝连接的碳毡(4.5 cm×3.5 cm×0.3 cm)电极置于4 mol/L的HCl溶液中, 浸泡24小时后, 取出清洗。将上述过程重复4次, 以去除碳毡表面的杂质。
Fe@Fe2O3/NCF复合电极制作:为考察电极铁含量对BEF系统去除效率的影响, 制作了具有不同铁含量的Fe@Fe2O3/NCF复合电极, 见表 1。以Fe@Fe2O3/NCF-D电极为例, 称取0.2703 g FeCl3·6H2O和2.25 g NaBH4, 分别溶于500 mL和200 mL的去离子水中, 取100 mL Fe3+溶液, 逐滴加入40 mL NaBH4溶液, 使Fe还原并吸附在碳毡电极上, 制得Fe@Fe2O3/NCF-D。
| 阴极 | m(FeCl3•6H2O)/g | m(NaBH4)/g | 电极含铁量/mg |
| Fe@Fe2O3/NCF-A | 0.0154 | 0.0308 | 0.73±0.012 |
| Fe@Fe2O3/NCF-B | 0.0332 | 0.0664 | 1.54±0.056 |
| Fe@Fe2O3/NCF-C | 0.0676 | 0.1352 | 2.44±0.025 |
| Fe@Fe2O3/NCF-D | 0.2703 | 2.2500 | 5.15±0.042 |
1.3 生物电Fenton系统的构建与运行
本实验中用聚甲基丙烯酸甲酯有机玻璃制成双室生物电化学系统反应器, 阳极室和阴极室的体积均为75 mL (5.5 cm×5.5 cm×3.0 cm), 两室之间用质子交换膜(3.0 cm×3.0 cm)分离。阳极电极为石墨碳毡(4.5 cm×4.5 cm×0.3 cm)。两片由钛丝串连的Fe@Fe2O3/NCF复合电极作为阴极。阳极室以厌氧污泥(深圳红树林滩涂底泥)为接种物, 葡萄糖为碳源, 阳极培养液组成为: CH3COONa (1.0 g/L), NH4Cl (0.31 g/L), NaH2PO4·12H2O (6.63 g/L), Na2HPO4·2H2O (3.67 g/L)和KCl (0.13 g/L)。阴极液为含有120 μg/L E2的0.1 mol/L NaCl溶液, 并用1.0 mol/L HCl调节溶液的pH保持在3.0左右[15]。持续用流速为100 mL/min的气泵曝气, 以使阴极内氧气充足。实验中, 每隔一段时间从阴极室取出1 mL样品, 并用气相色谱-质谱联用仪(GC/MS)测定E2浓度。每组实验均在30°C下进行, 并设定3个平行样。实验结束后, 为测定阴极上E2的吸附量, 将阴极取出, 冷冻干燥24小时, 再将干燥后的电极用50 mL二氯甲烷超声萃取30分钟, 最后取1 mL样品前处理, GC-MS检测。
1.4 产电性能分析当输出电压达到周期稳定最大值时, 通过稳态放电实验测定极化曲线。利用直流变阻箱将外电阻从99999 Ω逐渐降低, 直至5 Ω, 再增加至99999 Ω, 每个电阻重复测两次, 记录每个稳定的电压值。由计算出的电流得到相应的面积功率密度。功率密度最大时, 即电池内阻与外接电阻相等时, 可得到电池内阻。
1.5 化学分析 1.5.1 溶液中过氧化氢与总Fe浓度的检测采用碘量法测定溶液中过氧化氢的浓度[16], 邻菲罗啉分光光度法测定溶液中的总铁浓度。
1.5.2 样品中E2的检测分离检测水样中E2前, 需对水样进行液液萃取、氮吹、衍生化的前处理操作。首先在每个样品(1 mL)中加入40 μL 2 ng/μL的E2-d2内标液并摇匀, 用3 mL的正己烷萃取两次, 在40°C下用缓和的氮气流将萃取液中溶剂吹干, 向吹干后的残留物中加入50 μL的衍生剂(BSTFA +1% TMCS)和50 μL的吡啶溶液, 用封口膜密封, 放置于70°C的水浴中衍生化反应1小时, 待混合溶液冷却至室温, 转移至GC进样瓶中, 等待GC-MS检测。
采用GC-MS (Agilent GC 7890A/MS 5975C)对E2进行分离和检测。气相色谱柱选用DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm), 载气为氦气, 流速设定为1 mL/min。采用梯度升温程序:初始温度为100°C, 在此温度下停留1 min; 然后以25°C/ min的速率升温至200°C, 不停留; 再以20°C/min的速率升温至260°C, 不停留; 最后以5°C/min的速度升温至300°C, 停留1 min, 总运行时间为17 min。进样口、离子源和传输线温度分别设定为280°C, 280°C和250°C。在不分流模式(splitless)下运行, 进样体积为1.0 μL。MS以E I源为电离源, 电子轰击能量为70 eV。在选择离子检测模式(SIM)下进行定量。该方法检测E2的回收率和检出限分别为(89.4±2.5)%和0.6 ng/L。
2 结果与讨论 2.1 生物电Fenton系统的产电性能图 1是以NCF和Fe@Fe2O3/NCF为阴极电极材料的BEF系统的功率密度曲线和极化曲线。以NCF为阴极的BEF系统的开路电压和最高功率密度可以达到0.66 V和2.99 W/m3, 以Fe@Fe2O3/ NCF为阴极的BEF系统的开路电压和最高功率密度可以达到0.83 V和4.35 W/m3。由功率密度曲线最高点所对应的外电路电阻阻值与反应器表观内阻阻值相等[12]可知, 与NCF阴极BEF系统和Fe@Fe2O3/NCF阴极BEF系统最高功率密度相应的反应器表观内阻阻值(即外电路电阻阻值)分别为250 Ω和150 Ω。这表明, 在系统内加入铁后, BEF系统内阻阻值降低, 功率密度增加。这是由于铁离子能与阴极液中H+反应并接收电子, 促进了阳极电子移动, 进而提高了功率密度。平滑的极化曲线和功率密度曲线表明该BEF系统的阳极微生物已经可以稳定产电, 并且能够适应较大的电流密度变化, 具有较好的产电能力。
|
| 图 1. 采用NCF或Fe@Fe2O3/NCF阴极的BEF系统极化曲线(a)和功率密度曲线(b) Figure 1. Polarization curve (a) and power density curve (b) of bio-electro-chemical system using NCF or Fe@Fe2O3/ NCF as cathodes |
2.2 生物电Fenton系统中E2的去除效果 2.2.1 吸附作用对E2去除效率的贡献
BEF系统反应器及质子交换膜材料均对有机物有一定吸附作用, 电极材料碳毡的多孔结构使其具有较大吸附容量, 并且, E2是一类疏水性化合物, 容易被吸附。因此, 为研究体系中各种吸附作用(反应器、质子交换膜、NCF阴极及Fe@Fe2O3/NCF阴极)对E2去除的贡献, 在开路条件下设计了4种反应器(如表 2所示), 考察阴极液中E2浓度随时间的变化。
| 反应器 | 阴极室 | 阳极室 | 阴极 |
| A | 100 mL阴极液 | 无 | - |
| B | 100 mL阴极液 | 100 mL去离子水 | - |
| C | 100 mL阴极液 | 100 mL去离子水 | NCF |
| D | 100 mL阴极液 | 100 mL去离子水 | Fe@Fe2O3/NCF-D |
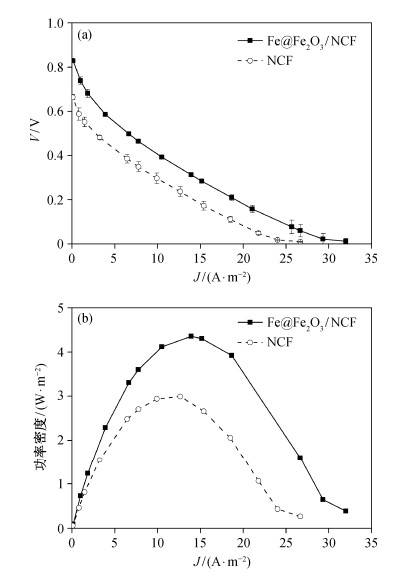
2小时后, 4种反应器内E2基本上达到吸附平衡。在6小时内, 反应器A中7.7%的E2被去除, 此部分E2的去除是由于聚甲基苯烯酸甲酯有机玻璃反应器的吸附作用; 反应器B中14.1%的E2被去除, 同时阳极室内未检测到E2, 表明质子交换膜对E2也有一定的吸附作用, 但未发生E2从阴极室向阳极室的迁移; 反应器C中由于NCF电极、反应器及膜表面的吸附作用, E2的去除率达到52.6%;反应器D中约有67.8%的E2被去除, 由于电极上附着的纳米尺度的Fe@Fe2O3颗粒具有一定的吸附能力[17], 因此Fe@Fe2O3/NCF电极对E2的吸附去除率高于NCF电极。图 2(a)给出开路条件下反应器D各部分吸附作用对E2去除的贡献率。
|
| 图 2. 开路条件下反应器D各部分吸附作用的贡献率(a)和闭路条件下各部分吸附及电化学氧化作用贡献率(b) Figure 2. Adsorption of E2 on different media of bioreactor D under open circuit condition (a) and Adsorption on different media and oxidation of E2 under closed circuit condition (b) |
2.2.2 电化学作用对E2去除效率的贡献
实验中, BEF系统是在闭路的条件下处理含有E2的废水, 系统中存在着吸附、解吸附及氧化的动态平衡。因此, 在外阻为1000 Ω, 闭路条件下运行上述反应器D, 6小时内, E2去除率为77.4%。为确定经过电化学作用后, 阴极上E2的吸附量, 反应结束后, 洗脱阴极, 测得有14.4%的E2残留在电极上, 远小于开路条件下Fe@Fe2O3/NCF-D电极上E2的吸附量(53.7%), 因此, 在该BEF系统中电化学氧化作用是E2的主要去除机制。图 2(b)给出闭路条件下反应器各部分吸附作用及氧化作用对E2去除的贡献率。
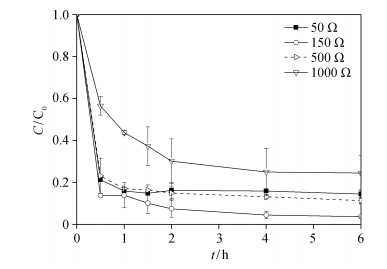
2.3 生物电Fenton系统的优化 2.3.1 外电阻对E2去除效率的影响外电阻能够改变阳极微生物群落结构及多样性, 影响微生物催化活性, 进而影响微生物燃料电池的电化学性能[18-19]。本研究以Fe@Fe2O3/NCF-D为阴极, 在闭路条件下, 研究4组不同外电阻阻值(1000, 500, 150和50 Ω)的BEF系统对E2 (C0=120 μg/L)去除效率的影响, 确定最佳外电阻负荷。
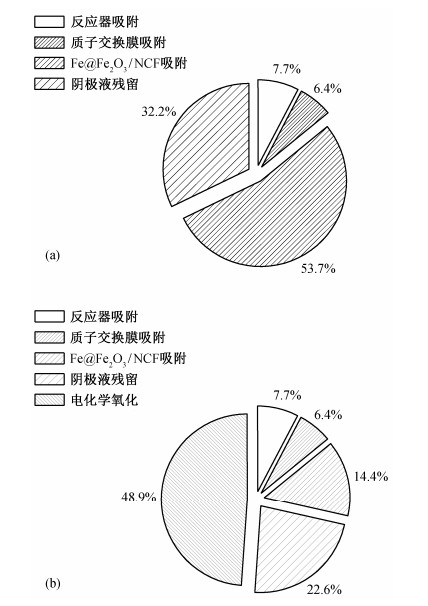
4种系统中, 雌激素E2浓度随时间的变化如图 3所示。当外电阻阻值为1000, 500, 150和50 Ω时, 6小时内E2的去除率分别达到77.4%, 88.6%, 96.4%和85.5%, 相应BEF系统的功率密度分别为2.41, 3.01, 4.35和3.47 W/m3。结果表明, 当外阻阻值接近内阻阻值, 即体系功率密度最大时, BEF系统的效率最高。这一结果与Fernando等[20]关于微生物燃料电池中外电阻对染料还原脱色的影响研究结果一致。这主要是由于当外阻阻值接近内阻阻值时, 提高了微生物燃料电池中的微生物多样性, 从而促进微生物产电。随着产电量的增加, 氧气在阴极得电子生成Fenton试剂H2O2的量随之增多, 进而E2去除率也随之增高。因此, 实验中将系统外电阻设定为150 Ω。
|
| 图 3. 闭路条件下不同外电阻负荷的BEF系统E2浓度随时间的变化 Figure 3. Variation of E2 concentration in BEF systems with different external resistance under losed circuit condition |
2.3.2 电极含铁量对E2去除效率的影响
Fe@Fe2O3/NCF阴极是该BEF系统中Fenton试剂Fe2+的来源, 因此, Fe@Fe2O3/NCF阴极中的铁含量可能对E2的去除有影响。实验中, 通过控制Fe@Fe2O3/NCF阴极制备原料FeCl3·6H2O和NaBH4的比例来调节阴极的含铁量。按表 1中的配比计量制成的电极分别命名为Fe@Fe2O3/NCF-A, Fe@Fe2O3/NCF-B, Fe@Fe2O3/NCF-C和Fe@Fe2O3/ NCF-D。
在外电阻阻值为150 Ω的闭路条件下, 分别运行上述4种反应器, 测定体系中总铁浓度、H2O2浓度及E2浓度。由图 4中溶液总铁浓度和H2O2浓度随时间的变化曲线可知, 阴极铁含量越高, 溶解在溶液中的铁离子浓度越高, 相应的H2O2浓度越低。这是由于溶液中除了Fe2+与H2O2发生Fenton反应外, 过量的Fe3+能与O2在阴极竞争获得电子, 同时Fe3+也会直接与H2O2反应[21], 从而使H2O2的产量减少。
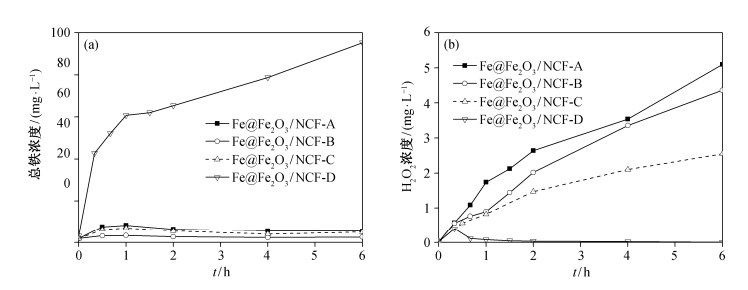
|
| 图 4. 闭路条件下不同Fe@Fe2O3/NCF阴极体系中, 总铁浓度(a)和H2O2浓度(b)随时间的变化 Figure 4. Concentrations of total irons (Fe2+ and Fe3+) (a) and H2O2 (b) versus time with cathodes containing different amount of iron under closed circuit condition |
不同阴极体系中E2去除率的变化曲线(图 5)表明, 6小时内, 所有体系中E2的去除率均可达到90%以上, 而前2小时内, E2去除率为Fe@Fe2O3/ NCF-A < Fe@Fe2O3/NCF-D < Fe@Fe2O3/NCF-C < Fe@Fe2O3/NCF-B。Nakrst等[22]的研究表明, 溶液中H2O2与总铁浓度的摩尔比越低, 越不易产生羟基自由基。Fe@Fe2O3/NCF-D系统中, 溶液中铁浓度过高, 以至于H2O2浓度很低, 不易产生羟基自由基, 但其Fe@Fe2O3纳米材料含量较多, 吸附作用较快, 因此, 前2小时内E2的去除速率相对较高。Fe@Fe2O3/NCF-A系统中H2O2与总铁浓度的摩尔比相对较高, 但铁离子浓度太低, 以致不能较快地生成羟基自由基。综合考察4种复合阴极, Fe@Fe2O3/NCF-B具有较合适的H2O2与总铁浓度的摩尔比, 并具有最高的E2去除率, 所以Fe@Fe2O3/ NCF-B是相对经济有效的阴极材料, 即为BEF系统的最佳阴极。
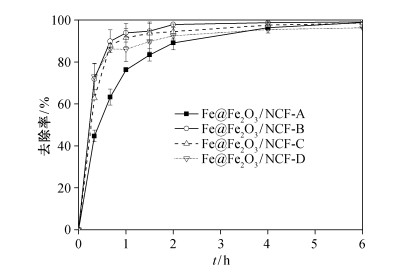
|
| 图 5. 闭路条件下, 不同电极含铁量的生物电Fenton系统中E2去除率随时间的变化 Figure 5. E2 removal rates in BEF with cathodes containing different amount of iron under closed circuit condition |
2.3.3 曝气量对E2去除效率的影响
O2在阴极获得电子原位产生Fenton试剂(H2O2), 因此阴极液溶解氧量对溶液中E2的去除也有一定影响。实验中通过调节曝气速率来控制溶解氧的量, 在外电阻阻值为150 Ω的闭路条件下, Fe@Fe2O3/NCF-B为阴极的BEF系统内, 研究0, 40, 60, 80和120 mL/min共5组不同曝气速率对120 μg/L的雌激素E2的降解效果, 确定最佳曝气速率。
图 6的结果表明, 在曝气速率为0 mL/min时, BEF系统对E2的去除率达到70%, 该部分的去除率主要归因于系统内Fe@Fe2O3/NCF阴极的吸附、反应器的吸附等多种作用的协同作用。曝气速率低于60 mL/min时, 随着曝气速率的提高, BEF系统对E2的去除性能也相应提高; 曝气速率高于60 mL/min时, 曝气速率对BEF系统去除E2的性能影响不大, 6小时内E2去除率均达到95%。综合能耗成本和E2去除效率两方面来考虑, 实验中将系统曝气速率设定为60 mL/min。
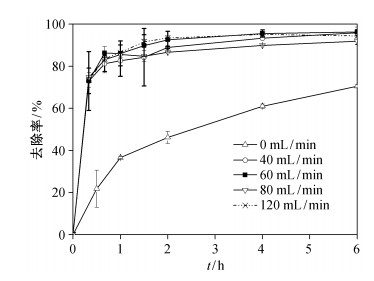
|
| 图 6. 闭路条件下, 不同曝气速率下雌激素E2去除率随时间的变化 Figure 6. Variation of E2 removal rates in BEF systems with different aeration rate under closed circuit condition |
2.3.4 pH对E2去除效率的影响
阴极液pH直接影响BEF系统中H2O2, Fe2+以及羟基自由基(· OH)的产生[21]。Sirés等[23]的研究表明, pH能够影响Fenton反应效率, 并指出Fenton反应的最佳pH值为2.8。本实验以Fe@Fe2O3/ NCF-B为阴极, 在外电阻阻值为150 Ω, 曝气速率为60 mL/min的闭路条件下, 设定pH分别为3, 5和7的阴极液(pH值的误差范围控制在±0.2), 研究不同pH值条件下E2的去除效果。
图 7的结果表明, 随着阴极电解质pH值的增大, 体系中的E2去除率略有下降, 但3种pH条件下均有95%以上的E2被去除。吸附实验结果表明, 开路条件下, Fe@Fe2O3/NCF阴极系统6小时内对E2的吸附量最多达到67.8%, 因此, pH较高时E2仍有较高的去除率。这不只因为存在反应体系的吸附作用, 还应存在一定的化学氧化作用。有研究表明, Fe@Fe2O3核壳纳米材料可在中性条件下用作Fenton系统的铁试剂, 纳米级的零价铁能够激活O2分子, 得到两个电子产生活性氧[21, 24-25]。Fe2O3表面吸附的Fe2+通过单电子转移, 活化O2分子形成超氧自由基[26-27]。因此, 可以推测, 在较高pH条件下, 该生物电Fenton系统可能会产生活性氧自由基, 进而氧化降解溶液中的E2, 使得应用该系统在中性条件下去除痕量E2成为可能, 进一步扩展了系统应用的pH范围。

|
| 图 7. 闭路条件下, BEF系统中E2去除效率随pH值的变化 Figure 7. Variation of E2 removal rates in BEF systems with different catholyte pH under closed circuit condition |
3 结论
1) 本研究分析了BEF体系应用于去除痕量有机微污染物E2可能存在的主要物理吸附作用(包括反应器、质子交换膜、电极), 其中以电极的静态吸附为主; 而将该系统用于闭合回路中时, 电化学氧化作用是去除E2的主要途径。
2) 对BEF系统条件进行优化, 以Fe@Fe2O3/ NCF为阴极, 在外电阻阻值为150 Ω, 曝气速率为60 mL/min, 阴极液pH为3的闭路条件下, 该系统对120 μg/L的E2的去除效果最好, 去除率达到99%。
3) 外电阻是影响体系中E2去除效率的主要因素。当内外电阻阻值相等、系统功率密度最大时, 改变其他任一影响因素(电极含铁量、曝气速率或pH值), E2的去除效率都超过90%。
| [1] | Hartz A M S, Mahringer A, Miller D S, Bauer B. 17-β-Estradiol:a powerful modulator of blood-brain barrier BCRP activity. Journal of Cerebral Blood Flow and Metabolism , 2010, 30 (10) : 1742–1755 DOI:10.1038/jcbfm.2010.36 . |
| [2] | Mostafa S, Seamon V, Azzarolo A M. Influence of sex hormones and genetic predisposition in Sjogren's syndrome:a new clue to the immunopathogenesis of dry eye disease. Experimental Eye Research , 2012, 96 (1) : 88–97 DOI:10.1016/j.exer.2011.12.016 . |
| [3] | Kavlock R J, Daston G P, et al. Research needs for risk assessment of health and environmental effects of endocrine disrupters:a report of the US EPA-spon-sored workshop. Environmental Health Perspect , 1996, 104 (4) : 715–740 . |
| [4] | Limpiyakorn T, Homklin S, Ong S K. Fate of estrogens and estrogenic potentials in sewerage systems. Critical Reviews in Environmental Science and Technology , 2011, 41 (13) : 1231–1270 DOI:10.1080/10643380903488680 . |
| [5] | Liu Z H, Kanjo Y, Mizutani S. Urinary excretion rates of natural estrogens and androgens from humans, and their occurrence and fate in the environment:a review. Science of the Total Environment , 2009, 407 (18) : 4975–4985 DOI:10.1016/j.scitotenv.2009.06.001 . |
| [6] | Lee J H, Zhou J L, Lee Y, et al. Changes in the sorption and rate of17β-estradiol biodegradation by dissolved organic matter collected from different water sources. Journal of Environmental Monitoring , 2012, 14 (2) : 543–551 DOI:10.1039/C1EM10690B . |
| [7] | Logan B E, Hamelers B, Rozendal R A, et al. Microbial fuel cells:methodology and technology. Environmental Science & Technology , 2006, 40 (17) : 5181–5192 . |
| [8] | Jiang J Q, Zhao Q L, Zhang J N, et al. Electricity generation from bio-treatment of sewage sludge with microbial fuel cell. Bioresource Technology , 2009, 100 (23) : 5808–5812 DOI:10.1016/j.biortech.2009.06.076 . |
| [9] | Zheng X, Nirmalakhandan N. Cattle wastes as substrates for bioelectricity production via microbial fuel cells. Biotechnology Letters , 2010, 32 (12) : 1809–1814 DOI:10.1007/s10529-010-0360-3 . |
| [10] | Tao H C, Li W, Liang M, et al. A membrane-free baffled microbial fuel cell for cathodic reduction of Cu (Ⅱ) with electricity generation. Bioresource Tech-nology , 2011, 102 (7) : 4774–4778 DOI:10.1016/j.biortech.2011.01.057 . |
| [11] | Tao H C, Gao Z Y, Ding H, et al. Recovery of silver from silver (Ⅰ)-containing solutions in bioelectroche-mical reactors. Bioresource Technology , 2012, 111 : 92–97 DOI:10.1016/j.biortech.2012.02.029 . |
| [12] | Feng C H, Li F B, Mai H J, et al. A dual-chamber microbial fuel cell with conductive film-modified anode and cathode and its application for the neutral electro-Fenton process. Electrochimica Acta , 2010, 55 (6) : 2048–2054 DOI:10.1016/j.electacta.2009.11.033 . |
| [13] | Zhuang L, Zhou S, Li Y, et al. In situ Fenton-enhanced cathodic reaction for sustainable increased electricity generation in microbial fuel cells. Journal of Power Sources , 2010, 195 (5) : 1379–1382 DOI:10.1016/j.jpowsour.2009.09.011 . |
| [14] | Zhu X P, Ni J R. Simultaneous processes of electricity generation and p-nitrophenol degradation in a microbial fuel cell. Electrochemistry Commu-nications , 2009, 11 (2) : 274–277 DOI:10.1016/j.elecom.2008.11.023 . |
| [15] | Zhao Y, Hu J Y. Photo-Fenton degradation of17β-estradiol in presence of α-FeOOHR and H2O2. Applied Catalysis B:Environmental , 2008, 78 (3/4) : 250–258 . |
| [16] | Klassen N V, Marchington D, McGowan H C. H2O2determination by the I3-method and by KMnO4titration. Analytical Chemistry , 1994, 66 (18) : 2921–2925 DOI:10.1021/ac00090a020 . |
| [17] | Wu H, Ai Z, Zhang L. Anoxic and oxic removal of humic acids with Fe@Fe2O3core-shell nanowires:a comparative study. Water Research , 2014, 52 (1) : 92–100 . |
| [18] | Lyon D Y, Buret F, Vogel TM, Monier J M. Is resistance futile?Changing external resistance does not improve microbial fuel cell performance. Bioelec-trochemistry , 2010, 78 (1) : 2–7 DOI:10.1016/j.bioelechem.2009.09.001 . |
| [19] | Ren Z, Yan H, Wang W, et al. Characterization of microbial fuel cells at microbially and electrochemi-cally meaningful time scales. Environmental Science & Technology , 2011, 45 (6) : 2435–2441 . |
| [20] | Fernando E, Keshavarz T, Kyazze G. External resistance as a potential tool for influencing azo dye reductive decolourisation kinetics in microbial fuel cells. International Biodeterioration & Biodegrada-tion , 2014, 89 : 7–14 . |
| [21] | Shi J, Ai Z, Zhang L. Fe@Fe2O3core-shell nanowires enhanced Fenton oxidation by accelerating the Fe (Ⅲ)/Fe (Ⅱ) cycles. Water Research , 2014, 59 (1) : 145–153 . |
| [22] | Nakrst J, Bistan M, Tišler T, et al. Comparison of Fenton's oxidation and ozonation for removal of estrogens. Water Science & Technology , 2011, 63 (10) : 2131–2137 . |
| [23] | Sirés I, Oturan N, Oturan M A, et al. Electro-Fenton degradation of antimicrobials triclosan and triclo-carban. Electrochimica Acta , 2007, 52 (17) : 5493–5503 DOI:10.1016/j.electacta.2007.03.011 . |
| [24] | Ai Z, Lu L, Li J, et al. Fe@Fe2O3core-shell nanowires as the iron reagent.2.An efficient and reusable sono-Fenton system working at neutral pH. Journal of Physical Chemistry C , 2007, 111 (20) : 7430–7436 DOI:10.1021/jp070412v . |
| [25] | Li J, Ai Z, Zhang L. Design of a neutral electro-Fenton system with Fe@Fe2O3/ACF composite catho-de for wastewater treatment. Journal of Hazard Mate-rial , 2009, 164 (1) : 18–25 DOI:10.1016/j.jhazmat.2008.07.109 . |
| [26] | Ai Z, Gao Z, Zhang L, et al. Core-shell structure dependent reactivity of Fe@Fe2O3nanowires on aerobic degradation of4-chlorophenol. Environmental Science & Technology , 2013, 47 (10) : 5344–5352 . |
| [27] | Pecher K, Haderlein S B, Schwarzenbach R P. Reduction of polyhalogenated methanes by surface-bound Fe (Ⅱ) in aqueous suspensions of iron oxides. Environmental Science & Technology , 2002, 36 (8) : 1734–1741 . |
 2016, Vol. 52
2016, Vol. 52