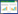文章信息
- 张楠, 熊富忠, 温东辉, 于聪, 李琪琳
- ZHANG Nan, XIONG Fuzhong, WEN Donghui, YU Cong, LI Qilin
- 环境因素对降解型生物膜形成的影响
- Effects of Environmental Factors on Degrading Bacterial Biofilm Formation
- 北京大学学报(自然科学版), 2016, 52(2): 345-353
- Acta Scientiarum Naturalium Universitatis Pekinensis, 2016, 52(2): 345-353
-
文章历史
- 收稿日期: 2014-12-14
- 修回日期: 2015-03-03
- 网络出版日期: 2016-03-16
2. College of Civil and Environmental Engineering, Rice University, Texas 77005
2. College of Civil and Environmental Engineering, Rice University, Texas 77005
吡啶和喹啉是典型的高毒性、难降解氮杂环芳烃化合物。吡啶可看做苯环中的-CH=被-NH=取代的化合物, 能与水互溶; 喹啉可看做杂环吡啶和纯碳苯环并连而成, 微溶于水, 具有碱性。吡啶和喹啉作为化工原料和溶剂, 广泛应用于医药合成、染料和农药等生产。因此, 吡啶和喹啉及其衍生物常见于工业废水中。吡啶具有强烈刺激性, 能麻醉中枢神经系统。喹啉具有致突变、致癌性, 对生态环境和人类健康产生危害, 其排放前的处理具有重要意义。生物强化是去除吡啶和喹啉的有效途径。目前已有多株高效降解菌被分离, 并形成复合菌剂, 如本实验室分离的吡啶降解菌Shinella zoogloeoides BC026[1]、Paracoccus sp. BW001[2]和喹啉降解菌Pseudomonas sp. BW003[3]、Pseudomonas sp. BW004[4], 对这些降解菌在悬浮态生长条件下的降解特性已有较充分的研究。
在实际水环境中, 与悬浮态相比, 生物膜群落是大多数细菌既定的生长模式[5]。结构有序、功能分化的生物膜群落能够为其内部生长并繁殖的细胞提供保护, 为细菌提供抵御外部环境(包括噬菌体、抗生素、毒素、免疫活性物质等)冲击的“居所”[6-8]。因此, 探究水处理过程中降解菌生物膜形成的影响因素, 对保持降解菌的生物活性及保证系统处理效率具有重要意义。
生物膜的形成是一个极为复杂、受多重因素影响的过程。无论是细菌的生物学特性(如表面附属结构[9-11])、胞外聚合物(EPS, extracellular polymeric substances)[12-14]、群体感应效应(QS, quorum sensing)[15-17]、细菌运动能力[18], 还是环境因子(如pH[19-20]、营养物质[21-24]、水力剪切力[25]、材料表面特性[26-27]等), 都可能对其成膜产生影响。目前的研究多以医学常见致病菌(如大肠杆菌和铜绿假单胞菌)为模式细菌, 对环境工程中应用较多的、由降解菌形成的降解型生物膜的研究却较为匮乏。尤其对高毒、高污染环境中生物膜形成的影响因素, 尚存在诸多认识空白。
本研究考察环境因子(包括pH、温度、培养时间、目标污染物浓度)对吡啶和喹啉降解型生物膜形成的影响, 初步确定降解型生物膜形成的最佳条件, 为进一步考察降解型生物膜的降解效率及实际处理中生物膜形成的人工调控提供参考。
1 材料与方法 1.1 受试菌株研究采用从首钢焦化活性污泥中分离纯化的4株降解菌, 菌株特性见表 1[28]。
| 目标污染物 | 菌名 | 菌属 | 革兰氏染色 | 好氧性 | 形态 | 保藏号 |
| 吡啶 | BC026 | 生枝动胶菌(Shinella zoogloeoides) | G- | 好氧 | 杆菌, 有鞭毛 | CGMCC2224 |
| BW001 | 脱氮副球菌(Paracoccus) | G- | 好氧 | 球菌或短杆菌, 无鞭毛 | CGMCC2225 | |
| 喹啉 | BW003 | 假单胞菌(Pseudomonas) | G- | 好氧 | 杆菌, 有鞭毛 | CGMCC3008 |
| BW004 | 假单胞菌(Pseudomonas) | G- | 好氧 | 杆菌, 有鞭毛 | CGMCC4221 | |
| 说明:保藏号为在中国微生物菌种保藏管理委员会普通微生物中心的号码。 | ||||||
1.2 培养基
细菌的活化与富集及微孔板成膜实验培养使用LB培养基, 含10 g/L胰蛋白胨、5g/L酵母膏和10 g/L NaCl。若无特殊说明, 需另加入200 mg/L目标污染物, 以保持降解菌的降解特性。细菌的分离清洗以及微孔板的清洗使用无机盐培养基(MSM, mineral salt medium)[29]。所有培养基使用前均于121℃, 1.05 kg/cm2下灭菌20分钟。
1.3 主要试剂胰蛋白胨及酵母提取物购自Oxoid (英国); 琼脂糖购自Amresco (美国), 琼脂购自国药集团化学试剂有限公司(中国), 吡啶标准溶液购自Chem Service (美国), 喹啉标准溶液购自AccuStandard (美国), 1%结晶紫染液购自北京索莱宝科技有限公司(中国), 牛血清蛋白购自Sigma-Aldrich (西班牙), 考马斯亮蓝染液购自南京建成生物工程研究所(中国), SYBR Green购自北京拜尔迪生物技术有限公司(中国)。无特殊说明的化学试剂均为分析纯及以上级别。
1.4 改良微孔板法对生物膜的半定量测定微孔板法是生物膜研究中应用较广的一种对生物膜进行半定量的方法。本研究在George[30]和Merritt等[31]微孔板生物膜实验的基础上, 有所改进, 采用组织培养处理的聚苯乙烯12孔板(Corning, 美国)进行实验, 具体操作如下。
将过夜培养(16~18小时)的菌体用MSM清洗两遍, 用含有目标污染物的LB液体培养基稀释至OD595=0.5。将1 mL菌液接种到12孔板的A和C两行微孔中, 中间B行加LB作为空白, 每个条件做2块孔板平行实验。接种后, 封口膜密封, 于不同环境条件下培养。
培养24小时后, 先将125 μL菌悬液转移至96孔板, 酶标仪(BioTek Instruments, 美国)测定OD595, 表征浮游态细菌的生长量。用去离子水小心洗去孔板中的悬浮细胞和培养基, 于60℃烘干1小时固定。每孔加入2 mL 0.1%结晶紫(CV, Crystal Violet)染色25分钟, 小心洗去多余染料, 于35℃烘干。每孔加入4 mL 95%乙醇, 置于95 rpm摇床45分钟, 充分溶解结晶紫。最后每孔移取125 μL至96孔板, 以除去空白的OD595, 表征生物膜的形成量。
1.5 单一环境因子实验设置本研究考察温度、pH值、培养时间和污染物浓度对生物膜形成的影响。pH考察6个水平, 分别为4, 7, 8, 9, 10和11;温度考察5个水平, 分别为20, 25, 30, 35和40℃; 培养时间考察5个水平, 分别为12, 24, 36, 48和60小时; 污染物浓度考察5个水平, 分别为0, 400, 800, 1200和1600 mg/L。
每批实验只改变单一因子条件, 若无特殊说明, 温度为35℃, pH=7, 污染物浓度为200 mg/L, 静置培养24小时。
1.6 统计学分析实验结果以均值±SD表示。采用SPSS 20.0软件, 对不同细菌的相同生物学特性进行t检验, 对同一受试细菌在不同环境条件下生物膜成膜量指标进行单因素方差分析及LSD多重比较。以P < 0.05为差异有统计学意义。
2 结果与讨论 2.1 4株降解菌生物学特性4株降解菌形态如图 1所示。此前曾对4株降解菌的初始黏附能力(30分钟内)[32]、细胞疏水性[33]、胞外蛋白与胞外多糖(培养24小时)测定[34-36], 游动能力(swimming motility)、群游能力(swarming motility)和抽动运动能力(twitching motility)[18, 37], 发现BW001的初始黏附能力、疏水性、EPS分泌能力以及运动能力均显著低于其他菌株; BC026的初始黏附细胞数量和胞外多糖分泌能力显著高于其他三株菌株; BW003和BW004的初始黏附能力、疏水性、胞外多糖分泌及运动能力较为接近, 未呈现显著差异。因此在后续实验中, 只选择BW004作为代表考察环境因子对成膜的影响。

|
| 图 1. 4株NHCs降解菌成熟期的电子显微镜照片 Figure 1. Photographs of the NHCs degrading bacteria by SEM |
2.2 环境因子对生物膜形成的影响 2.2.1 pH值
在实际废水处理过程中, 鉴于焦化废水的复杂性, 其pH常常有一定波动, pH可能对水处理系统中的降解菌产生冲击, 影响生物膜的形成。
前人研究表明, 焦化废水多呈碱性, 如首钢集团焦化二厂焦化废水原水pH在8.47~9.48之间[38], 广东韶钢焦化厂原水pH在9.1~11.0之间[39]。因而本实验着重考察碱性条件对生物膜的影响。
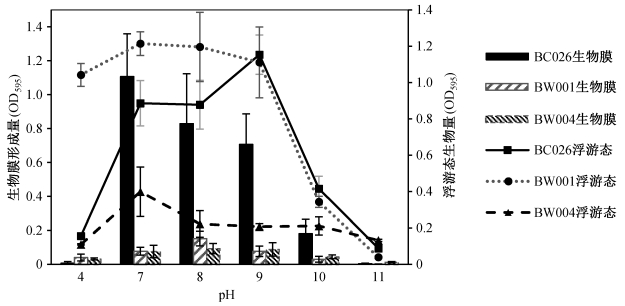
图 2和3表明, BC026生物膜态生长的最适pH为7, BW001为8, BW004为7~9。在此最适pH条件下, 生物膜量与其他水平相比呈现显著差异, 同时生物膜量/浮游态生物量比值最大。由此推断, 3株降解菌都不适合在酸性条件下生存, 而在焦化废水的弱碱性环境中依然具有一定成膜能力。另外, 虽然BC026在pH为7~9范围内成膜量较多, 但它对碱性环境较为敏感, 随着pH升高, 生物膜量下降速度远远高于浮游态。相比之下, BW001和BW004生物膜对碱性环境的变化具有一定抵御能力。
|
| 图 2. pH值对NHCs降解菌浮游态与生物膜态生长的影响 Figure 2. Amount of planktonic cells and biofilm of the degrading bacteria in response to different pH |
|
| 图 3. pH值对NHCs降解菌生物膜与浮游态生物量比的影响 Figure 3. Ratio of biofilm/planktonic cells of the degrading bacteria in response to different pH |
2.2.2 温度
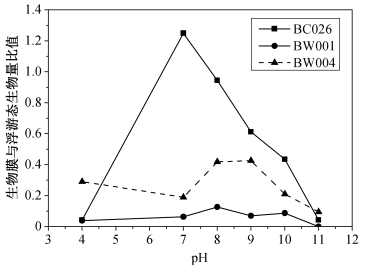
无论是焦化废水原水还是处理过程中, 水温会随着处理流程与反应过程变化, 而温度是影响细胞生长与内酶系发挥作用的重要因素, 因此, 考察最佳成膜温度对废水实际处理过程温度的控制具有一定参考价值。
从图 4(a)可以看出, BC026成膜量最多的温度为35℃, 而浮游态生长量最多的温度为25~30℃。两者相比(图 4(d)), 30~40℃范围内, 随着温度升高, 生物膜态明显占据优势。BW001成膜量最多的温度为35℃, 而浮游态生长量最多的温度为30~40℃(图 4(b))。两者相比(图 4(d)), 20~40℃范围内, 生物膜态与浮游态较为均衡。BW004成膜量最多的温度为40℃, 而浮游态生长量最多的温度为25℃(图 4(c))。两者相比(图 4(d)), 40℃条件下生物膜态占据明显优势, 成膜量是其他条件下的两倍左右。
|
| 图 4. 温度对NHCs降解菌生物膜形成的影响 Figure 4. Effects of temperature on degrading bacteria biofilm formation |
综上所述, BC026和BW004在较高温度(30~40℃)下, 生物膜态都有逐渐占据优势的趋势, 而BW001响应不显著, 说明该菌对温度因子响应不敏感。
基于pH和温度对降解菌生物膜形成的影响研究, 得出BC026成膜的最适pH为7, 最适温度为35℃; BW001成膜的最适pH为8, 最适温度为35℃; BW004成膜的最适pH为7~9, 最适温度为40℃。因此, 后续实验选择在pH=7, 35℃条件下进行。相比本课题组之前确定的降解菌浮游态的最佳降解条件[28](BC026 pH为6.5~7.9, 温度为23.9℃~34.3℃; BW001 pH为6.5~7.5, 温度为26.2℃~36.1℃; BW004 pH为6.4~7.5, 温度为26.8℃~34.7℃), 可以看出:生物膜形成的最佳条件与生物降解的最佳pH较为相似, 而成膜所需温度更高, 在实际处理过程中不易达到。而不同降解菌最佳成膜与最佳降解条件各不相同, 如何在实际反应器中协调各个菌株, 成为实际处理过程需要解决的问题。因此, 需要进一步结合实际情况, 确定能够同时保障成膜与降解的最优条件。
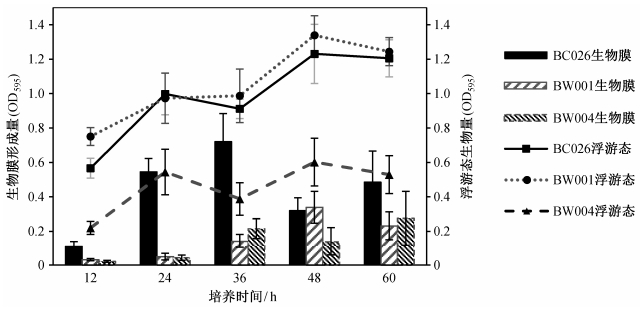
2.2.3 培养时间生物膜的形成包括最初黏附、分泌EPS从而不可逆黏附、早期结构形成、结构成熟分化以及最后膜内单细胞的裂解散播5个步骤[40]。不同降解菌在相同条件下, 经历各个阶段所需的时间也有差异。
3株降解菌的浮游态与生物膜态都呈现出阶梯式生长规律(图 5和6):在一定时间内, 先增长, 然后小幅下降, 继而在原有基础上增长。其中, BC026和BW004生物膜的生长明显比悬浮态的生长滞后。BC026在12~24小时期间, 细菌迅速适应环境, 进入到对数期, 生物量迅速增加, 发生黏附继而成膜的细胞也快速增加, 因此浮游态与生物膜态呈现一致的增长趋势; 24~36小时期间, 浮游态减少, 生物膜增加, 说明浮游态细菌可能已经过稳定期进入衰亡期, 而生物膜细胞依然处于成熟分化阶段, 稳定增长; 36~48小时期间, 生物膜可能进入裂解期, 细胞散播而转为浮游态, 因此浮游态细胞增多; 48~60小时期间, 浮游态再次进入稳定期甚至衰亡期, 而生物膜继续增长。
|
| 图 5. 培养时间对NHCs降解菌浮游态与生物膜态生长的影响 Figure 5. Amount of biofilm and planktonic cells of the different degrading bacteria in response to incubation time |

|
| 图 6. 培养时间对NHCs降解菌生物膜与浮游态生物量比值的影响 Figure 6. Ratio of biofilm/planktonic cells of the different degrading bacteria in response to incubation time |
不同培养时间浮游态与生物膜态细胞数量的变化, 在一定程度上反映生物膜由黏附到裂解的成膜过程。可由此推断, 3株降解菌生物膜形成的最佳培养时间分别为36小时(BC026和BW004)和48小时(BW001)(图 6中比值最高点)。另外, 对于多孔板培养法, 过长的培养时间会造成营养基质匮乏、培养基体积减少, 影响成膜的因素增加, 增大实验误差(图 5)。因此, 考察生物膜的形成过程培养时间不宜超过60小时。
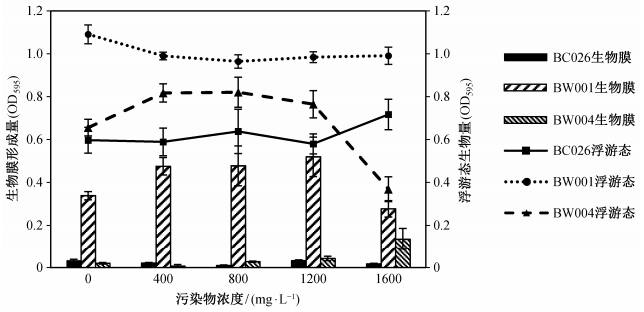
2.2.4 目标污染物浓度以24小时为培养时间(图 7), BC026在污染物为0~1600 mg/L的不同水平下, 浮游态生长不存在显著差异, 而生物膜生长也没有明显规律; BW001的浮游态生长于0 mg/L浓度下明显高于其他水平, 生物膜生长在400~1200 mg/L范围较好; BW004的浮游态生长于400~1200 mg/L较好, 生物膜生长明显在1600 mg/L最好。
|
| 图 7. 目标污染物浓度对NHCs降解菌浮游态与生物膜态生长的影响(24小时) Figure 7. Amount of biofilm and planktonic cells of degrading bacteria in response to the pollutant concentration (24 hours) |
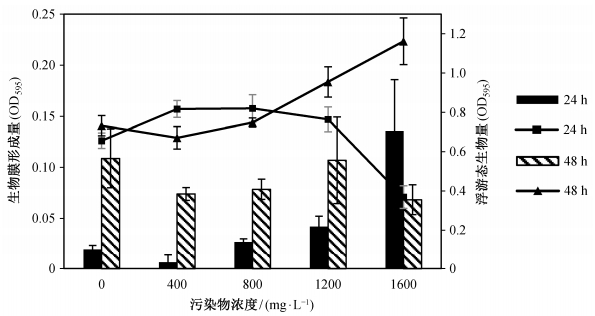
本文还考察延长培养时间, 不同菌株对目标污染物的响应。结果表明, BW004的响应较为特别(图 8):与24小时培养不同, BW004在各污染物浓度下的成膜量多有所增加, 但在极高污染物浓度下, 生物膜量反而大幅减少; 与之相反, 在800~1600 mg/L, 24小时培养时, 浮游态生物量为逐渐上升趋势, 48小时培养后却转为下降趋势。
|
| 图 8. 目标污染物浓度对BW004浮游态与生物膜态生长的影响 Figure 8. Amount of biofilm and planktonic cells of BW004 in response to the pollutant concentration |
结合培养时间对生物膜影响的考察结果, 可推测BW004在培养36小时后, 已经形成稳定的生物膜, 在36~48小时培养的过程中, 生物膜部分裂解, 细胞散播到液体中, 继而重新进入新的成膜过程, 因此在0~1200 mg/L浓度下, 成膜量多有所增加。随着污染物浓度(800~1600 mg/L)的升高, BW004生物膜的形成速度可能受到高浓度刺激而加速, 尤其是1600 mg/L条件下, 在培养24 h时成膜量最高, 而培养48 h时刚好进入裂解散播期, 导致浮游态生物量迅速增加, 生物膜量反而因老化脱落而减少。
细菌由浮游状态向生物膜状态的转变, 是自身应对外界环境的一种保护机制[41-42]。随着污染物浓度升高, BW004成膜量增多, 说明BW004可能具有较为敏感的保护机制, 能够在接收到环境污染物刺激时, 较快形成生物膜, 以抵御外界环境的变化。
另一方面, 吡啶和喹啉对降解菌来说, 不仅是高毒性冲击负荷物质, 也可以作为生长所需的碳源。研究表明, 碳源会影响细菌的群集运动能力和群体感应效应, 从而影响生物膜的形成[24]。还有研究发现一种CsrA蛋白可以通过调控中央碳通量和细胞内的糖原合成与代谢作用来抑制生物膜的形成, 刺激裂解散播的发生[43-44]。因此, 基质污染物也可能是通过类似的途径对成膜造成影响。
另外, 生物膜的形成可能受到包括群体感应调控系统[17]、代谢产物阻遏与应激反应[45]等多种、甚至其他未知的调控机制与途径的影响, 有待进一步探究。
3 结论1) 降解型生物膜的形成受pH、温度和培养时间的影响显著, 各降解菌的最佳成膜条件为: BC026成膜的最适pH为7, 最适温度为35℃, 培养时间为36小时; BW001成膜的最适pH为8, 最适温度为35℃, 培养时间为48小时; BW004成膜的最适pH为7~9, 最适温度为40℃, 培养时间为36小时。
2) BC026对pH的变化较为敏感, 随着pH升高, 生物膜量减少速度远远高于浮游态; BC026和BW004对温度的变化较为敏感, 在较高温度(30~40℃)条件下, 生物膜态都有逐渐占据优势的趋势; BW001形成的生物膜对pH和温度的响应都不敏感。
3) 降解型生物膜的形成受目标污染物浓度(在0~1600 mg/L范围内)影响不显著, 不存在明显适合成膜的浓度范围。
| [1] | Bai Y, Sun Q, Zhao C, et al. Aerobic degradation of pyridine by a new bacterial strain, Shinella zoog-loeoides BC026. Journal of Industrial Microbiology & Biotechnology , 2009, 36 (11) : 1391–1400 . |
| [2] | Bai Y, Sun Q, Zhao C, et al. Microbial degradation and metabolic pathway of pyridine by a Paracoccussp. strain BW001. Biodegradation , 2008, 19 (6) : 915–926 DOI:10.1007/s10532-008-9193-3 . |
| [3] | 柏耀辉, 赵翠, 肖亚娜, 等. 降解喹啉的假单胞菌BW003菌株的分离, 鉴定和降解特性. 环境科学 , 2009, 29 (12) : 3546–3553. |
| [4] | 郑中原, 赵翠, 温东辉, 等. 喹啉降解菌BW004的分离, 鉴定及降解特性. 北京大学学报:自然科学版 , 2013, 49 (4) : 683–688. |
| [5] | Jefferson K K. What drives bacteria to produce a biofilm?. FEMS Microbiology Letters , 2004, 236 (2) : 163–173 DOI:10.1111/fml.2004.236.issue-2 . |
| [6] | Costerton J W, Stewart P S, Greenberg E P. Bacterial biofilms: a common cause of persistent infections. Science , 1999, 284 : 1318–1322 DOI:10.1126/science.284.5418.1318 . |
| [7] | Branda S S, Vik Å, Friedman L, et al. Biofilms: the matrix revisited. Trends in Microbiology , 2005, 13 (1) : 20–26 DOI:10.1016/j.tim.2004.11.006 . |
| [8] | Flemming H C, Neu T R, Wozniak D J. The EPS matrix: the "house of biofilm cells". Journal of Bacteriology , 2007, 189 (22) : 7945–7947 DOI:10.1128/JB.00858-07 . |
| [9] | O'Toole G A, Kolter R. Flagellar and twitching motility are necessary for Pseudomonas aeruginosa biofilm development. Molecular Microbiology , 1998, 30 (2) : 295–304 DOI:10.1046/j.1365-2958.1998.01062.x . |
| [10] | Klausen M, Heydorn A, Ragas P, et al. Biofilm formation by Pseudomonas aeruginosa wild type, flagella and type Ⅳ pili mutants. Molecular Microbiology , 2003, 48 (6) : 1511–1524 DOI:10.1046/j.1365-2958.2003.03525.x . |
| [11] | Conrad J C. Physics of bacterial near-surface motility using flagella and type Ⅳ pili: implications for biofilm formation. Research in Microbiology , 2012, 163 (9) : 619–629 . |
| [12] | Ma L, Jackson K D, Landry R M, et al. Analysis of Pseudomonas aeruginosa conditional psl variants reveals roles for the psl polysaccharide in adhesion and maintaining biofilm structure postattachment. Journal of Bacteriology , 2006, 188 (23) : 8213–8221 DOI:10.1128/JB.01202-06 . |
| [13] | Ryder C, Byrd M, Wozniak D J. Role of polysac-charides in Pseudomonas aeruginosa biofilm deve-lopment. Current Opinion in Microbiology , 2007, 10 (6) : 644–648 DOI:10.1016/j.mib.2007.09.010 . |
| [14] | Yang L, Hu Y, Liu Y, et al. Distinct roles of extracellular polymeric substances in Pseudomonas aeruginosabiofilm development. Environmental Microbiology , 2011, 13 (7) : 1705–1717 DOI:10.1111/j.1462-2920.2011.02503.x . |
| [15] | Davies D G, Parsek M R, Pearson J P, et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science , 1998, 280 : 295–298 DOI:10.1126/science.280.5361.295 . |
| [16] | Purevdorj B, Costerton J W, Stoodley P. Influence of hydrodynamics and cell signaling on the structure and behavior of Pseudomonas aeruginosa biofilms. Applied and Environmental Microbiology , 2002, 68 (9) : 4457–4464 DOI:10.1128/AEM.68.9.4457-4464.2002 . |
| [17] | O'Loughlin C T, Miller L C, Siryaporn A, et al. A quorum-sensing inhibitor blocks Pseudomonas aeru-ginosa virulence and biofilm formation. Proceedings of the National Academy of Sciences , 2013, 110 (44) : 17981–17986 DOI:10.1073/pnas.1316981110 . |
| [18] | Rashid M H, Kornberg A. Inorganic polyphosphate is needed for swimming, swarming, and twitching motilities of Pseudomonas aeruginosa. Proceedings of the National Academy of Sciences , 2000, 97 (9) : 4885–4890 DOI:10.1073/pnas.060030097 . |
| [19] | Patil S A, Harnisch F, Koch C, et al. Electroactive mixed culture derived biofilms in microbial bioelec-Trochemical systems: the role of pH on biofilm formation, performance and composition. Bioresource Technology , 2011, 102 (20) : 9683–9690 DOI:10.1016/j.biortech.2011.07.087 . |
| [20] | Nostro A, Cellini L, Di Giulio M, et al. Effect of alkaline pH on staphylococcal biofilm formation. APMIS , 2012, 120 (9) : 733–742 DOI:10.1111/apm.2012.120.issue-9 . |
| [21] | Zhou G, Shi Q S, Chen Y B. Effects of nutritional and environmental conditions on planktonic growth and biofilm formation of Citrobacter werkmanii BF-6. Journal of Microbiology and Biotechnology , 2013, 23 (12) : 1673–1682 DOI:10.4014/jmb1307.07041 . |
| [22] | Hunt S M, Werner E M, Huang B, et al. Hypothesis for the role of nutrient starvation in biofilm detach-ment. Applied and Environmental Microbiology , 2004, 70 (12) : 7418–7425 DOI:10.1128/AEM.70.12.7418-7425.2004 . |
| [23] | Shrout J D, Chopp D L, Just C L, et al. The impact of quorum sensing and swarming motility on Pseudo-monas aeruginosa biofilm formation is nutritionally conditional. Molecular Microbiology , 2006, 62 (5) : 1264–1277 DOI:10.1111/mmi.2006.62.issue-5 . |
| [24] | Gjermansen M, Nilsson M, Yang L, et al. Charac-terization of starvation-induced dispersion in Pseudomonas putida biofilms: genetic elements and molecular mechanisms. Molecular Microbiology , 2010, 75 (4) : 815–826 DOI:10.1111/mmi.2010.75.issue-4 . |
| [25] | Stoodley P, Cargo R, Rupp C J, et al. Biofilm material properties as related to shear-induced deformation and detachment phenomena. Journal of Industrial Micro-biology and Biotechnology , 2002, 29 (6) : 361–367 DOI:10.1038/sj.jim.7000282 . |
| [26] | Carlen A, Nikdel K, Wennerberg A, et al. Surface characteristics and in vitro biofilm formation on glass ionomer and composite resin. Biomaterials , 2001, 22 (5) : 481–487 DOI:10.1016/S0142-9612(00)00204-0 . |
| [27] | Loo C Y, Young P M, Cavaliere R, et al. Silver nanoparticles enhance Pseudomonas aeruginosa PAO1 biofilm detachment. Drug Development and Industrial Pharmacy , 2014, 40 (6) : 719–729 DOI:10.3109/03639045.2013.780182 . |
| [28] | 赵翠.含氮杂环芳烃废水的生物强化处理技术及机理研究[D].北京:北京大学, 2012 |
| [29] | Jianlong W, Xiangchun Q, Liping H, et al. Microbial degradation of quinoline by immobilized cells of Burkholderia pickettii. Water Research , 2002, 36 (9) : 2288–2296 DOI:10.1016/S0043-1354(01)00457-2 . |
| [30] | George A. Microtiter dish biofilm formation assay. Journal of Visualized Experiments , 2011 (47) : e2437 . |
| [31] | Merritt J H, Kadouri D E, O'Toole G A. Growing and analyzing static biofilms. Current protocols in Microbiology , 2005 : 1B . |
| [32] | Andersson S, Kuttuva Rajarao G, Land C J, et al. Biofilm formation and interactions of bacterial strains found in wastewater treatment systems. FEMS Microbiology Letters , 2008, 283 (1) : 83–90 DOI:10.1111/fml.2008.283.issue-1 . |
| [33] | Rosenberg M, Gutnick D, Rosenberg E. Adherence of bacteria to hydrocarbons: a simple method for measuring cell-surface hydrophobicity. FEMS Micro-biology Letters , 1980, 9 (1) : 29–33 DOI:10.1111/fml.1980.9.issue-1 . |
| [34] | Tielen P, Strathmann M, Jaeger K E, et al. Alginate acetylation influences initial surface colonization by mucoid Pseudomonas aeruginosa. Microbiological Research , 2005, 160 (2) : 165–176 DOI:10.1016/j.micres.2004.11.003 . |
| [35] | Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances. Analytical Chemistry , 1956, 28 (3) : 350–356 DOI:10.1021/ac60111a017 . |
| [36] | Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analy-tical Biochemistry , 1976, 72 (1) : 248–254 . |
| [37] | Kearns D B. A field guide to bacterial swarming motility. Nature Reviews Microbiology , 2010, 8 (9) : 634–644 DOI:10.1038/nrmicro2405 . |
| [38] | 郑中原. SBBR-多相臭氧催化氧化组合工艺处理焦化废水的试验研究[D].北京:北京大学, 2014 http://d.g.wanfangdata.com.cn/Thesis_Y2667453.aspx |
| [39] | 任源, 韦朝海, 吴超飞, 等. 焦化废水水质组成及其环境学与生物学特性分析. 环境科学学报 , 2007, 27 (7) : 1094–1100. |
| [40] | Stoodley P, Sauer K, Davies D G, et al. Biofilms as complex differentiated communities. Annual Reviews in Microbiology , 2002, 56 (1) : 187–209 DOI:10.1146/annurev.micro.56.012302.160705 . |
| [41] | Fujishige N A, Kapadia N N, De Hoff P L, et al. Investigations of Rhizobium Biofilm Formation. FEMS Microbiology Ecology , 2006, 56 (2) : 195–206 DOI:10.1111/fem.2006.56.issue-2 . |
| [42] | Rinaudi L, Fujishige N A, Hirsch A M, et al. Effects of nutritional and environmental conditions on Sinorhizobium meliloti biofilm formation. Research in Microbiology , 2006, 157 (9) : 867–875 DOI:10.1016/j.resmic.2006.06.002 . |
| [43] | Jackson D W, Simecka J W, Romeo T. Catabolite repression of Escherichia coli biofilm formation. Journal of Bacteriology , 2002, 184 (12) : 3406–3410 DOI:10.1128/JB.184.12.3406-3410.2002 . |
| [44] | Jackson D W, Suzuki K, Oakford L, et al. Biofilm formation and dispersal under the influence of the global regulator CsrA of Escherichia coli. Journal of Bacteriology , 2002, 184 (1) : 290–301 DOI:10.1128/JB.184.1.290-301.2002 . |
| [45] | Domka J, Lee J, Wood T K. YliH (BssR) and YceP (BssS) regulate Escherichia coli K-12 biofilm formation by influencing cell signaling. Applied and Environmental Microbiology , 2006, 72 (4) : 2449–2459 DOI:10.1128/AEM.72.4.2449-2459.2006 . |
 2016, Vol. 52
2016, Vol. 52