文章信息
- 鲁昊, 季承, 倪培刚, 周敏, 付宛璐
- LU Hao, JI Cheng, NI Peigang, ZHOU Min, FU Wanlu
- 安徽巢湖早三叠世原始鱼龙类的结构和行为特征及其对鱼龙类起源研究的启示
- Structural and Behavioral Characters of the Early Triassic Ichthyosauriformes from Chaohu, Anhui Province, and Their Implications on the Origin of Ichthyopterygia
- 北京大学学报(自然科学版), 2016, 52(2): 234-240
- Acta Scientiarum Naturalium Universitatis Pekinensis, 2016, 52(2): 234-240
-
文章历史
- 收稿日期: 2015-01-09
- 修回日期: 2015-04-09
- 网络出版日期: 2016-01-22
2. 中国科学院资源地层学与古地理学重点实验室, 中国科学院南京地质古生物研究所, 南京 210008
2. Key Laboratory of Economic Stratigraphy and Palaeogeography, Nanjing Institute of Geology and Palaeontology, Chinese Academy of Sciences, Nanjing 210008
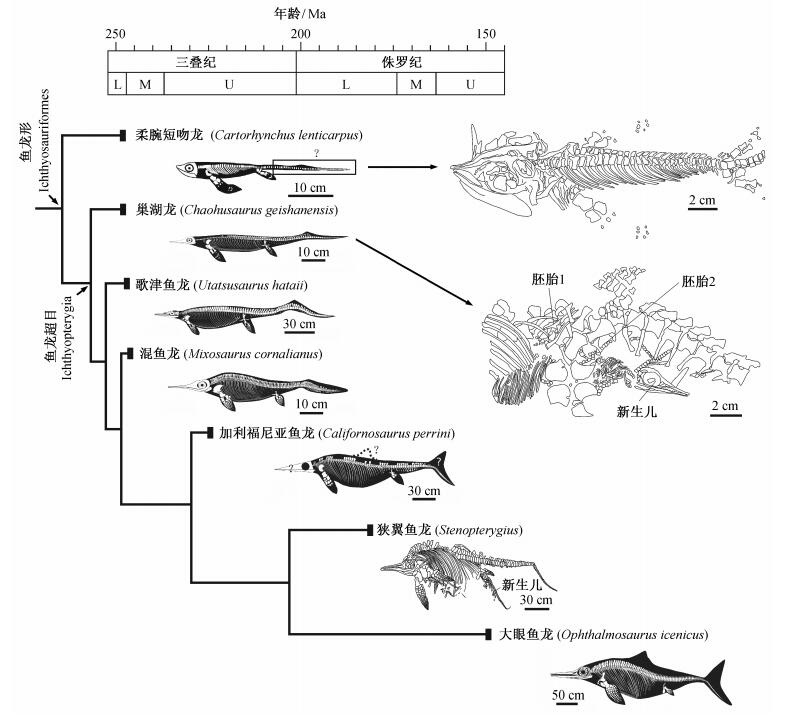
以鱼龙类、鳍龙类、海龙类为典型代表的爬行动物在三叠纪初期占领海洋。鱼龙类自早三叠世开始出现至晚白垩世早期绝灭, 是高度适应海洋生活的典型代表。在其演化序列中, 鱼龙类的形态特征和行为特征发生一系列变化, 如身体逐步特化成流线型, 四肢特化成扁平的鳍脚状以适应快速游泳的生活方式, 吻增长并具有粗壮的牙齿用以捕食, 以及以胎生的方式在海洋中直接生产幼子等[1]。鱼龙类最早出现于早三叠世晚期化石记录中时, 已经显示出特化的水生生活特征, 形态学研究表明早期鱼龙类不具有陆地行走能力, 之前从未发现从陆生到海生的过渡类型[2]。鱼龙类与其陆生祖先的演化关系一直存有疑问, 其形态学特征的早期起源和早期演化问题仍缺少可靠的化石证据[3]。近年来, 北京大学、安徽省古生物化石博物馆、加州大学戴维斯分校、意大利米兰大学等多个研究机构的古生物学家联合在中国安徽巢湖地区对早三叠世巢湖海生脊椎动物群开展野外调研和发掘, 共发现约80件爬行动物骨架、大量的鱼类以及与之伴生的多门类无脊椎动物化石。对其中两具鱼龙类化石的详细研究[4-5]为鱼龙类的最早期演化提供了新的证据。一具标本代表目前所知最原始的鱼龙型(Ichthyosau-riformes)动物--柔腕短吻龙(Cartorhynchus)[4]; 另一具为目前所知时代最早的含胚胎鱼龙标本, 保存了正在分娩的巢湖龙(Chaohusaurus)母体和3个胚胎[5]。
1 研究材料概况本文研究的两具标本发现于安徽巢湖市马家山地区下三叠统南陵湖组上段, 时代上属于奥伦尼克期(Olenekian)斯帕斯亚期(Spathian), 层位可归为菊石Subcolumbites带[4-5]。标本均保存于安徽省古生物化石博物馆。
柔腕短吻龙标本(标本编号AGB6257, 图 1)尾部不完整, 保存部分体长21.4 cm, 推断其全长约40 cm, 是目前发现最小的鱼龙型爬行动物。从骨骼形态上看, 个体小、短吻、具软骨质腕骨。该个体看似未成年, 但其桡腕骨已经骨化, 并且中轴骨骨化程度高, 这些骨骼特征表明该个体已成年。此外, 柔腕短吻龙以短吻、下颌骨宽、仅具31节荐前椎等特征区别于巢湖龙。
正在分娩的母体及其3个胚胎化石标本(标本编号AGM I-1, 图 1)的母体缺少头骨、前肢和尾后部, 其余骨骼保存完整。现存骨骼中, 母体的跗骨骨化相对于其趾骨有明显延迟, 具独一无二的次生趾骨等特征, 因此可鉴定为巢湖龙。母体内包含两个胚胎骨骼化石, 一个完全在母体体腔中(胚胎1), 另一个头部刚出母体盆骨(胚胎2)。另外, 还保存一具已产出母体体外的新生儿的部分骨骼。母体内的两具胚胎化石头骨保存清晰, 骨骼特征保存良好, 无胃酸侵蚀的痕迹, 且位于母体腰带位置(胃容物通常位于身体更前部, 不可能在此位置), 因此可排除它们是被捕食者的可能性。胚胎2保存下颌牙齿16颗, 上颌牙齿23颗, 但基于该胚胎颌骨齿槽的位置和长度, 上颌牙齿数应为40~45枚, 比成年个体的牙齿数目少大约10枚。新生儿位于母体体外, 大部分被压在母体身下, 出露不完整, 但可看出它已从母体产出。
2 柔腕短吻龙的陆生结构特征
柔腕短吻龙具31节荐前椎, 这与陆生爬行动物椎体数相似。吻部短, 也类似于陆生动物。鳍状前肢的前臂和指骨之间距离较远, 缺少远端腕骨, 表明中间有软骨质结构存在, 类似于现生海狮, 可能具有一定的陆地爬行功能。
2.1 荐前椎数目原始的陆生爬行动物, 通常有约30节荐前椎, 其中颈椎约7节, 这在早期四足类中相当普遍, 现生具正常四肢的陆生爬行动物荐前椎数目为16~36节[8]。鱼龙类自早三叠世晚期出现开始, 一般具40~60或60~80节荐前椎[1], 这是由于鱼龙在近岸向远洋扩散的过程中, 随着游泳能力的进一步提高, 其身体结构向着适应快速游泳的“金枪鱼型”逐步特化。荐前椎数目的增加使其躯干部分的长度比例相应增加, 同时椎骨形态的进一步扁化使相邻椎骨连接更加紧密, 逐渐由全身摆动型的游泳方式过渡到仅靠尾部摆动的游泳方式[9]。至中-晚三叠世, 部分鱼龙类的荐前椎数已经达到60节以上, 如杯椎鱼龙科(Cymbospondylidae)和萨斯特鱼龙科(Shasta-sauridae), 在部分类群中甚至达到80节以上, 如萨斯特鱼龙科中的关岭鱼龙属(Guanlingsaurus)[10]。中-晚三叠世鱼龙个体长度达到最大, 如Shoni-saurus sikanniensis可达21 m以上[11]。巢湖龙是鱼龙超目最原始的分子之一, 荐前椎数目约36节, 是鱼龙超目中荐前椎数最少的类型。与巢湖龙同层位发现的柔腕短吻龙仅具31节荐前椎, 这个数目处于陆生爬行动物荐前椎数目的范围, 但远低于后期更加特化的鱼龙类。这表明, 柔腕短吻龙在荐前椎数目上比巢湖龙及后期的鱼龙类都原始, 其水生生活的适应性比鱼龙类弱, 更接近其陆生祖先。
2.2 吻的长度陆生爬行动物普遍具有较短的吻部, 通常吻长与头骨长的比值约为0.44[4]。晚二叠世的陆生爬行类杨氏蜥(Youngia), 曾被认为可能是鱼龙类的陆地祖先, 其吻长与头骨长的比值约为0.43[12]。在水生爬行动物中, 很多类群演化出长吻, 这一特征的变化可以减小爬行动物在水中游泳时所受的流体压力, 该特征被认为是爬行类适应水生的次生性状, 目前仅在水生爬行类和始虚骨龙(Coelurosauravus)中存在[13]。鱼龙类普遍具有较长的吻部(图 1), 这个特征在以巢湖龙(Chaohusaurus)、歌津鱼龙(Uta-tsusaurus)为代表的最早期类型中已经出现, 它们的吻长与头骨长的比值分别为0.68和0.60。中三叠世的混鱼龙(Mixosaurus), 该比值达0.73。吻部增长的特征是鱼龙类的共有近裔特征。柔腕短吻龙的吻长与头骨长比值仅为0.35, 远小于鱼龙类(表 1), 而更接近于陆生爬行类。这个特征表明, 柔腕短吻龙的吻部还没有发生显著特性化, 仍保留其陆生生活的比例, 与后来特化的鱼龙类相比, 更加适应陆生生活。
| 对比项 | 巢湖龙 Chaohusaurus |
歌津鱼龙 Utatsusaurus |
混鱼龙 Mixosaurus |
加利福尼亚鱼龙 Californosaurus |
大眼鱼龙 Ophthalmosaurus |
柔腕短吻龙 Cartorhynchus |
杨氏蜥 Youngia |
| 吻长/头骨长 | 0.68 | 0.60 | 0.73 | ? | 0.68 | 0.35 | 0.43 |
| 前肢长/荐前椎长 | 0.27 | 0.27 | 0.31 | 0.19 | 0.31 | 0.45 | ? |
吻部的长度除与在水中运动的阻力有关外, 还可能与其捕食方式关系密切。在快速游泳型的水生爬行动物中, 可见两种不同的吻部比例关系, 分别对应两种不同的捕食方式:一种为跃捕式(ram-feeding), 另一种为吸食式(suction-feeding)[14]。前者具有长吻, 常具有锥状的牙齿, 在快速游泳过程中咬住食物并吞下。后者具有短吻, 牙齿常退化, 主要靠口腔产生负压将食物吸入。鱼龙类普遍的捕猎方式为跃捕式, 目前没有证据表明有吸食式取食的类型[14]。与鱼龙类显著不同的是, 柔腕短吻龙吻部显著缩短且向前收缩, 这个比例关系符合吸食式取食的水生爬行动物的特征。此外, 柔腕短吻龙具有粗壮的舌颌骨, 且没有牙齿发育, 可能在取食过程中, 舌颌骨附着的粗壮的肌肉具有使口腔空间迅速增大产生负压的能力, 完成将食物吸入的过程。
2.3 腕部的结构和发育一些爬行动物在逐步适应水生生活的过程中, 四肢逐渐特化成鳍状[15]。这个过程中伴随着四肢骨骼形态的特化, 如鱼龙类中长骨骨干逐步退化, 指骨进一步扁化成盘状且数量逐渐增加。在早期鱼龙类如巢湖龙中, 指骨仍保持着原始四足类指式[8], 且仍具有骨干; 而后期进化型的鱼龙类中, 前肢呈紧密排列的圆点状多指带形式, 骨干完全退化。柔腕短吻龙在肢体形态上与巢湖龙相似, 其四肢已呈鳍状, 指骨骨干部分退化, 表明其适应水生生活。
柔腕短吻龙肢体骨骼特征同其他鱼龙类差异明显, 如其肱骨前缘并未显著外展, 而这一特征是鱼龙类共有的近裔特征。此外, 其鳍状前肢所占身体比例明显大于鱼龙类其他属种(表 1)。柔腕短吻龙前肢长与荐前椎长的比值为0.45, 约为躯体的一半, 而其他典型的鱼龙属种中比值最大的是混鱼龙(Mixosaurus)和大眼鱼龙(Ophthalmosaurus), 比值均为0.31, 最小的是加利福尼亚鱼龙(Califonosaur-rus), 比值为0.19。
柔腕短吻龙鳍状前肢的前臂和指骨之间距离较远, 桡腕骨、中央腕骨、尺腕骨之间间隙较大, 排列不紧密, 缺少远端腕骨。这表明在其前臂和指骨之间存在范围较大的未骨化中间软骨, 中间软骨与整个前肢比值约为0.51, 占整个前肢的一半。后肢跗部仅见距骨和跟骨, 缺少其他跗部骨骼, 表明在后肢胫腓骨与趾骨之间也有软骨质存在, 跗部中间软骨与整个后肢比值约为0.29。前肢与后肢的比值约为1.71, 前肢明显比后肢发育, 因此腕部软骨范围较跗部更为明显。双孔类陆生爬行动物腕跗部通常比其他部位的肢体骨骼骨化晚, 称为延迟骨化, 这一特征在鱼龙类群中, 仅在早三叠世的巢湖龙中保留[16]。龟山巢湖龙的腕部与前肢的比值约为0.13, 在巢县巢湖龙中这一比值约为0.23[4], 均明显小于柔腕短吻龙。而在后期更加进化的鱼龙(如狭翼鱼龙(Stenopterygius))中, 其腕骨与跗骨均骨化, 未有延迟骨化现象[15]。这可能是由于爬行动物进入海洋后, 随着从陆生爬行到水生游泳的运动方式变化, 腕骨与跗骨所需要的灵活度降低, 所以延迟骨化现象消失。柔腕短吻龙腕部软骨特别发育, 表明其腕部仍具有较高的灵活度, 由此可推断其可能仍具有一定的陆生运动能力。同时, 腕部软骨显著发育是适应水陆两栖生活的脊椎动物共有的特征[4], 通过类比, 也可以推断柔腕短吻龙仍具有在陆地进行有限活动的能力。
柔腕短吻龙与后期鱼龙的另一个显著不同是, 其前肢中部强烈向前弯曲, 前臂主轴与指列之间呈约50°角, 这个角度在左右两个前肢中均保存下来。在鱼龙类群中, 这一弯曲现象不明显(图 1)。柔腕短吻龙前肢弯曲的特征很可能与其仍具有有限的陆地活动能力有关, 该弯曲能起到支撑身体的作用, 类似于陆生爬行动物的肘部, 可增加肢体对身体重力的承受能力。
综上所述, 柔腕短吻龙的前肢达到躯干长的近一半, 这一比例远大于其他鱼龙类, 使前肢能够支撑其身体在陆上活动; 腕部大范围未骨化的软骨则起到肘部的功能, 让前肢在爬行中自由弯曲; 而其腕部特有的弯曲使其在行走的过程中, 鳍状肢的前端仍保持靠近身体, 提高在陆上运动时鳍状肢对身体的支撑作用。柔腕短吻龙的这几个特征均与现生的海狮相似(海狮前肢中部向前弯曲, 利用鳍脚状的前肢支撑身体, 贴着地面缓慢行走)。基于其相似的骨骼结构和比例关系, 柔腕短吻龙可能仍保留在陆地上进行有限活动的能力, 其行走方式与海狮相似。这件标本的发现也表明, 很多早期下海的爬行动物都保留有陆生祖先的结构和特征, 在适应水生生活的同时, 可能仍具有陆地活动的能力。这一发现为探讨海生爬行动物的早起陆生起源和演化等问题提供了新的线索, 也填补了鱼龙陆生祖先与高度适应水生生活的后裔之间的空白环节。
3 巢湖龙的生殖行为特征及其陆生起源现生脊椎动物的生殖方式分为卵生和胎生。卵生指动物受精卵在母体外独立进行发育的生殖方式, 如绝大多数鱼类和爬行动物。胎生是动物受精卵在母体子宫内进行发育的生殖方式, 如绝大多数哺乳动物和部分爬行类[17]。此外还有一些动物, 受精卵虽在母体内发育, 但仍依靠卵内所含卵黄供给营养, 这种与母体联系较少的生殖方式, 也称之为胎生, 如现生的蝮蛇、海蛇、鲨等。发现于乌拉圭和巴西的早二叠世中龙胎生化石, 是最早的爬行类胎生证据[18]。
鱼龙类作为完全适应海洋生活的爬行动物, 以胎生的方式繁育后代。目前在中三叠世至早白垩世的至少6个属中发现胎生证据[5], 然而至今没有确切的证据表明早三叠世鱼龙类的生殖方式。在中三叠世混鱼龙中, 已经发现雌性鱼龙体内含有胚胎化石[19], 表明此类鱼龙已是胎生。传统上认为, 由于它们适应海生生活后, 不能返回到陆地上产卵, 继而演化出羊膜卵在体内孵化的胎生性状来维系种群的繁衍, 是其适应水生生活的结果[20]。因此, 海生爬行类中胎生的生殖方式一直被认为是适应水生生活过程中演化出的次生特征, 与陆生脊椎动物的胎生生殖方式不同源。
对现生爬行动物有鳞类胎生的研究表明, 胎生生殖方式的进化起源与寒冷气候有紧密的联系, 较低的温度是卵生转变为胎生的重要驱动力[21]。卵在母体中孵化, 可以获得较高的孵化温度, 这种体温调节方式在海洋中的影响会降低, 因为海洋的温度与陆地相比更为稳定, 且最低温度值更高[22]。因此, 胎生的生殖方式更可能起源于陆地, 而非海洋。对现生的海生爬行动物海蛇类(hydrophiine sea snakes)的分支系统学研究表明, 它们的原始成员来自陆地的一个胎生演化分支[23]。因此, 它们的胎生很有可能是从陆地祖先继承而来[5]。现生的海龟类虽然高度适应海生生活, 但仍旧回到陆地产卵, 并在陆地孵化出幼体, 幼体出生后即返回海洋生活, 并未进化出在海洋中直接产出幼体的胎生生殖方式。含胚胎巢湖龙标本清晰地保存了巢湖龙生殖时的瞬间, 明确表明鱼龙类演化最早期是胎生的生殖方式。因此, 鱼龙类的胎生生殖方式也应是继承自其陆地祖先, 而非在水生生活的适应过程次生演化出现。
含胚胎巢湖龙标本中的3个幼体具有一个共同的特点:头一致地朝向母体的尾部方向。这种头位的生产方式, 在陆生脊椎动物中普遍存在, 而水生的胎生脊椎动物都是臀位的生产方式, 如现生的鲸类。陆地胎生动物在生产过程中均为头先出而尾后出(如牛羊类), 这样能让新生儿在生产过程中先呼吸到氧气, 从而保证个体存活。反之, 如果新生儿是臀位, 则存在较高的生殖风险, 容易因缺氧导致死亡。在水中生活的胎生动物, 其生产方式则与陆生相反, 其胚胎绝大部分是尾先出(如鲸鱼、海牛等), 这是为避免新生儿在分娩中窒息[24]。现生水生哺乳类鲸目是古偶蹄类的后裔[25], 它们的原始祖先与现生牛羊类的祖先一样, 生活在陆地, 这些陆地祖先的生产方式应与现生陆生偶蹄类的生产方式一致, 头先产出。因此, 现生鲸目尾先出的生产方式, 是其适应水生生活后的次生特征, 这样能保持较高的生殖存活率, 而其胎生的生产方式则是直接继承自陆地祖先, 并非适应水生生活后二次进化而来。在德国侏罗系地层中发现的狭翼鱼龙(Stenop-terygius), 主要生活在开阔海洋中, 其中一具正在娩出幼体的雌性标本(图 1)证明狭翼鱼龙在生产时, 新生儿是尾巴先出产道, 如同现代鲸鱼, 以防止胎儿在完全经过产道之前窒息而死[7]。对比巢湖龙头先出的分娩方式可以看出, 后期鱼龙与现生水生哺乳类一致, 尾先出的生产方式是其在逐步适应水生生活中二次进化而来, 但其胎生的生殖方式则均源于陆地祖先。这种尾先出的生殖方式提高了后期鱼龙类群幼体出生时的存活率, 为鱼龙类的辐射式演化提供了保证。
综上所述, 鱼龙类的胎生生殖方式继承自其陆地祖先, 而不是适应海生生活后进化而来。在鱼龙类下海的初期, 仍旧保持高风险的头位生产方式(如巢湖龙), 可能伴随着相对较高的新生儿死亡率。随着对水生生活的逐步适应, 转变为尾先出的臀位特征, 这是爬行动物适应水生生活的次生特征(表 2)。根据目前的化石证据[4], 巢湖龙是最早完全适应水生生活的爬行动物, 而鱼龙类是最早在海洋中以头位胎生进行生殖的爬行动物。
4 结语
在巢湖动物群中, 除柔腕短吻龙和巢湖龙外, 还发现最早的鳍龙类--马家山龙(Majiashanosau-rus)和大个体、食肉型的龙鱼(Saurichthys)[27], 表明在早三叠世奥伦尼克期斯帕斯亚期, 安徽巢湖地区的海生脊椎动物种类已多样化, 生态系统已经呈现较高的分异度。
以往报道的最早的海生爬行动物化石均发现于斯帕斯亚阶Subcolumbites菊石带[1, 28], 但近年来在巢湖地区发现层位最低的巢湖龙, 位于南陵湖组自然层594层, 对应于Procolumbites菊石带[4], 所以巢湖龙是目前最古老的海生爬行动物化石。因此, 鱼龙类很可能最早起源于中国巢湖地区。
柔腕短吻龙发现于南陵湖组上段的下部(自然层633层), 形态学特征原始, 分支系统分析表明其处于鱼龙形下纲的最基部位置[4]。以往发现的最古老鱼龙类(如巢湖龙和歌津鱼龙)的形态学特征表明其已高度特化适应水生生活, 但缺少鱼龙类从陆地向海洋过渡的证据。柔腕短吻龙的发现填补了这一空白, 其身体结构具水生特征, 但同时仍具多个与陆生双孔类爬行动物相似的可适应陆地生活的特征(如荐前椎数目、短吻、腕部功能发育), 反映其可两栖生活。含胚胎巢湖龙化石首次揭示了最早期鱼龙的生殖方式, 表明巢湖龙虽已完全适应水生生活, 采用胎生的方式繁育后代, 但其生产过程中仍然保持头先出这种胎生陆生动物的生殖方式, 这是首次在鱼龙类中发现头先出的生产方式。中三叠世的混鱼龙的形态结构已经高度适应水生生活, 且具有胎生的生殖方式, 由于缺少化石证据, 目前尚不清楚其生产过程中是采用头位还是臀位方式。至早侏罗世, 狭翼鱼龙(Stenopterygius)的形态结构已特化成“金枪鱼形”, 高度适应水生生活, 其胎生生产方式转变为臀位生产, 与巢湖龙截然相反(表 2)。从时间轴上看, 鱼龙类自下海初期(如鱼龙型的柔腕短吻龙)至高度适应水生生活的演化过程中, 其结构的适应性特征(如肢体的鳍状化、吻部的增长等)比其行为特征(如生产方式的变化)改变得更早。
致谢:感谢江大勇教授对本文研究方法和写作等方面的悉心指导, 同时感谢孙作玉老师和薛进庄老师提出的宝贵修改意见。
| [1] | McGowan C, Motani R. Handbook of paleoherpeto-logy part 8: Ichthyopterygia. München: Verlag Dr Friedrich Pfeil, 2003 |
| [2] | Motani R. On the evolution and homologies of ichthyosaurian forefins. Journal of Vertebrate Paleon-tology , 1999, 19 : 28–41 DOI:10.1080/02724634.1999.10011120 . |
| [3] | Motani R, You H L. Taxonomy and limb ontogeny of Chaohusaurus Geishanensis(Ichthyosauria) with a note on the allometric equation. Journal of Vertebrate Paleontology , 1998, 18 (3) : 533–540 DOI:10.1080/02724634.1998.10011080 . |
| [4] | Motani R, Jiang D Y, Chen G B, et al. A basal Ichthyosauriform with a short snout from the Lower Triassic of China. Nature , 2015, 517 : 485–488 . |
| [5] | Motani R, Jiang D Y, Tintori A, et al. Terrestrial origin of viviparity in Mesozoic marine reptiles indicated by Early Triassic Embryonic fossils. Plos One , 2014, 9 (2) : e88640 DOI:10.1371/journal.pone.0088640 . |
| [6] | Motani R. Evolution of fish-shaped reptiles (Reptilia: Ichthyopterygia) in their physical environments and constraints. Annual Review of Earth and Planetary Sciences , 2005, 33 : 395–420 DOI:10.1146/annurev.earth.33.092203.122707 . |
| [7] | Boettcher R. New information on the reproductive biology of Ichthyosaurs (Reptilia). Stuttgarter Beitra-ege zur Naturkunde Serie B (Geologie und Palaeon-tologie) , 1990, 164 : 1–51 . |
| [8] | 罗默A S, 帕尔森T S.脊椎动物身体.杨白伦, 译.北京:科学出版社, 1985: 128 |
| [9] | Motani R, You H L, McGowan C. Eel-like swimming in the earliest Ichthyosaurs. Nature , 1996, 382 : 347–348 DOI:10.1038/382347a0 . |
| [10] | Sander P M, Chen X, Cheng L, et al. Short-snouted toothless ichthyosaur from China suggests Late Triassic diversification of suction feeding Ichthyo-saurs. Plos One , 2011, 6 (5) : e19480 DOI:10.1371/journal.pone.0019480 . |
| [11] | Nicholls E L, Manabe M. Giant Ichthyosaurs of the Triassic: a new species of "Shonisaurus" from the Pardonet Formation (Norian: Late Triassic) of British Columbia. Journal of Vertebrate Paleontology , 2004, 24 (4) : 838–849 DOI:10.1671/0272-4634(2004)024[0838:GIOTTN]2.0.CO;2 . |
| [12] | Massare J A, Callway J M. The affinities and ecology of Triassic Ichthyosaurs. Bulletin of the Geological Society of America , 1990, 102 (4) : 409–416 DOI:10.1130/0016-7606(1990)102<0409:TAAEOT>2.3.CO;2 . |
| [13] | Chen X H, Motani R, Cheng L, et al. The enigmatic marine reptile Nanchangosaurus from the Lower Triassic of Hubei, China and the phylogenetic affini-ties of Hupehsuchia. Plos One , 2014, 9 (7) : e102361 DOI:10.1371/journal.pone.0102361 . |
| [14] | Motani R, Ji C, Tomita T, et al. Absence of suction feeding Ichthyosaurs and its implications for Triassic Mesopelagic Paleoecology. Plos One , 2013, 8 (12) : e66075 DOI:10.1371/journal.pone.0066075 . |
| [15] | Motani R, You H L. The Forefin of Chensaurus chaoxianensis (Ichthyosauria) shows delayed mesopo-dial ossification. Journal of Paleontology , 1998, 72 (1) : 133–136 DOI:10.1017/S0022336000024069 . |
| [16] | Motani R, Jiang D Y, Tintori A, et al. First evidence of centralia in Ichthyopterygia reiterating bias from paedomorphic characters on marine reptile phyloge-netic reconstruction. Journal of Vertebrate Paleonto-logy , 2015, 35 (4) : e948547 DOI:10.1080/02724634.2014.948547 . |
| [17] | 赵肯堂. 中国的胎生爬行纲动物. 生物学通报 , 1988 (1) : 1–3. |
| [18] | Blackburn D G. Squamate reptiles as model orga-nisms for the evolution of viviparity. Herpetologi-cal Monographs , 2006, 20 (1) : 131–146 DOI:10.1655/0733-1347(2007)20[131:SRAMOF]2.0.CO;2 . |
| [19] | Brinkmann W. Ein Mixosaurier (Reptilia, Ichthyo-sauria) mit Embryonen aus der Grenzbitumenzone (Mitteltrias) des Monte San Giorgio (Schweiz, Kanton Tessin). Eclogae Geologicae Helvetiae , 1996, 89 : 1321–1344 . |
| [20] | 尹恭正, 刘冠邦. 贵州发现珍稀古生物化石:鱼龙类卵胎生的新例证. 贵州地质 , 2005, 22 (2) : 81–82. |
| [21] | 李宏.以蜥蜴为模型研究爬行动物卵胎生进化及其适应意义[D].南京:南京师范大学, 2009 |
| [22] | Sunday J M, Bates A E, Dulvy N K. Global analysis of thermal tolerance and latitude in ectotherms. Proceedings of the Royal Society B: Biological Sciences , 2011, 278 : 1823–1830 DOI:10.1098/rspb.2010.1295 . |
| [23] | Sanders K L, Lee M S Y, Leys R, et al. Molecular phylogeny and divergence dates for Australasian elapids and sea snakes (hydrophiinae): evidence from seven genes for rapid evolutionary radiations. Journal of Evolutionary Biology , 2008, 21 (3) : 682–695 DOI:10.1111/j.1420-9101.2008.01525.x . |
| [24] | McBride A F, Kritzler H. Observations on pregnancy, parturition, and postnatal behavior in the bottlenose dolphin. Journal of Mammalogy , 1951, 32 : 251–266 DOI:10.2307/1375657 . |
| [25] | 彭奕欣. 鲸的起源与演化. 生物学通报 , 2003, 38 (1) : 1–4. |
| [26] | 杨钟健, 董枝明. 中国三叠纪水生爬行动物. 中国科学古脊椎动物与古人类研究所甲种专刊 , 1972 (9) : 11–16. |
| [27] | Jiang D Y, Motani R, Tintori A, et al. The Early Triassic Eosauropterygian Majiashanosaurus disco-coracoidis, gen. et sp. nov. (Reptilia, Sauropterygia), from Chaohu, Anhui Province, People's Republic of China. Journal of Vertebrate Paleontology , 2014, 34 (5) : 1044–1052 DOI:10.1080/02724634.2014.846264 . |
| [28] | Rieppel O. Sauropterygia I // Wellnhofer P. Encyc-lopedia of paleoherpetology, part 12A. München: Verlag Dr Friedrich Pfeil, 2000: 1-134 |
 2016, Vol. 52
2016, Vol. 52