表1 自然光条件下的光强照度(Lux)
Table 1 Light intensity illuminance under natural light conditions (Lux)

位置晴天的白昼阴天的白昼 阳光照射处(1~12)×104约7×103 遮荫处(1~4)×103约1×103
北京大学学报(自然科学版) 第60卷 第1期 2024年1月
Acta Scientiarum Naturalium Universitatis Pekinensis, Vol. 60, No. 1 (Jan. 2024)
doi: 10.13209/j.0479-8023.2023.019
北京大学实验室与设备管理部教学改革经费资助
收稿日期: 2022–12–13;
修回日期: 2023–02–02
摘要 通过植物培养及拍摄系统的开发, 研制低成本的植物活体荧光影像系统。该系统采用双层箱体结构设计, 分为恒温光照培养系统和荧光记录系统两部分, 可以为植物生长发育提供所需的生命支撑功能, 还能实时获取植物生长发育过程中的关键图像, 包括监控转基因植物发育过程中荧光信号的时空模式。利用该系统成功地对EGFP转基因烟草和拟南芥进行培养和实时观察。低廉的成本极大地扩展了该系统在实验教学中的运用, 也为生命活动的观察和检测研究奠定基础。
关键词 仪器研制; 植物活体荧光影像系统; 植物培养实时显微记录仪; 植物培养箱
培养植物材料是植物学研究的日常工作。人工气候室和人工培养箱能够用于控制植物的培养条件, 促进生命科学研究的发展, 尤其适用于研究时间尺度较长的植物发育过程。随着学科的发展, 科研的需求日趋多样化, 了解生命的发育过程成为生命科学研究的重点目标之一, 拥有不同功能的培养记录箱也应运而生。
目前, 已有来自多个国家的公司或科研机构研制、设计并生产的功能多样的活体成像装置。“活体成像(in-vivo imaging)”指研究者在不破坏、不杀死实验材料的情况下, 对其信号(例如整体形貌、荧光蛋白信号、化学发光信号和 X 射线影像等)进行成像, 得到同一个体在整个生命周期中的信息。博益伟业公司的 Lumazone 系统和 Berthold 公司的LB 985 系统可以在目标植物的正常生活状态下, 进行全光谱以及荧光成像, 为研究者提供快捷的检测手段[1–2]。然而, LB 985 高达百万元的售价阻碍了它在实验教学中的广泛应用。
本研究通过荧光激发光源和荧光拍照记录系统的合理结合, 研制植物活体荧光影像系统。我们将这一系统整合到传统的培养箱上, 制做低成本的植物培养实时记录仪。该记录仪可以为植物生长发育提供所需的生命支持功能, 并实时地获取植物生长发育过程中的显微和宏观荧光图像, 监控植物发育过程中的关键因素。通过对拟南芥和烟草进行培养观察, 验证仪器的各种性能指标, 为后续对生命活动进行深入的观察和检测研究奠定基础。
荧光是一种光致的冷发光现象。处于基态的荧光分子吸收激发光, 跃迁到激发态, 经过内转换过程失去部分能量后, 再跃迁回到基态, 发射比激发光波长更长的发射光(即荧光)。激发光与发射光的光谱并不重合, 它们原则上可以区分, 并且在实际应用中可以通过滤光片进行区分, 这就使得观察到的结果仅来自特定空间位置的荧光分子。以此为基础的荧光标记技术已经在生命科学研究中得到广泛应用。
基于荧光成像的原理, 可以将荧光活体成像技术分解为 3 个部分: 1)高灵敏度的光电转换器件, 用来探测微弱的发射光信号; 2)合理的光谱分离系统, 用来从激发光背景中分离发射光; 3)根据光源来切换拍摄系统的控制部件。由于该系统同时记录植物在正常光照下的生长形态, 因此需要在全光谱的环境光和激发光两个不同光源条件下, 切换不同的拍摄系统。
植物培养实时记录仪是一个自动化的植物培养与拍照空间, 培养箱分为上下两个分区, 上层放置各种电路, 下层用于培养植物。相应的控制软硬件整合了诸如光周期控制、拍摄参数控制等培养与记录系统必不可少的功能。
植物培养条件控制包括光照控制与温度控制两部分。
光照控制首先需要合适的光源。光源应当能够提供强度合适、分布均匀、频谱合理的光照, 保证植物能在相同且适宜的光照下生长。我们选择LED轨道灯(35W, 6000K, 简称 LBJ PAR30)作为培养光源, 并测试其强度与频谱特性。此外, 我们通过继电器与相应的控制软件开发环境 LabView, 对植物的生长昼夜节律进行控制。由于白光光照会影响荧光的拍摄, 我们对培养条件控制系统和拍摄系统进行整合, 将培养条件控制系统和拍摄系统通过同一程序进行控制。用户可以通过图形用户界面(GUI)一键开关白光, 并进行荧光成像。
强度是光照的重要指标。实测得到自然光条件下的照度如表 1 所示。在晴朗夏日的正午, 北京户外开阔处的最强光照约为 12×104Lux。参考自然光条件的照度, 我们对人工条件下的照度进行评估。实测得到温室中不同位置的照度为(4.0±0.8)×103 Lux, 可以达到晴天荫蔽处的光照水平。
频谱是光照的另一重要指标。我们检测了常用光源的频谱(图 1)。自然光光谱整体比较平稳, LED灯表现为几个峰的叠加, 荧光灯的光谱由许多尖峰组成。进一步对比自然光与 LED 补光灯可以发现, 3 款 LED 补光灯在 450nm 左右的紫光都具有更多的光谱成分; 在 500~600nm 的绿光与紫光处, LED 轨道灯 PAR30 与已建成温室中的 LED 光源 HY-LED都具有更多的光谱成分, 而 GXP-450LED 与自然光基本上一致。GXP-450LED 在 650nm 左右的红光区提供了额外的光照。到红外区, 只有自然光仍然具有一定强度的光照。总体来看, 我们选用的 LBJ PAR30 与温室正在使用的 HY-LED 补光灯具有相对一致的光谱。
培养箱的拍摄系统是一个集成像与控制为一身的机器视觉系统。一个典型的工业机器视觉应用系统组成包括光照系统、数字摄像机和机器视觉软硬件[3]。
在正常的培养条件下, 培养箱通过植物生长灯为植物提供充足的白色光照。该光照也可以用于拍摄植物的形貌。为拍摄荧光信号的图像, 系统需要合适的荧光激发光源, 包括波段合适的发光元件与激发光滤光片, 这是实现活体荧光成像的关键。数字摄像机也需要配备相对应的滤光片。
表1 自然光条件下的光强照度(Lux)
Table 1 Light intensity illuminance under natural light conditions (Lux)

位置晴天的白昼阴天的白昼 阳光照射处(1~12)×104约7×103 遮荫处(1~4)×103约1×103
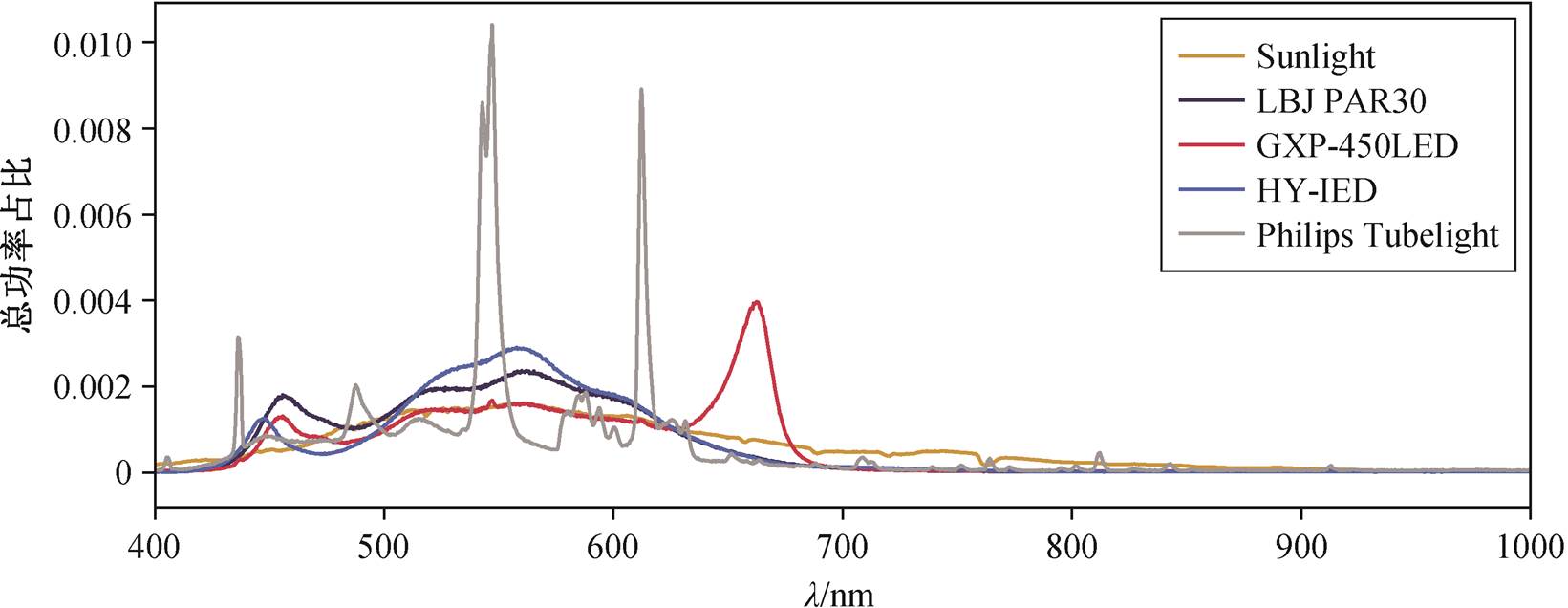
Sunlight: 阳光; LBJ PAR30: LED 轨道灯(35 W, 6000 K); GXP-450LED: 太仓市豪诚实验仪器制造有限公司的 GXP-450LED 培养箱的光源; HY-LED: 皓逸公司的皓悦系列灯具, 为已建成温室中的 LED 光源; Philips Tubelight: 飞利浦公司的 Essential Tubelight 灯具, 为已建成温室中的荧光灯光源
图1 植物培养常用光源的频谱检测
Fig. 1 Spectrum detection of common light sources in plant culture
为了制作频谱合适的激发光源, 我们选择 LED, 因为特定颜色的 LED 具有相对较窄的光谱; 并且, 相较于与滤光片/单色器搭配使用的金卤灯, 在单波长激发光的观测条件下, 与滤光片搭配使用的 LED成本更为低廉。
合适的光源与滤光片组合可以进一步提高荧光影像的拍摄效果[4–5]。选择滤光片的原则如下: 1)激发光与发射光的波段必须完全分离, 避免激发光的反射和散射影响发射光的观测; 2)经滤光片选择后, 荧光分子对激发光的吸收效率应尽可能高, 产生发射光的荧光效率应当尽可能高, 以便提高信号强度; 3)截止波段, 滤光片的 OD 值应足够高, 以便消除反射与散射的激发光。
构建仪器时, 将激发光滤光片置于准直的光源光线后, 发射光滤光片置于视场角较小的相机镜头前。准直的光源光线与较小的视场角都有助于避免滤光片在斜入射条件下展现不同的光学性质。
基于上述选择要点, 选定叶绿体和 EGFP 为需要观测的荧光信号, 在进行多轮尝试之后, 我们的荧光影像系统采用的配置如表 2 所示。发射滤光片固定在自制的滤光片转换器上, 可以实现多通道的观察。
为验证光照系统的有效性, 我们首先分析激发光的光谱(图 2)。在不使用滤光片时, LED 光源的光谱范围相对较宽, 有相当一部分与 EGFP 的发射光谱重合, 并且占据强度较大的波段, 这对发射滤光片的选择是不利的。加装 460~490nm 的滤光片后, 激发光源的光谱显著改善。
进一步, 我们拍摄 PTFE 标准白板在激发光照射下的影像, 验证了发射光与激发光的有效分离。PTFE 标准白板是一种在紫外–可见–近红外(200~ 2500nm)范围内都具有较高反射率(高于 98%)的漫反射材料(图 2(a)), 且不会产生荧光, 可用于检测反射光信号。不同光源与滤光片组合下的 PTFE 影像见图 3。值得注意的是, 对 490~495nm 的青色 LED, 使用 460~490nm 滤光片滤光后, 透过 510nm 长波通滤光片或 523~537nm 滤光片进行观察, 即使经过长曝光(2 分 53 秒), 图像中几乎观察不到 PTFE 漫反射影像。这表明, 上述光源与滤光片的组合有效地隔绝了反射信号。
表2 光源和滤光片参数
Table 2 Light source and filter parameters

光源或滤光片参数 光源490~495 nm青色LED阵列, 20 W 激发滤光片带通滤光片, 460~490 nm, 最大截止深度OD6 (两片OD3胶合) 发射滤光片叶绿素: 长波通滤光片, 510 nm, 最大截止深度OD4 EGFP: 带通滤光片, 523~537 nm, 最大截止深度OD4
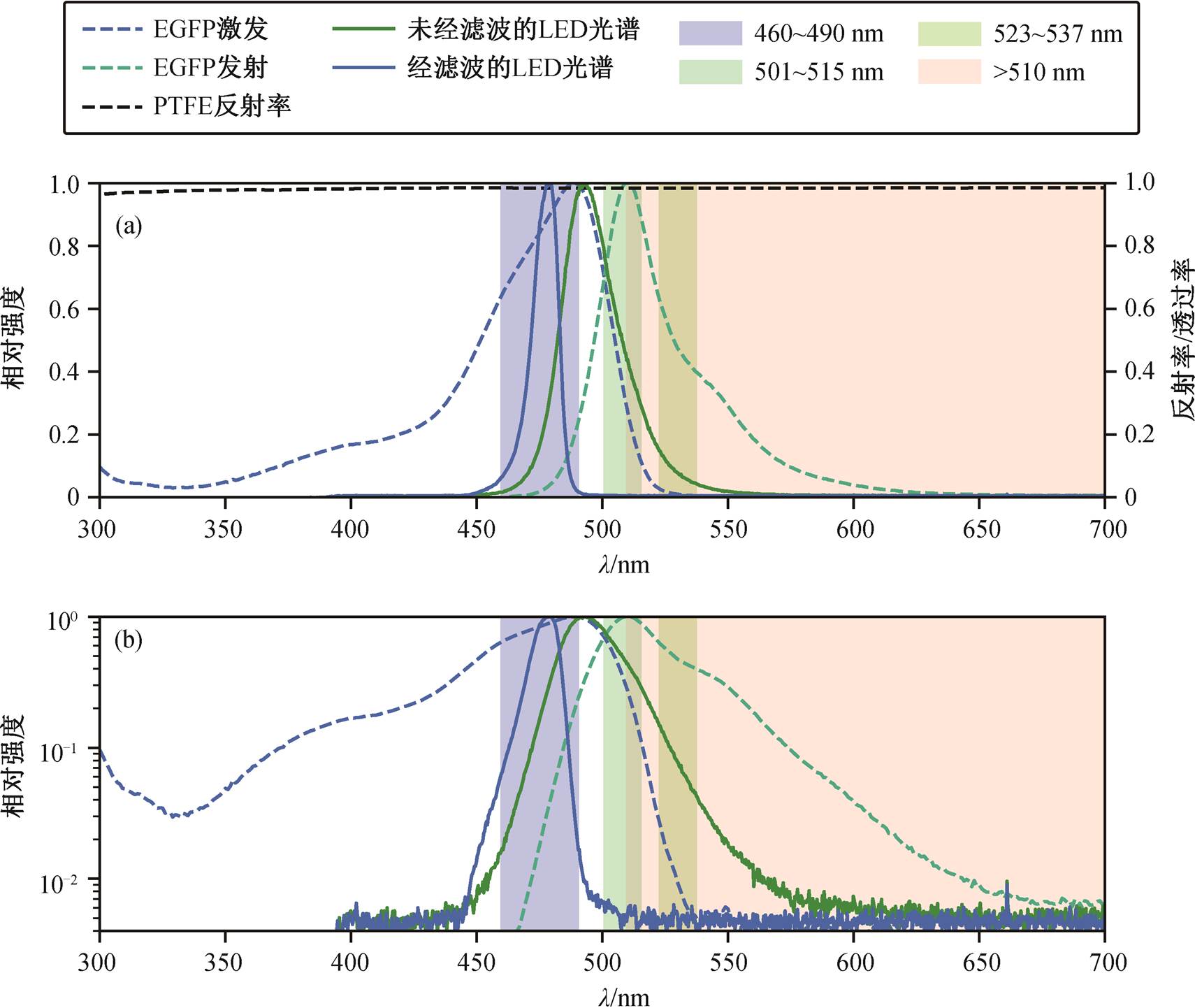
(a)光源、滤光片和 PTFE 的性质, PTFE 反射率数据来自供应商; (b)光源和滤光片的性质, 强度取对数坐标。滤光片的透过率非实测数据, 仅用于示意
图2 LED光源、滤光片、PTFE板和EGFP的光谱性质
Fig. 2 Spectral properties of the LED light source, filters, PTFE plate and EGFP

相机参数设置为Gamma=1, Contrast=0, RGB=(81, 64, 92), ISO=200
图3 不同条件下拍摄的PTFE板影像
Fig. 3 Images of the PTFE plate under different conditions
为了接收图像传感器传回的数字图像信息, 图像传感器/相机的供应商可能会提供闭源的控制软件或者供开发者使用的 SDK (Software Development Kit)。在本文的活体荧光影像系统中, 我们采用相机自带的 TSView7 拍摄软件。该软件提供的拍摄参数包括 Gamma, Contrast 和 ISO 等, 可用于优化照片质量。
为探究目标基因在植物体内的时空表达模式, 研究者可以将该基因的启动子与报告基因进行连接, 构建出的基因片段可用于在植物中表达。报告基因的时空表达模式反映该基因的时空表达模式。其中, 常用的报告基因包括 GUS 和 GFP (绿色荧光蛋白)基因; 常用的模式植物包括拟南芥(Arabido-psis thaliana)和红花烟草(Nicotiana tabacum)。我们检测了 35S:Dips-EGFP 在拟南芥和烟草中的表达模式, 验证了植物活体荧光影像系统的功能。
根据红花烟草和拟南芥的形貌及对应的荧光影像(图 4(a)), 对于活性较好的植株(第 1 行和 2 行), EGFP 转基因植株呈现明显的 EGFP 信号, 而非转基因植株(WT)观察不到信号。对于红花烟草, 叶脉处的 EGFP 信号最强, 可能是因为叶脉比叶片更粗, 也可能与基因表达的调控有关。

(a) 烟草与拟南芥的影像, 左侧植株为 EGFP 转基因植株, 右侧为野生型(WT); >510 nm 对应观察叶绿素荧光, 523~537 nm 对应观察EGFP荧光; 拍摄参数为Contrast = 0, RGB = (81, 64, 92), ISO = 200; 校正前、后分别表示未使用滤光片和使用滤光片后; (b) 不同成分干燥灭菌土壤的影像, 土壤未显示荧光, 拍摄参数为曝光时间2分32秒, Gamma = 0, Contrast = 0, RGB = (81, 64, 92), ISO = 200
图4 荧光影像检测
Fig. 4 Fluorescent image detection
除 EGFP 转基因植物样本外, 我们在土壤和枯萎的叶片中也检测到荧光信号。从图 4(a)可以看出, 观察叶绿素荧光(第 3 列)时, 第 2 行和第 3 行的土壤都观察到显著的荧光信号。观察 EGFP 荧光(第 4列)时, 3 个样品的土壤中都观测到显著的绿色信号。即便扣除 PTFE 板的反射信号本底后, 信号也没有明显减弱(第 5 列)。据此, 我们判定其为荧光信号。此外, 对于枯萎的叶片(第 3 行), 虽然它不能检测到叶绿素的红色信号(第 3 列), 却表现出强烈的绿色荧光(第 5 列和 6 列)。以上两个现象有可能源自荧光成像过程中的常见问题——自发荧光, 即样品在没有经过人工处理时, 自身就具有荧光。因此, 在样品观测时, 应尽量去除植株枯萎的组织和器官。叶绿素荧光实际上也属于自发荧光, 但距离 EGFP 的波段较远, 因此可以使用滤光片将其从观察波段中排除。干燥的灭菌土壤是观察不到荧光的(图 4(b)), 可考虑在周期性覆盖干燥的土壤来排除土壤造成的荧光背景。
经过对转基因烟草和拟南芥的培养观察, 证明此款在植物活体荧光影像系统基础上搭建的植物培养实时记录仪通过恒温光照培养箱与荧光检测记录仪的双向组合, 有效地解决了植物活体生长过程中基因表达观察的难题。
植物培养实时记录仪是在植物活体影像系统基础上搭建的一款功能模块化设计多功能成像平台, 可以最大程度地满足植物科学研究最新的技术需要, 并为顺应实验技术的前沿发展方向, 预留了多种兼容方案。目前, 该记录仪可应用于长时间监测活体植物的生长变化情况, 并在记录的同时, 调控其生长环境。相较于分子水平的研究, 更大时空尺度的研究为科研工作者理解植物中的基因功能及相互作用提供了额外的维度。
参考文献
[1] Berthold. NightSHADE LB 985 in vivo plant ima- ging system [EB/OL]. (2011) [2022–03–31]. https:// www.berthold.com/en/bioanalytic/products/in-vivo-im aging-systems/nightshade-lb985/
[2] 博益伟业仪器有限公司. Lumazone植物活体成像系统(生物发光和荧光)[EB/OL]. (2007) [2022–02–28]. http://www.bio-one.cn/CxcpDetails.aspx?xid=120
[3] 刘秀平, 景军锋, 张凯兵. 工业机器视觉技术及应用. 西安: 西安电子科技大学出版社, 2019: 1–2
[4] 爱特蒙特光学. 荧光滤光片套装, 适用于绿色荧光蛋白(GFP)[EB/OL]. (2022) [2022–04–03]. https:// www.edmundoptics.cn/p/fluorescence-filter-set-for-gr een-fluorescence-protein-gfp/21525/
[5] 爱特蒙特光学. 荧光滤光片套装, 适用于青色荧光蛋白(CFP)[EB/OL]. (2022) [2022–04–03]. https:// www.edmundoptics.cn/p/fluorescence-filter-set-for-cy an-fluorescence-protein-cfp/21522/
Research and Development of Living Plants in-vivo Fluorescence Imaging System for Experimental Teaching
Abstract Through the development of plant culture and imaging system, a low-cost plant living fluorescence imaging system was developed. The system adopts a double-layer box structure design, which is divided into two parts: the constant culture system and the fluorescence recording system. It can provide the necessary life support function for plant growth, and can also obtain the key images in the process of plant growth in real time, including the time-space mode of monitoring the fluorescence signal in the development of the transgenic plant. The EGFP transgenic tobacco and Arabidopsis were successfully cultured and observed in real time using this system. The low cost greatly expanded the application of the system in experimental teaching, and also laid a foundation for the further study of the observation and detection of follow-up life activities.
Key words instrument development; in-vivo fluorescence imaging system for living plants; plant cultivation real-time microscope recorder; plant incubator