
图1 载体架示意图
Fig. 1 Schematic diagram of carrier frame
北京大学学报(自然科学版) 第59卷 第6期 2023年11月
Acta Scientiarum Naturalium Universitatis Pekinensis, Vol. 59, No. 6 (Nov. 2023)
doi: 10.13209/j.0479-8023.2023.091
收稿日期: 2022–12–02;
修回日期: 2023–01–05
摘要 为提高厌氧氨氧化菌在低温(10~15℃)下的脱氮能力, 将厌氧氨氧化菌群在 5℃低温孵育, 探究复苏的厌氧氨氧化菌的低温氮代谢能力。结果表明, 经过 92 天的低温孵育, 厌氧氨氧化菌在 12±1℃的环境温度下脱氮容积负荷达到 225±25 mg N/(L·d), 约为 22±1℃工况下脱氮负荷的 68%, 显著高于以往研究结果。利用 16S rRNA基因高通量测序和主成分分析的方法对反应器内功能微生物菌群进行分析, 发现低温孵育对厌氧氨氧化生物膜上的微生物群落结构的演替有显著的影响。典型厌氧氨氧化菌 Candidatus_Kuenenia 对低温环境的适应性高于 Candidatus_Brocadia 和 Candidatus_Jettenia。低温孵育后 Candidatus_Kuenenia 占比的提高和低温代谢能力的增强, 对于提升厌氧氨氧化反应器在 10~15℃时低温的脱氮性能具有重要作用。
关键词 厌氧氨氧化; 群落结构; 低温脱氮; Candidatus_Kuenenia
厌氧氨氧化是一种低碳高效的自养生物脱氮技术。由于利用亚硝酸盐作为电子受体, 与传统的硝化反硝化的生物脱氮技术相比, 厌氧氨氧化的脱氮路径短, 氮去除负荷高, 无需外加碳源, 污泥产量极低。厌氧氨氧化菌的脱氮负荷高, 在 30℃以上的氮去除负荷达 3kg N/(m3·d)以上。但是, 随着温度的降低, 脱氮速率呈现断崖式的下降[1]。正因如此, 学者们一直在寻求如何提高厌氧氨氧化菌在低温状态下的活性, 并将其应用于主流污水处理工艺中。
目前, 部分学者通过投加微生物固定化载体并结合梯度降温的方式提高厌氧氨氧化菌在低温状态下的活性[2–4], 也有研究者通过改造的功能菌群, 基于信号分子调控的手段提高厌氧氨氧化菌在低温状态下的活性[2,5]。上述方案可在实验室中提高厌氧氨氧化菌在低温下的脱氮性能, 然而在工程应用中, 信号分子的调控还较难进行, 额外投加微生物特殊载体, 无疑也会增加系统的运行成本, 因此亟需探寻一条新的路径来提高厌氧氨氧化菌在低温状态下的活性。
目前已鉴别出的厌氧氨氧化菌主要分为 6 种不同的菌属, 其中 Candidatus_Kuenenia, Candidatus_ Brocadia 和 Candidatus_Jettenia 是实验室较为常见的 3 种菌属。由于实验室常采用模拟配水的方式孵育厌氧氨氧化菌, 这 3 种菌属经常被共同检出。有研究表明, 低温会影响 3 种菌属的丰度占比[6], 意味着不同类型的菌属在不同温度环境下的反应是不一致的。因此, 采用梯级降温的方式将有助于提前筛选出更适应低温环境的菌属。当前的梯度降温主要是将厌氧氨氧化菌的生长环境由 35℃经 2~6 个月逐级降低到 15℃。然而, 即便采用这一方式, 厌氧氨氧化菌的脱氮负荷也会降低近 75%[5,7]。虽然梯级降温的方式能保证厌氧氨氧化菌的部分氮代谢活性, 但效果并不理想。若能在更低的温度下对厌氧氨氧化菌进行孵育, 筛选出适宜低温运行的厌氧氨氧化菌, 并在生物膜表面构建稳定的菌群, 则可能有助于增强其在低温环境下(<15℃)的脱氮能力及运行稳定性。本研究在 5℃下储存孵育厌氧氨氧化生物膜, 构建适应低温运行的厌氧氨氧化菌群, 同时利用 16SrRNA 基因高通量测序技术, 分析主要菌属的演替过程, 鉴定核心代谢菌种。
用于培育厌氧氨氧化生物膜的反应器由进水系统、反应器主体、载体架和出水系统组成, 培育反应器尺寸为 300mm×200mm×350mm, 有效容积为21L。反应器选用亚克力材质制备, 设有盖板, 用于防止空气中的氧气与反应器中的微生物直接接触。同时, 反应器内部有一个推流泵, 用于提高微生物的挂膜效率。载体架用于固定纤维材质编织成的帘式载体, 由若干条状纤维纵向排布制成(图1)。单片帘式载体的面积为 300mm×170mm, 密度为 0.98g/cm3, 用于附着主要微生物菌群。
根据反应器运行的阶段不同, 反应器进水由实际生活废水和模拟废水构成, 模拟废水的物质组成见表 1。废水将预先通过短程硝化处理或额外配置氨氮、亚硝酸盐的方式, 保证反应器进水的氨氮与亚硝酸盐的浓度比在 1~1.2 之间。反应器采用的接种污泥是实验室预先培育的厌氧氨氧化污泥, 污泥投加量约为反应器容积的 1%, 完成前期接种时反应器内的污泥浓度为 100mg/L。
反应器共计运行 202 天, 第 1~80 天为反应器的常温运行阶段, 第81~172天为反应器的低温孵育阶段, 第 173~202 天为反应器的低温运行阶段。其中, 常温运行阶段下, 第 1~8 天为反应器的挂膜启动时间, 在此期间反应器采用序批次进水的方式运行,防止反应器内部未附着在载体上的微生物随水流流失, 期间反应器的进水氨氮和亚硝态氮浓度在 10~ 30mg/L 之间。第 9~26 天为反应器前期启动阶段, 在这一过程中, 反应器的水力停留时间逐步缩短。第 27 天后反应器进入常规运行阶段, 这一过程中进水氨氮、亚硝酸盐的波动较大, 同时水力停留时间逐步缩短至 1.6 小时。由于反应器在项目现场实地运行, 内部水温受环境温度的影响较大, 在水力停留时间为 5 小时以上时, 反应器水温的日波动区间在 23~29℃, 在水力停留时间降至 5 小时以内后, 反应器内部水温基本上维持在 23~28℃。受季节因素影响, 在运行 61 天后, 反应器内部温度降至 20~ 23℃。在低温孵育阶段, 生物膜与载体架一同放入低温反应器, 同时维持外部环境温度为 5±1℃, 并每隔 10 天更换一次模拟废水。在低温运行阶段, 经过孵育的生物膜被再次放入原反应器内, 进水方式与常温运行阶段一致。随着环境温度进一步下降, 第 187 天后, 反应器的内部水温逐渐降至 10℃。

图1 载体架示意图
Fig. 1 Schematic diagram of carrier frame
表1 模拟废水的组成
Table 1 Composition of synthetic wastewater

主要成分浓度/(g·L−1) (NH4)2SO40.10 NaNO20.12 NaHCO30.10 KH2PO40.054 CaCl20.07 KCl0.07 MgSO40.05 NaCl0.01 ZnSO4·7H2O0.043 (NH4)2SO40.10 微量元素浓度/(mg·L−1) FeSO4·7H2O9.5 EDTA-2Na5.5 CoCl2·6H2O0.24 CuSO4·5H2O0.25 H3BO30.014 NaMoO4·2H2O0.22 NiCl2·6H2O0.19 MnCl2·4H2O0.99
使用雷磁 PHB-4 型便携式 pH 计测定反应器内部 pH, 使用雷磁 JPB-607B 型便携式溶解氧测定仪测定反应器进水溶解氧。氨氮、亚硝酸盐、硝酸盐和污泥浓度等指标均采用国家标准方法进行测定。
在反应器运行第 8 天(完成挂膜后)、第 80 天(常温运行结束后)、第 173 天(低温运行开始)和第 186天(温度降至 12±1℃时), 分别对生物膜上的载体进行取样。每次取样时, 分别在生物膜顶部、中部和底部 3 个不同的位置刮取少量污泥样本, 刮取长度约为 5mm, 刮取厚度约为 2mm。混合后, 按照 E. Z.N.A.® soil DNA kit (Omega Bio-tek, Norcross, GA, 美国)试剂盒说明书进行微生物群落总 DNA 抽提, 并使用 1%的琼脂糖凝胶, 通过电泳检测 DNA 的提取质量, 使用NanoDrop2000 测定 DNA 浓度和纯度。使用 338F (5’-ACTCCTACGGGAGGCAGCAG-3’)和 806R(5’-GGACTACHVGGGTWTCTAAT-3’)对 16S rRNA 基因 V3-V4 可变区进行 PCR 扩增[8]。PCR (ABI Gene-Amp® 9700 型)扩增程序如下: 95℃预变性 3 分钟, 27 个循环(95℃变性 30 秒, 55℃退火30 秒, 72℃延伸 30 秒), 然后 72℃稳定延伸 10 分钟, 最后在 4℃进行保存。PCR 反应体系为 5×TransStart FastPfu 缓冲液 4μL, 2.5mmol/L dNTPs 2μL, 上游引物(5μmol/L) 0.8μL, 下游引物(5μmol/L) 0.8μL, Tr-ansStartFastPfu DNA 聚合酶 0.4μL, 模板 DNA 10ng, ddH2O 补足至 20μL。每个样本设置 3 个重复。
将同一样本的 PCR 产物混合后, 使用 2%琼脂糖凝胶回收 PCR 产物, 利用 AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, 美国)进行回收产物纯化, 2%琼脂糖凝胶电泳检 测, 并用 QuantusTM Fluorometer (Promega, 美国)对回收产物进行检测定量。使用 NEXTflexTM Rapid DNA-Seq Kit (Bioo Scientific, 美国)进行建库: 1)接头链接; 2)使用磁珠筛选去除接头自连片段; 3)利用 PCR 扩增进行文库模板的富集; 4)磁珠回收 PCR产物, 得到最终的文库。利用Illumina公司的Miseq PE300/NovaSeq PE250 平台进行测序(上海美吉生物医药科技有限公司)。
使用 fastp[9]软件(https://github.com/OpenGene/ fastp, version 0.20.0)对原始测序序列进行质控, 使用 FLASH[10]软件(http://www.cbcb.umd.edu/software /flash, version 1.2.7)按如下步骤进行拼接。
1)过滤 reads 尾部质量值 20 以下的碱基, 设置50bp 的窗口, 如果窗口内的平均质量值低于 20, 从窗口开始截去后端碱基, 过滤质控后 50bp 以下的reads, 去除含 N 碱基的 reads。
2)根据 PE reads 之间的 overlap 关系, 将成对reads 拼接(merge)成一条序列, 最小 overlap 长度为10bp。

图2 反应器进出水中NH4-N, NO2-N和NO3-N浓度变化(a), 反应器进水氮负荷及氮去除负荷(b)以及反应器第8天、第26天和第80天生物膜状态变化(c)
Fig. 2 Variations of NH4-N, NO2-N and NO3-N removal efficiencies in the reactor (a), change of NLR&NRR (b) and morphology of the biofilm on day 8th, day 26th and day 80th(c)

图3 反应器进出水中NH4-N, NO2-N和NO3-N浓度变化(a)以及反应器进水氮负荷和氮去除负荷(b)
Fig. 3 Variations of NH4-N, NO2-N and NO3-N removal efficiencies in the reactor (a) and change of NLR&NRR (b)
3)拼接序列的 overlap 区允许的最大错配比率为 0.2, 筛选不符合序列。
4)根据序列首尾两端的 barcode 和引物区分样品, 并调整序列方向, barcode 允许的错配数为 0, 最大引物错配数为 2。
使用 UPARSE[11]软件(http://drive5.com/uparse/, version 7.1), 根据 97%[11–12]的相似度, 对序列进行OUT 聚类并剔除嵌合体。利用 RDP classifier[13]软件(http://rdp.cme.msu.edu/, version 2.2), 对每条序列进行物种分类注释, 比对 Silva 16S rRNA 数据库(version 138), 设置比对阈值为 70%。
2.1.1常温运行阶段的脱氮性能
反应器的进出水氨氮、亚硝酸盐和硝酸盐的浓度变化如图 2(a)所示。由于反应器进水采用的是污水厂的实际生活污水, 不同批次的进水氨氮浓度差异巨大。经短程硝化处理后, 反应器的进水氨氮与亚硝酸盐的浓度比可以稳定在 1~1.2 之间。在反应器完成挂膜启动后, 反应器负荷随着水力停留时间的缩短而逐步增长, 反应器的出水氨氮和亚硝酸盐浓度均维持在 1mg/L 以内, 说明反应器内的厌氧氨氧化菌具有良好的脱氮活性。经历60天的运行, 反应器温度降至 23℃以下后, 反应器的脱氮能力呈现一定幅度的降低, 氮去除负荷由 27±1℃下的 551± 50mg N/(L·d)降至 22±1℃下的 331±37mg N/(L·d), 降幅达到 40%, 说明常规厌氧氨氧化生物膜对温度的敏感性很高, 低温显著地限制了厌氧氨氧化菌的脱氮活性。这与部分现有研究结果[2,4–5,7]相似, 即随着温度降低, 厌氧氨氧化菌的活性明显下降。
2.1.2低温运行阶段的脱氮性能
反应器的进出水氨氮、亚硝酸盐和硝酸盐浓度变化如图 3 所示。当载体结束冷藏孵育并置入反应器内 24 小时后, 厌氧氨氧化菌就表现出较高的氮代谢活性, 在进水氨氮和亚硝酸盐浓度分别为 22 和20mg/L 的实际工况下, 反应器的脱氮负荷达到 71mg N/(L·d), 说明低温强化后的厌氧氨氧化生物膜具备一定的低温脱氮能力。由于反应器出水亚硝酸盐的浓度始终维持在 1mg/L 内, 说明反应器具备更高的脱氮能力。经过 7 天的恢复性运行, 随着水力停留时间降低至 6 小时内, 反应器的容积脱氮负荷进一步提高至 164±17mg N/(L·d), 并最终达到 225± 25mgN/(L·d), 此时环境温度已降至 12±1℃。一些研究结果表明, 用梯级降温手段培养的厌氧氨氧化菌, 环境温度每降低 5℃, 其脱氮负荷降低 30%~ 40%[2–3,7,14–15]。当环境温度骤然降低至15℃或断崖式降温 20℃以上时, 厌氧氨氧化的氮去除效率会降低至 50%以下, 甚至完全丧失活性[7,16]。本研究中, 与 22±1℃下 331±37mg N/(L·d)的氮去除负荷相比, 经低温孵育后的厌氧氨氧化菌在 12±1℃下的脱氮负荷达到前者的 68%, 相当于每降低 5℃, 活性仅降低 17.5%, 远好于以往研究结果[17–19]。
为了进一步探究低温孵育对厌氧氨氧化菌群的影响, 对不同阶段生物膜上的厌氧氨氧化菌群进行16SrRNA 基因高通量测序。首先, 对采集样本的细菌测序结果进行主成分分析(principal component analysis, PCA), 探究低温筛分后反应器内微生物群落结构的相似性与差异性。PCA 分析可以在二维坐标图中表征样本间的相似性。样本组成越相似, 在PCA 图中的距离就越近。
如图 4 所示, 选取的样品聚为两类: 常温运行阶段 S1 和低温运行阶段 S2。S1 两个采样点距离较近, 说明在常温运行的工况下, 微生物群落结构没有发生大的改变。S2 两个采样点间距较远, 且与S1 的距离很大, 说明反应器内污泥群落结构发生显著的改变。上述结果表明, 低温孵育对厌氧氨氧化生物膜上的微生物群落结构的演替有显著的影响。
由图 5 可知, 不同运行时期, 生物膜上主要菌群的丰度占比具有较大的差异。从门水平(图 5(a))看, 运行 8 天后的群落结构和运行 80 天后的菌群结构并无明显差异, 经低温孵育后, 厌氧氨氧化功能菌所在的浮霉菌门(Planctomycetota)细菌的丰度由17.4%降至 5.1%, 变形菌门(Proteobacteria)的占比却提高到 49.5%, 说明 5℃下微生物菌群仍进行代谢和演替过程。低温条件限制了浮霉菌门细菌的生长, 提高了变形菌门的相对丰度。当反应器在 10~ 20℃下运行 30 天后, 浮霉菌门细菌的丰度提高到25.6%, 甚至超过常温运行工况的菌群丰度。
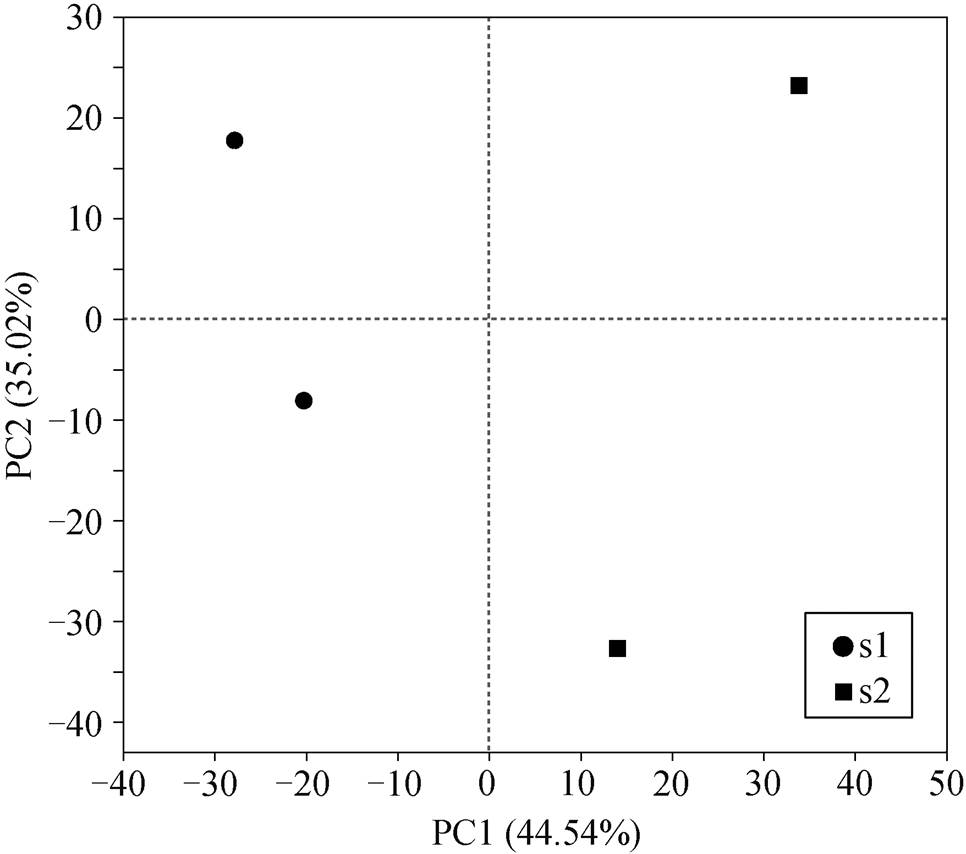
图4 主成分分析
Fig. 4 Principal component analysis
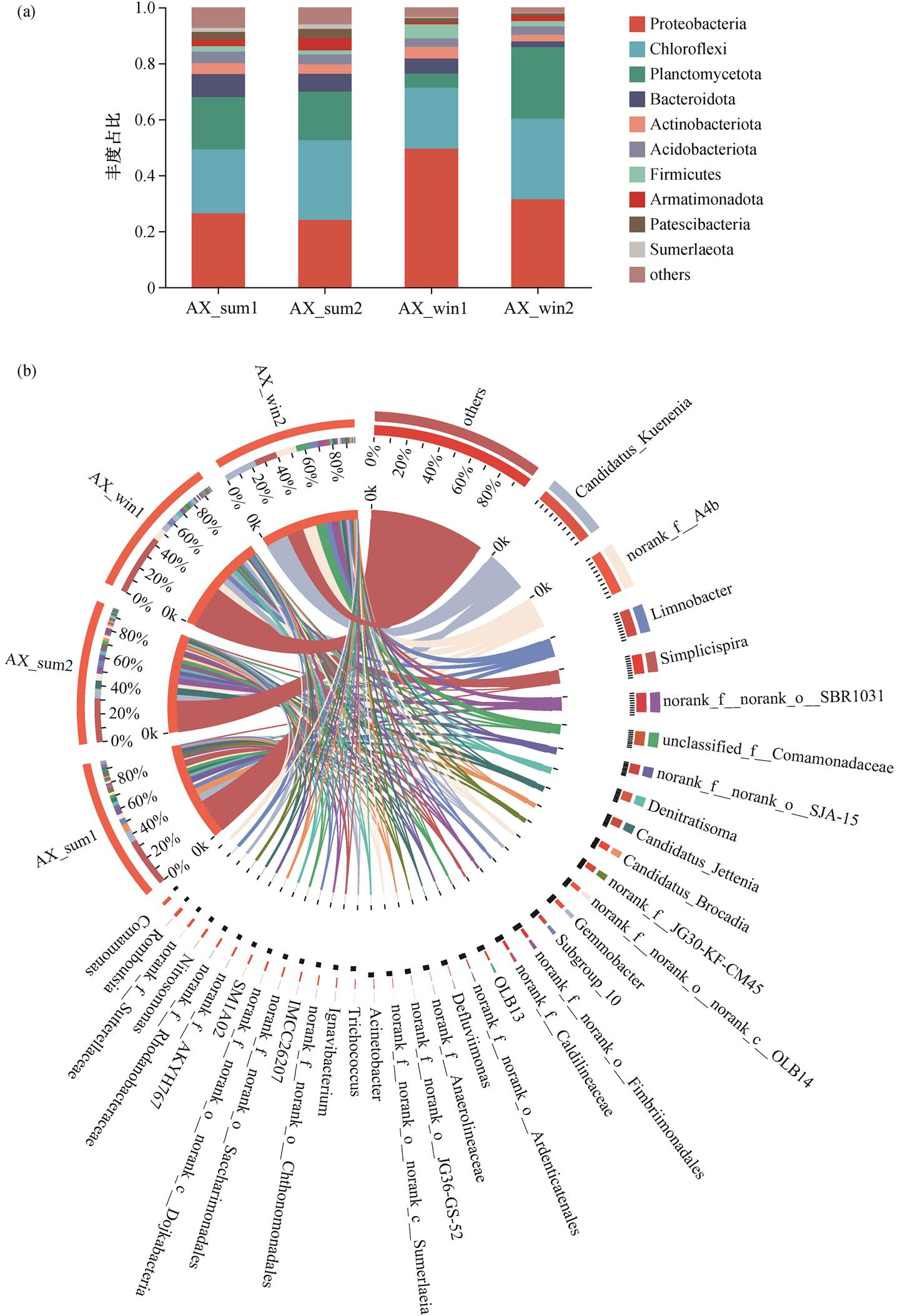
图5 污泥样品在门水平(a)和属水平(b)上的物种分类及丰度占比
Fig. 5 Phylum (a) and genus (b) classification and abundance of four samples in the reactor
进一步比较属水平下厌氧氨氧化菌的相对丰度变化(图 5(b))可以发现, 在完成启动挂膜后, 生物膜上的厌氧氨氧化菌属以 Candidatus_Kuenenia, Can-didatus_Brocadia 和 Candidatus_Jettenia这 3 种典型菌属为主, 丰度分别为 7.4%, 2.2%和 5.8%。随着反应器在室温下运行的结束, Candidatus_Kuenenia 和 Candidatus_Brocadia 的相对丰度提升至 8.8%和5.7%, 而 Candidatus_Jettenia 降至 2 .9%。3 种菌属的相对丰度变化差异不大, 说明生物膜上的厌氧氨氧化菌处于较为稳定的状态, 即便反应器的进水氮负荷存在一定幅度的波动, 主要菌群结构并未受到影响。但是, 在温度降至 20~23℃时, 反应器的氮容积负荷显著降低, 说明现阶段生物膜上的菌群受温度的影响很大, 难以满足厌氧氨氧化在低温运行下的脱氮需求。经低温孵育后发现, Simplicispira 和Gemmobacter 两类菌属的相对丰度由不足 0.1%增至13.3%和 5.5%, 而典型厌氧氨氧化菌 Candidatus_ Kuenenia 的丰度降至 4.6%, Candidatus_Brocadia 和Candidatus_Jettenia 的丰度直接降至 0.1%以下。这表明, 低温极大程度地限制了厌氧氨氧化菌的生长。Candidatus_Kuenenia 在经历 30 天的低温运行后, 丰度直接增至 24.4%, 表明该厌氧氨氧化菌属对低温环境的适应性强于其他两种厌氧氨氧化菌属。虽然部分研究报道 Candidatus_Brocadia 可能更适应低温运行环境[6,14], 但也有部分研究结果表明, 在梯级降温的低温实验中, Candidatus_Kue-nenia 被一同检出[14–15], 甚至有研究表明在 13℃的运行工况下, Candidatus_Kuenenia 的相对丰度可以达到 55.18%[15]。结合本实验中低温孵育后 Candi-datus_Kuenenia 的相对丰度依旧维持在 4.6%这一结果来看, 在更低的温度环境中, Candidatus_Kuene-nia 可能比 Candidatus_Brocadia 具备更好的生存能力。在温度提升至 10℃后, 随着相对丰度从 4.6%快速升高到 24.4%, 反应器的脱氮运行负荷也从 71mg N/(L·d)提高到 225mg N/(L·d)。这一趋势表明, 低温孵育有助于提前筛选出更加适应低温环境的厌氧氨氧化菌及其相应的伴生菌, 有利于保证反应器在低温状态下的脱氮能力。
经过低温孵育后, 将部分载体放入中试反应器内。运行一段时间后, 我们发现反应器在低温状态下依旧表现出较高的脱氮能力, 说明该方式可为该项技术的工程实际应用提供理论依据。
本文通过低温 5℃孵育的方式, 强化了厌氧氨氧化菌在低温状态(尤其是 10~15℃温度区间)下的脱氮性能, 得到如下主要结论。
1)通过低温强化后的厌氧氨氧化菌可在 15℃以下迅速恢复脱氮活性。
2)Candidatus_Kuenenia 对低温环境的适应性高于 Candidatus_Brocadia 和 Candidatus_Jettenia, Can-didatus_Kuenenia 丰度的提高有助于提高厌氧氨氧化菌在低温状态下的脱氮性能。
本研究对厌氧氨氧化菌在低温主流生活污水处理的应用具有指导意义。关于低温菌属与厌氧氨氧化菌的作用以及低温条件下底物合作代谢特性与菌群间的互作关系, 还有待进一步研究。
参考文献
[1] Tang C J, Zheng P, Mahmood Q, et al. Start-up and inhibition analysis of the anammox process seeded with anaerobic granular sludge. J Ind Microbiol Bio-technol, 2009, 36: 1093–1100
[2] Zhou J, Huo T, Sun J, et al. Response of amino acid metabolism to decreased temperatures in anammox consortia: strong, efficient and flexible. Bioresour Technol, 2022, 352: 127099
[3] Lin X, Wang Y, Ma X, et al. Evidence of differential adaptation to decreased temperature by anammox bac-teria. Environ Microbiol, 2018, 20: 3514–3528
[4] Huo T, Zhao Y, Tang X, et al. Metabolic acclimation of anammox consortia to decreased temperature. Environ Int, 2020, 143: 105915
[5] Gong X, Wang B, Qiao X, et al. Performance of the anammox process treating low-strength municipal wastewater under low temperatures: effect of undu-lating seasonal temperature variation. Bioresour Tech-nol, 2020, 312: 123590
[6] 曾涛涛, 李冬, 邱文新, 等. 低温厌氧氨氧化生物滤池群落结构分析. 哈尔滨工业大学学报, 2012, 44: 6–10
[7] Jin R C, Ma C, Yu J J. Performance of an anammox UASB reactor at high load and low ambient tem-perature. Chem Eng J, 2013, 232: 17–25
[8] Li X, Peng Y, Zhang J, et al. Multiple roles of complex organics in polishing THP-AD filtrate with double-line anammox: inhibitory relief and bacterial selection. Water Res, 2022, 216: 118373
[9] Chen S, Zhou Y, Chen Y, et al. Fastp: an ultra-fast all-in-one FASTQ preprocessor. Bioinformatics, 2018, 34: i884–i890
[10] Magoč T, Salzberg S L. FLASH: fast length adjustment of short reads to improve genome assemblies. Bioin-formatics, 2011, 27: 2957–2963
[11] Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nat Methods, 2013, 10: 996–998
[12] Stackebrandt E, Goebel B M. Taxonomic note: a place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacterio-logy. Int J Syst Evol Microbiol, 1994, 44: 846–849
[13] Wang Q, Garrity G M, Tiedje J M, et al. Naive Baye-sian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Appl Environ Micro-biol, 2007, 73: 5261–5267
[14] He S, Chen Y, Qin M, et al. Effects of temperature on anammox performance and community structure. Bio-resour Technol, 2018, 260: 186–195
[15] De Cocker P, Bessiere Y, Hernandez-Raquet G, et al. Enrichment and adaptation yield high anammox con-version rates under low temperatures. Bioresour Tech-nol, 2018, 250: 505–512
[16] Isaka K, Date Y, Kimura Y, et al. Nitrogen removal performance using anaerobic ammonium oxidation at low temperatures. FEMS Microbiol Lett, 2008, 282: 32–38
[17] Kouba V, Hůrková K, Navrátilová K, et al. Effect of temperature on the compositions of ladderane lipids in globally surveyed anammox populations. Sci Total En-viron, 2022, 830: 154715
[18] Rattray J E, Van Vossenberg J D, Jaeschke A, et al. Impact of temperature on ladderane lipid distribution in anammox bacteria. Appl Environ Microbiol, 2010, 76: 1596–1603
[19] Wang X, Yang H. Nitrogen removal performance of anammox immobilized fillers in response to seasonal temperature variations and different operating modes: substrate utilization and microbial community analy-sis. Sci Total Environ, 2022, 829: 154574
Effects of Refrigerate Incubation on Nitrogen Removal Performance and Microbial Community of Anammox
Abstract The anaerobic ammonia oxidation (anammox) consortia were incubated at 5℃ to explore the nitrogen removal performance of the recovered anammox bacteria at 10–15℃. The results showed that after 92 days of low temperature incubation, the nitrogen removal rate of anammox bacteria reached 225±25 mg N/(L·d)at 12±1℃, which reached 68% of the nitrogen removal rate at 22±1℃. It was significantly higher than previous research results. 16S rRNA gene high-throughput sequencing was used to analyze the microbial composition in the reactor. Low temperature incubation had significant impact on the microbial community, especially for anammox bacteria. Candidatus_Kuenenia, as typical anammox bacteria, have a higher adaptability to low temperature than Candidatus_Brocadia and Candidatus_Jettenia, thus dominated the microbial community. The increased abundance and low-temperature metabolic capacity of Candidatus Kuenenia after low temperature incubation play an important role in improving the nitrogen removal performance of anammox reactor at 10–15℃.
Key words anammox; community structure; psychrotolerant denitrification; Candidatus_Kuenenia