述评
doi: 10.13209/j.0479-8023.2023.041
广东省海洋经济发展(海洋六大产业)专项资金(2020-52)资助
收稿日期: 2022–07–12;
修回日期: 2022–09–26
北京大学学报(自然科学版) 第59卷 第4期 2023年7月
Acta Scientiarum Naturalium Universitatis Pekinensis, Vol. 59, No. 4 (July 2023)
海陆交错带红树植物药用资源利用现状及开发对策
王羚郦1,2 张昕1 王健松1,3 沈小雪2 唐丽丽2 李瑞利2,†
1.广州中医药大学中医药数理工程研究院, 广州 510006; 2.北京大学深圳研究生院, 广东省红树林工程技术研究中心, 深圳 518055; 3.广州白云山医药集团股份有限公司白云山制药总厂, 广州 510515;†通信作者, E-mail: liruili@pkusz.edu.cn
摘要 对近 50 年来中国药用红树植物的化学成分和药效研究进行归纳和评述。2000 年以后, 药用红树植物的研究数量呈指数增加, 其中对水黄皮(Pongamia pinnata)的关注度最高。目前已证实药用红树植物有 27 种, 其药用成分主要包括萜类、黄酮类、甾体类、醌类、糖类、苯丙素类和生物碱类。大多数药用红树植物具有抗肿瘤、抗氧化以及抗炎作用, 部分红树植物具有独特的药效, 如抗抑郁和抗阿兹海默症等。已有研究集中在红树植物药效方面, 药理机制尚待解译。最后, 针对中国药用红树植物资源利用存在的问题提出相应的开发对策。
关键词 红树植物; 化学成分; 药理作用
近年来, 新形态疑难杂症的涌现导致现有的药物储备不能很好地满足人类健康的需求, 新药的研发迫在眉睫。对海洋药用生物的开发已成为药物研发的热点之一。
作为生长在热带和亚热带地区潮间带的独特木本植物, 红树林是陆地向海洋过渡的特殊生态系统, 不仅具有护岸固沙、提供生物栖息地等众多生态功能[1], 也是“天然物种库”, 孕育着诸多动物、植物和微生物, 极大丰富了生物多样性[2]。全世界约有70 余种红树林物种, 中国有红树植物 20 科 37 种(其中真红树植物 26 种, 半红树植物 11 种)。我国将红树植物作为药用已有数百年历史, 积累了丰富的红树植物药用经验[3]。红树植物的功效较广泛, 例如鲜品捣碎外敷用于治疗外伤疾病、治疗皮肤溃疡、消炎止痛、治跌打损伤以及促进伤口愈合等; 水煎内服用于清热降火、治疗肠胃不适(腹痛、腹泻)以及祛风除湿等。
目前, 我国已证实具有药用价值的红树植物有27 种(包括 19 种真红树植物和 8 种半红树植物)。红树林植物种类繁多, 特殊的生长环境会使其体内次级代谢物质的多样性与典型的陆地药用植物有所差异。例如, 柠檬苦素一般存在于芸香科植物中, 但有 Ren 等[4]发现红树植物木果楝(Xylocarpus grana-tum)中含有多个新的具有广泛药理活性的柠檬苦素类化合物。药用红树植物具有丰富多样的天然产物结构和生物活性, 可直接作为药物先导化合物进行开发利用, 在抗肿瘤、抗感染、免疫和治疗中枢神经系统药物等方面显示出巨大的优势。
关于药用红树植物的组分及效用的研究较为分散, 多数研究只分析一个或几个红树植物的药效和药理活性, 缺乏系统的归纳和整理。本研究通过文献检索法, 阐述近 50 年来红树植物药用价值的研究进展, 归纳中国药用红树植物化学成分和药理活性的研究情况, 以期为中国药用红树植物的进一步开发利用提供参考。
1 中国药用红树植物的研究现状
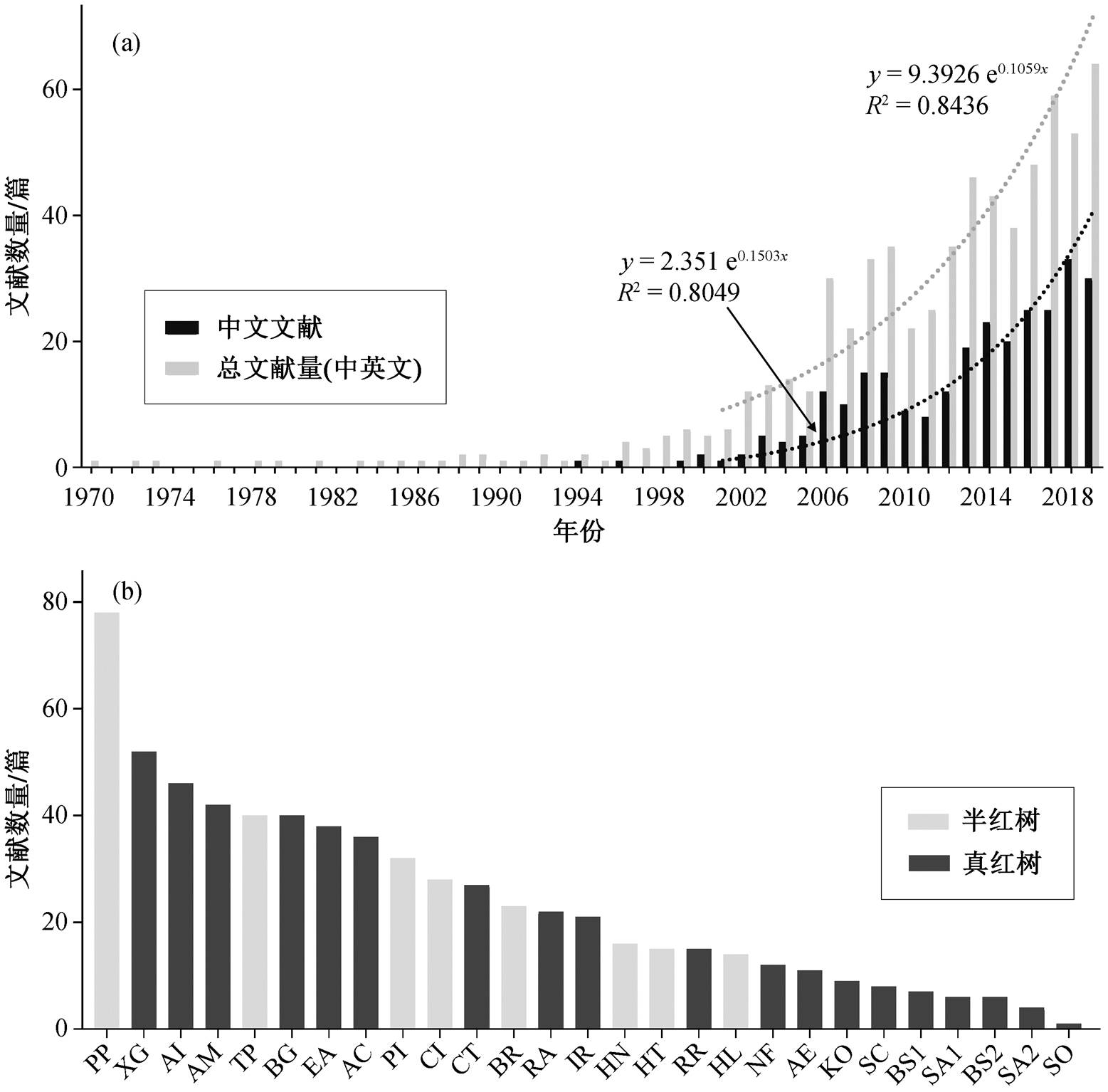
本文基于中国知网、万方数据库、Pubmed、Springer 和 Web of Science 多个数据库, 以中国药用红树植物的中文名和拉丁名以及“药效”、“功效”、“药理作用”、“活性物质”和“有效成分”作为关键词, 检索相关文献。检索时间范围为 1960 年 1 月至2020 年 1 月, 剔除会议通知等不相关内容后, 共得到有效文献 649 篇(其中英文文献 436篇, 中文文献213 篇)。对检索得到的文献进行筛选和分类整理, 总结主要药用红树植物的研究现状(图 1(a))。可以看出, 国内外对红树植物的药用研究始于 1971 年, 从 2000 年开始, 药用红树植物的研究论文数量显著增加, 呈指数增长趋势, 2010 年之后上升趋势有所缓和。虽然国内对红树植物的传统利用较早, 但是现代研究与国外相比较滞后。中文文献最早出现于1994 年, 在 2004 年之后中文论文数量显著上升, 说明红树植物的药用价值受到国内学者越来越多的关注。每种红树植物的总发文量见图 1(b), 其中关于水黄皮(Pongamia pinna-ta)药用研究的论文数量最多(78 篇), 其次是木果楝(52 篇)和老鼠簕(Acanthus ilicifolius)(46 篇), 对秋茄(Kandelia obovata)、木榄(Bruguiera gymnorrhiza)和桐花树(Aegiceras cor-nicelatum)等国内的其他优势种虽有一定程度的研究, 但每种植物的研究论文数量均不超过 40篇, 其中关于秋茄药用价值的研究论文仅有 9 篇。
目前对红树植物成分结构的鉴定不够全面, 对药理作用的机制研究也鲜有报导。我国药用红树植物资源丰富, 且在抗炎、抗肿瘤、抗菌和抗氧化方面的功效均有报道, 但由于实验方法和检测手段的限制等原因, 对这一医药宝库尚未大规模开展有益的探索。对于已知药用红树植物的药效作用, 仍停留在传统医药的定性描述阶段, 缺少对其在药用成分和药效方面的系统研究。
2 中国药用红树植物组分与功效分析
2.1 中国药用红树植物药效作用
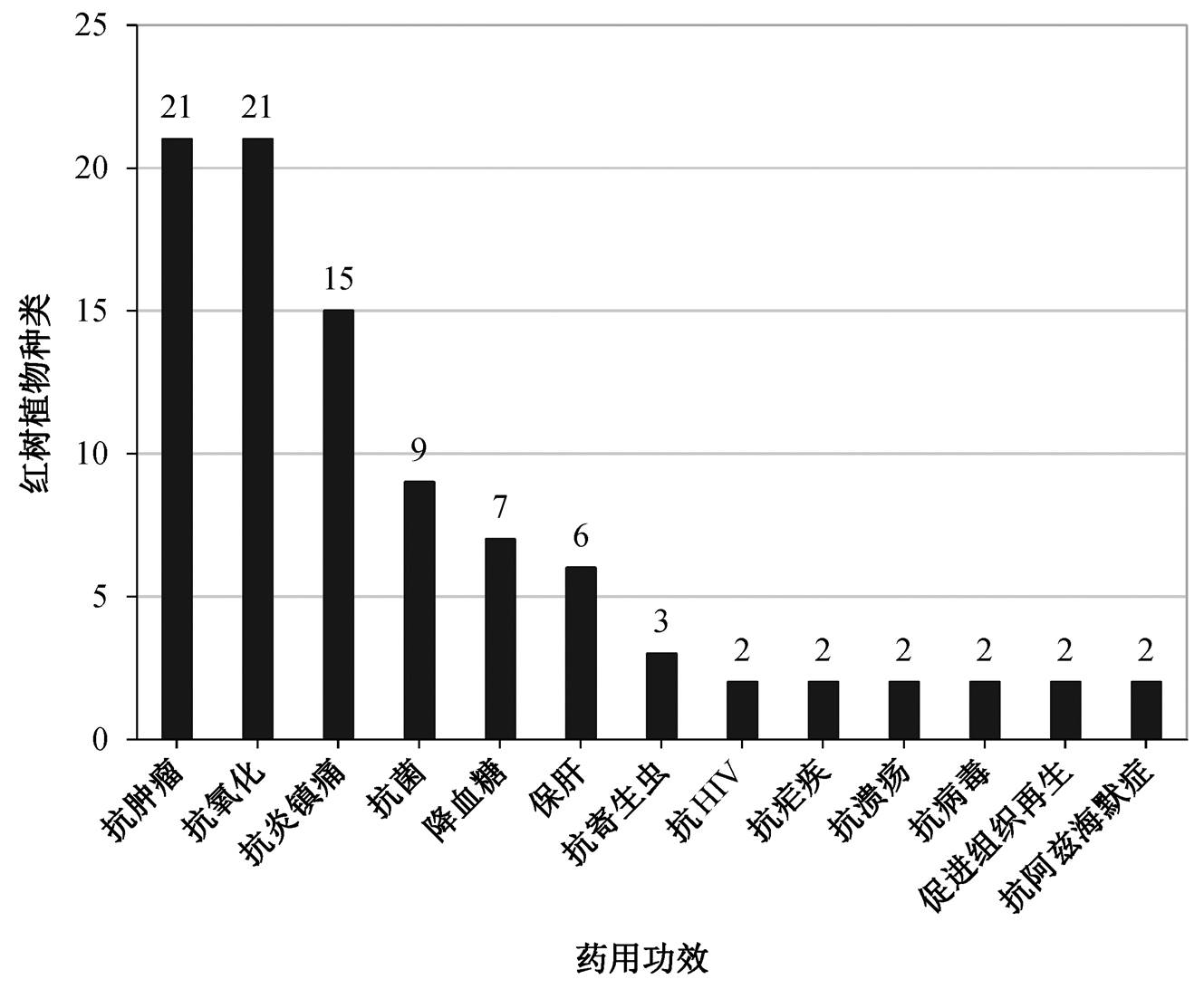
本文对现已报道的 27 种中国药用红树林植物的药效作用进行归纳和总结, 结果如图 2 和表 1 所示。可以看到, 红树植物具有多种不同的药效作用, 包括抗肿瘤(21 种)、抗氧化(21 种)、抗炎镇痛(15种)、抗菌(9 种)、降血糖(7 种)、保肝(6 种)、抗寄生虫(3 种)、抗 HIV(2 种)、抗疟疾(2 种)、抗溃疡(2种)、抗病毒(2 种)、促进组织再生(2 种)、抗阿兹海默症(2 种)、抗血管生成(1 种)、抗抑郁(1 种)、促进创伤愈合(1 种)、止泻(1 种)、促淋巴细胞增殖(1种)、抗胆酰作用(1 种)、抗酪氨酸活性(1 种)、缓解运动型抽搐(1 种)、抗紫外线(1 种)、抑制胰腺脂肪酶(1 种)、抑制肾小管 Ca 离子信号的传导(1 种)、抗肾毒性(1 种)和平喘(1 种)。不同红树植物的药用价值有所差异。
2.2 中国药用真红树植物组分与功效分析
正红树(Rhizophora apiculata)是红树科红树属的高大乔木, 分布于我国海南, 民间用正红树治疗结石和烫伤。近 20 年来, 对正红树的研究集中在药效活性方面, 且均为国外报道。例如, 正红树提取物能显著地降低脂质过氧化作用, 增加线粒体酶活性, 使谷胱甘肽增加至接近对照水平, 表明其中所含多糖可以通过清除自由基起到抗氧化的作用[5]; 从正红树林植物的茎中分离到一个新的二萜类化合物(15(S)-isopimar-7-en-1-oxo-15,16-二醇), 并首次从该植物中分离出 3 种具有较好抗氧化活性的成分, 表明正红树可能是天然抗氧化剂的潜在来源[6–7]。正红树提取物能作为化疗药物的化学保护剂, 减少化疗药物副作用[8]。红树提取物(主要为 4-吡咯烷基、吡唑和酮类衍生物)对小鼠实体瘤的生长具有抑制作用, 具有作为天然抗炎和抗肿瘤药物的潜力[9]。从正红树树皮的氯仿层、水层和乙醇层中分离出多个化合物, 这些化合物均有较好的降血糖功效[10]。除此之外, 正红树在抗结肠炎和护肝方面的作用也有报导[11–12]。
红海榄(Rhizophora rstylosa)为红树科红树属常绿灌木, 分布于我国海南、广东、广西和台湾, 在东南沿海地区有较长的药用历史。近年来针对红海榄化学成分结构的研究较多, 其中所含有的二级代谢成分主要有萜类、黄酮类、酚类、脂肪酸类和甾体类等[13]。红海榄枝的氯仿提取物对多种球菌有抑制效果[14]。从红海榄的茎和枝中分离并鉴定出的 8 个黄烷醇类化合物均具有显著的抗氧化活 性[15]。从红海榄中分离出的黄酮类化合物能显著地提高小鼠脾淋巴细胞增殖的生物活性, 萜类化合物对肿瘤细胞具有一定的抑制作用[16]。从红海榄甲醇提取物中分离出一种新的苷类化合物, 对 3 种人类癌细胞系(KB (表皮样癌)、LU-1 (肺癌)和 SK-MEL-2(黑色素瘤))具有显著的细胞毒性[17]。目前, 国内外对红海榄的研究大多停留在成分的分离鉴定以及抗菌、抗氧化和抗肿瘤的药效方面。
秋茄(Kandelia obovata)隶属红树科秋茄树属, 分布于我国海南、广东、广西、福建、香港、台湾和浙江(引种), 秋茄的根可用于治疗风湿性关节炎。陈虹等[18]在体外实验中发现, 秋茄根的各有机溶剂提取部位对多种细菌均有一定的抑制作用, 包括金黄色葡萄球菌、表皮葡萄球菌、枯草芽胞杆菌和藤黄八叠球菌, 且石油醚提取物对肝癌、胃癌和黑色素瘤等细胞的生长具有较明显的抑制作用。从秋茄叶的甲醇提取物中分离出的 1 个倍半萜类化合物和 3 个愈创木酚化合物与 TRAIL 联合使用, 对致敏 TRAIL 耐药的人胃腺癌细胞具有抑制作用[19]。秋茄中的总黄酮具有广谱抗紫外线及体外抗氧化作用[20]。目前, 针对秋茄的药理研究大多停留在提取物的药效作用方面。
表1 药用红树植物化学成分与药效作用
Table 1 Chemical constituents and pharmacological effects of mangrove plants
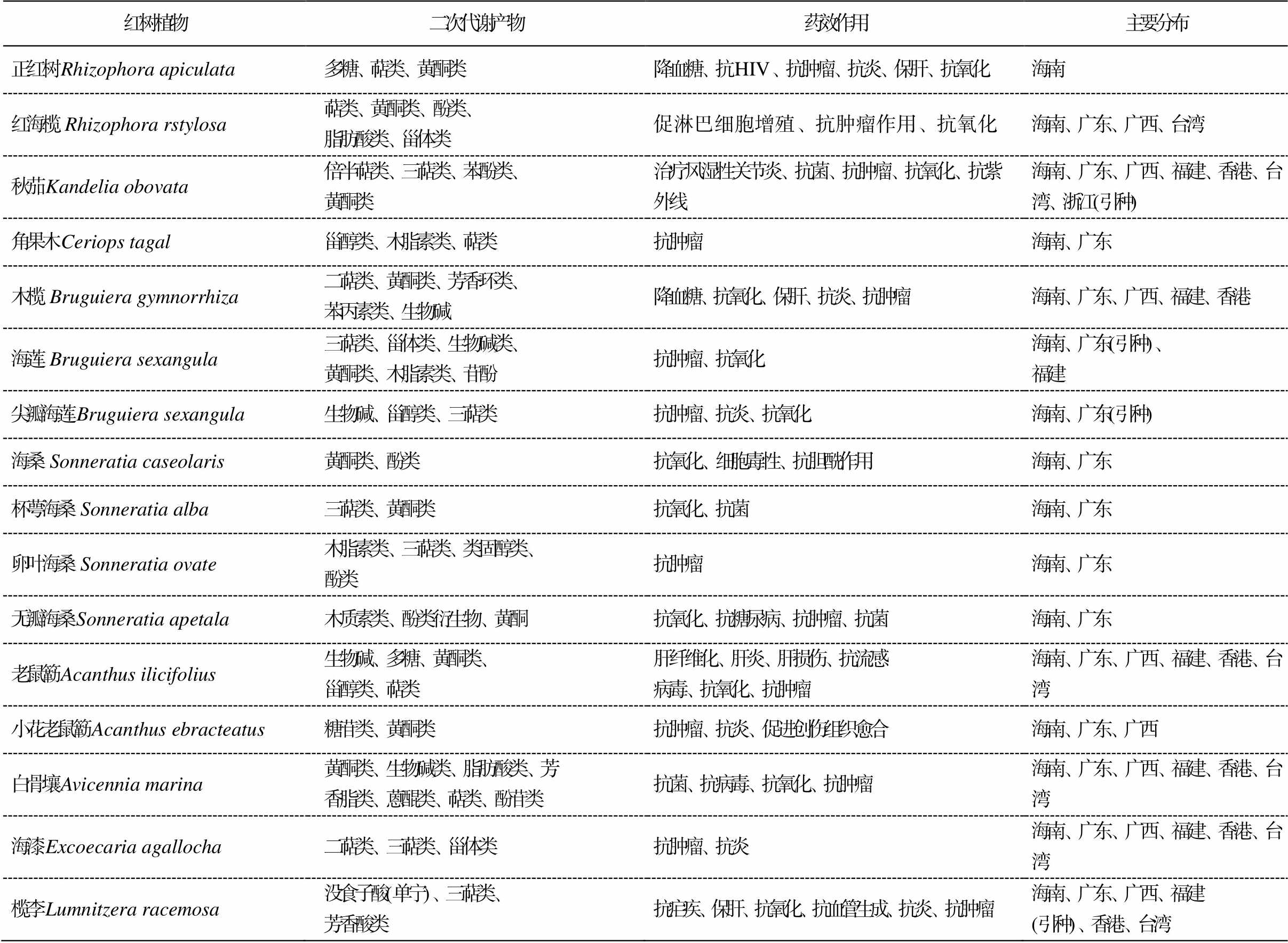
红树植物二次代谢产物药效作用主要分布 正红树Rhizophora apiculata多糖、萜类、黄酮类降血糖、抗HIV、抗肿瘤、抗炎、保肝、抗氧化海南 红海榄Rhizophora rstylosa萜类、黄酮类、酚类、脂肪酸类、甾体类促淋巴细胞增殖、抗肿瘤作用、抗氧化海南、广东、广西、台湾 秋茄Kandelia obovata倍半萜类、三萜类、苯酚类、黄酮类治疗风湿性关节炎、抗菌、抗肿瘤、抗氧化、抗紫外线海南、广东、广西、福建、香港、台湾、浙江(引种) 角果木Ceriops tagal甾醇类、木脂素类、萜类抗肿瘤海南、广东 木榄 Bruguiera gymnorrhiza二萜类、黄酮类、芳香环类、苯丙素类、生物碱降血糖、抗氧化、保肝、抗炎、抗肿瘤海南、广东、广西、福建、香港 海莲 Bruguiera sexangula三萜类、甾体类、生物碱类、黄酮类、木脂素类、苷酚抗肿瘤、抗氧化海南、广东(引种)、福建 尖瓣海莲Bruguiera sexangula生物碱、甾醇类、三萜类抗肿瘤、抗炎、抗氧化海南、广东(引种) 海桑 Sonneratia caseolaris黄酮类、酚类抗氧化、细胞毒性、抗胆酰作用海南、广东 杯萼海桑Sonneratia alba三萜类、黄酮类抗氧化、抗菌海南、广东 卵叶海桑Sonneratia ovate木脂素类、三萜类、类固醇类、酚类抗肿瘤海南、广东 无瓣海桑Sonneratia apetala木质素类、酚类衍生物、黄酮抗氧化、抗糖尿病、抗肿瘤、抗菌海南、广东 老鼠簕Acanthus ilicifolius生物碱、多糖、黄酮类、甾醇类、萜类肝纤维化、肝炎、肝损伤、抗流感病毒、抗氧化、抗肿瘤海南、广东、广西、福建、香港、台湾 小花老鼠簕Acanthus ebracteatus糖苷类、黄酮类抗肿瘤、抗炎、促进创伤组织愈合海南、广东、广西 白骨壤Avicennia marina黄酮类、生物碱类、脂肪酸类、芳香脂类、蒽醌类、萜类、酚苷类抗菌、抗病毒、抗氧化、抗肿瘤海南、广东、广西、福建、香港、台湾 海漆Excoecaria agallocha二萜类、三萜类、甾体类抗肿瘤、抗炎海南、广东、广西、福建、香港、台湾 榄李Lumnitzera racemosa没食子酸(单宁)、三萜类、芳香酸类抗疟疾、保肝、抗氧化、抗血管生成、抗炎、抗肿瘤海南、广东、广西、福建(引种)、香港、台湾
续表
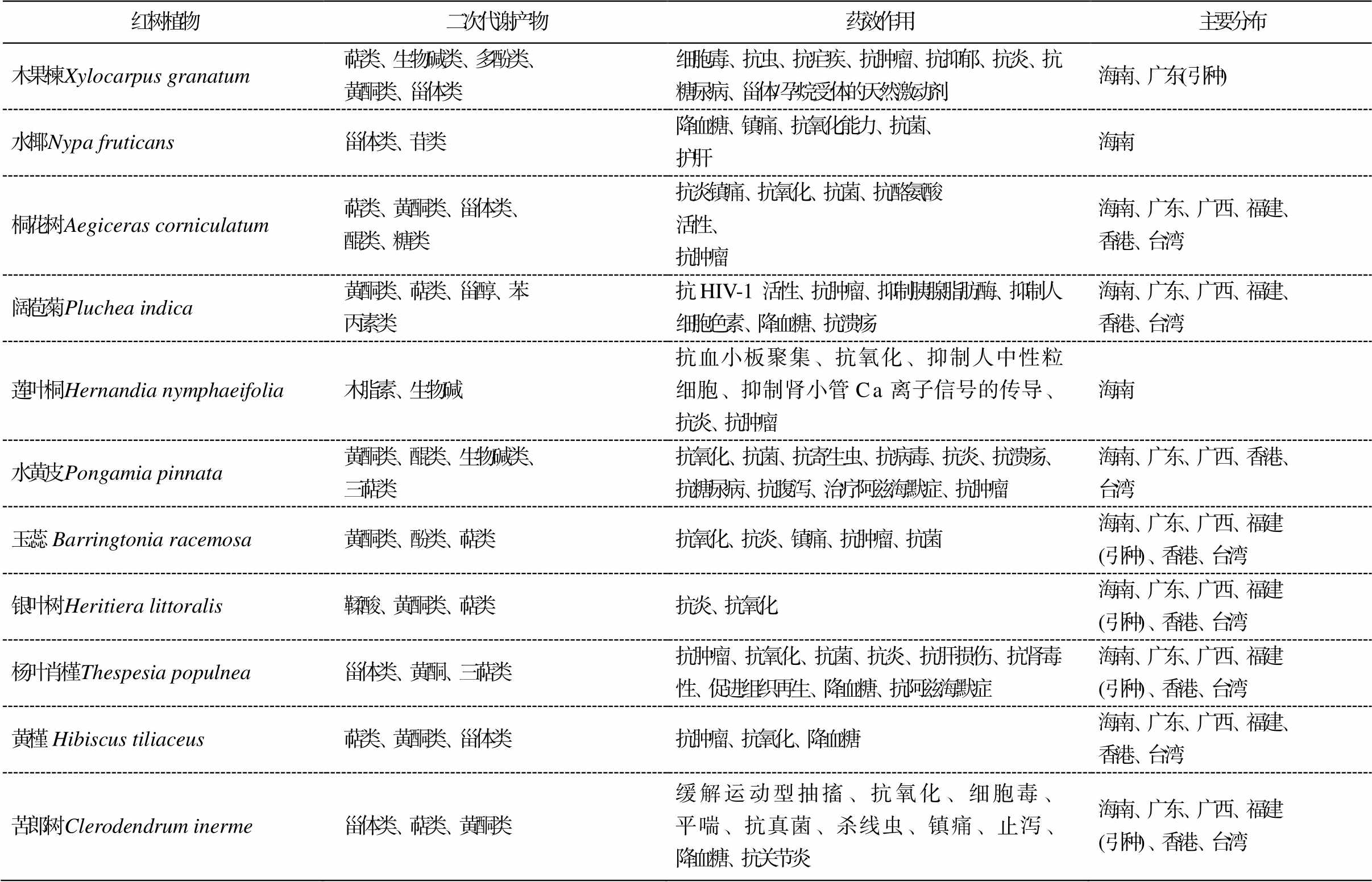
红树植物二次代谢产物药效作用主要分布 木果楝Xylocarpus granatum萜类、生物碱类、多酚类、黄酮类、甾体类细胞毒、抗虫、抗疟疾、抗肿瘤、抗抑郁、抗炎、抗糖尿病、甾体/孕烷受体的天然激动剂海南、广东(引种) 水椰Nypa fruticans甾体类、苷类降血糖、镇痛、抗氧化能力、抗菌、护肝海南 桐花树Aegiceras corniculatum萜类、黄酮类、甾体类、醌类、糖类抗炎镇痛、抗氧化、抗菌、抗酪氨酸活性、抗肿瘤海南、广东、广西、福建、香港、台湾 阔苞菊Pluchea indica黄酮类、萜类、甾醇、苯丙素类抗HIV-1活性、抗肿瘤、抑制胰腺脂肪酶、抑制人细胞色素、降血糖、抗溃疡海南、广东、广西、福建、香港、台湾 莲叶桐Hernandia nymphaeifolia木脂素、生物碱抗血小板聚集、抗氧化、抑制人中性粒细胞、抑制肾小管 Ca 离子信号的传导、抗炎、抗肿瘤海南 水黄皮Pongamia pinnata黄酮类、醌类、生物碱类、三萜类抗氧化、抗菌、抗寄生虫、抗病毒、抗炎、抗溃疡、抗糖尿病、抗腹泻、治疗阿兹海默症、抗肿瘤海南、广东、广西、香港、台湾 玉蕊Barringtonia racemosa黄酮类、酚类、萜类抗氧化、抗炎、镇痛、抗肿瘤、抗菌海南、广东、广西、福建(引种)、香港、台湾 银叶树Heritiera littoralis鞣酸、黄酮类、萜类抗炎、抗氧化海南、广东、广西、福建(引种)、香港、台湾 杨叶肖槿Thespesia populnea甾体类、黄酮、三萜类抗肿瘤、抗氧化、抗菌、抗炎、抗肝损伤、抗肾毒性、促进组织再生、降血糖、抗阿兹海默症海南、广东、广西、福建(引种)、香港、台湾 黄槿 Hibiscus tiliaceus萜类、黄酮类、甾体类抗肿瘤、抗氧化、降血糖海南、广东、广西、福建、香港、台湾 苦郎树Clerodendrum inerme甾体类、萜类、黄酮类缓解运动型抽搐、抗氧化、细胞毒、平喘、抗真菌、杀线虫、镇痛、止泻、降血糖、抗关节炎海南、广东、广西、福建(引种)、香港、台湾
角果木(Ceriops tagal)隶属红树科角果木属, 分布于我国海南和广东。民间常将其树皮和种子捣碎, 治疗痈疽疮疡和各种外伤出血。从角果木中分离的化合物对 HeLa 人宫颈癌细胞系具有一定的抑制效果[21]。目前, 已在角果木中分离到萜类化合物(二萜和三萜)和少部分甾醇类和木脂素类[22]。从发现的活性成分来看, 角果木的萜类提取物大多具有抗肿瘤活性, 如角果木提取物 Tagalsin 能够调控癌症相关基因, 实现抑瘤作用[23]。此外, 从角果木中提取并分离得到 7 个三萜类化合物, 均对人肿瘤细胞株有一定的抑制效果[24]。Zhang 等[25]从角果木中提取到 4 个新的化合物, 能够抑制 4 种乳腺癌细胞株(MDA-MB-453, MDA-MB-231, SK-BR-3和MT-1)的生长。另外, 有研究表明, 角果木不仅对肿瘤细胞的生长具有抑制作用, 而且对多药耐药的肿瘤细胞具有良好的生长抑制活性[26]。因此, 应该从与其他抗肿瘤药物联合使用入手, 达到“增效减毒”的 效果。
木榄(Bruguiera gymnorrhiza)为红树科木榄属植物, 分布于我国海南、广东、广西、福建和香港地区。近年来, 国内外学者已从木榄中分离出二萜类、黄酮类、芳香环类、苯丙素类和生物碱等多种化学成分[27]。木榄的药效有降血糖[28]、抗肿 瘤[29]、抗肝炎[30]、抗氧化[31]、抗炎[32]和神经保 护[33]。值得注意的是, 近几年许多学者对木榄的研究集中在木榄的胚轴上, 目前从木榄胚轴中分离出8 个新化合物, 包括 1 个黄酮苷、3 分菁苷、3 个生物碱和 1 个呋喃酮[34]。从木榄胚轴中发现新化合物和新的药效活性, 是木榄药用研究的一个新方向。
海莲(Bruguiera sexangula)和尖瓣海莲(B. se-xangula)均为红树科木榄属植物, 海莲分布于海南、广东(引种)和福建, 尖瓣海莲分布于我国海南和广东(引种)。国内外对海莲和尖瓣海莲的药理作用和药效物质基础的研究较少, 可能与海莲和尖瓣海莲分布稀少有关。从多个数据库检索的结果来看, 已经从尖瓣海莲中分离得到的化合物主要包括三萜类、甾体类、生物碱类、黄酮类以及木脂素 类[35–36]。对海莲的药效研究主要是针对抗氧化活 性[37–38]和抗肿瘤活性[39]的研究; 对尖瓣海莲的药效研究缺乏系统性, 但从尖瓣海莲中分离到的化合物具有抗肿瘤、抗炎和抗氧化等多种药效功能[40]。
海桑科海桑属植物在全球分布有 9 种, 包括海桑(Sonneratia caseolaris)、杯萼海桑(S. alba)、卵叶海桑(S. ovate)、披针叶海桑(S.lanceolata )和无瓣海桑(S. apetala)等。中国海桑属植物有 6 种, 主要分布在广东和海南[41]。目前, 针对海桑属植物药用价值的研究集中在海桑、杯萼海桑、卵叶海桑和无瓣海桑。海桑具有抗氧化或细胞毒性作用, 花提取物具有一定的抗菌活性。有研究者利用 5 种抗生素敏感菌和 6 种耐药菌对海桑不同部位提取物进行抗菌活性评价, 结果表明海桑甲醇提取物的整体抗菌效果最强[42]。从海桑中分离得到的黄酮类和酚类化合物均具有不同程度的抗氧化作用和乙酰胆碱抑制作用[43–44]。杯萼海桑树皮的甲醇提取物具有显著的抗氧化性能, 其中溶于氯仿层的粗提物活性最强, 四氯化碳可溶性组分对蜡样芽胞杆菌、枯草芽胞杆菌、黄肉芽胞杆菌、铜绿假单胞菌和痢疾志贺氏菌试验菌有中等活性[45]。从杯萼海桑中分离得到新的 lupane 型三萜类化合物也具有抗菌活性[46], 因此, 杯萼海桑有可能成为新型抗生素的潜在来源, 需开展更多药效物质基础方面的研究。卵叶海桑化学成分的研究尚无明确的结论。从卵叶海桑中分离出的两个木质素类化合物和 1 个酚类衍生物对 MCF -7 (人乳腺癌)癌细胞系有毒理作用, 而对正常细胞无毒性[47]。针对无瓣海桑的研究集中在抗氧化、抗糖尿病、抗肿瘤和抗菌活性方面。无瓣海桑的树皮和叶中 4 种溶剂提取物(丙酮、乙醇、甲醇和水)具有较强的抗氧化性, 其中, 无瓣海桑叶的甲醇提取物对鼠 EAC 细胞有 34%的抑制作用, 所有提取物均存在一定的抗糖尿病特性和较强的抗菌活 性[48]。有的研究运用不同有机溶剂对无瓣海桑果实和种子进行分馏, 并开展抗菌、抗腹泻、镇痛和细胞毒性评价, 发现所有组分均能强烈地抑制蓖麻油引起的小鼠腹泻发作和发病时间, 甲醇组分对大肠杆菌、甲型副伤寒沙门菌、伤寒沙门菌、痢疾志贺氏菌和金黄色葡萄球菌(霍乱弧菌除外)具有良好的抑制作用, 正己烷和乙醚组分具有显著的镇痛作用[49]。目前对 4 种海桑属植物药用价值的研究停留在提取物的药效作用考察阶段, 缺乏药理作用机制的研究和有效成分的系统分离。
老鼠簕(Acanthus ilicifolius)为爵床科老鼠簕属植物, 主要分布于海南、广东、广西、福建、香港和台湾。老鼠簕一直是治疗各种疑难杂症的民间良药[50]。国内外对老鼠簕已有诸多研究, 研究部位主要包括叶、花和根[51], 发现的有效成分主要包括甾醇类和萜类[52–53]以及生物碱、多糖和黄酮类等[51]。值得注意的是, 近十年来对老鼠簕的药效研究大多聚焦于其生物碱对肝纤维化[54]和肝损伤[55–56]的影响。老鼠簕中的生物碱 A 能显著地减少肝纤维化大鼠Ⅰ、Ⅲ型胶原的表达, 具有逆转肝纤维化的作用[57]。老鼠簕生物碱 A 及其衍生物保护肝脏抗纤维化的分子生物学机制可能与其抑制 TGF-β1, Sma-d3, TRL4, MAPK 和 α-SMA 等细胞因子的过度表达有关[58]。老鼠簕花的甲醇提取物有抑制自由基活性和抗肿瘤的作用, 具有潜在的抗氧化作用, 也是癌症治疗的候选药物[59]。另外, 老鼠簕中的苯甲酸酯和苯乙醇衍生物具有抑菌活性[60]。老鼠簕生物碱 A 能保护由环磷酰胺导致的小鼠生殖系统损 伤[61]。总之, 国内外对老鼠簕的抗肝损伤和肝纤维化的研究已较深入, 但对老鼠簕抗肿瘤作用的深入研究还较少。
小花老鼠簕(A. ebracteatus)属于老鼠簕属的红树植物, 分布于海南、广东和广西。针对小花老鼠簕成分结构的研究只开展了系统的提取分离和结构鉴定, 共分离 27 个成分, 主要是糖苷类和黄酮类化合物[62]。小花老鼠簕的粗提物能抑制宫颈癌细胞株的生长和血管生成[63]。小花老鼠簕提取物能促进创伤愈合, 在组织再生领域具有潜在的应用价值[64–65]。小花老鼠簕对表皮样癌具有一定的抗癌活性[66]。目前, 国外学者对小花老鼠簕的研究集中在其抗肿瘤以及促进创伤组织愈合的药效方面。
白骨壤(Avicennia marina)属于马鞭草科海榄雌属, 分布于海南、广东、广西、福建、香港和台湾。尽管未收录在中国药典中, 但在民间已有悠久的药用历史, 国内外对白骨壤的茎、叶、皮和果实等部位的药用研究已经相当丰富。在成分研究方面, 已从白骨壤各个部位中分离出 100 多个化合物, 包括黄酮类、生物碱类、脂肪酸类、芳香脂类、醌类、萜类、酚苷类、苯丙素类、木脂素类、糖苷类、多糖和甾醇等次级代谢物质[67]。白骨壤的药效作用主要体现为抗炎、抗氧化和抗肿瘤等[68], 其中具有抗肿瘤活性的成分主要为萜类, 具有抗菌作用的成分主要是黄酮类、生物碱类和醌类, 抗炎活性的成分主要是多糖类和黄酮类等。此外, 有研究者从白骨壤甲醇提取物中导向分离出一个呋喃醌, 能抑制 5α-二氢睾酮的过度产生, 而 5α-二氢睾酮被认为是导致雄激素性脱发的酶[69]。白骨壤乙醇提取物对四氯化碳导致的雄性大鼠肾损伤有一定的保护作用[70]。对白骨壤化学成分的分析研究已较为全面, 而从已知化学成分上开发白骨壤的药用价值是一个值得深入的研究方向。
海漆(Excoecaria agallocha)是大戟科海漆属植物, 分布于我国海南、广东、广西、香港和台湾。海漆具有很高的药用价值, 同时也有较强的毒副作用, 有报道称海漆的乳汁会致皮肤损伤和眼睛失明[71]。海漆在民间已有较长的药用历史, 常用于治疗体实便秘、溃疡和手足肿毒等症[72]。国内外对海漆有效成分的研究集中在萜类和甾体类物质。从海漆的乙酸乙酯和石油醚提取物组分中分离得到多个次级代谢产物(包括二萜类、三萜类、甾体类化合物), 其中二萜类化合物占大多数[73]。因此, 海漆药效物质基础研究都是围绕二萜类成分进行, 从海漆中分离出的 10 个二萜类化合物具有显著的体内抗肿瘤活性[74]。海漆的一个二萜化合物具有抑制NF-κB 的作用, 而 NF-κB 细胞通路与炎症的作用有着密切的联系[75]。从海漆中分离出的两个新的黄酮类化合物能抑制 Hedgehog(Hh)信号通路, 该信号通路被认为与癌症的产生有关[76]。此外, 有研究者发现从海漆中分离出多个多酚成分, 部分成分对丙型肝炎有显著的抑制作用[77]。总之, 海漆的成分和药效研究都集中于甾体和萜类化合物这两类成分, 海漆中其他类型的化合物是否具有潜在的药效, 还需进一步探讨。
榄李(Lumnitzera racemosa)为使君子科榄李属植物, 分布于海南、广东、广西、福建(引种)、香港和台湾, 长期以来主要作为建筑材料和燃料, 大多数对榄李的报道也集中在生态学领域, 对榄李所含的化合物和药效研究较少[78]。然而, 榄李也具有潜在的药用价值, 民间用榄李治疗疱疹和疥疮。近30 年来, 科学家为了阐明榄李的化学结构和药效活性, 不懈地探索。从榄李中分离出的柯子酸对小鼠有较好的抗高血压作用, 而另一成分 Punicalagin (安石榴甙)对小鼠有升血压作用, 使得榄李叶子总提物对外不表现出降血压功效, 其作用机制尚不明确[79]。榄李是一种潜在的抗疟疾药物, 其乙醇提取物具有一定的抗疟原虫活性[80]。从榄李甲醇组分中分离出的外消旋内酯 A 具有抗血管生成和抗炎作用, 而抑制炎症和血管生成被认为是肿瘤发展和转移的有效治疗措施, 揭示了榄李提取物具有一定的抗肿瘤活性[81]。针对榄李的后续研究在抗肿瘤领域可能会是一个热点。
木果楝(Xylocarpus granatum)是我国唯一的木果楝属植物, 主要分布在海南和广东(引种)[82]。国内外许多学者已对木果楝进行大量的研究, 研究部位包括枝叶、果实、种子和树皮。目前已知大约120 种成分, 包括萜类、生物碱类、多酚类、黄酮类、甾体类[83]以及柠檬苦素类化合物[84–85]。在药效方面, 木果楝具有抗虫[86]、抗疟疾[87]和抗肿 瘤[88]活性。近年还发现木果楝中的部分柠檬苦素类化合物具有显著的抗抑郁作用[89–90]。在抗癌机制方面, 从木果楝中提取到的一个木聚糖能抑制Wnt 细胞通路中 TCF/β 连环蛋白的转录活性, Wnt 通路在机体中调控着机体内细胞的增殖和分化, 同时也是一种促癌通路[91]。从木果楝中分离出的两个化合物具有很好的 PTP1B(蛋白酪氨酸磷酸酯酶) 抑制活性, 是 2 型糖尿病相关蛋白, 提示木果楝可能有潜在的抗糖尿病作用, 这是柠檬苦素类化合物PTP1B 抑制活性的首次报道[92]。从木果楝中分离出的 3 个新的柠檬苦素类化合物对脂多糖引起的NF-κB 激活具有抑制作用, 初步揭示了木果楝的抗炎作用机制[93]。总之, 国内外学者对木果楝的研究均集中在柠檬苦素类化合物上。
水椰(Nypa fruticans)是棕榈科水椰属的植物, 分布于海南。近年来, 由于生态环境破坏和人为偷盗, 水椰已成为我国三级重点保护濒危植物。目前, 国内对水椰的化学成分和药理药效的报道[94]较少。国外对水椰的研究近 10 年才见报道, 如水椰的茎叶甲醇提取物具有降血糖和镇痛作用[95], 水椰提取物能抗金黄色葡萄球菌感染[96], 另外, 水椰还能降血糖、抗氧化和护肝[97–98]。
桐花树(Aegiceras corniculatum)是紫金牛科蜡烛果属灌木或小乔木, 分布于我国海南、广东、广西、福建、香港和台湾。桐花树具有较广泛的药用价值, 民间有用其树皮和叶子熬汁, 治疗哮喘、糖尿病和风湿等疾病。在成分研究方面, 已发现桐花树的叶、茎、树皮和胚轴等部位所含化学成分分别有萜类、黄酮类、甾体类、醌类和糖类[99]。在药效作用的研究方面, 桐花树具有多种药效, 包括抗炎镇痛、抗氧化、抗酪氨酸活性、抗衰老和抗过敏[100–101]。在抗肿瘤和抗菌活性方面, 桐花树提取物能调节细胞周期和细胞凋亡, 在不同的结直肠癌细胞系、前列腺癌和其他实体瘤细胞系中具有很强的抗癌活性[102], 从桐花树中分离出的一种化合物对乳腺癌、前列腺癌、结肠癌和黑色素癌均有较好的抑制作用[103]。目前对桐花树药效活性的研究较多, 但对其药理机制的探讨较少。尽管针对桐花树的抗癌作用已陆续有报道, 但其抗肿瘤的作用机制尚不明确, 是以后研究的一个方向。
2.3 中国药用半红树植物组分与功效分析
阔苞菊(Pluchea indica)为菊科阔苞菊属的常绿亚灌木, 分布于我国海南、广东、广西、福建、香港和台湾。阔苞菊分布广, 适应力强, 常成片生长于红树林林缘, 民间常取其根、茎煎水服用, 治疗湿痛和腰痛, 具有解热、发汗和助消化等功效。研究表明, 阔苞菊具有的药效作用包括抗炎、抗溃疡、抗结核、抗人免疫缺陷病毒 1 型(HIV-1)活性、抗肿瘤、抑制胰腺脂肪酶、抑制人细胞色素和抗 α-葡萄糖苷酶(降血糖)等诸多活性[104–105]。针对阔苞菊化学成分的研究包括黄酮类、萜类、甾醇和苯丙素类等[106]。从阔苞菊中分离出咖啡酰奎尼酸类化合物, 而二咖啡酰奎尼酸作为该类化合物的主要成分, 是我国第一个具有自主知识产权的抗艾滋病新药, 但对这类化合物的进一步研究报道有限[107]。
莲叶桐(Hernandia nymphaeifolia)是莲叶桐科莲叶桐属植物, 分布于我国海南。尽管莲叶桐生长速度快, 但由于栖息地的破坏和盗挖, 现仅存于我国的海南和台湾地区, 属于濒危红树植物。对莲叶桐药用价值的报道不多, 有研究者从莲叶桐的树皮中分离出多个生物碱类化合物, 而且分离的化合物具有抗血小板聚集和抗氧化作用[108]; 该研究团队证明了莲叶桐中多个木脂素类化合物能抑制人中性粒细胞和肾小管中 Ca 离子信号的传导[109]; 近几年, 他们再次从莲叶桐的根和果实中分离出新的木脂素类化合物, 且具有抗炎和抗肿瘤作用; 之后还从其树皮中分离得到 3 种新的木脂素类化合物, 对人口腔表皮样癌、大肠癌、肺癌细胞株具有较强的细胞毒性[110–111]。莲叶桐有较好的抗肿瘤作用, 但尚缺乏对莲叶桐有效成分和药效的系统研究。
水黄皮(Pongamia pinnata)是豆科水黄皮属唯一的一种植物, 适应性强, 耐旱亦耐水湿, 生长快, 广泛分布于我国广东、广西、海南、香港和台湾。民间常用其种子榨油, 用于疥癣、脓疮及风湿症的治疗, 也用其花治疗糖尿病。科学家们已从水黄皮的种子、叶、皮和花等部位分离出近 170 个成分, 主要为黄酮、生物碱和三萜等, 且该植物各个部位的化合物类型有一定的规律[112]。水黄皮已被发现的药效作用包括抗氧化、抗菌、抗寄生虫、抗病毒、抗炎、抗溃疡、抗糖尿病和抗腹泻[113–114]。同时, 水黄皮提取物能抗神经退化性疾病, 是治疗阿兹海默症的潜在药物[115–116]。在抗肿瘤活性方面, 水黄皮提取物可以抗骨癌[117]、肺癌[118]和大肠 癌[119]。与其他红树植物相比, 水黄皮的化学成分和药效作用的研究较为广泛和深入。
玉蕊(Barringtonia racemosa)分布于我国海南、广东、广西、福建(引种)、香港和台湾。该属植物有较好的药用价值, 在我国海南有较长的药用历史, 民间常用其根退热, 用其果止咳。玉蕊的主要有效成分包括黄酮类、酚类和萜类化合物(二萜和三萜) 等[120]。已发现的药效包括抗氧化、抗炎、镇痛、抗肿瘤和抗菌[121–122]。目前, 国内外对玉蕊药理机制的系统性研究暂未见报道。
银叶树(Heritiera littoralis)是梧桐科乔木, 存在于我国的海南、广东、广西、福建(引种)、香港和台湾。国内外对银叶树化学成分和药效活性的研究较少, 民间未见药用历史。有学者为高效利用银叶树资源, 开发了从银叶树的果壳中分离单宁的提取工艺[123]。单宁是一种鞣酸, 具有广泛的药用价值。此外, 还有学者从银叶树中分离得到黄酮类和萜类化合物[124]。银叶树在药效学方面仅见抗炎和抗氧化活性的报道[125–126]。
杨叶肖槿(Thespesia populnea)是锦葵科肖槿属的半红树植物, 分布于我国海南、广东、广西、福建(引种)、香港和台湾, 是传统的民间药用植物, 其树皮可用于各种皮肤疾病的治疗, 叶子还具有消炎消肿功效, 果实亦可外用治疗皮癣[127]。有研究者利用现代技术, 从杨叶肖槿的不同部位分离得到许多成分[128]。其中, mansonones (曼宋酮)类化合物是杨叶肖槿中具有特点的次级代谢物质, 表现出明显的抗肿瘤活性, 但对该类化合物的药效作用机制尚未进行深入研究[129–130]。此外, 杨叶肖槿还具有抗氧化、抗菌、抗炎、抗肝损伤、抗肾毒性、抗阿兹海默症、促进组织再生以及降血糖等多种药理作用[129,131–132]。
黄槿(Hibiscus tiliaceus)是锦葵科的常绿乔木, 分布于我国海南、广东、广西、福建、香港和台湾。黄槿是一种半红树植物, 广泛应用于我国滨海地区城镇绿化, 也是防风、防潮和固沙的优良树种。国内外对黄槿的研究集中在植物内生真菌[133]以及环境学[134]方面, 对化学成分和药效活性的研究较少, 主要涉及抗肿瘤、抗氧化和降血糖[135], 但未见深入的药理机制研究。
苦郎树(Clerodendrum inerme)是马鞭草科常绿灌木, 分布于我国海南、广东、广西、福建、香港和台湾。苦郎树适应性强, 生长速度快, 是极佳的防风固沙植物。近 20 年来, 国内外对苦郎树的研究不仅包括育苗造林, 也包括成分和药用价值。苦郎树是泰国的传统药用植物, 其叶片常用来治皮肤病, 在我国则常取其根入药, 可清热解毒、舒经活络。现代研究从苦郎树中分离出多种化学成分, 包括甾体类、萜类和黄酮类等[136]。在药效学研究方面, 苦郎树的乙醇提取物能减轻甲基苯丙胺诱导的小鼠运动过度, 避免造成运动损伤, 具有缓解运动型抽搐的作用[137]。从苦郎树中分离出新的重排枞烷二萜, 具有抗氧化活性和细胞毒活性[138]。苦郎树还具有平喘、抗真菌、杀线虫、镇痛、止泻、抗血浆、降血糖以及抗关节炎等诸多活性[139]。目前, 国内外对苦郎树的研究停留在药效的考察阶段, 缺乏药效物质基础和药理机制方面的研究。
3 中国药用红树植物资源利用与开发存在的问题
1)药理明确的药用红树植物开发利用滞后, 亟需重点推广开发。纵观药用红树植物资源的现代药理研究, 可发现部分红树植物的药理研究已相对全面, 但其药效资源的开发利用却完全空白。以水黄皮为例, 我国民间常用水黄皮内服治疗糖尿病, 外用治疗疥癣和脓疮。现代研究也表明, 水黄皮具有抗炎、抗氧化以及抗糖尿病的作用, 且其作用机制已相对明确, 但并无研究者针对水黄皮的药效进行相关药物和产品的开发利用。尽管民间有一定的药用经验, 但由于缺乏科学指导和安全性评价, 可能会使药效大打折扣, 同时还存在一定的用药风险。目前, 临床上并无有效的药物用于预防和治疗阿兹海默症, 美国食品药品监督管理局批准的胆碱酯酶抑制剂也无法阻止阿兹海默症的疾病进程, 而水黄皮被认为是治疗阿兹海默症的潜在药物。由此可见, 红树资源的开发和利用具有很好的前景, 但目前开发模式单一, 系统性和普及性不足, 亟需重点开发和推广。
2)药效学考察阶段的药用红树植物药用成分及其药效研究亟待加强。除为数不多的几种红树植物(老鼠簕和水黄皮等)有较明确的药理研究外, 大部分红树植物停留在药效学的考察阶段, 如桐花树对乳腺癌、前列腺癌、结肠癌和黑色素癌等多种肿瘤都有很好的抑制作用, 说明其可能是通过阻断多种肿瘤共有的发生机制而发挥作用, 如抑制肿瘤细胞的抗凋亡途径, 抑制细胞周期的进程, 从而抑制肿瘤细胞的增殖, 亦或通过阻断肿瘤细胞的上皮间质转化抑制肿瘤细胞的转移等。但是, 目前对其抗肿瘤机制的基础研究尚属空白。与桐花树研究现状类似的红树植物还有苦郎树、黄瑾和木榄等。
3)药用红树植物开发与保护失衡, 亟需协调发展。由于所处的特殊地理位置(海陆交界), 红树植物体内代谢出许多结构独特、生物活性多样的化合物, 具有巨大的研究价值。除已知的 27 种红树植物外, 中国还有其他 10 种红树植物可能由于资源采集受限或属于濒危保护品种, 目前仍待挖掘和研究。对于这类红树植物, 建议在保护育种的前提下合理采集, 并适当开展部分成分分离和药效学研究, 以期发现新的先导化合物和新功效。值得注意的是, 部分药用红树植物由于遭到人为过度采摘、滥砍滥伐等, 导致其开发和保护失衡, 近年来已有一些红树植物逐渐被列入濒危保护品种。据报道, 国内75%的红树林已纳入保护区, 限制人为活动, 这也成为限制红树植物药用价值开发的主要原因。
4 开发对策
本研究基于大量的文献检索, 结合药用红树植物化学成分和药理活性的研究现状, 对中国药用红树植物药用成分和药效作用的研究提出以下建议。
1)加强珍贵药用红树植物相关药物研发, 开发新型药物。针对在药效作用机理等方面已有深入研究的红树植物种类(包括水黄皮、木果楝和角果木等), 鼓励开展产学研结合的研发模式, 开发新的药物资源, 是今后新药研究的重点之一。在开发新药和新产品研究的同时, 应兼顾开展用药安全性评价(急性毒性和慢性毒性)和最佳用药区间的探索。许多抗肿瘤药物对人体均有较强的毒副作用, 可尝试将药用红树资源与现有化学药物联用, 以期达到“增效减毒”的作用。在进行安全性评价后, 如果发现药用红树资源安全性较高, 可尝试将其开发为补充食品或外用试剂, 拓展红树资源的利用方式。
2)系统地推进药用红树植物的药效学考察, 探究作用机制。针对药用价值研究停留在药效学考察层面的部分药用红树植物, 其相关药效的作用机制研究是今后药用红树植物研究的重点, 也是药用红树植物作为临床用药的前提。红树植物的药理作用机制研究包括体内外药效学考察, 从疾病模型入手分析药物可能的作用靶点, 也可以利用不同疾病的相关性筛选潜在的作用机制。明确红树的化学成分, 对深入研究其药理作用机制也起着关键作用, 红树广泛的药理作用和新药效可能与其所含的不同于陆地植物的化学成分密切相关。
3)践行可持续发展, 缓解药用红树植物保护与开发之间的矛盾。部分未见报道的红树资源也可能具有潜在的药理作用, 值得进一步的研究和开发。如尖瓣海莲和无瓣海桑等在民间均未见药用历史, 但现代研究证明这些红树植物具有一定的药理活性。针对这类植物, 可尝试采用体外模型, 广泛筛选可能存在的药效学作用, 结合现代分析手段, 快速筛选红树中存在的化学成分, 选择药效佳、活性好的植物或成分开展深入的研究, 丰富药用红树资源的种类。近年来, 由于环境改变和人为破坏, 使得部分红树植物成为濒危物种。根据世界自然保护联盟(IUCN)的标准, 卵叶海桑属于极危等级, 小花老鼠簕属于濒危等级, 海桑和海莲属于近危等级, 正红树、尖瓣海莲、莲叶桐、木果楝、水耶、银叶树和玉蕊属于易危等级。对濒危的药用红树植物, 尤其是极危的卵叶海桑, 应该开展育苗技术研发和生境地的保护, 科学地选择宜林地, 实现濒危药用植物自然更新能力的恢复。在妥善保护之余, 应该合理取材, 适度放开药用价值研究。对红树植物体内众多新型次级代谢物质的探究, 有助于补充和完善天然产物的结构和药理活性的多样性, 为揭示化学结构与药理作用之间的关系提供理论支撑, 也为现代化学药物的合成和结构修饰提供参考。
参考文献
[1] 王文卿. 中国红树林. 北京: 科学出版社, 2007
[2] 王亚楠, 傅秀梅, 邵长伦, 等. 中国红树林资源状况及其药用研究调查Ⅰ. 生态功能与价值. 中国海洋大学学报(自然科学版), 2009, 39(4): 699–704
[3] 邵长伦, 傅秀梅, 王长云, 等. 中国红树林资源状况及其药用调查Ⅲ. 民间药用与药物研究状况. 中国海洋大学学报(自然科学版), 2009, 39(4): 712–718
[4] Ren J L, Zou X P, Li W S, et al. Limonoids containing a C1-O-C29 moiety: isolation, structural modification, and antiviral activity. Mar Drugs, 2018, 16(11): 434–450
[5] Vijayavel K, Anbuselvam C, Balasubramanian M P. Free radical scavenging activity of the marine man-grove Rhizophora apiculata bark extract with refe-rence to naphthalene induced mitochondrial dysfunc-tion. Chem Biol Interact, 2006, 163(12): 170–175
[6] Gao M Z, Yuan X Y, Cheng M C, et al. A new di-terpenoid from Rhizophora apiculata. J Asian Nat Prod Res, 2011, 13(8): 776–779
[7] Gao M, Xiao H. Activity-guided isolation of antioxi-dant compounds from Rhizophora apiculata. Molecu-les, 2012, 17(9): 10675–10682
[8] Vinod P V, Guruvayoorappan C. Evaluation of im-munostimulant activity and chemoprotective effect of mangrove Rhizophora apiculata against cyclophos-phamide induced toxicity in BALB/c mice. Immuno-pharmacol Immunotoxicol, 2012, 34(4): 608–615
[9] Prabhu V V, Guruvayoorappan C. Inhibition of meta-static lung cancer in C57BL/6 mice by marine mang-rove Rhizophora apiculata. Asian Pac J Cancer Prev, 2013, 14(3): 1833–1840
[10] Selvaraj G, Kaliamurthi S, Thirugnasambandan R. Effect of Glycosin alkaloid from Rhizophora apiculata in non-insulin dependent diabetic rats and its mecha-nism of action: in vivo and in silico studies. Phytome-dicine, 2016, 23(6): 632–640
[11] Zhang H, Jacob J A, Jiang Z, et al. Hepatoprotective effect of silver nanoparticles synthesized using aque-ous leaf extract of Rhizophora apiculata. Int J Nano-medicine, 2019, 14(3): 3517–3524
[12] Vinod P V, Guruvayoorappan C. Protective effect of marine mangrove Rhizophora apiculata on acetic acid induced experimental colitis by regulating anti-oxidant enzymes, inflammatory mediators and nuclear factor-Kappa B subunits. Int Immunopharmacol, 2014, 18(1): 124–134
[13] 梁成钦, 龚受基, 周先丽, 等. 红海榄化学成分. 中国实验方剂学杂志, 2011, 17(2): 76–79
[14] 朱秋燕, 张晓燕, 龚受基, 等. 红海榄提取物体外抗菌抗肿瘤活性研究. 安徽农业科学, 2010, 38(16): 8417–8418
[15] 周婧, 李钢, 徐静. 红海榄不同部位总酚和总黄酮含量分析及抗氧化活性研究. 食品科技, 2017, 42 (6): 220–224
[16] 杨旭红, 李怀标, 陈虹, 等. 红海榄叶的化学组成及其生物活性. 药学学报, 2008, 43(9): 974–978
[17] Huong P T, Diep C N, Thanh N V, et al. A new cy-cloartane glucoside from Rhizophora stylosa. Nat Prod Commun, 2014, 9(9): 1255–1257
[18] 陈虹, 金国虔, 李萍, 等. 红树植物秋茄根提取 物的体外抑菌与抗肿瘤活性. 中国海洋药物杂志, 2008, 27(5): 15–17
[19] Minakawa T, Toume K, Arai M A, et al. Eudesmane-type sesquiterpenoid and guaianolides from Kandelia candel in a screening program for compounds to over-come TRAIL resistance. J Nat Prod, 2012, 75(8): 1431–1435
[20] 计燕萍, 覃倩菲, 杨芸, 等. 红树秋茄提取物抗氧化及抗紫外活性研究. 北方药学, 2019, 16(2): 7–9
[21] Ouyang X W, Wang X C, Yue Q X, et al. A new dolabrane-type diterpene from Ceriops tagal. Nat Prod Commun, 2010, 5(1): 9–12
[22] 刘喜苹. 海南红树角果木的化学成分研究[D]. 广州: 暨南大学, 2016
[23] 王子熹. 角果木提取物对人卵巢癌裸鼠皮下移植瘤的作用. 齐鲁医学杂志, 2013, 28(3): 199–202
[24] Yang Y, Zhang Y, Liu D, et al. Dolabrane-type diter-penes from the mangrove plant Ceriops tagal with anti-tumor activities. Fitoterapia, 2015, 103: 277–282
[25] Zhang X, Li W, Shen L, et al. Four new diterpenes from the mangrove Ceriops tagal and structure revision of four dolabranes with a 4,18-epoxy group. Fitoterapia, 2018, 124: 1–7
[26] Yang Y, Zhang Y, Liu D, et al. Dolabrane-type diter-penes from the mangrove plant Ceriops tagal with antitumor activities. Fitoterapia, 2015, 103: 277–282
[27] 郑彩娟, 王德能, 夏成明, 等. 木榄属植物的化学成分研究进展. 广东化工, 2014, 41(4): 45–46
[28] 庞冠兰. 红树植物木榄胚轴降糖活性成分的筛选[D]. 桂林: 广西师范大学, 2013
[29] 易湘茜, 高程海, 何碧娟, 等. 红树植物木榄胚轴中苯丙素类化学成分研究. 广西植物, 2013, 33(2): 191–194
[30] Yi X X, Deng J G, Gao C H, et al. Four New Cyclo-hexylideneacetonitrile Derivatives from the Hypoco-tyl of Mangrove (Bruguiera gymnorrhiza). Molecules, 2015, 20(8): 14565–14575
[31] Sur T K, Hazra A, Hazra A K. Antioxidant and hepato-protective properties of Indian Sunderban mangrove Bruguiera gymnorrhiza L. leave. J Basic Clin Pharm, 2016, 7(3): 75–79
[32] Barik R, Sarkar R, Biswas P, et al. 5, 7-dihydroxy-2-(3-hydroxy-4,5-dimethoxy-phenyl)-chromen-4-one-a flavone from Bruguiera gymnorrhiza displaying anti-inflammatory properties. Indian J Pharmacol, 2016, 48(3): 304–311
[33] 周媛, 吴军, 刘朝霞. 木榄提取物及单体化合物对神经细胞保护作用的研究//基层医疗机构从业人员科技论文写作培训会议论文集. 北京: 中国中药杂志社, 2016: 153–154
[34] 龙彬. 红树木榄胚轴化学成分及其抗氧化活性研究[D]. 南宁: 广西大学, 2014
[35] Bao S, Ding Y, Deng Z, et al. Rhyncosides A-F, pheno-lic constituents from the Chinese mangrove plant Bru-guiera sexangula var. rhynchopetala. Chem Pharm Bull, 2007, 55(8): 1175–1180
[36] 曾佳敏, 钟仕花, 钱伟, 等. 水环境中有机磷酸酯的污染现状及其生物毒性. 中国环境科学, 2021, 41(9): 4388–4401
[37] 陶桂兰, 杨帆, 田树红, 等. 海莲叶乙醇提取物的抗氧化作用和对黑素的抑制作用. 中国海洋药物, 2019, 38(3): 59–63
[38] 张旭, 李静, 徐静. 红树林植物海莲不同部位提取物抗氧化活性研究. 热带作物学报, 2017, 38(5): 849–853
[39] 黄绵庆, 陶桂兰, 田树红, 等. 海莲叶提取物对胃癌细胞增殖的抑制作用及对小鼠急性毒性实验. 中国海洋药物, 2018, 37(2): 39–44
[40] Bai J, Fang Z F, Chen H, et al. Antioxidant phenolic glycosides from the roots of Illicium dunnianum. Car-bohydr Res, 2012, 36(1): 206–211
[41] 王瑞江, 陈忠毅. 海桑科的系统进化及地理分布. 广西植物, 2002, 22(3): 214–219
[42] Yompakdee C, Thunyaharn S, Phaechamud T. Bacteri-cidal activity of methanol extracts of crabapple man-grove tree (Sonneratia caseolaris Linn.) against multi-drug resistant pathogens. Indian J Pharm Sci, 2012, 74(3): 230–236
[43] Sadhu S K, Ahmed F, Ohtsuki T, et al. Flavonoids from Sonneratia caseolaris. J Nat Med, 2006, 60(3): 264–265
[44] Wetwitayaklung P, Limmatvapirat C, Phaechamud T. Antioxidant and anticholinesterase activities in various parts of Sonneratia caseolaris (L.). Indian J Pharm Sci, 2013, 75(6): 649–656
[45] Milon M A, Muhit M A, Goshwami D, et al. Antioxi-dant, cytotoxic and antimicrobial activity of Sonne-ratia Alba bark. Int J Pharm Sci Res, 2012, 3(7): 2233–2237
[46] Harizon, Pujiastuti B, Kurnia D, et al. Antibacterial triterpenoids from the bark of Sonneratia alba (Lyth-raceae). Nat Prod Commun, 2015, 10(2): 277–280
[47] Nguyen T H, Pham H V, Pham N K, et al. Chemical constituents from Sonneratia ovata backer and their in vitro cytotoxicity and acetylcholinesterase inhibitory activities. Bioorg Med Chem Lett, 2015, 25(11): 2366–2371
[48] Patra J K, Das S K, Thatoi H. Phytochemical profiling and bioactivity of a mangrove plant, Sonneratia ape-tala from Odisha Coast of India. Chin J Integr Med, 2015, 21(4): 274–285
[49] Hossain S J, Islam M R, Pervin T, et al. Antibacterial, anti-diarrhoeal, analgesic, cytotoxic activities, and GC-MS profiling of Sonneratia apetala (Buch-Ham.) seed. Prev Nutr Food Sci, 2017, 22(3): 157–165
[50] 谢丽莎, 廖月葵, 黄权芳, 等. 药用红树植物老鼠簕的生药学研究. 中国中药杂志, 2005(19): 25–27
[51] Zhao D, Xie L, Yu L, et al. New 2-benzoxazolinone derivatives with cytotoxic activities from the roots of Acanthus ilicifolius. Chem Pharm Bull, 2015, 63(12): 1087–1090
[52] 海芳, 唐旭利, 李国强. 红树植物老鼠簕中的甾醇和萜类成分. 天然产物研究与开发, 2010, 22(4): 597–599
[53] 海芳. 药用红树植物老鼠簕Acanthus ilicifolius化学成分及其生物活性研究[D]. 青岛: 中国海洋大学, 2009
[54] Liu L, Fan H, Qi P, et al. Synthesis and hepatopro-tective properties of Acanthus ilicifolius alkaloid A and its derivatives. Exp Ther Med, 2013, 6(3): 796–802
[55] 沐小敏, 韦朋海, 徐斌, 等. 老鼠簕醇提物抗鸭乙型肝炎病毒及护肝作用的实验研究. 现代预防医学, 2015, 42(4): 689–693
[56] Wei P H, Wu S Z, Mu X M, et al. Effect of alcohol extract of Acanthus ilicifolius L. on anti-duck hepatitis B virus and protection of liver. J Ethnopharmacol, 2015, 160(25): 1–5
[57] 韦明中, 莫思燕, 邱金慧, 等. 老鼠簕生物碱A对肝纤维化大鼠Ⅰ、Ⅲ型胶原表达的影响. 广西医科大学学报, 2015, 32(6): 891–894
[58] 梁颖娥. 老鼠簕生物碱A及其衍生物抗大鼠肝纤维化作用及对相关因子表[D]. 南宁: 广西医科大学, 2013
[59] Firdaus M, Prihanto A A, Nurdiani R. Antioxidant and cytotoxic activity of Acanthus ilicifolius flower. Asian Pac J Trop Biomed, 2013, 3(1): 17–21
[60] Ravikumar S, Raja M, Gnanadesigan M. Antibacterial potential of benzoate and phenylethanoid derivatives isolated from Acanthus ilicifolius L. leaf extracts. Nat Prod Res, 2012, 26(23): 2270–2273
[61] 韦贤, 彭兴, 王金妮, 等. 老鼠簕生物碱A对环磷酰胺致小鼠生殖系统损伤的保护作用. 右江民族医学院学报, 2018, 40(2): 103–107
[62] Kanchanapoom T, Kasai R, Picheansoonthon C, et al. Megastigmane, aliphatic alcohol and benzoxazinoid glycosides from Acanthus ebracteatus. Phytochemis-try, 2001, 58(5): 811–817
[63] Mahasiripanth T, Hokputsa S, Niruthisard S, et al. Effects of Acanthus ebracteatus Vahl on tumor angio-genesis and on tumor growth in nude mice implanted with cervical cancer. Cancer Manag Res, 2012, 4: 269–279
[64] Somchaichana J, Bunaprasert T, Patumraj S. Acanthus ebracteatus Vahl. ethanol extract enhancement of the efficacy of the collagen scaffold in wound closure: a study in a full-thickness-wound mouse model. J Bio-med Biotechnol, 2012, 2012: 754–527
[65] Rusak A, Rybak Z. New directions of research related to chronic wound healing. Polim Med, 2013, 43(3): 199–204
[66] Khamwut A, Jevapatarakul D, Reamtong O, et al. In vitro evaluation of anti-epidermoid cancer activity of Acanthus ebracteatus protein hydrolysate and their effects on apoptosis and cellular proteins. Oncol Lett, 2019, 18(3): 3128–3136
[67] Sharaf M, El-Ansari M A, Saleh N A. New flavonoids from Avicennia marina. Fitoterapia. 2000, 71(3): 274–277
[68] Yang X W, Dai Z, Wang B, et al. Antitumor triterpenoid saponin from the fruits of Avicennia marina. Nat Prod Bioprospect, 2018, 8(5): 347–353
[69] Jain R, Monthakantirat O, Tengamnuay P, et al. Avice-quinone C isolated from Avicennia marina exhibits 5al-pha-reductase-type 1 inhibitory activity using an and-rogenic alopecia relevant cell-based assay system. Mo-lecules, 2014, 19(5): 6809–6821
[70] Mirazi N, Movassagh S N, Rafieian-Kopaei M. The protective effect of hydro-alcoholic extract of man-grove (Avicennia marina L.) leaves on kidney injury induced by carbon tetrachloride in male rats. J Neph-ropathol, 2016, 5(4): 118–122
[71] Kumarasinghe S P, Seneviratne R. Skin and eye injury due to latex of Excoecaria agallocha. Australas J Der-matol, 1998, 39(4): 275–276
[72] 宁小清, 陈卫卫, 谈远锋, 等. 海漆的生药鉴别研究. 中药材, 2010, 33(11): 1717–1720
[73] Anjaneyulu A S, Rao V L, Sreedhar K. Agallochins J-L, new isopimarane diterpenoids from Excoecaria aga-llocha L. Nat Prod Res, 2003, 17(1): 27–32
[74] Konoshima T, Konishi T, Takasaki M, et al. Anti-tumor-promoting activity of the diterpene from Excoe-caria agallocha. II. Biol Pharm Bull, 2001, 24(12): 1440–1442
[75] Jiang Z P, Zou B H, Li X J, et al. Ent-kauranes from the Chinese Excoecaria agallocha L. and NF-κB inhibitory activity. Fitoterapia, 2019, 133: 159–170
[76] Rifai Y, Arai M A, Sadhu S K, et al. New Hedge-hog/GLI signaling inhibitors from Excoecaria agallo-cha. Bioorg Med Chem Lett, 2011, 21(2): 718–722
[77] Li Y, Yu S, Liu D, et al. Inhibitory effects of poly-phenols toward HCV from the mangrove plant Excoe-caria agallocha L. Bioorg Med Chem Lett, 2012, 22 (2): 1099–1102
[78] 陈利洪. 红树濒危植物红榄李的保护生物学研究[D]. 南宁: 广西大学, 2007
[79] Ta-Chen I, Feng-Lin H, Juei-Tang C. Antihypertensive activity of corilagin and cheb ulinic acid, tannins from Lumnitzera Racemosa. J of Nat Prod, 1993, 56(4): 629–632
[80] Ravikumar S, Gnanadesigan M. Hepatoprotective and antioxidant activity of a mangrove plant Lumnitzera racemosa. Asian Pac J Trop Biomed, 2011, 1(5): 348–352
[81] Yu S Y, Wang S W, Hwang T L, et al. Components from the leaves and twigs of mangrove Lumnitzera race-mosa with anti-angiogenic and anti-inflammatory effe-cts. Mar Drugs, 2018, 16(11): 404
[82] 姚轶锋, 廖文波, 宋晓彦, 等. 海南三亚铁炉港红树林资源现状与保护. 海洋通报, 2010, 29(2): 150–155
[83] 李韶静. 木果楝小枝化学成分研究[D]. 石家庄: 河北医科大学, 2019
[84] Shi X, Wu Y, Lv T, et al. A chemometric-assisted LC-MS/MS method for the simultaneous determination of 17 limonoids from different parts of Xylocarpus grana-tum fruit. Anal Bioanal Chem, 2017, 409(19): 4669–4679
[85] Wu Y B, Wang Y Z, Ni Z Y, et al. Xylomexicanins I and J: Limonoids with unusual B/C rings from Xylo-carpus granatum. J Nat Prod, 2017, 80(9): 2547–2550
[86] Misra S, Verma M, Mishra S K, et al. Gedunin and photogedunin of Xylocarpus granatum possess antifi-larial activity against human lymphatic filarial parasite Brugia malayi in experimental rodent host. Parasitol Res, 2011, 109(5): 1351–1360
[87] Lakshmi V, Srivastava S, Mishra S K, et al. Antima-larial activity in Xylocarpus granatum (Koen). Nat Prod Res, 2012, 26(11): 1012–1015
[88] 李明, 刘霞, 郭书翰, 等. 木果楝内酯抑制人乳腺癌脑转移细胞增殖活性的研究. 解放军医学院学报, 2013, 34(8): 865–868
[89] 石晓伟. 木果楝柠檬苦素的质谱分析与抗抑郁研究[D]. 石家庄: 河北医科大学, 2017
[90] Gao Q, Gao Y, Song H, et al. Cipadesin A, a bioactive ingredient of Xylocarpus granatum, produces antide-pressant-like effects in adult mice. Neurosci Lett, 2016, 6(33): 33–39
[91] Toume K, Kamiya K, Arai M A, et al. Xylogranin B: a potent Wnt signal inhibitory limonoid from Xylocarpus granatum. Org Lett, 2013, 15(23): 6106–6109
[92] 郭跃伟, 周振芳. 红树林植物木果楝的化学成分及生物活性研究//全国第九届海洋生物技术与创新药物学术会议. 赤峰, 2014: 99
[93] Liu R X, Liao Q, Shen L, et al. Krishnagranatins A‒I: new limonoids from the mangrove, Xylocarpus grana-tum, and NF-κB inhibitory activity. Fitoterapia, 2018, 13(1): 96–104
[94] 张偲, 南海函, 尹浩. 水椰的化学成分研究. 中国海洋药物杂志, 2008, 27(1): 40–42
[95] Reza H, Haq W M, Das A K, et al. Anti-hyperglycemic and antinociceptive activity of methanol leaf and stem extract of Nypa fruticans Wurmb. Pak J Pharm Sci, 2011, 24(4): 485–488
[96] Kong C, Yehye W A, Abd R N, et al. Discovery of potential anti-infectives against Staphylococcus aureus using a Caenorhabditis elegans infection model. BMC Complement Altern Med, 2014, 6(14): 4–20
[97] Yusoff N A, Yam M F, Beh H K, et al. Antidiabetic and antioxidant activities of Nypa fruticans Wurmb. Vine-gar sample from Malaysia. Asian Pac J Trop Med, 2015, 8(8): 595–605
[98] Yusoff N A, Lim V, Al-Hindi B, et al. Nypa fruticans Wurmb. Vinegar’s aqueous extract stimulates insulin secretion and exerts hepatoprotective effect on STZ-induced diabetic rats. Nutrients, 2017, 9(9): 925–936
[99] 王海鸣, 李支薇, 田光超, 等. 桐花树树皮化学成分的研究. 广东化工, 2014, 41(4): 26–27
[100] 黄晓冬, 黄木水生, 黄建新, 等. 红树植物桐花树叶抗炎镇痛活性部位研究. 中药材, 2015, 38(12): 2590–2593
[101] 黄建新, 黄木水生, 黄晓冬, 等. 桐花树叶乙酸乙酯部位抗氧化、抗过敏活性组分的筛选. 泉州师范学院学报, 2016, 34(2): 1–6
[102] Luo H, Hao E, Tan D, et al. Apoptosis effect of Aegiceras corniculatum on human colorectal cancer via activation of FoxO signaling pathway. Food Chem Toxicol, 2019, 134: 110–861
[103] Vinh L B, Nguyet N, Yang S Y, et al. Cytotoxic triter-pene saponins from the mangrove Aegiceras cornice-latum. Nat Prod Res, 2019, 33(5): 628–634
[104] Cho C L, Lee Y Z, Tseng C N, et al. Hexane fraction of Pluchea indica root extract inhibits proliferation and induces autophagy in human glioblastoma cells. Bio-med Rep, 2017, 7(5): 416–422
[105] Buranasukhon W, Athikomkulchai S, Tadtong S, et al. Wound healing activity of Pluchea indica leaf extract in oral mucosal cell line and oral spray formulation containing nanoparticles of the extract. Pharm Biol, 2017, 55(1): 1767–1774
[106] Ruan J, Li Z, Yan J, et al. Bioactive constituents from the aerial parts of Pluchea indica Less. Molecules, 2018, 23(9): 2104
[107] 邱蕴绮, 漆淑华, 张偲, 等. 阔苞菊的化学成分研究. 中草药, 2009, 40(5): 701–704
[108] Chao Y Y, Jan C R, Ko Y C, et al. Effect of lignans isolated from Hernandia nymphaeifolia on estrogenic compounds-induced calcium mobilization in human neutrophils. Life Sci, 2002, 70(26): 3109–3121
[109] Chao Y Y, Chen I S, Yeh J L, et al. Novel action of lignans isolated from Hernandia nymphaeifolia on Ca2+signaling in renal tubular cells. Eur J Pharmacol, 2002, 443(13): 31–38
[110] Chen Y T, Chen J J, Wang H T. Targeting RNA polymerase I with hernandonine inhibits ribosomal RNA synthesis and tumor cell growth. Mol Cancer Res, 2019, 17(11): 2294–2305
[111] Wei C Y, Wang S W, Ye J W, et al. New anti-inflam-matory aporphine and lignan derivatives from the root wood of Hernandia nymphaeifolia. Molecules, 2018, 23(9): 2286
[112] Al M L, Ahmat N, Ruzaina S A, et al. Medicinal uses, phytochemistry and pharmacology of Pongamia pin-nata (L.)Pierre: a review. J Ethnopharmacol, 2013, 150(2): 395–420
[113] Wen R, Lv H, Jiang Y, et al. Anti-inflammatory fla-vanones and flavanols from the roots of Pongamia pinnata. Planta Med, 2018, 84(16): 1174–1182
[114] Dwivedi D, Dwivedi M, Malviya S, et al. Evaluation of wound healing, anti-microbial and antioxidant po-tential of Pongamia pinnata in wistar rats. J Tradit Complement Med, 2017, 7(1): 79–85
[115] Li J, Jiang Z, Li X, et al. Natural therapeutic agents for neurodegenerative diseases from a traditional herbal medicine Pongamia pinnata (L.) Pierre. Bioorg Med Chem Lett, 2015, 25(1): 53–58
[116] Saini P, Lakshmayya L, Bisht V S. Anti-Alzheimer activity of isolated karanjin from Pongamia pinnata (L.) pierre and embelin from Embelia ribes Burm. f. Ayu, 2017, 38(1/2): 76–81
[117] Wei K, Sun H, Chen X, et al. Furowanin A exhibits antiproliferative and pro-apoptotic activities by targe-ting sphingosine kinase 1 in osteosarcoma. Anat Rec (Hoboken), 2019, 302(11): 1941–1949
[118] Kumar G, Gupta R, Sharan S, et al. Anticancer activityof plant leaves extract collected from a tribal region of India. 3Biotech, 2019, 9(11): 399
[119] Zhao J, Xu J, Lv J. Identification of profilin 1 as the primary target for the anti-cancer activities of Furo-wanin A in colorectal cancer. Pharmacol Rep, 2019, 71(5): 940–949
[120] 夏欢, 郑希龙, 王国华, 等. 半红树玉蕊化学成分的研究. 中国中药杂志, 2016, 41(13): 2460–2465
[121] Patil K R, Patil C R. Anti-inflammatory activity of bartogenic acid containing fraction of fruits of Bar-ringtonia racemosa Roxb. in acute and chronic animal models of inflammation. J Tradit Complement Med, 2017, 7(1): 86–93
[122] Amran N, Rani A N, Mahmud R, et al. Antioxidant and cytotoxic effect of Barringtonia racemosa and Hibi-scus sabdariffa fruit extracts in MCF-7 human breast cancer cell line. Pharmacognosy Res, 2016, 8(1): 66–70
[123] 胡上英, 庞庭才, 黄海, 等. 银叶树果壳单宁提取及抗氧化性研究. 粮食与油脂, 2018, 31(10): 93–96
[124] 张艳军, 彭重威, 徐淑庆, 等. 银叶树树叶中总黄酮提取工艺优化. 中药材, 2012, 35(4): 638–641
[125] Tewtrakul S, Tansakul P, Daengrot C, et al. Anti-infla-mmatory principles from Heritiera littoralis bark. Phytomedicine, 2010, 17(11): 851–855
[126] Christopher R, Nyandoro S S, Chacha M, et al. A new cinnamoylglycoflavonoid, antimycobacterial and an-tioxidant constituents from Heritiera littoralis leaf extracts. Nat Prod Res, 2014, 28(6): 351–358
[127] Hausen B M, Knight T E, Milbrodt M. Thespesia populnea dermatitis. Am J Contact Dermat, 1997, 8(4): 225–228
[128] 田艳, 吴军, 张偲. 半红树药用植物杨叶肖槿的化学成分和药理作用研究进展. 中草药, 2003, 34(1): 85–87
[129] Lindamulage I K, Soysa P. Evaluation of anticancer properties of a decoction containing Adenanthera pavonina L. and Thespesia populnea L. BMC Comple-ment Altern Med, 2016, 16: 70
[130] Mika D, Guruvayoorappan C. Experimental study on anti-tumor and anti-inflammatory effect of Thespesia populnea phytochemical extract in mice models. Im-munopharmacol Immunotoxicol, 2013, 35(1): 157–163
[131] Vasudevan M, Gunnam K K, Parle M. Antinociceptive and anti-inflammatory effects of Thespesia populnea bark extract. J Ethnopharmacol, 2007, 109(2): 264–270
[132] Belhekar S N, Chaudhari P D, Saryawanshi J S, et al. Antidiabetic and antihyperlipidemic effects of Thespe-sia populnea fruit pulp extracts on alloxan-induced diabetic rats. Indian J Pharm Sci, 2013, 75(2): 217–221
[133] Wang H, Lu Z, Qu H J, et al. Antimicrobial aflatoxins from the marine-derived fungus Aspergillus flavus 092008. Arch Pharm Res, 2012, 35(8): 1387–1392
[134] Santiago L S, Lau T S, Melcher P J, et al. Morp-hological and physiological responses of Hawaiian Hibiscus tiliaceus populations to light and salinity. Int J Plant Sci, 2000, 161(1): 99–106
[135] Abdul-Awal S M, Nazmir S, Nasrin S, et al. Evaluation of pharmacological activity of Hibiscus tiliaceus. Sp-ringerplus, 2016, 5(1): 1209
[136] 方笑, 张坚强, 朱丹丹, 等. 苦郎树研究进展综述. 绿色科技, 2017, 8(15): 125–126
[137] Huang W J, Lee H J, Chen H L, et al. Hispidulin, a constituent of Clerodendrum inerme that remitted mo-tor tics, alleviated methamphetamine-induced hyperlo-comotion without motor impairment in mice. J Ethno-pharmacol, 2015, 166: 18–22
[138] Ba V L, Thi M N N, Young Y S, et al. A new rearranged abietane diterpene from Clerodendrum inerme with antioxidant and cytotoxic activities. Nat Prod Res, 2018, 32(17): 2001–2007
[139] Mohan Maruga Raja M K, Mishra S H. Comprehensive review of Clerodendrum phlomidis: a traditionally used bitter. J Chin Integr Med, 2010, 8(6): 510–524
Utilization Status and Development Countermeasures of Mangrove Medicinal Resources in the Marine-Terrestrial Interlaced Zone
WANG Lingli1,2, ZHANG Xin1, WANG Jiansong1,3, SHEN Xiaoxue2, TANG Lili2, LI Ruili2,†
1. Mathematical Engineering Academy of Chinese Medicine, Guangzhou University of Chinese Medicine, Guangzhou 510006; 2. Peking University Shenzhen Graduate School, Guangdong Mangrove Engineering Technology Research Center, Shenzhen 518055; 3. Guangzhou Baiyunshan Pharmaceutical Holdings CO., LTD. Baiyunshan Pharmaceutical General Factory, Guangzhou 510515; † Corresponding author, E-mail: liruili@pkusz.edu.cn
Abstract This study summarizes and reviews Chinese medicinal mangroves’ chemical constituent and medicinal effect researches in the past 50 years. Since 2000, the research on medicinal mangroves has increased exponentially, and the most attention is paid to Pongamia pinnata. 27 kinds of medicinal mangroves have been confirmed, and the main medicinal components include terpenoids, flavonoids, steroids, quinones, carbohydrates, phenylpropanoids and alkaloids. Most medicinal mangroves have anti-tumour, antioxidant and anti-inflammatory effects, and some mangrove plants have unique medicinal effects, including anti-depression and anti-Alzheimer's disease. Existing research mainly focuses on the medicinal effects of mangrove plants, but the pharmacological mechanism needs further study. In view of the problems in medical components and the pharmacological effect of mangroves, some suggestions are put forward for their further development and utilization.
Key words mangrove; chemical composition; pharmacological action