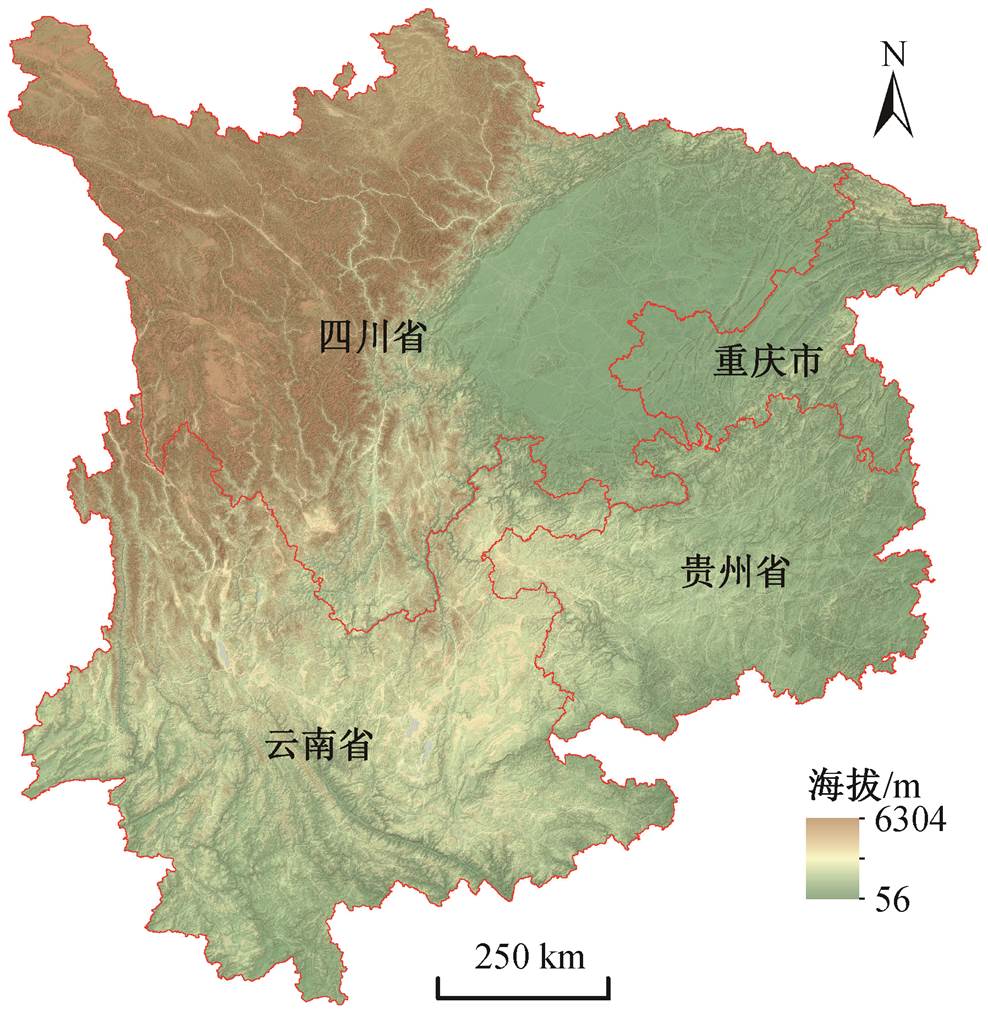
图1 研究区示意图
Fig. 1 Location of the study area
doi: 10.13209/j.0479-8023.2023.028
保山学院转型发展项目(SKZX202103)资助
收稿日期: 2022–06–16;
修回日期: 2022–11–17
北京大学学报(自然科学版) 第59卷 第4期 2023年7月
Acta Scientiarum Naturalium Universitatis Pekinensis, Vol. 59, No. 4 (July 2023)
摘要 以中国西南地区为例, 利用优化参数地理探测器模型(OPGD)研究气候、地形、植被以及人类活动对区域鸟类物种丰富度的单因素和综合影响, 确定维持鸟类丰富度的单因素的最适范围。研究结果表明, 中国西南地区鸟类物种丰富度的空间分异主要受植被和气候因素影响。在各因素的独立影响中, 植被因素的贡献率最大, 增强植被指数(EVI)与森林覆盖高度(FCH)的合计贡献率达到 33.8%~34.7%。双因子对的耦合作用增强了任何单一因素的影响, 并且对鸟类物种丰富度具有显著的非线性效应。研究结果还表明, 植被因子的代理指标, 特别是生产力的代理指标, 能够较好地反映区域环境的综合状况, 更适用于鸟类物种多样性的 估计。
关键词 鸟类多样性; 植被; 人类活动; 空间异质性; 中国西南地区
理解物种丰富度(species richness, SR)及其与环境因子(environmental factor, EF)的关系是群落生态学研究的一个焦点[1]。人们希望从众多环境因子中找出影响物种多样性的主导因素, 从而可以通过环境因子的异质性预测物种丰富度。然而, 由于问题本身的尺度依赖性, 探索过程较为困难, 研究结果也具有更多的不确定性[2]。遥感技术的发展和计算机技术的快速进步, 使得对环境因子进行大规模、高分辨率监测成为可能[3]。对于不同尺度的研究, 从卫星获取的环境数据可以较容易地被各种设备读取。为理解生态模式的共性, 有学者倡导进行跨尺度、多水平的建模[4], 通过改变分析的粒度或范围来量化多个尺度上的环境条件, 然后评估最能解释该模式的最佳尺度[5]。目前, 已有研究者从不同的尺度探讨动物物种丰富度与环境梯度的关系[6]。有学者利用大尺度环境遥感及物种分布数据研究全球和大洲尺度的动物丰富度分布模式[7–8]。在全球尺度, 气候和地形因素是影响脊椎动物物种多样性的主要因素[9–10]。然而, 由于大尺度研究中相关细节信息的损失[2], 使其结论难以应用到更小尺度的生物多样性保护实践中[7]。
在探索物种丰富度与环境因子关系的研究中, 线性回归是比较常用的方法。通过对比一元回归的 R2值或对多元回归系数进行分析, 获得环境因子对物种丰富度相对贡献率的信息[1,11]。虽然多数研究都假设环境驱动因素与物种分布之间存在简单的线性关系, 但实际上, 物种分布对环境因子空间分异的响应可能因研究区、分析尺度(粒度)的变化而表现出复杂性[6,12]。例如, Udy 等[9]通过在全球八大生物地理区建立物种丰富度与高程范围和降水范围的回归方程, 发现物种丰富度取决于区域以及海拔范围和降水范围。在古北区(Palaearctic), 物种丰富度随高程范围增大而增大; 而在印度–马来西亚区(Indo–Malaya), 物种丰富度在 3000~4000m 的高程范围出现高值, 海拔高于 4000m 后, 物种丰富度下降。古北区物种丰富度随降水量增大, 在 1000~1500mm 范围出现高值, 然后物种丰富度下降; 印度–马来西亚区的物种丰富度则随降水增大而缓慢增加。因此, 用简单的线性模型来反映环境因子和物种丰富度梯度的关系尚存争议。
Du 等[13]设计一个地理探测器(GD)来处理不同的生态解释, 可在一定程度上弥补线性回归方法的不足。在模型拟合中, 地理探测器不仅可以用空间方差来量化单个因素的相对重要性, 而且可以探索变量间隐含的交互作用[14]。通过在更灵活的多粒度分析框架中实现地理探测, 可以恢复更多有关生态复杂性的信息, 如环境因子的空间格局以及它们之间的尺度依赖作用或非线性关系[15]。
中国是世界上生物多样性较高的几个国家之一, 西南地区尤为突出。该区域处于中国西南山地与印度–缅甸两个全球生物多样性热点的交错区[16]。中国西南地区气候类型多样, 以热带和温带气候为主, 垂直气候分异显著, 是中国自然条件最复杂, 自然环境较优越, 也最脆弱的区域之一。然而, 在过去的几十年中, 由于人类活动的叠加影响, 西南地区的生物多样性正在迅速丧失[17–18]。
本文选取中国西南地区为研究区, 以鸟类物种丰富度(birds richness, BR)为研究对象, 试图通过地理探测器揭示鸟类丰富度与环境因子的关系。本研究的目标是:1)识别中国西南地区鸟类物种丰富度的空间格局; 2)分析影响鸟类物种丰富度的主要因素及其相对重要性, 探索不同分析粒度对物种丰富度相关因子解释力的影响; 3)探查各环境因素在鸟类物种丰富度空间分异中的交互作用。
如图 1 所示, 中国西南地区指云南、四川、贵州三省及重庆市, 地理坐标为 21°08′32″—34°20′N, 97°30′—110°10′E。该地区幅员辽阔, 包括青藏高原东南边缘川西南山地、四川盆地和云贵高原大部分地区[19], 总面积约为 114.2×104 km2。该地区是世界上生物多样性最为丰富的地区之一, 地形特点是青藏高原隆升形成的高原和山脉景观。气候总体上受亚洲季风系统控制, 降水比较丰沛, 但空间分异较大, 年均降水量为 750~1500mm。除最南端位于云南西双版纳的一小块热带区域外, 大部分地区属于亚热带范围[20]。
鸟类丰富度的空间分布数据提取自 Biodiversity Mapping (https://biodiversitymapping.org/)。数据层为非海洋鸟类空间融合数据, 空间分辨率为 10 km。该图层由 Jenkins 研究团队[7,21]根据国际鸟类联盟2018 年发布的世界鸟类地图第 7 版制作。

图1 研究区示意图
Fig. 1 Location of the study area
对物种多样性产生影响的环境指标大致可归入4 个专题(theme): 气候、地形、植被和人类活动。对多种环境因子进行选择性比较, 有助于更好地理解和概括各环境因子对物种丰富度的重要性。参考Stein 等[11]的研究, 我们初步筛选的指标集如下。
1)气候指标(Clim): 从 CHELSA (https://chelsa-climate.org/)下载的 Bioclim 数据集, 包括 1979—2013 年分辨率为 1km 的年均气温(TEM)、年均降水(PCP)图层以及 Bioclim 扩展变量 5℃生长度日热量(GDD5)图层[22]; 全球干旱与潜在蒸散发数据集(https://cgiarcsi.community/data/global-aridity-and-pe>t-database/), 数据为 1970—2000 年 1km 分辨率潜在蒸散发(PET)[23]; 气候分区(CLZ)为 CliMond 气候数据中的柯本 1975 气候区栅格数据(https://climond. org/Core/Authenticated/KoppenGeiger.aspx)。
2)地形指标(Topo): 高程(ELE)、坡度(SLP)[5]和坡向(ASP)通常用于反映地形状况[12], 可以通过DEM 计算得到。DEM 来自中国科学院资源环境科学与数据中心(https://www.resdc.cn/)对 SRTM-DEM的重采样 250 m 分辨率数据。
3)植被指标(Veg): 在宏观尺度的生物多样性变量中, 可以用植被覆盖相关指标来反映生物栖息地的结构[3]。选择增强型植被指数(EVI)[24]、净初级生产力(NPP)和森林冠层高度(FCH)[11]来反映植被特性。其中, EVI 采用 MOD13A1v006 产品 2015年 11 月 500m 数据(https://lpdaac.usgs.gov/products/mod13a1v006/); NPP 为中国 2010 年 NPP (单位为gC/m2) 1km 栅格数据, 下载自中国科学院资源环境科学与数据中心(https://www.resdc.cn/); FCH 数据源自 1km 分辨率全球森林高度数据集(https://csdms. colorado.edu/wiki/Data:Global_Forest_Heights)[25]。
4)人类活动(Anth): 通过人口密度(POP)反映人类活动影响的强度分布。从 NASA 社会经济数据中心 (http://sedac.ciesin.columbia.edu/data)下载全球调整人口密度第 4 版(GPWv4) 2015 年栅格数据。
以往的研究多采用大约 1° (约 100×100km)的采样网格, 然而较大的取样尺度会模糊诸如山区等物种迅速变化的地区, 导致原始信息的损失[2]。山区往往是物种多样性和特有现象最多的地区[26]。例如, 在安第斯山脉, 100km 的单个网格可能覆盖多个山头, 从而掩盖了山头之间可能存在的物种分异[7]。有研究者建议尽量使用较高分辨率的数据, 或采用多个邻域尺度进行度量, 以便减少取样偏 差[27]。为探索空间取样的尺度效应, 利用 ArcGIS建立一系列空间粒度(10, 20, 40, 80 和 160km)的网格, 对上述变量的栅格图层进行分区统计, 提取地理探测器所需的输入变量。
为剔除各专题大类间相关性较高的因子, 对连续型数值因子进行主成分分析(PCA), 前 3 个主成分共解释 78.7%的方差。PCA 双序图反映因子与主轴以及因子间的相关性。如图 2 所示, EVI, NPP, PET 和 PCP 因子间夹角较小, 说明这些因子之间的相关性较高。考虑到因子类型的差异, 在这一簇因子中, 属于植被和气候的因子可以各选一个。其中, 植被因子 EVI 的得分最高, 同时在气候因子方面, 与 PET 相比, PCP 与 EVI 的相关性更低一些, 所以气候因子选择 PCP。另外, 地形因子 ELE 的延长线与 TEM 和 GDD5 的夹角较小, 说明 ELE 与后两者有较强的负相关关系。考虑到海拔对气温垂直变化有较强的影响, 保留 ELE 因子。最终纳入分析的因子为气候(CLZ 和 PCP)、地形(ELE, SLP 和 ASP)、植被(EVI和FCH)及人类活动(POP)。
1.3.1鸟类丰富度空间格局分析
莫兰指数(Moran’s I)是澳大利亚统计学家帕克·莫兰提出的衡量空间自相关程度的一个综合指标, 用于评价数据在全局表现出的聚集、离散和随机分布特征[28]。Moran’s I 检验统计量扩展了空间上的标准皮尔逊相关性(增加滞后距离), 可以估计变量 z 的空间自相关程度[5]:
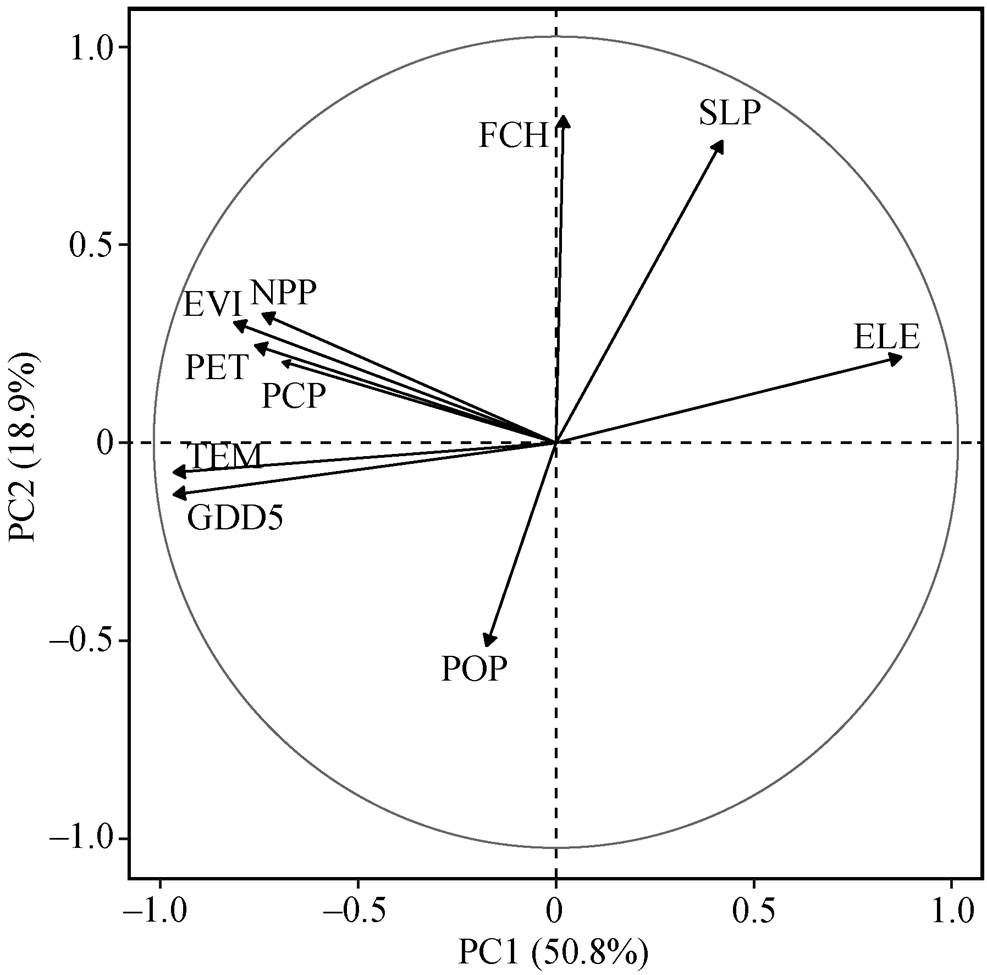
图2 连续型环境因子的PCA分析
Fig. 2 PCA of continuous environmental factors
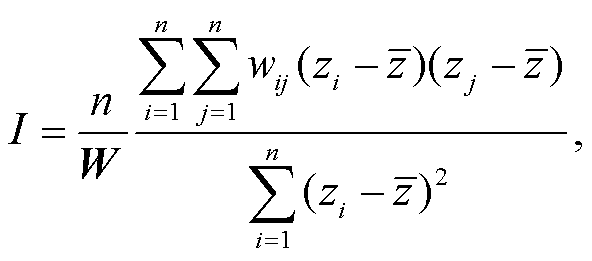 (1)
(1)
式中, W 是一个权重矩阵, 描述位置i与j之间的依赖关系。通常, 这是一个邻域指标矩阵。如果 i 与j 相邻, 则 wij=1, 否则为 0。将矩阵进行标准化后, ∑jwij=1。这个统计量也可用于计算不同的距离间隔, 将空间依赖性解释为距离的函数:
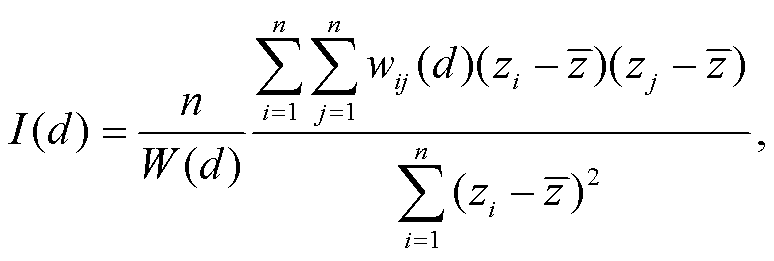 (2)
(2)
式中, d 是采样点之间的距离。作为距离等级的函数, I(d)图被称为空间相关图, 用于解释空间格局随距离的变化, 并估计格局的空间尺度。
高–低聚类(Getis Ord General G)统计量[29]用于测量给定研究区域内高(低)值的集中程度。总体空间关联的一般 G 统计量的计算公式为
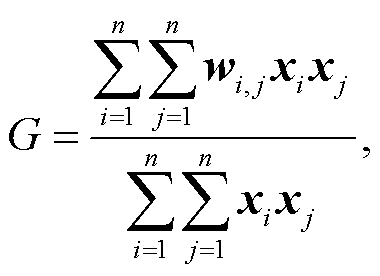 (3)
(3)
式中, xi 和 xj 是要素 i 和 j 的属性值, wi,j 是要素 i和j之间的空间权重, n 是要素的数量。当返回的 p 值很小且具有统计显著性时, 可以拒绝零假设(不存在特征值的空间聚类)。如果零假设被拒绝, z 得分的符号就变得很重要。如果 z 得分值为正, 则观测的 G 指数大于预期的 G 指数, 表明在研究区该要素为高值聚集。如果 z 值为负, 则观测 G 指数小于期望值, 表明要素为低值聚集。
1.3.2地理探测器
作为一种统计方法, 地理探测器用于研究空间分层异质性的影响因素和机制。空间分层异质性指层内方差之和小于区域总方差的现象。该方法的核心思想是, 如果自变量对因变量有重要影响, 则自变量与因变量的空间分布具有一致性。地理探测器包含 4 个模块: 因子探测器、交互探测器、风险探测器和生态探测器[14]。
因子探测是地理探测器的核心。用 Q 统计量(解释力)评价解释变量的相对重要性。计算原则基于方差分析, Q 统计量比较整个研究区的观测值与变量层之间的离散方差, 计算公式如下:
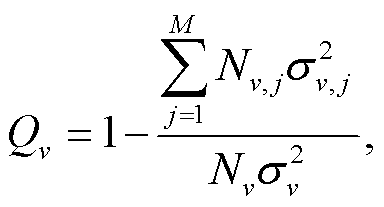 (4)
(4)
式中, Nv和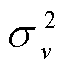 分别是整个研究区的总样本数和总体方差, Nv,j和
分别是整个研究区的总样本数和总体方差, Nv,j和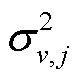 是变量 v 的第 j (j=1, …, M)子区内观测值的数量和总体方差。由于子区内方差较小, 子区之间方差较大, 因此大的 Q 值意味着解释变量的相对重要性较高。在地理探测器中, 每个图层至少需要两个样本来计算均值和方差值。
是变量 v 的第 j (j=1, …, M)子区内观测值的数量和总体方差。由于子区内方差较小, 子区之间方差较大, 因此大的 Q 值意味着解释变量的相对重要性较高。在地理探测器中, 每个图层至少需要两个样本来计算均值和方差值。
交互探测器根据因子探测器交互 Q 值的相对重要性来确定两个重叠空间变量的交互影响。空间交互作用是两个空间解释变量的叠加。交互作用探测是通过相互作用的 Q 值以及两个单变量之间的比较来识别相互作用, 判断两个空间变量的影响是减弱的、增强的还是相互独立的。交互作用探测器可以识别 5 种相互作用: 非线性弱化(nonlinear-weaken)、单变量弱化(uni-variable weaken)、双变量增强(bi-variable enhance)、独立(independent)以及非线性增强(nonlinear-enhance)[15]。
在传统的地理探测器模型中, 连续变量在建模前需经过离散化处理。本文采用 Song 等[15]开发的优化参数地理探测器模型(OPGD), 研究鸟类丰富度空间分异的解释变量。OPGD模型的一大优点是能够基于数据, 对连续变量进行空间自动离散化, 从而免除人为设置间断的主观性及繁琐的操作。离散化方法和破断间隔的最优参数会因解释变量和分析粒度而异, 需要在处理前预设最大分级数, 模型将在此范围内寻求最优解。
鸟类丰富度空间分析结果显示 Moran’s I 值达到 0.98, 表示中国西南地区鸟类物种丰富度的全局呈显著的集聚分布趋势。为了用 Moran’s I 解释空间相关性, 使用 R3.63 及其“pgirmess”包生成相关函数曲线(图 3(a))。可以看出, 在大约 600km 的范围内, 正空间依赖性是显著的; 在更大的范围上, 则呈现负空间依赖性。
根据物种丰富度空间分布(图 3(b)), 该区鸟类种数范围在 114~519 之间。鸟类种数达到 300 以上的区域占整个研究区的 46.1%, 鸟类种数在 200 以下的区域占 7.2%。在明确空间分布呈集聚趋势后, 通过General G 统计分析其具体分布特征。General G 统计的 z 得分=114.1, 表明鸟类丰富度在研究区为高值聚集。从图 3(b)可以看出, 高值区集中于研究区西南部的云南省, 尤其是云南省西部及西南部较为突出。鸟类丰富度分布的空间分异表现为由西南向东北减小的梯度特征。在四川盆地西北边缘的山地, 分隔为两个丰富度略低的区域: 四川盆地和四川省西北部。
通过因子探测器计算影响因子的 Q 值。Q 值反映环境因子的相对重要性, 数值越大表明因子对鸟类丰富度分异的贡献越大。分别用 10, 20, 40, 80 和160km 的粒度分析各影响因子的 Q 值变化(图 4 (a))。可以看出, 随着粒度从 10km 增加到 160km, 除 ELE 外的各因子 Q 值变化呈现不同程度的增加趋势。根据 Q 值变化范围, 可大致分为 3 组: 1)EVI; 2)PCP, POP, ELE, CLZ 和 FCH; 3)SLP 和 ASP。在所有环境因子中, EVI的相对影响最大, SLP 和 ASP的单独作用十分有限, 多数粒度下, 其 Q 值小于0.1, 反映出这些因素对鸟类丰富度空间分异的贡献很小。ELE 和 CLZ 的曲线较平缓, 说明粒度对其 Q值的影响不大。
从图 4(a)中分解出单个因子对鸟类丰富度的相对贡献(图 4(b))如下: EVI 为 22.0%~25.2%, PCP 为13.8%~17.1%, ELE 为 13.3%~18.9%, CLZ 为 12.4%~ 17.4%, POP 为 12.2%~14.7%, FCH 为 9.0%~11.8%, SLP 为 2.5%~4.9%, ASP 为 0.2%~3.8%。若按因子所在专题类别分解, 各专题的相对贡献基本上不受分析粒度的影响。植被因子的相对贡献最大(33.8%~ 34.7%), 气候因子次之(29.5%~31.3%), 第三是地形因子 (21.3%~22.0%)。但是, 在次级因子上, 相对贡献随分析粒度发生变化(图 4 (b))。临界粒度大约在40km, 在小于 40km 的粒度上, ELE 的相对影响仅次于 EVI, PCP 的影响位居第 4; 当分析粒度大于 40km 时, PCP 的相对影响上升至第二位。随着分析粒度增加, 人口因子(POP)的相对贡献在 160km 粒度以上时超过 ELE, 位居第三。
利用风险探测器检验各因子不同分级区间鸟类丰富度均值的差异, 并探测其随环境因子梯度的变化过程。各因子分段内的鸟类丰富度越大, 该段因子范围越利于维持较多的鸟类物种。风险探测结果(图 5)显示, 在环境因子不同分级区间内的鸟类丰富度存在显著差异。例如, EVI 对鸟类丰富度有显著的正效应, 随着 EVI 的增加, 鸟类丰富度增加(图 5(e)), 意味着植被绿度越高的地区有更高的鸟类多样性。在地形影响方面, 随着分析粒度增加, 海拔对鸟类丰富度变化的解释力有所下降。从高程分级的鸟类丰富度均值对比结果(图 5(b))来看, 几乎在所有分析粒度下鸟类丰富度与 ELE 的关系均呈不对称的驼峰型。以 20km 粒度为例, 鸟类丰富度最大的高程段在 1000~2000m 之间, 其次是 2000~ 3000m。在环境因子中, ELE 为间接因子, 可通过影响水热分布来影响物种丰富度, 更高海拔的地区可能受不利气候条件的影响, 使得鸟类丰富度降低。另外, 从图 5(d)可见, 随着降水量增加, 鸟类丰富度大致呈上升趋势, 在降水 1600mm 以上达到高值。
在不同粒度下, POP 对鸟类丰富度的影响也呈不对称的驼峰形态。同样以 20km 粒度为例, 在人口密度较低(60~114 人/km2)的区域有较高的鸟类丰富度, 人口密度进一步增加时, 鸟类丰富度下降。有意思的是, 人口密度最低的区域也对应最低的鸟类丰富度。鸟类丰富度在各气候区有较显著的差异, 以 Cwb (亚热带高原气候)和 Cwa (亚热带季风气候)为主的区域具有更高的丰富度, 而以 ET (冻原气候)为主的区域丰富度最低(图 5(c))。
绘制 40, 80 和 160km 分析粒度下, EVI 变量相应取值区间对应的鸟类丰富度均值空间分布图(图 6)。根据因子不同分级区间, 将鸟类丰富度分为高、中、低 3 个级别。图 6 中, 3 种粒度下的鸟类丰富度格局与其原始分辨率下的格局(图 3(b))基本上一致。即使以较粗的粒度(160km)进行分析, 也能捕捉到本研究区鸟类丰富度的总体分布模式。虽然分析粒度的变化会造成因子相对解释力的变化, 但对主要因子的识别影响不大。
生态检测器用于探索变量之间的交互作用。在交互作用分析中, 用数学符号∩表示因子对之间的交互作用, Q 值反映因子对的联合效应。图 7 展示粒度为 80km 时的因子交互 Q 值。在不同分析粒度下, Q 值最高的相互作用均发生在与 EVI 交互的因子对, 如, EVI∩ELE Q=0.73 (粒度为 10km), EVI ∩ELE Q=0.78 (20km), EVI∩CLZ Q=0.80 (40km),EVI∩ELE Q=0.85 (80km), EVI∩FCH Q=0.90 (160km)。其他因子在与 EVI 交互后, 效应都有所增强, 甚至单因子中对鸟类丰富度空间分异解释力较低的ASP。除与 EVI 交互外, 其他因子对之间的所有交互 Q 值也大于单因子 Q 值(图 4(a))。这些结果表明, 环境因子之间具有较强的交互作用, 从而形成耦合效应。此外, 除大部分因子之间显示双重协同效应(图 7 中橘色圆点)外, 还存在与 ASP 和 SLP 交互的因子对之间的非线性增强关系(图 7 中红色圆点), 进一步反映出环境因子交互作用的复杂性。
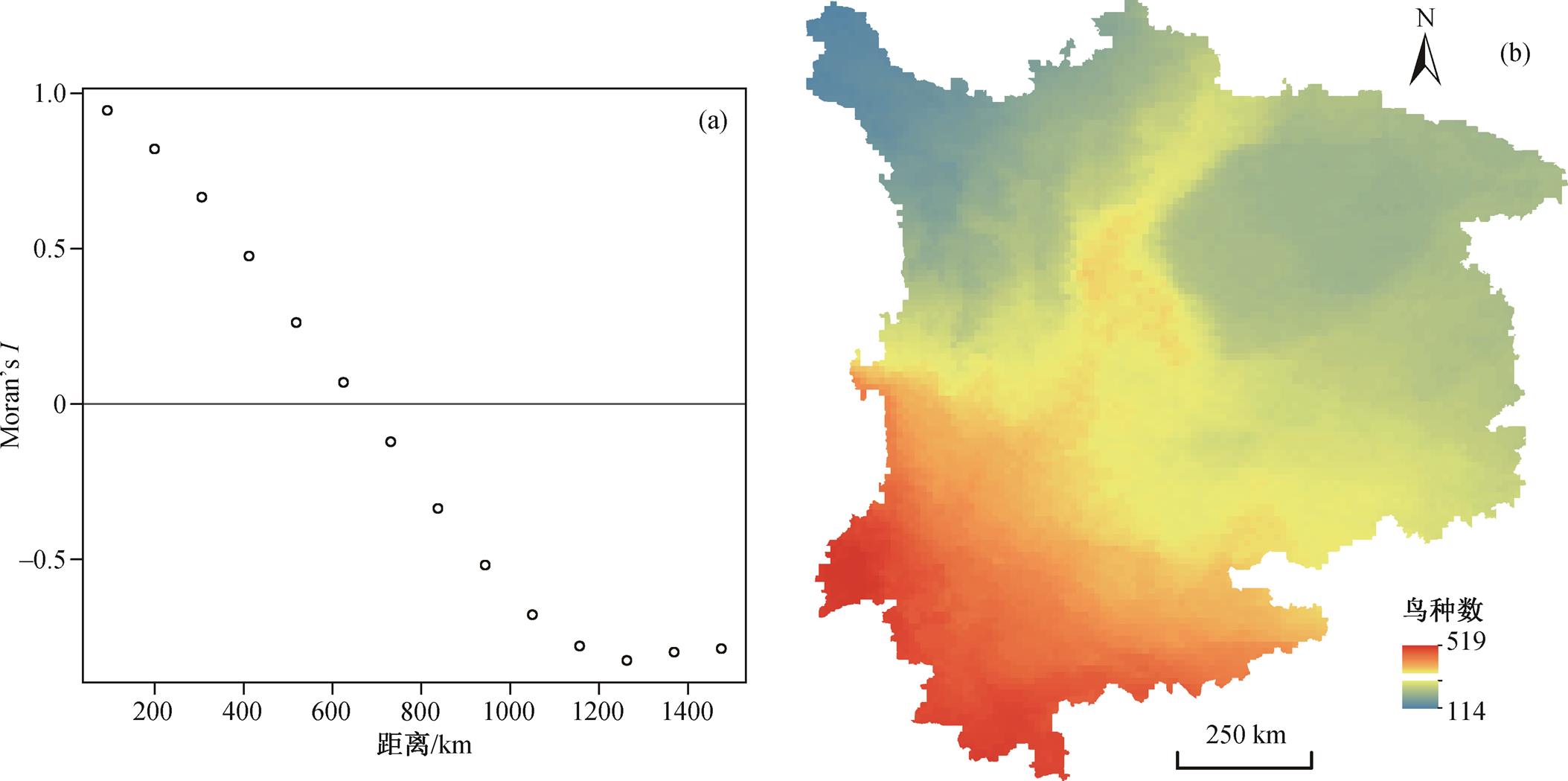
图3 研究区鸟类丰富度与距离的相关图(a)及其空间分布(b)
Fig. 3 Distance-binned correlograms (a) and distribution of birds richness (b) in the study area

图4 环境因子解释力的尺度效应(a)与相对贡献(b)
Fig. 4 Size effects of spatial units for Q values of explanatory variables (a) and the relative contribution of environmental factors (b)
物种多样性的空间模式对识别陆地生物多样性热点、制定保护计划以及进行生态系统服务核算等具有重要意义。目前, 物种丰富度格局研究中的一个主要方面是厘清潜在环境因子与物种丰富度分异的关系。本研究利用优化参数的地理探测模型, 探讨中国西南地区不同环境因素对鸟类物种丰富度空间分异的独立及交互作用。

分级(Bin)从低到高(1~7)代表对应环境因子从低到高分段取值, 如 1.3.2 节所述, 分级方法和间隔依环境因子和分析粒度而异, 由OPGD模型在预设最大分级数(这里设为7)内自动寻求最优解。例如, 粒度为 80 km 时, 最优离散化结果如下: ELE为等间隔法(分6级), PCP为标准差法(分7级), EVI为分位数法(分6级), FCH为标准差法(分7级), POP为自然间断法(分6级), SLP为等间隔法(分6级)。图(c)中, Bsh为热带半干旱气候, Cfa为亚热带湿润气候, Cfb为温带海洋性气候, Cwa为亚热带季风气候, Cwb为亚热带高原气候, Dfb为温带大陆性湿润气候, Dwb为温带季风气候, Dwc为亚寒带季风气候, ET为冻原气候
图5 因子分级区间的鸟类丰富度(BR)均值
Fig. 5 Mean birds richness (BR) in environmental factors bins
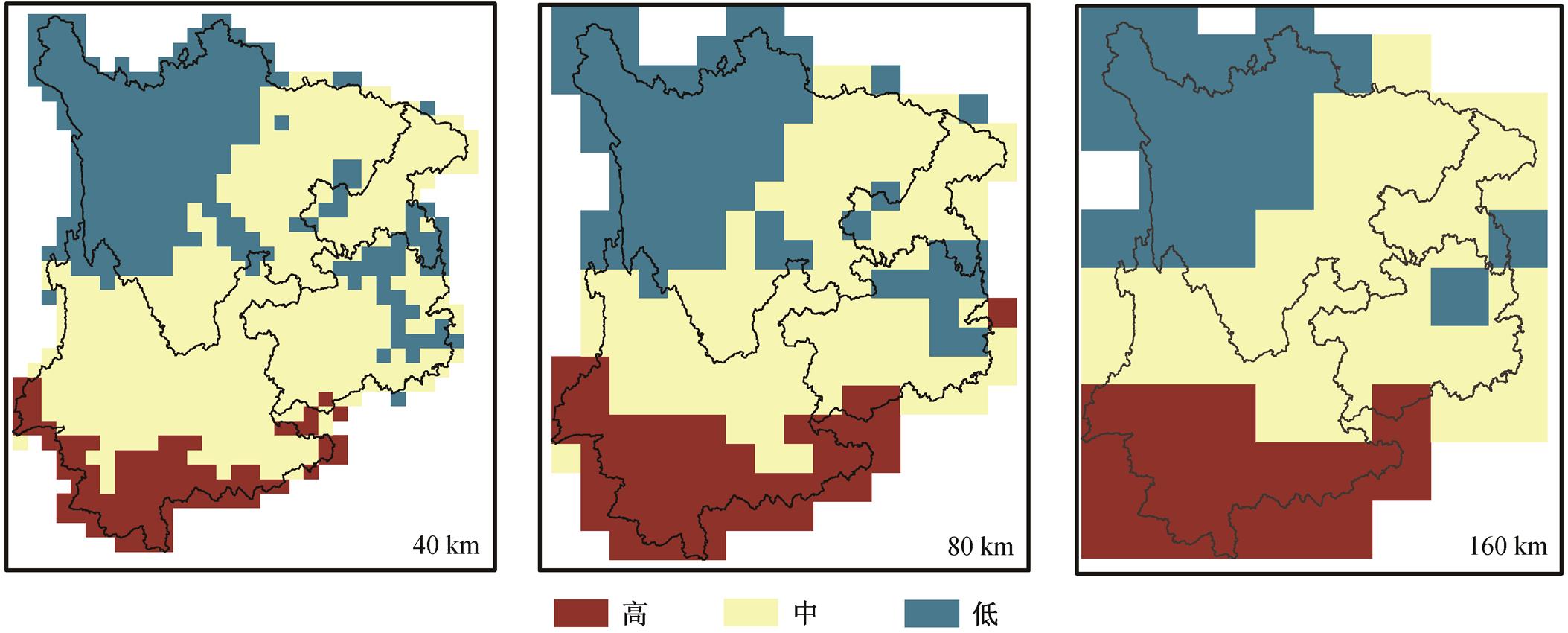
低、中和高分别对应EVI取值区间[0.07, 0.23], (0.23, 0.36]和(0.36, 0.55], 相应的区域鸟类物种数均值分别为240, 290和421
图6 在3种分析粒度下基于解释变量EVI的鸟类丰富度空间分布
Fig. 6 Spatial distribution of birds richness based on explanatory variable EVI at three different grains

图7 因子交互效应矩阵(粒度为80 km)
Fig. 7 Factor interaction matrix (grain=80 km)
本研究发现, 中国西南地区的鸟类丰富度在全局呈显著的集聚分布趋势, 在 600km 以内的空间尺度上表现出强的空间依赖性。与以往集中于影响物种丰富度的单一环境因素的研究相比, 本文定量地研究了固定空间范围和多分析粒度下环境因素之间的相互作用。因子探测的结果显示, 在 600km 的空间范围或相当的空间尺度内, EVI 是被测因素中影响鸟类丰富度的首要因素, PCP 和 ELE(间接地代表温度因素)其次。Udy 等[9]在全球生物地理区尺度的研究中发现, 物种丰富度与 ELE 的关系在古北区为正向增加的关系, 在印度–马来亚区为驼峰型关系(物种数量高值出现在海拔 3000~4000m)。中国西南地区位于古北区与印度–马来亚区两大生物地理区的交界部位, 本研究发现鸟类丰富度最高的高程段在 1000~2000m 之间, 在此高程段之外, 鸟类丰富度向两端减小, 显示出鸟类丰富度与 ELE 之间的驼峰型关系, 与印度–马来亚区的特征相似。
多粒度(20~160km)分析结果显示, 环境因子影响鸟类丰富度的相对解释力变化。在较大的分析粒度上, 因子分级之间的差异可能被平滑, 但对主导因子的识别并无明显影响。本研究估算了环境指标对鸟类丰富度分异的相对贡献率, 结果显示单因子中 EVI 具有最高的贡献率, 为 22.0%~25.2%。此结果支持 Skidmore 等[3]关于遥感生物多样性代理指标选择的建议。然而, 植被的另一项指标——林木高度(FCH)似乎并未对鸟类丰富度的分异构成大的影响, 其贡献率仅为 9.0%~11.8%。植被或植物群落的多样性通常与动物物种丰富度有一定的关联[30], 但本区域复杂的植被类型(如亚热带森林、高寒草地等类型兼具)很难单纯地从植被高度上得以体现。作为植被因子的代理指标, EVI 指数可能比植被高度更能反映群落生产力的差异[3]。高的生产力或者物种间食物资源的精细分配, 可能促使更多的物种在一个稳定群落中共存[31]。
除降水和地形以外, 本研究还考虑了来自人类活动的作用。作为反映人类活动强度的间接指标, 人口密度对鸟类丰富度有一定的影响, 与生物气候区差异的贡献率(12.2%~14.7%)相当。人类活动会改变下垫面植被, 并压缩鸟类生境。本研究中, 在中高人口密度以上, 鸟类丰富度随人口密度增加而出现下降趋势(符合一般认知)。在人口密度极低的区域, 高海拔的不利气候条件可能导致较低的鸟类丰富度。其他因素(尤其是 ELE, PCP 和 ASP等)与植被因子也会产生复杂的交互作用, 由此增强它们对鸟类丰富度空间分异的解释力。然而, 各因子间复杂的交互过程和非线性作用也会在一定程度上增加贡献率分解的不确定性。
一般认为, 气候是影响生物分布的主要环境因子, 但对动物多样性格局而言, 植被因子的影响可能更加直接。本研究结果显示, 植被对鸟类丰富度具有强的正效应, 是本区鸟类丰富度空间格局的主导因子。与其他因子相比, 植被因子的相对稳定性更高。植被因子的代理指标, 特别是生产力方面的代理指标, 能够较好地反映区域环境的综合状况, 更适合作为预测指标, 用于鸟类丰富度空间格局的估计。随着对地遥感技术的发展以及地面生物多样性观测记录的不断积累, 植被环境多样性的表征数据会更加丰富, 将有利于进一步探索动物物种多样性与植被之间的关系。
参考文献
[1]Field R, Hawkins B A, Cornell H V, et al. Spa- tial species-richness gradients across scales: a meta-analysis. Journal of Biogeography, 2009, 36(1): 132–147
[2]Bar-Yam Y. From big data to important information. Complexity, 2016, 21(S2): 73–98
[3]Skidmore A K, Coops N C, Neinavaz E, et al. Priority list of biodiversity metrics to observe from space. Nature Ecology & Evolution, 2021, doi: 10.1038/s41 559-021-01451-x
[4]Stein A, Gerstner K, Kreft H. Environmental hetero-geneity as a universal driver of species richness ac-ross taxa, biomes and spatial scales. Ecology Letters, 2014, 17(7): 866–880
[5]Fletcher R, Fortin M J. Spatial ecology and conser-vation modeling: applications with R. Cham: Sprin-ger, 2018
[6]Peters M K, Hemp A, Appelhans T, et al. Predictors of elevational biodiversity gradients change from single taxa to the multi-taxa community level. Nature Com-munications, 2016, 7: 13736
[7]Jenkins C N, Pimm S L, Joppa L N. Global patterns of terrestrial vertebrate diversity and conservation. PNAS, 2013, 110(28): E2602-10
[8]IUCN. The IUCN red list of threatened species. Ver-sion 2018.2 [EB/OL]. (2018)[2021–07–14]. https:// www.iucnredlist.org
[9]Udy K, Fritsch M, Meyer K M, et al. Environmental heterogeneity predicts global species richness patterns better than area. Global Ecology and Biogeography, 2021, 30(4): 842–851
[10]McCain C M, Grytnes J A. Elevational gradients in species richness. Encyclopedia of Life Sciences, 2010: doi: 10.1002/9780470015902.a0022548
[11]Stein A, Beck J, Meyer C, et al. Differential effects of environmental heterogeneity on global mammal species richness. Global Ecology and Biogeography, 2015, 24(9): 1072–1083
[12]Amatulli G, Domisch S, Tuanmu M N, et al. A suite of global, cross-scale topographic variables for envi-ronmental and biodiversity modeling. Scientific Data, 2018, 5: 180040
[13]Du Z, Zhang X, Xu X, et al. Quantifying influences of physiographic factors on temperate dryland vegetation, Northwest China. Scientific Reports, 2017, 7: 40092
[14]Wang J F, Zhang T L, Fu B J. A measure of spatial stratified heterogeneity. Ecological Indicators, 2016, 67: 250–256
[15]Song Y, Wang J, Ge Y, et al. An optimal parameters-based geographical detector model enhances geogra-phic characteristics of explanatory variables for spa-tial heterogeneity analysis: cases with different types of spatial data. GIScience & Remote Sensing, 2020, 57(5): 593–610
[16]Hoffman M, Koenig K, Bunting G, et al. Biodiversity Hotspots (version 2016.1)[R/OL]. (2016) [2021–07–14]. https://zenodo.org/record/3261807#.YC_imzO-dCk
[17]Critical Ecosystem Partnership Fund. Ecosystem pro-file: Indo-Burma biodiversity hotspot [R/OL]. (2011) [2021–07–14]. https://www.kfbg.org/en/conservation-by-site/indo-burma-biodiversity-hotspot
[18]Critical Ecosystem Partnership Fund. Mountains of Southwest China Hotspot [R/OL]. (2002) [2021–07–14]. https://www.cepf.net/our-work/biodiversity-hots-pots/mountains-southwest-china
[19]Jiang S, Chen X, Smettem K, et al. Climate and land use influences on changing spatiotemporal patterns of mountain vegetation cover in Southwest China. Eco-logical Indicators, 2021, 121: 107193
[20]Tang C Q. The subtropical vegetation of southwestern China: plant distribution, diversity and ecology. Dor-drecht: Springer, 2015
[21]Pimm S L, Jenkins C N, Abell R, et al. The biodiver-sity of species and their rates of extinction, distribu-tion, and protection. Science, 2014, 344: 1246752
[22]Karger D N, Conrad O, Böhner J, et al. Climatologies at high resolution for the Earth’s land surface areas. Scientific Data, 2017, 4: 170122
[23]Trabucco A, Zomer R. Global aridity index and po-tential evapotranspiration (ET0) Climate Database v2 [R/OL]. (2019) [2021–07–14]. https://cgiarcsi.commu nity/2019/01/24/global-aridity-index-and-potential-eva potranspiration-climate-database-v2/
[24]Tuanmu M N, Jetz W. A global, remote sensing-based characterization of terrestrial habitat heterogeneity for biodiversity and ecosystem modelling. Global Ecolo-gy and Biogeography, 2015, 24(11): 1329–1339
[25]Simard M, Pinto N, Fisher J B, et al. Mapping forest canopy height globally with spaceborne lidar. Journal of Geophysical Research, 2011, 116(G4): doi: 10.10 29/2011JG001708
[26]Rahbek C, Borregaard M K, Colwell R K, et al. Humboldt’s enigma: what causes global patterns of mountain biodiversity?. Science, 2019, 365: 1108–1113
[27]Theobald D M, Harrison-Atlas D, Monahan W B, et al. Ecologically-relevant maps of landforms and phy-siographic diversity for climate adaptation planning. PLOS ONE, 2015, 10(12): e0143619
[28]Mellin C, Mengersen K, Bradshaw C J A, et al. Gen-eralizing the use of geographical weights in biodi-versity modelling. Global Ecology and Biogeography, 2014, 23(11): 1314–1323
[29]Getis A, Ord J K. The analysis of spatial association by use of distance statistics. Geographical Analysis, 1992, 24(3): 189–206
[30]Cox C B, Moore P D, Ladle R J. Biogeography: an ecological and evolutionary approach. 9th ed. Oxford: Wiley Black, 2016
[31]Hao M, Jin Q, Meng G, et al. Regional assemblages shaped by historical and contemporary factors: evi-dence from a species-rich insect group. Molecular Ecology, 2020, 29(13): 2492–2510
Study on Bird Species Richness and Its Maintenance Factors in Southwest China
Abstract Taking southwest China as an example, the optimal parameters-based geographical detector (OPGD) was used to study the single and comprehensive effects of climate, topography, vegetation and human activities on bird species richness in the region, and determine the optimal range of single factors that promote the maintenance of bird richness. The results suggest that the spatial differentiation of bird species richness in southwest China is mainly affected by vegetation and climate factors. In the independent influence of various factors, the vegetation factor is the most important contribution, and the total contribution rate of enhance vegetation index (EVI) and forest cover height (FCH) is 33.8%‒34.7%. The interaction between the two factors enhances the influence of any single factor, and makes a significant nonlinear effect on birds richness. The study shows that the agent index of vegetation factor, especially the agent index of productivity, can better reflect the comprehensive status of the regional environment and is more suitable for the estimation of bird species diversity.
Key words birds richness; vegetation; human activity; spatial heterogeneity; southwest China