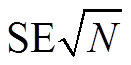 得到。如果研究中既没有标准偏差, 也没有标准误差, 则采用均值的 1/10 表示标准偏差[13]。如果相关数据不是以文本或表格的形式呈现, 则使用 GetData Graph Digitizer 从数字化图形中提取数值。
得到。如果研究中既没有标准偏差, 也没有标准误差, 则采用均值的 1/10 表示标准偏差[13]。如果相关数据不是以文本或表格的形式呈现, 则使用 GetData Graph Digitizer 从数字化图形中提取数值。北京大学学报(自然科学版) 第59卷 第3期 2023年5月
Acta Scientiarum Naturalium Universitatis Pekinensis, Vol. 59, No. 3 (May 2023)
doi: 10.13209/j.0479-8023.2023.027
国家自然科学基金基础科学中心项目(31988102)资助
收稿日期: 2022–06–15;
修回日期: 2022–08–19
摘要 基于全球范围内开展的凋落物去除和根系去除实验, 获取 61 对土壤 N2O 排放数据, 通过整合分析方法, 定量地评估去除凋落物和根系对土壤 N2O 排放的影响与调控因素。结果表明, 去除凋落物处理后, 土壤 N2O 排放显著降低(−16.5%); 去除根系处理后, 土壤 N2O 排放显著增加(+131.6%)。凋落物和根系去除情况下, N2O 排放的变化与土壤水分和硝态氮含量的变化具有显著的正相关关系, 表明土壤水分和硝态氮含量的变化是土壤 N2O 排放响应植物输入降低的主要调控因素。研究结果揭示了凋落物去除和根系去除对土壤 N2O 排放的影响与调控因素, 有利于理解未来全球变化背景下植物输入的改变如何影响土壤 N2O 的排放。
关键词 氧化亚氮; 温室气体; 植物残体输入和去除实验; 凋落物去除; 根系去除; 整合分析
大气中温室气体(greenhouse gases, GHG)的急剧上升导致全球温度比 1750年前升高 1°C[1]。作为一种主要的温室气体, 氧化亚氮(N2O)的增温潜势相当于二氧化碳的 234 倍。研究表明, 大气中 N2O的浓度比 1750年增加 20%以上[2], 2007—2016年, 全球 N2O 排放 17.0TgN/年, 其中自然土壤通量为5.6TgN/年[2]。
土壤是 N2O 的主要排放源, 其排放受到植物地上和地下输入(即凋落物和根系)以及土壤理化性质的影响[3]。在有氧环境下, 土壤硝化细菌在将铵盐氧化为硝酸盐的过程中产生部分 N2O。在厌氧环境下, 反硝化细菌通过还原硝酸盐及亚硝酸盐产生N2O[3], 反硝化作用也是 N2O 产生的主要过程。硝化作用和反硝化作用受到土壤温度、湿度和底物可利用性等多种环境因素的共同调控[4]。由于底物可利用性、气体扩散率和土壤微生物分布等因子的高度异质性, 凋落物层和根际具有的微生态环境可能成为反硝化作用的热点区域[5]。
地上凋落物不仅是氮循环的重要组成部分, 也构成土壤与大气之间的缓冲层, 可以调节土壤微环境[6]。降水减少和干旱等气候变化一般会减少森林生态系统的植物净初级生产力(net primary produc-tivity, NPP)[7], 净初级生产力的下降可能会减少地上凋落物输入的质量和数量。此外, 森林火灾也会迅速减少凋落物层。去除凋落物层会减少土壤养分的输入, 同时由于缺少雨水截流的功能而增加养分淋溶。凋落物层是分解者生境的组成部分, 去除凋落物会改变土壤理化性质, 进而改变土壤分解者群落结构。
根系既可以吸收养分, 也可以吸收水分, 同时是除凋落物之外的土壤重要输入碳源。植物根系对土壤碳氮循环的影响是生物地球化学循环研究中关注的热点[7]。在陆地生态系统中, 根系在植物与土壤之间发挥水分和养分的运输作用。根系的生理功能包括吸收水分和养分以及产生根际沉积物等。根系会改变土壤的理化性质, 影响土壤微生物数量和活性, 从而对土壤硝化、反硝化等微生物过程以及 N2O 的排放产生影响。在全球变化背景下, 土地利用变化(如人为砍伐)和氮沉降等会改变植物向地下的碳分配, 从而减弱根系的养分和水分获取等生理活动[8], 进而对土壤的硝化与反硝化过程产生深刻的影响。
鉴于 N2O 排放在全球温度上升进程中的重要性以及全球变化背景下植物输入潜在的变化, 了解植物输入降低对 N2O 排放的影响和调控因素就至关重要。凋落物去除和根系去除是植物残体输入和去除实验(detritus input and removal treatments, DIRT)的组成部分, 是研究植物输入变化对生态系统碳氮循环影响的重要手段。在过去几十年中, 针对凋落物去除和根系去除对土壤 N2O 排放的影响, 已经有一些相关的案例研究, 但其结果千差万别, 尚未达成共识[9–11]。因此, 对已开展的案例研究进行整合分析(meta-analysis), 有利于揭示植物输入减少对土壤N2O 排放的影响与调控机制。
本研究基于对全球案例数据的整合分析, 评估凋落物去除和根系去除对土壤 N2O 排放的影响, 主要目标如下: 1)量化凋落物去除和根系去除对土壤 N2O 排放的总体影响; 2)解析凋落物去除和根系去除影响土壤N2O 排放的关键调控因子。
在 Web of Science (http://apps.webofknowledge. com/)和中国知网(CNKI, http://www.cnki.net/)平台, 利用以下关键词及其组合进行文献检索: (“氧化亚氮”或“一氧化二氮”或“N2O”或“温室气体”)和(“处理凋落物”或“凋落物实验”或“凋落物输入”或“碳输入”或“凋落物处理”或“去除凋落物”或“根处理”或“环割”或“沟”或“去除根”或“DIRT”), 检索截止时间为2021年11月11日。
根据如下标准, 对检索得到的文献进行筛选: 1)为了更好地反映自然环境下土壤温室气体排放的响应, 必须是野外试验, 并且不包括野外采土、室内盆栽培养的试验; 2)研究需设置对照组和实验组, 并给出相关指标的平均值、样本量和标准偏差(或者可以推算出); 3)由于大多数生态系统土壤 N2O排放的季节变化很大, 研究必须测量至少一个生长季的土壤 N2O 排放[12]。文献检索和筛选流程图如附录 1 所示(访问 http://xbna.pku.edu.cn 查看附录)。
最后, 共筛选出 28 篇文献, 获得 61 对土壤 N2O排放数据, 其中凋落物去除 34 对, 根系去除 27 对, 数据地理分布如图 1 所示。我们也检索了凋落物增加以及凋落物和根系同时去除两个处理的数据, 但土壤N2O 排放数据太少, 所以没有纳入本研究。
构建的数据库包括两类变量: 土壤 N2O 排放通量和环境变量(土壤温度、土壤含水量、土壤铵态氮含量[NH4+-N]、土壤硝酸态氮含量[NO3−-N]、微生物生物量碳(MBC)和可溶性有机碳(DOC))。我们从原始研究数据中提取每个变量的均值(X)、标准偏差(SD)和样本量(N)。当变量被重复测量超过一个生长季节或整个生长周期时, 选择每一个生长周期的数据, 对重复测量多个生长周期的数据使用同一个“site”变量(即数据来自同一个样点的实验)。如果研究变量使用的是标准误差(SE), 而不是标准偏差(SD), 那么标准偏差可以通过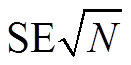 得到。如果研究中既没有标准偏差, 也没有标准误差, 则采用均值的 1/10 表示标准偏差[13]。如果相关数据不是以文本或表格的形式呈现, 则使用 GetData Graph Digitizer 从数字化图形中提取数值。
得到。如果研究中既没有标准偏差, 也没有标准误差, 则采用均值的 1/10 表示标准偏差[13]。如果相关数据不是以文本或表格的形式呈现, 则使用 GetData Graph Digitizer 从数字化图形中提取数值。
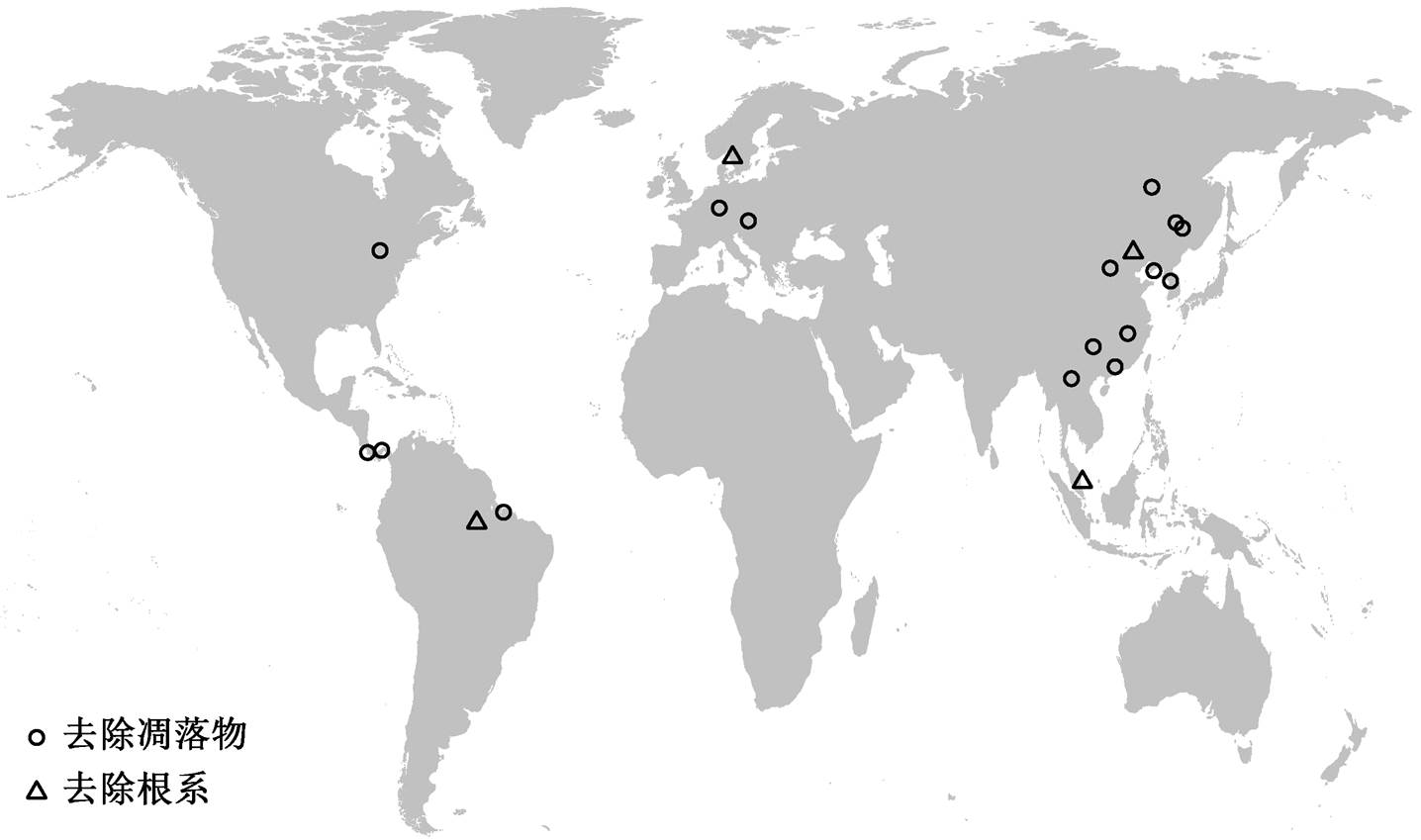
图1 研究数据所在位置
Fig. 1 Location of study sites included in the meta-analysis
本研究采用整合分析方法研究土壤 N2O 排放对去除凋落物和去除根系的响应(RR), 并探讨其潜在驱动机制。具体而言, 使用 RR 的自然对数表示土壤 N2O 排放的效应值[13]。RR 及其对应方差(v)的计算公式为
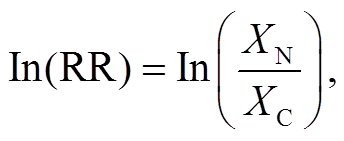 (1)
(1)
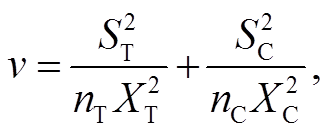 (2)
(2)
其中, XT和 XC分别是实验组和对照组中给定变量的平均值; XT, nT和 ST分别是去除凋落物或去除根系(实验组)的平均值、样本量和标准偏差; XC, nC和SC分别是对照组的平均值、样本量和标准偏差。
本研究采用混合效应模型进行 Meta 分析, 即使用“metafor”软件包的 rma.mv 函数计算土壤 N2O排放的加权响应比(weighted response ratio, RR++)。由于一些研究结果提供了不止一对观测结果, 在混合效应模型中将变量“site”作为随机因素纳入, 以便消除同一研究中不同观测值的非独立性[14]。如果加权响应比的 95%置信区间(CI)不与零重叠, 则认为实验处理的效应在 α=0.05 水平上是显著的。为便于理解, 我们将加权响应比及其对应的 95% CI转换为百分比形式: 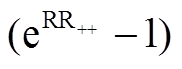 ×100%。为了确定 N2O排放响应的驱动因素, 在 N2O 排放响应比与相关环境因子响应比和环境变量(即铵态氮含量和硝态氮含量)的本底值之间进行回归分析。同时, 检验发表偏倚, 结果显示各个指标均不存在发表偏倚(附 录 2)。
×100%。为了确定 N2O排放响应的驱动因素, 在 N2O 排放响应比与相关环境因子响应比和环境变量(即铵态氮含量和硝态氮含量)的本底值之间进行回归分析。同时, 检验发表偏倚, 结果显示各个指标均不存在发表偏倚(附 录 2)。
土壤 N2O 排放对去除凋落物与去除根系的响应具有较大的变异, 其响应比分别为−0.18 和 0.84 (图2)。总的来说, 去除凋落物处理使土壤 N2O 排放减少 16.5%, 而去除根系处理使得土壤 N2O 排放增加131.6%。与土壤 N2O 排放的响应类似, 去除凋落物使土壤硝态氮含量降低 18.9%, 而去除根系使其增加 26.7%。除此之外, 根系去除使土壤含水量增加15.0% (响应比为 0.14), 但凋落物去除对其不产生显著影响。
土壤 N2O 排放的响应与土壤湿度和硝态氮含量的响应呈正相关关系(图 3), 但与其他指标的响应不存在显著关系(表 1)。土壤 N2O 排放受到土壤湿度和土壤硝态氮的调节。此外, 在凋落物和根系去除两种处理情况下, 仅凋落物去除实验中的土壤N2O 排放响应比与土壤本底硝态氮含量呈正相关关系: 土壤硝态氮含量越高, 去除凋落物对土壤 N2O排放的影响越大(图 4, 表 1)。
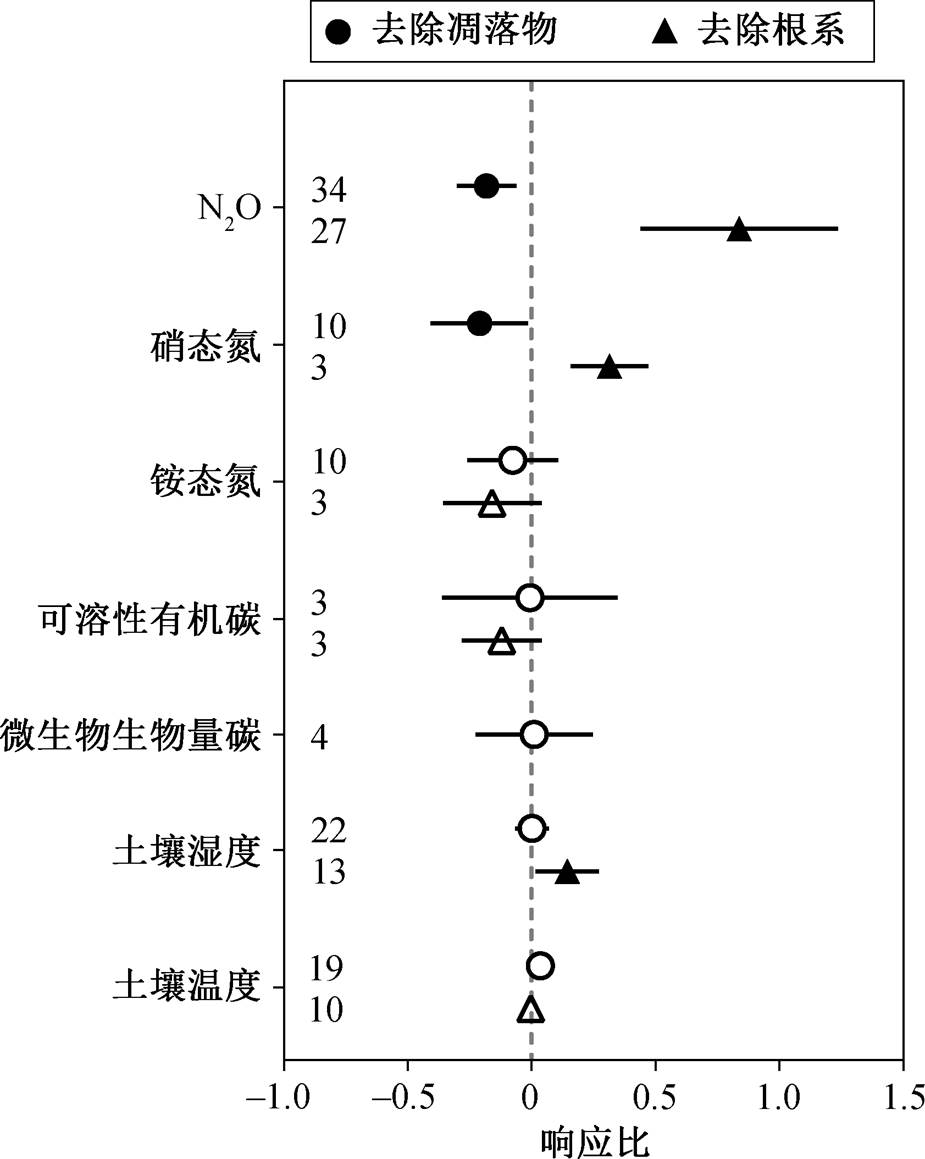
变量右侧数字为样本量; 误差线代表95%的置信区间; 实心点和空心点分别代表显著(95%CI不与零重叠)和不显著的响应比
图2 去除凋落物、去除根系对土壤 N2O 排放及相关土壤变量的影响
Fig. 2 Effects of removing litters and roots on soil N2O emission and related soil variables
整合分析结果表明: 1)去除凋落物后, 土壤硝态氮含量和 N2O 排放显著减少(图 2); 2)去除凋落物实验中, 土壤 N2O 排放响应比与土壤本底硝态氮呈正相关关系(图 4, 表 1); 3)改变植物输入后, 土壤N2O 排放响应比与土壤湿度响应比、土壤硝态氮响应比呈正相关关系(图 3, 表 1)。凋落物是养分归还土壤的主要途径, 凋落物去除直接降低土壤的氮源输入, 土壤硝态氮含量下降, 而硝态氮是反硝化作用的反应底物, 即 N2O 的主要底物来源减少。此外, 凋落物去除也降低土壤的碳源输入, 减少微生物生物量[15], 减弱微生物活性[10]。因此, 凋落物去除导致的土壤氮源输入降低和微生物活性降低共同导致 N2O 排放降低。去除凋落物实验中, 本底土壤硝态氮含量越高, 去除凋落物后 N2O 排放响应比越大, 可能与土壤本底硝态氮含量高时凋落物去除对土壤硝态氮的影响相对较大有关[10,16]。
绝大多数相关研究结果均表现为凋落物去除后N2O 的排放减少[11,17–18], 但也有不少研究结果显示去除凋落物后 N2O 的排放增加[9–10,19]。造成研究结果之间差异的原因之一可能是环境条件的不同。N2O 对去除凋落物响应的不同基于环境异质性, 可能是由于不同的树种具有不同的凋落物质量和数量。例如, 樟树凋落物可能释放了抑制相关微生物活性的化学物质, 抑制土壤 N2O 排放, 从而去除樟树凋落物反而促进土壤 N2O 的排放[19–20]。与温带阔叶林相比, 亚热带森林的针叶凋落物含酚量高, 不易分解, 针叶凋落物对 N2O 排放的短期影响可能不如阔叶凋落物显著[9]。凋落物对 N2O 排放的作用可能与季节有关, 凋落物在雨季可能对 N2O 排放具有促进作用(15%), 在干季反而有抑制作用(42%)[9]。
表1 土壤N2O排放响应比与其他变量之间的关系
Table 1 Relationships between the response ratio of soil N2O emission and other variables
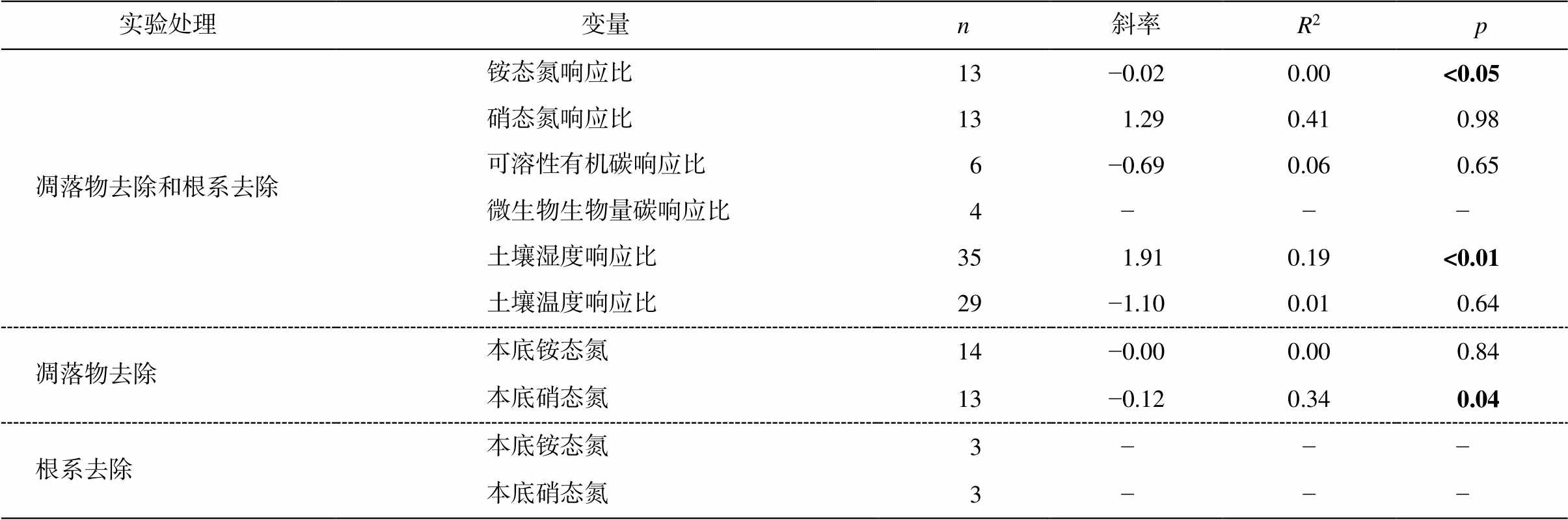
实验处理变量n斜率R2p 凋落物去除和根系去除铵态氮响应比13−0.020.00<0.05 硝态氮响应比131.290.410.98 可溶性有机碳响应比6−0.690.060.65 微生物生物量碳响应比4−−− 土壤湿度响应比351.910.19<0.01 土壤温度响应比29−1.100.010.64 凋落物去除本底铵态氮14−0.000.000.84 本底硝态氮13−0.120.340.04 根系去除本底铵态氮3−−− 本底硝态氮3−−−
说明: n表示数据点的样本量, 当 n<5 时, 不做统计分析(用“−”表示); 粗体数字表示p < 0.05。
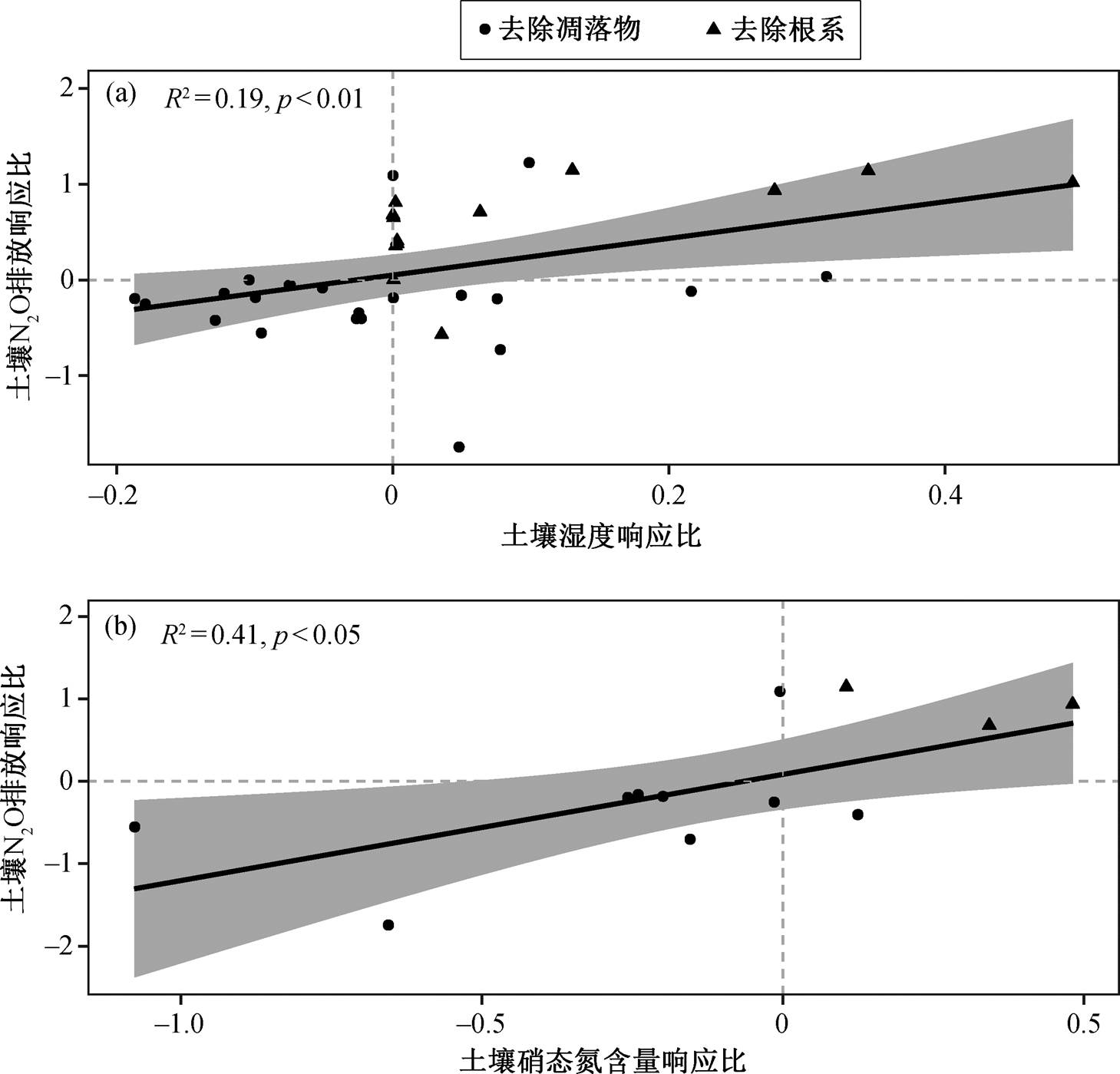
阴影区域表示95%的置信区间, 下同
图3 凋落物去除和根系去除下土壤N2O排放响应比与土壤湿度响应比(a)和土壤硝态氮响应比(b)的关系
Fig. 3 Relationships between the response ratio (RR) of soil N2O emission and RR of soil moisture (a) and soil nitrate content (b) under litter-removal treatment and root-removal treatment
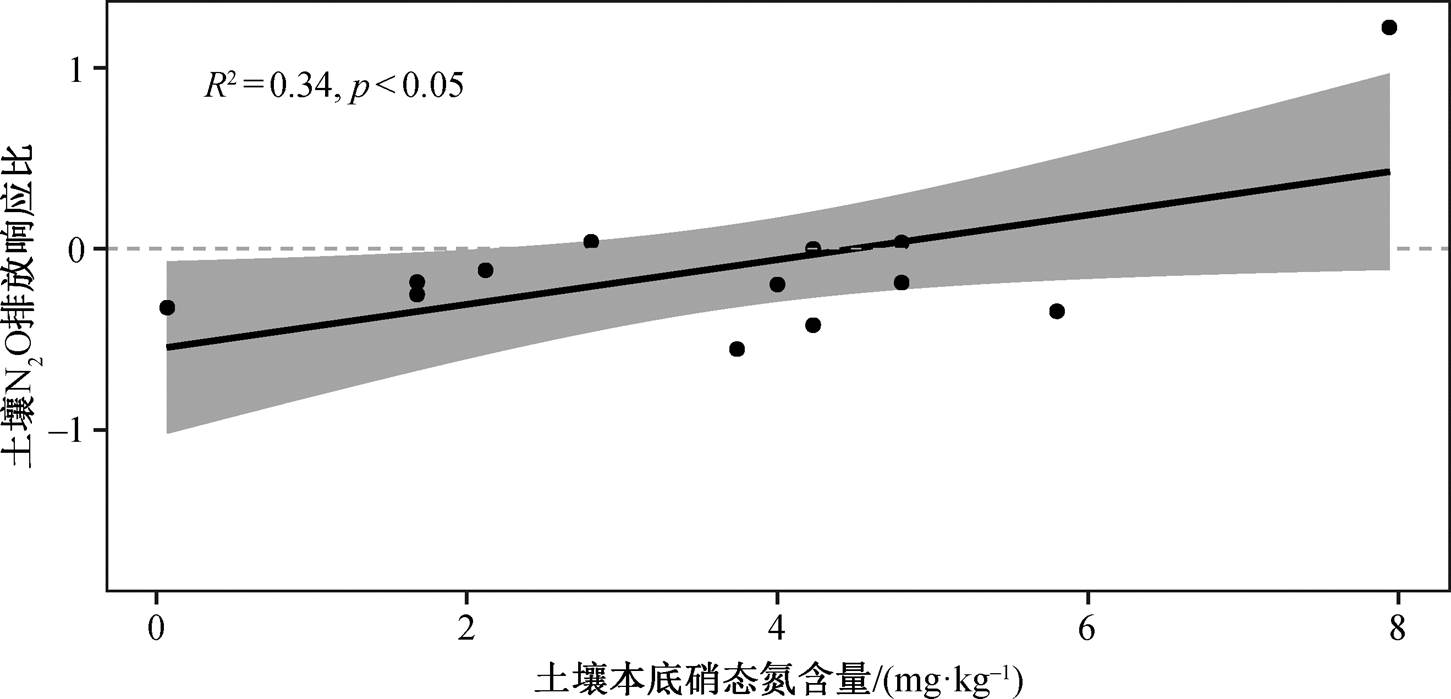
图4 去除凋落物处理下土壤N2O排放响应比与土壤本底硝态氮的关系
Fig. 4 Relationship between the response ratio of soil N2O emission and the baseline soil nitrate content under litter-removal treatment
整合分析结果表明: 1)去除根系后, 土壤 N2O排放显著增加, 土壤湿度和硝态氮含量也显著增加(图 2); 2)改变植物输入后, 土壤 N2O 排放的响应比与土壤湿度的响应比、土壤硝态氮的响应比呈正相关关系(图 3, 表 1)。与以往的研究结果相似, 本研究也发现去除根系后土壤硝态氮含量增加, 同时土壤湿度增加[21–25]。
根系去除导致土壤 N2O 排放的增加可能与 3 个方面的因素有关。1)根系去除后, 减弱了根系对水分的吸收, 土壤含水量增加。土壤含水量影响土壤通气性、氧化还原电位、土壤有效氮分布及其对微生物的有效性等[25]。一般而言, 土壤水分的增加会导致土壤通气性变差, 土壤孔隙度变小, 营造厌氧环境, 有利于反硝化作用[26]。虽然土壤含氧量下降, 不利于 N2O 气体运输, 但微生物的反硝化作用产生更多的 N2O。2)去除根系处理后, 减弱了根系对土壤速效氮的吸收及其与微生物对 N 素的竞争, 导致微生物有更加充裕的底物, 从而增加其反硝化能力产生 N2O[27]。3)所有的研究均使用挖沟(tren-ching)方法来模拟去除根系处理, 这会在短期内使土壤中留下很多死根, 死根的分解增加了 N2O 的底物来源。虽然根际沉积物的降低减少了对休眠微生物的刺激作用[28], 但死根分解过程中营造的厌氧环境可能会增强反硝化细菌活性[23]。总的来说, 去除根系处理对 N2O 排放的促进影响超过抑制影响。
本研究基于全球范围的 61 对野外观测数据, 探究植物输入减少对土壤 N2O 排放的影响与调控因素。研究结果表明, 去除凋落物处理后, 土壤 N2O排放显著降低(−16.5%); 去除根系处理后, 土壤N2O 排放显著增加(+131.6%)。土壤水分和硝态氮含量的变化是调控土壤 N2O 排放响应植物输入降低的主要因素。凋落物去除和根系去除是植物残体输入和去除实验(DIRT)的组成部分。未来的研究中可以补充凋落物输入增加等条件的 DIRT 实验, 丰富DIRT 处理下土壤 N2O 排放的问题。总的来说, 本文的研究结果揭示了凋落物去除和根系去除对土壤N2O 排放的影响与调控因素, 有利于理解未来全球变化背景下植物输入的改变如何调控土壤 N2O 的排放。
参考文献
[1] IPCC. Summary for policymakers—Global warming of 1.5 °C. Geneva, 2018
[2] Tian H, Xu R, Canadell J G, et al. A comprehensive quantification of global nitrous oxide sources and sinks. Nature, 2020, 586: 248–256
[3] Dalal R C, Wang W, Robertson G P, et al. Nitrous oxide emission from Australian agricultural lands and mitigation options: a review. Soil Research, 2003, 41 (2): 165–195
[4] Wen L, Lei P, Xiang W, et al. Soil microbial biomass carbon and nitrogen in pure and mixed stands of Pinus massoniana and Cinnamomum camphora dif-fering in stand age. Forest Ecology & Management, 2014, 328: 150–158
[5] Kuzyakov Y, Blagodatskaya E. Microbial hotspots and hot moments in soil: concept & review. Soil Bio-logy and Biochemistry, 2015, 83: 184–199
[6] Sayer E J. Using experimental manipulation to assess the roles of leaf litter in the functioning of forest ecosystems. Biological Reviews, 2006, 81(1): 1–31
[7] Frank D A, Groffman P M. Plant rhizospheric N pro-cesses: what we don’t know and why we should care. Ecology, 2009, 90(6): 1512–1519
[8] Ma X, Zhu B, Nie Y, et al. Root and mycorrhizal stra-tegies for nutrient acquisition in forests under nitro-gen deposition: a meta-analysis. Soil Biology and Bio-chemistry, 2021, 163: 108418
[9] Cheng J, Lee X, Zhou Z, et al. The effects of litter layer and soil properties on the soil-atmosphere fluxes of greenhouse gases in karst forest, southwest China. Polish Journal of Ecology, 2013, 61: 79–92
[10] Tang X, Liu S, Zhou G, et al. Soil-atmospheric ex-change of CO2, CH4, and N2O in three subtropical forest ecosystems in southern China. Global Change Biology, 2006, 12(3): 546–560
[11] Wieder W R, Cleveland C C, Townsend A R. Through-fall exclusion and leaf litter addition drive higher rates of soil nitrous oxide emissions from a lowland wet tropical forest. Global Change Biology, 2011, 17 (10): 3195–3207
[12] Liu H, Zhao P, Lu P, et al. Greenhouse gas fluxes from soils of different land-use types in a hilly area of South China. Agriculture, Ecosystems & Environ-ment, 2008, 124(1): 125–135
[13] Luo Y, Hui D, Zhang D. Elevated CO2 stimulates net accumulations of carbon and nitrogen in land ecosys-tems: a meta-analysis. Ecology, 2006, 87(1): 53–63
[14] Han Y, Feng J, Han M, et al. Responses of arbuscular mycorrhizal fungi to nitrogen addition: a meta-analy-sis. Global Change Biology, 2020, 26(12): 7229–7241
[15] Feng J, He K, Zhang Q, et al. Changes in plant in- puts alter soil carbon and microbial communities in forest ecosystems. Global Change Biology, 2022, 28 (10): 3426–3440
[16] Wang Y, Wang H, Wang Z L, et al. Effect of litter la-yer on soil–atmosphere N2O flux of a subtropical pine plantation in China. Atmospheric Environment, 2014, 82: 106–112
[17] Welch B, Gauci V, Sayer E J. Tree stem bases are sources of CH4 and N2O in a tropical forest on upland soil during the dry to wet season transition. Global Change Biology, 2019, 25(1): 361–372
[18] Peichl M, Arain M A, Ullah S, et al. Carbon dioxide, methane, and nitrous oxide exchanges in an age-sequence of temperate pine forests. Global Change Biology, 2010, 16(8): 2198–2212
[19] Zheng X, Wang S, Xu X, et al. Soil N2O emissions increased by litter removal but decreased by phos-phorus additions. Nutrient Cycling in Agroecosystems, 2022, 123: 49–59
[20] Zheng X, Liu Q, Zheng L, et al. Litter removal enhan-ces soil N2O emissions: implications for management of leaf-harvesting Cinnamomum camphora planta-tions. Forest Ecology and Management, 2020. 466: 118–121
[21] Ernfors M, Rütting T, Klemedtsson L. Increased ni-trous oxide emissions from a drained organic forest soil after exclusion of ectomycorrhizal mycelia. Plant and Soil, 2011, 343(1): 161–170
[22] Holz M, Aurangojeb M, Kasimir Å, et al. Gross ni-trogen dynamics in the mycorrhizosphere of an orga-nic forest soil. Ecosystems, 2016, 19(2): 284–295
[23] Hu Q, Cai J, Yao B, et al. Plant-mediated methane and nitrous oxide fluxes from a Carex meadow in Poyang Lake during drawdown periods. Plant and Soil, 2016, 400(1): 367–380
[24] Silver W L, Thompson A W, McGroddy M E, et al. Fine root dynamics and trace gas fluxes in two low-land tropical forest soils. Global Change Biology, 2005, 11(2): 290–306
[25] Varner R K, Keller M, Robertson J R, et al. Experi-mentally induced root mortality increased nitrous oxide emission from tropical forest soils. Geophysi-cal Research Letters, 2003, 30(3): 1144–1148
[26] Han M G, Zhu B. Changes in soil greenhouse gas fluxes by land use change from primary forest. Global Change Biology, 2020, 26(4): 2656–2667
[27] ShenY W, Zhu B. Arbuscular mycorrhizal fungi re-duce soil nitrous oxide emission. Geoderma, 2021, 402: 115179
[28] Joergensen R G, Wichern F. Alive and kicking: why dormant soil microorganisms matter. Soil Biology and Biochemistry, 2018, 116: 419–430
Responses of Soil N2O Emission to Litter Removal and Root Removal: A Meta-Analysis
Abstract Based on litter removal and root removal experiments carried out worldwide, 61 pairs of soil N2O emission data were obtained, and the effects and regulatory factors of litter removal and root removal on soil N2O emission were quantitatively evaluated by the meta-analysis approach. The results showed that soil N2O emission decreased (−16.5%) significantly after removing litters, but increased (+131.6%) significantly after removing roots. The response ratio (RR) of soil N2O emission was positively correlated with the RR of soil moisture and nitrate nitrogen content under litter and root removal treatments, which suggested that soil moisture and nitrate nitrogen content were the main factors regulating the response of soil N2O emission to reduced plant inputs. Overall, the results reveal the effects of litter removal and root removal on soil N2O emission and regulatory factors for such effects, which is helpful to understanding how altered plant inputs will regulate soil N2O emissions in the context of future global change.
Key words N2O; greenhouse gases; detritus input and removal treatments (DIRT); litter removal; root removal; meta-analysis