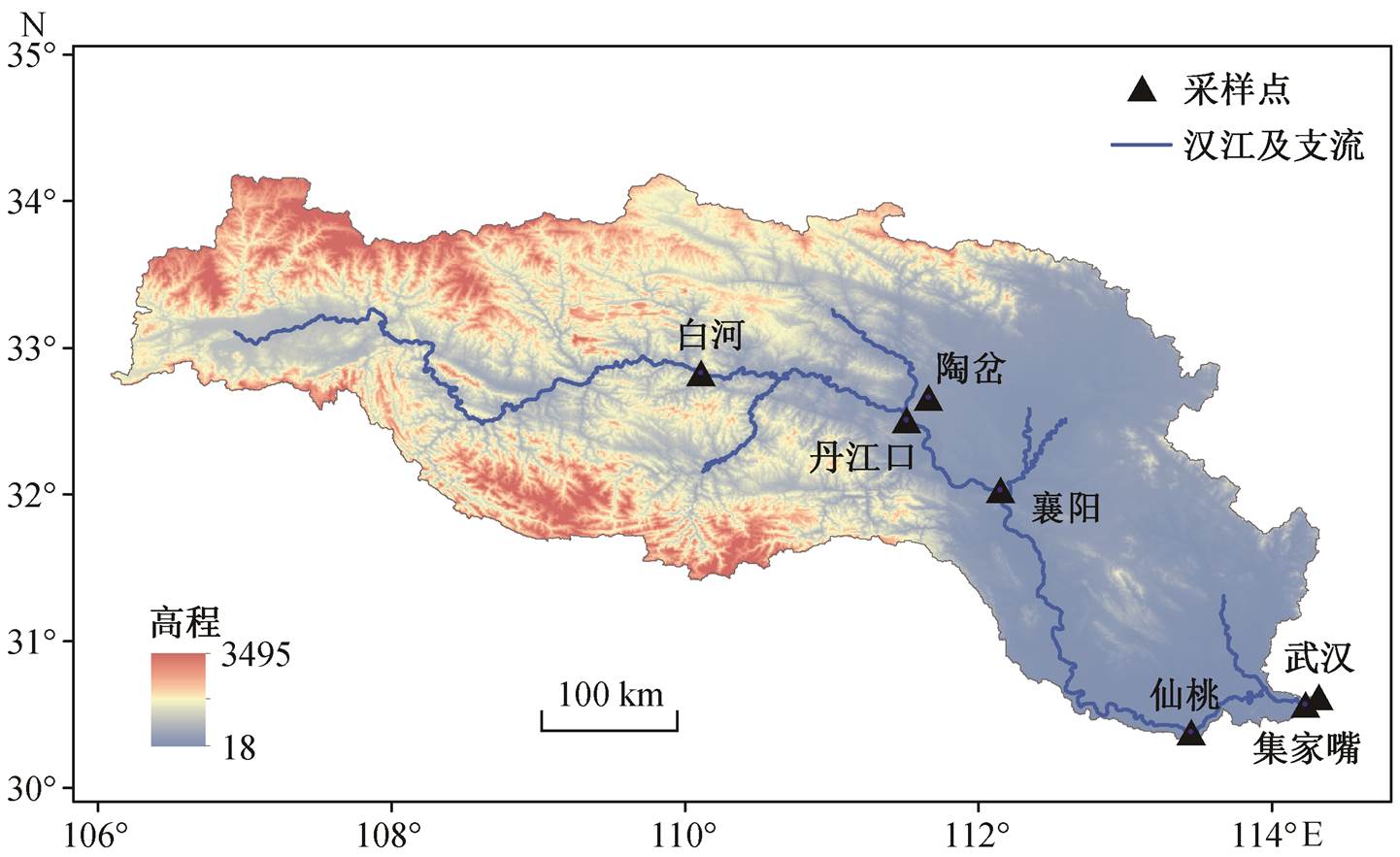
图1 采样点布设
Fig. 1 Distribution of sampling sites
北京大学学报(自然科学版) 第59卷 第2期 2023年3月
Acta Scientiarum Naturalium Universitatis Pekinensis, Vol. 59, No. 2 (Mar. 2023)
doi: 10.13209/j.0479-8023.2023.004
国家自然科学基金(41907203)和中国博士后科学基金(2021T140010)资助
收稿日期: 2022–03–02;
修回日期: 2022–03–27
摘要 基于 Illumina 高通量测序, 调查汉江浮游细菌整体及稀有、丰富物种的组成、分布与构建机制, 得到细菌 22 门 55 纲 93 目 132 科 164 属, Proteobacteria, Actinobacteria 和 Bacteroidetes 等为优势菌门。将 4035 个ASV (80.2%)定义为稀有物种。汉江浮游细菌群落 α多样性季节差异显著, 而稀有物种受季节的影响更显著。非度量多维尺度分析结果显示, 汉江浮游细菌群落季节分布与沿程分布差异不显著。Mantel 分析结果表明, 溶解氧和氨氮为秋季群落的主要影响因素。方差分解分析结果表明, 环境因子对群落的影响大于空间因子。确定性过程为群落总体的主导构建机制, 而稀有及丰富物种主要受随机过程影响。与丰富物种相比, 稀有物种受环境选择过程的影响更大。
关键词 汉江; 浮游细菌; 稀有物种; 构建机制
细菌是生态系统中的重要组成成分。河流水体充当生物和非生物物质的载体[1], 河流浮游细菌通过复杂的群落结构和功能, 耦合大陆与海洋间碳、氮、磷和硫等元素的循环过程[2–3], 在淡水水生生态系统的能量流动和生物地球化学循环中起到关键作用[4–5]。生物信息学技术已广泛应用于微生物生态学, 能够基于高通量测序数据揭示细菌群落组成、探究其生物地理学分布特征以及群落组装过 程[1,6–8], 从而为维护水生生态环境平衡健康发展提供依据[9]。
高通量测序技术可以从环境样本中鉴别丰度较高的丰富物种和丰度较低的稀有物种[10]。前者实现了环境中大部分的生态功能[11], 但稀有物种也是群落生态的重要贡献者, 它们提供了丰富的遗传多样性与广泛的生态功能, 为维持生态平衡、增强群落的适应性提供了更多的可能性[12–13]。已有研究表明, 在土壤[14–15]、海洋[16–17]和湖泊[18]等生态系统中, 稀有物种表现出独特的分布模式, 与丰富物种有显著差异, 因此进一步探索其生物地理学模式及群落构建差异十分必要[19]。
汉江是长江最大的支流, 发源于陕西秦岭, 流经陕西和湖北两省, 在武汉市汉口龙王庙汇入长江, 是“长江经济带”的重要组成部分, 承载上百万人的用水需求。朱庆威等[20]从汉江上游采样, 探究沉积物细菌群落结构特征及其形成过程中所受的生态机制影响。梁俊等[21]研究了丹江口水库生态调度期间汉江中下游细菌群落结构的变化特征。但是, 对汉江流域内细菌群落结构及稀有物种和丰富物种的生物地理学分布研究仍有待开展。
本研究在汉江采集春、秋两季水样, 利用二代扩增子测序技术, 探究自然生态和人类活动作用下的汉江浮游细菌总体群落和稀有物种、丰富物种的组成、多样性、分布特征及群落构建机制, 为河流微生物研究提供基础资料, 为维护汉江绿色生态功能提供科学参考。
汉江为长江第一大支流, 干流全长 1577km, 丹江口以上为上游, 丹江口至钟祥为中游, 钟祥以下为下游, 流域面积为 15.9 万 km2[22]。受季风气候影响, 汉江流域径流年内分配不均, 夏秋多, 冬春少, 雨量分布大致呈现东南向西北递减的趋势, 不同降水期径流相差约 6 倍[23]。汉江满足着沿线居民的用水需求, 其中丹江口水库是南水北调中线干线工程的水源地, 具有重要的战略意义。
本研究在汉江流域布设 7 个采样点, 自上而下依次为白河(1BH)、陶岔(2TC)、丹江口(3DJK)、襄阳(4XY)、仙桃(5XT)、集家嘴(6JJZ)和武汉(7WH), 分别于 2014 年 3 月和 10 月对水体样品进行采集, 站点位置如图 1 所示。
使用采水器采集水体样品, 采集好的水样于0~4ºC 冷藏运输至实验室, 采样方法参照《淡水浮游生物调查技术规范》(SC/T 9402—2010)。24 小时内, 使用孔径为 0.22μm 的聚碳酸酯膜(Millipore, USA)过滤水样, 后续滤膜用于 DNA 提取。
同时, 使用流速仪测定水体流量, 用 YSI-85水质分析仪(YSI, USA)现场测定水体 pH 值、水温和溶解氧等指标, 化学需氧量、氨氮和生物需氧量等理化指标的测定在实验室按标准方法进行。

图1 采样点布设
Fig. 1 Distribution of sampling sites
每份样品取两张滤膜置于 2mL 灭菌离心管中, 经液氮速冻后捣碎, 使用 FastDNA® SPIN Kit for soil 试剂盒(MP Biomedicals, USA)进行 DNA 提取。每份样品进行 3~5 次 DNA 提取, 混合后作为该样品的 DNA 样本。使用 0.8%的琼脂糖凝胶电泳检测DNA 是否完整, 用 NanoDrop 2000 (Thermo Fisher Scientific, 美国)检测 DNA 浓度和纯度。选用细菌16SrRNA 基因 V4-V5 区域进行 PCR 扩增和 Illu-mina 测序, 引物为 515F(5’-GTGCCAGCMGCCGC GG-3’)-907R(CCGTCAATTCMTTTRAGTTT-3’), 测序长度为 2×250 bp。
1.4.1生物信息学分析
使用 QIIME2[24]对 16SrRNA 基因序列进行生物信息学分析。VSEARCH [25]用于合并双端序列与质量控制, Deblur[26]用于降噪和生成 ASV(Ampli-con Sequence Variants), 剔除序列数少于 10 条的ASV, 使用 Classify-Sklearn 方法[27]进行序列比对和注释, 并去除叶绿体与线粒体的 DNA 片段, 数据库选用 Silva 138 16S rRNA 数据库(99%聚类)。
1.4.2统计学分析
群落由高丰度的优势种以及低丰度的稀有种构成[28]。本研究中将所有物种按照相对丰度均值定义为丰富物种(abundant taxa, AT, 相对丰度均值高于 0.1%)和稀有物种(rare taxa, RT, 相对丰度均值低于 0.01%)。
使用 R 语言计算 Richness 指数、Chao1 指数、Shannon 指数和 Pielou 指数等 4 种多样性指数以及PD(phylogenetic diversity, 系统发育多样性)、PD/ Richness、MNTD(mean nearest taxon distance, 平均最近种间距离)和 NTI (nearest taxon index, 最近种间距离)等 4 种系统发育指数。如果数据服从正态分布并通过方差齐性检验, 则进行 t 检验, 否则进行 Wilcoxon 秩和检验。
采用 Bray-Curtis 距离表现浮游细菌群落及丰富、稀有物种两两间的差异, 通过非度量多维尺度分析(non-metric multidimensional scaling, NMDS) 探究浮游细菌群落的物种组成, 通过相似性分析(ANOSIM)检验浮游细菌群落组成的组间差异。用方差分解分析(variance partitioning analysis, VPA)来比较环境和空间因素对细菌群落结构的影响。由于这些环境因素之间可能存在共线性, 使用基于调整后的 R2 的前向选择来最大限度地减少影响。
为量化构建机制对浮游细菌群落结构的贡献, 在零模型的基础上计算 β-最近种间距离(β-nearest taxon index, βNTI)与基于 Raup-Crick 的Bray-Curtis相异性指数(Bray-Curtis-based Raup-Crick metric, RCbray)[29–31]。βNTI<−2 表明同化选择作用(homoge-neous selection)使得群落的系统发育相似性更高, βNTI>2 则为异化选择作用(variable selection)在起主导作用。|βNTI|<2 时, 随机过程主导群落构建, 此时若 RCbray>+0.95, 表明扩散受限(dispersal limi-tation)主导群落构建, 导致群落 β 多样性显著大于零模型, 若 RCbray<−0.95, 则表明同化扩散(homo-genizing dispersal)使得群落 β 多样性显著低于零模型, 当|RCbray|<0.95 时, 通常认为无主导过程(undo-minated processes)影响群落结构。
以上分析通过 R 语言的vegan, ggplot2, picante和 linkET 等程序包实现。
本研究共测得 5029 个 ASV, 包含细菌 22 门 55纲 93 目 132 科 164 属。汉江流域内浮游细菌群落中Proteobacteria(变形菌门)、Actinobacteria(放线菌门)和 Bacteroidetes(拟杆菌门)三者相对丰度之和达90%以上。与汉江上游及支流[20]相比, Proteobac-teria 和 Proteobacteria 均为优势菌门, 而 Actinobac-teria 在中下游流域更丰富[33]。其中, Proteobacteria在秋季丰度较高(春季 33.7%, 秋季 49.0%), Bacte-roidetes 在春季丰度较高(春季 26.2%, 秋季14.3%)。Planctomycetes(浮霉菌门)、Acidobacteria(酸杆菌门)、Chlorobi(绿菌门)、Chloroflexi(绿弯菌门)、Cyanobacteria(蓝细菌)、Verrucomicrobia(疣微菌门)、Firmicutes(厚壁菌门)和 Armatimo-nadetes(装甲菌门)的相对丰度也高于 1%。浮游细菌群落在各样品中的门水平分布如图 2 所示。
本研究选取 Richness 指数、Chao1 指数、Shan-non 指数、Pielou 指数、PD 指数、PD/Richness 值、MNTD 以及 NTI 指数, 对汉江浮游细菌群落多样性进行评价。Richness 指数用于统计测得的物种数量, Chao1 指数用于估计群落中含 ASV 数目, Shannon指数反映群落的多样性, Pielou 指数可以得到群落的物种均匀度, PD 指数用于评估群落的系统发育多样性, 另外, 通过计算 PD/Richness 值, 可以消除物种丰富度的影响, MNTD 与 NTI 反映群落的系统发育组成。
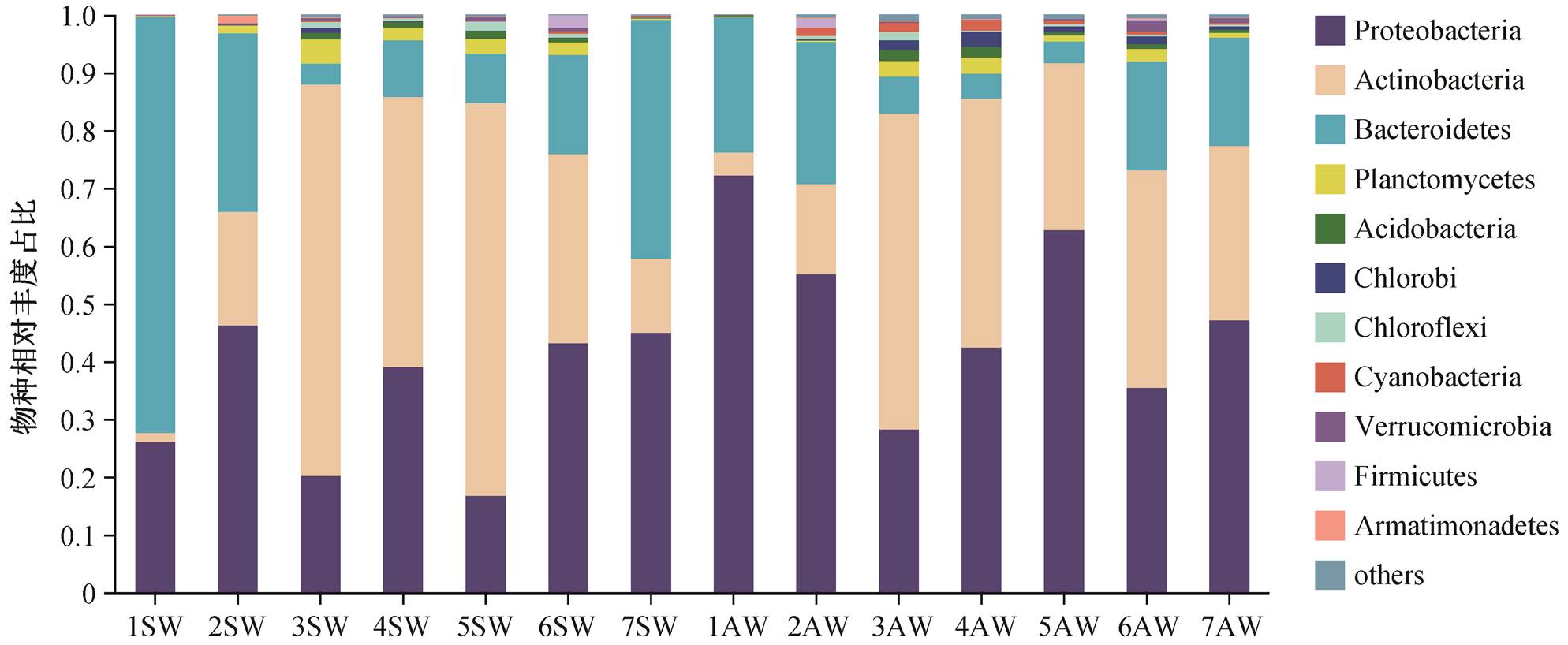
SW: 春季水体; AW: 秋季水体
图2 汉江浮游细菌门水平分布
Fig. 2 Distribution of bacterioplankton on Phylum level in Hanjiang River
如图 3 所示, 通过计算 α 多样性指数, 基于 t 检验与 Wilcoxon 秩和检验, 发现细菌群落的丰富度、Chao1 指数、PD 指数与 NTI 指数在春秋两季存在显著性差异, 秋季的 Richness 指数、Chao1 和 PD指数均高于春季, NTI 低于春季, 说明汉江秋季的细菌群落具有更高的丰富度和系统发育多样性。而其他指数(如香农多样性和均匀度等)没有表现出季节差异, 与汉江上游细菌群落的情况[32]类似。
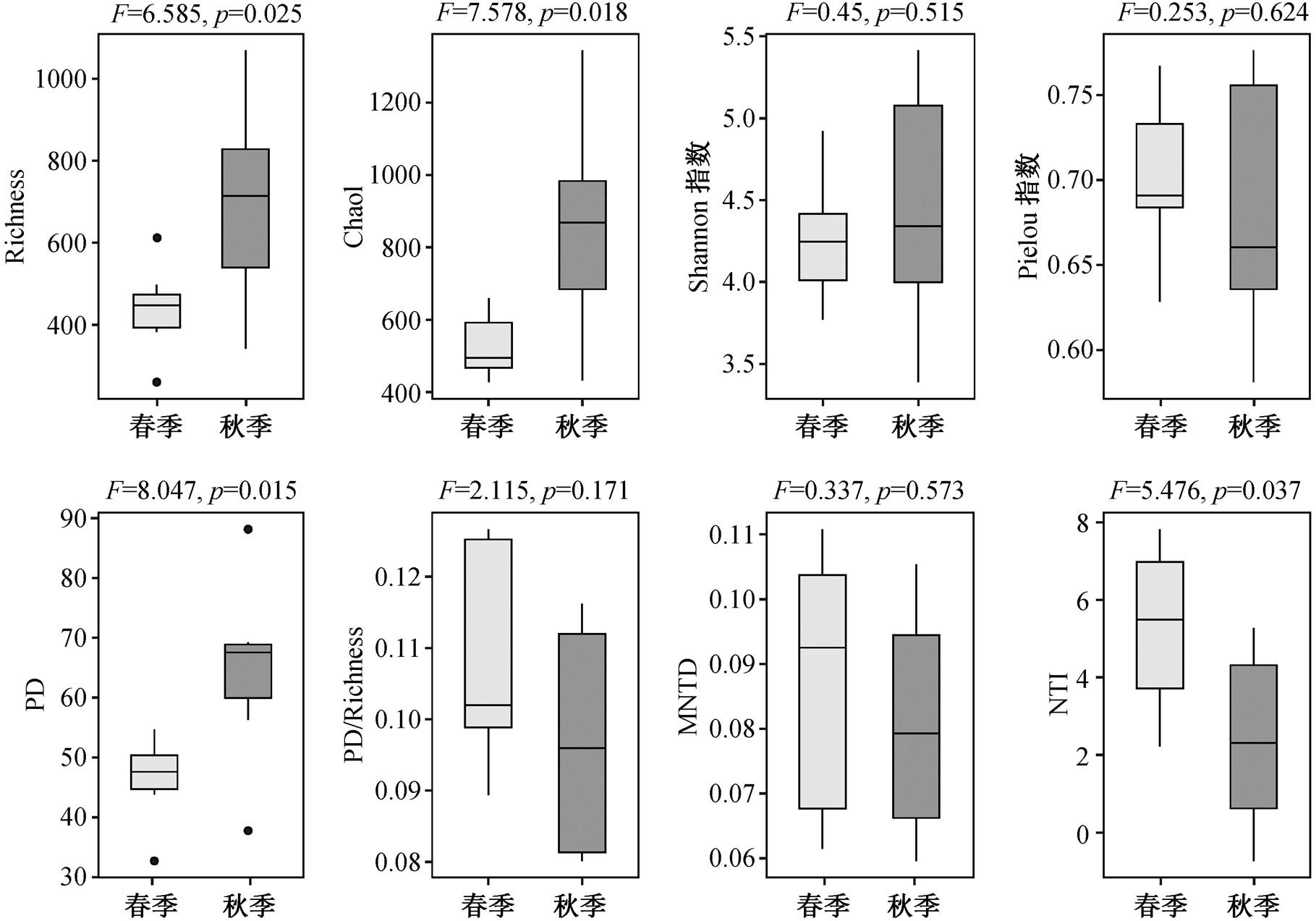
图3 春秋两季汉江细菌群落 α多样性指数差异
Fig. 3 Differences of alpha diversity index of bacterial community between spring and autumn in Hanjiang River
本研究中, 共计 4035 个 ASV 被定义为稀有物种(RT), 丰度占全部 ASV 的 10.1%; 相比之下仅 有 171 个 ASV 被定义为丰富物种(AT), 分属 Actino-bacteria, Bacteroidetes, Chlorobi, Planctomycetes 和Proteobacteria5 个门, 但丰度却占到 66.6%。如图4 所示, 丰富物种的丰富度和相对丰度没有表现出季节差异, 而稀有物种在秋季的丰富度和相对丰度显著高于春季, 表明稀有物种受季节的影响较为显著, 这与长江的情况[13]一致。由于稀有物种的多样性, 这种影响可能更为广泛。
对汉江从白河至武汉 7 个站点的样品, 基于Bray-Curtis 距离的 NMDS 分析结果表明, 浮游细菌的群落组成没有显著的季节差异。空间方面, 群落Bray-Curtis 距离和与武汉距离的 Mantel 分析结果表明, 汉江随地理距离的衰减模式不明显(p>0.05), 可能受到支流或外源汇入的影响。考虑到汉江以丹江口和钟祥为界分为上、中、下游, 根据采样点的地形分布, 将所有样品区分为上游和中下游两段进行分析。排序结果(图 5)显示, 群落总体和稀有物种的样品在不同河段具有差异, 丰富物种无明显变化, 表明由于庞大的多样性, 稀有物种对群落存在较大的潜在影响, 从而与群落总体保持相似的分异趋势, 但 ANOSIM 分析结果显示此段 p 值不显著, 可能是由于样本较少。
本研究调查汉江流域 16 个环境因子参数, 分别为流量(Q)、水温(T)、pH 值、固体悬浮物(SS)、电导率(COND)、溶解氧(DO)、硬度(THRD)、氯离子(Cl−)、硫酸根离子(SO42−)、氟离子(F−)、氨氮(NH3−)、硝态氮(NO3−)、总磷(TP)、总氮(TN)、五日生化需氧量(BOD5)和高锰酸盐指数(CODMn)。采用 t 检验和 Wilcoxon 秩和检验分析春季与秋季之间的差异, 发现仅有气温、水温、溶解氧和 pH 表现出显著差异, 秋季水温和气温显著高于春季, 春季的溶解氧和 pH 高于秋季, 其他理化因子无显著差异。相关性分析结果(图 6)显示, 春季理化因子中有 24 对显著相关(p<0.05), 而秋季有 41 对, 意味着秋季的环境因子可能存在更多的相互作用。
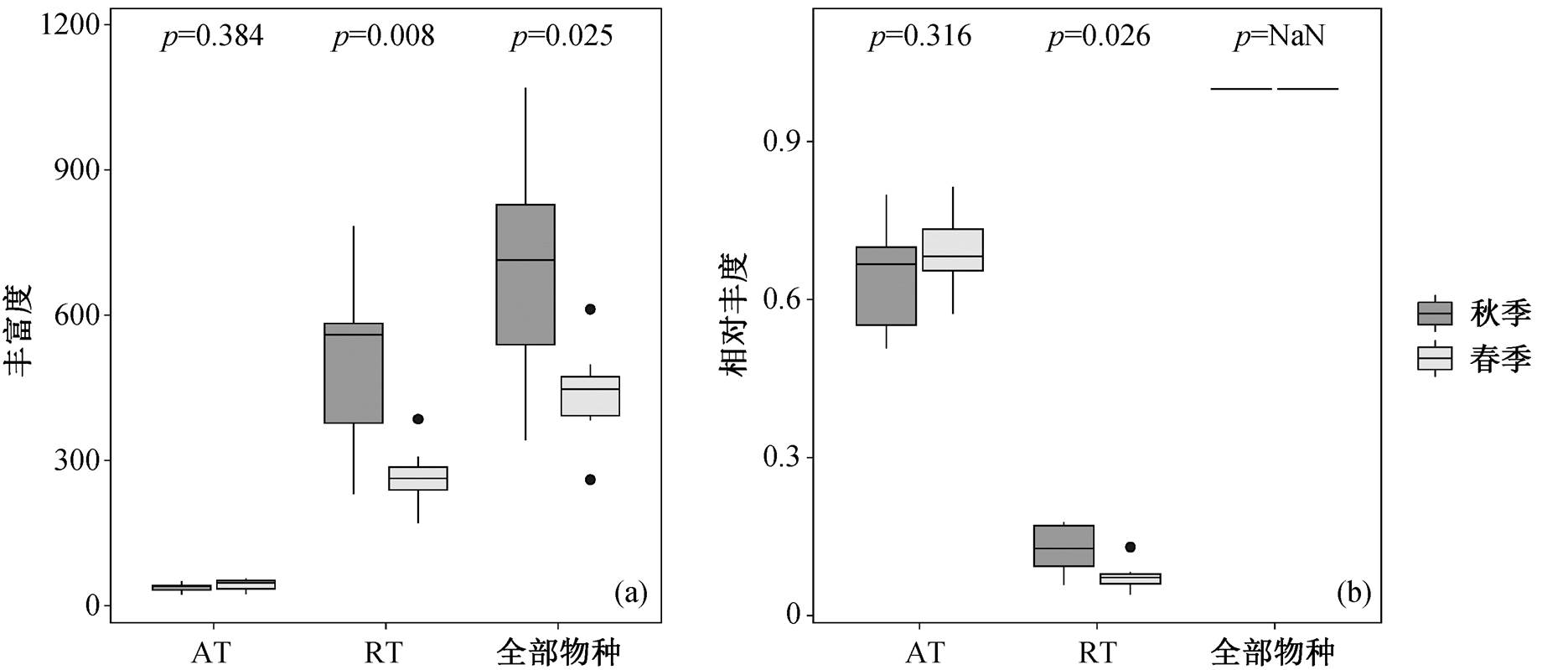
图4 春秋两季汉江细菌群落的丰富度与相对丰度
Fig. 4 Richness and relative abundance of bacterial community in spring and autumn in Hanjiang River
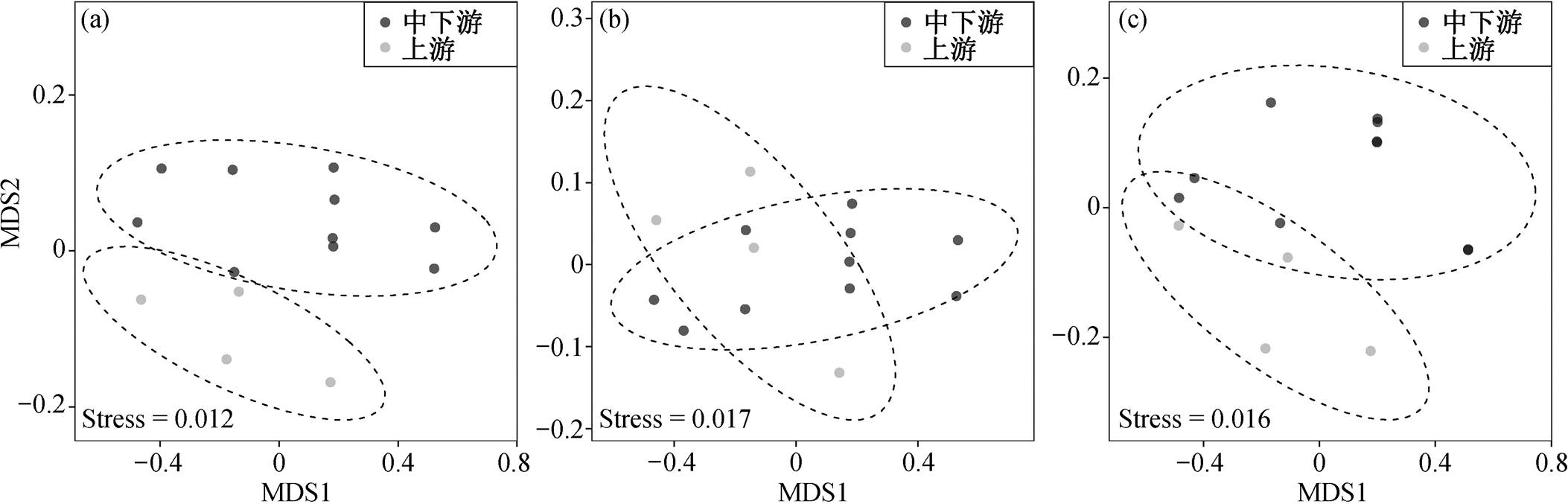
图5 汉江细菌群落整体(a)、丰富(b)及稀有(c)物种的沿程差异
Fig. 5 Spatial differences of total (a), abundant (b) and rare (c) bacterial community along Hanjiang River
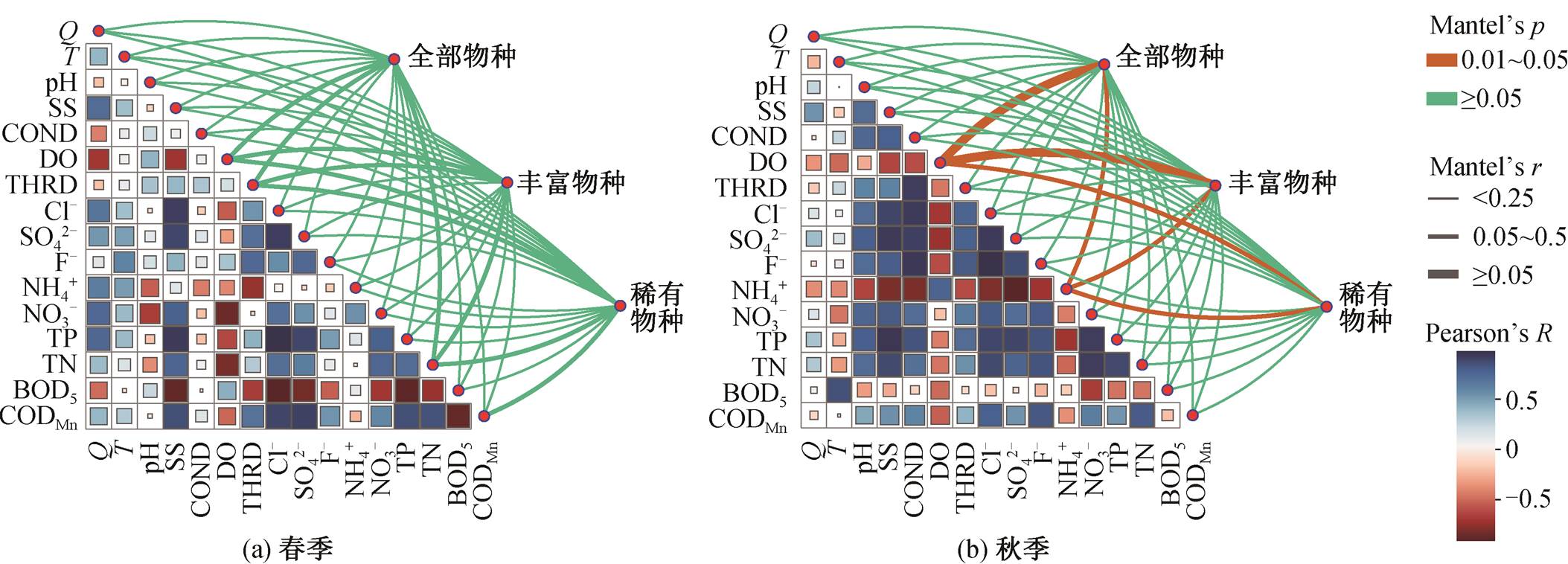
图6 环境因子对浮游细菌群落的影响
Fig. 6 Effects of environmental factors on bacterioplankton community
将群落组成与主要环境因子的相关性作为评估环境因子对群落影响的依据, Mantel 分析结果表明溶解氧与氨氮含量为秋季浮游细菌的主要影响因素, 并且与丰富物种的相关性更高(图 6), 与长江干流中溶解氧对水体中细菌群落的显著影响[1]相似。由于春季的群落组成与环境因子没有表现出显著相关性, 表明春季的群落受环境因素的影响较弱, 与汉江上游的研究结果[20]一致。VPA 分析结果(图 7)表明, 纯空间因子(样点距离)对细菌群落的解释度为 13.2%, 纯环境因子为 29.5%, 但二者结合起来解释度反而降低, 总计贡献 26.9%的解释度, 表明空间因子与环境因子存在共线性。
使用系统发育零模型评估汉江细菌群落的构建机制。图 8 表明, 对于所有物种, 确定性过程是群落的主要构建过程(69.2%), 其中同化选择过程贡献64.8%。但是, 对于稀有物种, 两个季节整体上均为随机性过程主导(53.9%), 秋季确定性过程贡献较大(76.2%), 受异化选择影响, 群落的系统发育可能更趋于相异, 同时群落整体 PD 指数在秋季更高, 说明稀有物种贡献较多的系统发育具有多样性。随机性过程也是丰富物种的主要构建机制(67.0%), 且所占比例比稀有物种高, 与长江干流细菌群落[13]的构建相似, 可能是因为其普遍的分布及较高的丰度, 其中尤以扩散受限为主(59.3%)。
同化选择、异化选择和扩散受限 3 种主要过程塑造了汉江浮游细菌群落, 这些过程对不同物种的贡献差异反映群落演变过程的复杂性。稀有物种同时受这 3 种过程的主导, 且相对比例变化较大, 表明其对环境的响应与丰富物种不同, 并且更易受外界因素的扰动, 甚至会在局部生境中消失[33]。确定性过程对群落总体影响较大, 表明可能存在其他对环境的选择作用十分敏感的物种。群落总体和丰富物种春季确定性过程贡献高于秋季, 一方面由于丰富物种受到异化选择过程影响, 另一方面由于同化选择对春季整体群落影响的主导地位。这些对环境选择过程的响应表明, 还有其他未监测因子以及生物间的相互作用对细菌群落有着重要的影响。
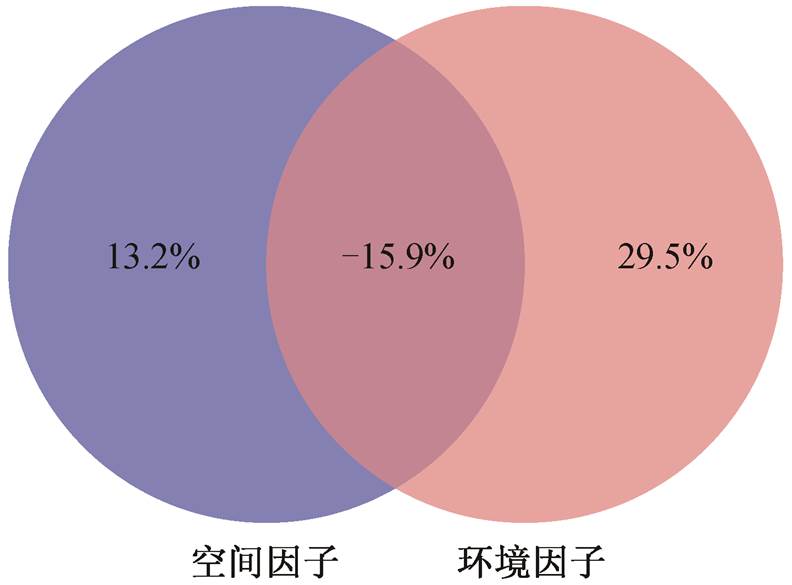
残差 = 73.1%
图7 环境与空间因子对浮游细菌群落的影响
Fig. 7 Effects of environmental and spatial factors on bacterioplankton community
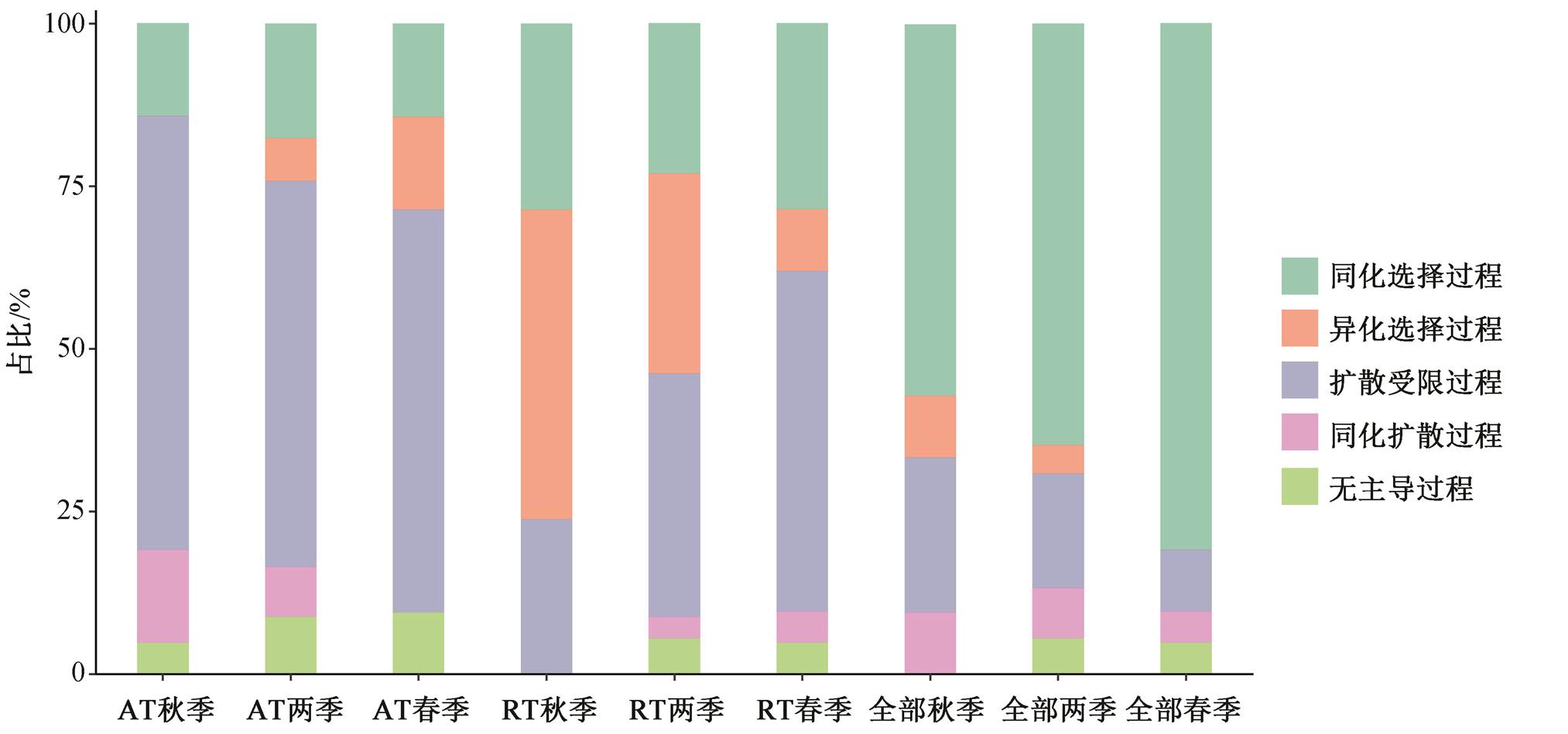
图8 汉江浮游细菌群落构建机制
Fig. 8 Assembly mechanisms of bacterial community in Hanjiang River
本文研究汉江浮游细菌的群落组成、分布与构建机制, 通过高通量测序得到 5029 个 ASV。汉江的优势菌为 Proteobacteria, Actinobacteria 和 Bacteroi-detes 等, 丰富物种 ASV 数量较少, 但丰度占比较高(66.6%), 而稀有物种以较小的丰度贡献了更多的系统发育多样性。汉江浮游细菌的群落组成有明显的季节差异。秋季的细菌群落具有更多的物种数、更高的丰富度与系统发育多样性, 稀有物种表现出相似的趋势, 表明浮游细菌更适应秋季的生境。浮游细菌总体与稀有物种的群落结构在不同的河段有所差异, 表明地理因素对细菌群落的影响大于季节, 体现了稀有物种在群落中的重要作用。环境因子对浮游细菌群落的影响大于空间因子, 其中秋季溶解氧与氨氮含量显著地影响细菌群落。丰富物种和稀有物种均主要受随机性过程影响, 但对环境选择表现出不同的响应, 稀有物种受环境的影响更大。
参考文献
[1] Liu T, Zhang A N, Wang J, et al. Integrated biogeo-graphy of planktonic and sedimentary bacterial com-munities in the Yangtze River. Microbiome, 2018, 6 (1): 16
[2] Raymond P A, Hartmann J, Lauerwald R, et al. Global carbon dioxide emissions from inland waters. Nature, 2013, 503: 355–359
[3] Aufdenkampe A K, Mayorga E, Raymond P A, et al. Riverine coupling of biogeochemical cycles between land, oceans, and atmosphere. Front Ecol Environ, 2011, 9(1): 53–60
[4] Ward N D, Keil R G, Medeiros P M, et al. Degra-dation of terrestrially derived macromolecules in the Amazon River. Nat Geosci, 2013, 6(7): 530–533
[5] Liu T, Liu S, He S, et al. Minimization of N2O emission through intermittent aeration in a sequen-cing batch reactor (SBR): main behavior and mecha-nism. Water, 2021, 13(2): 210
[6] Wang J, Liu Q, Zhao X, et al. Molecular biogeo-graphy of planktonic and benthic diatoms in the Yang-tze River. Microbiome, 2019, 7(1): 153
[7] Ning D, Deng Y, Tiedje J M, et al. A general frame-work for quantitatively assessing ecological stochas-ticity. Proceedings of the National Academy of Scien-ces, 2019, 116(34): 16892–16898
[8] Chen W, Ren K, Isabwe A, et al. Stochastic processes shape microeukaryotic community assembly in a sub-tropical river across wet and dry seasons. Micro-biome, 2019, 7(1): 138
[9] Wang Y, Ye F, Wu S, et al. Biogeographic pattern of bacterioplanktonic community and potential function in the Yangtze River: roles of abundant and rare taxa. Sci Total Environ, 2020, 747: 141335
[10] Wang H, Qi Z, Zheng P, et al. Abundant and rare microbiota assembly and driving factors between mangrove and intertidal mudflats. Appl Soil Ecol, 2022, 174: 104438
[11] Zhang W, Wan W, Lin H, et al. Nitrogen rather than phosphorus driving the biogeographic patterns of abundant bacterial taxa in a eutrophic plateau lake. Sci Total Environ, 2022, 806: 150947
[12] Yi M, Fang Y, Hu G, et al. Distinct community assembly processes underlie significant spatiotem-poral dynamics of abundant and rare bacterioplankton in the Yangtze River. Front Env Sci Eng, 2022, 16 (6): 79
[13] Chen Q, Ding J, Zhu D, et al. Rare microbial taxa as the major drivers of ecosystem multifunctionality in long-term fertilized soils. Soil Biology and Bioche-mistry, 2020, 141: 107686
[14] Jiao S, Lu Y. Soil pH and temperature regulate assembly processes of abundant and rare bacterial communities in agricultural ecosystems. Environ Mic-robiol, 2019, 22(3): 1052–1065
[15] Ji M, Kong W, Stegen J, et al. Distinct assembly mechanisms underlie similar biogeographical patterns of rare and abundant bacteria in Tibetan Plateau grassland soils. Environ Microbiol, 2020, 22(6): 2261–2272
[16] Wu W, Logares R, Huang B, et al. Abundant and rare picoeukaryotic sub-communities present contrasting patterns in the epipelagic waters of marginal seas in the northwestern Pacific Ocean. Environ Microbiol, 2016, 19(1): 287–300
[17] Mo Y, Zhang W, Yang J, et al. Biogeographic patterns of abundant and rare bacterioplankton in three subtro-pical bays resulting from selective and neutral pro-cesses. The ISME Journal, 2018, 12(9): 2198–2210
[18] Peter H, Jeppesen E, De Meester L, et al. Changes in bacterioplankton community structure during early lake ontogeny resulting from the retreat of the Greenland Ice Sheet. The ISME Journal, 2018, 12(2): 544–555
[19] Jiao S, Wang J, Wei G, et al. Dominant role of abundant rather than rare bacterial taxa in maintaining agro-soil microbiomes under environmental distur-bances. Chemosphere, 2019, 235: 248–259
[20] 朱庆威, 潘保柱, 孙贺, 等. 汉江上游干支流沉积物细菌群落多样性和影响因素. 水资源保护, 2022, 38(6): 202–210
[21] 梁俊, 黄峰, 黄睿, 等. 水库生态调度下汉江水环境因子及细菌群落变化特征. 水电能源科学, 2020, 38(2): 65–68
[22] 黄子叶, 王易初, 倪晋仁. 汉江流域河网分级特征研究. 北京大学学报(自然科学版), 2021, 57(2): 351–360
[23] 夏瑞, 张远, 王璐, 等. 汉江下游河流型水华暴发的多影响要素特征识别. 环境科学研究, 2020, 33 (4): 911–920
[24] Bolyen E, Rideout J R, Dillon M R, et al. Repro-ducible, interactive, scalable and extensible micro-biome data science using QIIME 2. Nat Biotechnol, 2019, 37(8): 852–857
[25] Rognes T, Flouri T, Nichols B, et al. VSEARCH: a versatile open source tool for metagenomics. Peer J, 2016, 4: e2584
[26] Amir A, Mcdonald D, Navas-Molina J A, et al. Deblur rapidly resolves single-nucleotide community sequ-ence patterns. mSystems, 2017, 2(2): e00191-16
[27] Bokulich N A, Kaehler B D, Rideout J R, et al. Optimizing taxonomic classification of marker-gene amplicon sequences with QIIME 2’s q2-feature-clas-sifier plugin. Microbiome, 2018, 6(1): 90
[28] Jia X, Dini-Andreote F, Falcão Salles J. Community assembly processes of the microbial rare biosphere. Trends Microbiol, 2018, 26(9): 738–747
[29] Stegen J C, Lin X, Fredrickson J K, et al. Estimating and mapping ecological processes influencing micro-bial community assembly. Front Microbiol, 2015, 6: 370
[30] Stegen J C, Lin X, Fredrickson J K, et al. Quantifying community assembly processes and identifying fea-tures that impose them. The ISME Journal, 2013, 7(11): 2069–2079
[31] Tripathi B M, Stegen J C, Kim M, et al. Soil pH mediates the balance between stochastic and deter-ministic assembly of bacteria. The ISME Journal, 2018, 12(4): 1072–1083
[32] 梁俊, 黄峰, 黄睿, 等. 水库生态调度下汉江水环境因子及细菌群落变化特征. 水电能源科学, 2020, 38(2): 65–68
[33] Lynch M D J, Neufeld J D. Ecology and exploration of the rare biosphere. Nat Rev Microbiol, 2015, 13(4): 217–229
Distribution and Assembly Mechanisms of Rare Bacterioplankton Community in Hanjiang River
Abstract The authors probed Illumina high-throughput sequencing in Hanjiang River to investigate the community structure, distribution and assembly mechanisms of bacterioplankton integrally and rare taxa (RT), abundant taxa (AT) respectively. Hanjiang River bacteria spanned across 22 phyla, 55 classes, 93 orders, 132 families and164 genera dominated by Proteobacteria, Actinobacteria and Bacteroidetes. 4035 ASVS (80.2%) were defined as RT. Significant seasonal differences were found of the bacteria community by alpha diversity and this pattern were intensified by RT. Non-metric multidimensional scaling (NMDS) showed insignificant differences of the seasonal and spatial distribution of bacteria community in Hanjiang River. Mantel tests considered dissolved oxygen (DO) and ammonia nitrogen as primary influencing factors of autumn microbiome community. Variance partitioning analysis (VPA) indicated more stress from environmental factors to the bacteria community compared with spatial factors. The holistic bacteria community was dominated by deterministic process, while both RT and AT were mainly affected by stochastic process. Overall, RT was mainly influenced by environmental selection as opposed to AT which were more inclined to stochastic distribution.
Key words Hanjiang River; bacterioplankton; rare taxa; assembly mechanism