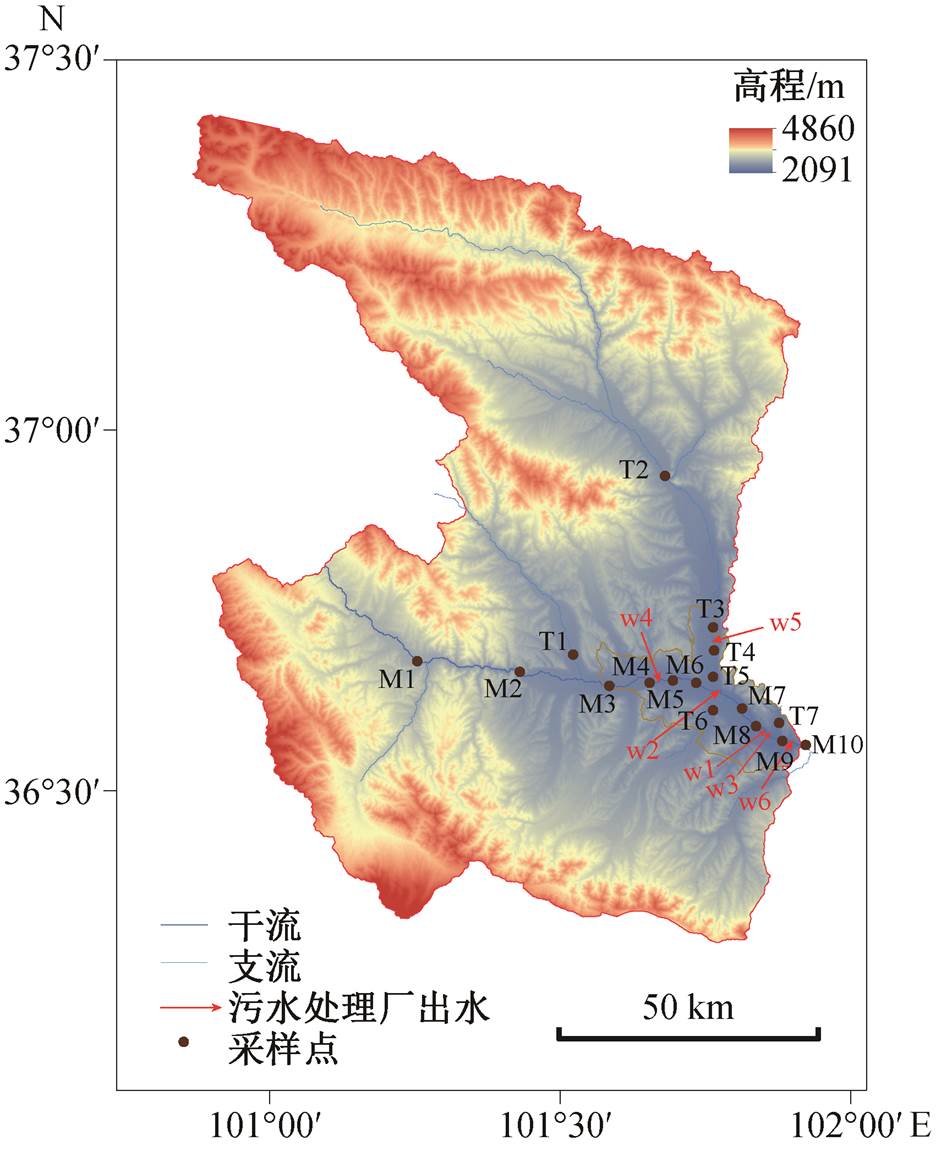
图1 湟水河西宁段采样点分布
Fig. 1 Sampling sites in the study area
北京大学学报(自然科学版) 第59卷 第1期 2023年1月
Acta Scientiarum Naturalium Universitatis Pekinensis, Vol. 59, No. 1 (Jan. 2023)
doi: 10.13209/j.0479-8023.2022.122
青海省自然科学基金(2019-ZJ-952Q)和国家自然科学基金(52100171)资助
收稿日期: 2022–02–27;
修回日期: 2022-03-16
摘要 于丰水期(2018 年 7 月)和枯水期(2019 年 4 月)分别在湟水河西宁段典型断面采集水体和沉积物样品共58 个, 枯水期同时采集污水处理厂出水样 6 个。利用实时荧光定量 PCR 方法, 对 12 种氮转化功能基因进行定量分析。结果表明, 湟水河平均总氮浓度为 3.06±1.23 (1.308~6.51) mg/L。水体和沉积物中相对丰度较高的氮转化功能基因是 narG, nirS 和 nosZ。氮转化功能基因的丰度和组成在沉积物中存在明显的季节差异, 在水体中无明显季节差异。关键氮素转化过程是反硝化, 对水体和沉积物氮素的去除贡献率分别为 88%和 98%。水体氮素转化主要受 pH 值、总氮及 NO3−-N 调控, 其中, 氨氧化与 NO3−-N 浓度负相关, 反硝化与 pH 负相关。沉积物氮素转化与水体氮素浓度、沉积物 pH 值、总氮、总磷和有机碳等相关, 其中, 氨氧化与水体氮素浓度负相关, 而反硝化主要受沉积物性质影响。进一步的分析结果表明, 污水处理厂排放会显著降低水体中 AOA-amoA, CMX-amoA, nirS, nxrB, napA, narG 和 hzsA 等基因的丰度, 增加 nrfA 基因的丰度, 使反硝化、厌氧氨氧化、硝化和完全硝化等过程受到抑制, 硝酸盐异化还原成铵(DNRA)对水体氮素去除的贡献提高。受影响河段沉积物中, AOA-amoA, nxrB 和 CMX-amoA 等基因丰度显著降低, 硝化和完全硝化过程受到抑制。研究结果可为湟水河西宁段氮素污染控制提供科学依据。
关键词 氮转化功能基因; 氮素转化过程; 污水处理厂; 湟水河; 影响因素
氮循环是生物地球化学循环的重要组成部分。作为陆地与海洋生态系统之间的纽带, 河流是承接、输送和转化氮素的重要载体, 通过氮异化和同化等途径参与全球氮素生物地球化学循环[1–2]。受人类活动影响, 大量活性氮排入水体, 破坏了水生态系统中原有的氮平衡[3–4]。过量氮素输入不仅会造成水体缺氧黑臭, 增加水体温室气体 N2O 的排放, 还会导致流域湖泊富营养化及邻近海域赤潮, 威胁水生态系统健康[5–7]。近年来, 含氮化合物成为我国河流的主要污染物之一[8], 因此研究河流氮素转化过程及影响因素, 对控制河流氮污染, 维持流域水生态系统健康和生态系统服务具有重要意义。
河流系统中的氮素循环主要由微生物通过一系列氧化还原过程驱动, 包括矿化、固氮、反硝化、硝酸盐还原、硝酸盐异化还原成铵(DNRA)、氮同化、氨氧化、硝化和厌氧氨氧化等[5–6,9–10], 其中主要涉及硝化和硝酸盐还原两个关键过程。硝化作用的第一步亚硝化过程(NH4+→NO2−)是关键限速步骤, 该过程的主要功能微生物是自养氨氧化细菌(AOB)和氨氧化古菌(AOA), 参与催化的氨单加氧酶(AMO)基因由 3 个亚基 amoA, amoB 和 amoC组成, 氨氧化微生物的定量研究通常用 amoA 作为分子标记[11–13]。硝化作用的第二步亚硝酸盐氧化为硝酸盐(NO2−→NO3−)的过程由亚硝酸盐氧化细菌(NOB)驱动[10,14]。最近发现一种硝化螺菌属[15–16], 能独立地完成从 NH4+ 到 NO3−的完全氨氧化作用(NH4+→ NO3−), 打破了两步硝化的传统认识, 称为完全硝化细菌(Comammox)。硝酸盐还原是将水体中的活性氮通过还原作用去除的过程, 主要包括反硝化、硝酸盐异化还原为铵(DNRA)和厌氧氨氧化 3 个过 程[1,9,17]。硝酸盐还原为亚硝酸盐的过程由 napA 和narG 基因编码的硝酸盐还原酶(NARs)催化[18]。反硝化过程(NO2−→NO−→N2O→N2)和 DNRA (NO2−→ NH4+)是硝酸盐还原为亚硝酸盐(NO3−→NO2−)后进一步进行还原脱氮的两个方向, 最终产物分别为N2和铵[6]。反硝化过程主要由亚硝酸盐还原酶, 一氧化氮还原酶和一氧化二氮还原酶等参与催化[18–19], 相关功能基因分别为 nirK/ nirS, norB 和 nosZ 等。参与 DNRA 过程的细菌携带 nrfA 功能基因编码亚硝酸盐还原酶(NIR)。厌氧氨氧化是在厌氧条件下以 NH4+-N 作为电子供体, 经厌氧氨氧化细菌直接将 NO2−反硝化为 N2 的过程, 厌氧氨氧化细菌由HZS 酶激活, 编码基因为 hzsA 和 hzsB [20–21]。各基因丰度可用做确定环境中各种氮转化潜力的代理变量[22]。通过对这些氮转化功能基因的量化, 可对各氮转化微生物在氮循环中的贡献进行研究。
各种氮转化途径在水生态系统中的作用受环境因子的影响[23]。一般来说, 氮是构成蛋白质、核酸和叶绿素等生物体重要组分所需的营养元素, 因此同化途径比异化途径占优势[18,24]。在异化途径中, 水体氮素去除主要受反硝化、DNRA 和厌氧氨氧化3 个过程调控[25], 在不同的生态系统中存在显著差异。在丹江口水库水体[24]、金水河和淇河夏季水 体[5]、太湖湖区沉积物[26]、芬兰湾的海岸沉积物[27]、长江河口沉积物[25]以及潮白河沉积物[4]中的氮还原过程均以反硝化过程为主。上海城市河网沉积物中, 每年有 1.33 × 105 tN 的损失与反硝化和厌氧氨氧化有关, 约占上海河网氮输入的 20.1%[28]。在无锡城市河流和城郊河流中, 厌氧氨氧化作用是脱氮主要过程[29], 金水河和淇河春秋季水体[5]、珠江口沉积物[30]和亚热带海岸泻湖中 DNRA 对 NO3−去除的贡献较大[31]。
发源于包胡图山的青海省母亲河——湟水河, 是世界第五大河流黄河上游的重要水源, 也是青海省污染物转移的关键路径。湟水河流域人口密集, 工业活动频繁, 社会经济快速发展, 工业生产以及人类生活排放的污水或粪便对水环境产生严重威胁。目前湟水河流域 56%的水体硝酸盐含量高于V 类水氮含量的标准限值[32], 且该流域沿岸分布多个污水处理厂, 可能会加剧水体氮污染。因此, 亟需对其氮转化过程进行探讨, 以便对其氮污染进行控制和管理。我们于丰水期(2018 年 7 月)和枯水期(2019 年 4 月)分别在湟水河西宁段典型断面采集水体和沉积物样品共 58 个, 同时在枯水期采集 6 个污水处理厂出水, 以便评估污水排放对氮转化过程的影响。利用实时荧光定量 PCR 检测方法, 对 12 种氮转化功能基因进行定量分析, 全面研究湟水河流域氮转化功能基因的时空分布和影响因素, 明确污水处理厂的运行对氮转化功能基因的影响。
湟水河是黄河上游最大的一级支流, 流经甘肃省和青海省, 在青海省内长 349km, 省内流域面积为 16100km2, 土地利用类型主要是森林和城市土地。湟水河西宁段总长 96km, 主要支流北川河和南川河主河干全长 35km[33]。西宁市总人口为 235.5万, 位于青藏高原东北部气候敏感的半干旱区, 平均海拔为 2275m, 典型气候特征是气压低, 日照时间长, 太阳辐射强, 昼夜温差大。年平均降水量约为 400mm, 全年降水量的 70%集中在 6—9 月, 年平均气温为 3.2℃。湟水河西宁段沿线有 6 个污水处理厂(W1, W2, W3, W4, W5 和 W6), 平均处理能力为 1.5 万~10 万 m3/d, 处理后的生活污水直接排入湟水河。
在 2018 年 7 月(丰水期)和 2019 年 4 月(枯水期)采集湟水河水体、沉积物和污水处理厂出水样。采样点如图 1 所示。枯水期在湟水河干流10 个代表性采样点(M1~M10)和支流 7 个采样点(T1~T7)共采集 17 对水和沉积物样品。同时, 在污水处理厂排入接收河流之前, 从污水处理厂的出水口(W1~W6)直接采集 6 个废水样品(WE)。丰水期在干流 7 个样点(M1, M2, M3, M5, M6, M7和M10)和支流 5 个采样点(T1, T2, T5, T6 和 T7)共采集 12 对水和沉积物样。按照现场采样位置是否受污水处理厂影响, 将湟水河枯水期水样分为河流水体(RW)和受污水处理厂出水影响的河流水体(WRW)两种类型, 沉积物分为河流沉积物(RS)和受污水处理厂出水影响水体的沉积物(WRS)两种类型。其中, 受污水处理厂影响的有干流的 M4~M10 站点以及支流的 T3 和 T4 站点, 这些站点采集的水样为 WRW 类型, 采集的沉积物为 WRS 类型, 其余站点水样均为 RW 类型, 沉积物均为 RS 类型。

图1 湟水河西宁段采样点分布
Fig. 1 Sampling sites in the study area
每个采样点所在区域具有相似的土地利用情况, 大约 91.3%属于城市区域, 另外 8.7%属于森林区域。水样采集、预处理方法、理化指标分析和DNA 提取方法参照文献[34]。实时荧光定量 PCR采用 2X ChamQ SYBRCOLOR qPCR Master Mix试剂盒, 博日 LineGene9600plus 型荧光定量 PCR 仪。qPCR 反应体系为 20μL 体系: 10μL 定量qPCR 试剂, 2μL 模板 DNA, 前后引物各 0.4μL 以及 7.2μL 无菌ddH2O。每个样品设置 3 个平行样。实验标准品扩增效率为 80%~100%, 标准曲线相关性大于 0.99, 扩增溶解曲线均为单一峰。定量 PCR 引物如表 1 所示。基因丰度用单位质量内检测到的基因拷贝数表示(copies/g), 相对丰度为各氮转化功能基因丰度和16S 基因总丰度的比值。
表1 引物及相应qPCR反应程序
Table 1 Primers and corresponding qPCR reaction profiles
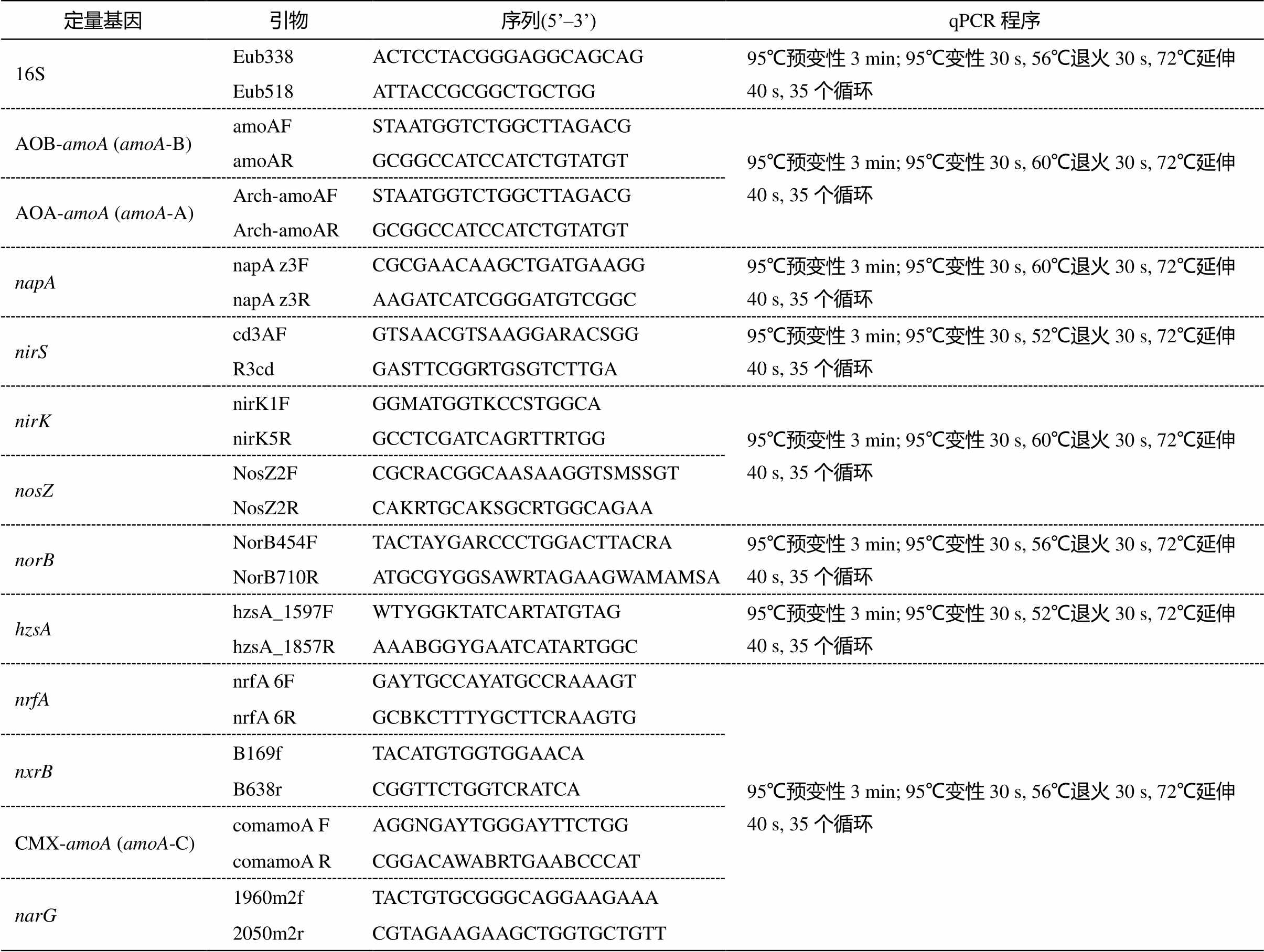
定量基因引物序列(5’–3’)qPCR程序 16SEub338ACTCCTACGGGAGGCAGCAG95℃预变性3 min; 95℃变性30 s, 56℃退火30 s, 72℃延伸40 s, 35个循环 Eub518ATTACCGCGGCTGCTGG AOB-amoA (amoA-B)amoAFSTAATGGTCTGGCTTAGACG95℃预变性3 min; 95℃变性30 s, 60℃退火30 s, 72℃延伸40 s, 35个循环 amoARGCGGCCATCCATCTGTATGT AOA-amoA (amoA-A)Arch-amoAFSTAATGGTCTGGCTTAGACG Arch-amoARGCGGCCATCCATCTGTATGT napAnapA z3FCGCGAACAAGCTGATGAAGG95℃预变性3 min; 95℃变性30 s, 60℃退火30 s, 72℃延伸40 s, 35个循环 napA z3RAAGATCATCGGGATGTCGGC nirScd3AFGTSAACGTSAAGGARACSGG95℃预变性3 min; 95℃变性30 s, 52℃退火30 s, 72℃延伸40 s, 35个循环 R3cdGASTTCGGRTGSGTCTTGA nirKnirK1FGGMATGGTKCCSTGGCA95℃预变性3 min; 95℃变性30 s, 60℃退火30 s, 72℃延伸40 s, 35个循环 nirK5RGCCTCGATCAGRTTRTGG nosZNosZ2FCGCRACGGCAASAAGGTSMSSGT NosZ2RCAKRTGCAKSGCRTGGCAGAA norBNorB454FTACTAYGARCCCTGGACTTACRA95℃预变性3 min; 95℃变性30 s, 56℃退火30 s, 72℃延伸40 s, 35个循环 NorB710RATGCGYGGSAWRTAGAAGWAMAMSA hzsAhzsA_1597FWTYGGKTATCARTATGTAG95℃预变性3 min; 95℃变性30 s, 52℃退火30 s, 72℃延伸40 s, 35个循环 hzsA_1857RAAABGGYGAATCATARTGGC nrfAnrfA 6FGAYTGCCAYATGCCRAAAGT95℃预变性3 min; 95℃变性30 s, 56℃退火30 s, 72℃延伸40 s, 35个循环 nrfA 6RGCBKCTTTYGCTTCRAAGTG nxrBB169fTACATGTGGTGGAACA B638rCGGTTCTGGTCRATCA CMX-amoA (amoA-C)comamoA FAGGNGAYTGGGAYTTCTGG comamoA RCGGACAWABRTGAABCCCAT narG1960m2fTACTGTGCGGGCAGGAAGAAA 2050m2rCGTAGAAGAAGCTGGTGCTGTT
使用 R 语言软件(R version 4.1.0)的 pheatmap程序包, 对数据进行热图分析。在 OmicShare 平台上进行基于 Bray-Curtis 距离的非度量多维标定(non-metric multi-dimensional scaling, NMDS)、主坐标分析(principal co-ordinates analysis, PCoA)和 ANO-SIM 分析, 研究水体和沉积物中氮转化功能基因的相对丰度和组成的差异。季节变化情况基于 Stamp软件进行 ANOVA 组间方差分析, 使用 origin 软件做堆积柱状图。环境因子的影响采用 Spearman 相关性分析和 Mantel 检验。其中, 相关性分析和方差分析均以 p<0.05 作为显著性筛选标准。
湟水河水体中氨氮浓度范围为 0.189~2.497mg/ L, 大部分站点水体达到《地表水环境质量标准》中的Ⅱ类~Ⅳ类标准。其中, 枯水期浓度范围为0.214~2.497mg/L, 受污水处理厂影响的 M4 站点水体为劣 V 类(>2mg/L); 丰水期浓度范围为 0.106~ 2.265mg/L。西钢桥(M5)站点水体为劣 V 类, 小峡口(M10)站点为 V 类。硝态氮浓度范围在枯水期为1.02~5.47mg/L, 丰水期为 1.50~3.56mg/L。就总氮(TN)而言, 浓度范围为 1.308~6.51mg/L, 平均浓度为 3.06±1.23mg/L。如果考虑地表水总氮标准, 大部分站点超过V类水总氮含量标准限值。枯水期总氮浓度范围为 1.42~6.51mg/L, 17 个站点中仅北川站(T2)达到Ⅳ类水, 润泽桥站点(T5)为Ⅴ类水, 其余站点均为劣 V 类。在丰水期浓度范围为 1.308~ 3.464mg/L, 12 个站点中湟源县(M1)、西纳川河(T1)和北川站(T2) 3 个站点达到Ⅳ类水标准, 扎麻隆(M2)和润泽桥(T5)站点为Ⅴ类水, 其余均为劣 V类。枯水期 TN 和亚硝态氮(NO2−-N)浓度显著高于丰水期(表 2)。
湟水河沉积物中 NH4+-N 浓度范围在枯水期为ND~0.69mg/kg, 远低于黄河源沉积物春季 NH4+-N浓度(1.9~8.18mg/kg)[35]; 丰水期为 1.08~19.5mg/kg, 与黄河源夏季(2.67~46.71mg/kg) [35]相当。NO3–-N 浓度范围在枯水期为 ND~49.8mg/kg, 丰水期为 ND~ 24.8mg/kg, 均高于汉江流域金水河和淇河沉积物的浓度[5]。枯水期沉积物 TN 平均浓度为 900.59mg/kg (浓度范围为 180~1770mg/kg)显著低于丰水期的 2505mg/kg (791~8700mg/kg)(表2)。
通过定量 PCR, 检测出 12 种与氮转化相关的功能基因(图 2)。水体中氮转化功能基因的总丰度范围为 1.98×103~5.53×106copies/g; 沉积物中总丰度范围为 3.35×105~2.91×108copies/g, 水体和沉积物中相对丰度最高的基因均为 narG, nirS 和 nosZ 基因(图 2)。基于 NMDS 方法, 分析不同样品中氮转化功能基因组成的差异(图 3(a)), NMDS1 显示氮转化功能基因相对丰度和组成在水体和沉积物两种介质中存在显著的差异, 与 ANOSIM 结果一致(图 3(b), ANOSIM R=0.81, p=0.001)。在水体氮转化功能基因中 narG 基因占比为 12%~67%, nirS 为 3%~67%, nosZ 为 3%~26%。在沉积物中 narG 基因占比为 28%~93%, nirS 为 1%~43%, nosZ 为 4%~18%。
湟水河水体中氮转化功能基因相对丰度和组成在整体上没有季节差异(图 3(a)和(d), ANOSIM R =−0.039, p = 0.701)。枯水期水体氮转化功能基因丰度平均为 6.34×105copies/g (丰度范围为 1.98×103~ 5.53×106 copies/g), 丰水期平均为 1.18×105copies/g(6.21×103~3.10×105 copies/g)。基于 Stamp 的 ANO-VA 方差分析结果(图 4(a))显示, 水体中仅 4 个相对丰度较低的基因 AOA-amoA, CMX-amoA, napA 和nrfA 存在季节差异。其中, AOA-amoA, CMX-amoA和 napA 的相对丰度在丰水期高于枯水期, 而 nrfA在枯水期较高。
湟水河沉积物中氮转化功能基因的相对丰度和组成具有显著的季节差异(图 3(a)和(c))。枯水期沉积物中氮转化功能基因平均丰度为 9.61×107copies/ g (范围为 6.05×106~2.91×108copies/g), 丰水期平均为 2.19×107copies/g (3.35×105~1.07×108copies/g)。沉积物中除 nosZ 和 AOB-amoA 外, 其他 10 种氮转化功能基因的相对丰度均存在显著的季节差异(图4(b), ANOVA p = 0.000)。AOA-amoA, nxrB, napA, nirK, nirS, norB 和 CMX-amoA 等基因的相对丰度在丰水期高于枯水期, narG 和 nrfA 基因在枯水期较高。narG 基因在枯水期的平均相对丰度为 0.0189 (0.005~0.030), 在丰水期为 0.0164 (0.005~0.027), 季节差异与赵彬洁[36]的研究结果一致。nirS 基因在丰水期平均相对丰度为 0.016 (0.001~0.115), 在枯水期为 0.01 (0.002~0.024)。
进一步将 12 种氮转化功能基因进行归类[24,37], 结果表明湟水河中的氮素转化主要有硝化(Nitrifi-cation)、硝酸盐还原为亚硝酸盐(Nitrate reduction, NO3−→NO2−)、亚硝酸盐反硝化(Denitrification, NO2−→N2)、DNRA、全程硝化(Comammox)和厌氧氨氧化(Anammox)这 6 种途径(图 5), 其中硝化和Comammox 为氨氧化过程, 硝酸盐还原为亚硝酸盐和亚硝酸盐反硝化一般统称为反硝化过程。如图 5 (a)所示, 虽然水体和沉积物中各氮代谢途径对氮转化的贡献率存在差异, 但均以反硝化作用为主, 其次是硝化作用。在反硝化过程中, 硝酸盐还原为亚硝酸盐过程对湟水河水体氮素转化的平均贡献率为46% (贡献率范围为 16%~68%), 在沉积物中平均贡献率达 83% (77%~93%)。亚硝酸盐反硝化对水体氮素转化的平均贡献率为 42% (8%~79%), 在沉积物中平均贡献率为 15% (6%~21%)。因此, 整个反硝化过程在水体中平均贡献率为 88%, 在沉积物中平均贡献为 98%, 湟水河丰富的反硝化过程揭示了水体中硝酸盐依次转化为气态氮的潜在机制。
表2 湟水河无机氮素赋存浓度
Table 2 Inorganic nitrogen concentration in samples
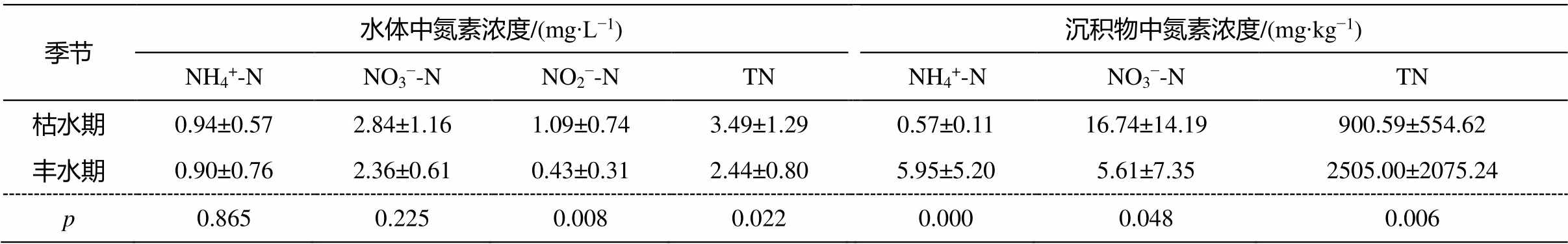
季节水体中氮素浓度/(mg∙L−1)沉积物中氮素浓度/(mg∙kg−1) NH4+-NNO3−-NNO2−-NTNNH4+-NNO3−-NTN 枯水期0.94±0.572.84±1.161.09±0.743.49±1.290.57±0.1116.74±14.19900.59±554.62 丰水期0.90±0.762.36±0.610.43±0.312.44±0.805.95±5.205.61±7.352505.00±2075.24 p0.8650.2250.0080.0220.0000.0480.006
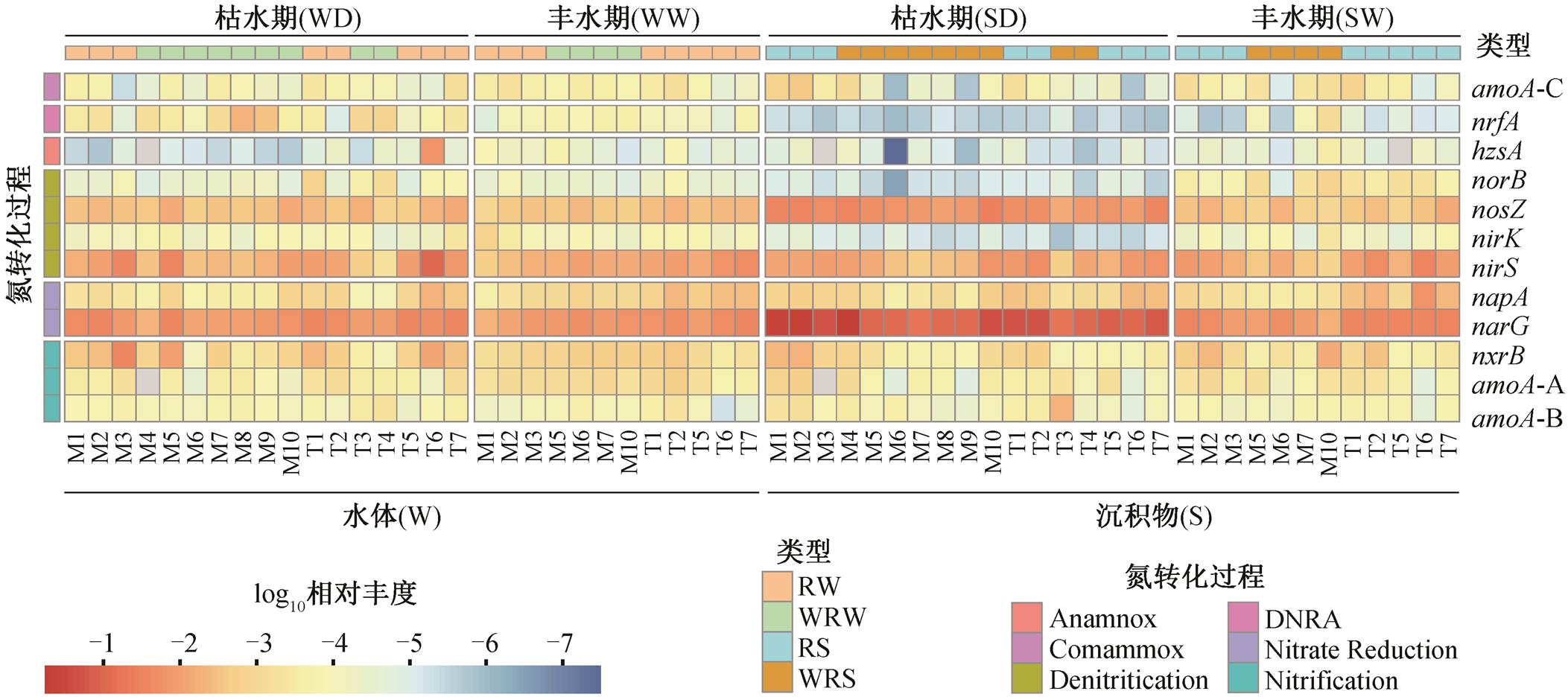
图2 湟水河水体和沉积物中各氮转化功能基因的相对丰度热图
Fig. 2 Heatmap depiction of the relative abundances of nitrogen functional genes in water and sediment samples
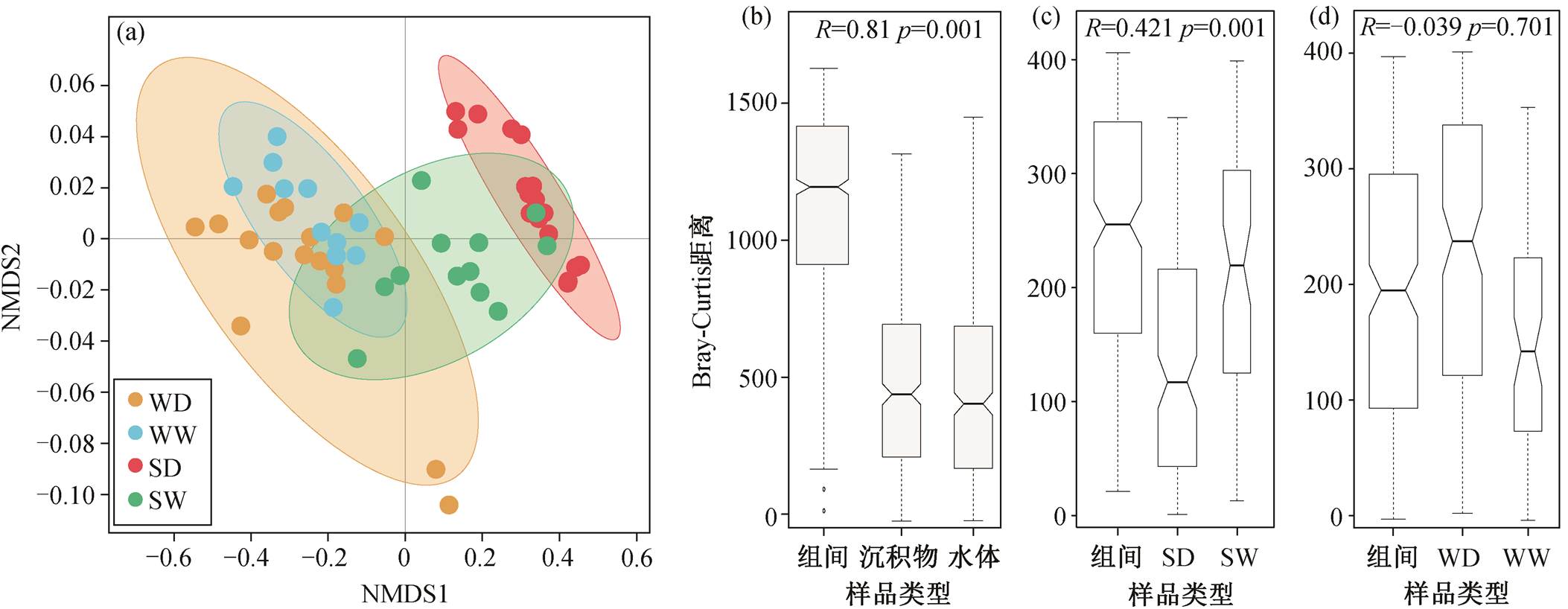
图3 湟水河水体和沉积物中氮转化功能基因相对丰度和组成的NMDS (a)和ANOSIM ((b)~(d))分析
Fig. 3 NMDS (a) and ANOSIM ((b)–(d)) analysis of relative abundances and composition of nitrogen functional genes in water and sediment samples
湟水河水体和沉积物的关键氮转化过程未表现出显著的季节差异, 按贡献率依次为硝酸盐还原为亚硝酸盐、亚硝酸盐反硝化作用和硝化作用, 但水体和沉积物中一些氮素代谢途径对水体氮转化过程的贡献率在丰水期和枯水期存在显著差异(图 5(b)和(c))。在水体中, Comammox 和 DNRA 过程贡献率有显著的季节差异(图 5(b))。Comammox 在丰水期的氮转化贡献率( 0~3%)显著高于枯水期(0~1%, ANOVA p = 0.028), 而 DNRA 在枯水期(0~24%)显著高于丰水期(0~1%, ANOVA p = 0.000), 这种季节变化与在金水河和淇河中的研究结果一致, 枯水期两条河流水体的 DNRA 脱氮贡献率均增加[5]。在沉积物中, 6 种氮代谢途径均存在显著季节差异(图 5 (c))。硝酸盐还原为亚硝酸盐过程在枯水期(78%~ 90%)显著高于丰水期(31%~80%, ANOVA p =0.000),原因是枯水期 narG 基因相对丰度较高(图 4(b))。而硝化和亚硝酸盐反硝化作用在丰水期(18%~47%和0~38%)显著高于枯水期(6%~21%和 0~7%, ANOVA p=0.000), 与城市河网沉积物中反硝化过程的季节差异一致[28]。此外, 虽然沉积物中 Comammox 过程在氮转化中贡献不大, 但季节差异显著, 在丰水期相对丰度较高(图5, ANOVA p=0.000)。
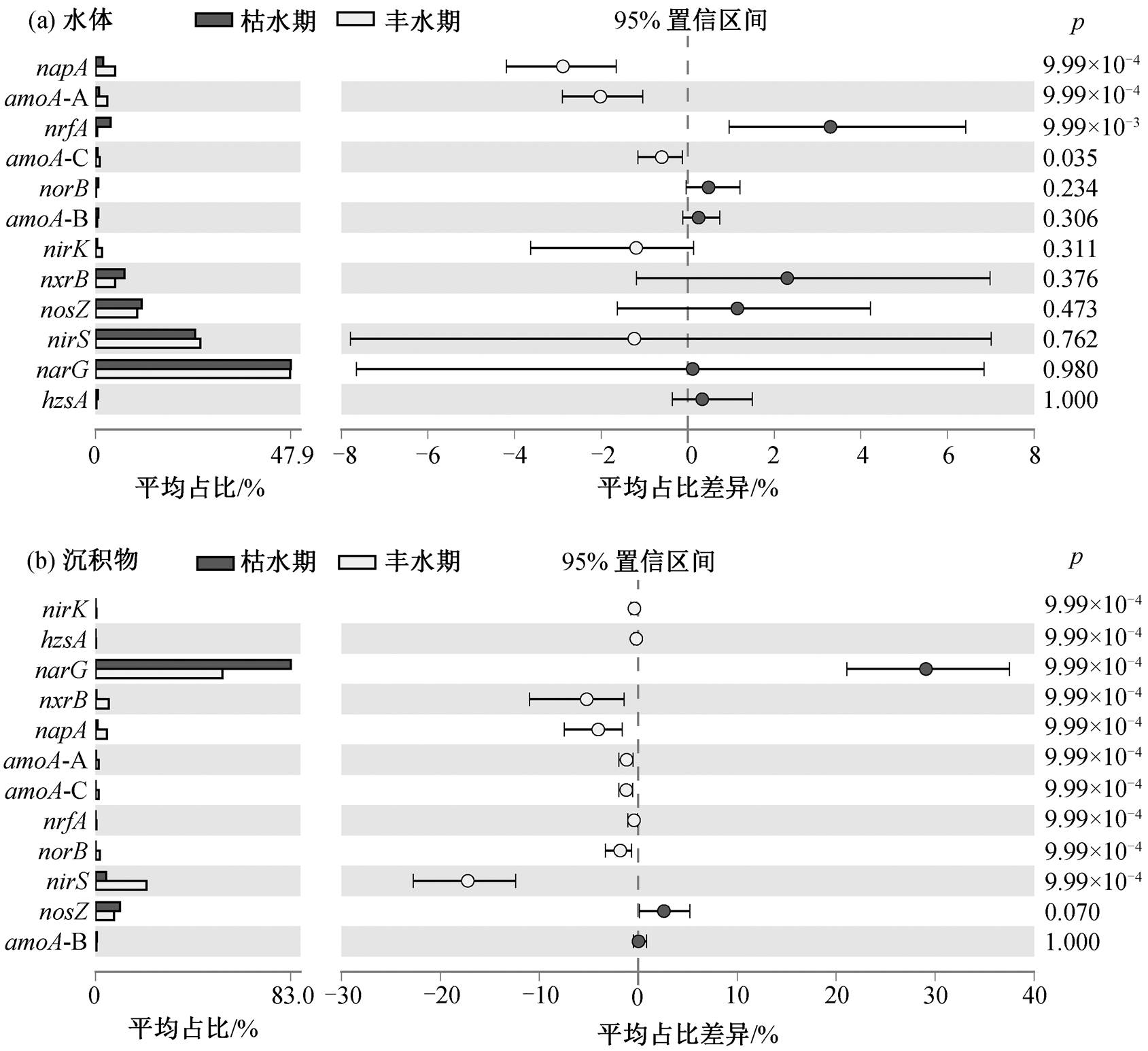
图4 湟水河水体(a)和沉积物(b)中各氮转化功能基因的季节差异分析
Fig. 4 Seasonal differences of each nitrogen functional gene in water (a) and sediment (b) samples between the wet and dry season
采用曼特尔检验(Mantel)方法, 分析不同环境因子对氮转化过程的影响(图 6)。在湟水河水体中, NO3−-N 浓度、pH 和水温等对氮循环微生物及氮素转化过程的影响最大, 不同氮转化功能基因对理化因子的响应不同(图 6(a)和(b))。氨氧化过程中的硝化作用(Mantel 相关系数 r = −0.38, p = 0.04)和 Com-ammox (r = −0.618, p = 0.000)均与水体 NO3−-N 浓度显著负相关, 可能是过量的 NO3−-N 对氮氧化产生抑制作用。在氮还原过程中, 反硝化过程仅与 pH显著负相关, 与 NO3−-N 浓度没有相关性。pH 会显著影响硝酸盐代谢微生物的活动, 反硝化作用的最佳 pH 值范围是 7.0~8.0 [38], 湟水河水体 pH 值范围为 8.09~8.58。研究表明, 浓度大于 1mg/L 时, 反硝化速率与 NO3−浓度并无太大的相关性[39], 湟水河水体 NO3−-N 浓度在 1.016~5.473mg/L 之间, 说明NO3−不是该过程的限制因素。DNRA 相关基因与水温显著负相关(p = 0.04), 与河流氮(NH4+-N, NO3−-N 和 TN)显著正相关(p < 0.05), 与在城市富营养湖泊中的研究结果[40]一致。厌氧氨氧化与水温显著正相关(r = 0.438, p = 0.017), 与 TN 显著负相关(r =−0.406, p = 0.03)。在一定温度范围内, 厌氧氨氧化微生物活性随温度升高而增强[41]。
在沉积物中, 氮素转化过程主要与沉积物的pH、NH4+-N、TN、TP 和有机碳 (SOC) 以及水体的 NH4+、NO3−和 TN 等显著相关(图 6(c)和(d))。沉积物硝化作用和 Comammox 主要受水体氮素浓度的显著负影响。反硝化过程主要受沉积物性质的影响, 与 pH 值、NH4+-N 和 SOC 等负相关, 与 TP 显著正相关。总磷可能是沉积物硝酸盐还原和反硝化过程的限制因子。与反硝化过程相反, DNRA 与沉积物 SOC、NH4+-N 和 pH 显著正相关, 与 NO3−-N 和TP 显著负相关。与以往研究结果[35,42]一致, 沉积物中 DNRA 反应速率与 SOC 和 NH4+显著正相关。DNRA 是需要碳源作为电子供体的异养过程, 与反硝化作用争夺电子受体 NO3−[23,43], 竞争机制主要受碳氮比、NO3−、有机碳浓度、温度和 pH 等环境因素的影响[23,44], 在高碳氮比(C/N)[45]、NO3−有限[44]、水温较高[46]和碱性环境[47]条件下占优势。
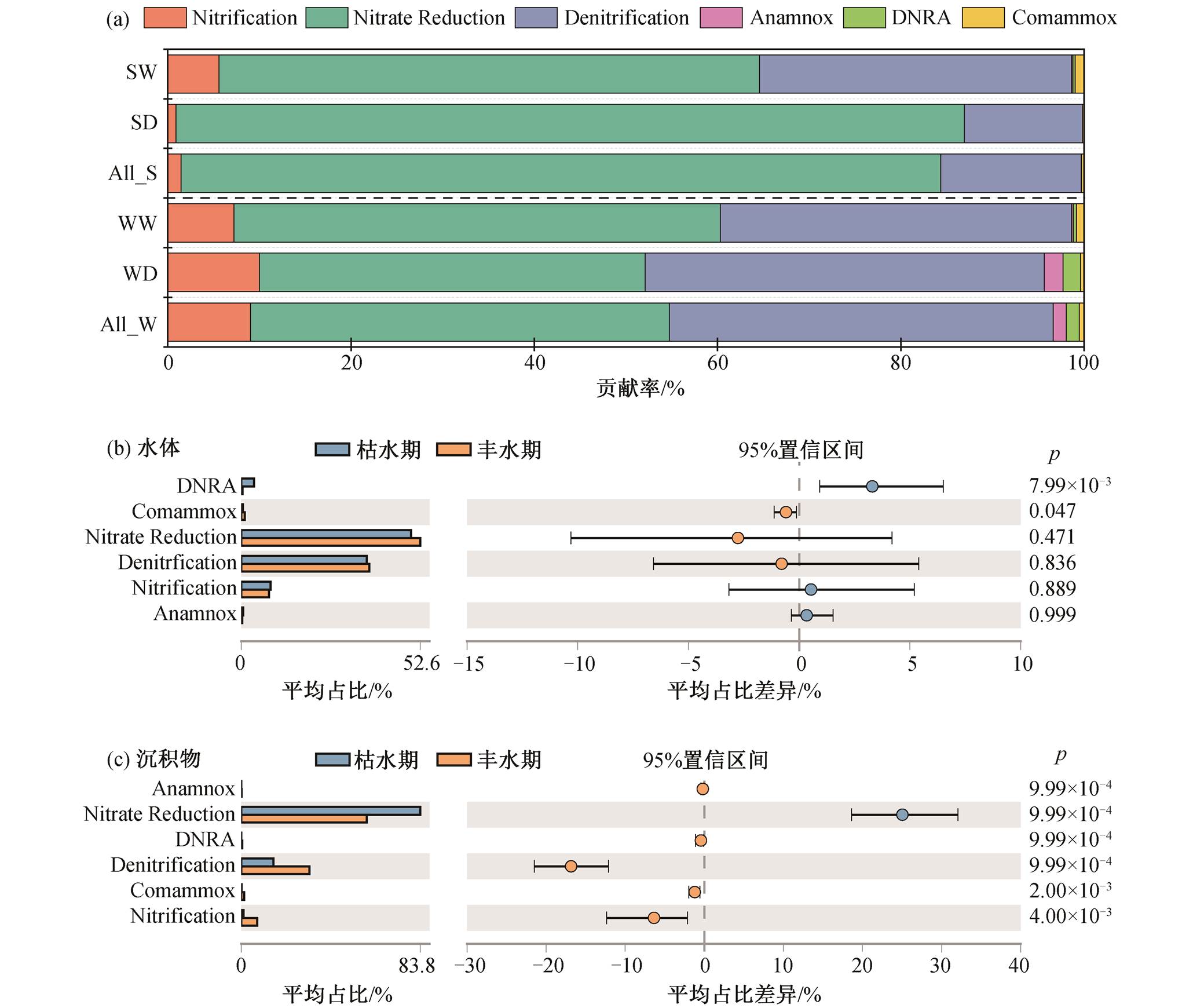
ALL_W代表所有水样, ALL_S代表所有沉积物样品
图5 水体和沉积物中各氮代谢途径在氮素转化过程中的贡献(a)及其季节差异((b)~(c))
Fig. 5 Contribution of each nitrogen metabolic pathway to nitrogen transformation processes in water and sediment samples and its seasonal differences ((b)–(c))
对影响因素的研究发现, 水体 NO3−-N浓度对水体和沉积物中的一些氮转化功能基因均有显著负影响, 例如 AOA-amoA, nxrB, hzsA 和 CMX-amoA 基因等, 而对 nrfA 基因有显著正影响, 推测可能与湟水河水体持续受污水处理厂出水影响有关。
随着污水排放量的逐渐增加, 污水处理厂的运行对河流微生物群落的影响引起广泛关注[48]。研究报道了水体及沉积物中细菌群落对污水处理厂废水的响应[34]。我们对湟水河西宁段不同类型水样的 PCoA 分析结果表明, 污水处理厂出水和受污水处理厂出水影响的河段水体中有相似的氮转化功能基因组成(图 7(a), ANOSIM R = −0.05, p = 0.622), 且与河流水体存在显著差异(图 7(b))。受污水处理厂影响的河段水体和沉积物中的氮转化功能基因也存在显著差异(图 7(c), ANOSIM R = 0.266, p =0.015)。因此, 污水处理厂出水会同时对湟水河水体和沉积物中的氮转化功能微生物产生显著影响。
相对于河流水体和沉积物样品, 污水处理厂出水和受污水处理厂影响的河段水体及沉积物中的氮转化功能基因平均相对丰度均显著降低(图 8(b))。由图 8(a)可知, 受污水处理厂影响的河段水体和污水处理厂出水中, hzsA, nirS, nxrB, napA, narG, AOA-amoA 和 CMX-amoA 基因的平均丰度分别显著降低 86.5%, 32.75%, 26.2%, 20.9%, 16.6%, 11.6%和 7%, 而参与 DNRA 作用的 nrfA 基因丰度显著增加 21.9%。受污水处理厂影响的沉积物中,nxrB, CMX-amoA 和 AOA-amoA 等基因的丰度显著降低21.08%, 20.36%和 10.6%。
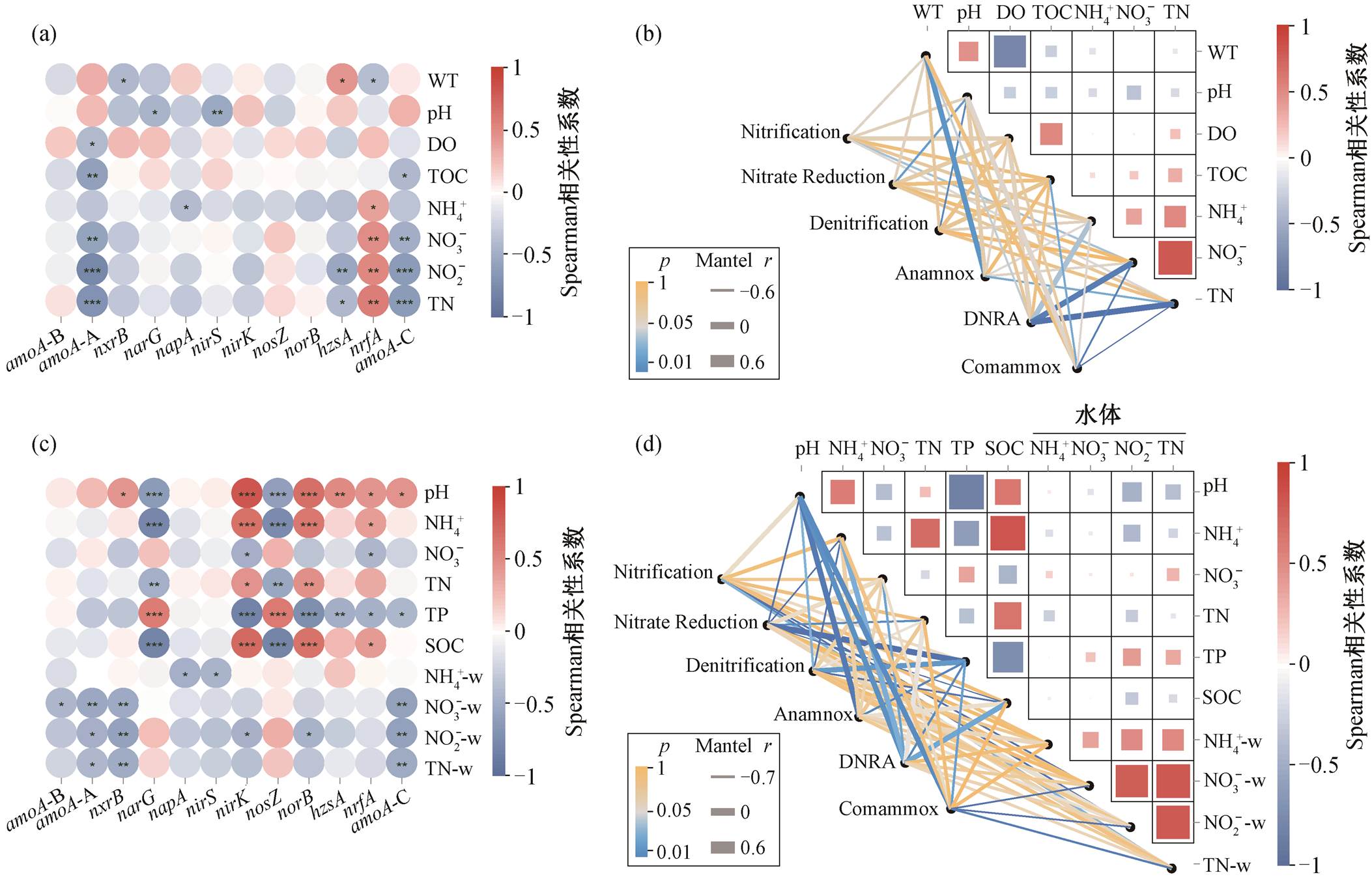
NH4+-w, NO3−-w和TN-w为在水体中的氮素浓度
图6 水体((a)~(b))和沉积物((c)~(d))中12种氮转化功能基因和6种氮代谢途径与环境因子的Spearman相关性分析和Mantel检验
Fig. 6 Spearman’s correlation analysis and Mantel tests among relative abundances of 12 kinds of nitrogen functional genes, 6 kinds of nitrogen metabolic pathways and environmental factors in water ((a)–(b)) and sediment ((c)–(d)) samples
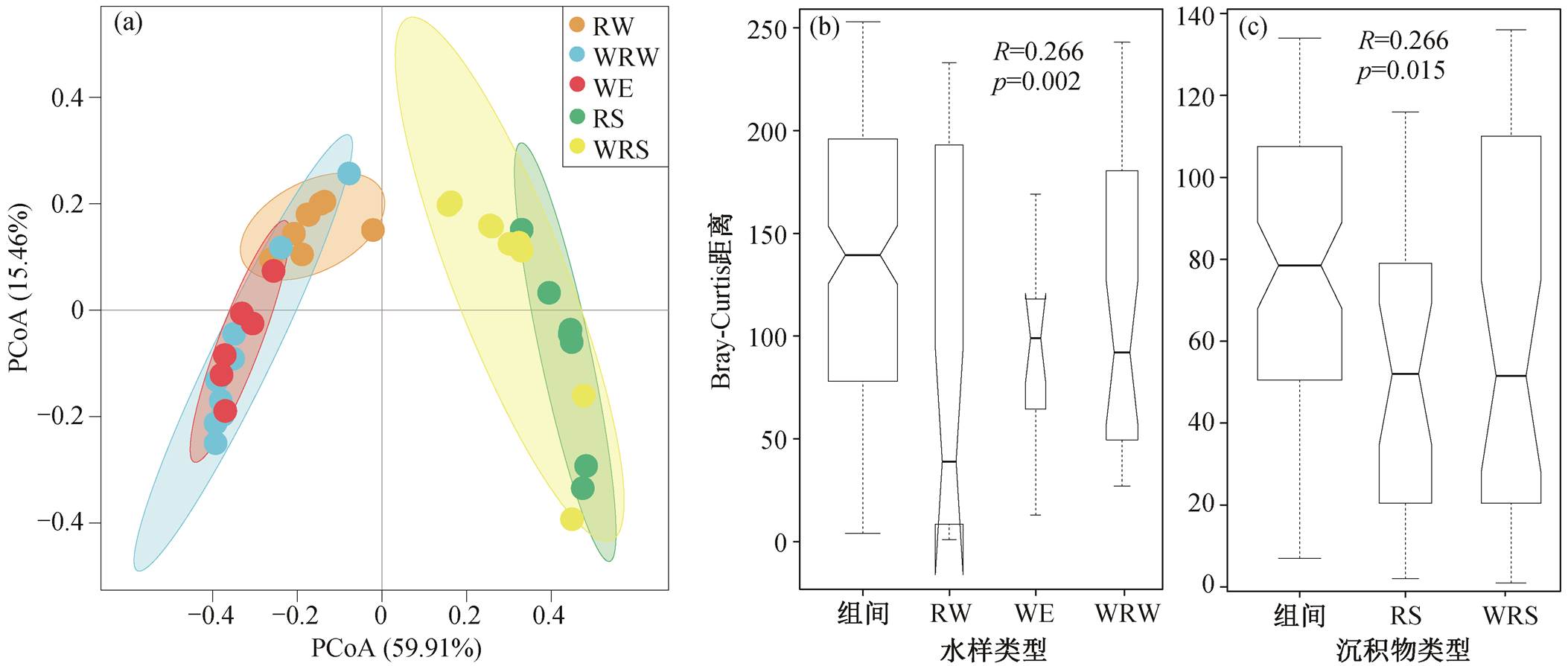
图7 5种类型样品中氮转化功能基因差异性的PCoA (a)和ANOSIM ((b)~(c))分析
Fig. 7 PCoA plot (a) and ANOSIM ((b)–(c)) analysis of nitrogen functional genes differences in RW, WRW, WE, WS and WRS samples
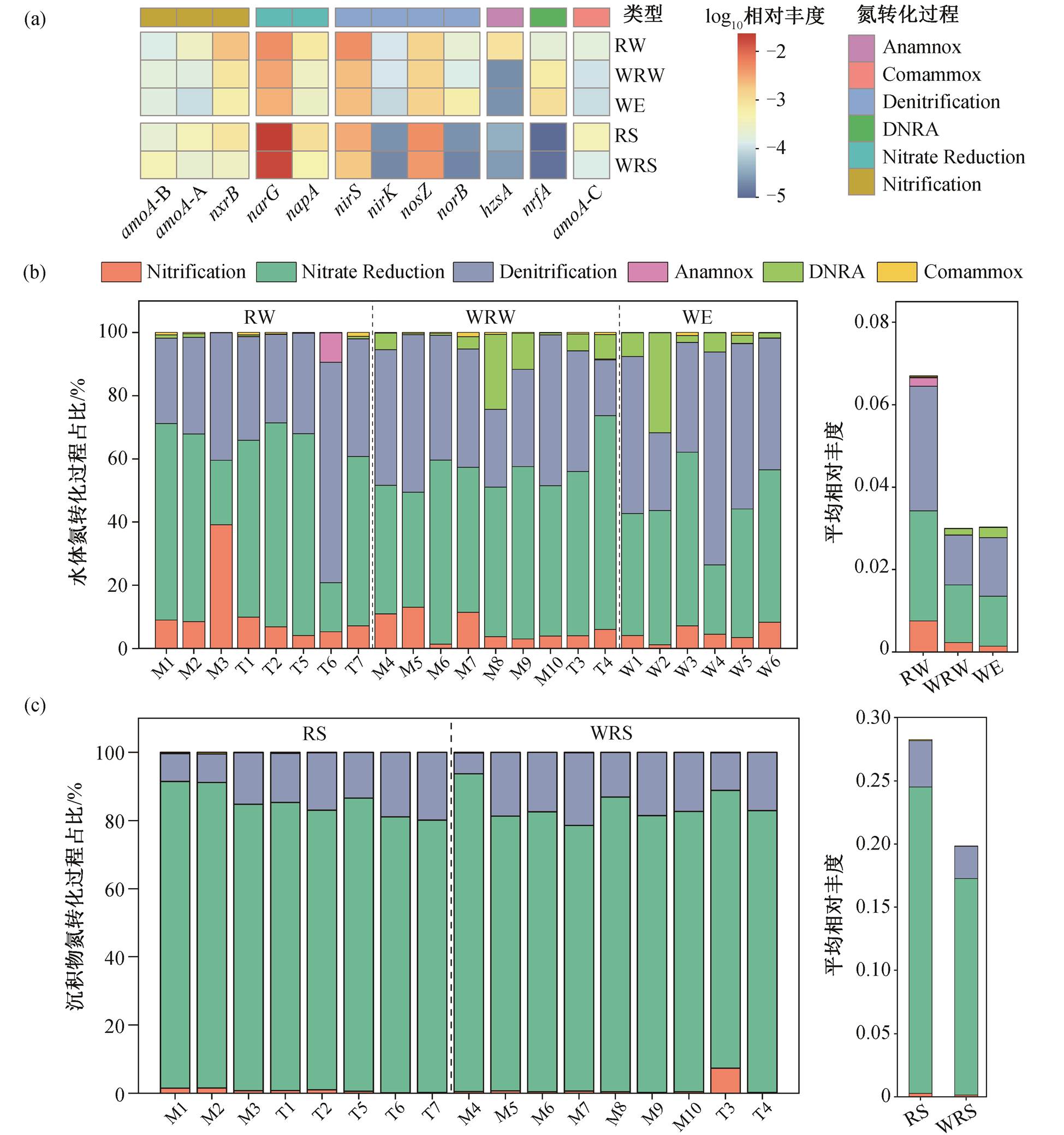
图8 不同类型样品中各氮转化功能基因平均相对丰度(a)和各氮代谢途径(b)对氮素转化过程的贡献
Fig. 8 Average relative abundance of each nitrogen functional genes and contribution of each nitrogen metabolic pathway to nitrogen transformation process for different water environment
就氮转化过程而言, 在受污水处理厂影响的水体和沉积物中占主导地位的氮转化过程仍是反硝化和硝化过程, 但水体中反硝化和厌氧氨氧化等氮还原过程以及硝化和 Comammox 等氨氧化过程均受到显著削弱, 沉积物中硝化和 Comammox等氨氧化过程减弱(图 8(b))。氮代谢的减弱可能归因于受纳污水处理厂出水的水体物理化学条件的变化, 如污水处理厂出水和受影响河流水体中的有毒化合物、NO3−-N 和 TN 等微污染物浓度的显著增加[34]。水体受污水处理厂影响 NO3−-N 浓度显著增加, 而水体碳源不足, 不符合湟水河硝酸盐还原过程的适宜碳氮比[49], 使得水体硝酸盐代谢的变弱。该结果可以解释水体和沉积物中多种基因丰度与水体中 NO3−和TN浓度的负相关关系(图 6(a)和(c))。
此外, 受污水处理厂影响, 河段中氮转化功能基因组成也发生改变, DNRA 过程在水体氮转化过程中的占比显著增加(图 8(b)), 在受影响河段和污水处理厂出水中对氮转化过程的贡献率分别为 0~ 24%和 2%~32%, 而在河流水体中的贡献率为 0~ 1%。此外, 厌氧氨氧化过程贡献率降低至 0 左右。水体中参与 DNRA 过程的 nrfA 基因与水体中 TN 和NO3−-N 显著正相关(r = 0.49, p = 0.006)(图 6(a)), 然而受污水处理厂影响, 水体中 NO3−-N 和 TN 显著升高。有研究表明, 在污染水体中可能存在较高的DNRA[42], 因此 DNRA 对氮转化贡献率的增加可能归因于河流中氮浓度的升高。在淡水生态系统中, DNRA 的最终产物 NH4+促进藻类生长和富营养化的速率显著高于 NO3−[19,50], 可能是一个重要的导致富营养化的过程。
本研究分析湟水河西宁段丰水期和枯水期水体及沉积物中氮转化功能基因的组成、关键氮转化过程及影响因素, 得到如下结论。
1)湟水河水体和沉积物中参与氮转化的功能基因相对丰度最高的是 narG, nirS 和 nosZ, 功能基因相对丰度和组成有显著季节差异。水体中 AOA-amoA, CMX-amoA 以及 napA 基因在丰水期较高, 而nrfA 在枯水期较高。沉积物中 nirK, napA, nirS, nxrB, norB, AOA-amoA 和 CMX-amoA 等基因在丰水期较高, 而narG 和 nrfA 基因在枯水期较高。
2)水体和沉积物中关键氮素转化过程是反硝化过程(NO3−→NO2−→N2), 在水体中的平均贡献率为 88%, 在沉积物中的平均贡献率为 98%。与丰水期相比, 水体中 DNRA 和 Comammox 在氮转化中的贡献率存在显著的季节差异, DNRA 的贡献率在枯水期大于丰水期, 而 Comammox 的贡献率在丰水期大于枯水期。在枯水期, 沉积物中硝酸盐还原为亚硝酸盐(NO3−→NO2−)过程的贡献率高于丰水期, 而亚硝酸盐反硝化(NO2−→N2)和硝化过程的贡献率比丰水期低。
3)氮循环微生物及氮素转化过程在水体中主要受 NO3−-N 和 pH 等因素的影响, 氨氧化过程与水体 NO3−-N 浓度负相关, 反硝化过程与 pH 负相关; 在沉积物中与沉积物 pH, TN, TP, SOC 及水体氮素浓度相关, 氨氧化过程主要受水体氮素浓度负影响, 而反硝化过程主要与沉积物性质相关, 总磷可能是限制因子。
4)污水处理厂污水排放显著削弱受纳河段水体中反硝化(NO3−→NO2−→N2)、厌氧氨氧化等氮还原过程以及硝化和 Comammox 等氨氧化过程, 但增加了 DNRA 对水体氮素去除的贡献率, 同时降低了沉积物中氨氧化过程的比例。
参考文献
[1]Kuypers M M M, Marchant H K, Kartal B. The microbial nitrogen-cycling network. Nature Reviews Microbiology, 2018, 16(5): 263–276
[2]Cole J J, Prairie Y T, Caraco N F, et al. Plumbing the global carbon cycle: integrating inland waters into the terrestrial carbon budget. Ecosystems, 2007, 10(1): 172–185
[3]鲍林林, 陈永娟, 王晓燕. 河流沉积物氮循环主要微生物的生态特征. 微生物学通报, 2015, 42(6): 1141–1150
[4]彭强, 关傲梅, 齐维晓, 等. 基于同位素示踪和分子生物学技术对潮白河沉积物中氮还原功能特征的研究. 环境科学学报, 2021, 41(11): 4615–4624
[5]Zhao B, Li X, Wang Y, et al. Dissimilatory nitrate reduction and functional genes in two subtropical ri-vers, China. Environmental Science and Pollution Re-search, 2021, 28(48): 68155–68173
[6]Xia X, Zhang S, Li S, et al. The cycle of nitrogen in river systems: sources, transformation, and flux. Environmental Science-Processes & Impacts, 2018, 20(6): 863–891
[7]Merseburger G, Marti E, Sabater F, et al. Point-source effects on N and P uptake in a forested and an agri-cultural Mediterranean streams. Science of the Total Environment, 2011, 409(5): 957–967
[8]夏星辉, 王君峰, 张翎, 等. 黄河泥沙对氮迁移转化的影响及环境效应. 水利学报, 2020, 51(9): 1138–1148
[9]Lamba S, Bera S, Rashid M, et al. Organization of biogeochemical nitrogen pathways with switch-like adjustment in fluctuating soil redox conditions. Royal Society Open Science, 2017, 4(1): 160768
[10]Daims H, Lebedeva E V, Pjevac P, et al. Complete nitrification by Nitrospira bacteria. Nature, 2015, 528: 504–509
[11]Kowalchuk G A, Stephen J R. Ammonia-oxidizing bacteria: a model for molecular microbial ecology. Annual Review of Microbiology, 2001, 55: 485–529
[12]陈春兰, 陈哲, 朱亦君, 等. 水稻土细菌硝化作用基因(amoA和hao)多样性组成与长期稻草还田的关系研究. 环境科学, 2010, 31(6): 1624–1632
[13]Francis C A, Roberts K J, Beman J M, et al. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(41): 14683–14688
[14]郭建华, 彭永臻. 异养硝化、厌氧氨氧化及古菌氨氧化与新的氮循环. 环境科学学报, 2008, 28(8): 1489–1498
[15]van Kessel M A, Speth D R, Albertsen M, et al. Complete nitrification by a single microorganism. Nature, 2015, 528: 555–559
[16]Liu S, Wang H, Chen L, et al. Comammox Nitrospira within the Yangtze River continuum: community, bio-geography, and ecological drivers. ISME J, 2020, 14 (10): 2488–2504
[17]Song G D, Liu S M, Marchant H, et al. Anammox, denitrification and dissimilatory nitrate reduction to ammonium in the East China Sea sediment. Biogeo-sciences, 2013, 10(11): 6851–6864
[18]Rathour R, Gupta J, Mishra A, et al. A comparative metagenomic study reveals microbial diversity and their role in the biogeochemical cycling of Pangong lake. Science of the Total Environment, 2020, 731: 139074
[19]Wang S, Pi Y, Song Y, et al. Hotspot of dissimilatory nitrate reduction to ammonium (DNRA) process in freshwater sediments of riparian zones. Water Re-search, 2020, 173: 115539
[20]Chen H, Yuan X, Gao Y, et al. Nitrous oxide emissions from newly created littoral marshes in the drawdown area of the Three Gorges Reservoir, China. Water, Air, & Soil Pollution, 2009, 211(1/2/3/4): 25–33
[21]Bristow L A, Callbeck C M, Larsen M, et al. N2 production rates limited by nitrite availability in the Bay of Bengal oxygen minimum zone. Nature Geo-science, 2016, 10(1): 24–29
[22]Philippot L, Hallin S. Finding the missing link be-tween diversity and activity using denitrifying bacte-ria as a model functional community. Current Opin-ion in Microbiology, 2005, 8(3): 234–239
[23]Kraft B, Tegetmeyer H E, Sharma R, et al. The environmental controls that govern the end product of bacterial nitrate respiration. Science, 2014, 345: 676–679
[24]Dang C, Liu S, Chen Q, et al. Response of microbial nitrogen transformation processes to antibiotic stress in a drinking water reservoir. Science of the Total Environment, 2021, 797: 149119
[25]Deng F, Hou L, Liu M, et al. Dissimilatory nitrate reduction processes and associated contribution to nitrogen removal in sediments of the Yangtze Estuary. Journal of Geophysical Research: Biogeosciences, 2015, 120(8): 1521–1531
[26]吴庆乐, 阮晓红, 吴朝明, 等. 太湖西部河湖氮污染物来源及转化途径分析. 环境科学学报, 2015, 35(12): 3883–3889
[27]Jäntti H, Stange F, Leskinen E, et al. Seasonal varia-tion in nitrification and nitrate-reduction pathways in coastal sediments in the Gulf of Finland, Baltic Sea. Aquatic Microbial Ecology, 2011, 63(2): 171–181
[28]Cheng L, Li X, Lin X, et al. Dissimilatory nitrate reduction processes in sediments of urban river net-works: spatiotemporal variations and environmental implications. Environmental Pollution, 2016, 219: 545–554
[29]Yu L, Liu S, Jiang L, et al. Insight into the nitrogen accumulation in urban center river from functional genes and bacterial community. PLoS ONE, 2020, 15(9): e0238531
[30]Wang P, Li J L, Luo X Q, et al. Biogeographical distributions of nitrogen-cycling functional genes in a subtropical estuary. Functional Ecology, 2021, 36(1): 187–201
[31]Bernard R J, Mortazavi B, Kleinhuizen A A. Dissi-milatory nitrate reduction to ammonium (DNRA) sea-sonally dominates NO3− reduction pathways in an an-thropogenically impacted sub-tropical coastal lagoon. Biogeochemistry, 2015, 125(1): 47–64
[32]闵秀云, 李廷伟, 高春亮, 等. 硝酸盐氮同位素指示的青海湟水河中可能的氮污染来源. 盐湖研究, 2021, 29(4): 52–59
[33]葛劲松. 湟水西宁段污染趋势. 青海环境, 1995(3): 144–146
[34]Wang J, Chen Y, Cai P, et al. Impacts of municipal wastewater treatment plant discharge on microbial community structure and function of the receiving river in Northwest Tibetan Plateau. Journal of Hazar-dous Materials, 2022, 423(Pt B): 127170
[35]Zhang S, Qin W, Bai Y, et al. Linkages between anammox and denitrifying bacterial communities and nitrogen loss rates in high-elevation rivers. Limno-logy and Oceanography, 2020, 66(3): 765–778
[36]赵彬洁. 汉江流域金水河与淇河氮循环过程及微生物驱动机制[D]. 武汉: 中国科学院大学(中国科学院武汉植物园), 2021
[37]Liu F, Zhang Y, Liang H, et al. Long-term harvesting of reeds affects greenhouse gas emissions and micro-bial functional genes in alkaline wetlands. Water Re-search, 2019, 164: 114936
[38]徐亚同. pH值、温度对反硝化的影响. 中国环境科学, 1994(4): 308–313
[39]Bates H K, Spalding R F. Aquifer denitrification as interpreted from in situ microcosm experiments. Journal of Environmental Quality, 1998, 27(1): 174–182
[40]Yin X, Chen L, Tang D, et al. Seasonal and vertical variations in the characteristics of the nitrogen-related functional genes in sediments from urban eutrophic lakes. Applied Soil Ecology, 2019, 143: 80–88
[41]Canion A, Overholt W A, Kostka J E, et al. Tem-perature response of denitrification and anaerobic ammonium oxidation rates and microbial community structure in Arctic fjord sediments. Environmental Microbiology, 2014, 16(10): 3331–3344
[42]Bu C, Wang Y, Ge C, et al. Dissimilatory nitrate reduction to ammonium in the Yellow River Estuary: rates, abundance, and community diversity. Scientific Reports, 2017, 7(1): 6830
[43]Sgouridis F, Heppell C M, Wharton G, et al. Deni-trification and dissimilatory nitrate reduction to am-monium (DNRA) in a temperate re-connected flood-plain. Water Research, 2011, 45(16): 4909–4922
[44]Smith C J, Dong L F, Wilson J, et al. Seasonal variation in denitrification and dissimilatory nitrate reduction to ammonia process rates and corresponding key functional genes along an estuarine nitrate gra-dient. Frontiers in Microbiology, 2015, 6: 542
[45]Shan J, Zhao X, Sheng R, et al. Dissimilatory nitrate reduction processes in typical chinese paddy soils: rates, relative contributions, and influencing factors. Environ Sci Technol, 2016, 50(18): 9972–9980
[46]van den Berg E M, van Dongen U, Abbas B, et al. Enrichment of DNRA bacteria in a continuous culture. ISME J, 2015, 9(10): 2153–2161
[47]Yoon S, Cruz-Garcia C, Sanford R, et al. Denitri-fication versus respiratory ammonification: environ-mental controls of two competing dissimilatory NO3−/ NO2− reduction pathways in Shewanella loihica strain PV-4. ISME J, 2015, 9(5): 1093–1104
[48]Atashgahi S, Aydin R, Dimitrov M R, et al. Impact of a wastewater treatment plant on microbial community composition and function in a hyporheic zone of a eutrophic river. Scientific Reports, 2015, 5: 17284
[49]Her J J, Huang J S. Influences of carbon surface and C/N ratio on nitrate nitrite denitrification and carbon breakthrough. Bioresource Technology, 1995, 54(1): 45–51
[50]Nogaro G, Burgin A J. Influence of bioturbation on denitrification and dissimilatory nitrate reduction to ammonium (DNRA) in freshwater sediments. Biogeo-chemistry, 2014, 120(1/2/3): 279–294
Microbial Nitrogen Transformation Key Processes and Its Influencing Factors in Water and Sediment of Xining Section of the Huangshui River
Abstract A total of 58 water and sediment samples were collected in the typical sampling section of the Xining section of the Huangshui River during the wet season (July 2018) and the dry season (April 2019), respectively, and 6 wastewater samples were directly taken from the effluents of wastewater treatment plants (WWTPs) in the dry season. A total of 12 nitrogen functional genes were quantitatively analyzed by real-time fluorescence quanti-tative PCR technology (qPCR). The results showed that the average of total nitrogen (TN) concentration in Huangshui River was 3.06±1.23 (1.308–6.51) mg/L. The nitrogen functional genes with high relative abundance in water and sediments were narG, nirS and nosZ. There were significant seasonal differences in the abundance and composition of nitrogen functional genes in sediments rather than those in water. The key nitrogen transformation process was denitrification, and its average contribution to nitrogen removal in water and sediment were 88% and 98%, respectively. The nitrogen transformation process in water was mainly impacted by pH, TN and NO3−-N, the ammonia oxidation process was negatively correlated with the NO3−-N concentration, and the denitrification process was negatively correlated with the pH. The nitrogen transformation process in sediment was mainly related to the water nitrogen concentration, sediment pH, TN, total phosphorus and organic carbon concentration, etc., the ammonia oxidation process was negatively related to the water nitrogen concentration, and the denitrification process was related to the sediment properties. Further analysis showed that the wastewater treatment plant effluents significantly reduced the abundance of genes such as AOA-amoA, CMX-amoA, nirS, nxrB, napA, narG, hzsAin the received water, which might lead to the limitation of the denitrification, anammox, nitrification and comammox processes, but at the same time elevated the abundance ofnrfA genes and increased the contribution rate of dissimilatory nitrate reduction to ammonium (DNRA) to nitrogen removal in water. The relative abun-dances, such as AOA-amoA, nxrB and CMX-amoA, were significantly reduced in the sediments in the affected river segments, and nitrification and comammox processes in sediments were suppressed. This study can provide a scientific basis for nitrogen pollution control in the Xining section of Huangshui River.
Key words nitrogen functional genes; nitrogen transformation processes; wastewater treatment plant; Huangshui River; influencing factors