doi: 10.13209/j.0479-8023.2022.020
蛋白质与植物基因研究国家重点实验室开放运行费(8102000374/006)资助
北京大学学报(自然科学版) 第58卷 第5期 2022年9月
Acta Scientiarum Naturalium Universitatis Pekinensis, Vol. 58, No. 5 (Sept. 2022)
收稿日期: 2021-09-17;
修回日期: 2021-10-22
植物生长素整体原位定位技术
王东辉
北京大学生命科学学院, 生物学国家级实验教学示范中心, 蛋白质与植物基因研究国家重点实验室, 北京 100871; E-mail: wangdh@pku.edu.cn
摘要 针对现有植物激素测定方法比较繁琐, 缺少胞内激素浓度测量方法的问题, 建立拟南芥侧根和花发育过程中生长素 IAA 分布整体原位检测方法。利用抗体对抗原的特异性反应, 通过与酶和荧光分子等连接的二抗结合, 利用光学显微镜和电子显微镜对组织或器官内的生长素进行检测, 实现植物生长素的整体原位定位。该方法不仅适用于生长素 IAA, 也适用于脱落酸 ABA 等激素快速和可靠的组织或器官定位。整个检测流程通常在 3~4 天内完成, 是一种高度敏感、特异且简单的激素原位定位方法, 适用于各种植物幼嫩的器官和组织。
关键词 整体原位定位技术; 抗体; 植物激素; 生长素
植物激素在植物生长发育的多个方面发挥着极其重要的作用, 包括调节胚胎发生、分生组织活性、器官发生、气孔孔径和雌配子体形成等, 此外, 激素还是植物感受外部环境条件变化、调节自身生长状态、抵御不良环境和维持生存必不可少的信号分子[1–2]。植物激素的分布和浓度对其生理反应很重要, 只有作用位点中的激素积累才能诱发生理效应, 因此了解植物激素在组织和器官中的分布特点, 是探讨其在植物体内发挥作用机制的基础。虽然有人用提取法和 SPE 固相萃取柱前处理方法, 结合HPLC-ESI-MS/MS 方法正负模式来测定植物激素[3], 但方法比较繁琐。本研究的前期工作中研发了组织切片的激素定位方法, 为植物激素的机理研究提供了一种可靠的技术手段[4], 但对于不适合做切片的材料, 需要研制一种合适的激素定位方法。
生长素是迄今为止发现的唯一具有极性转运特性的植物激素, 广泛参与植物发育的各种形态发生过程[5]。一方面, 生长素调控细胞分裂和促进细胞伸长; 另一方面, 以其分布的浓度梯度影响植物个体及其器官的形态建成。例如, 所有侧生器官的发生都是生长素浓度梯度和转录因子表达区域相互作用的结果, 在根的发育过程中, 生长素通过诱导中柱鞘细胞, 对侧根的发生位置起决定性作用。生长素通过极性转运维持根分生组织(RAM)中干细胞的活性, 干细胞活性的维持是通过 SAM 中生长素和细胞分裂素的平衡来完成[6]。另外, 生长素可以参与花粉的有丝分裂、花粉粒的成熟、花药开裂和花丝伸长。这些研究通常基于 DR5:GUS/GFP 在植物中的信号分布, 并通过其转运抑制剂来观察生长素对雄蕊发育的影响[7–8]。它的梯度分布经常是植物新器官或组织形成的位置信息。因此, 了解生长素分布模式对理解植物的生长发育有重要意义。
拟南芥中主要有 PIN 家族和 ABCB(PGP)家族两类生长素输出蛋白, 通过这两类蛋白的作用, 将生长素运出细胞。由于目前没有方法测量胞内的生长素浓度, 只能根据 PIN 蛋白在细胞膜上的分布位置, 结合生长素信号指示标记株系, 使用 DR5:GUS/ GFP 以及 DII-VENUS 来判断生长素的梯度分布状况[9]。近年来已经认识到, 仅使用 DR5:GUS/GFP研究生长素在发育过程中的作用是不准确、不敏感的[10–12]。为探索生长素如何影响植物的发育及侧根的发生, 以及生长素是否影响雄蕊的发育和生殖细胞的发生这些科学问题, 必须先了解在这些部位是否存在 IAA 及其浓度情况。要回答这个问题, 需要一种更直接的方法, 即使用 IAA 抗体来观察 IAA在各个发育阶段的分布。
为了完善植物生长素梯度分布测定需求, 将内源激素分布规律形象和直观地表现出来, 把激素定位与定量(或相对定量)尽可能统一起来, 本文在整体原位杂交[13–15](whole mount in situ hybridization, WISH)和蛋白整体免疫定位[16–17]方法的基础上, 提出一种相对快速且简单的激素整体免疫定位方法, 主要利用抗体对抗原的特异性反应, 对组织或细胞内的某一抗原进行检测, 无需组织切片, 即可在植物组织中进行 IAA 或 ABA 等激素的整体原位免疫定位。
1 激素整体原位定位技术关键步骤
激素整体免疫定位技术分为 4 个主要步骤: 材料固定、渗透和封闭、抗体孵育以及信号检测。
1.1 EDC/NHS/BFA 固定材料
成功进行激素整体免疫定位的关键是固定抗原, 并保持组织或细胞的形态。激素是一种本身不能作为抗原反应的小分子物质, 在固定过程中极易流失。首先使用 1-乙基-3-(3-二甲基-氨基丙基)碳二亚胺(EDC)和 N-羟基琥珀酰亚胺(NHS)固定植物材料。EDC 首先将小分子激素与羧基交联, 形成一个胺反应性 O-酰基脲脲中间体, 然后与 NHS 反应, 形成稳定的半抗原, 这样就将酸性的植物激素与大分子蛋白相交联, 防止生长素及脱落酸的流失。这种半抗原可以被抗体检测到。
1.2 渗透和封闭
使用甲醇和乙醇作为有机溶剂, 去除叶绿素和表皮蜡。用蛋白酶 K 消化细胞壁和细胞膜可以增加通透性, 帮助抗体进入细胞内的抗原。随后, 用去污剂进行处理, 去污剂会在膜上形成小孔而不破坏细胞或组织的结构完整性。封闭液中的牛血清白蛋白 BSA 可以封闭非特异结合位点。
1.3 抗体孵育
目前只有少数几家公司生产植物激素抗体, 本研究选择 IAA 抗体作为一抗进行反应。二抗的选择取决于染色底物和一抗, 荧光素异硫氰酸酯(FITC)偶联的抗体会产生具有高对比度的明亮信号, 但该信号在几天之内迅速扩散, 也容易受到自发荧光的干扰。结合 HRP (辣根过氧化物酶)或结合 AP (碱性磷酸酶)的抗体可产生高度敏感和特异的棕色或蓝色不溶产物。
1.4 信号检测
对于显色试剂的选择, 主要考虑因素是灵敏度、背景以及易用性和稳定性。HRP 偶联抗体的二氨基联苯胺(3,3’-diaminobenzidine, DAB)是过氧化物酶的显色底物, 在过氧化氢的作用下失去电子, 呈现颜色变化和积累, 形成棕褐色不溶性产物, 并就地原位沉淀。四唑硝基蓝(tetranitroblue tetraz-olium chloride, NBT)结合5-溴-4-氯-3-吲哚-磷酸盐(5-bromo-4-chloro-3-indolyl-phosphate, BCIP)是碱性磷酸酶最佳的底物组合之一, 在碱性磷酸酶(AP)的催化下, BCIP 会被水解, 产生强反应性产物。该产物与 NBT 发生反应, 形成不溶性的深蓝色至蓝紫色化合物。该试剂可用于碱性磷酸酶系统的酶促显色。在 AP 的催化下, 结合 AP 偶联物的地方产生深蓝色沉淀, 可根据颜色反应来确定目的抗原的位置及表达情况。目前, 免疫荧光显色被越来越多的人使用, 偶联不同荧光颜色的二抗也容易购得。
2 激素整体免疫定位实验流程
2.1 主要溶液配制
10×磷酸缓冲液 10×PBS (10×phosphate buffered saline): 1.3 M NaCl, 30 mM KCl, 70 mM Na2HPO4.2H2O, 30 mM KH2PO4, 调整 pH 为 7.2。
EDC/NHS 溶液: 2g EDC (N-(3-dimethylamin-opropyl)-N′-ethylcarbodiimide hydrochloride, Sigma)和 2gNHS(N-hydroxysuccinimide)溶解于 100mL 1× PBS 溶液中: 新鲜配制, 使用前 4ºC 预冷, EDC 粉末溶解后放入冰盒。
磷酸缓冲液 PBST: 1×PBS 加入 0.1% 吐温-20 (Tween-20)溶液。
多聚甲醛固定液(PFA溶液): 称取多聚甲醛 4g加入 50mL1×PBS 中, 加一定量的 NaOH 粉末调整 pH 为 7.2, 放入 65ºC 烘箱至多聚甲醛溶解, 后冷却至室温, 定容至 100mL 使用。
BSA 封闭液: 1×PBS, 0.1% Tween-20, 1.5%甘氨酸, 3% BSA。
20×SSC: 将 175.3g NaCl和 88.2g 柠檬酸钠溶解在 800mLH2O 中, 用 HCl 调节 pH 值至 7.0。定容至 1L, 高压灭菌保存。
通透液: 25mL 20×SSC, 0.1 mL Tween-20, 3g十二烷基磺酸钠(sodium dodecyl sulfonate, SDS), 加水至 100mL, 并在 65°C 孵育至少 30 分钟。
透明液: 80mL 水合氯醛, 10mL 甘油和 20mL无菌双蒸馏水。
DAB 染色溶液: 将 3.6mL500mM Tris-HCl (pH 8.0), 2mL0.2%NiCl2用水溶解, 定容至 40mL 后加入 24mg 3,3'-二氨基联苯胺(DAB)和 80µLH2O2, DAB 染色溶液必须新鲜配制。
2.2 材料准备
将拟南芥种子播种于 MS 培养基上, 幼苗在MS 培养基上生长 14~20 天后, 移栽到种植土中, 在16h : 8h(光照:黑暗)光周期, 22°C 恒温下培养。取14 天大的幼苗和花序用于激素整体免疫定位。
2.3 材料固定
用镊子夹取拟南芥花序或幼苗, 放入预冷的含有 0.1% Tween-20 的 EDC/NHS 缓冲液中, 并抽真空, 帮助 EDC/NHS 溶液渗透, 直到所有样品沉底。此过程需要在黑暗中进行。换新的 EDC/NHS 缓冲液, 在 4ºC 冰箱中继续固定样品 60 分钟。EDC/NHS可以使小分子 IAA 和 ABA 交联形成半抗原。整个过程中, 所有溶液都应保持冰冷状态。
倒掉 EDC/NHS 溶液, 并用 1×PBST 洗涤样品 3次, 每次 10 分钟。由于 DMSO 和 NP-40 有调节细胞膜渗透性的能力, 因此在样品中加入 4%PFA/ PBST 和 10%DMSO, 3%NP-40 固定液并抽真空, 直到所有材料沉入固定液底部, 不再有气泡冒出为止。换新的 4%PFA/PBST, 在 4°C 冰箱中过夜, 继续固定。
2.4 渗透和封闭
此步骤必须用溶剂去除表皮蜡和叶绿素, 增加抗体进入细胞的能力, 封闭抗体非特异性结合位点。使用通透液来调节植物细胞壁和细胞膜, 增加抗体进入细胞的能力。通透液需新鲜配制。
渗透时倒掉 4% PFA/PBST, 用 1×PBST 漂洗样品, 随后倒掉 1×PBST, 用 25%甲醇/PBST、50%甲醇/PBST、75%甲醇/PBST 和 100%甲醇漂洗样品。每次 20 分钟, 重复两次或直到叶绿素消失。接着, 再用 75%甲醇/25%乙醇、50%甲醇/50%乙醇、25% 甲醇/75%乙醇和 100%乙醇分别漂洗样品 20 分钟。最后, 倒掉乙醇, 将样品加入新配置的通透液中, 于 65°C 孵育至少 2 小时, 根据材料的幼嫩程度确定通透的时间, 通透后样品将完全透明。该步骤使组织对抗体更具渗透性和可及性。
封闭时倒掉通透液, 加入 4%甲醛/PBST 固定液, 固定样品 30 分钟。接着, 在室温下用 1×PBST 清洗样品 3 次, 每次 10 分钟。然后, 在样品中加入蛋白酶 K 溶液(在 1×PBST 中最终浓度为 100µg/mL), 在 37°C 轻轻摇动孵育 1 小时, 加入 5%甘氨酸/PBST终止反应。除去反应缓冲液, 并在室温下用 10% DMSO/PBST 溶液继续处理样品 1 小时(DMSO 用来调节膜渗透性)。倒掉 10% DMSO/PBST 溶液, 加入4%甲醛/PBST, 再次固定 30 分钟, 接着用 1×PBST清洗样品 3 次, 每次 10 分钟。最后, 将样品置于 3% (质量/体积) BSA/PBST 封闭液中, 在室温下孵育 4 小时, 或在 4°C 轻轻摇动过夜, 以便封闭非特异结合位点。
2.5 抗体孵育
倒掉 3% (质量/体积) BSA/PBST 封闭液, 用 1× PBST 清洗组织 3 次, 在室温下轻轻摇动, 每次 10分钟。接着, 将样品放在 IAA 或 ABA 抗体(1:100)/ 3% (质量/体积) BSA/PBST 杂交液中, 在室温下轻轻摇动, 温育 6 小时或 4°C 过夜(此步骤不设置 IAA 或ABA 抗体的阴性对照)。倒掉杂交液, 在 PBST 中清洗样品 3 次, 每次 10 分钟。最后, 在室温下将样品置于 1 : 500 二抗/3% (质量/体积) BSA/PBST 中孵育4 小时, 或在 4°C 轻轻摇动过夜。
2.6 信号检测
在室温下, 用 1×PBS, 0.1% (体积比) Tween-20洗涤样品 3 次, 每次 20 分钟。然后, 用 DAB 染色溶液孵育组织, 直到材料显示棕色背景。将样品浸入去离子水中, 以便终止反应, 并漂洗几次。按照以下浓度梯度, 用甲醇清洗样品: 25%甲醇, 50%甲醇, 75%甲醇, 100%甲醇, 每次 25 分钟, 去除背景杂色, 此步骤使反应产物的颜色变深为蓝紫色。将样品放在载玻片上, 在载玻片加入几滴水合氯醛透明液, 在显微镜下检测。
3 拟南芥侧根和花发育过程生长素的整体原位检测
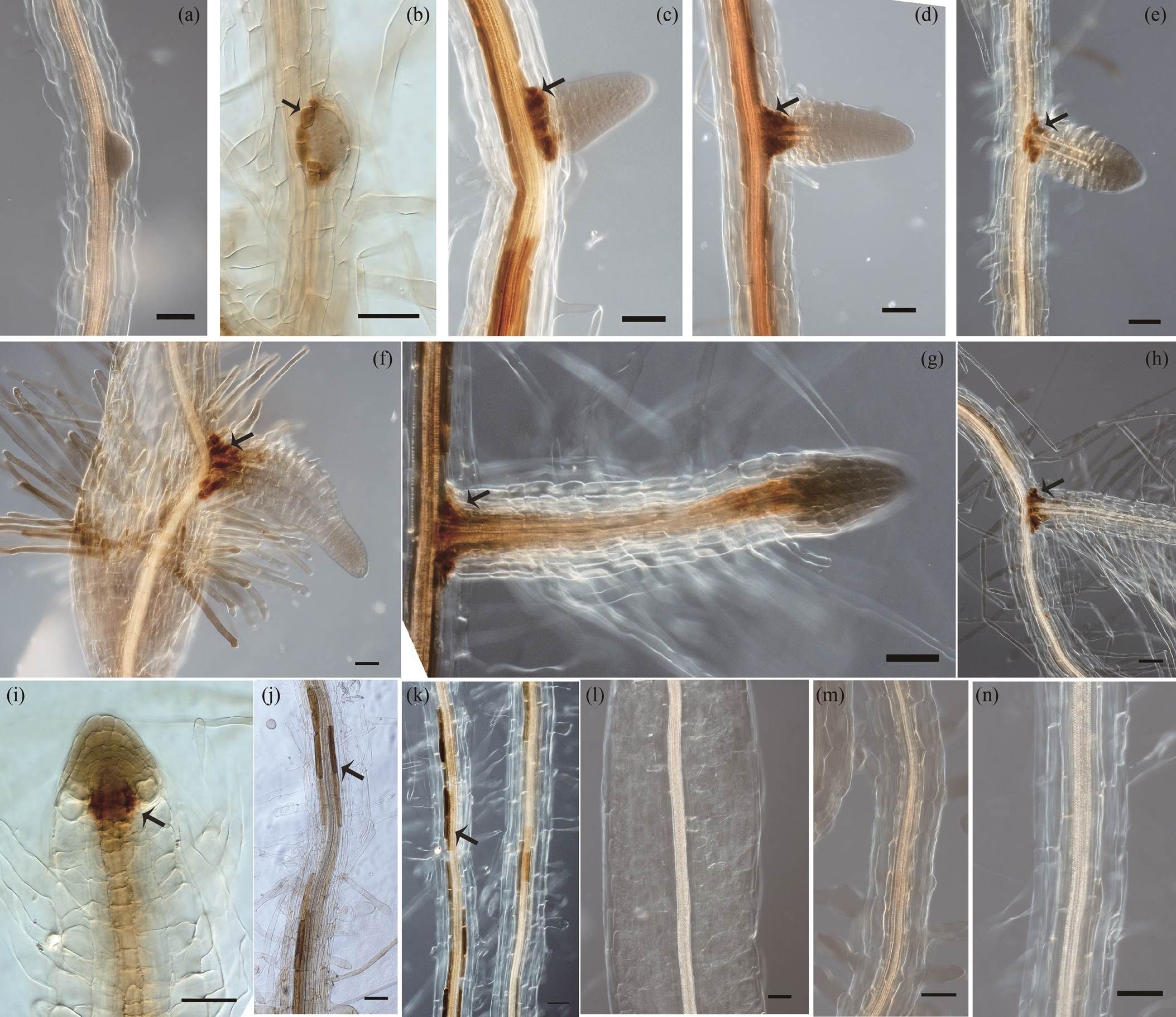
3.1 拟南芥侧根发育过程中生长素梯度分布
植物生长素能诱导根分生组织的形成和侧根原基的形成。在拟南芥幼苗中, 在侧根发育过程中观察到较强的 IAA 积累。侧根原基开始出现后, 观察到 IAA 的积累(图 1(a)和(f)), 并在静止中心(QC)得到维持(图 1(g)和(i)), 在根顶端分生组织中未观察到生长素信号, 生长素信号也以不连续的模式存在于脉管系统中(图 1(j)~(k)), 在下胚轴脉管系统中未观察到生长素信号的存在(图 1(l))。
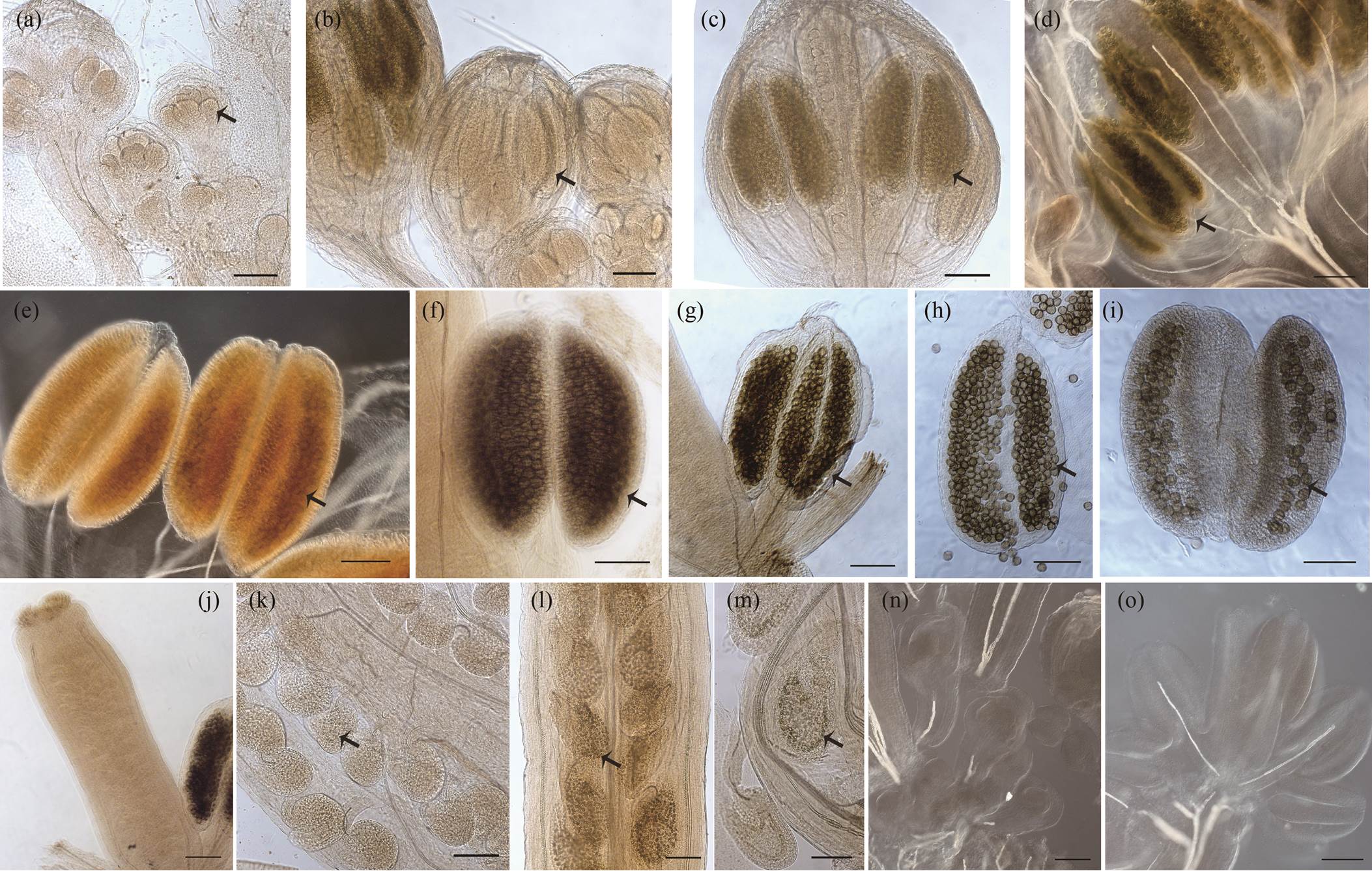
3.2 拟南芥花发育过程中生长素梯度分布
遗传证据表明, 生长素的极性运输控制拟南芥中花发育的一个主要控制信号, 即生长素的形成和分化[8]。本文的实验结果表明, 早期雄蕊中存在生长素信号, 并且随着雄蕊的发育, 其浓度在雄蕊发育期间在发育中的花粉粒中显著增加(图 2(a)~(i))。最高的生长素浓度主要在花药的花粉粒中观察到(箭头)。受精前, 心皮中没有 IAA 的积累(图 2(j)); 受精后, 胚囊中检测到低水平 IAA (图 2(k)~(m))。
4 结论
目前, 生长素和脱落酸的单克隆抗体和多克隆抗体已经商品化, 通过与酶和荧光分子等连接的二抗结合, 实现植物激素的原位定位。激素的整体原位免疫定位技术是一种操作简单、灵敏度高且准确的植物组织中激素定位的方法, 是在空间上定义植物激素分布和浓度的有效工具。
激素的整体原位免疫定位技术非常适合幼嫩的植物组织和器官, 例如根尖、侧根、年轻的初生叶、子叶、下胚轴和胚芽, 可以直接观察发育过程中的激素定位模式。但是, 仍然存在一些挑战, 例如带有较多植物酚的蕨类植物和棉花胚胎具有深褐色的背景, 固定过程中甲醛与植物酚反应形成深色聚合物, 并聚集类黄酮和丹宁酸物质, 如果采用化学染色的方法, 检测信号容易受到干扰, 可以使用免疫荧光方法解决这一问题。
参考文献
[1]Montalban I A, Novak O, Rolcik J, et al. Endogenous cytokinin and auxin profiles during in vitro organo-genesis from vegetative buds of Pinus radiata adult trees. Physiologia Plantarum, 2013, 148: 214–231
[2]Albacete A, Ghanem M E, Martinez-Andujar C, et al. Hormonal changes in relation to biomass partitioning and shoot growth impairment in salinized tomato (Solanum lycopersicum L.) plants. Journal of Experi-mental Botany, 2008, 59: 4119–4131
[3]Šimura J, Antoniadi I, Široká J, et al. Plant hormono-mics: multiple phytohormone profiling by targeted metabolomics. Plant Physiology, 2018, 177(2): 476–489
[4]Peng Y B, Zou C, Wang D H, et al. Preferential locali-zation of abscisic acid in primordial and nursing cells of reproductive organs of Arabidopsis and cucumber. New Phytology, 2006, 170: 459–466
[5]Zhao Y. Auxin biosynthesis and its role in plant deve-lopment. Annual Review of Plant Biology, 2010, 61: 49–64
[6]Marhava P, Bassukas A E L, Zourelidou M, et al. A molecular rheostat adjusts auxin flux to promote root protophloem differentiation. Nature, 2018, 558: 297–300
[7]Cecchetti V, Altamura M M, Falasca G, et al. Auxin regulates arabidopsis anther dehiscence, pollen matu-ration, and filament elongation. Plant Cell, 2008, 20: 1760–1774
[8]Pagnussat G C, Alandete-Saez M, Bowman J L, et al. Auxin-dependent patterning and gamete specification in the Arabidopsis female gametophyte. Science, 2009, 324: 1684–1689
[9]赵峰. 拟南芥雄蕊中生殖细胞诱导发生的调控机制研究[D]. 北京: 北京大学, 2014
[10]Aloni R, Schwalm K, Langhans M, et al. Gradual shifts in sites of free-auxin production during leaf-primordium development and their role in vascular differentiation and leaf morphogenesis in Arabidop-sis. Planta, 2003, 216: 841–853
[11]Nakamura A, Higuchi K, Goda H, et al. Brassinolide induces IAA5, IAA19, and DR5, a synthetic auxin response element in Arabidopsis, implying a cross talk point of brassinosteroid and auxin signaling. Plant Physiology, 2003, 133: 1843–1853
[12]Vert G, Walcher C L, Chory J, et al. Integration of auxin and brassinosteroid pathways by auxin response factor 2. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105: 9829–9834
[13]He J B, Mo D S, Chen J Y, et al. Combined whole-mount fluorescence in situ hybridization and antibody staining in zebrafish embryos and larvae. Nature Protocols, 2020, 15: 3361–3385
[14]García-Aguilar M, Dorantes-Acosta A, Pérez-España V, et al. Whole-mount in situ mRNA localization in developing ovules and seeds of Arabidopsis. Plant Molecular Biology Reporter, 2005, 23: 279–289
[15]Stahl Y, Simon R. mRNA detection by whole mount in situ hybridization (WISH) or sectioned tissue in situ hybridization (SISH) in Arabidopsis. Methods in Molecular Biology, 2010, 655: 239–251
[16]Forestan C, Varotto S. Auxin immunolocalization in plant tissues. Methods Mol Biol, 2013, 959: 223–233
[17]Sauer M, Paciorek T, Benkova E, et al. Immunocyto-chemical techniques for whole-mount in situ protein localization in plants. Nature Protocols, 2006, 1: 98–103
Whole Mountin situ Localization Technology of Plant Hormones
WANG Donghui
School of Life Sciences, National Teaching Center for Experimental Biology, State Key Laboratory of Protein and Plant Gene Research, Peking University, Beijing 100871; E-mail: wangdh@pku.edu.cn
Abstract The existing phytohormones measurement methods are relatively cumbersome and difficult to measure the concentration of intracellular hormones. The paper describes whole-mount “immunolocalization” technique for the overall distribution of auxin (IAA) during lateral root and flower development in Arabidopsis. Based on the specific reaction of the antibody to the antigen, this method binds the antibody to the secondary antibody linked to enzymes, fluorescent molecules, etc. to detect the auxin in tissues or organs by light and electron microscopy, realizing the overall in situ localization of auxin (whole mount in situ localization of Hormone, WISIH). This method is not only suitable for growth hormone IAA, but also for rapid and reliable tissue or organ localization of hormones such as abscisic acid (ABA). The protocol is usually done within three to four days. It is a highly sensitive, specific and simple hormone in situ localization method, and is suitable for various plant tender organs and tissues.
Key words whole mount in situ localization; antibody; hormone; IAA