氮磷添加对温带和亚热带森林土壤碳氮矿化的影响
李瑞 冯继广 朱彪†
北京大学生态研究中心, 北京大学城市与环境学院, 地表过程分析与模拟教育部重点实验室, 北京 100871; †通信作者, E-mail: biaozhu@pku.edu.cn
摘要 选取黑龙江五营温带森林和福建武夷山亚热带森林两个站点, 通过 120 天室内培养实验, 探讨氮磷(NH4NO3 和 NaH2PO4)添加对两种森林表层土壤(0~20cm)碳氮矿化的影响。结果表明, 氮添加通过降低土壤微生物的生物量及其碳氮比来降低亚热带森林的土壤碳矿化, 但对温带森林的土壤碳矿化没有显著影响; 磷添加对两种森林的土壤碳矿化均没有显著影响。磷添加显著地增加温带森林的土壤净氮矿化, 氮添加显著地降低温带森林的土壤净氮矿化, 氮添加和磷添加均对亚热带森林的土壤净氮矿化没有显著影响。总体而言, 可能由于养分可利用性和土壤性质的区别, 温带森林和亚热带森林土壤碳氮矿化对氮磷添加的响应存在 区别。
关键词 养分添加; 温带森林; 亚热带森林; 土壤微生物; 土壤碳氮矿化
土壤是陆地生态系统最大的碳库, 0~1m 土层的碳储量约为 1500Pg, 是大气碳储量的两倍, 全球植被碳储量的 3 倍[1], 土壤呼吸也是陆地生态系统碳循环中第二大碳通量。作为陆地生态系统中营养物质循环的关键角色, 土壤微生物分解土壤有机碳产生的碳(即碳矿化或异养呼吸)通量占土壤呼吸总量的 2/3 以上[2], 在全球碳循环过程中起着重要作用。因此, 土壤碳矿化(异氧呼吸)的微小变化会对土壤有机碳的固存产生较大地影响, 进而影响全球碳循环[2]。土壤氮矿化指土壤有机氮在微生物作用下转换为无机氮的过程, 是植物可利用氮的主要来源[3]。研究土壤碳氮矿化, 对于了解土壤碳和养分循环以及揭示生态系统功能具有重要意义。土壤碳氮矿化过程主要由微生物驱动, 受到生物(微生物生物量、微生物胞外酶活性等)与非生物因素(pH值、氮磷可利用性和土壤有机质含量等)的共同影响[3–5]。
氮(N)和磷(P)是影响陆地生态系统生产力和土壤微生物结构与功能的两种重要元素。工业革命以来, 人类活动产生的氮磷输入对植被生产力、土壤碳固存和释放等生态系统过程产生重大影响[6]。氮磷添加可以直接或间接地影响土壤微生物活性(如生物量和酶活性), 进而影响土壤碳氮矿化。研究表明, 氮添加会通过降低土壤 pH 值来抑制微生物生物量和胞外酶活性, 从而抑制土壤碳矿化[7]。在缺磷的土壤中, 磷添加会促进土壤碳矿化[8]。整合分析研究结果表明, 氮添加降低了微生物生物量和土壤碳矿化[9], 磷添加增加了热带森林土壤微生物生物量和土壤碳矿化[10]。对氮矿化而言, 氮磷添加均能显著地提高土壤微生物净氮矿化[11]。但是, 也有研究表明, 在亚热带森林中氮添加会抑制净氮矿化, 这个现象可能与氮的可利用性增加有关[12]。此外, 在氮饱和的土壤中添加磷, 能够显著促进土壤净氮矿化[13]。温带森林和亚热带森林在土壤养分状况和微生物资源限制等方面存在差异[14–15], 氮磷添加会对不同森林类型的土壤微生物群落结构和功能产生不同的影响, 进而对土壤碳氮矿化产生差异性的影响。
由于温带森林和亚热带森林土壤养分可利用性的差别, 氮磷添加对二者土壤碳氮矿化的影响可能并不一致, 但目前尚缺少采用相同实验条件(如养分种类和添加量)将两种森林放在一起的研究, 使得不同实验结果的比较具有很大的不确定性。基于此, 本研究选取温带森林和亚热带森林为研究对象, 设置对照、低氮添加、高氮添加、低磷添加和高磷添加 5 种处理, 探讨不同剂量的氮磷添加对土壤碳氮矿化的影响。本文提出以下假设: 由于温带森林土壤微生物的氮限制程度较强, 而亚热带森林土壤微生物的磷限制程度较强, 氮添加可能会促进温带森林土壤碳氮矿化, 磷添加则会促进亚热带森林土壤碳氮矿化。
1 材料与方法
1.1 研究区域概况
本文选取中国森林养分添加实验平台(Nutrient Enrichment Experiments in Chinese Forests, NEECF)中的五营(温带森林)和武夷山(亚热带森林)两个站点为研究对象, 探究不同剂量的氮磷添加对森林土壤碳氮矿化的影响。
五营站位于小兴安岭南段伊春市五营区境内的五营林区(129°11′E, 48°07′N, 海拔 350m), 为寒温带大陆性气候。夏季高温多雨, 春、秋、冬季都比较干旱, 年平均降水量为 654mm, 年平均气温为−0.5°C, 最热月和最冷月平均气温分别为20.3°C 和−24.2°C。主要植被类型为针阔叶混交林, 乔木层以红松为主(Pinus koraiensis), 伴有云杉(Picea je-zoensis)、臭冷杉(Abies nephrolepis)等针叶乔木以及枫桦(Betulla costata)、椴树(Tilia amurensis)、柞树(Quercus mongolica)等阔叶乔木[16]。土壤类型主要是在花岗岩上发育起来的暗棕壤[17]。
武夷山站位于福建省西北部的武夷山国家自然保护区内(117°57′E, 27°39′N, 海拔602m), 为亚热带季风气候。四季温暖湿润, 年平均降水量为 1889mm, 年平均气温为 18.0°C, 最热月和最冷月平均气温分别为 19.2°C 和 10.5°C。武夷山植被垂直带谱比较完整, 海拔从高到低依次为高山草甸、亚高山矮林、针叶林、针阔混交林和常绿阔叶林[18]。植被类型主要为常绿阔叶林, 乔木层的主要树种有米槠(Castanopsis carlesii)、刨花润楠(Machilus pauhoi)、杉木(Cunninghamia lanceolata)等, 灌木层伴生种主要有榕叶冬青(Ilex ficoidea)、树参(Dendropanax dentiger)、密花树(Rapanea neriifolia)等, 草本层物种比较少, 主要有砂仁(Amomum villosum)和狗脊(Woodwardia japonica)[19]。土壤类型主要为山地黄壤[20]。
1.2 实验设计与方法
在两个站点分别选取 3 个取样点(间距超过 20m)作为重复, 用直径 5cm 的土钻进行随机取样, 分别钻取 0~10cm 和 10~20cm 的矿质土壤(去除地表凋落物)各 3 钻。将每钻的两层土壤混合, 得到每个取样点的混合土样(0~20cm), 进行过筛处理和室内培养。
两种森林都设置 5 种养分处理: 对照、低氮添加(N1, 0.25mgN/g soil)、高氮添加(N2, 1.0mgN/g soil)、低磷添加(P1, 0.25mgP/gsoil)和高磷添加(P2, 1.0mgP/gsoil)。以溶液的形式进行氮(NH4NO3)和磷(NaH2PO4)添加, 对照组添加相同体积的超纯水, 每个处理设置 3 个重复, 一共 30 个样品进行室内培养。2018 年 6 月开始培养实验, 预培养 10 天后, 进行养分添加处理, 开始正式培养, 并采用碱液吸收法测定土壤碳矿化, 培养温度为 25°C, 培养时间为120 天。根据土壤含水量, 称取相当于 20g 干土的鲜土置于培养杯中, 调节土壤水分至田间持水量的65%, 同时取 20 mL1MNaOH 溶液置于 30 mL 广口塑料小白瓶中, 将装有土壤的培养杯和小白瓶一起放入塑料盒中, 然后向其中倒入少量水, 加盖密封。正式培养的第 4, 8, 14, 22, 31, 41, 55, 70, 84, 100 和 120 天收集并更换碱液, 一共得到 330 个碱液样品。
1.3 测定指标及方法
室内培养前和培养后, 对土壤的基础理化性质和微生物相关指标进行测定。培养结束后, 采用电导率法测定碱液中的 CO2-C 含量[21]。首先, 取按不同比例混合的 0.5M 的 NaOH 和 0.25M 的 Na2CO3 配置标准曲线。然后, 取 4mL 碱液置于离心管中, 加入 4mL 超纯水, 振荡混合均匀, 用电导率仪(FE38-Standard, Mettler Toledo)测定 3 次, 并记录电导率读数。将 3 次的电导率读数进行平均, 根据标准曲线计算碱液中无机碳含量, 并经过换算得到微生物的碳矿化总量。为定量表示养分添加对土壤碳氮矿化的影响, 本研究计算了 120 天累积的单位土壤的碳矿化(R, μg C/g soil)和净氮矿化(Nmin, μg N/g soil)。碳矿化的计算公式为
R = 碱液中C浓度×碱液体积/土壤干重,
氮矿化的计算公式为
Nmin = (培养后无机氮含量−培养前无机氮含量)/土壤干重。
采用荧光法测定土壤胞外酶活性[22], 包括 3 个水解酶(BG, β-1,4-glucosidase, 碳获取酶; NAG, β-1,4-N-acetyl-glucosaminidase, 氮获取酶; AP, acid phosphatase, 磷获取酶)和两个氧化酶(POX, phenol oxidase, 将苯酚氧化为喹酮; PER, peroxidase, 参与木质素氧化分解)。提前一天将样品从−20°C 转移到 4°C 冰箱中, 准确地称取 1.5g 土壤样品, 置于250mL 硬质玻璃瓶中, 加入 150mL 醋酸钠缓冲溶液, 搅拌 2 分钟至均匀。对于水解酶(BG, NAG, AP), 用移液枪取 200μL 土壤溶液, 加入 96 孔黑色酶标板中, 再加入 50μL 对应底物, 并用 200μL 土壤溶液和 50μL 标准物质(MUB)配置标准曲线。对于氧化酶(POX, PER), 用移液枪在 96 孔白色酶标板中加入 200μL 土壤溶液和 50μLDOPA(用于测定POX), 或加入 200μL 土壤溶液、50μLDOPA 和 10μLH2O2 (用于测定 PER)。同时设置对照组, 包括底物对照和样品对照。每个样品重复测定 8 次, 将水解酶放置培养箱中, 于 25°C 黑暗条件下培养 3 小时, 氧化酶放置培养箱中, 于 25°C 黑暗条件下培养24 小时。培养完成后, 使用酶标仪(SynergyH1M, Biotek, 美国)测量读数, 并计算酶活性, 水解酶单位为nmol/(h·g), 氧化酶单位为μmol/(h·g)。
1.4 数据处理
计算土壤胞外酶活性的矢量特征。以碳获取酶活性与碳氮总获取酶活性的比值(代表微生物受氮限制程度)为 X 轴, 以碳获取酶活性与碳磷总获取酶活性的比值(代表微生物受磷限制程度)为 Y 轴, 在坐标系中画出样点, 与原点(0, 0)连接, 获得一条矢量线段, 其长度表示微生物碳相对于养分的限制(car-bon vs nutrient limitation), 矢量与 X 轴的夹角表示微生物磷相对氮限制(PvsN limitation)的情况[23]。计算公式为
X = Ln(BG)/Ln(BG+AP),
Y = Ln(BG)/Ln(BG+NAG),
矢量长度 = SQRT(X2 + Y2),
矢量角度 = DEGREES(ATAN2(X;Y)),
式中, SQRT, DEGREES 和 ATAN2 分别为平方根函数、角度函数和方位角函数。
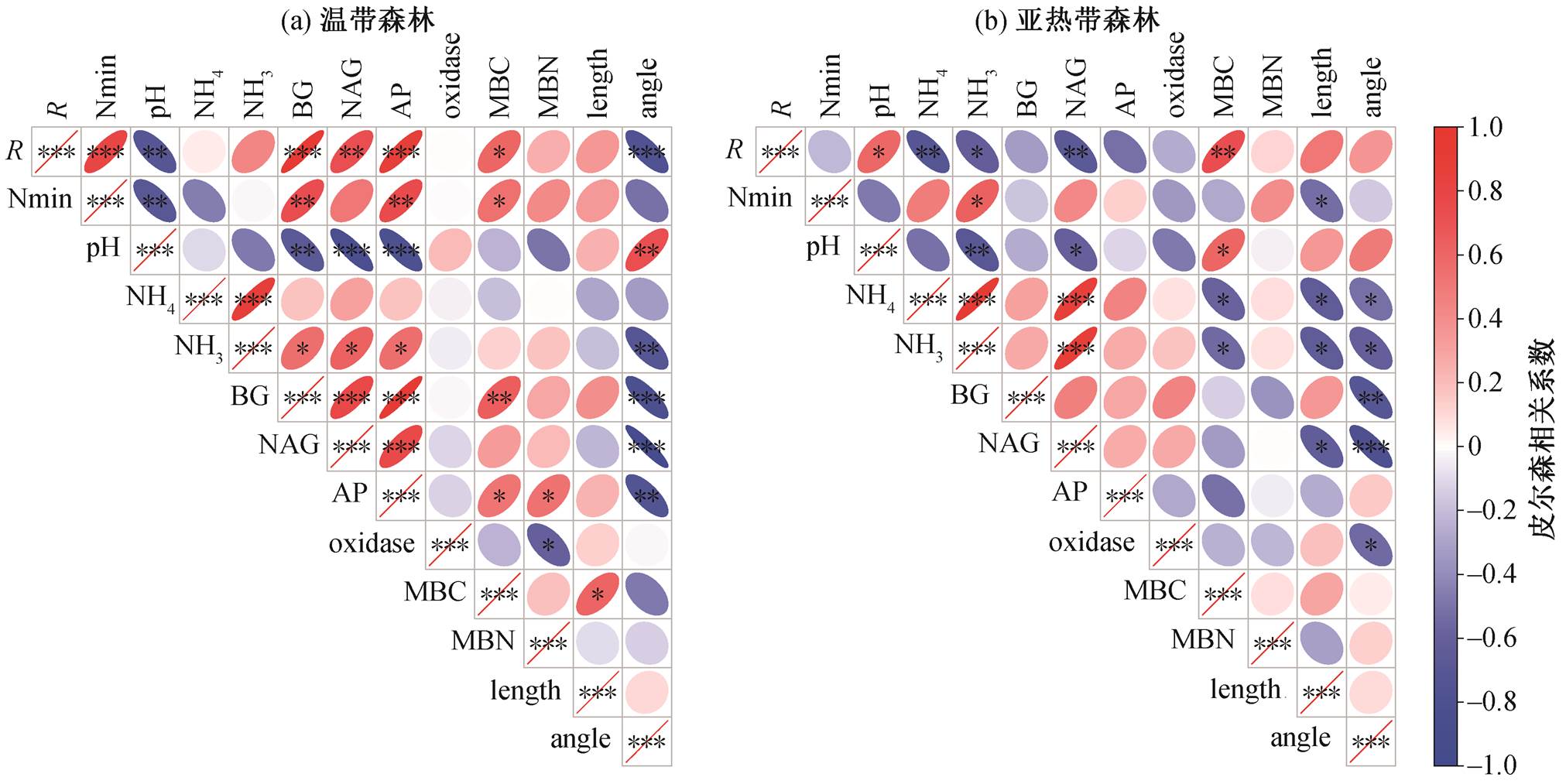
用多元方差分析方法, 研究氮(磷)添加、地点以及两者的交互作用对土壤基础理化性质、微生物生物量、胞外酶活性以及铵态氮、硝态氮等指标的整体影响。为分析每个地点氮(磷)添加的影响是否显著, 用配对 t 检验方法分析对照组与 4 个实验组之间的差异。用土壤 pH 以及土壤微生物生物量、酶活性等指标, 与土壤微生物碳氮矿化做 Pearson相关分析。全部数据分析和绘图都使用 R4.0.3 软件完成。
2 结果
2.1 氮磷添加对土壤基础理化性质的影响
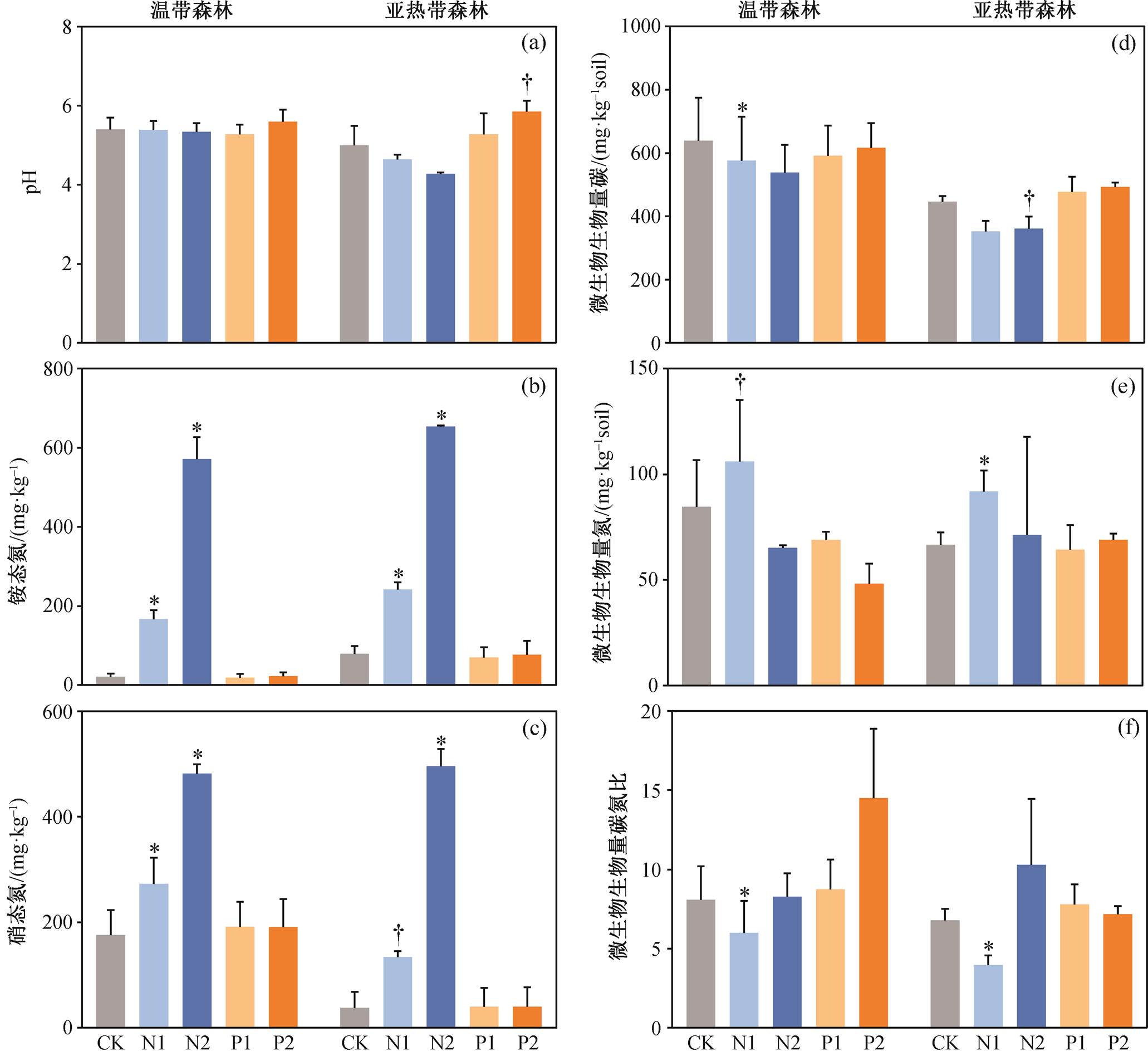
从表 1 看出, 两种森林之间土壤 pH 差异显著(p<0.05), 亚热带森林土壤 pH 比温带森林土壤 pH低。总体上, 氮添加对土壤 pH 值影响显著(p<0.05), 磷添加对土壤 pH 的影响接近显著(p<0.10), 氮添加和森林类型交互作用显著(p<0.05)。分开来看, 氮磷添加对温带森林和亚热带森林土壤 pH 均没有显著影响(图 1)。就土壤中无机氮而言, 不论是硝态氮还是铵态氮, 五营温带森林和武夷山亚热带森林之间均差异显著(p<0.05, 表 1)。由于外源氮添加, 土壤无机氮含量在氮添加处理与对照之间差异显著(p<0.05, 图 1)。磷添加则对土壤无机氮没有显著 影响。
表1 氮磷添加、森林类型以及它们的交互作用对土壤和微生物指标的影响
Table 1 Effects of nitrogen and phosphorus addition, forest types and their interactions on soil and microbial variables
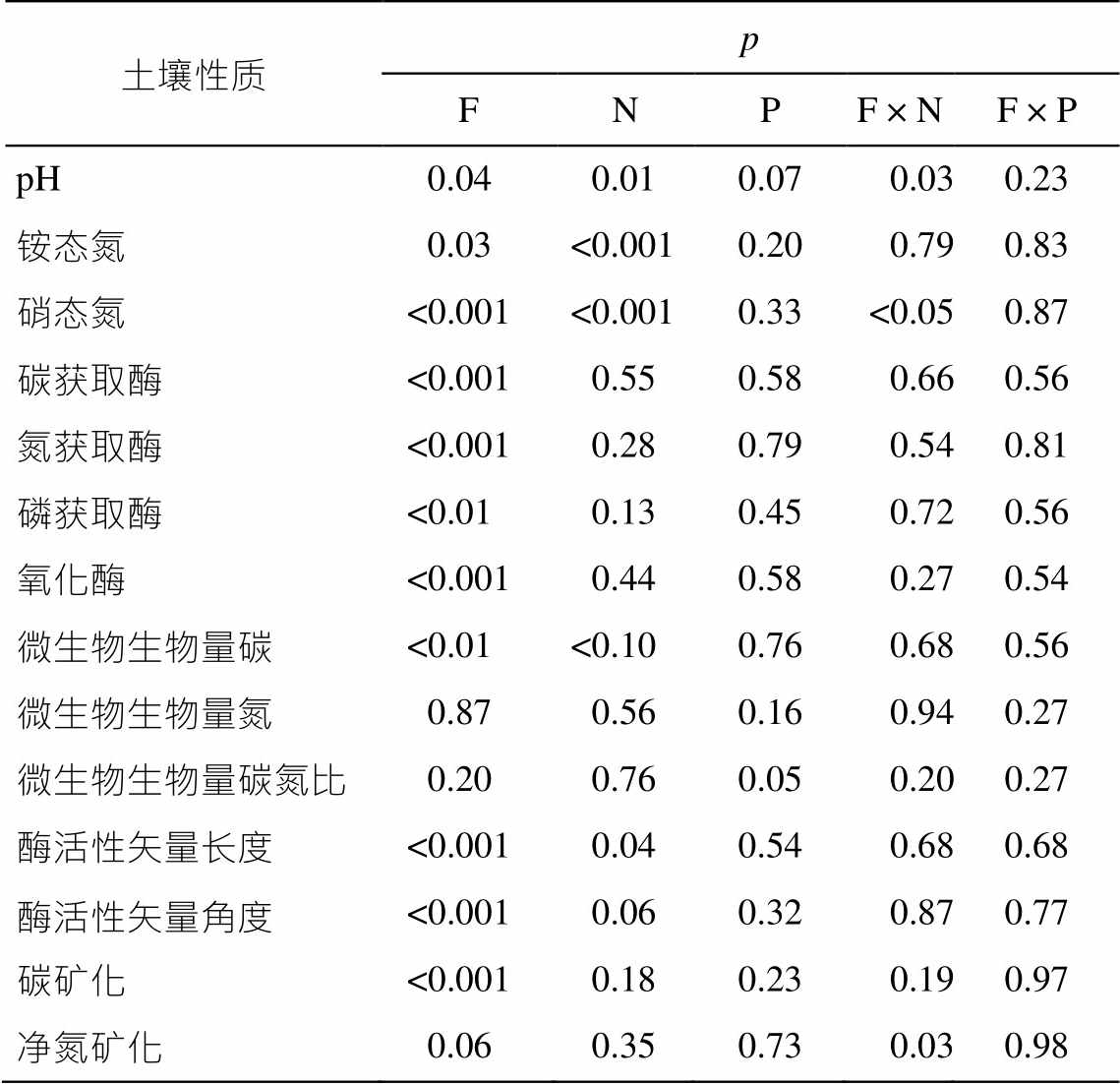
土壤性质p FNPF × NF × P pH0.040.010.070.030.23 铵态氮0.03<0.0010.200.790.83 硝态氮<0.001<0.0010.33<0.050.87 碳获取酶<0.0010.550.580.660.56 氮获取酶<0.0010.280.790.540.81 磷获取酶<0.010.130.450.720.56 氧化酶<0.0010.440.580.270.54 微生物生物量碳<0.01<0.100.760.680.56 微生物生物量氮0.870.560.160.940.27 微生物生物量碳氮比0.200.760.050.200.27 酶活性矢量长度<0.0010.040.540.680.68 酶活性矢量角度<0.0010.060.320.870.77 碳矿化<0.0010.180.230.190.97 净氮矿化0.060.350.730.030.98
说明: F表示森林类型, N表示氮添加, P表示磷添加, 乘号表示交互作用。
2.2 氮磷添加对土壤微生物生物量和酶活性的影响
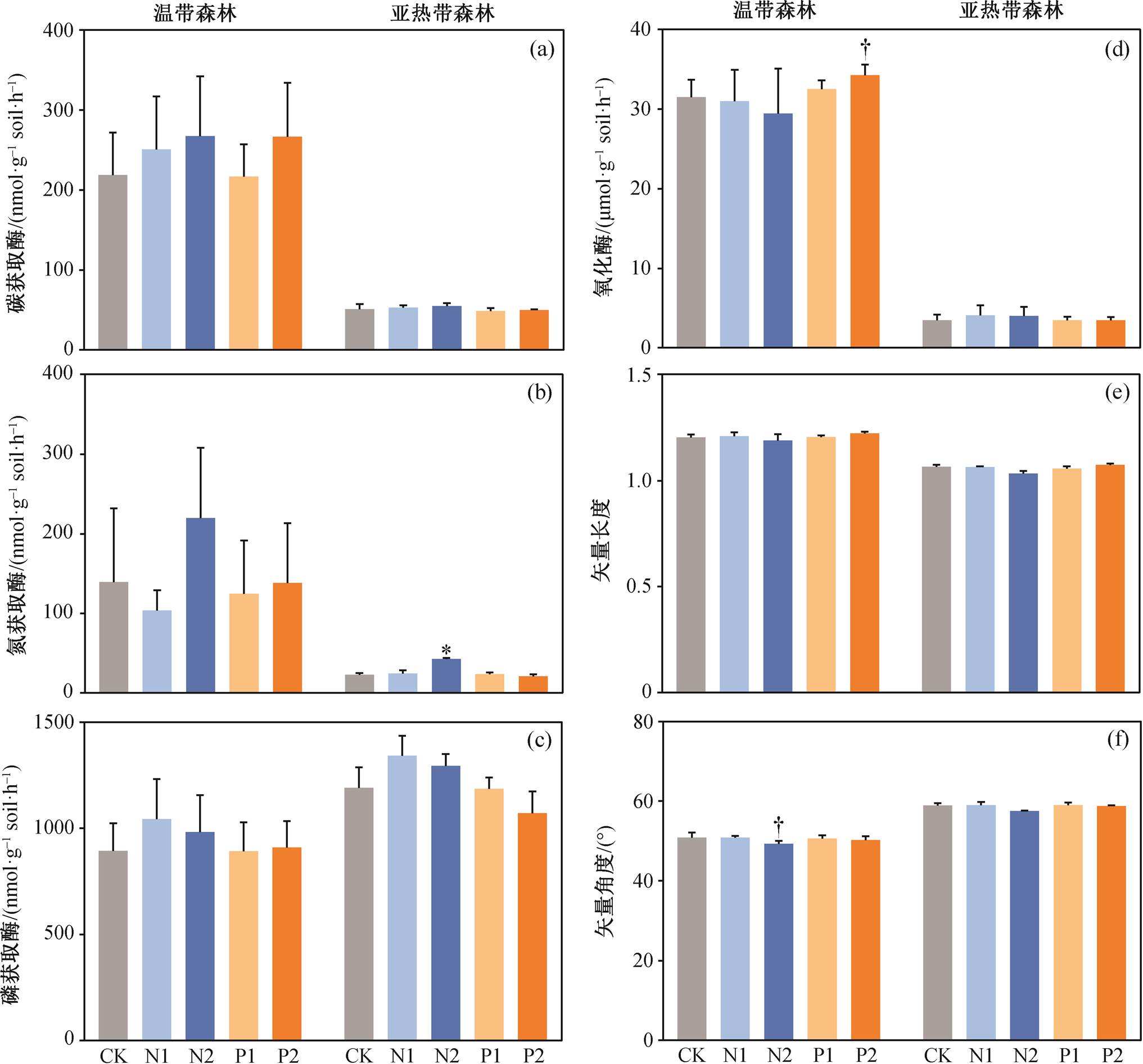
两种森林的微生物生物量碳、碳氮获取酶和氧化酶活性以及酶活性矢量长度和角度均存在显著的差异(p<0.05), 而微生物生物量氮和微生物生物量碳氮比差异不显著(表 1)。温带森林的微生物生物量碳、碳氮获取酶和氧化酶活性高于亚热带森林, 而亚热带森林的磷获取酶活性和酶活性矢量角度高于温带森林(p<0.05, 图 1 和 2)。总体而言, 氮磷添加对这些微生物生物量和酶活性相关指标的影响均比较小(表 1), 且这种影响在两种森林中并不一致(图 1 和 2)。从图 1 看出, 低氮添加对两种森林的微生物生物量碳有抑制趋势(p<0.10), 而低氮添加显著促进微生物生物量氮(p<0.10), 并降低微生物生物量碳氮比(p<0.05)。从图 2 看出, 高氮添加促进亚热带森林的氮获取酶活性(p<0.05), 降低温带森林的酶活性矢量角度(p<0.10), 而高磷添加提高了温带森林的氧化酶活性(p<0.10)。
2.3 氮磷添加对土壤碳氮矿化的影响
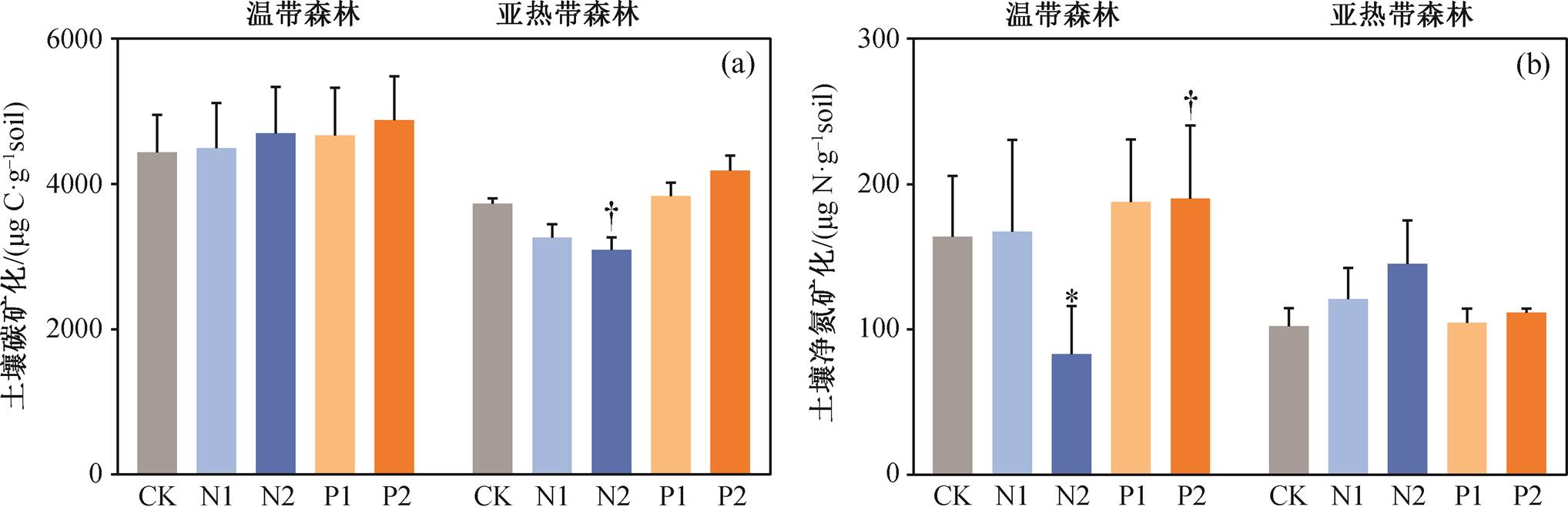
表 1 显示, 两种森林土壤培养期间的碳矿化具有显著的差别(p<0.05), 净氮矿化具有接近显著的区别(p<0.10)。从图 3 看出, 温带森林的土壤碳矿化与净氮矿化均比亚热带森林要高。具体而言, 高氮添加接近显著地抑制亚热带森林的土壤碳矿化(p< 0.10), 高氮添加和高磷添加分别显著(p<0.05)地抑制和接近显著(p<0.10)地促进温带森林的土壤净氮矿化, 其他处理则没有显著影响。
3 讨论
3.1 氮添加对两种森林土壤碳氮矿化的影响
本研究表明, 120 天的短期氮添加对温带森林的土壤碳矿化无显著影响, 但高氮添加显著地抑制亚热带森林的土壤碳矿化(图 3)。
以往的案例研究和整合分析研究大多表明, 氮添加倾向于降低土壤微生物生物量[24–25]。一般来说, 氮添加导致微生物生物量降低, 进一步导致微生物活性降低, 从而抑制土壤有机质的分解。我们发现, 低氮添加显著地降低亚热带森林的微生物生物量碳, 而微生物生物量碳与土壤碳矿化具有正相关关系(图 4), 因此, 这可能是氮添加显著地抑制亚热带森林土壤碳矿化的原因。除降低微生物生物量外, 氮添加也对微生物群落结构和组成产生影响[26–27]。本文研究结果表明, 低氮添加显著地降低亚热带森林微生物的生物量碳氮比(图 1), 表明在亚热带森林中, 氮添加可能降低了微生物群落中真菌生物量, 从而减少微生物分解难以分解的有机碳, 降低碳矿化。
虽然氮添加显著地降低温带森林的微生物生物量碳和碳氮比, 但对土壤碳矿化没有显著影响, 可能是因为氮添加减轻了温带森林的磷限制, 促进了微生物对磷的利用(图 2)。研究表明, 氮添加导致的土壤 pH 降低会对微生物生长产生毒害作用[28]。温带森林土壤 pH 对氮添加的响应没有亚热带森林强烈(图 1), 可能也是氮添加没有对温带森林土壤碳矿化产生显著抑制的原因之一。
对净氮矿化而言, 氮添加降低温带森林土壤净氮矿化, 但对亚热带森林土壤净氮矿化没有显著影响。一方面, 温带森林更缺氧, 所以土壤净氮矿化较高, 氮添加可能缓解了氮匮乏, 从而降低土壤净氮矿化。另一方面, 外源氮添加可能会被固定到不易分解的土壤有机质中[29], 从而降低微生物净氮矿化。本研究发现, 虽然氮添加促进了亚热带森林土壤微生物的氮获取酶活性, 但没有促进亚热带森林土壤微生物的净氮矿化, 可能是因为亚热带森林土壤微生物的磷限制大于氮限制。
3.2 磷添加对两种森林土壤碳氮矿化的影响
磷是植物生长的主要限制元素之一, 也是热带森林的限制元素, 但有关磷添加对温带地区土壤影响的研究比较匮乏[30]。本研究发现, 磷添加对两种森林土壤碳矿化没有显著影响(图 3)。
以往的研究表明, 磷添加会显著地促进土壤有机质分解[31–33]。也有整合分析研究发现, 磷添加会促进热带森林土壤碳矿化, 但对温带森林没有显著影响[30]。有研究发现, 磷添加通过促进微生物生物量来促进土壤碳矿化[34]。但是, 本研究结果表明, 磷添加对两种森林的微生物生物量碳都没有显著影响。另外, 胞外酶是参与土壤有机质分解的最直接的酶, 其活性可作为微生物养分需求、土壤养分循环和土壤碳矿化的指标[35]。我们发现, 磷添加对两种森林土壤胞外酶活性均没有产生显著影响, 可能是短期磷添加对微生物生物量和胞外酶影响较小, 从而没有对土壤碳矿化产生显著影响。
有研究发现, 磷添加会通过解吸附可溶性有机碳, 减轻土壤微生物的碳限制, 从而促进土壤碳矿化[36]。然而, 我们的研究发现, 虽然亚热带森林比温带森林具有更高的磷限制, 但添加磷并没有减轻亚热带森林的碳限制(图 2)。也有研究发现, 氮磷同时添加会显著地促进土壤碳矿化, 单独施加则无影响[37]。虽然我们研究的亚热带森林和温带森林的土壤微生物皆为磷限制大于氮限制, 但是它们可能仍然受到氮匮乏的影响, 因此磷添加对土壤碳矿化没有产生显著影响。另外, 热带和亚热带森林土壤磷容易被铁铝氧化物吸附而变成微生物难以利用的磷[38–39]。因此, 虽然亚热带森林的磷限制更强, 但是外源添加的磷可能会被吸附, 从而不会对土壤碳矿化产生显著影响。
对氮矿化而言, 磷添加促进温带森林土壤的净氮矿化, 其中高磷添加的影响接近显著(图 3, p< 0.10)。这可能是因为磷添加促进了微生物对氮矿化资源的分配[13]。磷添加对亚热带森林土壤净氮矿化没有显著影响, 可能是磷添加没有起到促进微生物活性的作用, 从而不会促进净氮矿化。
4 结论
本研究选取温带森林和亚热带森林表层 0~20 cm 土壤进行短期(120 天)氮磷添加室内培养实验, 结果表明两种森林土壤微生物的营养限制均为磷限制大于氮限制, 说明随着氮沉降的进行, 土壤氮磷比升高, 森林土壤微生物可能正经历由氮限制向磷限制的转变。同时, 由于养分可利用性和土壤性质的区别, 氮磷添加对两种森林的土壤碳氮矿化产生不同的影响。氮磷添加对温带森林土壤碳矿化没有显著的影响, 而高氮添加降低了亚热带森林的碳矿化。就净氮矿化而言, 氮添加显著地抑制温带森林土壤净氮矿化, 磷添加显著地促进温带森林土壤净氮矿化。
本研究存在一些不足之处, 一是所设计的氮磷梯度偏少(0.25 和 1.0mg/g soil), 不能全面地反映氮磷沉降量对土壤碳氮矿化的非线性影响; 二是没有测定培养末期土壤微生物群落组成的变化, 限制了对微生物群落如何调控土壤碳氮矿化的认识。未来的研究中应选取更多地点, 拓宽氮磷添加梯度, 延长培养时间, 增加微生物指标测定, 更加全面和深入地探究氮磷添加对森林土壤碳氮矿化的影响及其调控机制。
参考文献
[1]Schlesinger W H, Andrews J A. Soil respiration and the global carbon cycle. Biogeochemistry, 2000, 48 (1): 7–20
[2]Chen S T, Zou J W, Hu Z H, et al. Global annual soil respiration in relation to climate, soil properties and vegetation characteristics: summary of available data. Agricultural and Forest Meteorology, 2014, 198: 335–346
[3]Mooshammer M, Wanek W, Hammerle I, et al. Ad-justment of microbial nitrogen use efficiency to car-bon: nitrogen imbalances regulates soil nitrogen cyc-ling. Nature Communications, 2014, 5: 3694
[4]Meier I C, Finzi A C, Phillips R P. Root exudates increase N availability by stimulating microbial tur-nover of fast-cycling N pools. Soil Biology & Bio-chemistry, 2017, 106: 119–128
[5]陈书涛, 胡正华, 张勇, 等. 陆地生态系统土壤呼吸时空变异的影响因素研究进展. 环境科学, 2011, 32(8): 2184–2192
[6]Yue K, Fornara D A, Yang W Q, et al. Influence of multiple global change drivers on terrestrial carbon storage: additive effects are common. Ecology Let-ters, 2017, 20(5): 663–672
[7]Keeler B L, Hobbie S E, Kellogg L E. Effects of long-term nitrogen addition on microbial enzyme activity in eight forested and grassland sites: implications for litter and soil organic matter decomposition. Ecosys-tems, 2009, 12(1): 1–15
[8]Hui D, Porter W, Phillips J R, et al. Phosphorus rather than nitrogen enhances CO2 emissions in tropical forest soils: evidence from a laboratory incubation study. European Journal of Soil Science, 2020, 71(3): 495–510
[9]Zhang T A, Chen H Y H, Ruan H. Global negative effects of nitrogen deposition on soil microbes. The ISME Journal, 2018, 12(7): 1817–1825
[10]Camenzind T, Hättenschwiler S, Treseder K K, et al. Nutrient limitation of soil microbial processes in tropical forests. Ecological Monographs, 2018, 88(1): 4–21
[11]Wang C H, Zhu F, Zhao X, et al. The effects of N and P additions on microbial N transformations and bio-mass on saline-alkaline grassland of Loess Plateau of Northern China. Geoderma, 2014, 213: 419–425
[12]赵阳, 张驰, 赵竑绯, 等. 氮磷添加对亚热带常绿阔叶林土壤氮素矿化的影响. 生态学杂志, 2013, 32 (7): 1690–1697
[13]Chen H, Gurmesa G A, Zhang W, et al. Nitrogen saturation in humid tropical forests after 6 years of nitrogen and phosphorus addition: hypothesis testing. Functional Ecology, 2016, 30(2): 305–313
[14]Walker T W, Syers J K. Fate of phosphorus during pedogenesis. Geoderma, 1976, 15(1): 1–19
[15]Joergensen R G, Scheu S. Response of soil microorga-nisms to the addition of carbon, nitrogen and phos-phorus in a forest Rendzina. Soil Biology & Bioche-mistry, 1999, 31(6): 859–866
[16]邹春静, 徐文铎. 中国东北植被生态学研究中的焦点问题. 应用生态学报, 2004, 15(10): 1711–1721
[17]李俊清, 崔国发, 臧润国. 小兴安岭五营林区森林生态系统经营研究. 北京林业大学学报, 2000, 22 (4): 25–34
[18]何容, 王国兵, 汪家社, 等. 武夷山不同海拔植被土壤微生物量的季节动态及主要影响因子. 生态学杂志, 2009, 28(3): 394–399
[19]康海军, 李春光. 武夷山亚热带常绿阔叶林土壤养分及酶活性对氮沉降的响应. 水土保持研究, 2019, 26(2): 93–99
[20]徐侠, 陈月琴, 汪家社, 等. 武夷山不同海拔高度土壤活性有机碳变化. 应用生态学报, 2008, 19(3): 539–544
[21]Han M G, Sun L J, Gan D Y, et al. Root functional traits are key determinants of the rhizosphere effect on soil organic matter decomposition across 14 tem-perate hardwood species. Soil Biology & Biochemis-try, 2020, 151: 108019
[22]Chen X, Ding Z J, Tang M, et al. Greater variations of rhizosphere effects within mycorrhizal group than between mycorrhizal group in a temperate forest. Soil Biology & Biochemistry, 2018, 126: 237–246
[23]Moorhead D L, Sinsabaugh R L, Hill B H, et al. Vector analysis of ecoenzyme activities reveal con-straints on coupled C, N and P dynamics. Soil Bio-logy & Biochemistry, 2016, 93: 1–7
[24]Riggs C E, Hobbie S E. Mechanisms driving the soil organic matter decomposition response to nitrogen enrichment in grassland soils. Soil Biology & Bio-chemistry, 2016, 99: 54–65
[25]Mori T, Lu X K, Aoyagi R, et al. Reconsidering the phosphorus limitation of soil microbial activity in tropical forests. Functional Ecology, 2018, 32(5): 1145–1154
[26]Zak D R, Pregitzer K S, Burton A J, et al. Microbial responses to a changing environment: implications for the future functioning of terrestrial ecosystems. Fun-gal Ecology, 2011, 4(6): 386–395
[27]Demoling F, Nilsson L O, Baath E. Bacterial and fungal response to nitrogen fertilization in three coniferous forest soils. Soil Biology & Biochemistry, 2008, 40(2): 370–379
[28]Tian D S, Niu S L. A global analysis of soil acidifi-cation caused by nitrogen addition. Environmental Research Letters, 2015, 10(2): 024019
[29]Kaye J, Barrett J, Burke I. Stable nitrogen and carbon pools in grassland soils of variable texture and carbon content. Ecosystems, 2002, 5(5): 461–471
[30]Feng J G, Zhu B. A global meta-analysis of soil respiration and its components in response to phos-phorus addition. Soil Biology & Biochemistry, 2019, 135: 38–47
[31]Cleveland C C, Townsend A R. Nutrient additions to a tropical rain forest drive substantial soil carbon dio-xide losses to the atmosphere. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(27): 10316–10321
[32]Liu L, Gundersen P, Zhang T, et al. Effects of phos-phorus addition on soil microbial biomass and com-munity composition in three forest types in tropical China. Soil Biology & Biochemistry, 2012, 44(1): 31–38
[33]Hui D F, Porter W, Phillips J R, et al. Phosphorus rather than nitrogen enhances CO2 emissions in tro-pical forest soils: Evidence from a laboratory incuba-tion study. European Journal of Soil Science, 2020, 71(3): 495–510
[34]Wei S Z, Tie L H, Liao J, et al. Nitrogen and phos-phorus co-addition stimulates soil respiration in a subtropical evergreen broad-leaved forest. Plant and Soil, 2020, 450(1/2): 171–182
[35]Zechmeister-Boltenstern S, Keiblinger K M, Moo-shammer M, et al. The application of ecological stoichiometry to plant-microbial-soil organic matter transformations. Ecological Monographs, 2015, 85(2): 133–155
[36]Spohn M, Schleuss P M. Addition of inorganic phosphorus to soil leads to desorption of organic compounds and thus to increased soil respiration. Soil Biology & Biochemistry, 2019, 130: 220–226
[37]Liu H M, Zhou G Y, Bai S H, et al. Differential response of soil respiration to nitrogen and phospho-rus addition in a highly phosphorus-limited subtro-pical forest, China. Forest Ecology and Management, 2019, 448: 499–508
[38]Kruse J, Abraham M, Amelung W, et al. Innovative methods in soil phosphorus research: A review. Journal of Plant Nutrition and Soil Science, 2015, 178(1): 43–88
[39]Bortoluzzi E C, Perez C A S, Ardisson J D, et al. Occurrence of iron and aluminum sesquioxides and their implications for the P sorption in subtropical soils. Applied Clay Science, 2015, 104: 196–204
Effects of Nitrogen and Phosphorus Addition on Soil Carbon and Nitrogen Mineralization in Temperate Forest and Subtropical Forest
LI Rui, FENG Jiguang, ZHU Biao†
Institute of Ecology, College of Urban and Environmental Sciences, Key Laboratory for Earth Surface Processes (MOE), Peking University, Beijing 100871; † Corresponding author, E-mail: biaozhu@pku.edu.cn
Abstract The soils collected from a temperate forest in Wuying in Heilongjiang Province and a subtropical forest in Wuyi Mountain in Fujian Province were used to investigate the effects of nitrogen and phosphorus addition (NH4NO3 and NaH2PO4) on soil carbon and net nitrogen mineralization in the topsoil (0–20 cm) through a 120-day laboratory incubation experiment. The results showed that nitrogen addition reduced soil carbon mineralization in the subtropical forest by reducing soil microbial biomass and its carbon/nitrogen ratio, but had no significant effect on soil carbon mineralization in the temperate forest.Phosphorus addition had no significant effect on soil carbon mineralization in the two forests. Moreover, phosphorus addition significantly increased soil net nitrogen mineralization in the temperate forest, nitrogen addition significantly reduced soil net nitrogen mineralization in the temperate forest, but nitrogen and phosphorus addition had no significant effect on soil net nitrogen mineralization in the subtropical forest.In general, the responses of soil carbon and net nitrogen mineralization to nitrogen and phosphorus addition are different between the temperate forest and the subtropical forest, likely due to the differences in nutrient availability and soil properties between the two forests.
Key words nutrient addition; temperate forest; subtropical forest; soil microbes; soil carbon and net nitrogen mineralization
doi: 10.13209/j.0479-8023.2022.050
国家自然科学基金(31988102)和地理科学拔尖人才培养计划资助
收稿日期: 2021-06-28;
修回日期: 2021-08-28