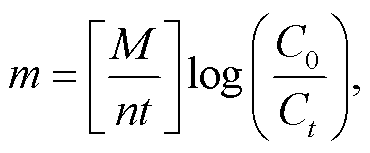 (1)
(1)
摘要 为了探索碳纳米材料氧化石墨烯(GO)和全氟辛烷磺酸类物质(PFOS)在淡水底栖贝类体内的联合毒性效应, 以河蚬为研究对象, 考察 1 mg/L GO 和 500 ng/L PFOS 单独及联合暴露 28 天后对河蚬体长、体重、滤食率、活性氧水平、抗氧化系统酶活性和丙二醛含量的影响, 并采用优化的综合生物标志物响应指数(EIBR)进行整体评估。结果表明, 暴露结束后, 河蚬的体长和体重没有明显的变化。与空白对照组和溶剂对照组相比, GO 和 PFOS 的单独暴露组及联合暴露组的滤食率均显著下降。在河蚬的鳃和内脏团中, GO 和 PFOS 的胁迫都会引起抗氧化系统酶活性响应的显著变化, 且两器官中变化趋势一致。EIBR 结果表明, 鳃和内脏团中联合暴露组的毒性比 PFOS 或 GO 单独暴露组的毒性更强。
关键词 PFOS; 氧化石墨烯; 联合作用; 生理响应; 河蚬
全氟辛烷磺酸类物质(perfluorooctane sulfona-te, PFOS)是近年来备受关注的持久性有机污染物(persistent organic pollutant, POPs)。这类物质难降解, 进入生物后易与蛋白结合, 主要分布在血液、肝脏和肾脏中, 具有生殖毒性、发育毒性、神经毒性、免疫毒性、肝毒性和内分泌干扰作用等多种毒性[1–2]。作为一种重要的全氟化表面活性剂, PFOS也是许多全氟及多氟烷基物质的重要前体, 目前在全世界范围内的各类环境介质、生物体和人体内均有检出。
氧化石墨烯(graphene oxide, GO)是一类石墨烯衍生物, 是含氧基团官能化的石墨烯基碳纳米材料。与其他碳纳米材料不同, GO 具有高亲水性及高表面活性[3–5], 在水中具有高分散性、高吸附性以及高化学活性。随着 GO 在环境、催化、能量存储、生物传感、材料和医学等领域的广泛使用[6–9], 不可避免地通过各种途径进入水环境中, 与水体中的有机污染物相互作用, 从而影响其环境行为和毒性效应[10]。因此, 研究 GO 和共存污染物的联合行为对准确评估其生态风险具有重要意义。
底栖贝类是重要的环境污染指示物种。淡水底栖贝类河蚬因广泛分布且数量众多、易于野外捕获与实验室养殖、生物背景学资料丰富、对污染物有较强的富集性以及较低的代谢能力等优势[11], 广泛用做指示生物来研究多种水体污染物的生物有效性[12]。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽S-转移酶(GST)和谷胱甘肽还原酶(GR)是抗氧化系统的代表酶, 可以反映生物体为减少污染物胁迫导致的危害(活性氧(ROS)水平和丙二醛(MDA)含量的变化)而做出的反应。
本研究以河蚬为代表性贝类, 探索 GO 与 PFOS单独暴露以及联合暴露对河蚬虹吸行为、ROS 水平、抗氧化系统酶活性和 MDA 含量的影响, 旨在探明联合胁迫对河蚬各器官脂质过氧化水平和组织损伤的影响。最后, 采用优化的综合生物标志物响应(EIBR)评估其毒性效应, 以期为 GO 与 PFOS 复合污染的生态效应评价提供科学依据。
全氟辛烷磺酸钾(C8F17KO3S, >98%)、磷酸缓冲盐溶液(PBS)和中性红均购自上海麦克林生化科技有限公司, 纯度为 AR 级。GO 购自南京先丰纳米材料科技有限公司, 片径为 0.5~5μm, 厚度为 0.8~ 1.2nm。总蛋白、ROS、SOD、CAT、GST、GR 和MDA 等试剂盒均购自南京建成生物工程研究所。实验用水为 Milli-Q 超纯水(美国 Millipore 公司)。采用透射电子显微镜(TEM, 日本电子株式会社)对 GO 进行表征, 确定其形态与尺寸。
河蚬采自广州增江, 尺寸在 17~24mm 之间。在暴露实验前, 将河蚬放在装有脱氯自来水的培养箱中曝气培养两周, 水温为(20±1)ºC, 光照条件为 16小时 : 8 小时 (昼:夜), 每隔 36 小时喂一次小球藻(Ch-lorella vulgaris, 购自中国科学院水生生物研究所)。
驯化完毕后, 在装有 1.5L 曝气脱氯水的聚乙烯量杯中进行实验。本研究中的暴露浓度设置遵循在可检出范围内尽可能接近环境浓度的原则[13], 采用的 GO 浓度为 1mg/L, PFOS 浓度为 500ng/L。其中, PFOS 使用甲醇助溶, 为避免溶剂效应, 甲醇浓度≤0.1mL/L。实验共分为 5 组: 空白对照组、溶剂对照组、1mg/L GO 单独暴露组、500ng/L PFOS 单独暴露组以及 1mg/LGO + 500ng/LPFOS 联合暴露组。实验前, 将暴露液超声震荡 30 分钟, 待污染物固液分配平衡后, 向每个量杯中放入 20 只新鲜河蚬, 水温和光照等条件与驯化时一致, 并定期换水和喂食。暴露期间, 每隔 7 天记录河蚬的体重和体长。28 天暴露结束后, 测定其滤食率、ROS 水平、抗氧化系统酶活性和 MDA 含量。
测定滤食率的方法参照文献[14]。暴露实验结束后, 从每个 PP 量杯中随机取出 5 只河蚬放入装有 100 mL 中性红溶液(1 mg/L)的烧杯中, 避光静置2 小时。实验前后分别取样, 使用紫外–可见分光光度计(DR6000, 美国哈希公司), 于 530nm 测定其吸光度。根据标准曲线, 将吸光度转化为中性红浓度, 并采用式(1)计算滤食率m(mL/(只∙h)):
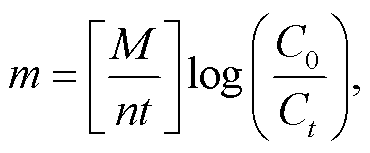 (1)
(1)
其中, M 为待测溶液的体积(mL), n 为河蚬的数量, t为时间(小时), C0 为中性红溶液的初始浓度(mg/L), Ct 为 t 时刻中性红溶液的浓度(mg/L)。
ROS 水平、抗氧化系统酶(SOD, CAT, GST 和GR)活性以及 MDA 含量的测定均按照南京建成工程研究所试剂盒说明书, 根据预实验得出的河蚬鳃与内脏团的最佳测定浓度及最佳取样量进行操作。ROS 采用化学荧光法, 使用多功能微孔板酶标仪(Envision 2104, 美国 PerkinElmer 公司)测定荧光强度; SOD, CAT, GR 和 GST 活性以及 MDA 含量分别采用羟胺法、钼酸铵法、紫外比色法、比色法和TBA 法, 其中 CAT 活性使用酶标仪(E1x8081U, 美国 BioTek 公司)测定, 其他酶活性和 MDA 含量使用紫外–可见分光光度计(DR6000, 美国哈希公司)测定。通过蛋白含量校准计算以上指标, ROS 水平表示为荧光度值/mg 蛋白, SOD, CAT 和 GST 活性表示为 U/mg 蛋白, GR 活性和 MDA 含量分别表示为U/g蛋白和nmol/mg蛋白。
优化的综合生物标志物响应(enhanced integra-ted biomarker response, EIBR)是一种通过计算在特定暴露条件下测量的所有生物标志物来评估潜在的生物效应的工具[15–16]。与同样广泛应用的综合生物标志物响应(integrated biomarker response, IBR)相比, EIBR 考虑了多个生物学水平上的生物标志物的差异[16–18]。本研究选取河蚬鳃和内脏团组织中ROS 水平、抗氧化系统酶(SOD, CAT, GST 和 GR)活性以及 MDA 含量为指标来计算 EIBR (由于滤食率实验未分器官, 在此不作为计算指标), 计算步骤如下。
首先, 对每种生物标志物指标进行标准化:
Y=(X−m)/s, (2)
其中, Y 是标准化处理后的值, X 为每种暴露条件下的每种生物标志物的平均值, m 和 s 为所有暴露条件下每种生物标志物的平均值和标准差。
然后, 在对应于抑制或激活的生物效应中, 每种生物标志物的生物效应 Z 被赋值为−Y 或 Y (如果此生物标志物被抑制, 则令 Z = −Y; 如果被激活, 则Z=Y)。对每种生物标志物进行评分:
S=Z+|Zmin|,(3)
其中, S ( S≥0)是某种生物标志物的得分, |Zmin|为 Z 最小值的绝对值。
最后, 根据各个生物标志物的得分和权重来计算 EIBR:
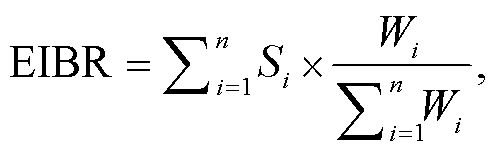 (4)
(4)
Wi 表示每个生物标志物的权重。本文计算的 EIBR基于河蚬鳃和内脏团两种组织, 所以使用整只河蚬测定的指标不参与计算。ROS 水平、抗氧化系统酶(SOD, CAT, GST 和 GR)活性和 MDA 含量均为酶或非酶分子的生物学水平, 因此权重值均为1[16]。
实验的数据分析采用 SPSS20.0 进行。结果均表示为平均值±标准偏差(means±SD), 不同组之间的差异采用单因素方差法进行比较, 显著性水平为p<0.05。
超声波处理 2 小时, 获得均匀稳定的 GO 分散液, 使用透射电子显微镜(TEM)表征 GO 的微观结构, 结果如图 1 所示。低倍 TEM 图(图 1(a))显示, 分散液颗粒横向尺寸在 0.1~0.6μm 之间。高倍 TEM图(图 1(b))表明, GO 呈现片状铺展的形貌, 且边缘锋利。GO 的尺寸会影响其生物毒性, 有文献报道, 小片层 GO (500nm 以下)主要通过网格蛋白介导的内吞作用或丝状伪足包裹其进入细胞, 大片层 GO (1~2 µm)则主要通过吞噬作用进入细胞[19–21]。

图1 GO的低倍(a)和高倍(b) TEM照片
Fig. 1 TEM images of GO in lower magnification (a) and higher magnification (b)
暴露期间河蚬的体长和体重情况如图 2 所示。图 2(a)显示, 河蚬的体长为 1.75~2.40 cm, 暴露期间不同组之间没有明显区别, 且不同时间段各组之间也没有明显差别, 说明污染物的暴露对成年河蚬的体长没有显著影响。从图 2(b)可以看到, 暴露期间河蚬的体重为 1.60~2.41g, 不同组之间没有明显差异。随着暴露时间增加, 各组都有轻微下降趋势, 但没有显著差异。这可能是由于实验室饲养河蚬时, 小球藻的投喂量小于其在自然环境下的摄食量, 从而出现体重轻微下降的现象。本研究中污染物的暴露没有使河蚬体重出现明显变化。同样地, Yang等[22]在麦穗鱼 Pseudorasbora parva 与蟾蜍 Bufo gar-garizans 的 30 天 PFOS 慢性暴露实验中也未发现体重和体长的显著性变化。
急性毒性(尤其是致死性)实验是毒性测定中最常用且可以反映毒性物质对生物体最直接影响的方法。然而, 即使在严重污染的环境中, 双壳类动物的适应性也相对较高。大多数污染条件下, 可以通过观察虹吸行为进行毒性研究[23]。双壳类动物的虹吸管在营养生理、防御和生殖机制中起着重要作用[24–25]。虹吸行为的变化可以显示出河蚬对生理水平化学暴露的最直接反应, 是反映健康或压力的信号[26]。本实验采用滤食率来评估河蚬的虹吸行为。图 3 为河蚬在 28 天慢性暴露后滤食率的实验结果, 可以看到, 与空白对照组相比, 溶剂对照组的滤食率显著下降, 说明加入甲醇会对河蚬的虹吸行为产生一定的影响。与空白对照组和溶剂空白对照组相比, 在 PFOS 和 GO 单一暴露与共暴露条件下, 河蚬滤食率水平均显著下降, 表明 PFOS 与 GO的长期单独暴露与联合暴露都会抑制河蚬的虹吸行为。
已有研究证明, 有机化合物和纳米材料等污染物都会对河蚬的虹吸行为产生负面影响。比如, 吡虫啉(IMI)[27]和氟西汀(FLX)[25]等有机污染物可以显著地抑制虹吸作用, 纳米铝(nano-Al13 和 Alm)[23]等纳米颗粒也会使滤食率显著降低。由于河蚬通过虹吸作用从水中过滤食物来完成物质交换, 暴露于污染物中时, 河蚬通过减少滤食频率降低代谢率、心跳和氧气消耗来阻止有毒物质的进入[16]。本研究中虹吸行为的下降趋势表明, PFOS 和 GO触发了河蚬对污染物的防御系统, 试图降低污染物可能对自身健康造成的不良影响。
将河蚬分别放置于 5 个不同的暴露组中, 进行为期 28 天的长期暴露后, 对其 ROS 水平进行检测, 结果如图 4 所示。可以看出, 空白对照组与溶剂对照组的 ROS 水平没有显著区别。与空白对照组和溶剂对照组相比, GO 和 PFOS 单独暴露与联合暴露组的 ROS 水平都有上升趋势。其中, 内脏团中 3 个实验组的 ROS 水平都显著上升(p<0.05), 鳃中只有联合暴露组显著上升(p<0.05)。
研究表明, PFOS 可增加体内外 ROS 的产生[16], 进而可能导致细胞凋亡[28]或 DNA 损伤[29], 本研究中 PFOS 单独暴露组 ROS 水平增加的结果与之一致。Guo 等[30]在斑马鱼 Danio rerio 的 21 天 PFOS暴露实验中发现, 肝脏中 ROS 的产生具有显著的剂量依赖性, PFOS 可加速 ROS 的形成, 并诱导雄性肝脏产生氧化应激。Liu 等[31]在淡水罗非鱼 Oreochromis niloticus 的 24 小时 PFOS 暴露实验中同样发现 ROS水平显著上升。
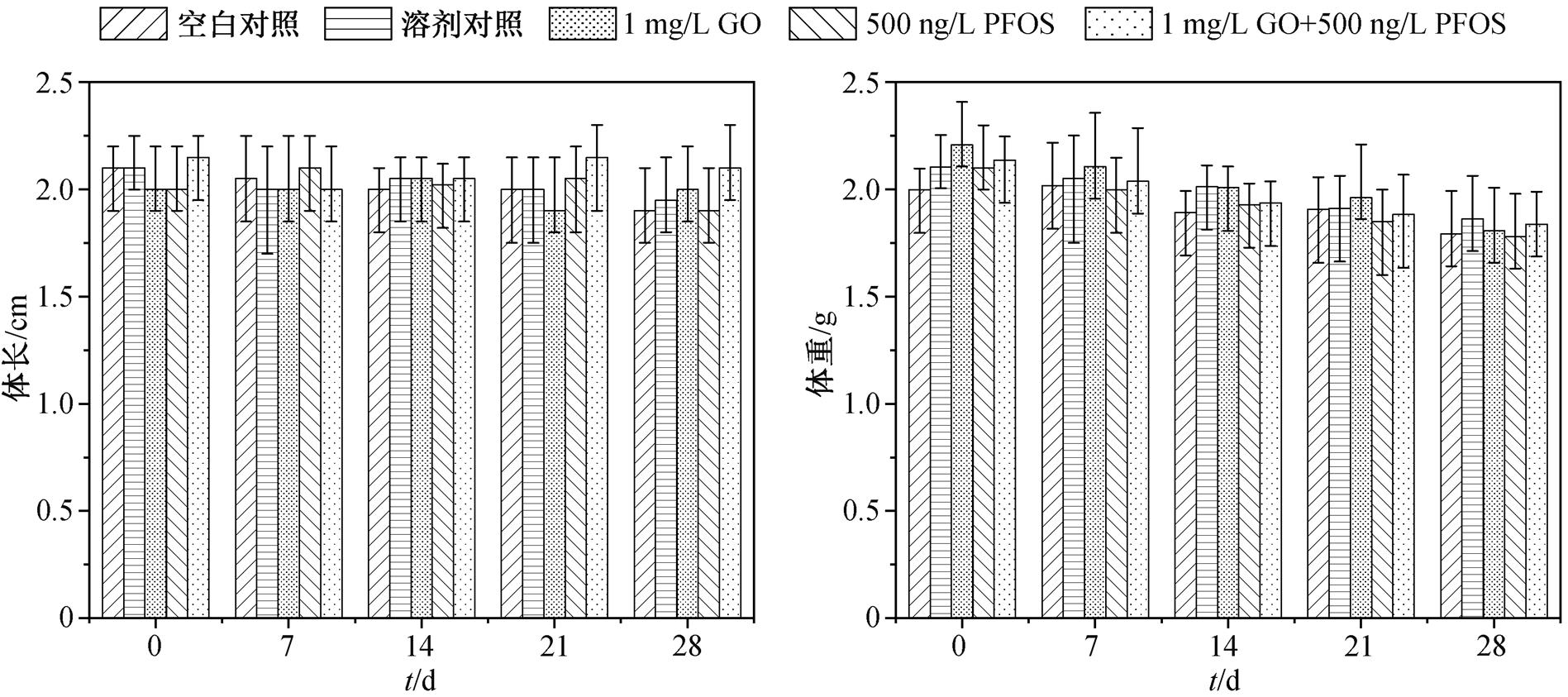
结果表示为平均值±标准偏差(n = 4), 下同; 各组数据之间均无显著性差异(p<0.05)
图2 河蚬在暴露期间的体长(a)和体重(b)
Fig. 2 Body length (a) and body weight (b) of C. fluminea during exposure
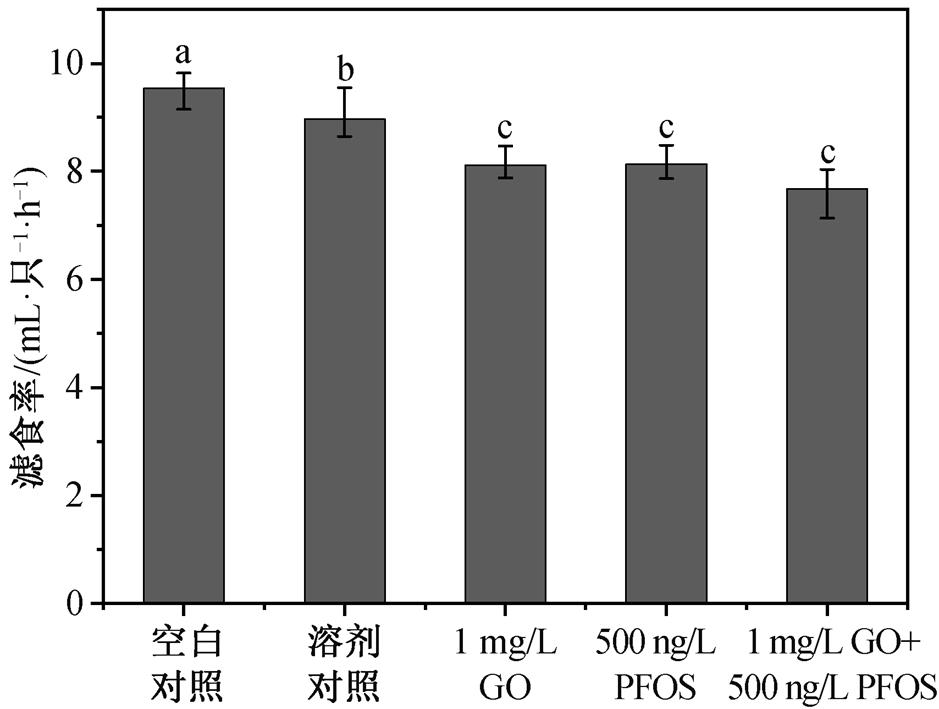
柱子上方的不同字母表示有显著性差异(p<0.05), 下同
图3 暴露于GO和PFOS中28天后河蚬的滤食率
Fig. 3 Filtration rate of C. fluminea after 28 days of exposure to GO and PFOS
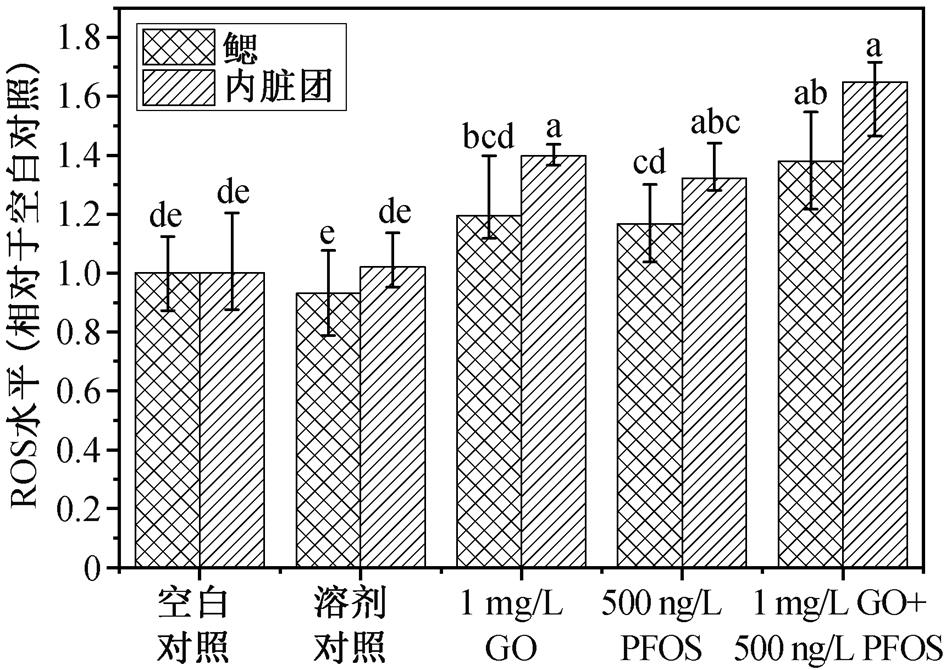
图4 暴露于GO和PFOS28天后河蚬体内不同器官(鳃和内脏团)的ROS水平
Fig. 4 Effect of GO and PFOS on reactive oxygen species levels (ROS) in gills and visceral masses of C. flu-minea after 28 days of exposure
Lammel 等[32]采用鱼细胞系 PLHC-1 体外模型, 发现经 72 小时 GO 暴露后细胞内 ROS 水平显著升高。Katsumiti 等[33]将贻贝 Mytilus galloprovincialis血细胞暴露于 GO 中 24 小时, 发现 ROS 水平增高并产生由 ROS 介导的膜损伤。Li 等[34]通过小鼠 RAW 264.7 巨噬细胞的 48 小时石墨烯暴露实验表明, 石墨烯可通过增加细胞内 ROS 水平和耗尽线粒体膜电位来诱导细胞毒性, 然后通过激活线粒体通路触发细胞凋亡。本研究中 GO 单独暴露组鳃和内脏团中 ROS 含量明显增加, 可能是由于 GO 与细胞膜的直接物理相互作用或暴露后的间接细胞反应[35]。GO 可以与膜脂质相互作用, 并引起直接的物理毒性[36]。GO 也被证明可以诱导炎症反应[37–38]和线粒体毒性[39]。尖锐的 GO 边缘与细胞膜和组件的物理接触可能导致损伤引起的炎症[40]和随后 ROS 的产生[41]。此外, GO 相关细胞内 ROS 的增加可能使抗氧化机制不堪重负, 并导致线粒体、DNA、脂质和蛋白质受损[32], 从而对整个细胞产生不良作用。
图 5 是 28 天的长期暴露后, 河蚬鳃和内脏团中SOD 和 CAT 活性结果。可以看出, 与空白对照组相比, 溶剂对照组鳃中的 SOD 活性、鳃与内脏团中的 CAT 活性无显著变化, 而溶剂对照组内脏团中的SOD 活性显著升高。暴露于 GO 和 PFOS 后, 河蚬组织中的 SOD 活性比空白对照组和溶剂对照组都显著提高(p<0.05)。CAT 活性的结果与SOD 活性类似, 3 个实验组中鳃和内脏团中的 CAT活性都显著上升(p<0.05), 说明 PFOS 和 GO 的长期暴露都会对SOD 和 CAT 活性产生诱导。类似地, Li 等[42]将斑马鱼 D. rerio 暴露在 PFOS 和单壁碳纳米管(SWCNT)中 96 小时, 发现联合暴露组中的 SOD 和 CAT 活性自 24 小时起就出现显著的提升。Zhang 等[43]在河蚬的 15 天联苯菊酯(BF)暴露实验中, 也同样观察到消化腺中 SOD 和 CAT 活性的增加。除此之外, 本实验还观察到, 与 PFOS 和 GO 的单独暴露组相比, PFOS 与 GO 联合暴露组中鳃和内脏团的 SOD 活性及内脏团中 CAT 活性显著地升高(p< 0.05), 说明PFOS 与 GO 联合暴露的毒性效应比其单独暴露更强。
SOD 和 CAT 是抗氧化系统抵抗外源性污染的第一道防线。抗氧化酶可以诱导生物体应对不安全暴露导致的应激[44], SOD 和 CAT 是主要的抗氧化酶, 共同起着将过量 ROS 转化为无害代谢物的作用: SOD 通过催化超氧自由基, 生成过氧化氢, 然后过氧化氢经由 CAT 降解为水和分子氧[16]。本研究中, PFOS 和 GO 单独暴露组与联合暴露组中 SOD的活性和 CAT 含量显著增加, 以便清除体内产生的过量 ROS。
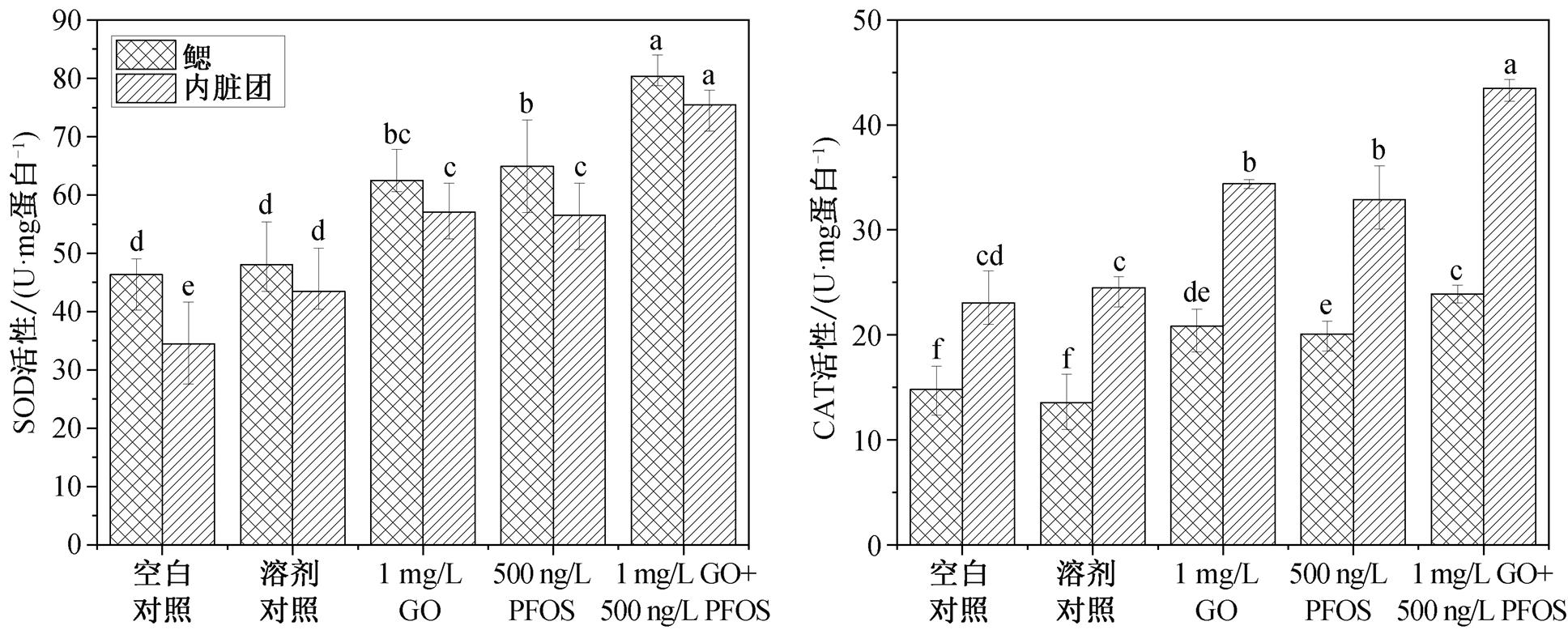
图5 暴露于GO和PFOS后河蚬体内不同器官(鳃和内脏团)的SOD (a)和CAT (b)活性
Fig. 5 Effect of GO and PFOS on SOD (a) and CAT (b) activities in gills and visceral masses of C. fluminea after 28 days of exposure
图 6 是 28 天暴露后河蚬鳃和内脏团中 GR 和GST 的活性结果。可以看出, 相对于空白对照组, 溶剂对照组中鳃和内脏团的 GR 和 GST 活性均无显著变化。与空白对照组和溶剂对照组相比, 暴露于GO 和 PFOS 后河蚬鳃和内脏团中的 GR 活性都显著降低(p<0.05), GST 活性也出现显著下降(p<0.05), 说明 PFOS 和 GO 的长期暴露都会对 GR 和 GST 的活性产生抑制。有研究结果显示, 暴露于卡马西平(CBZ) 30 天[24]以及暴露于 IMI 30 天后[27]的河蚬鳃和消化腺中的 GR 活性都显著降低。Liu 等[31]在淡水罗非鱼 O. niloticus 的 24 小时 PFOS 暴露实验中也观察到 GST 活性的降低。
GR 是一种重要的细胞抗氧化剂, 与 SOD 相似, GR 的合成受到暴露于高浓度 ROS 引起的氧化应激的调节。GST 是 II 期酶家族的一员, 参与过氧化物的清除和解毒[23]。GR 催化谷胱甘肽二硫化物(GSSG)还原为谷胱甘肽(GSH)[26], GST 催化 GSH 与亲电基团结合来代谢异型生物质起到解毒的作用[25]。谷胱甘肽过氧化物酶(GPx)可以像 CAT 一样参与 H2O2 的还原, 同时也参与催化 GSH 转化为GSSG[45], 而较低活性的 GPx 导致 GSSG 水平较低, 从而相继引起 GR 和 GST 的活性降低。
作为不饱和脂肪酸过氧化物的分解产物之一, MDA 具有严重破坏细胞膜的能力。通过测量 MDA含量可以间接地评估脂质过氧化(LPO)作用[23]。图7 是暴露 28 天后河蚬鳃和内脏团中 MDA 含量的结果, 可以看出, 相比于空白对照组, 溶剂对照组中鳃和内脏团的 MDA 含量均无显著性变化。与空白对照组和溶剂对照组相比, 暴露于 GO 和 PFOS 后河蚬鳃和内脏团中的 MDA 含量显著提高(p<0.05), 说明PFOS 和 GO 的长期暴露都会对 MDA 含量产生诱导。Khan 等[46]将牡蛎 Crassostrea virginica 暴露于 GO 中 14 天后发现, 低浓度和高浓度组中, 鳃和消化腺中的 MDA 含量均有所上升。Wu 等[23]在暴露于纳米 Al13 和 Alm 中 10 天的河蚬组织中也观察到MDA 含量的显著提高。本研究中, 与 PFOS 和 GO的单独暴露组相比, 联合暴露组中鳃的 MDA 含量显著升高(p<0.05), 表明 ROS 水平超过抗氧化系统酶的消除能力, 并导致鳃和内脏团中 MDA 含量显著上调。MDA 的产生表明发生了细胞膜损伤[46], 污染物进入鳃细胞和内脏团细胞, 并造成细胞损伤。
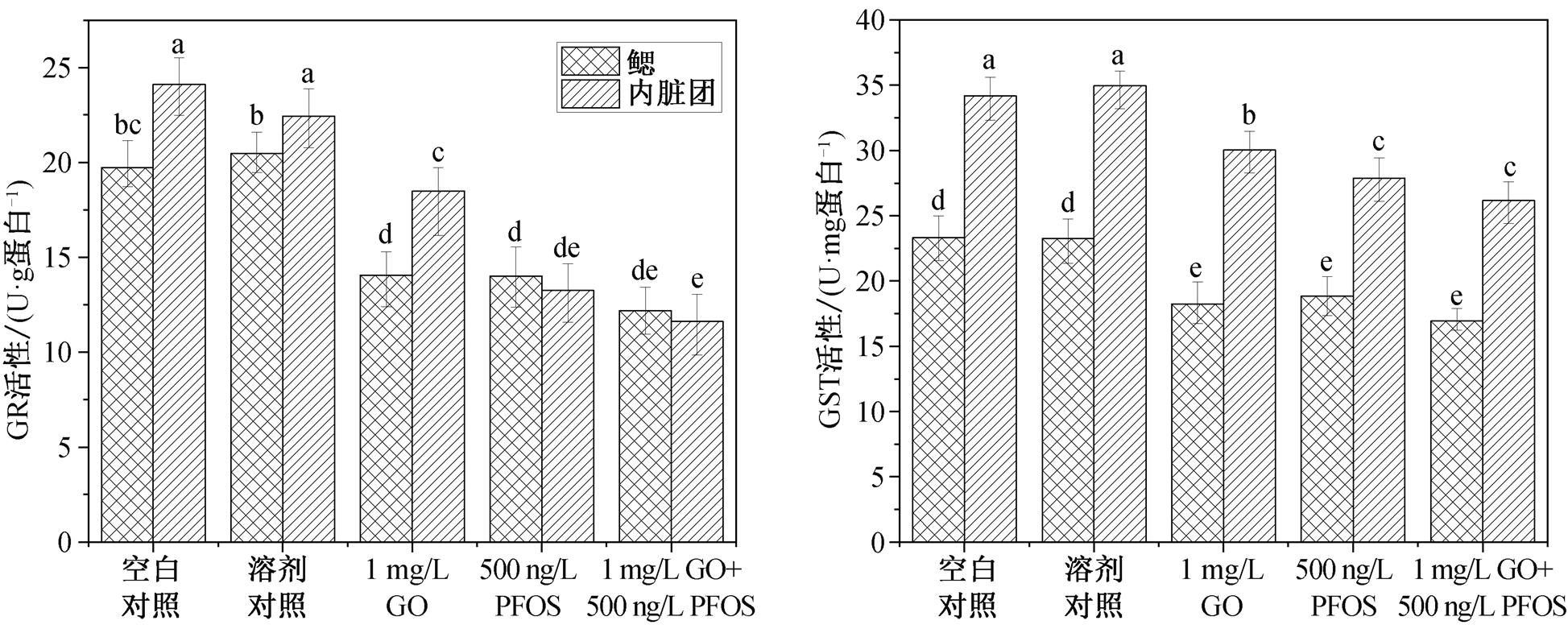
图6 暴露于GO和PFOS后河蚬体内不同器官(鳃和内脏团)的GR (a)和GST (b)活性
Fig. 6 Effect of GO and PFOS on GR (a) and GST (b) activities in gills and visceral masses of C. fluminea after 28 days of exposure
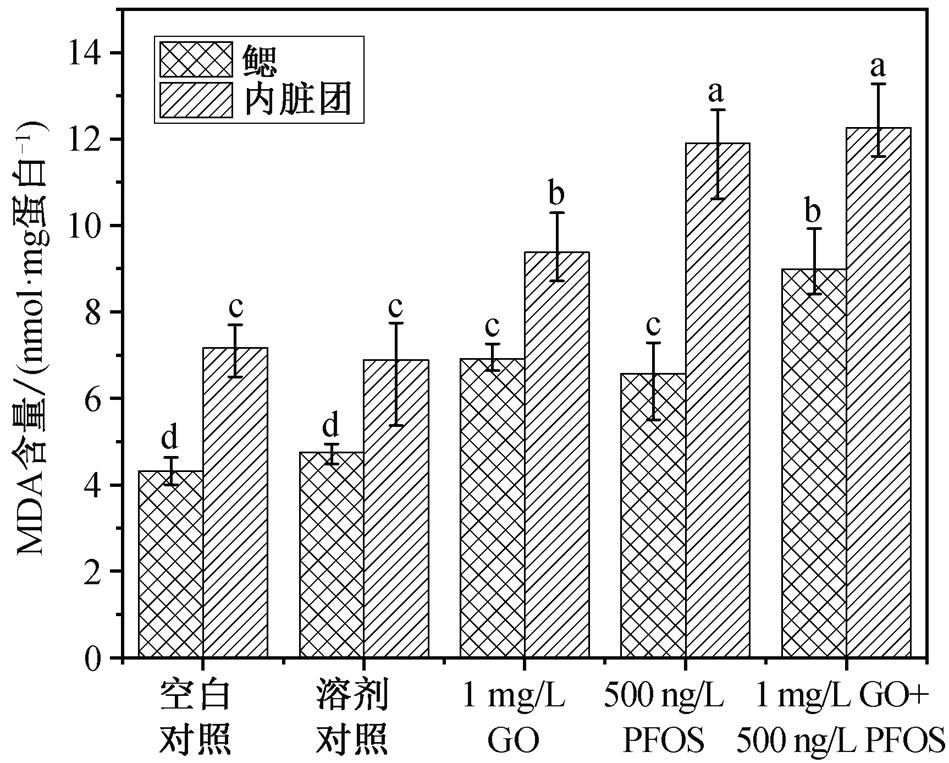
图7 暴露于 GO 和 PFOS 中 28 天后河蚬体内不同器官(鳃和内脏团)的MDA含量
Fig. 7 Effect of GO and PFOS on MDA content in gills and visceral masses of C. fluminea after 28 days of exposure
图 8 为实验体系中河蚬在不同暴露组的 EIBR值。一般来说, EIBR值越高, 表明污染物对生物体不利影响就越大[42]。如图所示, 鳃与内脏团在各暴露组的 EIBR 值排序一致, 均为 500ng/L PFOS + 1mg/L GO联合组>1mg/L GO组>500ng/L PFOS组>溶剂对照组>空白对照组。由此可知, 联合暴露组的毒性比单一暴露组更强。原因可能有以下两点: 1)虽然 PFOS 与 GO 的单独暴露都会产生过量的ROS, 并诱导氧化应激, 然而 GO 纳米片的锋利边缘可能会直接将细胞膜割破, 在联合暴露时增加PFOS 进入细胞内部的机会, 进而产生更强的毒性; 2)联合暴露条件下, GO 可以作为载体吸附 PFOS, 河蚬通过摄食吸收更多的污染物, 从而产生更大的毒性。
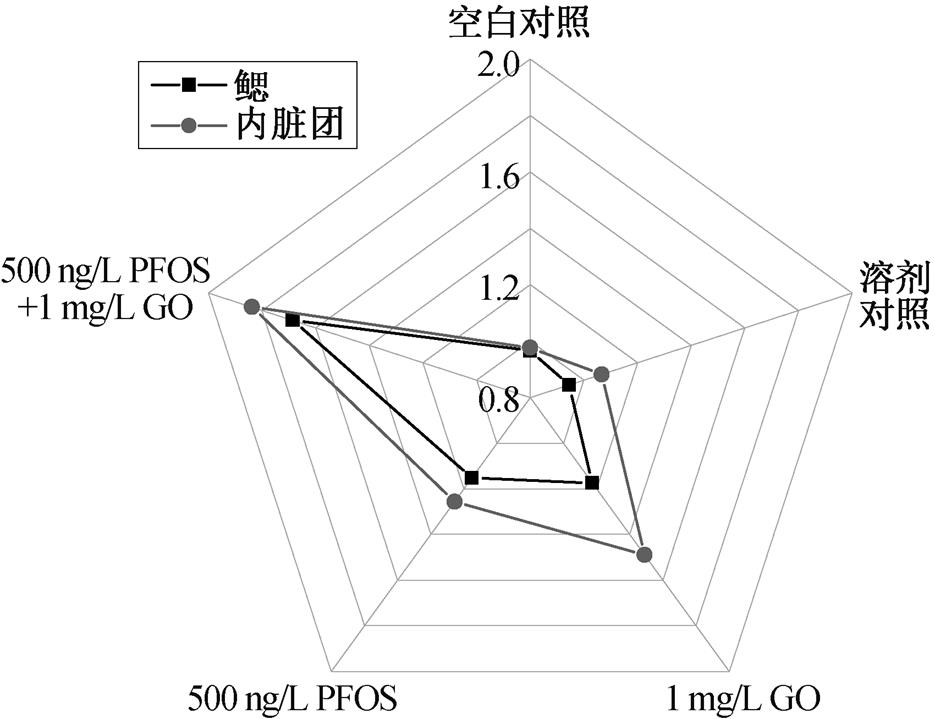
图8 暴露于 GO 和 PFOS 后河蚬鳃和内脏团中的综合生物标志物响应(EIBR)雷达图
Fig. 8 Radar map of enhanced integrated biomarker response (EIBR) in the gills and visceral masses of C.fluminea exposed to GO and PFOS
28 天暴露结束后, 河蚬的体长与体重没有明显的变化。与空白对照组和溶剂对照组相比, PFOS 和GO 单一暴露与联合暴露条件下河蚬的滤食率均显著下降。与单独暴露组相比, GO 和 PFOS 的联合暴露没有显著地影响河蚬的滤食率。
与空白对照组和溶剂对照组相比, 在 PFOS 和GO 的各个暴露组中, 河蚬鳃和内脏团的指标变化趋势均一致, 其中 ROS 水平、SOD 活性、CAT 活性和 MDA 含量均显著上升, GR 活性和 GST 活性均显著下降。
与 PFOS 和 GO 的单一暴露组相比, 联合暴露组的鳃和内脏团中 SOD 活性、内脏团中 CAT 活性以及鳃中 MDA 活性均呈现显著上升的趋势。EIBR计算结果显示, 联合暴露组毒性最强。
参考文献
[1]Lau C, Anitole K, Hodes C, et al. Perfluoroalkyl acids: a review of monitoring and toxicological fin-dings. Toxicological Sciences, 2007, 99(2): 366–394
[2]Jensen A A, Leffers H. Emerging endocrine dis-rupters: perfluoroalkylated substances. International Journal of Andrology, 2008, 31(2): 161–169
[3]Dreyer D R, Park S, Bielawski C W, et al. The che-mistry of graphene oxide. Chemical Society Reviews, 2010, 39(1): 228–240
[4]Geim A K, Novoselov K S. The rise of graphene. Nature Materials, 2007, 6(3): 183–191
[5]Zhu Y, Murali S, Cai W, et al. Graphene and graphene oxide: synthesis, properties, and applications. Ad-vanced Materials, 2010, 22(35): 3906–3924
[6]Balapanuru J, Yang J X, Xiao S, et al. A graphene oxide-organic dye ionic complex with DNA-sensing and optical-limiting properties. Angewandte Chemie-International Edition, 2010, 49(37): 6549–6553
[7]Pavagadhi S, Tang A L L, Sathishkumar M, et al. Removal of microcystin-LR and microcystin-RR by graphene oxide: adsorption and kinetic experiments. Water Research, 2013, 47(13): 4621–4629
[8]Robinson J T, Tabakman S M, Liang Y, et al. Ultras-mall reduced graphene oxide with high near-infrared absorbance for photothermal therapy. Journal of the American Chemical Society, 2011, 133(17): 6825–6831
[9]Shen Y, Fang Q, Chen B. Environmental applications of three-dimensional graphene-based macrostructures: adsorption, transformation, and detection. Environ-mental Science & Technology, 2015, 49(1): 67–84
[10]Zhao J, Wang Z, White J C, et al. Graphene in the aquatic environment: adsorption, dispersion, toxicity and transformation. Environ Sci Technol, 2014, 48 (17): 9995–10009
[11]郭晓宇, 李茹枫, 冯成洪. 河蚬在我国沉积物毒性评价与鉴定中的应用研究. 生态毒理学报, 2016, 11(2): 89–100
[12]Guo X, Feng C. Biological toxicity response of Asian clam (Corbicula fluminea) to pollutants in surface water and sediment. Sci Total Environ, 2018, 631/ 632: 56–70
[13]Qiang L, Chen M, Zhu L, et al. Facilitated bioaccu-mulation of perfluorooctanesulfonate in common carp (Cyprinus carpio) by graphene oxide and remission mechanism of fulvic acid. Environ Sci Technol, 2016, 50(21): 11627–11636
[14]Coughlan J. The estimation of filtering rate from clearance of suspensions. Marine Biology, 1969, 2(4): 356–358
[15]Beliaeff B, Burgeot T. Integrated biomarker response: a useful tool for ecological risk assessment. Environ-mental Toxicology and Chemistry, 2002, 21(6): 1316–1322
[16]Liu Y, Junaid M, Xu P, et al. Suspended sediment exacerbates perfluorooctane sulfonate mediated toxi-city through reactive oxygen species generation in freshwater clam Corbicula fluminea. Environmental Pollution, 2020, 267: 115671
[17]Liu J, Lu G, Zhang Z, et al. Biological effects and bioaccumulation of pharmaceutically active compoun-ds in crucian carp caged near the outfall of a sewage treatment plant. Environmental Science-Processes & Impacts, 2015, 17(1): 54–61
[18]Liu C, Chang V W C, Gin K Y H. Environmental toxicity of PFCs: an enhanced integrated biomarker assessment and structure-activity analysis. Environ-mental Toxicology and Chemistry, 2013, 32(10): 2226–2233
[19]Yue H, Wei W, Yue Z, et al. The role of the lateral dimension of graphene oxide in the regulation of cellular responses. Biomaterials, 2012, 33(16): 4013–4021
[20]Mu Q, Su G, Li L, et al. Size-dependent cell uptake of protein-coated graphene oxide nanosheets. ACS App-lied Materials & Interfaces, 2012, 4(4): 2259–2266
[21]段伟艳, 杜永祥, 孟范平, 等. 氧化石墨烯对双 壳类动物文蛤的亚致死毒性研究. 中国环境科学, 2017, 37(7): 2755–2764
[22]Yang S, Xu F, Wu F, et al. Development of PFOS and PFOA criteria for the protection of freshwater aquatic life in China. Science of the Total Environment, 2014, 470: 677–683
[23]Wu Y, Gu E, Li H, et al. Oxidative stress and histological changes in Corbicula fluminea exposed to nano-Al13 and monomeric Al coagulants. Environ-mental Science: Nano, 2019, 6(9): 2736–2748
[24]Chen H, Zha J, Liang X, et al. Effects of the human antiepileptic drug carbamazepine on the behavior, biomarkers, and heat shock proteins in the Asian clam Corbicula fluminea. Aquat Toxicol, 2014, 155: 1–8
[25]Chen H, Zha J, Yuan L, et al. Effects of fluoxetine on behavior, antioxidant enzyme systems, and multixeno-biotic resistance in the Asian clam Corbicula flumi-nea. Chemosphere, 2015, 119: 856–862
[26]Yan S, Wu H, Qin J, et al. Halogen-free organopho-sphorus flame retardants caused oxidative stress and multixenobiotic resistance in Asian freshwater clams (Corbicula fluminea). Environmental Pollution, 2017, 225: 559–568
[27]Shan Y, Yan S, Hong X, et al. Effect of imidacloprid on the behavior, antioxidant system, multixenobiotic resistance, and histopathology of Asian freshwater clams (Corbicula fluminea). Aquatic Toxicology, 2020, 218: 105333
[28]Lee H-G, Lee Y J, Yang J-H. Perfluorooctane sulfo-nate induces apoptosis of cerebellar granule cells via a ROS-dependent protein kinase C signaling pathway. Neurotoxicology, 2012, 33(3): 314–320
[29]Xu D, Li C, Wen Y, et al. Antioxidant defense system responses and DNA damage of earthworms exposed to perfluorooctane sulfonate (PFOS). Environmental Pollution, 2013, 174: 121–127
[30]Guo J, Wu P, Cao J, et al. The PFOS disturbed immunomodulatory functions via nuclear factor-kappa B signaling in liver of zebrafish (Danio rerio). Fish & Shellfish Immunology, 2019, 91: 87–98
[31]Liu C, Yu K, Shi X, et al. Induction of oxidative stress and apoptosis by PFOS and PFOA in primary cultured hepatocytes of freshwater tilapia (Oreochro-mis niloticus). Aquatic Toxicology, 2007, 82(2): 135–143
[32]Lammel T, Navas J M. Graphene nanoplatelets spon-taneously translocate into the cytosol and physically interact with cellular organelles in the fish cell line PLHC-1. Aquatic Toxicology, 2014, 150: 55–65
[33]Katsumiti A, Tomovska R, Cajaraville M P. Intracel-lular localization and toxicity of graphene oxide and reduced graphene oxide nanoplatelets to mussel he-mocytes in vitro. Aquatic Toxicology, 2017, 188: 138–147
[34]Li Y, Liu Y, Fu Y, et al. The triggering of apoptosis in macrophages by pristine graphene through the MAPK and TGF-beta signaling pathways. Biomaterials, 2012, 33(2): 402–411
[35]Jastrzebska A M, Kurtycz P, Olszyna A R. Recent advances in graphene family materials toxicity inves-tigations. Journal of Nanoparticle Research, 2012, 14(12): 1320
[36]Hu W, Peng C, Lv M, et al. Protein corona-mediated mitigation of cytotoxicity of graphene oxide. Acs Nano, 2011, 5(5): 3693–3700
[37]Wang G, Qian F, Saltikov C W, et al. Microbial reduction of graphene oxide by Shewanella. Nano Research, 2011, 4(6): 563–570
[38]Chen L, Hu P, Zhang L, et al. Toxicity of graphene oxide and multi-walled carbon nanotubes against human cells and zebrafish. Science China - Chemistry, 2012, 55(10): 2209–2216
[39]Zhang L, Xia J, Zhao Q, et al. Functional graphene oxide as a nanocarrier for controlled loading and targeted delivery of mixed anticancer drugs. Small, 2010, 6(4): 537–544
[40]Khan B, Adeleye A S, Burgess R M, et al. A 72-h exposure study with eastern oysters (Crassostrea vir-ginica) and the nanomaterial graphene oxide. Envi-ronmental Toxicology and Chemistry, 2019, 38(4): 820–830
[41]Chen M, Yin J, Liang Y, et al. Oxidative stress and immunotoxicity induced by graphene oxide in zeb-rafish. Aquatic Toxicology, 2016, 174: 54–60
[42]Li Y, Men B, He Y, et al. Effect of single-wall carbon nanotubes on bioconcentration and toxicity of per-fluorooctane sulfonate in zebrafish (Danio rerio). Sci Total Environ, 2017, 607/608: 509–518
[43]Zhang H, Hong X, Yan S, et al. Environmentally relevant concentrations of bifenthrin induce changes in behaviour, biomarkers, histological characteristics, and the transcriptome in Corbicula fluminea. Science of the Total Environment, 2020, 728: 138821
[44]Cossu C, Doyotte A, Jacquin M C, et al. Glutathione reductase, selenium-dependent glutathione peroxida-se, glutathione levels, and lipid peroxidation in fresh-water bivalves, Unio tumidus, as biomarkers of aqua-tic contamination in field studies. Ecotoxicology and Environmental Safety, 1997, 38(2): 122–131
[45]Chen H, Zha J, Liang X, et al. Sequencing and de novo assembly of the Asian clam (Corbicula flumi-nea) transcriptome using the Illumina GAIIx method. PlOS ONE, 2013, 8(11): e79516
[46]Khan B, Adeleye A S, Burgess R M, et al. Effects of graphene oxide nanomaterial exposures on the marine bivalve, Crassostrea virginica. Aquatic Toxicology, 2019, 216: 105297
Physiological and Biochemical Responses of Corbicula fluminea under the Stress of Graphene Oxide Combined with Perfluorooctane Sulfonate (PFOS)
Abstract In order to explore the combined toxicity of carbon nanomaterial graphene oxide (GO) and perfluo-rooctane sulfonate (PFOS) in freshwater benthic shellfish, Corbicula fluminea was used as the target organism to study the effects of single and co-exposures of 1 mg/L GO or/and 500 ng/L PFOS for 28 days on body length, body weight, filtration rate, level of reactive oxygen species (ROS), antioxidant enzyme system and malondialdehyde (MDA) content. The toxicity was evaluated by enhanced integrated biomarker response (EIBR). The results showed that the body length and body weight of C. fluminea did not change significantly after exposure. Compared with the blank control and solvent control groups, the filtration rates in the single and co-exposure groups significantly decreased. Both GO and PFOS stresses significantly changed the enzyme responses in gills and visceral masses of C.fluminea with consistent variation trends in both organs. The EIBR results showed that the toxicity in gills and visceral masses of the co-exposure group was stronger than that of the PFOS or GO single exposure groups.
Key words perfluorooctane sulfonate (PFOS); graphene oxide; co-exposure; biochemical responses; Corbicula fluminea
doi: 10.13209/j.0479-8023.2022.028
国家自然科学基金(51939009, 51879003, 21707003)资助
收稿日期: 2021-05-21;
修回日期: 2021-06-15