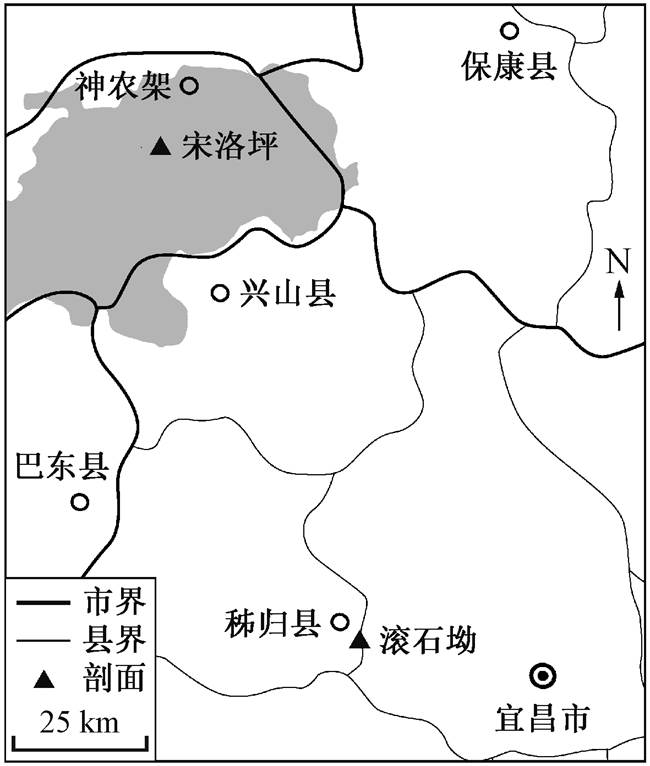
图1 研究剖面地理位置
Fig. 1 Location map of research section
摘要 利用光学显微镜和扫描电子显微镜, 对湖北神农架地区宋洛坪剖面和秭归地区滚石坳剖面寒武系第二统水井沱组的宏体锥管状化石开展详细的研究。识别出楔叶虫属 Sphenothallus 的一个新种, 以其“V”形加厚带表面的纵向纹饰为特征; 首次在水井沱组发现软舌螺纲 Hyolithida 偶带线螺属 Ambrolinevitus。研究结果丰富了水井沱组的生物多样性, 为探讨早期生命演化提供了新的化石材料。
关键词 寒武纪; 水井沱组; 刺胞动物; 楔叶虫属; 软舌螺纲
埃迪卡拉纪末期到寒武纪早期是地球生命演化的重要转折时期, 是后生动物起源及早期演化的重要阶段[1]。寒武纪早期, 后生生物迅速出现且辐射状演化, 形成以后生动物为主导的海洋生态系统[2‒3], 生物多样性增加, 体型增大, 躯体骨骼化, 形态逐渐复杂。一系列重要化石群的发现, 让这一过程逐渐明晰, 但关于寒武纪生命大爆发的研究, 目前大部分都集中在浅水环境下的特异埋藏化石群落[1,4‒6], 深水环境下的化石面貌尚存在疑点。
寒武系第二统沉积时, 以节肢动物为主的后生生物群落主控浅水生态系统, 取代了小壳动物的主导地位[5,7]。在筇竹寺期, 动物向深水迁移, 生态空间扩展[8], 深水环境的生物群落面貌和扩展进程值得探究。华南早寒武世水井沱组为一套代表深水环境的页岩, 露头连续, 年代地层分辨率高, 化石产出多样[9]。系统地研究水井沱组内生物群, 对丰富化石记录及厘清后生生物演化谱系具有重要意义。
既往研究结果显示, 湖北水井沱组页岩中产出丰富的三叶虫、海绵古针和古杯等化石[10‒13], 近年来新发现锥管状刺胞动物化石松林楔叶虫Spheno-thallus songlinensis (松林楔叶虫)[14‒15]。在三峡地区前寒武纪末至寒武纪地层中发现的一些形态相对简单的磷质或几丁质管状化石(如 Protoconites (原锥虫)、Cambrorhytium (杯管虫)、Sphenothallus (楔叶虫)和 Byronia (拜如尼亚虫)等[14‒21][15,22])是寒武纪古海洋生物群的重要组成部分[14‒15,22‒23]。这类化石的形态相对简单, 其软组织结构往往在成岩和保存过程中被破坏, 因此古生物学家对其软组织相关信息知之甚少, 最早把它们解释成植物或管状“蠕虫”[24‒25]。后来, 根据其在形态、微观结构和无性出芽等方面与刺胞动物的相似性[20‒21], 这些管状化石被认为是软体或骨骼化的刺胞动物[16,18‒19,26], 但具体的亲缘关系仍不明晰[14,27]。
本研究对采集自湖北地区水井沱组的宏体锥管化石的形态、结构和成分特征进行系统的观察, 鉴定出 Sphenothallus 的一个新种及软舌螺纲 Ambro-linevitus maximus (巨大偶线带螺)相似种, 并根据其特征, 对亲缘关系进行讨论, 以期为寒武纪早期宏体锥管化石研究提供新材料。
本文研究的化石标本采集自湖北神农架地区宋洛坪剖面和宜昌秭归地区滚石坳剖面(图 1)。两个剖面隶属扬子板块三峡东部地区, 剖面内寒武系地层发育良好, 出露完整[10,28](图 2)。滚石坳剖面自下而上依次为埃迪卡拉系的灯影组以及寒武系的岩家河组、水井沱组和石牌组。寒武系底界在不同区域穿层分布。在秭归地区, 该底界位于下寒武统的岩家河组中, 与上覆水井沱组岩层平行不整合接触[12]。神农架地区则缺失岩家河组地层, 水井沱组下部与灯影组顶部平行不整合接触[9]。按照岩性, 可将水井沱组分为三段: 下段主要为黑色碳质页岩, 发育锅底状结核; 中段主要是灰黑色碳质泥页岩与泥晶灰岩互层, 有大量化石产出, 如三叶虫和海绵骨针等; 上段主要是浅灰色生物碎屑灰岩, 生物碎屑主要由腕足类和海绵骨针构成[11]。水井沱组顶部与上覆石牌组整合接触[12](图 3)。

图1 研究剖面地理位置
Fig. 1 Location map of research section
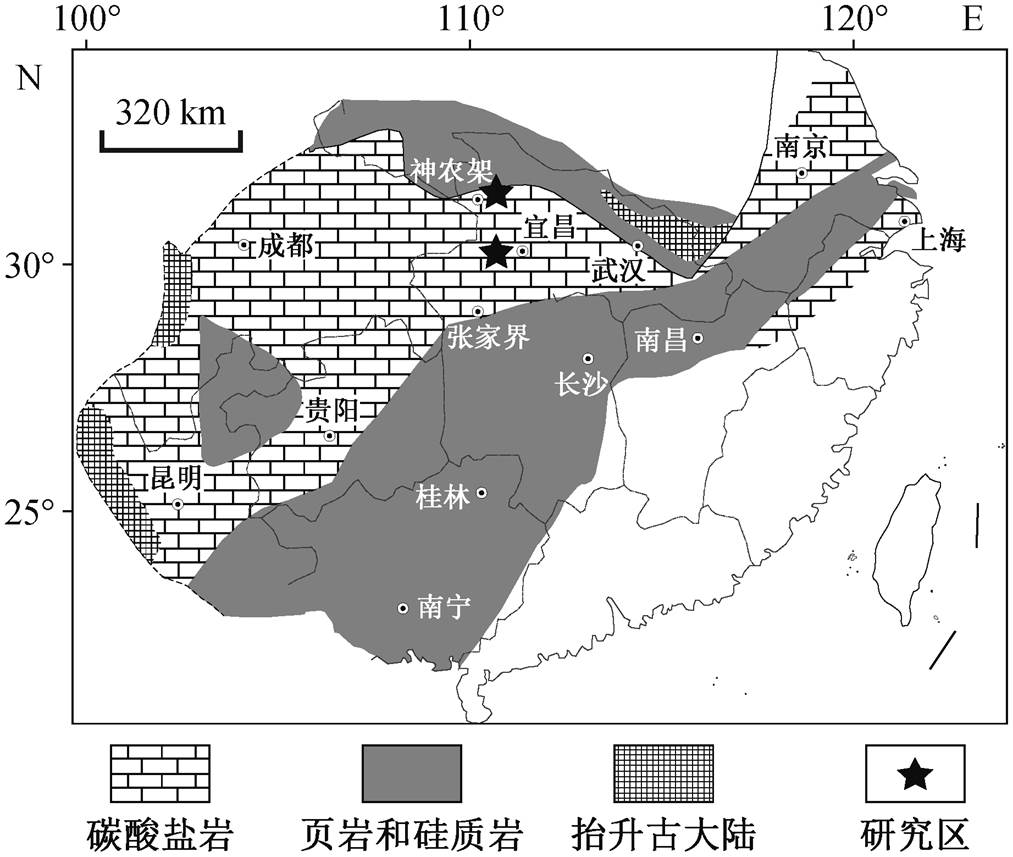
图2 华南地区早寒武世岩相简图(修改自文献[10])
Fig. 2 Early Cambrian litho-geographic map of South China (modified from Ref. [10])
本文研究的化石层位为位于水井沱组下段的黑色碳质页岩, 层内古生物化石丰富, 主要有三叶虫Sinodiscus shipaiensis, Sinodiscus similis, Sinodiscus changyangensis, Tsunyidiscus ziguiensis, Tsunyidiscus sanxiaensis, Hubeidiscus orientalis和Hubeidiscus ele-vatus 以及放射虫、腕足类、高肌虫、等刺虫、刺细胞、海绵骨针、藻类、疑源类、软舌螺、开腔骨和古杯类等(图3)。
刺胞动物门 Phylum CNIDARIA Hatshek, 1988
纲、目、科未定 Class, Order, Family Uncertain
楔叶虫属 Genus Sphenothallus Hall, 1847
模式种 Sphenothallusangustifolius Hall, 1847
属征 虫体细长, 呈锥管状, 最大长度超过 90 mm, 单体或有侧分支。有近似锥状的吸盘和一对从始端延伸到口部的纵向加厚物。始端常弯曲, 口部通常直, 开口角小(2°~26°)。
分布和时代 中国、美国、韩国和德国等地, 寒武纪至二叠纪。
Sphenothallus ziguiensis sp. nov.秭归楔叶虫(新种)
种征 壳体呈短锥管状, 整体略弯曲。锥管开口角为 12°~20°, 无分支。有一对纵向加厚带, 表面具中沟和纵脊, 纵向脊结构特征未在其他已定种中发现, 故据此特征建立新种。
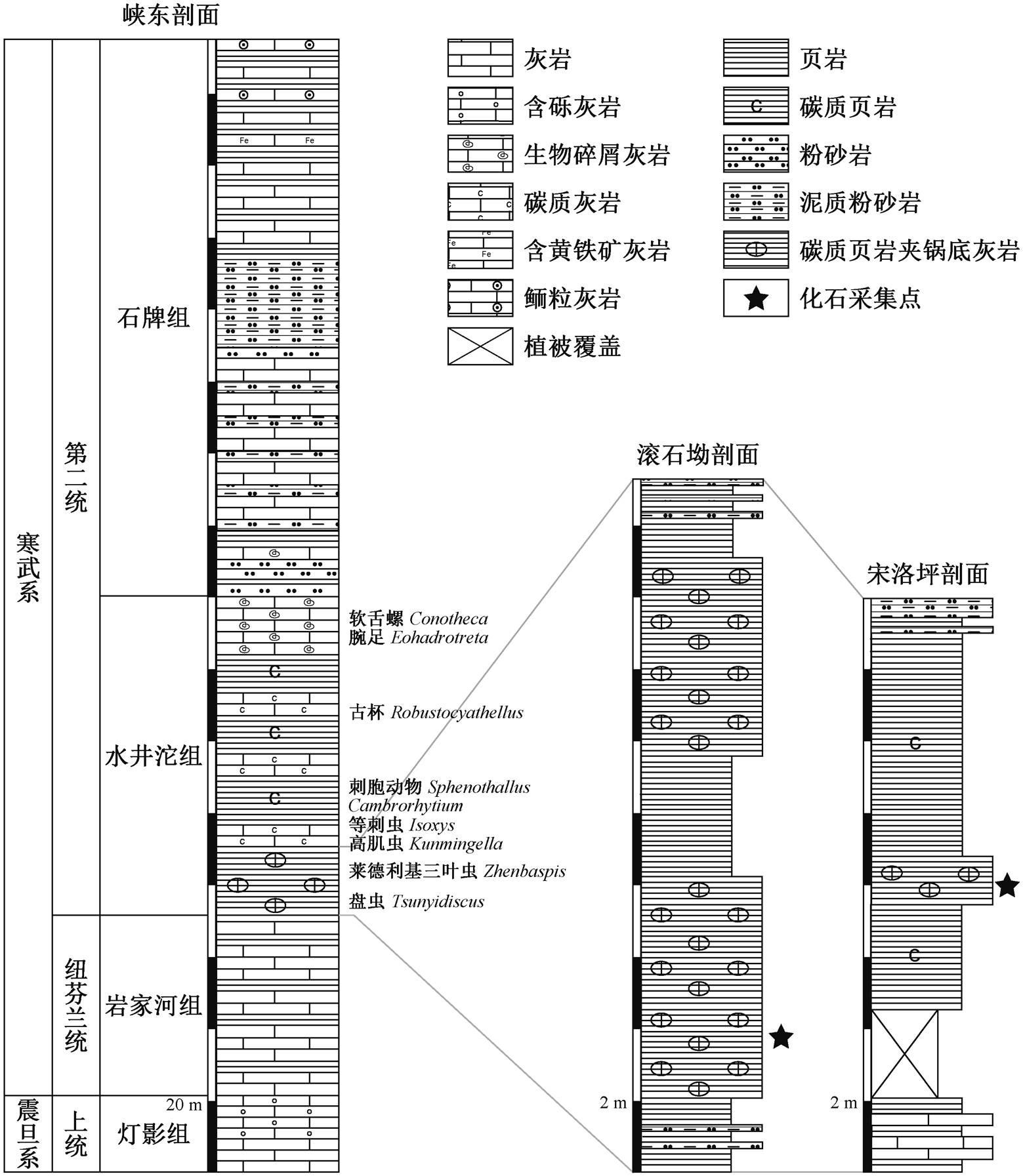
图3 湖北峡东剖面寒武系岩性柱状图以及峡东、滚石坳和宋洛坪剖面水井沱组化石分布(修改自文献[12])
Fig. 3 Lithologic column of the Cambrian in Xiadong Section and fossils distribution of Shuiingtuo Formation in Xiadong, Gunshi’ao and Songluoping Sections of Hubei (modified from Ref. [12])
模式标本 湖北宜昌秭归地区滚石坳剖面水井沱组下部的 P45-S4-2 为正型标本(图 4(a)中箭头所指), P45-S1-1 为副型标本(图4(b))。
化石描述 壳体呈锥管状, 锥管由始部(较细的一端)向口部(较宽的一端)逐渐膨胀变粗, 标本略弯曲。个体的长度一般在 5~15mm 之间, 最大个体为 21.8mm; 口部宽度为 2~3mm, 最大宽度为 6.3mm; 锥管开口角度为 12°~20°。壳体两侧有一对窄而细长的纵向加厚带, 常扭曲弯折, 截面呈新月状, 宽度为 0.4~0.7mm。一些标本的纵向加厚带中间可见一条从顶部至口部延伸的纵向“中沟”(图 4(a)和(e)), 标本的纵向加厚带可见成层的规则的纵向脊(50~80 条/mm)(图 4(c)和(e))。绝大部分标本纵向加厚带左右两支呈“一凹一凸”型保存, 即一支保存为向外凸起的正模, 另一支保存为向围岩处凹入的负模(图 4(d))。纵向加厚带呈层状结构, 不同片层显示出不同的表面特征(图 4(f))。一些个体保留着左右两支加厚带之间的管壁部分, 其成分为有机质薄膜, 偶见管壁部分的低起伏横向结构(图 4(h)和(i))。所有标本的始部均未见锥形固着器。
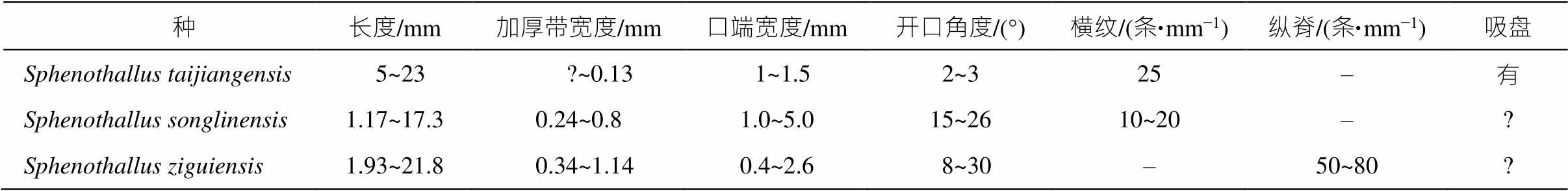
比较 新标本与 Sphenothallus 的属征相符, 故将其归入本属。在我国寒武系已发现 Sphenothallus属的两个种: Sphenothallus songlinensis Peng et al., 2005 (松林楔叶虫)和Sphenothallus taijiangensis Zhu et al., 2000 (台江楔叶虫)。另有一些标本被归入台江楔叶虫相似种 Sphenothallus cf. taijiangensis[21,29‒30], 分布于贵州和湖北等地。通过形态学分析对比, 可知与 Sphenothallus taijiangensis 相比, 当前标本不具备极细而规则的外部横纹, 且 Sphenothallus tai-jiangensis 的个体更加细长和弯曲, 锥管开口角更小[19,30]。新标本个体相对短小、口部宽度与锥管开口角度较大、形态上弯曲程度较低以及无固着器等特点, 与 Sphenothallus songlinensis 更加相似(图 4 (i))[19,31], 但以加厚带表面纵向的规则纹饰与 Sphe-nothallus songlinensis 相区别[14‒15,21](表 1)。本研究的标本大量破碎, 且缺失锥形固着器, 表明化石埋藏之前经历过搬运。

(a)和(b) Sphenothallus ziguiensis sp. nov.; (a)正型(holotype), P45-S4-2 (箭头所指); (b)副型(paratype), 标本P45-S1-1, 左右两支常一凹一凸保存, 可见中沟; (c)为(b)中方框区域的负模保存部分局部放大, 可见明显的纵向脊; (d)和(e)正模标本表面的纵脊结构; (f)一件标本的扫描电子显微镜照片, 示片状结构, 纵脊分布在不止一个片层上(箭头所指); (g) Sphenothallus ziguiensis sp. nov.的一个不完整个体, 箭头指示碳质膜形式保存的管壁; (h)管壁碎片, 可见管壁上的横纹; (i)同层位中Sphenothallus songlinensis的不完整个体, 个体更直, 加厚带可见清晰横纹。比例尺均为1 mm
图4 秭归水井沱组中刺胞动物秭归楔叶虫(新种)的显微照片
Fig. 4 Microscopic photographs of cnidaria Sphenothallus ziguiensis from Shuijingtuo Formation at Zigui
产地和层位 湖北秭归地区滚石坳剖面, 寒武系第二统水井沱组。
由于埋藏条件较差, 大部分化石仅保存左右两支加厚带, 中间管壁被压扁成有机质薄膜或缺失, 加厚带中部有贯穿整支的向内凹陷的中沟, 呈片层结构, 表面片层存在纵向脊纹饰。纵向脊在片层上分布较连续, 纹饰密度在 50~80 条/mm 之间。在光学显微镜和扫描电子显微镜下观察, 可以发现纵向脊分布在加厚带表面的几个片层, 向内部则是光滑的片层, 片层厚数微米(图 4(f))。X 射线能谱分析结果显示, 含纵向脊片层与表面光滑片层在成分上没有差异。整体而言, 化石比围岩具有更高的碳质成分(图 5(b))和钙质成分(图 5(d)), 黏土矿物和硅质相对较少(图 5(e)和(i)~(k))。另一方面, 在有纵向脊纹饰的片层中, 部分区域呈现鳞片状龟裂结构(图 5(f)和(m)中箭头所指处), 与未龟裂部分的表面成分有着较大的差异。与光滑片层相比, 鳞片状龟裂部分含更多的 C 和 Ca (图 5(n)和(p)), 伴随低的 O, K, Al和 Si 含量(图 5(o)和(u)~(w)), 与围岩的差异更显著。我们初步认为, 标本表面的纵向脊状结构并非生物矿化的结果, 而是其原生结构在成岩作用下的保留, 表面鳞片化龟裂则是后期脱矿程度不均一的产物。Muscente 等[14]指出, 原始楔叶虫的锥管壁应该具有外部有纹饰、内部光滑的有机磷酸盐片层。本研究中标本的 Sphenothallus 片层成为碳质, 可能是磷酸盐脱矿作用过程中保存了碳质物质, 同时丢失很多微观结构, 所以很多标本中未见纵向纹饰, 或纵向纹饰仅分布在加厚带的部分区域。
表1 华南早寒武纪Sphenothallus的定性形态学资料统计
Table 1 Statistic of qualitative morphological data of Sphenothallus from the early Cambrian of South China
种长度/mm加厚带宽度/mm口端宽度/mm开口角度/(°)横纹/(条·mm−1)纵脊/(条·mm−1)吸盘 Sphenothallus taijiangensis 5~23 ?~0.13 1~1.52~325‒有 Sphenothallus songlinensis1.17~17.30.24~0.81.0~5.015~2610~20‒? Sphenothallus ziguiensis1.93~21.8 0.34~1.140.4~2.6 8~30‒50~80?
简单的解剖学结构使得对 Sphenothallus 进行亲缘划分变得十分困难。在详细研究 Sphenothallus的骨骼解剖结构、壳壁微观构造及矿物成分后, 根据其与刺胞动物水螅纲无性出芽生殖相似的主茎分支现象[19,21,26]以及与锥石类相似的数个平行层构成的管壁[14], 将 Sphenothallus 划入刺胞动物门。然而, Muscente 等[14]在对湖北寒武系中 Sphenothallus进行细致的埋藏学分析后指出, Sphenothallus 的平行层理结构与加厚物之间管壁低起伏的横肋可能是生物矿化的结果, 不能作为分析其亲缘关系的依据, 若要进一步确定 Sphenothallus 的亲缘关系, 还需更多的解剖学证据。
本文报道的新种中纵向脊状结构的发现为其亲缘关系的探究提供了新的佐证, 其纵向脊与某些肌肉组织在形态上具有一致性[32]。虽然肌肉组织通常是最难保存的部分, 但有时其轮廓可以保存下来, 例如在英格兰赫利福德郡(Herefordshire)志留系文洛克阶中发现的 Offacolus[33], 当有机物腐烂时, 周围沉积物的快速胶结使得原来有机质占据的位置成为一个可被矿物质填充的空间, 并在随后的成岩过程中被填充[33]。刺胞动物门的一个典型特征是上皮肌肉细胞在表皮基部形成纵向纤维外层, 在胃皮基部形成环形纤维内层, 用于帮助肌肉收缩[34]。此外, 现生刺胞动物门中, 绝大多数动物是辐射对称的, 即具有多个相等的辐射轴[34]。根据 Sphenothallus的结构可知, 锥管壁两侧纵向加厚物使得其身体结构具有两辐射对称的特点(图 6)。通过将现生水螅等刺胞动物与古生代其他刺胞动物门化石进行解剖对比, Dzik 等[35]指出生物构型可能并非如人们先前设想的那般从简单到复杂地进化, 而是可能经历了逆演化过程。现生辐射对称的水螅体内也观察到两辐射对称结构, 依次类推, Sphenoth-allus 也可能是原始的刺胞动物。刺胞动物的生理结构在不断适应环境并进化的过程中被简化, 演变为现今的辐射对称构型。
门未定Phylum Uncertain
软舌螺纲 Class Hyolitha Marek, 1963
软舌螺目Order Hyolithida Sysoyev, 1957
泡克西螺科Family Pauxillitide Marek, 1966
偶线带螺属Genus Ambrolinevitus Syssoiev, 1958
巨大偶线带螺(相似种)Ambrolinevitus cf. A. maximus Jiang, 1982
化石描述 壳体呈直锥管状, 锥管从始部(较细的一端)向口部(较宽的一端)逐渐膨胀变粗, 口缘近平直。壳体背部具有凹陷的纵向“中沟”, 将壳体分为左右两瓣(图 7(a)和(b))。个体长 15~20mm, 口端测量宽度为 3~4mm, 锥管开口测量角度为 15°~ 21°。壳体呈片层状结构, 碳质, 片层表面可见均匀的纵向脊, 密度为 15~25 条/mm (图 7(c)、(e)和(f)~ (h)), 纵向脊自始部向口部略呈放射状, 口部比始部稀疏, 直或略弯曲(图 7(c)), 近口缘有 3~4 条横向环饰, 将纵向脊隔断。仅极少数标本保存口盖(图 7 (d)), 未见始端肉茎和附肢等结构。

(a)~(l) 正模保存标本X射线能谱分析结果; (m)~(x) 负模保存标本X射线能谱分析结果
图5 湖北秭归水井沱组楔叶虫标本显微结构和元素矿物组成
Fig. 5 Microstructures and elemental compositions of Sphenothallus specimens from Shuijingtuo Formation at Zigui, Hubei Province, China

固着器参考 Sphenothallus taijiangensis, 加厚带和管壁原始成分依据文献[14]
图6 Sphenothallus ziguiensis sp. nov.复原示意图
Fig. 6 Restoration of Sphenothallus ziguiensis sp. nov.
比较 该标本为宏体实体化石, 保存的结构信息较少, 其锥管状的轮廓形态和细密的纵向脊结构是探讨其亲缘关系的突破口。刺胞动物门中, Sphe-nothallus 和 Cambrorhytium (寒武杯管虫)都具有与该化石相似的锥管状形态[15]。Cambrorhytium 的个体大小和开口角度都与之相似, 然而 Cambrorhytium通常保存为二维碳质膜或重晶石层[15,36]。虽然该化石的轮廓、纵向脊和“中沟”都与 Sphenothallus 高度相似, 但 Sphenothallus 标志性的一对纵向加厚带在本研究的标本中却没有体现。由于存在隔板结构, 古杯化石会呈现纵向的纹饰结构, 但其纵向放射状隔板的间距与本文标本的纵向结构密度相差较大, 且本文研究的标本不存在古杯化石标志性的外壁孔结构[12‒13]。与水井沱组顶部的微体软舌螺[12,37]相比, 本文标本具有相似的纵向纹饰, 但体型更大。本文标本的壳体保存形式和表面纹饰上都与在云南黑林铺组和贵州杷榔组发现的 Ambrolinevitus maxi-mus (巨大偶线带螺)[7,38‒39]极为相似, 但本文标本的开口角比 Ambrolinevitus maximus 略大, 背部相对较高, 且背壳具有一个稳定的纵向“中沟”结构。
产地和层位 湖北神农架, 水井沱组。
软舌螺的外骨骼主要由顶端封闭呈锥管状的锥壳以及用于封闭锥壳的圆盘状口盖两部分组成, 部分属种发育一对桨状的附肢, 从锥壳与口盖聚合面两侧的缺口处伸出[40‒42]。口盖在水井沱组标本中极少保留, 未见附肢。我国软舌螺的早期演化可分为 7 个阶段, 从梅树村期早期的体型较小、不分背腹、装饰单一, 到筇竹寺期的有口唇、无口唇但背腹分异明显, 再到腹凹和粗纵脊出现[43]。水井沱组软舌螺化石的背腹分异已经显著, 并具有背中沟和纵向纹饰。这些特征表明, 软舌螺的辐射演化进程比我们以前认知的更加迅速。
本研究的锥管化石微观上仍显示片层状结构, 纵向脊在外部数个片层上分布, 密度为 15~25 条/mm。扫描电子显微镜图像显示, 片层表面光滑, 孔隙结构少见。X 射线能谱分析结果表明, 化石和围岩的成分较均一, 似乎反映了化石的原生结构。虽然在埋藏成岩过程中化石成分被改造了, 但其表面纹饰和片层结构仍被保留(图 8)。
长期以来, 软舌螺的亲缘关系一直存在争议。其口盖特征、壳体形态以及显微结构与软体动物相似[44‒45], 而其肠道形态和壳内肌肉排列方式与星虫动物更接近[46‒47]。Moysiuk等[48]在加拿大布尔吉斯页岩的软舌螺类化石中发现羽翼状的触手结构, 并将其解释为与触手冠动物纤毛环取食结构同源的纤毛环(lophophore), 认为软舌螺应属于与腕足动物紧密相关的触手冠动物(lophophorates)。Sun 等[49]在直管螺类化石中发现与腕足动物相似的固着“肉茎”结构, 且双瓣壳的身体构型和封闭的过滤腔等特征也可与腕足动物类比, 推测软舌螺动物与腕足动物具有较近的亲缘关系, 认为软舌螺属于腕足动物姊妹类群或冠群。Liu 等[50]发现, 澄江化石库中直管螺类化石 Triplicatella (三槽螺)扇状排列的触手结构(Tentacles)营沉积取食, 不同于触手冠动物的纤毛环(lophophore)的被动滤食功能, 因此软舌螺并非触手冠动物, 与腕足动物的亲缘关系较远。软体动物能够通过外套膜分泌碳酸钙, 形成具有多层次复杂微细结构的外骨骼。本研究发现的片状壳体纤维结构与软体动物的结构[51‒52]有些相似, 或许可以从侧面佐证软舌螺与软体动物的亲缘关系。水井沱组标本已经具有显著的背腹分异, 并具有背中沟和纵向纹饰(图 9), 但尺寸比澄江生物群中该类化石稍小, 可能因为与澄江化石相比, 水井沱组沉积于较深水环境, 软舌螺类生物可能通过减小个体尺寸来适应深水环境, 减小身体承受的压力[53]。

(a)和(b) Ambrolinevitus maximus cf. A. Jiang, 1982; (a)标本19sjt-56; (b)标本 19sjt-55; (c)为(a)的局部放大, 显示中沟、清晰的纵向脊和横向的隔断; (d)保存了口盖的标本; (e)和(f)一件标本同一区域的局部放大, 显示纵脊和横向隔断; (g)和(h)一对正负模标本, 靠近口部沿背部剥离, 保存了纵向结构, 靠近始端则显示内部充填情况。比例尺均为1 mm
图7 神农架水井沱组软舌螺Ambrolinevitus cf. maximus的显微照片
Fig. 7 Microscopic photographs of hyolithid Ambrolinevitus cf. maximus from Shuijingtuo Formation at Shennongjia

图8 神农架水井沱组软舌螺标本显微结构和元素矿物组成
Fig. 8 Microstructures and elemental compositions of Hyolithida from Shuijingtuo Formation at Shennongjia
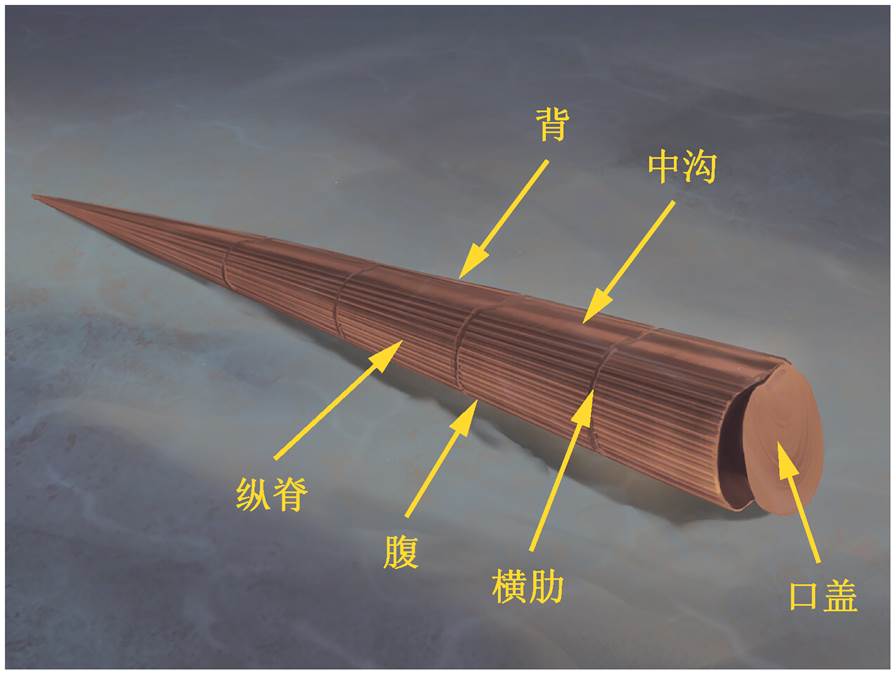
图9 Ambrolinevitus cf. A. maximus Jiang, 1982复原示意图
Fig. 9 Restoration of Ambrolinevitus cf. A. maximus Jiang, 1982
1)水井沱组深水黑色页岩沉积物中的生物群落, 除常见的三叶虫、球节子类和腕足类等化石外, 还包括微古植物、小壳化石和宏体锥管状化石。之前对刺胞动物门Sphenothallus属的结构报道, 集中在其加厚带、有机质壁上的横纹和横脊。作为一个新的特征, 本研究发现的纵向纹饰区分和界定了一个新种: Sphenothallus ziguiensis sp. nov., 也为探究刺胞动物的亲缘关系提供了新的证据。
2)水井沱组软舌螺类种属丰富, 但之前的研究集中在该组顶部个体较小的软舌螺化石, 与软舌螺演化早期梅树村阶更为相似。本研究发现的与Ambrolinevitus maximus相似的宏体软舌螺化石, 将软舌螺向宏体进化的时代提前, 也丰富了水井沱组的生物组合面貌。
致谢 北京大学史前生命与环境科学研究所孙元林教授和薛进庄副教授提出宝贵的修改意见, 美国设计艺术中心学院研究生徐祎贺和北京大学地球与空间科学学院研究生章美希帮助绘制复原图, 北京大学地球与空间科学学院研究生秦树建、李辰卿和凌坤参与化石采集, 在此一并致以衷心的谢意。
参考文献
[1]朱茂炎. 动物的起源和寒武纪大爆发: 来自中国的化石证据. 古生物学报, 2010, 49(3): 269‒287
[2]Butterfield N J. Animals and the invention of the Pha-nerozoic Earth system. Trends in Ecology & Evolu-tion, 2011, 26(2): 81‒87
[3]Butterfield N J. Oxygen, animals and oceanic ventila-tion: an alternative view. Geobiology, 2010, 7(1): 1‒7
[4]朱茂炎, 张俊明, 李国祥. 澄江生物群的沉积环境——云南澄江县下寒武统玉案山组的沉积学研究. 古生物学报, 2001, 40(增刊 1): 80‒105
[5]Li G, Steiner M, Zhu X, et al. Early Cambrian meta-zoan fossil record of South China: generic diversity and radiation patterns. Palaeogeography Palaeoclima-tology Palaeoecology, 2007, 254(1/2): 229‒249
[6]Bengtson S, Zhao Y. Fossilized metazoan embryos from the Earliest Cambrian. Science, 1997, 277: 1645‒1648
[7]侯先光. 澄江动物群: 5.3 亿年前的海洋动物. 昆明: 云南科技出版社, 1999
[8]Wen W, Yang A H, Janussen D, et al. Hexactinellid sponges from the early Cambrian black shale of South Anhui, China. Journal of Paleontology, 2005, 79(6): 1043‒1051
[9]湖北省地质矿产局. 湖北省区域地质志. 北京: 地质出版社, 1982
[10]湖北省地质局三峡地层研究组. 峡东地区震旦纪至二叠纪地层古生物. 北京: 地质出版社, 1978
[11]曹文超. 湖北秭归地区寒武系第二统水井沱组放射虫动物群[D]. 北京: 中国地质大学, 2014
[12]汪洋, 李勇, 张志飞. 峡东水井沱组顶部微体骨骼化石初探. 古生物学报, 2010, 49(4): 511‒523
[13]王相人. 湖北峡东地区寒武系水井沱组古杯化石研究[D]. 西安: 西北大学, 2012
[14]Muscente A D, Xiao S. New occurrences of Spheno-thallus in the lower Cambrian of South China: impli-cations for its affinities and taphonomic deminera-lization of shelly fossils. Palaeogeography, Palaeocli-matology, Palaeoecology, 2015, 437: 141‒164
[15]Chang S, Sébastien C, Lei Z, et al. New probable cnidarian fossils from the Lower Cambrian of the Three Gorges area, South China, and their ecological implications. Palaeogeography Palaeoclimatology Pa-laeoecology, 2018: 505: 150‒166
[16]Xiao S, Yuan X, Steiner M, et al. Macroscopic carbo-naceous compressions in a terminal Proterozoic shale: a systematic reassessment of the Miaohe Biota, South China. Journal of Paleontology, 2002, 76(2): 347‒376
[17]郭俊锋, 李勇, 韩健, 等. 原锥虫属(Prptpcpmotes Chen et al., 1994)在湖北三峡地区纽芬兰统(Ter-reneuvian)岩家河组的发现. 自然科学进展, 2009, 19(2): 180‒184
[18]陈孟莪, 萧宗正. 晚震旦世的特种生物群落—— 庙河生物群新知. 古生物学报, 1994, 33(4): 391‒403
[19]Zhu M, Iten H V, Cox R S, et al. Occurrence of By-ronia Matthew and Sphenothallus Hall in the Lower Cambrian of China. Palz, 2000, 74(3): 227‒238
[20]Iten H V, Zhu M Y, Collins D. First report of Sphe-nothallus Hall, 1847 in the Middle Cambrian. Journal of Paleontology, 2002, 76(5): 902‒905
[21]Peng J, Babcock L E, Zhao Y, et al. Cambrian Sphe-nothallus from Guizhou Province, China: early sessile predators. Palaeogeography, Palaeoclimato-logy, Pa-laeoecology, 2005, 220(1/2): 119‒127
[22]华洪, 蔡耀平, 闵筱, 等. 埃迪卡拉纪末期管状动物的“大辐射”. 西北大学学报(自然科学版), 2020, 50(2): 141‒174
[23]王琪, 刘云焕, 邵铁全, 等. 陕南寒武纪梅树村期西乡生物群中的管状化石研究. 微体古生物学报, 2017, 34(1): 53‒64
[24]Pashin J C, Ettensohn F R. An epeiric shelf-to-basin transition; Bedford-Berea Sequence, northeastern Ken-tucky and south-central Ohio. American Journal of Science, 1987, 287(9): 893‒926
[25]Neal M L, Hannibal J T. Paleoecologic and taxono-mic implications of Sphenothallus and Sphenothallus-like specimens from. Journal of Paleontology, 2000, 74(3): 369‒369
[26]Iten H V, Cox R S, Mapes R H. New data on the morphology of Sphenothallus Hall: implications for its affinities. Lethaia, 1992, 25(2): 135‒144
[27]Iten H V, Fitzke J A, Cox R S. Problematical fossil cnidarians from the Upper Ordovician of the north-central USA. Palaeontology, 1996, 39(4): 1037‒1062
[28]Wang J. Evolution from an anoxic to oxic deep ocean during the Ediacaran-Cambrian transition and impli-cations for bioradiation. Chemical Geology, 2012, 306/307: 129‒138
[29]彭进, 赵元龙, 王平丽, 等. 贵州下寒武统松林生物群中最古老的Sphenothallus (楔叶虫)//中国古生物学会第22届学术年会. 成都, 2003: 26
[30]张培兴, 赵元龙, 王平丽, 等. 贵州剑河八郎寒武系清虚洞组的楔叶形虫 Sphenothallus Hall, 1847. 微体古生物学报, 2013, 30(3): 310‒317
[31]赵元龙, 袁金良, 朱茂炎, 等. 贵州台江早寒武世台江生物群. 古生物学报, 1999, 38(增刊 1): 108‒ 115
[32]Briggs D E G. The role of decay and mineralization in the preservation of soft-bodied fossils. Annual Review of Earth & Planetary Sciences, 2003, 31(1): 275‒301
[33]Orr P, Briggs D, Siveter D, et al. Three dimensional preservation of a non-biomineralised arthropod in con-cretions in Silurian volcaniclasitcs from Herefordshire, England. Journal of the Geological Society, 2000, 157: 173‒186
[34]许振祖, 黄加祺, 林茂, 等. 中国刺胞动物门水螅虫总纲. 北京: 海洋出版社, 2014
[35]Dzik J, Baliński A, Sun Y. The origin of tetraradial symmetry in cnidarians. Lethaia, 2017, 50(2): 306–321
[36]Vaucher R, Martin E L O, Hormière H, et al. A genetic link between Konzentrat- and Konservat-Lagerstätten in the Fezouata Shale (Lower Ordovician,Morocco). Palaeogeography Palaeoclimatology Palaeo-ecology, 2016, 460(Suppl 1): 24‒34
[37]Zhang Z L, Skovsted C B, Zhang Z F. A hyolithid without helens preserving the oldest hyolith muscle scars: palaeobiology of Paramicrocornus from the Shujingtuo Formation (Cambrian Series 2) of South China. Palaeogeography Palaeoclimatology Palaeoe-cology, 2018, 489: 1‒14
[38]Sun H, Babcock L E, Peng J, et al. Systematics and palaeobiology of some Cambrian hyoliths from Gui-zhou, China, and Nevada, USA. Alcheringa: An Aus-tralasian Journal of Palaeontology, 2017, 41(1): 79‒ 100
[39]罗惠麟, 蒋志文, 武希彻, 等. 云南东部震旦系—寒武系界线. 昆明: 云南人民出版社, 1982
[40]Mus M, BergstrÖm J. Skeletal microstructure of he-lens, lateral spines of Hyolithids. Palaeontology, 2010, 50(5): 1231‒1243
[41]Mus M, Bergström J. The morphology of Hyolithids and its functional implications. Palaeontology, 2010, 48(6): 1139‒1167
[42]Mónica M M. Interpreting ‘shelly’ fossils preserved as organic films: the case of hyolithids. Lethaia, 2014, 47(3): 397‒404
[43]钱逸. 软舌螺分类与早期演化//中国古生物学会学术年会. 承德, 1993: 10‒11
[44]Malinky J M. Hyolitha from the Early Paleozoic glacial erratic boulders (Geschiebe) of Germany and Poland. Fossil Record, 2007, 10(2): 71‒90
[45]Marek L, Parsley R L, Galle A. Functional morpho-logy of hyoliths based on flume studies. Vestnik Ceskeho Geologickeho Ustavu, 1997, 72(4): 351‒358
[46]Huang D Y, Chen J Y, Vannier J, et al. Early Cambrian sipunculan worms from southwest China. Proceedings of the Royal Society B: Biological Sciences, 2004, 271: 1671‒1676
[47]Runnegar B, Pojeta J, Morris N J, et al. Biology of the Hyolitha. Lethaia, 1975, 8(2): 181‒191
[48]Moysiuk J, Smith M R, Caron J B. Hyoliths are Palaeozoic lophophorates. Nature, 2017, 541: 394‒ 397
[49]Sun H, Smith M R, Zeng H, et al. Hyoliths with pedicles illuminate the origin of the brachiopod body plan. Proceedings of the Royal Society: Biological Sciences, 2018, 285: 20181780
[50]Liu F, Skovsted C B, Topper T P, et al. Are hyoliths Palaeozoic lophophorates?. National Science Review, 2020, 7(2): 453‒469
[51]Kouchinsky A. A middle Cambrian fauna of skeletal fossils from the Kuonamka Formation, northern Sibe-ria. Alcheringa: An Australasian Journal of Palaeon-tology, 2011, 35(1): 123‒189
[52]Moore J L, Porter S M, Sigwart J. Plywood-like shell microstructures in hyoliths from the middle Cambrian (Drumian) Gowers Formation, Georgina Basin, Aus-tralia. Palaeontology, 2018, 61: 441‒467
[53]孙海静. 贵州东部寒武系杷榔组及北美西部寒武纪地层软舌螺类研究[D]. 贵阳: 贵州大学, 2015
New Discovery of Macroscopic Cone Fossils from the Cambrian Series-2 Shuijingtuo Formation of Hubei, China
Abstract Macroscopic cone fossils, from the early Cambrian Shuijingtuo Formation of Shennongjia and Zigui areas, Hubei Province, were studied by using stereo light microscopy and scanning electron microscopy. A new species of the genus Sphenothallus was identified by its longitudinal ridges located within the “V” shaped thickenings. The genus Ambrolinevitus of the class Hyolithida was firstly described from Shuijingtuo Formation. Theresult enriches the biodiversity of the Shuijingshuo Formation and adds new palaeontological data for the research of early life evolution.
Key words Cambrian; Shuijingtuo Formation; Cnidaria; Sphenothallus; Hyolithida
doi: 10.13209/j.0479-8023.2022.041
国家自然科学基金(41672334)资助
收稿日期: 2021-04-28;
修回日期: 2021-05-13