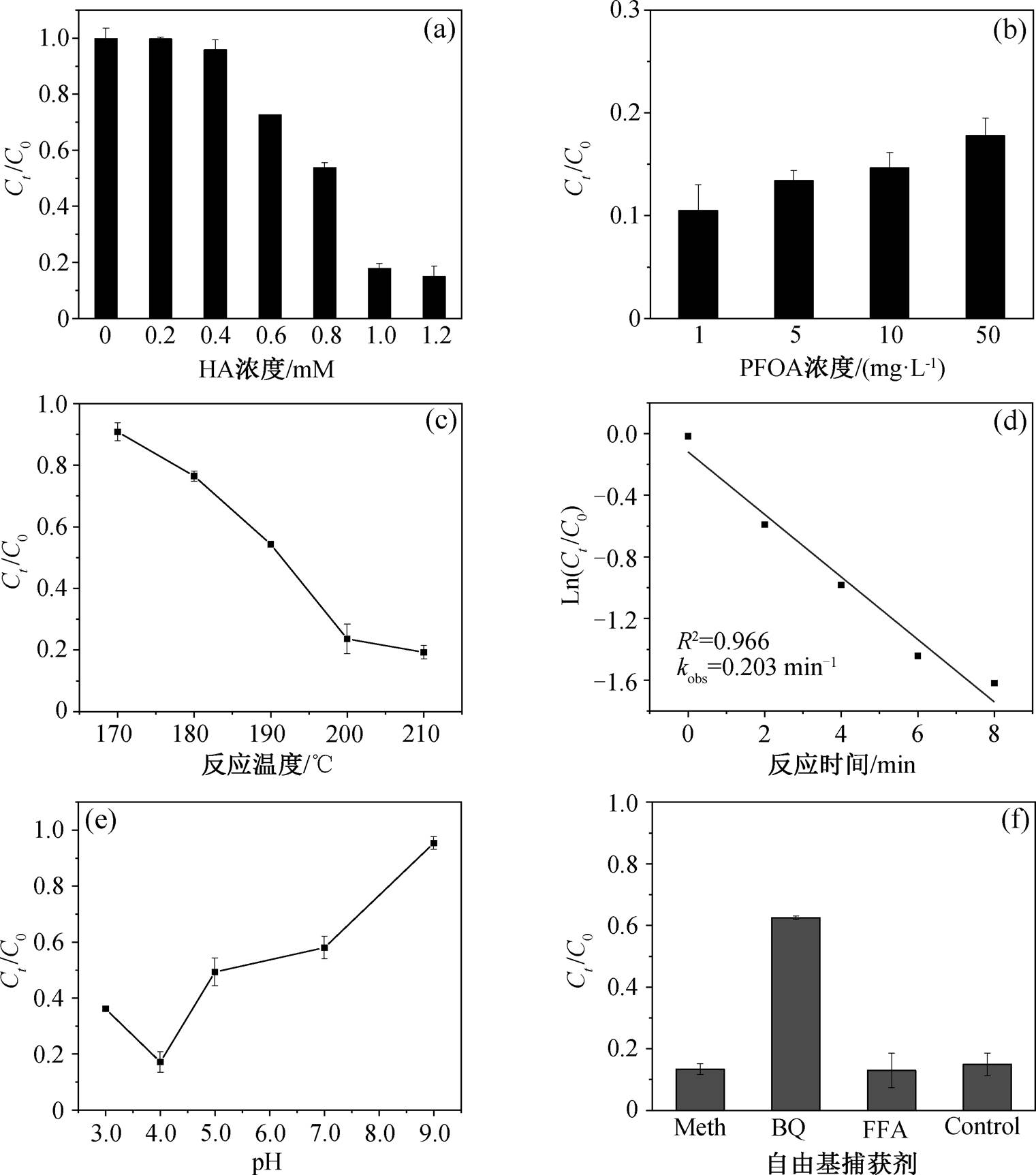
(a)羟胺浓度, (b)PFOA浓度, (c)反应温度, (d)反应时间, (e)pH, (f)自由基淬灭剂
图1 不同条件对微波辅助羟胺降解PFOA的影响
Fig. 1 Effects of different conditions on PFOA degradation by microwave assisted hydroxylamine reduction
摘要 通过微波辅助羟胺降解方法, 实现快速高效降解持久性有机物全氟辛酸(PFOA)。设置微波的功率为1200W, 在羟胺浓度为1.0 mM, 微波加热温度为200ºC, pH=3.92的条件下, 50 mg/LPFOA溶液在反应6分钟后的降解效率达到82.22%。微波透过反应器壁均匀加热反应体系, 反应体系中的羟胺在微波条件下选择性地吸收微波能量, 产生“火锅”效应, 促进自由基的生成, 提高降解效率。通过自由基淬灭实验, 得到羟胺降解PFOA的主要活性物质为超氧阴离子自由基(O2•–)。O2•–先攻击PFOA的羧基官能团(-COOH), 导致 C—O键断裂脱羟基(-OH), PFOA脱-OH后不稳定, 继续断裂, 逐步脱除CF2, 最终降解为F-和CO2。微波辅助羟胺降解PFOA可为开发新型持久性有机污染物的处理技术提供理论依据。
关键词 羟胺; 微波; 全氟辛酸(PFOA); 超氧阴离子自由基(O2•–)
全氟辛酸(PFOA)具有热稳定性好、化学稳定性强以及表面活性高等优点, 已广泛应用于消费品和工业领域[1–3]。全氟化合物中的 C—F 键键能高达485kJ/mol [1], 化学性质极其稳定, 难以被自然降解或生物降解, 在环境和人体[4–8]等基质中频繁检出。PFOA 对生态系统和人类健康存在潜在危害[9–10], 被斯德哥尔摩公约列为持久性有机污染物[11], 被美国环境保护署列为“可能的致癌物”[11–12], 在诸多国家被禁止或限制使用。研究表明, PFOA 在活性污泥和化学法等常规废水处理工艺中具有难降解性[13]。因此, 开发一种高效去除 PFOA 的处理方法对确保水质、保护环境和保障人类健康至关重要。
PFOA 上的氟电负性很强, 具有吸电子效应, 与之相连的碳原子电子云密度降低, 易受到电子的攻击而发生亲核反应。Arvaniti 等[14]用 Mg-氨基黏土包覆的纳米级零价铁先吸附后还原, 可以有效去除 96%的 PFOA。Lee 等[15]研究了在纳米铜存在条件下柠檬酸钛和维生素 B12 还原降解 PFOA, 维生素B12 与纳米铜的协同作用增强了电子转移反应和氢解反应的还原活性。在缺氧的水溶液中, 该系统可以有效地去除 65%的 PFOA。引入催化剂可以得到不错的降解效果, 但容易引入新杂质, 并且催化剂的制备成本较高, 也限制了该技术的应用。羟胺是一种强还原剂, 可以与 Cu2+结合, 通过还原溶解氧产生超氧阴离子自由基(O2•−)和 H2O2 等活性物质[16],也可以通过还原 Fe(III)来强化 Fe3O4, 激活过一硫酸氢盐降解阿特拉津[17]。da Silva-Rackov 等[18]利用铁改性硅藻土活化 H2O2 和过硫酸盐, 生成 O2•−, 从而实现 PFOA 脱氟。Mitchell 等[19]利用 0.5mM Fe(III)催化 1 M H2O2增殖反应生成 O2•−, 在 150 分钟内降解了 89% 的 PFOA。此外, 羟胺分解的产物为 NH3, N2O, H2O 和 HCl, 不会给反应体系引入新污染。但是, 常温下羟胺的活化不足以降解 PFOA, 需要借助加热来提高羟胺的活化效率。在加热体系中, 微波具有快速、非接触式加热和易于控制的优点, 与传统加热方法相比, 其能源效率更高。Li 等[20]利用负载 Pb 和 BiFeO3 的氧化还原石墨烯材料(Pb-BFO/ rGO), 在微波增强类芬顿工艺中通过活化H2O2, 在5 分钟内去除 90.0%的 PFOA (30.0~50.0mg/L)。微波辐射可以穿过反应器壁, 在整个反应体系中均匀地耗散能量, 促进自由基的生成, 从而促进污染物的降解。
本文使用羟胺作为反应过程中的活性还原剂, 在微波辅助加热条件下研究 PFOA 在水中的降解。考察反应过程的最优条件(羟胺浓度、PFOA 浓度、反应温度、反应时间和体系 pH 等), 确定 PFOA 的降解产物, 结合自由基实验和中间产物分析来推断反应机理, 以期为全氟化合物等新型持久性有机污染物的处理提供新的技术方法和理论依据。
全氟辛酸(C8HF15O2, > 98%)、盐酸羟胺(H3NO·HCl, AR, 98.5%)、乙醇(HPLC 级)、对苯醌(C6H4O2, 99%)、糠醇(C5H6O2, AR, 98%)、硫代硫酸钠(Na2S2O3, 99%)、氢氧化钠(NaOH, ACS, 97%)和盐酸(HCl, 分析纯)购自麦克林试剂有限公司, 甲醇(HPLC 级)购自阿拉丁试剂有限公司, 实验用水为超纯水。
在塑料锥形瓶中配置初始浓度为 1, 5, 10 和 50 mg/L 的 PFOA 溶液。反应体系为 100mL 微波消解罐(改性聚四氟乙烯 TFM 材质), 加入 15mLPFOA溶液, 并添加不同量的羟胺, 用 0.1mM HCl 或NaOH 溶液调节 pH 值。考虑到 TFM 材质对反应体系的影响, 设置空白对照组。然后, 将微波消解罐放入微波消解仪(ETHOS 1, Milestone Inc., 意大利)中开始反应。设置微波功率为 1200W, 设定不同的反应温度和反应时间。微波反应结束后, 冷却至室温, 用过量 Na2S2O3 淬灭, 用超高效液相色谱–串联三重四极杆质谱(UHPLC-MS/MS)测定化合物浓度。
采用 UHPLC-MS/MS (1260-6460A, 美国Agilent)检测 PFOA 和中间体。定量分析 PFOA 时, 采用电喷雾离子源, 负离子电离模式(ESI‾)和多重反应检测方式(MRM)。色谱柱为 Zorbax Eclipse Plus C18 (Rapid Resolution HD, 2.1 mm × 50 mm, 1.8 μm, 美国 Agilent), 柱温为 40°C。流动相为乙酸铵(5mM)水溶液(A)和 100%乙腈(B), 流速为 0.25mL/ min。梯度洗脱, 起始时 A 相比例为 95%, 保持 1分钟; 1~8 分钟时, A 相比例线性地减少至 5%, 保持 7分钟; 15~15.2 分钟时, A 相比例线性地增加至 95%, 保持 0.8 分钟。采用自动进样, 进样量为 5μL。PFOA中间体通过 UHPLC-MS/MS 全扫描模式检测, A 相为90%, B 相为 10%, 进样量为 5 μL。
2.1.1羟胺浓度
为了研究羟胺添加量对 PFOA 降解的影响, 设置羟胺初始浓度分别为 0, 0.2, 0.4, 0.6, 0.8, 1.0 和1.2mM, 考察在反应温度为 200°C, pH=3.92 的条件下 50mg/LPFOA 溶液降解效率的变化, 结果如图1(a)所示。微波加热 6 分钟后, 0, 0.2, 0.4, 0.6, 0.8, 1.0 和 1.2mM 的羟胺对 PFOA 的降解效率分别为0.24%, 0.34%, 4.22%, 27.41%, 46.29%, 82.22%和85.09%。根据实验结果, PFOA 的降解效率随羟胺浓度升高而升高。当羟胺浓度为 0mM 时, 羟胺对PFOA 的去除效率为 0.24%。当羟胺浓度为 1.0mM时, 羟胺对 PFOA 的去除效率为 82.22%。这可能是由于随着羟胺浓度的增加, 微波活化羟胺产生的自由基浓度增加, 单位时间内有更多自由基参与反应, 从而促进 PFOA 的降解。当羟胺浓度增加到 1.2mM后, PFOA 的降解效率略有增加。为了节约成本, 后续实验选择羟胺浓度为 1.0 mM。
2.1.2 PFOA浓度
PFOA 的降解效率也受到 PFOA 初始浓度的影响。设置反应体系初始 PFOA 浓度分别为 1, 5, 10和 50mg/L, 考察在羟胺浓度为 1.0mM, 反应温度为 200°C 和 pH=3.92 条件下 PFOA 溶液降解效率的变化, 结果如图 1(b)所示。微波加热 6 分钟后, 初始浓度从低到高的 PFOA 降解率分别为 89.51%, 86.62%, 85.35%和 82.22%。这说明, 随着 PFOA 初始浓度增加, 降解单位质量 PFOA 消耗的羟胺增加, 同时水溶液中产生的中间产物浓度增加, 降解中间产物进一步消耗羟胺, 导致羟胺对 PFOA 的降解效率降低。当羟胺浓度为 1.0mM 时, PFOA 初始浓度为 50mg/L 的降解效率仍能达到82.22%。此时羟胺与 PFOA 的摩尔比接近 10:1, 羟胺的浓度仍远大于 PFOA 的浓度, 1.0mM 羟胺浓度足够降解 50mg/L的 PFOA。为了充分且有效地利用羟胺, 后续实验中选择 PFOA 初始浓度为 50mg/L。

(a)羟胺浓度, (b)PFOA浓度, (c)反应温度, (d)反应时间, (e)pH, (f)自由基淬灭剂
图1 不同条件对微波辅助羟胺降解PFOA的影响
Fig. 1 Effects of different conditions on PFOA degradation by microwave assisted hydroxylamine reduction
2.1.3反应温度
反应温度对 PFOA 的降解效率有关键性的影响。分别设置反应体系温度为 170, 180, 190, 200和 210°C, 考察在羟胺浓度为 1.0mM, 反应时间为6 分钟和pH=3.92 条件下 ,50mg/LPFOA 溶液降解效率的变化, 结果如图 1(c)所示。反应温度从低到高, PFOA 降解率分别为 9.20%, 23.52%, 45.64%, 76.37%和 80.72%。随着反应温度增加, 微波加热提供给该体系的能量增加, PFOA 的降解效率增加。当反应温度为 200°C 时, PFOA 的降解效率达到76.37%。当反应温度继续增加时, 该体系对温度的利用效率下降, 导致耗能浪费。因此, 200°C 为最佳反应温度。
2.1.4反应时间
反应时间是影响 PFOA 降解效率的因素之一。分别设置反应时间为 0, 2, 4, 6 和 8 分钟, 考察在羟胺浓度为 1.0mM, 反应温度为 200°C 和 pH=3.92 条件下 50mg/L 的 PFOA 溶液降解效率的变化, 根据一级反应动力学方程(式(1))进行拟合, 结果如图 1(d)所示: kobs=0.203min−1, R2=0.966>0.95, 拟合度较好, 符合一级反应动力学。
Ln(Ct/C0) = −kobs t + b, (1)
其中, kobs 为表观速率常数, Ct 和 C0 分别为 PFOA在 t时的浓度和初始浓度。
2.1.5 pH值
在室温下, 分别设置反应体系 pH 为 3.0, 4.0, 5.0, 7.0 和 9.0, 考察在羟胺浓度为 1.0mM, 反应温度为 200°C 条件下 50mg/LPFOA 溶液降解效率的变化, 结果如图 1(e)所示。当反应时间为 6 分钟时, pH 从低到高的各反应体系对 PFOA 的降解率分别为 63.85%, 82.83%, 50.68%, 41.99%和 4.63%。反应体系 pH = 4.0 时, PFOA 降解效果最佳。当羟胺添加量为 1.0mM 时, 不调节 pH 的反应体系 pH 为3.92, 因此该反应体系在最佳反应条件时无需额外调节 pH, 利于工业化应用时降低成本。当反应体系 pH < 4.0 时, PFOA 降解效率下降, 这是因为溶液的pH 对 O2•-的歧化速率有较大的影响。在酸性条件下, O2•-更容易变成 H2O2, 而 H2O2 对 PFOA 的攻击能力较低, 导致降解率较低[21–22]。当反应体系pH > 4.0 时, PFOA 降解效率随着 pH 的增加而下降, 这是因为 pH 影响羟胺(NH3OH+, NH2OH 和 NH2O−)的形态[17], 从而影响电子转移效率。pH < 6 时, 以NH3OH+为主; 初始 pH > 6.0 时, NH2OH 含量增加; pH = 9.0时, NH2OH 几乎是唯一的形态。NH2OH 还原 O2•-的反应速率比 NH3OH+快, 容易消耗 O2•-[17]。实验结果说明, 羟胺在酸性条件下降解 PFOA, 能达到较好的降解率。
2.2.1活性基团淬灭剂对微波辅助羟胺降解 PFOA的影响
为探究 PFOA 的降解机理, 实验中分别采用 1M 甲醇(Meth)、0.2M 对苯醌(BQ)和 1M 糠醇(FFA)作为羟基自由基(•OH)、超氧阴离子自由基(O2•−)和单线态氧(1O2)的淬灭剂[17,23], 考察羟胺浓度为1.0mM, 反应温度为 200°C, 反应时间为 6 分钟和pH=3.92 条件下 50mg/LPFOA 溶液降解效率的变化, 结果如图 1(f)所示。反应结束后, PFOA 的降解率在加入甲醇、对苯醌、糠醇和无淬灭剂条件下分别为86.67%, 37.47%, 87.03%和 85.09%。该结果表明, 与无淬灭剂的对照组相比, 加入甲醇和糠醇的反应组降解效率无明显差异, 说明反应体系中没有•OH 和 1O2参与 PFOA 的降解。与无淬灭剂的对照组相比, 加入对苯醌的反应组明显抑制了 PFOA 的降解, 说明该反应体系中 O2•−为参与 PFOA 降解的主要活性物质。
2.2.2微波辅助羟胺降解 PFOA 的机理
微波透过反应器壁均匀地加热反应体系, 反应体系中的羟胺在微波加热条件下选择性地吸收微波能量, 产生“火锅”效应[20], 促进羟胺还原 O2 产生 O2•− [21,24], 如式(2)~(4)所示:
NH2OH + O2 → NH2O•+ H+ + O2•−, (2)
NH2OH + O2•−+ H+ → NH2O•+ H2O2 , (3)
2NH2O• → N2 + 2H2O。 (4)
O2•−提供一个电子参与反应[25–26], 通过攻击 PFOA上的羧基, 导致化学键的断裂, 从而生成短链全氟羧酸[27–28], 最终降解为 CO2, HF 和 H2O 等。利用微波加热辅助羟胺降解 PFOA, 可以缩短反应时间, 提高降解效率。在 PFOA 降解过程中, 在 UHPLC-MS/MS 全扫描模式下, 检测出 5 种中间降解产物(P1, P2, P3, P4和P5), 结果见表1。
基于表 1 提出的合理降解路径如图 2 所示。PFOA 上的羧基(-COOH)官能团容易被攻击[29–30], -COOH 被 O2•−攻击, 导致 C—O 键断裂脱羟基(-OH)。-COOH 脱-OH 后不稳定, 继续断裂脱 C== O, 生成全氟烷基(C7F15•)。C7F15•与 H2O/O2 反应, 生成不稳定的全氟庚醇(C7F15OH), 脱 HF, 生成 C6F13COF。C6F13COF 通过水解反应, 进一步转化为全氟庚酸C6F13COOH (PFHpA)。PFHpA 继续重复该循环, 逐步脱除 CF2, 最终降解为 F-和 CO2。
表1 反应过程中检出的PFOA降解产物
Table 1 Detected PFOA degradation products during the reaction

可能物质m/z ([M+H]+)结构式分子式 PFOA415C8HF15O2 P1397C8HF15O P2371C7HF15 P3281C6H2F10O P4135C2HF5O P5119C2HF5
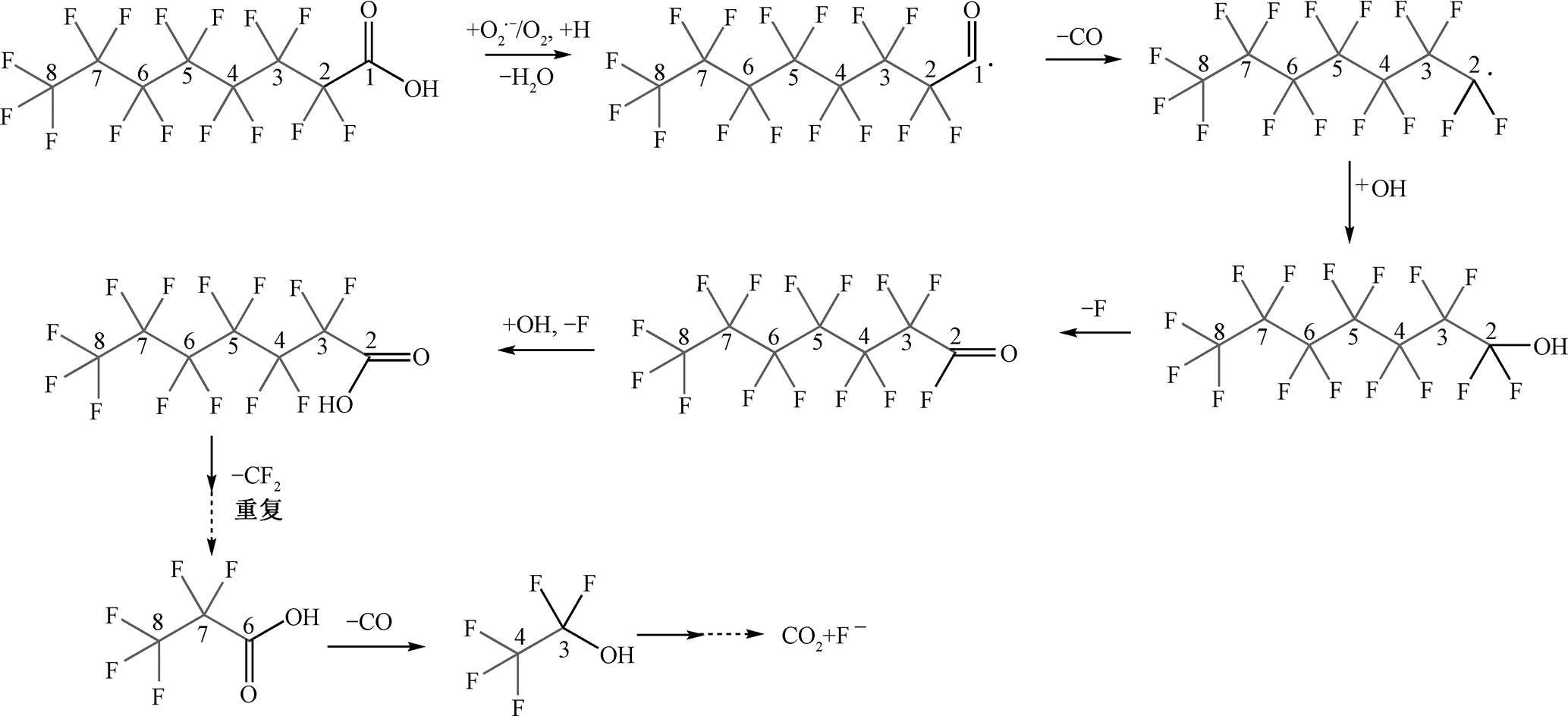
图2 微波辅助羟胺降解PFOA的路径
Fig. 2 Pathway of PFOA degradation by microwave assisted hydroxylamine reduction
1)通过微波加热辅助羟胺降解 PFOA, 实现PFOA 的快速高效降解。在反应 6 分钟后, 对 PFOA的降解效率达到 82.22%。
2)通过自由基淬灭实验, 得到羟胺降解 PFOA的主要活性物质为 O2•−。O2•−对 PFOA 的断链分解起决定性作用。
3)O2•−先攻击 PFOA 中的-COOH 官能团, 导致C—O 键断裂脱-OH。该中间产物不稳定, 继续断裂, 逐步脱除 CF2, 最终降解为 F-和 CO2。微波加热辅助羟胺降解 PFOA 工艺可为开发新型持久性有机污染物处理技术提供理论依据。
参考文献
[1] Krafft M P, Riess J G. Selected physicochemical aspects of poly- and perfluoroalkylated substances relevant to performance, environment and sustaina-bility — Part one. Chemosphere, 2015, 129: 4–19
[2] Liu B, Zhang H, Yao D, et al. Perfluorinated com-pounds (PFCs) in the atmosphere of Shenzhen, China: spatial distribution, sources and health risk assess-ment. Chemosphere, 2015, 138: 511–518
[3] Jian JM, Guo Y, Zeng L, et al. Global distribution of perfluorochemicals (PFCs) in potential human expo-sure source — a review. Environment International, 2017, 108: 51–62
[4] Tian Z, Kim SK, Shoeib M, et al. Human exposure to per- and polyfluoroalkyl substances (PFASs) via house dust in Korea: implication to exposure pathway. Science of the Total Environment, 2016, 553: 266–275
[5] Lohmann R, Jurado E, Dijkstra H A, et al. Vertical eddy diffusion as a key mechanism for removing per-fluorooctanoic acid (PFOA) from the global surface oceans. Environmental Pollution, 2013, 179: 88–94
[6] Zhang D, Zhang W, Liang Y. Distribution of eight perfluoroalkyl acids in plant-soil-water systems and their effect on the soil microbial community. Science of the Total Environment, 2019, 697: 134146
[7] Hamid H, Li L Y. Fate of perfluorooctanoic acid (PFOA) in sewage sludge during microwave-assisted persulfate oxidation treatment. Environmental Science and Pollution Research, 2018, 25(10): 10126–10134
[8] Zhan J, Zhang A, Heroux P, et al. Remediation of perfluorooctanoic acid (PFOA) polluted soil using pulsed corona discharge plasma. Journal of Hazardous Materials, 2020, 387: 121688
[9] Ibrahim W N W, Tofighi R, Onishchenko N, et al. Per-fluorooctane sulfonate induces neuronal and oligoden-drocytic differentiation in neural stem cells and alters the expression of PPAR gamma in vitro and in vivo. Toxicology and Applied Pharmacology, 2013, 269(1): 51–60
[10] Xu B, Zhou J L, Altaee A, et al. Improved photoca-talysis of perfluorooctanoic acid in water and waste-water by Ga2O3/UV system assisted by peroxymo-nosulfate. Chemosphere, 2020, 239: 124722
[11] Liu S, Junaid M, Zhong W, et al. A sensitive method for simultaneous determination of 12 classes of per- and polyfluoroalkyl substances (PFASs) in ground-water by ultrahigh performance liquid chromatogra-phy coupled with quadrupole orbitrap high resolu- tion mass spectrometry. Chemosphere, 2020, 251: 126327
[12] Abudayyak M, Öztaş E, Özhan G. Assessment of perfluorooctanoic acid toxicity in pancreatic cells. Toxicology in Vitro, 2021, 72: 105077
[13] Yu J, Hu J, Tanaka S, et al. Perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) in sewage treatment plants. Water Research, 2009, 43(9): 2399–2408
[14] Arvaniti O S, Hwang Y, Andersen H R, et al. Reduc-tive degradation of perfluorinated compounds in wa-ter using Mg-aminoclay coated nanoscale zero valenti-ron. Chemical Engineering Journal, 2015, 262: 133–139
[15] Lee Y C, Chen Y P, Chen M J, et al. Reductive def-luorination of perfluorooctanoic acid by titanium (III) citrate with vitamin B-12 and copper nanopar-ticles. Journal of Hazardous Materials, 2017, 340: 336–343
[16] Yan J, Peng J, Lai L, et al. Activation CuFe2O4 by Hydroxylamine for oxidation of antibiotic sulfame-thoxazole. Environmental Science & Technology, 2018, 52(24): 14302–14310
[17] Li J, Wan Y J, Li Y J, et al. Surface Fe(III)/Fe(II) cycle promoted the degradation of atrazine by pero-xymonosulfate activation in the presence of hydro-xylamine. Applied Catalysis B: Environmental, 2019, 256: 117782
[18] da Silva-Rackov C K O, Lawal W A, Nfodzo P A, et al. Degradation of PFOA by hydrogen peroxide and persulfate activated by iron-modified diatomite. Applied Catalysis B: Environmental, 2016, 192: 253–259
[19] Mitchell S M, Ahmad M, Teel A L, et al. Degradation of perfluorooctanoic acid by reactive species gene-rated through catalyzed H2O2 propagation reactions. Environmental Science & Technology Letters, 2013, 1 (1): 117–121
[20] Li S, Zhang G, Zhang W, et al. Microwave enhanced Fenton-like process for degradation of perfluorooc-tanoic acid (PFOA) using Pb-BiFeO3/rGO as hetero-geneous catalyst. Chemical Engineering Journal, 2017, 326: 756–764
[21] Jones A M, Garg S, He D, et al. Superoxide-mediated formation and charging of silver nanoparticles. En-viron Sci Technol, 2011, 45(4): 1428–1434
[22] Fang G D, Dionysiou D D, Al-Abed S R, et al. Super-oxide radical driving the activation of persulfate by magnetite nanoparticles: implications for the degra-dation of PCBs. Applied Catalysis B: Environmental, 2013, 129: 325–332
[23] Zhang H, Liu X, Lin C, et al. Peroxymonosulfate activation by hydroxylamine-drinking water treatment residuals for the degradation of atrazine. Chemos-phere, 2019, 224: 689–697
[24] Choudhary V R, Jana P, Bhargava S K. Reduction of oxygen by hydroxylammonium salt or hydroxylamine over supported Au nanoparticles for in situ generation of hydrogen peroxide in aqueous or non-aqueous medium. Catalysis Communications, 2007, 8(5): 811–816
[25] Pan Y, Su H, Zhu Y, et al. CaO2 based Fenton-like reaction at neutral pH: Accelerated reduction of ferric species and production of superoxide radicals. Water Res, 2018, 145: 731–740
[26] Wang Q, Yang X Q, Qu D. In situ ESR spectro-electrochemical investigation of the superoxide anion radical during the electrochemical O2 reduction reac-tion in aprotic electrolyte. Carbon, 2013, 61: 336–341
[27] Wang J, Cao C, Zhang Y, et al. Underneath mecha-nisms into the super effective degradation of PFOA by BiOF nanosheets with tunable oxygen vacancies on exposed (101) facets. Applied Catalysis B: Envi-ronmental, 2021, 286: 119911
[28] Zhao B, Lv M, Zhou L. Photocatalytic degradation of perfluorooctanoic acid with β-Ga2O3 in anoxic aqueous solution. Journal of Environmental Sciences, 2012, 24(4): 774–780
[29] Li F, Wei Z, He K, et al. A concentrate-and-destroy technique for degradation of perfluorooctanoic acid in water using a new adsorptive photocatalyst. Water Res, 2020, 185: 116219
[30] Zhang W, Zhang D, Liang Y. Nanotechnology in remediation of water contaminated by poly- and per-fluoroalkyl substances: a review. Environmental Pol-lution, 2019, 247: 266–276
Microwave Assisted Degradation of Perfluorooctanoic Acid by Hydroxylamine
Abstract Microwave assisted hydroxylamine technology was used to achieve rapid and efficient degradation of perfluorooctanoic acid (PFOA). The degradation efficiency of PFOA (50 mg/L) reached 82.22% after 6 min of reaction when the microwave power, hydroxylamine concentration, reaction temperature and pH were 1200 W, 1.0 mM, 200°C and 3.92, respectively. The reaction system was uniformly heated by microwave through the reactor wall, and the hydroxylamine in the reaction system selectively absorbed microwave energy under microwave conditions, resulting in “hot pot” effect, which promoted the generation of free radicals and improved the degradation efficiency. The free radical quenching experiments showed that superoxide radical (O2•–) was the main active group for hydroxylamine to degrade PFOA. The O2•– first attacked the carboxyl functional group (-COOH) in PFOA, resulting in the fracture of C―O bond and loss of the hydroxyl group (-OH). After losing -OH, the remainder was unstable and continued to fracture and lose CF2 step by step, and was finally degraded into F–and CO2. Therefore, the PFOA degradation by microwave assisted hydroxylamine reduction provides a reference and theoretical basis for the treatment of emerging persistent organic pollutants.
Key words hydroxylamine; microwave; perfluorooctanoic acid (PFOA); superoxide radical (O2•–)
doi: 10.13209/j.0479-8023.2022.026
深圳市科技计划项目(JCYJ20200109140616774和GXWD20201231165807007-20200810165349001)资助
收稿日期: 2021-05-15;
修回日期: 2022-03-15