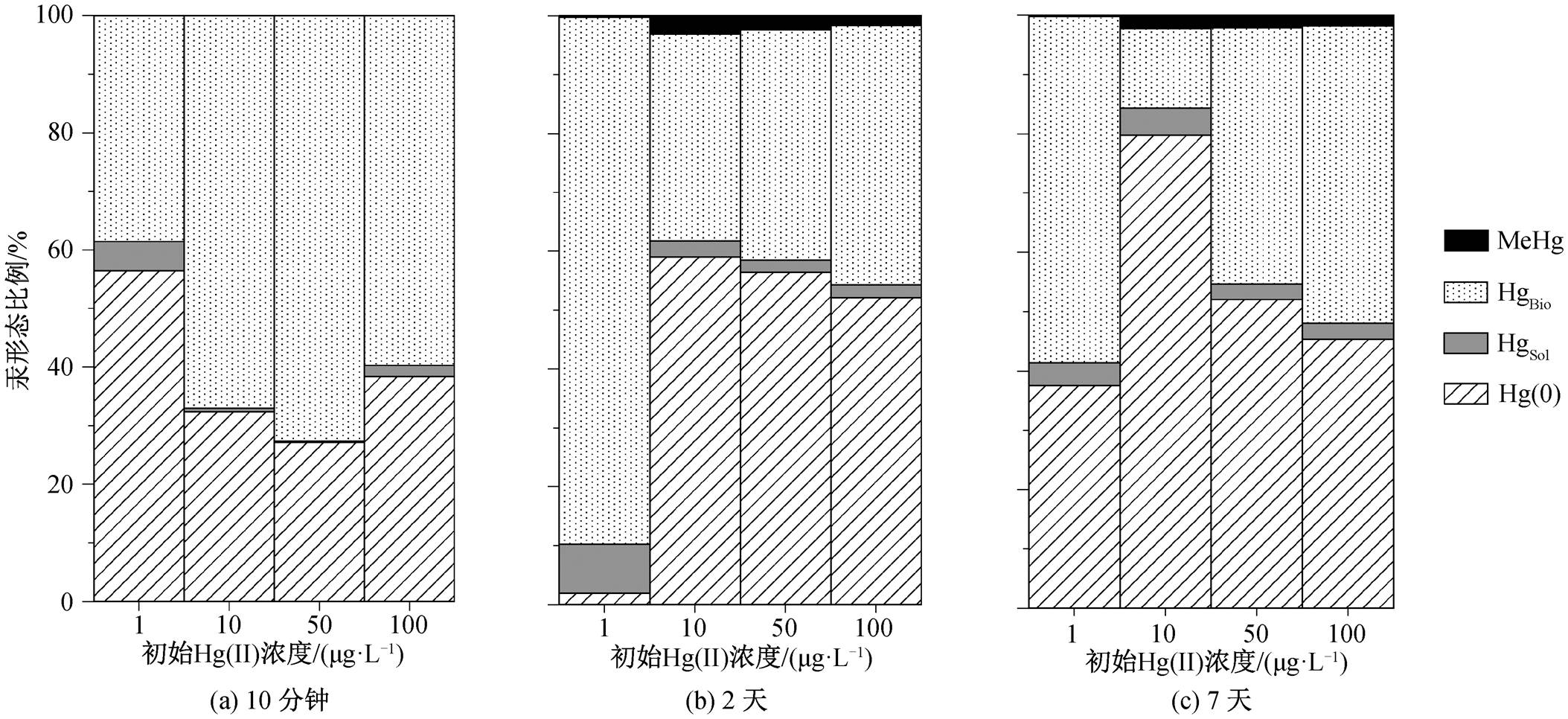
图1 添加不同浓度Hg(II)时PCA菌培养体系中汞的形态分布
Fig. 1 Species distribution of mercury with G. sulfurreducens PCA exposed to different initial concentrations of Hg(Ⅱ)
摘要 采用新兴的代谢组学技术, 筛选差异性细胞代谢物, 分析甲基汞生成和调控的关键代谢通路。在典型环境污染浓度(0~100μg/L) Hg(II)的胁迫下, 汞甲基化微生物 Geobacter sulfurreducens PCA 吸附/吸收的Hg(II)成为参与汞还原和甲基化的主要反应物质。初始 Hg(II)浓度为 10μg/L 时, G. sulfurreducens PCA 达到最高汞甲基化效率 3.09%±0.16%。代谢组学数据显示, Hg(II)胁迫对胞内的碳水化合物代谢、核苷酸代谢和氨基酸代谢造成干扰。为了应对 Hg(II)胁迫, G. sulfurreducens PCA 增大了对能量的需求, 用来调控汞生物甲基化反应, 并对受损 DNA 进行修复。
关键词 汞; Geobacter sulfurreducens PCA; 甲基化; 代谢组学
汞是一种全球性污染物, 能够随大气长距离迁移。在遥远的北极, 甚至检测到大量的汞污染[1–2]。汞污染在水体中的检测浓度通常为 ng~μg/L 水平, 在人类活动频繁区域的地表水中可达几百 μg/L[3–5]。全球汞污染来源于自然环境与人类活动[6]。据联合国环境规划署估计, 2015 年全球人为源大气汞排放约占大气汞排放总量的 30%[7]。环境中的汞主要以无机汞(Hg(0)、Hg(Ⅰ)和 Hg(Ⅱ))和有机汞形态存在, 汞的生态毒性与其形态密切相关[8], 有机汞的毒性远大于无机汞。其中, 甲基汞(methylmercury, MeHg)是最具毒性的汞形态。MeHg 具有很强的亲脂性和神经毒性, 易在食物链中富集, 可对人体神经系统造成永久性伤害[9]。自从日本暴发水俣病与伊拉克发生稻米中毒事件后, 人们对 MeHg 的生态毒理效应及其生物地球化学行为愈加关注。2013 年, 为了减少全球汞污染排放, 包括中国在内的 87 个国家签订了《水俣公约》。
在生物或非生物的作用下, MeHg 由 Hg(0)或Hg(Ⅱ)转化而成, 其中汞生物甲基化占主导地位。MeHg 生成与微生物活动以及 Hg(Ⅱ)的生物可利用率密切相关, 且随环境的不同而异[10]。地表水中MeHg 占总汞(total mercury, THg)的 0.1%~5%, 在缺氧水体中 MeHg 占比则较高, 可能是有机汞的主要存在形式[11]。据此推测, 汞甲基化过程主要依赖于厌氧微生物。硫酸盐还原菌、铁还原菌和产甲烷菌是汞甲基化的功能微生物[12]。特别地, 铁还原菌Geobacter sulfurreducens PCA (PCA 菌)不仅能够将Hg(Ⅱ)转化为 MeHg, 还能够将 Hg(Ⅱ)还原为Hg(0)[13–14]。目前, PCA 菌已被作为一种模式微生物应用于汞甲基化研究中。2013 年, Parks 等[15]首次报道汞甲基化调控基因簇 hgcA 和 hgcB。该基因簇存在于所有已测序的汞甲基化微生物中, 假定可能存在共同的 MeHg 生成途径。然而, 参与并调控汞生物甲基化过程的关键物质仍属未知。
代谢组学以小分子代谢物为研究对象, 能够表征在内外因素影响下生物体内代谢组所发生的微小变化[16]。与基因组和蛋白组学等其他组学方法相比, 代谢组学具有代谢物种类少、与生物表现型直接相关以及没有物种应用限制等独特的优势, 近年来广泛应用于生物医药工程、微生物学和环境科学等研究领域[17–24]。代谢组学能够检测并识别一系列代谢物, 这些代谢物在细胞信号释放、能量传递和细胞间通信等过程中发挥作用[25]。因此, 代谢组学能够在分子层面解释外部环境对生物胞内代谢的影响机制。通过代谢组学技术发掘的生物标记物, 能够在生态风险评估中反映环境的健康程度。目前, 关于汞甲基化微生物的代谢组研究尚未见报道。
本研究首次利用代谢组学技术, 以 PCA 菌为模式汞甲基化微生物, 在重金属 Hg(II)的胁迫下, 针对 MeHg 生成和 PCA 菌代谢组的变化关联, 推测与汞生物甲基化相关的胞内代谢途径。进而, 从代谢物的分子层面探讨微生物抵御汞污染胁迫的响应机制, 为汞污染及其生态风险控制提供科学支撑。
1.1.1细菌培养基
实验中选用的 PCA 菌来自中国科学院广州能源研究所, 使用 NBF 培养基在厌氧培养瓶中进行培养: 称取 4.64g 富马酸于烧杯中, 加入 700~800mL超纯水, 用 NaOH 溶液将 pH 调至 6.5~7.0, 使富马酸完全溶解。称量并加入 0.03gCaCl2, 0.10gMgSO4·7H2O, 1.80gNaHCO3, 0.43g Na2CO3 和1.23g NaAC, 搅拌至完全溶解, 分别加入 10mL 100Í NB Salts 储备液(1L中包含42gKH2PO4, 22gK2HPO4, 20 gNH4Cl, 38gKCl 和 36gNaCl), 10mLNB Mineral Elixir 储备液(1L中包含2.14g 氨三乙酸, 0.1gMnCl2·4H2O, 0.3gFeSO4·7H2O, 0.17gCoCl2·6H2O, 0.2gZnSO4·7H2O, 0.03gCuCl2·2H2O, 0.005gH3BO3, 0.09gNa2MoO4·2H2O, 0.11gNiSO4·6H2O 和 0.02gNa2WO4·2H2O)和 15mLDL Vitamins 储备液(1L 中包含 0.002g 生物素、0.005g 泛酸、0.0001g 维生素B12、0.005g 对氨基苯甲酸、0.005g 硫辛酸、0.005g 烟酸、0.005g 盐酸硫胺、0.005g 核黄素、0.01g盐酸吡哆醇和 0.002g 叶酸)以及 1mL 的 1mM Na2SeO4 溶液。用超纯水定容至 1L, 分装于 200mL厌氧瓶中, 用混合气 N2: CO2=8:2 (v/v)除氧 1小时, 密封, 高温灭菌(121℃, 20分钟)。PCA 菌在水浴恒温摇床中恒温(35℃)、避光培养。
1.1.2实验体系
本研究采用 100mL 磷酸盐缓冲液(Phosphate buffer saline, PBS)作为实验体系。在 PBS 溶液(2 nM KH2PO4, 10 nM Na2HPO4, 0.14 M NaCl和 3nM KCl)中加入 40mM 电子受体富马酸和 20mM 电子供体乙酸钠, pH 控制在 7.2~7.4。将 PBS 培养基分装于 200mL 厌氧瓶中, 用混合气 N2:CO2=8:2 (v/v)除氧 1小时, 密封, 高温灭菌(121℃, 20 分钟)。将在 NBF 培养基中生长至对数末期的菌液以 4500rpm 离心 10分钟 后, 弃去上清液, 将细胞再悬浮于PBS 溶液中清洗, 再离心, 重复操作 3 次。将清洗完成的细胞再悬浮于 PBS 溶液中, 即为浓缩菌液。将浓缩菌液注入 PBS 培养基, 使细胞的初始 OD600值为 0.45~0.55。
设置 1 个空白组和 4 个实验组(汞的浓度梯度为1, 10, 50 和 100μg/L), 每组设置 6 个平行实验。空白组由 95mL PBS 培养基与 5mL 浓缩菌液组成, 实验组由 94mL PBS 培养基、5mL 浓缩菌液和 1mL 汞标准溶液组成。
1.2.1总汞与甲基汞检测
取菌液过 0.22μm 聚醚砜滤膜, 取 1mL 滤液, 用重量法稀释, 加入 0.4% HCl (v/v), 于 4℃保存, 待测溶液中总汞(Hg(II)Sol)和 MeHg。取 1mL 菌液于消解管中, 加入 2mL 硝酸, 在 95℃水浴中消解6~8 小时, 取 1mL 消解液, 用重量法稀释, 于 4℃保存待测消解 THg。
采用(气相)冷蒸气–原子荧光光谱测汞仪(Total Mercury Manual System model III, Brooks Rand Labs, 美国)检测 THg 和 MeHg 浓度。THg 样品在检测前需加入 0.5%(v/v) BrCl 溶液, 反应 24 小时 后, 加入 0.5%(v/v)NH2OH·HCl 溶液, 以除去过量 BrCl, 再加入 SnCl2 溶液, 将 Hg(II)还原为 Hg(0), 吹扫至金砂管上富集并检测。MeHg 样品需经过蒸馏和乙基化, 再吹扫至 Tenax 管上富集并检测。
经过 PCA 菌还原生成的 Hg(0)通过汞的投加浓度减去检测 THg 值得出, PCA 菌的吸附/吸收总汞(Hg(II)Bio)通过 THg 减去 Hg(II)Sol 得出, 汞甲基化率为MeHg浓度与汞的投加浓度之比。
1.2.2细菌胞内代谢物提取与检测
在实验开始后第 2 天取代谢组学样品: 取 10 mL 菌液, 在 4℃和 4500rpm 下离心 10分钟, 弃去上清液。加入 10mL 除氧超纯水, 清洗细菌, 再次离心, 弃去上清液。重复该清洗步骤 3 遍, 冷冻干12小时。加入 0.5mL 80%的含内标的甲醇水溶液, 在细胞破碎仪中破碎, 再将浆液涡旋震荡 20 分钟, −20℃过夜沉淀蛋白, 在 4℃和 15000rpm 下高速离心 10 分钟, 取上清液于−80℃保存待测。每个样品取 30 μL混合成质量控制(quality control, QC)样本。
采用超高效液相色谱(Waters ACQUITY UPLC, 美国)与质谱(ABI Q-Trap 5500, AB SCIEX, 美国)联用检测样品的代谢物特征。获得的数据经过峰提取、峰校正以及内标校正等前处理, 用于代谢物的匹配与识别。
代谢组学数据前处理流程包括缺失值的删除与替代、过滤、Pareto 归一化和 Log 转换。前处理后, 用 SIMCA-P 14.1 (Umetrics)软件对数据进行多变量分析, 包括无监督的分类模型主成分分析(principal component analysis, PCA)和有监督的分类模型正交偏最小二乘法判别分析(orthogonal partial lear squares discriminant analysis, OPLS-DA), 并用线上代谢组学分析软件 MetaboAnalyst (https://www.metaboanal yst.ca/)进行独立样本 t 检验, 筛选出 OPLS-DA 模型中 VIP 值(variable importance in the projection)>1, 以及 t 检验中 p 值(经过 FDR 校正)<0.05 的代谢特征作为差异性代谢物, 在MetaboAnalyst 平台上进行代谢通路富集分析。
PCA 菌具有同时进行汞还原、汞吸附和汞甲基化的能力(图 1)。向 PCA 菌培养体系中添加 1, 10, 50 和 100μg/L Hg(Ⅱ)后, 菌体细胞在 10 分钟 内大量吸附 Hg(Ⅱ), 约 40%~70%的汞以 Hg(II)Bio 形式存在, 成为细胞内参与汞还原和甲基化的主要反应物质。同时, PCA 细胞将 Hg(II)Bio 快速地还原成 Hg(0), Hg(0)的比例可达 30%~60%。该过程通过细胞膜表面的功能蛋白转移电子即可实现[26–27], 无需能量, 导致 Hg(Ⅱ)还原速率远大于甲基化速率。当添加Hg(Ⅱ)浓度低至 1μg/L 时, PCA 菌的汞甲基化率仅为 0.2%左右。当添加 Hg(Ⅱ)浓度升高至 10μg/L 时, 汞生物甲基化率大幅度提升, 在第 2天时达到3.09%±0.16%。当添加Hg(Ⅱ)浓度继续升高至 50 和100μg/L 时, 7 天内的 MeHg 净产量可达 1189.80± 149.95 和 1875.37±242.32ng/L, 但汞生物甲基化率下降至 2%左右。在高浓度 Hg(II)底物条件下, PCA菌的汞甲基化能力成为限制因素[28]。有研究表明, 在汞污染严重的环境中, 汞甲基化率未见显著升高[29–32]。此外, 汞生物甲基化为细胞的耗能反应[27]主要发生在细胞生长阶段, 稳定和衰亡期细胞容易发生去甲基化[33]。本研究中, PCA 菌在前 2天 处于生长期, MeHg 生成较迅速; 随后细菌逐渐衰亡, 去甲基化反应逐渐加强; 第 7天末, 较高浓度 Hg(II)胁迫组的 PCA 菌净 MeHg 产率下降。进一步地, 细菌对 MeHg 的吸附与积累可能会抑制汞生物甲基化速率[34]。Lu 等[35]也发现, 在 25nM Hg(Ⅱ)的胁迫作用下, 由于存在去甲基化作用, Geobacter bemidjiensisBem 的 MeHg 产量在达到最大值后逐渐下降。综上所述, Hg(II)Bio 是主要的可生物利用形态。在初始Hg(Ⅱ)浓度为 10μg/L条件下, PCA 菌能够更充分地利用外源 Hg(Ⅱ)进行汞生物甲基化, 达到较高的MeHg 转化率。

图1 添加不同浓度Hg(II)时PCA菌培养体系中汞的形态分布
Fig. 1 Species distribution of mercury with G. sulfurreducens PCA exposed to different initial concentrations of Hg(Ⅱ)
PCA 分析结果表明, 在正、负离子模式下, 质量控制样本可以较好地聚集在一起, 系统重复性好。此时, 所有样品都在 95%置信区间内, 无异常值。在此基础上, 进行汞胁迫对 PCA 菌细胞代谢组的影响研究。在低、中、高浓度 Hg(II)胁迫下, 分别将各实验组与空白组进行 OPLS-DA 分析, 并对OPLS-DA 模型进行检验, 结果如图 2~4 所示。在 10μg/L Hg(Ⅱ)胁迫与空白组的 OPLS-DA 模型中, 正离子模式下的 R2Y和 Q2 分别为 0.995 和0.648, 负离子模式下分别为 0.995 和 0.790; 在 50μg/L Hg(Ⅱ)胁迫与空白组的 OPLS-DA 模型中, 正离子模式下的 R2Y 和 Q2 分别为 0.972 和 0.892, 负离子模式下分别为 0.968 和0.841; 在 100μg/L Hg(Ⅱ)胁迫与空白组的 OPLS-DA 模型中, 正离子模式下的 R2Y 和 Q2分别为 0.989和 0.925, 负离子模式下分别为 0.996和 0.966。所有的 OPLS-DA 模型均满足 R2Y 和 Q2 大于 0.5, 说明模型预测效果优良。200 次置换检验结果表明, Q2 点(深灰色正方形点)回归线与 Y 轴截距均小于 0, 说明模型没有过度拟合, 稳定可靠。
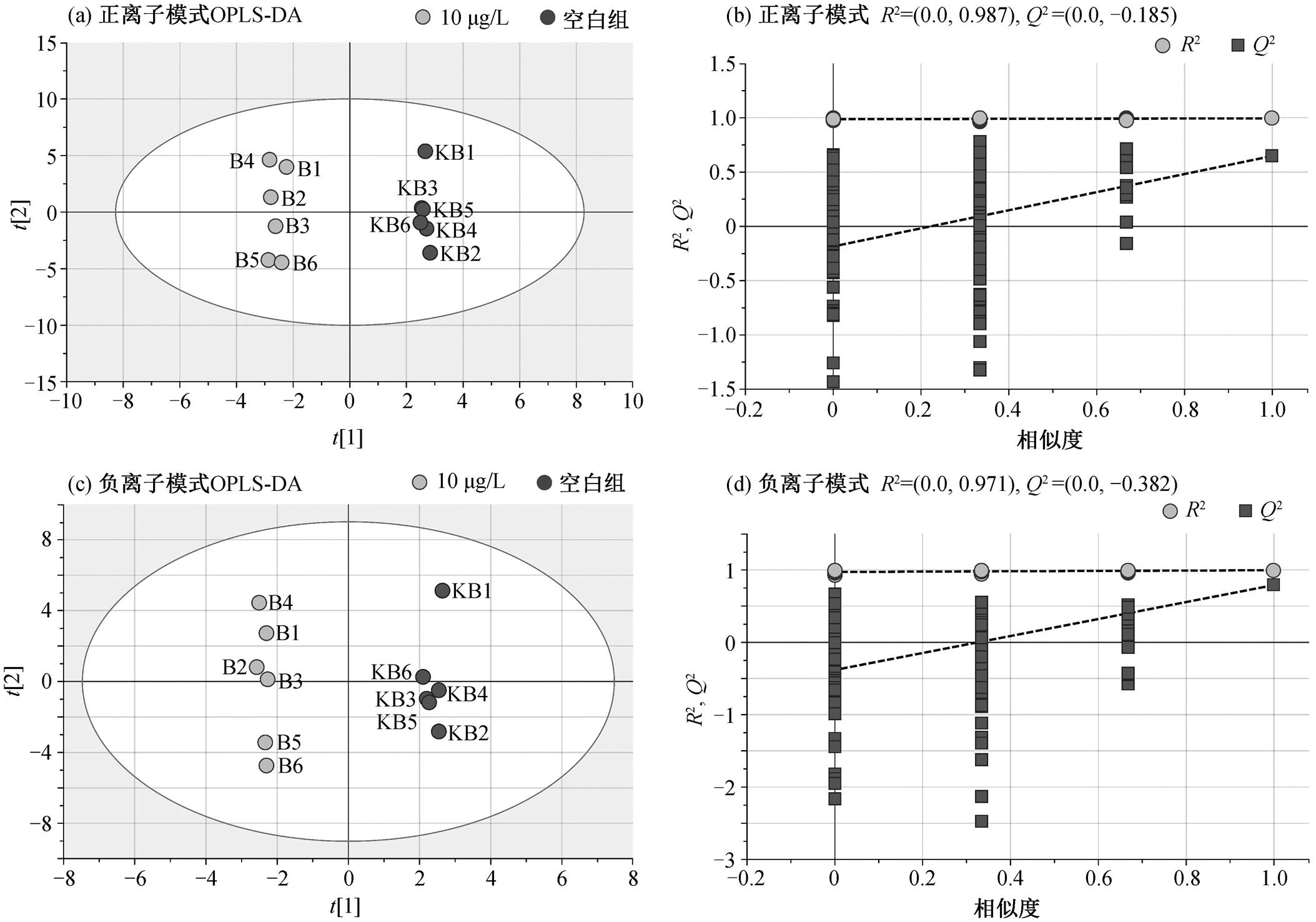
图2 低浓度组(10μg/LHg(Ⅱ))与空白组在正、负离子模式下的OPLS-DA散点图及各自的200次置换验证图
Fig. 2 OPLS-DA score plots and their 200 permutation plots in positive and negative modes under the stress of low Hg(Ⅱ) concentration of 10 μg/L
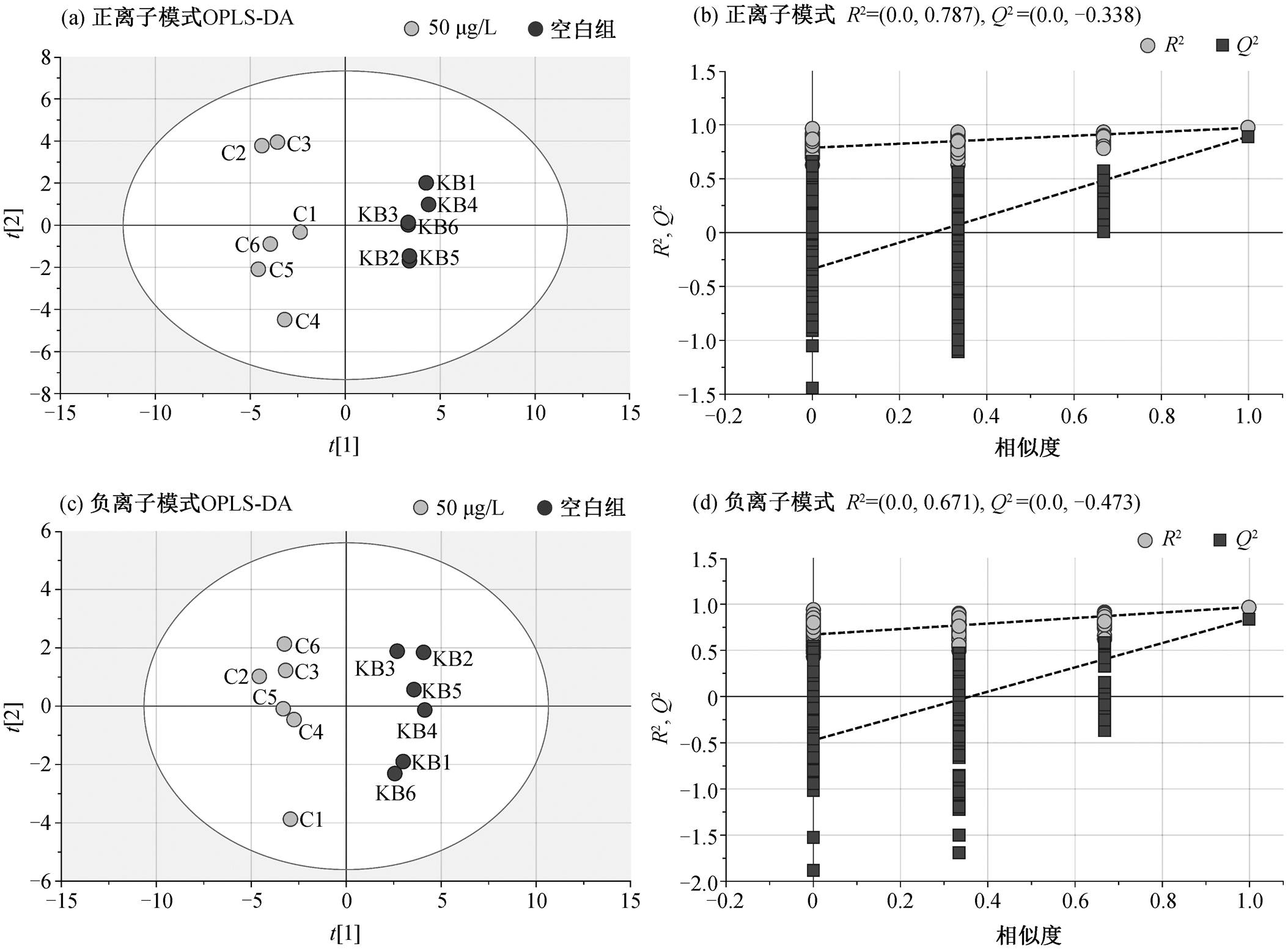
图3 中浓度组(50μg/LHg(Ⅱ))与空白组在正、负离子模式下的OPLS-DA散点图及各自的200次置换验证图
Fig. 3 OPLS-DA score plots and their 200 permutation plots in positive and negative modes under the stress of medium Hg(Ⅱ) concentration of 50 μg/L
结合 OPLS-DA 的 VIP 值>1 与独立样本 t 检验的 p<0.05, 筛选出差异性代谢特征, 其中 p 值经过FDR (false discovery rate)校正, 以降低假阳性[36]。共发现 375 个代谢特征, 包括正离子模式下 210 个和负离子模式下 165 个。1μg/L Hg(Ⅱ)胁迫未对PCA菌的代谢产生明显的影响, 与上述极低汞甲基化率相符。在 10μg/L Hg(II)胁迫组, 筛选出 10 个差异性代谢特征(正离子模式下 8 个, 负离子模式下 2 个),识别出 3 种代谢物; 在 50μg/L Hg(II)胁迫组, 筛选出 69 个差异性代谢特征(正离子模式下 35 个, 负离子模式下 34 个), 识别出 37 种代谢物; 在 100μg/L Hg(II)胁迫组, 筛选出 84 个差异性代谢特征(正离子模式下 44 个, 负离子模式下 40 个), 识别出 41 种代谢物。
如表 1 所示, 当受到 10μg/L Hg(Ⅱ)胁迫时, 细菌体内的差异性代谢物主要为脂肪酰胺与碳水化合物。当暴露于中、高浓度(50 和 100μg/L)Hg(Ⅱ)时, 细菌的差异性代谢物主要为脂质、核苷酸及其衍生物、氨基酸及其衍生物和碳水化合物等。
根据筛选出的差异性代谢物, 分析 PCA 细胞受到干预的代谢途径, 筛选出 p 值小于 0.05 和通路重要性(Pathway impact)大于 0.1 的代谢途径(图 5)。
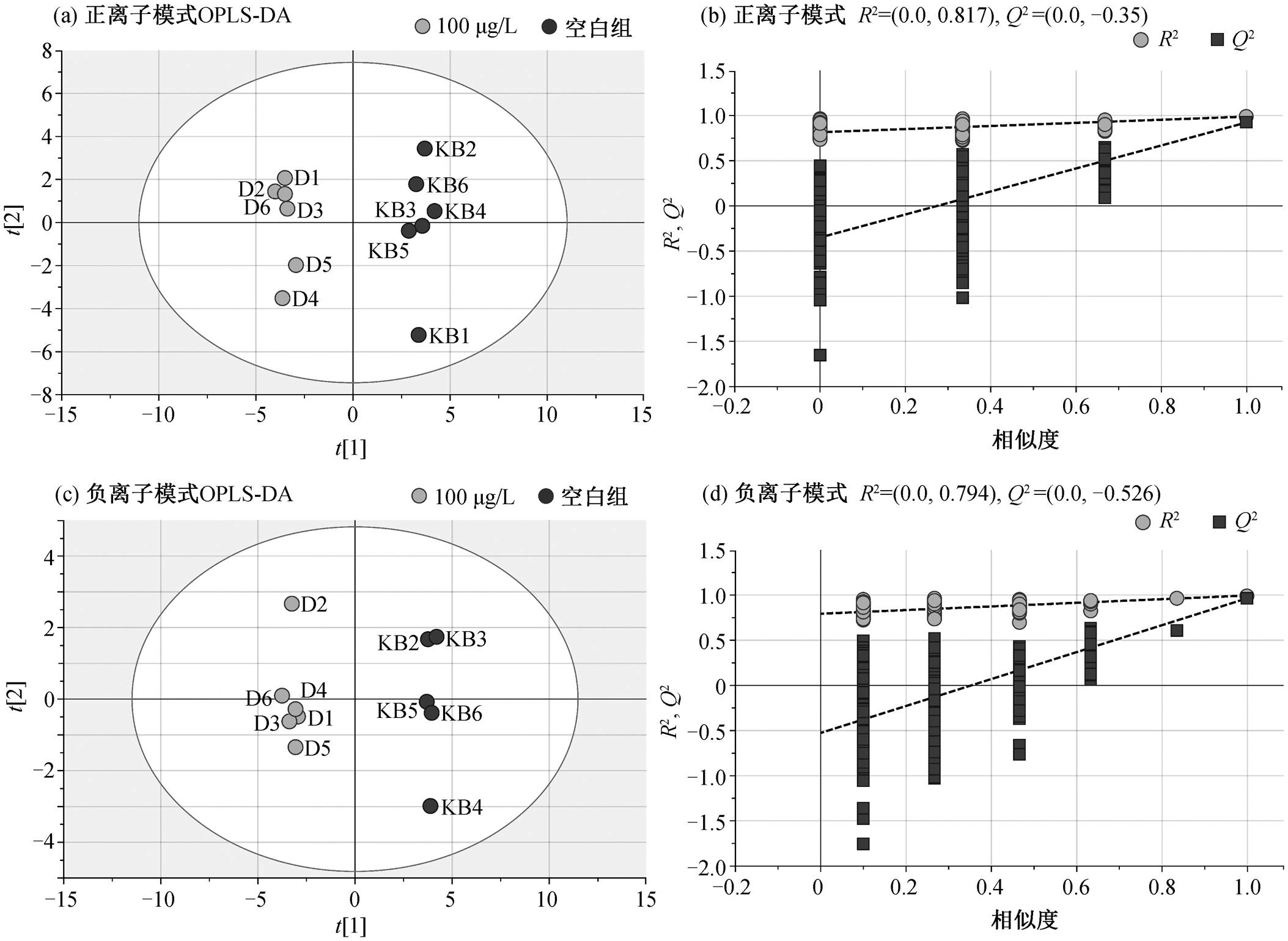
图4 高浓度组(100μg/LHg(Ⅱ))与空白组在正、负离子模式下的OPLS-DA散点图及各自的200次置换验证图
Fig. 4 OPLS-DA score plots and their 200 permutation plots in positive and negative modes under the stress of high Hg(Ⅱ) concentration of 100 μg/L
在 10μg/L Hg(Ⅱ)的胁迫下, 果糖与甘露糖代谢(fructose and mannose metabolism)和糖酵解(glycoly-sis/gluconeogenesis)是 PCA 菌受到干扰的主要代谢途径, 均属于碳水化合物代谢。差异性代谢物果糖-1,6-二磷酸(fructose 1,6-bisphosphate)是这两个代谢途径中的关键中间产物, 其含量显著上调, 差异倍数达到 3.59。兼性厌氧 PCA 菌在无氧条件下, 主要通过糖酵解来获取能量, 果糖-1,6-二磷酸和肌醇-1,3-二磷酸(D-myo-Inositol 1,3-bisphosphate)水平上调, 反映糖酵解被促进, 细胞产能增加。第 2 天时, PCA 菌生长被轻微促进, 汞甲基化率也达到峰值, 说明 10μg/LHg(Ⅱ)的胁迫促使细胞通过糖酵解产能, 用于自身繁殖和汞生物甲基化。在 50μg/LHg(Ⅱ)的胁迫下, 精氨酸生物合成(arginine biosynthesis), 丙氨酸、天冬氨酸和谷氨酸代谢(alanine, aspartate and glutamate metabolism), 嘌呤代谢( purine metabo-lism), 以及烟酸盐和烟酰胺的代谢(nicotinate and nicotinamide metabolism)是 PCA 菌受到干扰的主要代谢途径。在 100μg/L Hg(Ⅱ)的胁迫下, 淀粉与蔗糖代谢(starch and sucrose metabolism), 嘌呤代谢(purine metabolism), 磷酸戊糖途径(pentose phosphate pathway), 结氨酸、亮氨酸和异亮氨酸的代谢(valine, leucine and isoleucine metabolism)以及戊糖与葡萄糖醛酸的转换(pentose and glucuronate interconversions)是PCA 菌受到干扰的主要代谢途径。可见, 中、高浓度(50 和 100μg/L) Hg(Ⅱ)对PCA 菌的刺激会扰动碳水化合物代谢、氨基酸代谢和核苷酸代谢。在淀粉与蔗糖代谢中, 二磷酸尿苷葡糖(UDP-Glucose)与氨基糖和核苷酸糖代谢相关联, 其含量的显著变化可能影响氨基酸与核苷酸的代谢。
如图 6 所示, 当暴露于 Hg(Ⅱ)时, PCA 菌的胞内碳水化合物代谢途径中, 许多糖类及其衍生物的含量显著上调, 如糖酵解中间产物果糖-6-磷酸(Fructose 6-phosphate)、葡萄糖-6-磷酸(Glucose 6-phosphate)和果糖-1,6-二磷酸(Fructose 1,6-bispho-sphate)。同时, 磷酸戊糖途径中的 D-景天庚酮糖-7-磷酸(D-Sedoheptulose 7-phosphate)、D-核糖-5-磷酸(D-Ribose 5-phosphate)和甘油酸-3-磷酸(Glycerate 3-phosphate)水平上调, 糖类果糖(D-Fructose)和甘露糖(D-Mannose)水平下调。这些碳水化合物代谢中间产物含量的变化, 表明 Hg(Ⅱ)胁迫导致 PCA菌对能量需求的增加。当暴露于重金属时, 生物体的产能代谢响应灵敏[37], 为了减轻重金属的毒害作用, 生物体主要通过三羧酸(Tricarboxylic acid, TCA)循环和糖酵解等途径来满足自身的能量需求[38]。本研究中, Hg(Ⅱ)胁迫激活了 PCA 菌的汞甲基化作用, 体现了 PCA 菌对能量需求的增加。为了满足更高的能量需求, PCA 菌通过促进碳水化合物代谢来加快能量获取。ADP 与 AMP 水平升高, 说明随着更多的 ATP 被水解, 更多的能量被释放, 亦反映细菌能量消耗增大。
表1 添加不同浓度Hg(Ⅱ)时PCA菌体内的差异性代谢物
Table 1 Metabolites in G. sulfurreducens PCA exposed to different concentrations of Hg(Ⅱ)

Hg(Ⅱ)浓度/(μgL–1)模式代谢物差异倍数趋势Hg(Ⅱ)浓度/(μgL–1)模式代谢物差异倍数趋势 10+Docosanamide0.41↓100+Pyridoxal 5'-phosphate1.83↑ Erucamide0.42↓Phenylalanylphenylalanine0.11↓ ‒Fructose 1,6-bisphosphate3.59↑Leucylproline0.22↓ D-myo-Inositol 1,3-bisphosphate3.34↑L-Histidine0.36↓ 50+Docosanamide0.38↓L-Leucine0.64↓ Erucamide0.38↓L-Valine1.97↑ Palmitoleic acid1.67↑DL-Homocystine2.24↑ Palmitic amide1.56↑5'-Methylthioadenosine2.18↑ Palmitoylethanolamide0.52↓Cytidine 5'-monophosphate4.39↑ SM(d18:1/14:0)0.05↓Adenosine monophosphate (AMP)3.42↑ Serotonin4.52↑NAD4.21↑ Nicotinamide adenine dinucleotide (NAD)4.05↑Hypoxanthine2.15↑ 2-Methoxyestradiol3.27↑LysoPC(18:1(11Z)/0:0)0.57↓ Hypoxanthine3.29↑LysoPC(15:0/0:0)1.70↑ Citrulline3.48↑MG(18:0/0:0/0:0)1.73↑ L-Valine2.69↑Eicosapentaenoic acid0.37↓ L-Phenylalanine2.07↑5beta-Coprostanol0.39↓ DL-Homocystine4.75↑Dimethyl sulfone0.12↓ 4-Hydroxyproline2.09↑9,12-Hexadecadienoylcarnitine1.69↑ L-Lysine1.67↑Diisooctyl phthalate0.64↓ L-Glutamic acid2.61↑‒Fructose 1,6-bisphosphate6.83↑ ‒Behenic acid0.33↓6-Phosphonoglucono-D-lactone6.98↑ Erucic acid0.66↓D-Sedoheptulose 7-phosphate5.21↑ Fructose 1,6-bisphosphate7.19↑Fructose 6-phosphate8.60↑ Fructose 6-phosphate4.00↑Glucose 6-phosphate10.06↑ Glucose 6-phosphate4.12↑UDP-glucose4.08↑ Sucrose2.03↑D-Ribose 5-phosphate2.49↑ Glycerate 3-phosphate2.35↑D-Mannose0.31↓ Oxoglutaric acid1.82↑D-Fructose0.27↓ D-Ribose 5-phosphate2.98↑Glycerate 3-phosphate2.90↑ Pyridoxal 5'-phosphate3.84↑Oxoglutaric acid2.16↑ D-Sedoheptulose 7-phosphate2.22↑D-myo-Inositol-1,3-diphosphate6.31↑ D-myo-Inositol-1,3-diphosphate6.99↑Guanosine 5'-monophosphate4.19↑ Glycerol 3-phosphate3.35↑Uridine 5'-monophosphate7.69↑ Glycerone phosphate3.50↑Adenosine diphosphate (ADP)2.10↑ Fumaric acid1.71↑dGDP2.21↑ Carbamoyl phosphate3.17↑Inosinic acid2.51↑ Deoxyguanosine diphosphate (dGDP)2.09↑5-Hydroxymethyluracil2.71↑ Inosine13.14↑2-Ketobutyric acid1.96↑ Inosinic acid5.13↑Docosahexaenoic acid0.34↓ 2-Ketobutyric acid1.86↑Behenic acid0.26↓
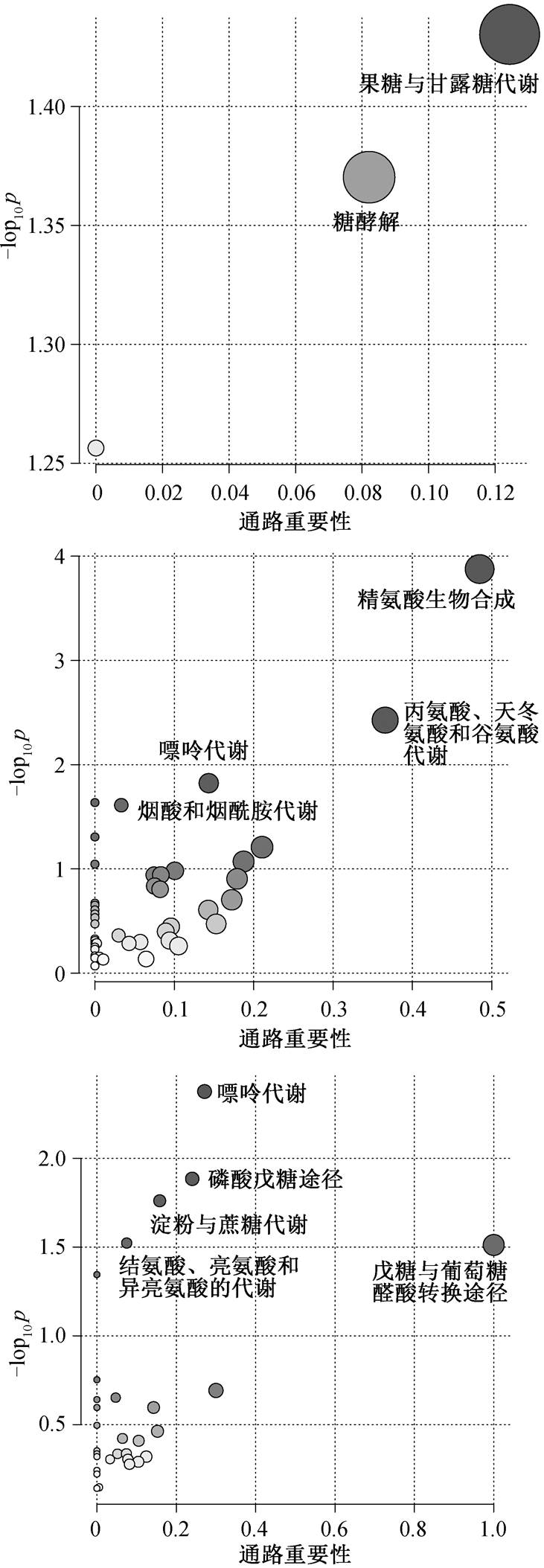
标注的代谢通路p<0.05。圆圈大小表示通路重要性, 越大通路重要性超强; 圆圈颜色越深表示p值越大
图5 添加10, 50和100 μg/L Hg(Ⅱ)时PCA菌的代谢通路富集分析
Fig. 5 Metabolic pathway enrichment analysis of G. sulfurreducens PCA exposed to 10, 50 and 100 μg/L Hg(Ⅱ)
此外, 鸟苷酸(GMP)、肌苷酸(IMP)和次黄嘌呤(Hypoxanthine)等涉及嘌呤代谢与嘧啶代谢。该类代谢物显著上调, 说明 Hg(Ⅱ)可能扰乱了 PCA菌的核苷酸代谢, 造成潜在的 DNA 损伤。当 DNA被损伤时, 生物会倾向于通过各种途径消除损伤或进行修复[39], 核苷酸及其衍生物水平的上升都可以反映该现象。氨基酸代谢是生物体内另一个重要的响应途径[40]。当暴露于中、高浓度的 Hg(Ⅱ)时, PCA 菌体内差异性代谢物中大部分的氨基酸含量都显著上调, 如瓜氨酸(Citrulline)、缬氨酸(L-Valine)和谷氨酸(L-Glutamic acid)等。一方面, 支链氨基酸(亮氨酸和缬氨酸)与生物体的蛋白质合成、产能、神经传递和免疫有关[41], 其含量变化能反映生物体对能量的额外需求[42];另一方面, 谷氨酸能够由谷氨酰胺转变而来, 在抵御氧化应激方面有重要作用[43]。谷氨酸波动反映生物体的氧化应激行为, 进而体现细菌的蛋白质合成和产能等活动被干扰。
综上所述, 当暴露于 Hg(Ⅱ)时, PCA 菌对能量的需求升高, 碳水化合物代谢、核苷酸代谢与氨基酸代谢途径有所波动。
本研究考察了汞污染胁迫对铁还原菌 G. sulfur-reducens PCA 汞甲基化和代谢组的影响, 主要结论如下。
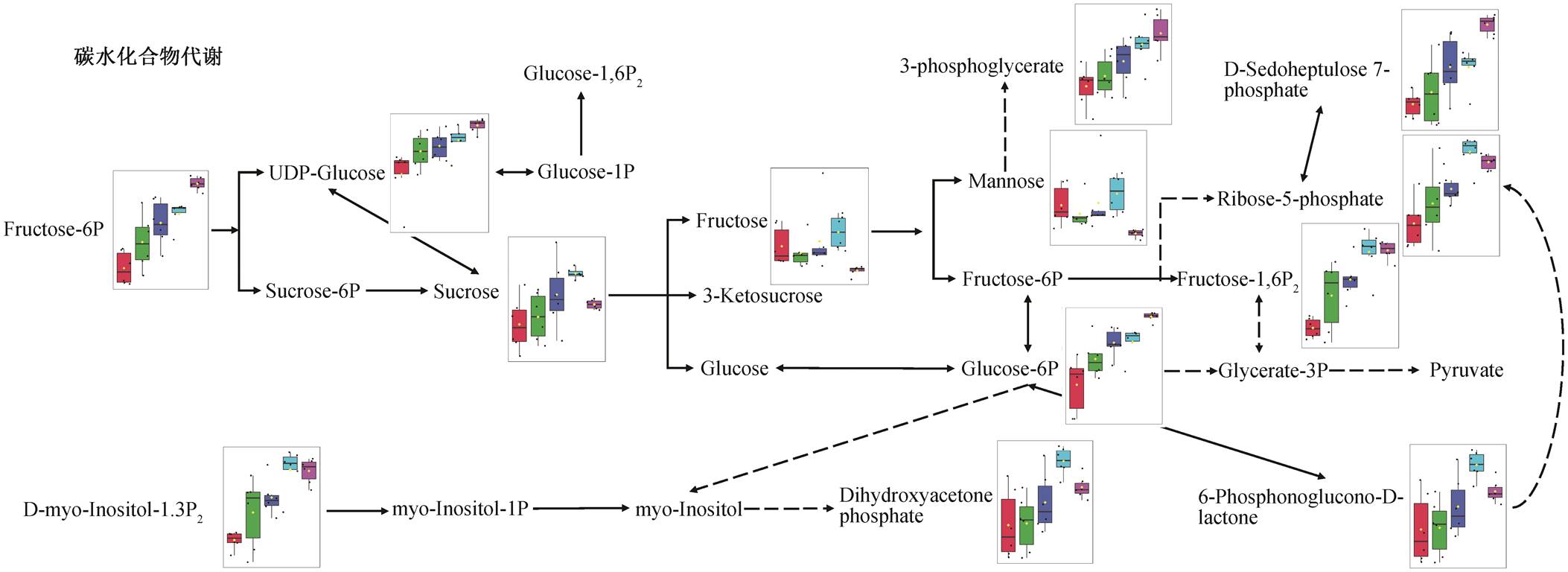
代谢物名称旁的箱型图表示该代谢物在各组的相对浓度, 箱型图横坐标从左到右分别为空白组和1, 10, 50和100 μg/L Hg(Ⅱ)组; 黑色的实线和虚线箭头分别表示直接和间接的途径
图6 Hg(Ⅱ)胁迫对PCA菌碳水化合物代谢的影响途径
Fig. 6 Effects of Hg(Ⅱ) on the carbohydrate metabolism in G. sulfurreducens PCA
1)在典型环境污染浓度(0~100μg/L)下, 吸附/吸收的 Hg(II)是 PCA 菌的主要利用形态, 汞生物甲基化率在初始 Hg(Ⅱ)浓度为 10μg/L 时达到最高值3.09%±0.16%。
2)Hg(Ⅱ)胁迫主要干扰 PCA 菌的碳水化合物代谢、核苷酸代谢和氨基酸代谢。
3)Hg(Ⅱ)胁迫会增加 PCA 菌对能量的需求, 激活汞生物甲基化作用。
4)Hg(Ⅱ)胁迫也会造成潜在的 DNA 损伤, 干扰蛋白质合成。
参考文献
[1] Douglas T A, Loseto L L, Macdonald R W, et al. The fate of mercury in Arctic terrestrial and aquatic eco-systems, a review. Environmental Chemistry, 2012, 9(4): 321–355
[2] Dietz R, Riget F, Born E W, et al. Trends in mercuryin hair of greenlandic polar bears (Ursus maritimus) during 1892–2001. Environmental Science and Tech-nology, 2006, 40(4): 1120–1125
[3] Coulibaly S, Atse B C, Koffi K M, et al. Seasonal accumulations of some heavy metal in water, sedi-ment and tissues of black-chinned tilapia Sarothe-rodon melanotheron from Bietri Bay in Ebrie Lagoon, Ivory Coast. Bulletin of Environmental Contamina-tion and Toxicology, 2012, 88(4): 571–576
[4] Churchill R C, Meathrel C E, Suter P J. A retrospec-tive assessment of gold mining in the Reedy Creek sub-catchment, northeast Victoria, Australia: Residual mercury contamination 100 years later. Environmental Pollution, 2004, 132(2): 355–363
[5] Sari M M, Inoue T, Matsumoto Y, et al. Measuring total mercury due to small-scale gold mining activi-ties to determine community vulnerability in Cihonje, Central Java, Indonesia. Water Science and Techno-logy, 2015, 73(2): 437–444
[6] Li P, Feng X B, Qiu G L, et al. Mercury pollution in Asia: a review of the contaminated sites. Journal of Hazardous Materials, 2009, 168(2): 591–601
[7] UN Environment. Global mercury assessment 2018 [R]. Geneva: UN Environment Programme, Chemicals and Health Branch, 2019
[8] Clarkson T W. Human toxicology of mercury. Journal of Trace Elements in Experimental Medicine, 2015, 11(2/3): 303–317
[9] 牟颖, 孙志伟, 林秀武. 甲基汞对小鼠DNA合成的影响. 中华预防医学杂志, 1992, 26(4): 247
[10] Hintelmann H. Organomercurials. Their formation and pathways in the environment. Metal Ions in Life Sciences, 2010, 7: 365–401
[11] Wiener J G, Krabbenhoft D P, Heinz G H, et al. Ecotoxicology of mercury // Hoffman D J, Rattner B A, Burton G A, et al. Handbook of ecotoxicology. 2nd ed. Boca Raton: CRC Press, 2003: 409–463
[12] Compeau G C, Bartha R. Sulfate-reducing bacteria: principal methylators of mercury in anoxic estuarine sediment. Applied and Environmental Microbiology, 1985, 50(2): 498–502
[13] Zhao L, Chen H, Xia L, et al. Contrasting effects of dissolved organic matter on mercury methylation by Geobacter sulfurreducens PCA and Desulfovibrio desulfuricans ND132. Environmental Science and Technology, 2017, 51(18): 10468–10475
[14] Schaefer J K, Morel F. High methylation rates of mer-cury bound to cysteine by Geobacter sulfurreducens. Nature Geoscience, 2009, 2(2): 123–126
[15] Parks J M, Alexander J, Mircea P, et al. The genetic basis for bacterial mercury methylation. Science, 2013, 339: 1332–1335
[16] Bundy J G, Davey M P, Viant M R. Environmental metabolomics: a critical review and future perspecti-ves. Metabolomics, 2009, 5(1): 3–21
[17] Newgard C B. Metabolomics and metabolic diseases: where do we stand?. Cell Metabolism, 2017, 25(1): 43–56
[18] Kumar R, Bohra A, Pandey A K, et al. Metabolomics for plant improvement: status and prospects. Frontiers in Plant Science, 2017, 8: 1302
[19] Castro-Puyana M, Herrero M. Metabolomics app-roaches based on mass spectrometry for food safety, quality and traceability. Trac-Trends in Analytical Chemistry, 2013, 52: 74–87
[20] Cevallos-Cevallos J M, Reyes-De-Corcuera J I, Etxeberria E, et al. Metabolomic analysis in food science: a review. Trends in Food Science and Technology, 2009, 20(11/12): 557–566
[21] Hu C, Xu G. Mass-spectrometry-based metabolomics analysis for foodomics. Trac-Trends in Analytical Chemistry, 2013, 52: 36–46
[22] Martien J I, Amador-Noguez D. Recent applications of metabolomics to advance microbial biofuel production. Current Opinion in Biotechnology, 2017, 43: 118–126
[23] Gombert A K, dos Santos M M, Christensen B, et al. Network identification and flux quantification in the central metabolism of Saccharomyces cerevisiae under different conditions of glucose repression. Journal of Bacteriology, 2001, 183(4): 1441–1451
[24] Saito N, Robert M, Kitamura S, et al. Metabolomics approach for enzyme discovery. Journal of Proteome Research, 2006, 5(8): 1979–1987
[25] Wang Q Z, Wu C Y, Chen T, et al. Integrating meta-bolomics into a systems biology framework to exploit metabolic complexity: strategies and applications in microorganisms. Applied Microbiology and Biotech-nology, 2006, 70(2): 151–161
[26] Hu H, Lin H, Zheng W, et al. Mercury reduction and cell-surface adsorption by Geobacter sulfurreducens PCA. Environmental Science and Technology, 2013, 47(19): 10922–10930
[27] Hu H, Lin H, Zheng W, et al. Oxidation and me-thylation of dissolved elemental mercury by anaero-bic bacteria. Nature Geoscience, 2013, 6(9): 751–754
[28] Lin H, Morrell-Falvey J L, Rao B, et al. Coupled mercury-cell sorption, reduction, and oxidation on methylmercury production by Geobacter sulfurre-ducens PCA. Environmental Science and Technology, 2014, 48(20): 11969–11976
[29] Brooks S C, Southworth G R. History of mercury use and environmental contamination at the Oak Ridge Y-12 Plant. Environmental Pollution, 2011, 159(1): 219–228
[30] Burns D A, Woodruff L G, Bradley P M, et al. Mercury in the soil of two contrasting watersheds in the Eastern United States. PLOS ONE, 2014, 9(2): e86855
[31] Schaefer J K, Yagi J, Reinfelder J R, et al. Role of the bacterial organomercury lyase (MerB) in control-ling methylmercury accumulation in mercury-conta-minated natural waters. Environmental Science and Technology, 2004, 38(16): 4304–4311
[32] Balogh S J, Nollet Y H, Swain E B. Redox chemistry in Minnesota streams during episodes of increased methylmercury discharge. Environmental Science and Technology, 2004, 38(19): 4921–4927
[33] Ramamoorthy S, Cheng T C, Kushner D J. Effect of microbial life stages on the fate of methylmercury in natural-waters. Bulletin of Environmental Contamina-tion and Toxicology, 1982, 29(2): 167–173
[34] Lin H, Lu X, Liang L, et al. Thiol-facilitated cell export and desorption of methylmercury by anaerobic bacteria. Environmental Science and Technology Letters, 2015, 2(10): 292–296
[35] Lu X, Liu Y, Johs A, et al. Anaerobic mercury meth-ylation and demethylation by Geobacter bemidjiensis Bem. Environmental Science and Technology, 2016, 50(8): 4366–4373
[36] Benjamini Y, Hochberg Y. Controlling the false disco-very rate: a practical and powerful approach to multi-ple testing. Journal of the Royal Statistical Society: Series B, 1995, 57(1): 289–300
[37] Cappello T, Pereira P, Maisano M, et al. Advances in understanding the mechanisms of mercury toxicity in wild golden grey mullet (Liza aurata) by H-1 NMR-based metabolomics. Environmental Pollution, 2016, 219: 139–148
[38] Zhang L J, Qian L, Ding L Y, et al. Ecological and toxicological assessments of anthropogenic contami-nants based on environmental metabolomics. Environ-mental Science and Ecotechnology, 2021, 5: 100081
[39] Farres M, Pina B, Tauler R. LC-MS based metabo-lomics and chemometrics study of the toxic effects of copper on Saccharomyces cerevisiae. Metallomics, 2016, 8(8): 790–798
[40] Gardner W S, Miller W H. Intracellular composition and net release rates of free amino-acids in Daphnia-magna. Canadian Journal of Fisheries and Aquatic Sciences, 1981, 38(2): 157–162
[41] Liu Y, Wang X, Li Y, et al. Metabolomic analysis of short-term sulfamethazine exposure on marine me-daka (Oryzias melastigma) by comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry. Aquatic Toxicology, 2018, 198: 269–275
[42] Monirujjaman M, Ferdouse A. Metabolic and physio-logical roles of branched-chain amino acids. Advan-ces in Molecular Biology, 2014: 364976
[43] Wu Z, Jin L, Zheng W, et al. NMR-based serum metabolomics study reveals a innovative diagnostic model for missed abortion. Biochemical and Bio-physical Research Communications, 2018, 496(2): 679–685
Metabolic Influence of Mercury Contamination on Bacterial Mercury Methylation by Geobacter sulfurreducens PCA
Abstract Metabolomics, a rising omics approach, was employed to screen out cellular significantly differential metabolites and analyze related metabolic pathways in bacterial Hg-methylating process. Under the stress of Hg(II) at environ-mentally relevant concentrations (0−100 μg/L), the adsorbed/assimilated Hg(II) was utilized by Hg-methylator of Geobacter sulfurreducens PCA to reduce and methylate Hg(II). The highest efficiency of 3.09%±0.16% was achieved for bacterial Hg-methylation upon exposure to 10 μg/L Hg(II). Metabolomics data showed that carbohydrate metabolism, amino acid metabolism and nucleotide metabolism were disturbed by Hg(II) stress in the PCA cells. To withstand the stress of Hg(II), G. sulfurreducens PCA increased energy demand for Hg methylation and DNA repair.
Key words mercury; Geobacter sulfurreducens PCA; methylation; metabolomics
doi: 10.13209/j.0479-8023.2022.036
国家自然科学基金(51679002, 51809004)和深圳市基础研究项目(JCYJ20180503182122539)资助
收稿日期: 2021-05-14;
修回日期: 2021-06-11