北京东灵山两种温带森林根际和非根际土壤酶活性、温度敏感性及矢量特征的季节动态
付粱晨1,2 丁宗巨1 唐茂1,2 曾辉2 朱彪1,†
1.地表过程分析与模拟教育部重点实验室, 北京大学生态研究中心, 北京大学城市与环境学院, 北京 100871; 2.北京大学深圳研究生院城市规划与设计学院, 深圳 518055; †通信作者, E-mail: biaozhu@pku.edu.cn
摘要 以北京东灵山两种主要植被类型——白桦(Betula platyphylla)林和辽东栎(Quercus wutaishanica)林土壤为研究对象, 于 2017 年春季(5 月)、夏季(7 月)、秋季(9 月)和冬季(12 月)分别采集根际与非根际土壤, 测定土壤理化性质、微生物生物量、植物根叶功能性状、3 种水解酶(BG, NAG 和 AP)及两种氧化酶(POX 和 PER)的活性及其温度敏感性和矢量特征。结果表明, 白桦林和辽东栎林土壤胞外酶活性、温度敏感性和矢量角度均存在显著的季节变化趋势, 且水解酶活性及温度敏感性的变化趋势与氧化酶相反; 根际土壤与非根际土壤中胞外酶活性、温度敏感性及矢量特征存在差异, 但季节变化趋势相同。温度是土壤胞外酶活性温度敏感性及矢量特征季节动态的重要驱动因素, 土壤 pH、土壤养分含量、植物叶片养分含量及细根生物量、细根密度对土壤胞外酶活性、温度敏感性及矢量特征有显著影响。
关键词 土壤胞外酶; 温度敏感性(Q10); 化学计量比; 根际; 季节动态
土壤有机质(soil organic matter, SOM)分解过程是生物地球化学循环的重要组成部分, 其对气候变化的响应会改变土壤有机碳储量, 影响生态系统中的能量流动和养分循环过程[1–2]。因此, 土壤有机质分解的温度敏感性已成为研究热点[3]。土壤有机质结构和组成复杂, 其分解需要多个步骤及多种酶的协同作用, 受到非生物环境因子和土壤微生物等一系列因素的影响, 其中土壤胞外酶是土壤有机质分解过程中的重要驱动因素[4]。
土壤胞外酶是动植物、微生物分泌及其残体分解到土壤中的蛋白质[5], 能够催化土壤有机质的分解, 供土壤微生物同化, 满足其生长以及代谢需求[3–4]。土壤胞外酶活性(extracellular enzyme activity, EEA)常用于表征土壤有机质分解速率。在全球变化背景下, 研究土壤胞外酶活性及其温度敏感性有利于探讨土壤有机碳库对气候变化的反馈[6]。土壤胞外酶种类众多, 可划分为水解酶和氧化酶两大类。目前已有的研究中, 常作为研究对象的胞外酶是催化 SOM 分解中末端反应的酶, 其产物可以直接被微生物利用。例如, 参与碳循环的 β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮循环的 β-1,4-N-乙酰氨基葡萄糖苷酶(β-1,4-N-acetyl-glucosamini-dase, NAG)以及参与磷循环的酸性磷酸酶(acid phosphatase, AP)等[7–8]。然而, 目前氧化酶的研究相对较少, 主要关注多酚氧化酶(phenol oxidase, POX)和过氧化物酶(peroxidase, PER)。由于POX 和PER 催化了土壤有机碳库难分解部分的氧化分解, 因此其活性与土壤碳积累密切相关[9]。
土壤胞外酶的温度敏感性系数 Q10 表示温度每升高 10℃, 土壤胞外酶活性增加的倍数[3]。Q10> 1 时, 温度升高, 土壤胞外酶活性增强; Q10<1 时, 温度升高, 土壤胞外酶活性降低。目前已有的关于土壤胞外酶活性及其温度敏感性的研究多关注与某一种元素循环相关的酶, 而土壤有机质分解过程还包括能量流动和养分循环, 因此需要综合考虑碳氮磷代谢酶[6–7]。土壤胞外酶活性指标仅能表征微生物对单一养分元素的利用状况, 通过酶化学计量学中的矢量分析, 则可以综合反映土壤中微生物在能量和养分获取方面受到的限制及其资源分配策略[8]。
土壤胞外酶的化学本质是蛋白质, 一旦释放到土壤中, 其活性就取决于多种环境因素的相互作用, 如温度、湿度和土壤 pH 等[1,10]。各种环境指标、微生物特征以及植物物候都会随季节发生变化, 尤其是在季节差异明显的地区。因此, 研究土壤胞外酶的季节动态有利于探究土壤微生物对气候及环境因子的综合响应[11–12]。由于不同区域间气候条件和生态系统类型等差异较大, 对土壤胞外酶活性及其温度敏感性的季节动态尚未得到一致的规律。
根际是受植物根系活动和微生物活动的影响, 在物理、化学和生物特性上与周围土壤有明显区别的微区域[13]。根际土壤中的根系分泌物等有机物会影响土壤胞外酶活性, 从而增加 SOM 的分解速率, 影响土壤碳库的组成和含量[14]。目前, 关注根际与非根际土壤胞外酶活性及其温度敏感性季节动态差异的研究相对匮乏[15]。
为探究上述问题, 本文以北京市东灵山地区的两个主要天然植被类型——白桦(Betula platyphylla)林和辽东栎(Quercus wutaishanica)林为研究对象, 于 2017 年春季(5 月)、夏季(7 月)、秋季(9 月)、冬季(12 月)分别采集根际与非根际土壤, 测定土壤理化性质, 3 种水解酶(BG, NAG 和 AP)和两种氧化酶(POX 和 PER)的活性、温度敏感性及胞外酶矢量特征, 并采集叶片和根系样品, 分析植物根叶性状与土壤胞外酶活性的相关性。
1 研究材料与方法
1.1 研究区域概况
本文研究区域位于北京市东灵山(39°57′33′′N, 115°25′40′′E, 海拔 1300m)。该区域属于暖温带半湿润季风气候, 夏季高温多雨, 冬季寒冷干燥。年平均气温为 5.4℃, 最冷月均温(1 月)为−10.4℃, 最热月均温(7 月)为 18.7℃。年平均降水量为 650mm, 约 70%的降水出现在 6—8 月。主要土壤类型为褐土, 土层厚度为 90~120cm。主要天然植被类型为落叶阔叶次生林[16], 主要树种为白桦和辽东栎等。
1.2 研究方法
1.2.1实验设计与样品采集
在研究区域内选取两个主要林型: 白桦林和辽东栎林, 二者均为外生菌根真菌侵染的树种。于2017 年春季(5 月)、夏季(7 月)、秋季(9 月)和冬季(12 月)分别在两个林型中选取生长状况良好, 胸径和树龄相似(胸径为 15~35cm, 树龄为 50~70 年)的树各 4 棵作为重复。在树干基部 1m范围内移除地被物层, 挖取 3 个长、宽为 30cm, 深度为 10cm 的土块。利用抖根法, 将轻轻抖动后仍附着在根系上的土定义为根际土, 剩余的土取部分混合均匀, 作为非根际土。收集土块中所有目标树种的活根, 作为根系样品, 根据直径划分为细根(直径小于 2 mm)和粗根(直径大于 2 mm)。
在收集土壤和根系样品的同时收集叶片样品。利用高枝剪采集目标树树冠上层向阳的健康成熟叶片, 每个植株采集 40 片完整叶片。因白桦和辽东栎为落叶树种, 且冬季土壤冻结, 故冬季只收集适量的根际与非根际土样品, 缺失叶片和根系样品。所有的土壤、根系和叶片样品均分装在已编号的密封袋中, 暂存于冰盒内, 运回实验室。将新鲜土样过2mm 筛网, 剔除凋落物和石砾。过筛后的土壤分为三部分: 一部分鲜土置于 4℃冷藏, 一部分土壤风干处理, 其余土壤置于冰箱中−20℃冷冻保存。所有样品于 12小时内完成处理。
1.2.2土壤理化性质测定
利用烘干称重法测定土壤含水量(soil water content, SWC): 土壤在 105℃烘干 24 小时 以上至恒重。根据烘干前后土壤质量差计算土壤含水量。利用 pH 计测定土壤 pH 值: 向 5g 鲜土中加入 10mL蒸馏水, 搅拌均匀, 静置后测定。利用 KCl 浸提法测定土壤可利用氮(available N, AN): 5g 鲜土用 20mL 2 M KCl 浸提, 利用流动注射分析仪(AA3, Bran +Luebbe, 德国)测定浸提液, 得到土壤铵态氮(NH4+-N)和硝态氮(NO3−-N)。二者相加, 得到可利用氮(AN)[17–18]。
土壤可提取有机碳(extractable organic carbon, EOC)、可提取总氮(extractable total nitrogen, ETN)、微生物生物量碳(microbial biomass carbon, MBC)和微生物生物量氮(microbial biomass nitrogen, MBN)利用 K2SO4 浸提法和氯仿(CHCl3)熏蒸提取法测定: 5g 鲜土在黑暗条件下用无醇氯仿熏蒸 24 小时, 另取 5g 未经熏蒸的鲜土, 二者都用 0.5 M K2SO4 浸提, 利用 TOC 分析仪(Multi N/C® 3100, Analytik Jena, 德国)测定浸提液中的土壤可提取碳(EOC)和土壤可提取总氮(ETN), 根据熏蒸土壤与未熏蒸土壤中 EOC与 ETN 的差值计算 MBC 和 MBN, 转换系数 Kec 和Ken 均为 0.45[19–20]。土壤有机碳(soil organic carbon, SOC)和土壤总氮(total nitrogen, TN)利用元素分析仪(Vario EL Ⅲ, Elementar, 德国)测定。土壤理化性质及微生物生物量参数见表 1。
1.2.3植物根和叶性状测定
本研究测定的叶片性状包括比叶面积(specific leaf area, SLA)、叶干物质含量(leaf dry matter content, LDMC)、叶片碳氮含量(leaf C, leaf N)及叶片碳氮比(leaf C/N)。根系性状包括细根生物量(fine root biomass)、细根密度(fine root density)、根系碳氮含量(root C, root N)和细根碳氮比(root C/N)。
利用扫描仪(Canon LiDE 110, 日本)和图像处理软件测定 10 片新鲜完整叶片的面积, 同时测定叶片的鲜重。将扫描后的叶片置于 65℃烘箱中, 烘干24 小时以上至恒重, 测定叶片干重。叶片干重与鲜重之比为叶干物质含量, 叶面积与干重之比为比叶面积。将野外收集的细根洗净, 于 65℃烘箱中烘干24 小时以上至恒重, 测得细根生物量。细根生物量与土壤体积之比即为细根密度。烘干后的叶片和根系样品, 取一部分粉碎后再次置于 65℃烘箱中烘干至恒重, 利用 C/N 元素分析仪(Elementar Vario EL Ⅲ, Hanau, 德国)测定碳氮含量, 计算碳氮比。植物根和叶性状见表 2。
1.2.4土壤胞外酶活性及温度敏感性测定
本研究共测定 5 种土壤胞外酶的活性。3 种水解酶分别是参与碳循环的 β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG)、参与氮循环的 β-1,4-N-乙酰氨基葡萄糖苷酶(β-1,4-N-acetyl-glucosaminidase, NAG)以及参与磷循环的酸性磷酸酶(acid phosphatase, AP)。两种氧化酶是参与难分解有机质分解的多酚氧化酶(phenol oxidase, POX)和过氧化物酶(pero-xidase, PER)。
水解酶活性采用荧光法测定, 以 4-甲基伞形酮(4-methylumbelliferyl, MUB)为标准物。称取 1.5g鲜土加入 150mL 醋酸钠缓冲溶液中, 调整缓冲液pH 至土壤平均 pH 值。搅拌均匀后, 立即用移液枪将 200μL 土壤悬浊液加入 96 微孔板中(每个样品设置 8 个重复), 随后各加入 50μL 的对应底物(200μM)。将微孔板置于 25℃恒温培养箱中培养 3小时, 在酶标仪(SynergyH1M, Biotek, USA)中进行测定, 激发波长为 365nm, 放射波长为 450nm。测得的荧光值可根据 MUB 标准曲线换算为 MUB 的浓度, 随后计算水解酶活性, 单位为 nmol·g−1 dry soil·h−1 [21]。氧化酶活性采用吸收光法测定, 以L-二羟基苯丙氨酸(L-dihydroxyphenylalanine, DOPA)为标准物。与水解酶不同的是, 96 微孔板要在 25℃恒温培养箱中培养 24 小时, 在酶标仪中测定吸收光时波长为 460nm。氧化酶活性的单位为μmol·g−1 dry soil·h−1 [22]。将以上土壤胞外酶活性(absolute activity)除以微生物生物量碳(MBC), 得到比酶活性(specific activity), 单位为 nmol·mg−1MBC·h−1 和 μmol·mg−1 MBC·h−1。
表1 土壤理化性质及微生物生物量
Table 1 Soil physiochemical properties and microbial biomass

参数取样位置白桦辽东栎 春 夏 秋 冬 春 夏 秋 冬 土壤含水量/%r42.1±5.9A45.7±2.8A18.8±2.1B45.7±11.1A9.6±4.3C30.8±2.4A13.3±1.6C26.1±2.9B b43.6±4.4A44.9±2.4A16.8±1.5B46.3±15.2A21.0±6.5B29.8±3.2A12.6±1.7C24.3±3.7AB 土壤酸碱度(pH)r5.48±0.16C5.97±0.37B6.45±0.32A5.89±0.14BC5.64±0.14B5.55±0.26B6.20±0.34A5.57±0.38B b6.41±0.11A6.39±0.48A6.65±0.28A6.46±0.26A6.34±0.16A5.82±0.12B6.44±0.26A5.55±0.43B 土壤有机碳/ (mg·g−1)r66.0±13.0A63.2±7.0A58.9±11.9A88.1±41.2A37.5±2.1A35.6±2.7A39.8±6.7A36.0±5.2A b59.0±11.4AB55.1±4.8B46.0±8.1B86.6±37.1A35.7±3.5A33.9±4.8A38.5±7.2A34.6±5.2A 总氮/(mg·g−1)r5.16±0.86A5.19±0.65A4.54±0.86A6.65±2.98A3.18±0.11A2.95±0.28A3.27±0.48A3.01±0.46A b4.73±0.84AB4.55±0.46AB3.79±0.53B6.65±2.75A3.12±0.38A2.85±0.46A3.15±0.53A2.91±0.43A 土壤碳氮比r12.7±0.7AB12.2±0.3B12.8±0.3AB13.1±0.7A11.8±0.6A12.1±0.6A12.2±0.5A12.0±0.3A b12.5±0.3B12.1±0.2B12.1±0.4B13.0±0.3A11.5±0.6A12.0±0.6A12.2±0.3A11.9±0.3A 可提取有机碳/(mg C·kg−1 soil)r1420.0±425.6A1552.2±286.7A741.5±251.8B491.3±220.2B955.4±155.4A1092.3±163.3A494.2±87.0B263.9±40.5C b1175.1±277.1A1289.8±193.5A485.6±139.6B437.7±149.8B922.9±227.9A1092.1±205.4A404.5±91.8B242.7±26.8B 可提取有机氮/(mg N·kg−1 soil)r138.2±33.7A135.6±21.5A50.5±22.3B67.0±30.3B86.2±10.8B100.3±4.2A31.8±5.0C31.9±3.6C b101.0±23.3A110.4±10.6A39.9±10.8B59.0±16.7B82.0±16.2A93.7±9.0A28.5±3.1B34.0±1.8B 可利用氮/(μg N·g−1 soil)r18.1±3.2B17.5±2.5B9.7±2.6B32.2±14.7A12.7±1.5B20.0±6.4A8.6±1.2B11.5±1.0B b11.1±2.2BC15.1±1.5B6.9±2.0C23.6±7.5A8.8±3.2B16.1±1.8A5.0±0.2C11.4±2.3B 微生物生物量碳/(mg C·kg−1 soil)r1224.4±143.2A1456.1±230.6A1202.4±237.6A1362.1±581.6A509.1±120.8C732.7±79.1B920.2±147.9A447.7±80.7C b1222.6±281.7A1160.6±145.1AB692.1±133.8B1048.5±590.2Aa648.2±208.2A608.3±108.2AB405.7±92.9B487.3±143.6AB 微生物生物量氮/ (mg N·kg−1 soil)r210.5±11.5A225.6±39.6A86.9±22.2B137.2±58.3B66.3±10.7B105.6±15.8A62.9±18.5B40.7±8.9C b187.3±53.6A187.5±38.4A67.8±15.7B140.4±83.3AB93.7±29.4A100.1±12.7A36.1±1.7B51.4±19.6B
说明: r 代表根际, b 代表非根际。方差分析结果用字母标记法展示, 不同大写字母表示同一树种不同季节间土壤理化性质和微生物生物量的差异, 下同。
表2 植物根和叶性状
Table 2 Plant root and leaf traits
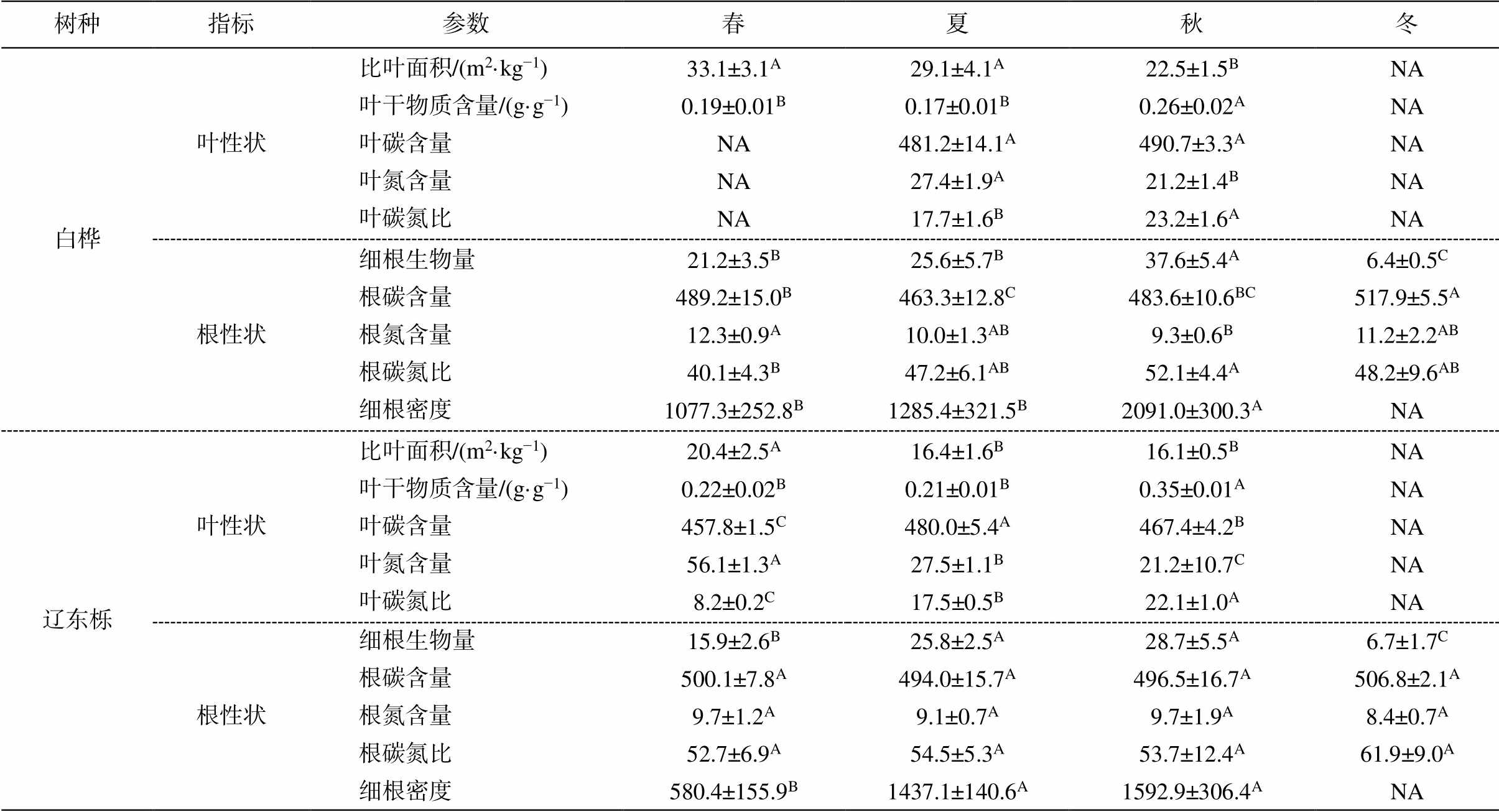
树种指标参数春夏秋冬 白桦叶性状比叶面积/(m2·kg−1)33.1±3.1A29.1±4.1A22.5±1.5BNA 叶干物质含量/(g·g−1)0.19±0.01B0.17±0.01B0.26±0.02ANA 叶碳含量NA481.2±14.1A490.7±3.3ANA 叶氮含量NA27.4±1.9A21.2±1.4BNA 叶碳氮比NA17.7±1.6B23.2±1.6ANA 根性状细根生物量21.2±3.5B25.6±5.7B37.6±5.4A6.4±0.5C 根碳含量489.2±15.0B463.3±12.8C483.6±10.6BC517.9±5.5A 根氮含量12.3±0.9A10.0±1.3AB9.3±0.6B11.2±2.2AB 根碳氮比40.1±4.3B47.2±6.1AB52.1±4.4A48.2±9.6AB 细根密度1077.3±252.8B1285.4±321.5B2091.0±300.3ANA 辽东栎叶性状比叶面积/(m2·kg−1)20.4±2.5A16.4±1.6B16.1±0.5BNA 叶干物质含量/(g·g−1)0.22±0.02B0.21±0.01B0.35±0.01ANA 叶碳含量457.8±1.5C480.0±5.4A467.4±4.2BNA 叶氮含量56.1±1.3A27.5±1.1B21.2±10.7CNA 叶碳氮比8.2±0.2C17.5±0.5B22.1±1.0ANA 根性状细根生物量15.9±2.6B25.8±2.5A28.7±5.5A6.7±1.7C 根碳含量500.1±7.8A494.0±15.7A496.5±16.7A506.8±2.1A 根氮含量9.7±1.2A9.1±0.7A9.7±1.9A8.4±0.7A 根碳氮比52.7±6.9A54.5±5.3A53.7±12.4A61.9±9.0A 细根密度580.4±155.9B1437.1±140.6A1592.9±306.4ANA
用同样的方法分别在 4℃, 15℃和 35℃下培养样品(水解酶在 4℃, 15℃下培养 3 小时, 35℃下培养1.5小时; 氧化酶在 3 种温度下均培养 24 小时), 测定土壤胞外酶活性, 以计算温度敏感性(Q10):
Q10 = e10·a,
其中, a 为以培养温度为自变量。以该温度下酶活性的自然对数值为因变量, 拟合线性回归方程的斜率:
ln(EEA) = a·T+b,
其中, T 为培养温度(45℃, 15℃, 25℃和 35℃), EEA为该温度下的酶活性[3,6]。
1.2.5矢量分析
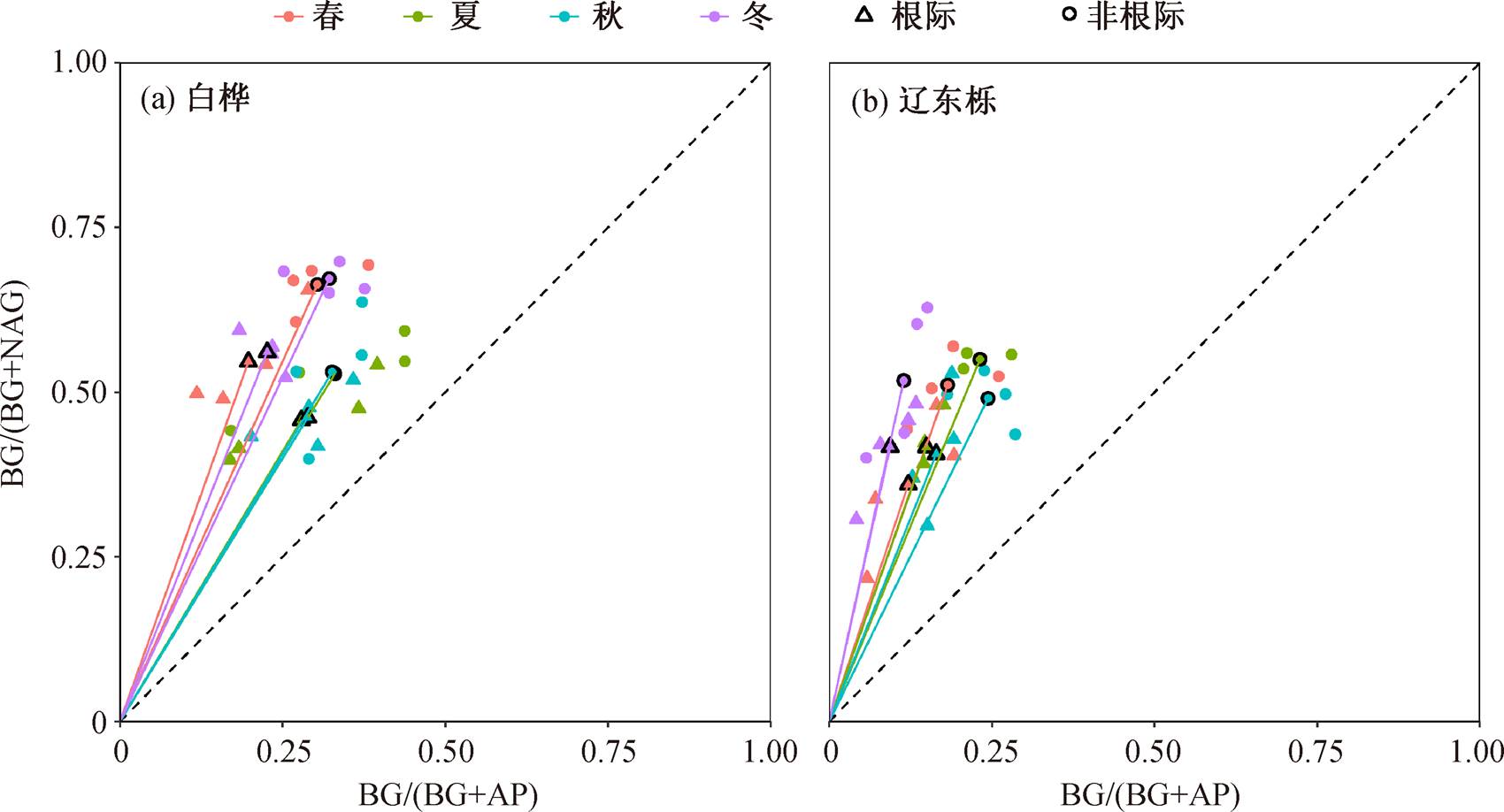
为表征土壤碳和养分限制状况, 采用 Moor-head 等[8,23]的方法进行土壤胞外酶活性矢量分析。设土壤中参与碳循环和磷循环酶的相对活性为 x, 参与碳循环和氮循环酶的相对活性为 y, 将坐标(x, y)与原点(0, 0)相连形成矢量, 矢量长度(vector length)表征土壤中能量相对于养分(C vs. nutrient)的限制程度, 矢量角度用于表征土壤中 P 相对于 N (P vs. N)的限制程度[8,23]。
矢量长度 = SQRT(x2+y2),
矢量角度 = DEGREES((ATAN2(x, y))),
其中, x 和 y 的计算公式[8]如下:
x = BG/(BG+AP),
y = BG/(BG+NAG)。
1.3 数据统计与分析
线性混合效应模型(linear mixed-effect model)用于分析季节(春夏秋冬)、生境(根际或非根际)及二者的交互作用对土壤理化性质、微生物生物量、胞外酶活性及其温度敏感性和矢量特征等指标的影响, 以季节和生境为固定效应, 样地为随机效应。单因素方差分析(one-way ANOVA)用于分析土壤理化性质、胞外酶活性及其温度敏感性和矢量特征在不同季节间差异的显著性, 最小显著性差异(least significant difference, LSD)检验用于对单因素方差分析结果进行多重比较(P=0.05)。
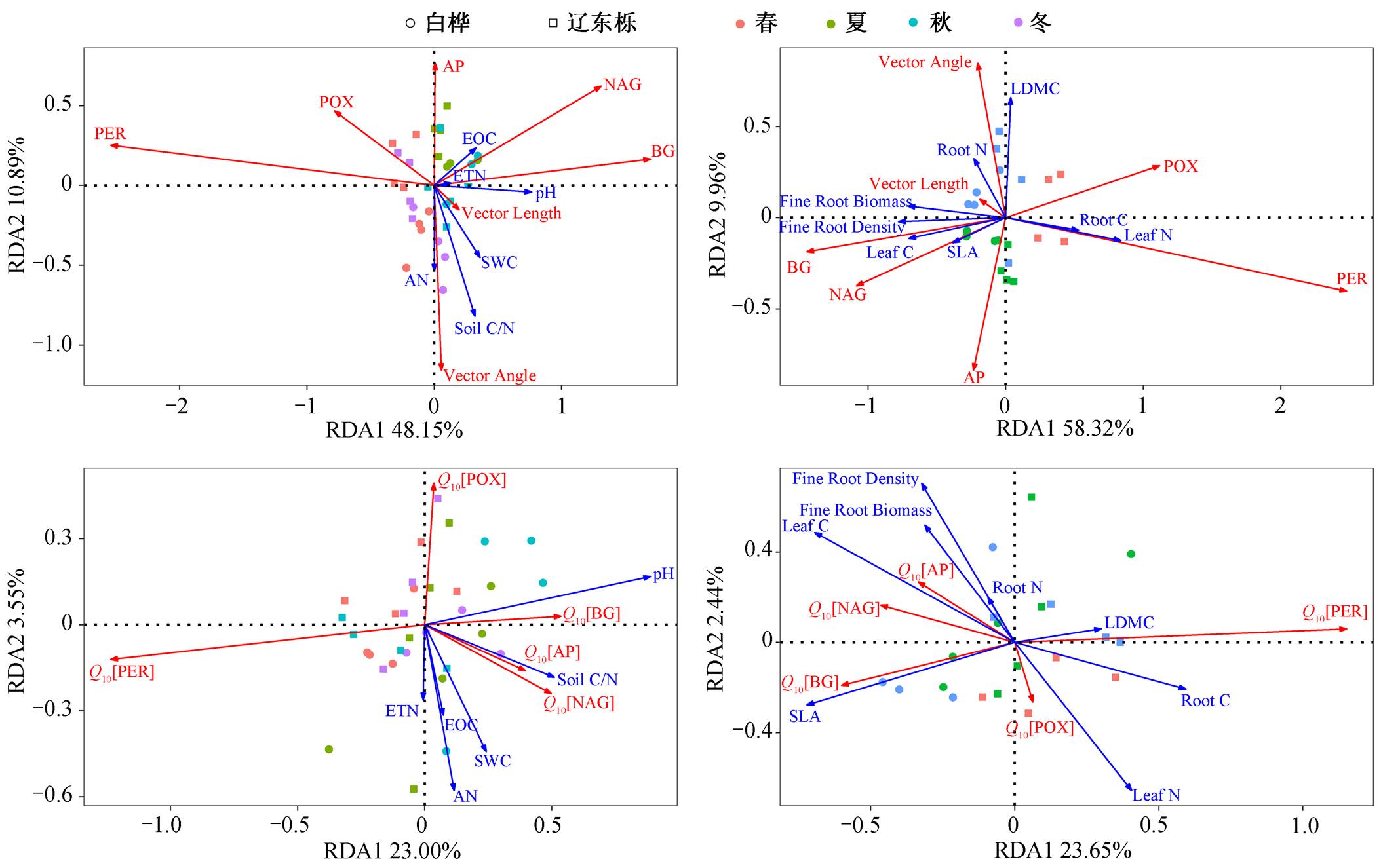
为探究根际土壤胞外酶活性相关参数季节动态的影响因素, 利用冗余分析(RDA)和皮尔森(Pear-son)相关分析, 确定根际土壤胞外酶活性、温度敏感性、矢量特征与土壤理化性质、植物根叶性状之间的相关关系。由于植物根叶性状冬季数据缺失(冬季落叶和土壤冻结), 因此对土壤理化性质、微生物生物量和植物根叶性状分别进行分析。
用方差膨胀因子(variance inflation factor, VIF)检验解释变量之间是否存在多重共线性: 当 0< VIF<10 时, 不存在多重共线性; 当 10≤VIF<100 时, 存在较强多重共线性; 当 VIF≥100, 存在严重多重共线性。SOC 和 TN 的 VIF>100, 存在严重多重共线性, 因此剔除这两个变量后再次进行冗余分析及Pearson 相关性分析。
本研究所有的统计分析均采用 R (version 4.0.5)和Excel (2019)软件, 利用R (version 4.0.5)作图。
2 结果
2.1 土壤胞外酶活性的季节动态
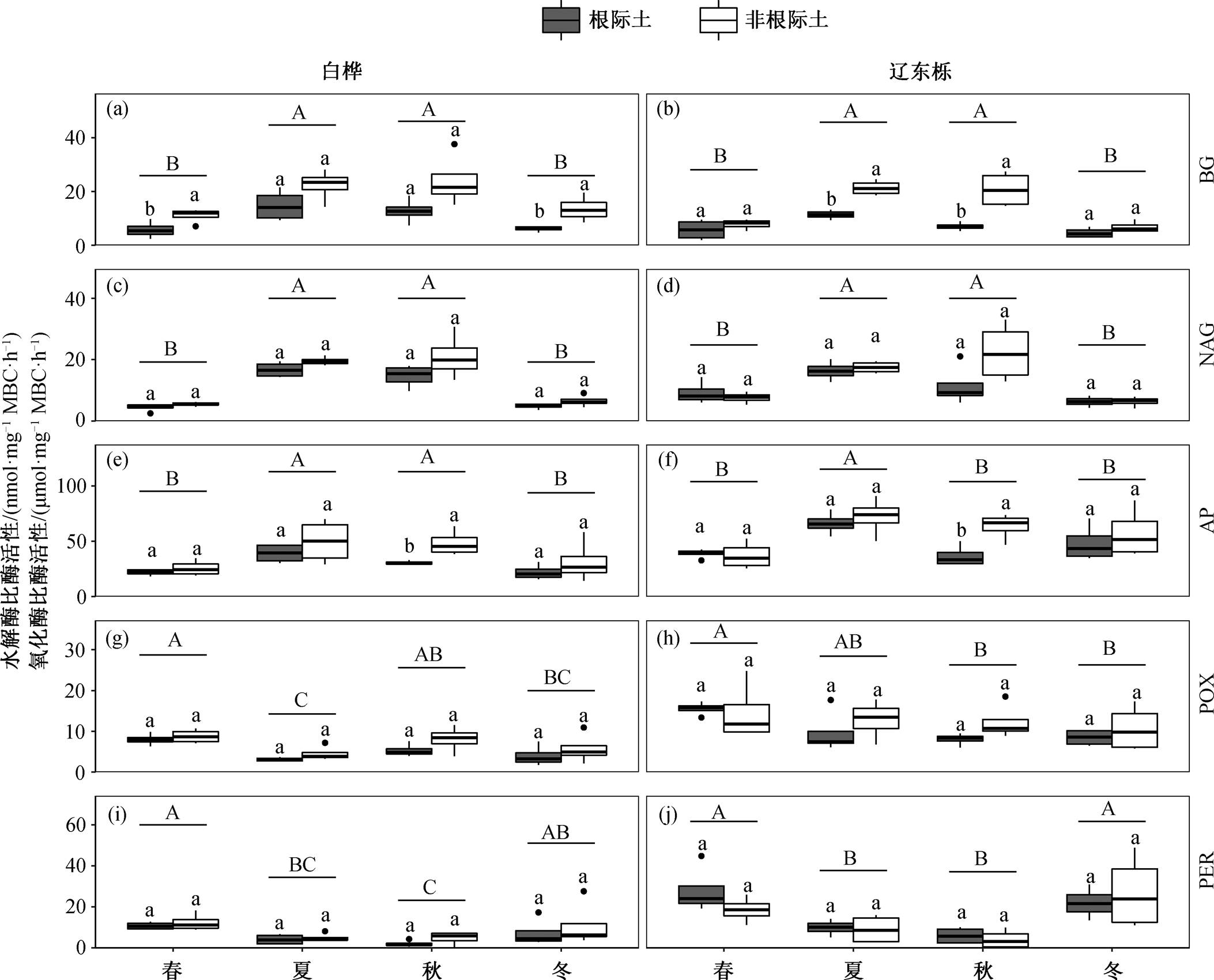
线性混合效应模型分析结果表明, 白桦和辽东栎林中, 土壤胞外酶活性均受到季节的显著影响(P<0.05); 生境(根际或非根际)对 3 种水解酶(BG, NAG 和 AP)活性的影响显著, 对氧化酶(POX 和PER)活性的影响不显著(P>0.05)。除辽东栎林中的 BG 和 NAG 外, 季节和生境的交互作用对土壤胞外酶活性没有显著影响(表 3)。根据变异系数表, PER 活性的变异系数(白桦林 81.23%, 辽东栎林77.18%)大于水解酶和 POX (表 4)。
如图 1 所示, 白桦林和辽东栎林中水解酶的季节动态呈现一致的趋势, 即在夏季达到最大值后逐渐减小, 夏秋季之间水解酶活性的差异并不显著, 春冬两季水解酶活性显著低于夏秋两季(辽东栎林中 AP 除外)。根际土壤中 3 种水解酶活性均低于非根际土壤, 且根际与非根际土壤中水解酶活性的季节变化趋势一致。
两种林型中, POX 和 PER 活性的季节变化趋势相同: 春季到夏季活性降低, 秋季到冬季活性回升, 秋季氧化酶活性最低(白桦林 POX 夏季活性最低, 图 1)。白桦林中根际土壤中氧化酶活性低于非根际土壤, 但两种林型中氧化酶活性在根际与非根际土壤之间的差异不显著(图1和表3)。
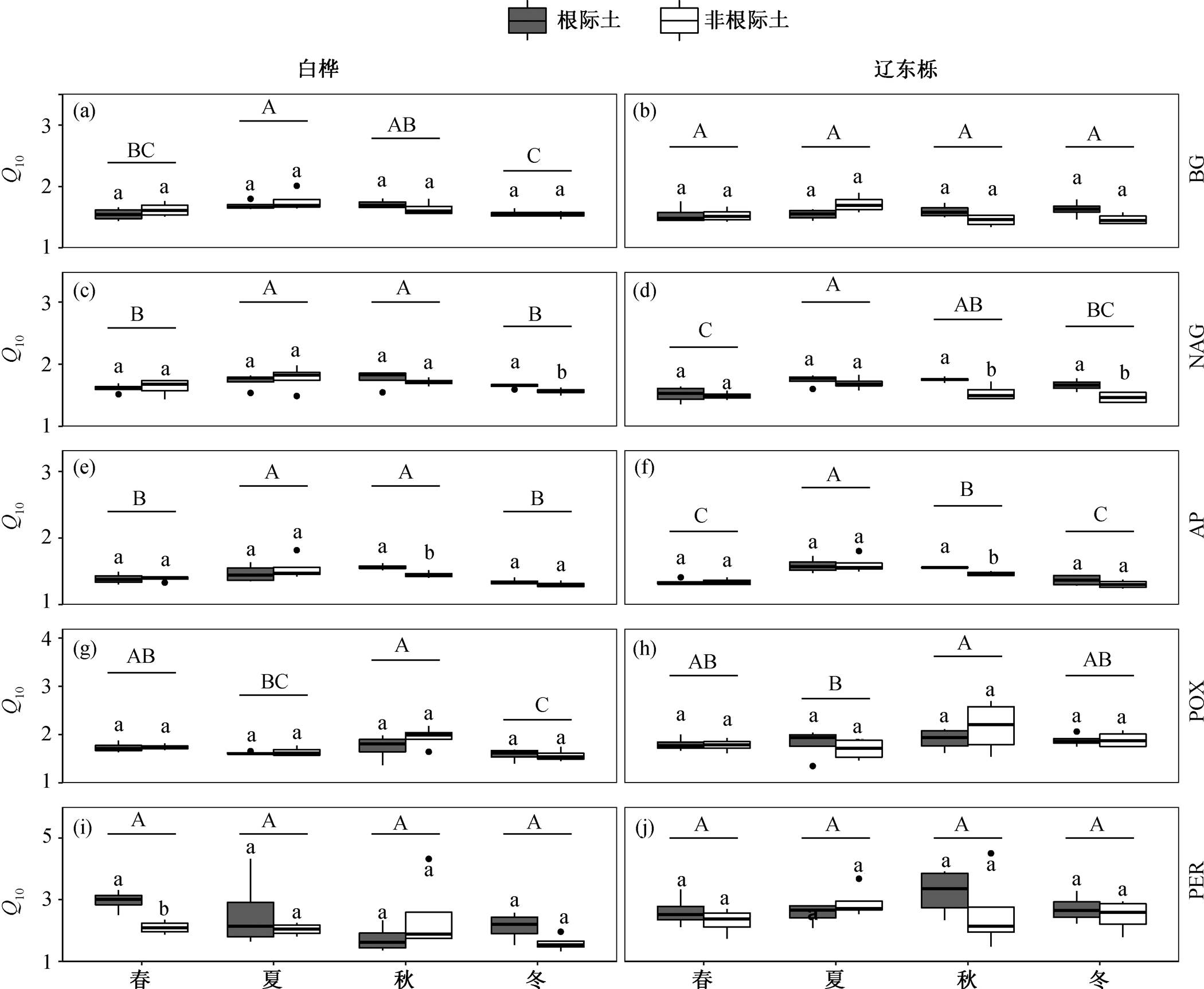
2.2 土壤胞外酶活性温度敏感性(Q10)的季节动态
水解酶活性的 Q10 受季节的显著影响, 而生境对其影响不显著。氧化酶 POX 活性的 Q10 受季节影响显著, 生境及季节生境交互作用对 Q10 [POX]没有显著影响, Q10[PER]不受季节、生境及二者交互作用的影响(表3)。
表3 季节、生境及其交互作用对土壤理化性质、微生物生物量、土壤胞外酶活性、Q10、矢量特征影响的线性混合效应模型分析结果
Table 3 Linear mixed-effect model for effects of season, habitat and their interactions on soil physiochemical properties, microbial biomass, soil extracellular enzyme activity, Q10 and vector characteristics
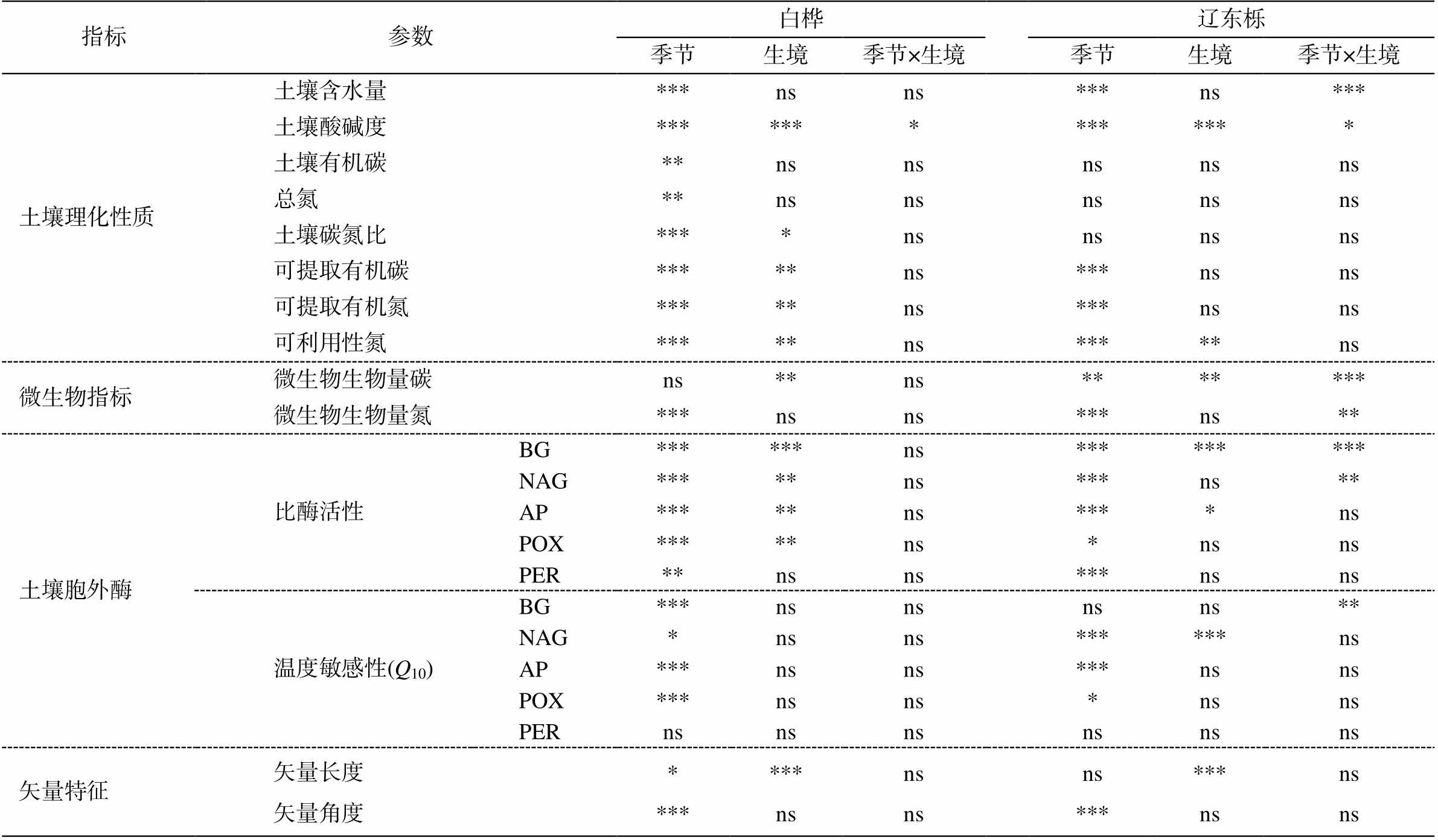
指标参数白桦辽东栎 季节生境季节×生境季节生境季节×生境 土壤理化性质土壤含水量***nsns***ns*** 土壤酸碱度************** 土壤有机碳**nsnsnsnsns 总氮**nsnsnsnsns 土壤碳氮比****nsnsnsns 可提取有机碳*****ns***nsns 可提取有机氮*****ns***nsns 可利用性氮*****ns*****ns 微生物指标微生物生物量碳ns**ns******* 微生物生物量氮***nsns***ns** 土壤胞外酶比酶活性BG******ns********* NAG*****ns***ns** AP*****ns****ns POX*****ns*nsns PER**nsns***nsns 温度敏感性(Q10)BG***nsnsnsns** NAG*nsns******ns AP***nsns***nsns POX***nsns*nsns PERnsnsnsnsnsns 矢量特征矢量长度****nsns***ns 矢量角度***nsns***nsns
说明: *p<0.05, **p<0.01, ***p<0.001; ns表示不显著, p>0.05。
表4 土壤胞外酶活性、温度敏感性(Q10)、矢量长度、矢量角度的最大值、最小值及变异系数
Table 4 Maximum, minimum and coefficient of variation of soil extracellular enzyme activity, temperature sensitivity, vector length and vector angle
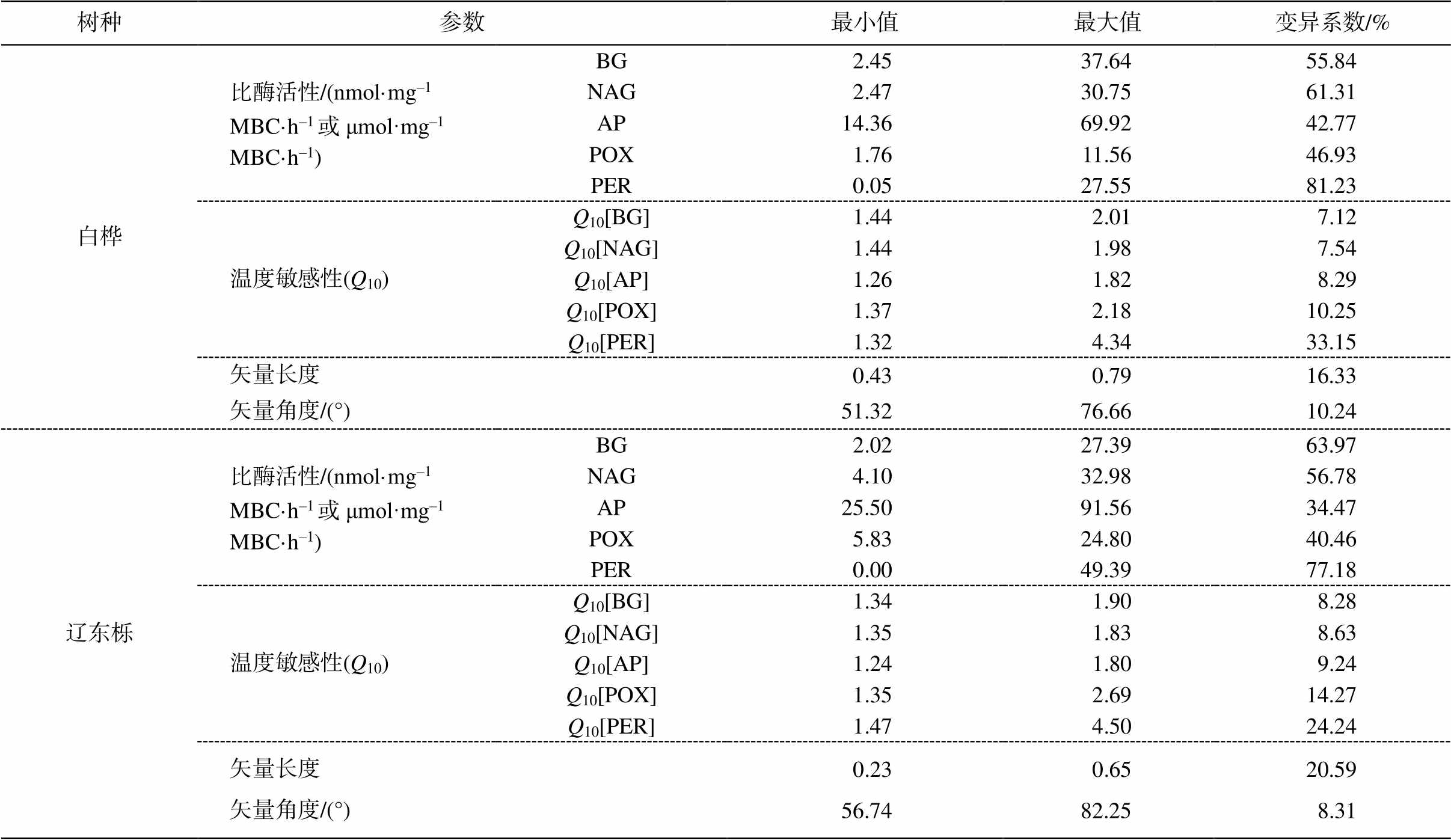
树种参数最小值最大值变异系数/% 白桦比酶活性/(nmol·mg‒1 MBC·h‒1或μmol·mg‒1 MBC·h‒1)BG2.4537.6455.84 NAG2.4730.7561.31 AP14.3669.9242.77 POX1.7611.5646.93 PER0.0527.5581.23 温度敏感性(Q10)Q10[BG]1.442.017.12 Q10[NAG]1.441.987.54 Q10[AP]1.261.828.29 Q10[POX]1.372.1810.25 Q10[PER]1.324.3433.15 矢量长度0.430.7916.33 矢量角度/(°)51.3276.6610.24 辽东栎比酶活性/(nmol·mg‒1 MBC·h‒1或μmol·mg‒1 MBC·h‒1) BG2.0227.3963.97 NAG4.1032.9856.78 AP25.5091.5634.47 POX5.8324.8040.46 PER0.0049.3977.18 温度敏感性(Q10)Q10[BG]1.341.908.28 Q10[NAG]1.351.838.63 Q10[AP]1.241.809.24 Q10[POX]1.352.6914.27 Q10[PER]1.474.5024.24 矢量长度0.230.6520.59 矢量角度/(°)56.7482.258.31
3 种水解酶活性 Q10 范围分别为 BG [1.34, 2.01], NAG [1.35, 1.98], AP [1.24, 1.84]; 两种氧化酶活性的 Q10 范围分别为 POX [1.37, 2.69], PER [1.32, 4.50]。从总体上看, 土壤胞外酶活性的 Q10 均大于 1, 且氧化酶的平均值高于水解酶, 其变异系数也大于水解酶(表4)。
从图 2 可以看出, 水解酶活性的 Q10 在夏季最大; 对氧化酶而言, POX 活性的 Q10 在秋季最大, PER 活性的 Q10 在不同季节之间没有显著差异。
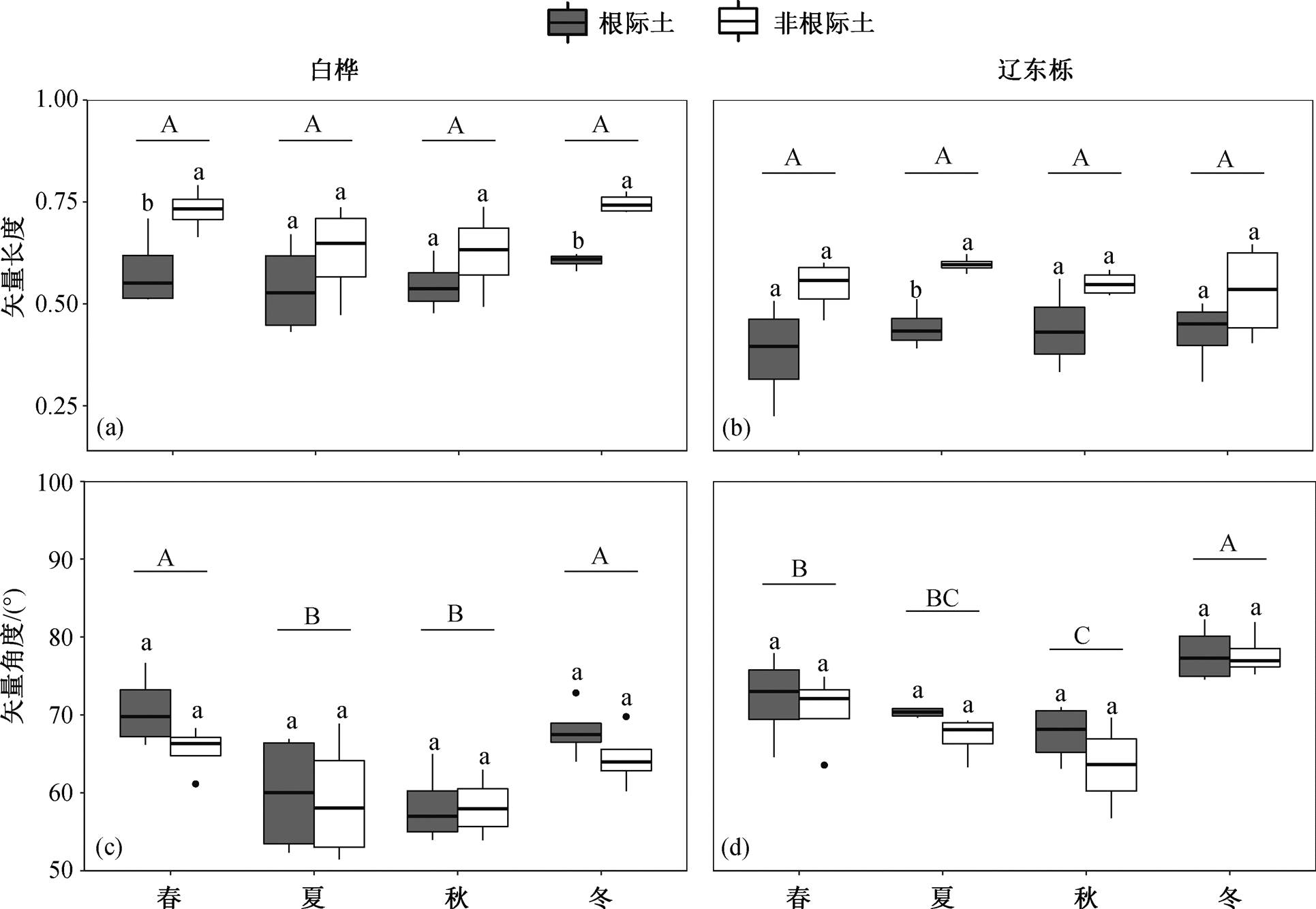
2.3 土壤胞外酶活性矢量特征的季节动态
白桦林和辽东栎林中土壤胞外酶活性的矢量角度均大于 45°, 非根际土壤矢量长度大于根际土壤, 矢量角度小于根际土壤(图 3 和 4)。线性混合效应模型分析结果表明, 季节对两个树种的矢量角度具有显著影响(p<0.001)(表 3); 生境对白桦和辽东栎的矢量长度均有显著影响(p<0.001), 对矢量角度的影响不显著(p>0.05)(表 3)。白桦和辽东栎的矢量角度从春季到秋季呈不断下降趋势, 秋季的矢量角度最小; 矢量长度在不同季节间差异不显著, 但根际土壤矢量长度显著小于非根际土壤(图4)。
2.4 土壤胞外酶活性、温度敏感性、矢量特征与土壤理化性质、微生物生物量、植物功能性状之间的相关性
冗余分析结果表明, 对于土壤胞外酶活性及其矢量长度和矢量角度, 土壤理化性质(SWC, pH, Soil C/N, EOC, ETN, AN)具有显著的影响, 共解释变异的 59.04% (图 5(a))。植物根叶性状(SLA, LDMC, Leaf C, Leaf N, Root C, Root N, Fine Root Biomass, Fine Root Density)共解释变异的 59.32% (图 5(b))。胞外酶活性温度敏感性与土壤理化性质和植物根叶功能性状的相关性弱于土壤胞外酶活性及其矢量特征, 土壤理化性质共解释胞外酶活性温度敏感性变异的 23.04%(图 5 (c)); 植物根叶性状共解释变异的23.67%(图 5 (d))。
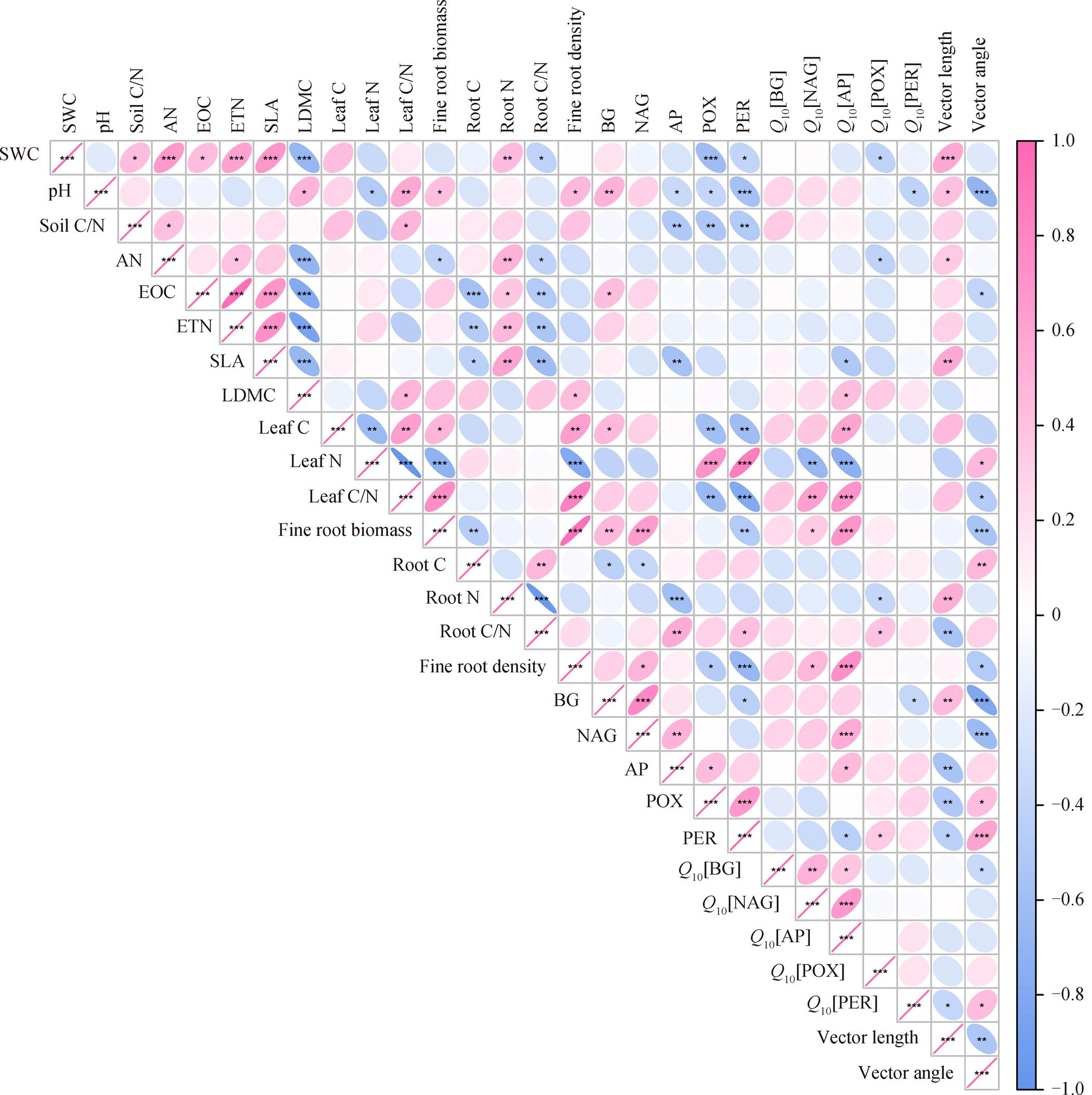
皮尔森相关性分析结果表明, 对于水解酶, BG活性、NAG 活性与土壤理化性质的相关性基本上一致, 二者均与 pH 和土壤可提取有机碳含量正相关(NAG 不显著); AP 活性与土壤理化性质的相关性与 BG 和 NAG 相反, AP 活性与 pH、土壤碳氮比显著负相关。3 种水解酶活性与植物根叶性状的相关性一致, 都与叶碳含量正相关, 与根系碳含量显著负相关; 与细根生物量和细根密度正相关(AP 不显著)(图6)。
氧化酶活性与植物叶性状的关系与水解酶相反, 两种氧化酶活性与叶碳含量和叶碳氮比显著负相关, 与叶氮含量显著正相关, 与细根生物量和细根密度显著负相关。POX 和 PER 活性与土壤含水量、pH和土壤碳氮比均显著负相关(图 6)。
水解酶活性的 Q10 与土壤理化性质相关性均不显著, 而氧化酶活性的 Q10 与土壤含水量和 pH 显著负相关。但是, 水解酶活性的 Q10 与植物根叶性状的相关性显著, 与叶干物质含量正相关, 与叶碳含量和叶碳氮比正相关, 与叶氮含量负相关, 与细根生物量和细根密度显著正相关, 氧化酶活性的Q10 受植物根叶性状的影响不显著(图 6)。
土壤水解酶活性的矢量长度、矢量角度与土壤理化性质、植物根叶性状的相关性完全相反。矢量长度与土壤含水量和 pH 显著正相关, 矢量角度与土壤 pH 显著负相关。对于根叶性状, 矢量长度与叶碳氮比正相关, 与根碳氮比负相关, 与 BG 活性显著正相关, 矢量角度与叶碳氮比负相关, 与根碳氮比正相关, 与细根生物量和细根密度显著负相关, 与 BG 和 NAG 活性显著负相关, 与 AP 活性正相关(图 6)。
3 讨论
3.1 土壤胞外酶活性及其温度敏感性的季节变化规律
本研究中, 水解酶活性及其温度敏感性均表现出显著的季节变化趋势。BG, NAG 和 AP 的活性在夏季达到最大值, 在春冬季节最低, 与季节间温度变化趋势一致。对于水解酶的温度敏感性, 夏季Q10 最大, 随着温度降低, Q10 逐渐减小。这一现象与已有的研究结果吻合。Wallenstein 等[24]的研究表明, 土壤胞外酶活性及其温度敏感性存在季节变异, 温度是水解酶原位活性及温度敏感性变化的主要驱动因素。氧化酶活性的季节变异趋势与水解酶相反, POX 和 PER 活性在夏秋季最低, 春冬两季最高。Di等[25]发现, 在温带气候区, POX 和 PER的活性表现出强烈的季节变化趋势, 冬季高, 夏季低, 本研究结果与之一致。POX 和 PER 活性 Q10 的季节变化趋势变现出较大差异, Q10[POX]在秋季最大, 而季节对Q10[PER]没有显著的影响。
Sinsabaugh 等[26]的研究表明, 氧化酶和水解酶这两大类土壤胞外酶在微生物编码酶的基因表达以及环境中酶的周转过程中受到的影响是不同的。另外由于水解酶主要催化土壤中易分解有机质(如纤维素和几丁质等)的分解, 而氧化酶主要调控难分解有机质(如木质素)的降解, 因此二者对季节变化的响应表现出不同的趋势。一方面, 土壤氧化酶活性在冬季最高, 可能是由于分泌 POX 和 PER 的菌群在夏季受到底物可利用性(木质素)的限制, 更易分解的凋落物组分会促进更具竞争力的微生物生长[25,27]; 另一方面, 夏季的高温条件可能会限制促进木质素分解的微生物生长[28]。对于水解酶, 温度是影响其活性的主导因素, 夏季温度升高, 水解酶活性增强[12]。
本研究中, 氧化酶活性及其温度敏感性的变异系数均大于水解酶, 说明氧化酶活性通常比水解酶的变异性强, 在土壤环境中, 氧化酶比水解酶更不稳定。这一结果与 Sinsabaugh 等[26]的研究结果一致, 即氧化酶活性时空变异的均值约为水解酶的 3倍。这可能是因为土壤氧化酶的分子大小约为大多数水解酶活性的 2 倍, 且其分子结构更加复杂, 因而对环境因子等变化的响应更加敏感[9,29]。
3.2 土壤微生物养分限制的季节动态
酶活性的矢量长度能够表征微生物能量相对于养分(C vs. nutrient)的限制程度, 矢量角度能够表征微生物磷相对于氮(P vs. N)的限制程度[8,23]。本研究中, 酶活性的矢量角度均大于 45°, 说明在东灵山白桦林和辽东栎林土壤中, P 是限制微生物的主要养分元素。东灵山地区的土壤类型为褐土, 磷的有效含量较低, 微生物受到的 P 限制严重, 从而投入更多的资源来生产与 P 循环相关的酶, 因此AP 的活性显著高于 BG 和 NAG [1,30]。
季节对矢量长度没有显著影响, 但矢量角度表现出显著的季节变化趋势: 从春季到秋季逐渐减小, 秋季最小, 表明土壤 P 限制程度在秋季最弱。原因可能是, 5-9 月是植物生长旺盛期, 光合作用积累大量有机物质, 在生长季末期, 植物将光合作用产物从地上向地下输入, 由于地上部分向地下分配有机质, 土壤微生物受到的养分限制减弱[15]。
3.3 土壤理化性质对土壤酶活性相关参数的影响
根际土壤是植物根系、土壤微生物和土壤接触的微区域, 会直接受到根系分泌物的影响[13], 通常, 根际土壤的养分含量和微生物生物量显著大于非根际土[31–33]。本研究中, 生境(根际或非根际)对水解酶活性、矢量长度和矢量角度具有显著影响。根际土壤水解酶活性和矢量长度显著小于非根际土壤, 而矢量角度显著大于非根际土壤, 说明根际土壤中微生物受到的能量限制弱于非根际土壤, P 限制相对于 N 限制强于非根际土壤。根系分泌物是植物根系释放到根际土壤中的可溶性低分子化合物(如糖类、氨基酸和有机酸等容易被微生物利用的物质[28–29,31]), 由于植物根系和土壤微生物对养分元素的吸收, 导致根际土壤中碳含量相对充足, 能量限制相对于养分限制更弱, 而养分元素相对受到限制。
冗余分析和 Pearson 相关性分析结果表明, 根际土壤中土壤含水量、pH 和土壤碳氮比对土壤胞外酶活性具有显著影响。其中, 土壤 pH 是影响土壤氧化酶活性的主要因素, 在全球范围内, POX 和PER 活性与土壤 pH 显著正相关, 这是因为 pH 增大会增加酚类物质的可溶性, 影响氧化酶转移电子的速率, 从而增强氧化酶活性[26,34]。但是, 本研究中POX 和 PER 活性与土壤 pH 显著负相关, 与已有的氧化酶活性与土壤 pH 正相关的观点[9]不一致, 可能是因为在东灵山森林根际土壤中, 土壤 pH 不是影响氧化酶活性的主导因素, 其原理有待进一步探究。
土壤含水量主要通过影响土壤中酶和底物的运输以及含氧量来影响土壤胞外酶活性。东灵山地区降雨集中在 6~8 月, 夏季土壤含水量(SWC)高, 有利于底物和水解酶的运输, 因此水解酶活性与SWC 正相关。土壤含水量高时, 土壤含氧量降低, 抑制氧化作用, 与氧化酶活性负相关。
土壤碳氮比反映土壤养分含量状况, 碳的可利用性越强, 微生物生产的与碳循环相关的酶越少, 酶活性越低。氧化酶活性 Q10 的变异范围远大于水解酶, 但线性混合效应模型的模拟结果表明, 季节对氧化酶 Q10 没有显著影响, 对水解酶 Q10 影响显著。Pearson 相关性分析结果表明, 不同于水解酶, 氧化酶 Q10 与土壤理化性质和微生物生物量具有显著相关性, 可能是由于受多种环境因素的影响, 氧化酶 Q10 变异范围大, 反而掩盖了其与某种单一环境因素的相关性。土壤胞外酶活性矢量特征与土壤养分状况显著相关。矢量长度, 即土壤能量相对于养分限制程度, 与可利用氮(AN)显著正相关, 表明土壤中 N 的有效性越强, 微生物受到的能量限制越强, 会分配更多的资源用于生产与碳循环相关的酶, 因此 BG 活性越强; 矢量角度, 即土壤中磷相对于氮的限制程度, 与EOC含量负相关。
3.4 植物功能性状与土壤酶活性温度敏感性和矢量特征的相关性
植物通过根系向地下分配的有机物和植物凋落物是土壤有机质的主要来源, 因此根系分泌物、根系生物量和叶片养分含量等都会对土壤有机质产生显著影响, 从而影响土壤胞外酶活性[15]。植物叶片和根系功能性状可以体现凋落物数量和质量, 指示土壤能量流动和养分循环过程等。植物根、叶的性状和土壤胞外酶活性等参数的冗余分析和相关性分析结果表明, 叶片和根系养分含量、细根生物量和细根密度对土壤胞外酶活性、温度敏感性和矢量特征有显著影响。
叶碳含量、细根生物量和细根密度与水解酶活性显著正相关。由于光合作用以及植物向地下部分输送养分, 随着生长季发展, 叶片中碳水化合物含量和地下细根密度、细根生物量逐渐增加, 根际土壤中根系分泌物随之增多, 易被利用的养分含量增多, 微生物分泌更多的水解酶来获取养分, 因此水解酶活性增强。Kaiser 等[35]认为土壤胞外酶活性在春季或秋季达到峰值, 是根系分泌物或凋落物的输入引起, 本文结果与之结果一致。
对于氧化酶, 其活性与叶碳氮比、细根生物量和细根密度显著负相关, 是由于叶片中的碳水化合物和根系分泌物中的主要成分均为易分解有机质, 微生物主要通过水解酶的活性催化其分解, 从而吸收利用, 因此氧化酶的活性相应地降低。
3.5 局限与展望
本研究主要测定了分别参与碳、氮和磷代谢的BG, NAG 和 AP 这 3 种水解酶和参与难分解有机质分解的 POX 和 PER 这两种氧化酶活性, 并测定土壤理化性质、微生物生物量和植物根叶性状等指标, 用于解释土壤胞外酶活性的季节动态, 未测定土壤磷含量相关指标, 在解释 AP 酶活性季节动态机制方面尚欠缺。由于冬季叶片和根系性状数据缺失(冬季落叶和土壤冻结), 在进行冗余分析时剔除了缺失数据, 导致数据量减小, 对根际土壤胞外酶活性、温度敏感性及其矢量特征的解释可能不够充分。今后的研究中会综合考虑土壤碳氮磷养分含量以及植物功能性状(包括常绿植物), 进一步探究土壤胞外酶活性、温度敏感性及其矢量特征季节动态的驱动机制。
4 结论
本研究通过测定北京东灵山两种植被类型——白桦林和辽东栎林的根际和非根际土壤中的微生物胞外酶活性、温度敏感性及其矢量特征, 探究胞外酶活性温度敏感性及矢量特征的季节动态。
结果表明, 东灵山森林土壤中胞外酶活性表现出显著的季节变化趋势, 且水解酶与氧化酶活性的季节变化趋势相反。水解酶活性在夏秋两季显著高于春冬两季; 氧化酶活性在夏秋季最低, 春冬季最高。季节对水解酶活性的温度敏感性具有显著影响, 但氧化酶活性的温度敏感性由于变异大, 掩盖了其季节变化趋势。
从总体上看, 东灵山土壤微生物受到 C 和 P 的共同限制, P 限制相对于 N 限制随着生长季进行而逐渐减弱。环境因素中, 温度是土壤水解酶季节动态的主要驱动因素, 但并不是唯一的因素; 土壤 pH和土壤养分状况对水解酶和氧化酶活性具有显著影响。
植物叶片和根系功能性状与土壤胞外酶活性及矢量特征之间具有显著相关性。根际土壤与非根际土壤中胞外酶活性、温度敏感性、矢量长度和矢量角度的差异主要由根际直接受到根系活动和根系分泌物的影响导致, 根际与非根际土壤在季节变化趋势上没有显著差异。虽然本研究中根际土壤与非根际土壤之间大多数指标没有显著差异, 但在以往同类研究中也有报道过, 可能的原因之一是采用抖根法时对土壤和根系的扰动影响了根际土与非根际土之间的差异[36]。本文研究结果可以促进对温带落叶阔叶林生态系统根际生物地球化学过程季节动态的理解。
参考文献
[1] Sinsabaugh R L, Follstad Shah J J. Ecoenzymatic stoichiometry and ecological theory. Annual Reviews of Ecology, Evolution & Systematics, 2012, 43(1): 313–343
[2] Jing X, Chen X, Fang J, et al. Soil microbial carbon and nutrient constraints are driven more by climate and soil physicochemical properties than by nutrient addition in forest ecosystems. Soil Biology & Bio-chemistry, 2020, 144(1): 107657
[3] Drake J E, Giasson M A, Spiller K J, et al. Seasonal plasticity in the temperature sensitivity of microbial activity in three temperate forest soils. Ecosphere, 2013, 4(6): 1–21
[4] Conant R T, Ryan M G, Agren G I, et al. Temperature and soil organic matter decomposition rates-synthesis of current knowledge and a way forward. Global Change Biology, 2011, 17(1): 3392–3404
[5] Burns R G. Ezyme activity in soil: location and a possible role in microbial ecology. Soil Biology & Biochemistry, 1982, 14(1): 423–427
[6] 赵子文, 王国梁, 吴阳, 等. 黄土高原不同植被带人工刺槐林土壤氮磷转化酶动力学参数及其温度敏感性. 应用生态学报, 2020, 31(8): 2515–2522
[7] 左宜平, 张馨月, 曾辉, 等. 大兴安岭森林土壤胞外酶活力的时空动态及其对潜在碳矿化的影响. 北京大学学报(自然科学版), 2018, 54(6): 1311–1324
[8] Moorhead D L, Sinsabaugh R L, Hill B H, et al. Vector analysis of ecoenzymes activities reveal constraints on coupled C, N and P dynamics. Soil Biology & Biochemistry, 2016, 93(1): 1–7
[9] Sinsabaugh R L. Phenol oxidase, peroxidase and organic matter dyniamics of soil. Soil Biology & Biochemistry, 2010, 42(1): 391–404
[10] German D P, Marcelo K R B, Stone M M, et al. The Michaelis-Menten kinetics of soil extracellular en-zyme in response to temperature: a cross-latitudinal study. Global Change Biology, 2012, 18(1): 1468–1479
[11] Pathan S I, Zifcakova L, Ceccherini M T, et al. Seasonal variation and distribution of total and ac- tive microbial community of β-glucosidase encoding genes in coniferous forest soil. Soil Biology & Bio-chemistry, 2017, 105(1): 71–80
[12] 及利, 马立新, 程政磊, 等. 大兴安岭北部不同海拔天然林土壤胞外酶化学计量特征及其季节动态. 应用生态学报, 2020, 31(8): 2491–2499
[13] Kuzyakov Y, Xu X. Competition between roots and microorganism for nitrogen: mechanisms and ecologi-cal relevance. New Phytologist, 2013, 198(1): 656–669
[14] Finzi A C, Abramoff R Z, Spiller K S, et al. Rhizosphere processes are quantitatively important components of terrestrial carbon and nutrient cycles. Global Change Biology, 2015, 21(1): 2082–2094
[15] Abramoff R Z, Finzi A C. Seasonality and partitioning of root allocation to rhizosphere soils in a midlatitude forest. Ecosphere, 2016, 7(11): e01547
[16] 姚辉, 胡雪洋, 朱江玲, 等. 北京东灵山 3 种温带森林土壤呼吸及其20年的变化. 植物生态学报, 2015, 39(9): 849–856
[17] Chen X, Ding Z, Tang M, et al. Greater variations of rhizosphere effects within mycorrhizal group than between mycorrhizal group in a temperate forest. Soil Biology & Biochemistry, 2018, 126: 237–246
[18] Ding Z, Tang M, Chen X, et al. Measuring rhizo-sphere effects of two tree species in a temperate forest: a comprehensive method comparison. Rhizo-sphere, 2019, 10: 100153
[19] Vance E D, Brookes P C, Jenkinson D S. An extrac-tion method for measuring soil microbial biomass C. Soil Biology & Biochemistry, 1987, 19(6): 703–707
[20] Jenkinson D S, Brookes P C, Powlson D S. Measuring soil microbial biomass. Soil Biology & Biochemistry, 2004, 36(1): 5–7
[21] German D P, Weintraub M N, Grandy A S, et al. Op-timization of hydrolytic and oxidative enzyme me-thods for ecosystem studies. Soil Biology & Bioche-mistry, 2011, 43(1): 1387–1397
[22] Bach C E, Warnock D D, van Horn D J, et al. Mea-suring phenol oxidase and peroxidase activities with pyrogallol, L-DOPA, and ABTS: effect of assay con-ditions and soil type. Soil Biology & Biochemistry, 2013, 67(1): 183–191
[23] Moorhead D L, Rinkes Z L, Sinsabaugh R L, et al. Dynamics relationships between microbial biomass, respiration, inorganic nutrients and enzyme activities: informing enzyme-based decomposition models. Frontiers in Microbiology, 2013, 4: 223
[24] Wallenstein M D, McMahon S K, Schimel J A P. Seasonal variation in enzyme activities and tem-perature sensitivities in Arctic tundra soils. Global Change Biology, 2009, 15(1): 1631–1639
[25] Di Nardo C, Cinquegrana A, Papa S, et al. Laccase and peroxidase isoenzymes during leaf litter decom-position of Quercus ilex in a Mediterranean ecosys- tem. Soil Biology & Biochemistry, 2004, 36(10): 1539–1544
[26] Sinsabaugh R L, Lauber C L, Weintraub M N, et al. Stoichiometry of soil enzyme activity at global scale. Ecology Letters, 2008, 11(1): 1252–1264
[27] Berg B, Hannus K, Popoff T, et al. Changes in organic-chemical components of needle litter during decomposition. Long-term decomposition in a Scots pine forest Ⅰ. Canadian Journal of Botany, 1982, 60 (8): 1310–1319
[28] Fioretto A, Papa S, Curcio E, et al. Enzyme dynamics on decomposing leaf litter of Citus incanus and Myrtus communis in a Mediterranean ecosystem. Soil Biology & Biochemistry, 2000, 32(13): 1847–1855
[29] Baldrian P. Fungal laccases-occurrence and proper-ties. FEMS Microbiology Reviews, 2006, 30(1): 215–242
[30] 高雨秋, 戴晓琴, 王建雷, 等. 亚热带人工林下植被根际土壤酶化学计量特征. 植物生态学报, 2019, 43(3): 258–272
[31] Phillips R P. The influence of soil fertility on rhizo-sphere effects in northern hardwood forest soils. Soil Science Society of America Journal, 2008, 72(1): 453–461
[32] Dai X, Fu X, Kou L, et al. C:N:P stoichiometry of rhizosphere soils differed significantly among over-story trees and understory shrubs in plantations in su-btropical China. Canadian Journal of Forest Research, 2018, 48(1): 1398–1405
[33] Kuzyakov Y. Review: factors affecting rhizosphere priming effects. Journal of Plant Nutrition and Soil Science, 2002, 165(1): 382–396
[34] 郭志明, 张心昱, 李丹丹, 等. 温带森林不同海拔土壤有机碳及相关胞外酶活性特征. 应用生态学报, 2017, 28(9): 2888–2896
[35] Kaiser C, Koranda M, Kitzler B, et al. Belowground carbon allocation by trees drives seasonal patterns of extracellular enzyme activities by altering microbial community composition in a beech forest soil. New Phytologist, 2010, 187(1): 843–858
[36] Gan D, Feng J, Han M, et al. Rhizosphere effects of woody plants on soil biogeochemical processes: a meta-analysis. Soil Biology & Biochemistry, 2021: 108310
Seasonal Dynamics of Activities, Temperature Sensitivities and Vector Characteristics of Extracellular Enzymes in Rhizosphere and Bulk Soils of Two Temperate Forests in Mt. Dongling, Beijing
FU Liangchen1,2, DING Zongju1, TANG Mao1,2, ZENG Hui2, ZHU Biao1,†
1. Key Laboratory for Earth Surface Processes of the Ministry of Education, Institute of Ecology, College of Urban and Environmental Sciences, Peking University, Beijing 100871; 2. School of Urban Planning and Design, Peking University Shenzhen Graduate School, Shenzhen 518055; † Corresponding author, E-mail:biaozhu@pku.edu.cn
Abstract Taking Betula platyphylla forest and Quercus wutaishanica forest, two main vegetation types in Mt. Dongling, Beijing as study object, we sampled paired rhizosphere and bulk soils in spring (May), summer (July), autumn (September) and winter (December) in 2017, and measured soil physiochemical properties, microbial biomass, functional traits of plant leaves and fine roots, activities of three hydrolases (BG, NAG, AP) and two oxidases (POX, PER) as well as their temperature sensitivities and vector characteristics. The results showed that EEA, Q10 and vector angle of soil in both forests had significantseasonal variation trends, and the seasonal variation trends of hydrolase activity and temperature sensitivity were opposite to those of oxidase. EEA, Q10 and vector characteristics of rhizosphere soil and bulk soil were different, but their seasonal variation trends were similar. Temperature was an important driving factor of the seasonal dynamics of soil EEA, Q10, and vector characteristics. Soil pH, soil nutrient content, leaf nutrient content, fine root biomass and fine root density showed significant effects on soil EEA,Q10, and vector characteristics.
Key words soil extracellular enzyme; temperature sensitivity (Q10); stoichiometry; rhizosphere; seasonal dynamics
doi: 10.13209/j.0479-8023.2022.035
国家自然科学基金(42141006, 31988102)资助
收稿日期: 2021-05-12;
修回日期: 2021-07-25