
图1 采样点布设情况
Fig.1 Distribution of sampling sites
摘要 为深入了解黄河玛曲至临河段这一重要水源地的水质, 于 2015 年春季和秋季分别在 10 个采样断面采集硅藻群落样品。利用形态学鉴定方法, 共鉴定出硅藻 2 纲 9 目 12 科 13 属 24 种。NMDS 和 ANOSIM 分析结果显示, 硅藻群落组成具有显著的季节差异, 春季硅藻的细胞密度和生物量均低于秋季。基于硅藻指示生物法和香农多样性指数(H)法进行水质评价, 发现指示多污带的 Nitzschia palea 在临河、青铜峡、兰州和玛曲等站点均有检出, 黄河玛曲至临河段的硅藻多样性较低, 整体水质为轻-中度污染。此外, 该河段春季的水质(H=1.91±0.67)稍好于秋季(H=1.58±0.49), 可能与春季更高的光照强度有关。
关键词 黄河玛曲至临河段; 硅藻; 群落组成; 水质评价
河流是连接陆地和海洋生态系统的重要纽带, 是自然界能量流动和物质循环的重要途径[1]。硅藻在河流生态系统中分布广泛, 是河流环境中重要的初级生产者[2]。硅藻是生态系统中碳、氮、磷、硅等物质生物地球化学循环的重要参与者[3], 是生态系统食物链的重要组成部分[4], 对维持河流生态系统的稳定至关重要。硅藻对外界环境的变化敏感, 并且反应迅速[5], 是理想的水质指示生物[6]。探究河流硅藻群落结构并基于此进行水质评价, 可为河流水生态环境的保护和管理提供科学依据[7-9]。
关于河流硅藻群落结构及水质评价的研究较多, 积累了丰富的经验。硅藻是河流浮游植物的主要组成部分[10-12], 可以贡献河流浮游植物细胞密度和生物量的 60%左右[13]。冯慧等[14]对黄河龙羊峡至刘家峡河段浮游植物的研究表明, 硅藻贡献了近一半的藻类细胞密度, 小环藻(Cyclotella sp.)和针杆藻(Synedra sp.)在水体中广泛分布。硅藻的群落组成表现出明显的季节差异[15-16]。Li 等[17]对长江河口区的研究表明, 硅藻在秋冬季浮游植物群落中的占比显著高于夏季。硅藻在环境监测中应用广泛, 部分硅藻的环境适应范围较小, 其检出情况可用于指示不同的水质, 如梅尼小环藻(Cyclotella mene-ghiniana)可以指示中-富营养水体[18], 广缘小环藻(Cyclotella bodanica)可以指示酸化水体[19]。硅藻指数也广泛应用于评价水体的清洁状况与营养化程度[20]。薛浩等[21]应用硅藻生物指数(biological dia-tom index, IBD)、富营养污染硅藻指数(diatom eu-trophication pollution index, EPI-D)和特定污染敏感指数(specific pollution sensitivity index, IPS)对甘河进行水生生态评价。辛晓云[22]对河南南湾水库的浮游硅藻进行分析, 并采用多样性指数和均匀性指数进行水质评价。
黄河是中华民族的母亲河, 其生态保护和高质量发展是国家重大战略需求。黄河是典型的高含沙河流, 上游河段是其主要清水来源, 贡献全河 60%以上的径流量[23]。玛曲至临河段是上游河段的主要部分, 流经重要的工业城市兰州, 同时受渔业养殖和大坝修筑等人类活动的干扰较多[24], 水生态环境受严峻考验。本文探究玛曲至临河段硅藻群落的动态变化, 并对该河段的水质进行评价, 以期为黄河上游的水质监测与保护提供理论依据, 为黄河流域的高质量发展提供科学支撑。
参照水利部黄河水利委员会的水文站布设情况, 我们在玛曲至临河段设 10 个采样点: 玛曲(MQ)、贵德(GD)、循化(XH)、小川(XC)、新城桥(XCQ)、兰州(LZ)、安宁渡(AND)、下河沿(XHY)、青铜峡(QTX)、临河(LH), 采样点分布如图 1 所示。
我们于 2015 年 5 月和 9 月进行样品采集, 同步采集浮游植物的定性和定量样品, 采样方法参照《淡水浮游生物调查技术规范》(SC/T 9402—2010)。采集定性样本时, 用 25 号浮游生物网将藻类捕获到 PE 瓶中, 立即加入 5%的甲醛溶液进行固定, 0~4ºC 避光保存运送至实验室, 使用 10×40 倍光学显微镜(Olympus BX51, Japan), 参考《中国淡水藻类》[25]进行藻种鉴定。采集定量样品时, 在每个采样点取 2L 混合水样, 立即加入 30mL 鲁哥试液(Lugol’s solution)进行固定, 于室内在 0~4ºC 避光沉淀 48 小时, 通过虹吸去除上清液, 将样品浓缩至30~50mL, 使用计数板在显微镜下计数。

图1 采样点布设情况
Fig.1 Distribution of sampling sites
使用流速仪测定水体流量(Q), 使用 YSI-85 水质分析仪(YSI, USA)现场测定水体 pH、水温(WT)和溶解氧(DO)等指标, 同时留取部分水样用于化学需氧量(COD)、氨氮和生物需氧量(BOD)等理化指标的测定, 具体方法参考文献[26-27]。
1.3.1细胞密度与生物量的计算
用浮游生物计数框行格法分类计数后, 按式(1)进行细胞密度的换算:
 (1)
(1)其中, Ni 为每升水中第 i 种浮游植物的细胞数量(个/ L), A 为计数框的面积(mm2), Ai 为计数面积(mm2), Vm 为 1L 水样经沉淀浓缩后的样品体积(mL), V 为原样本水量(mL), ni 为每片计数所得的第 i 种浮游植物的细胞数(个)。参照文献[15]的方法确定浮游植物细胞体积, 并按比重为 1 换算成生物量(mg/L)。
1.3.2基于香农多样性指数的水质评价
香农多样性指数(Shannon index, H)可以反映硅藻的物种多样性, H 值越高, 说明硅藻的物种多样性越高, 水质越好。计算公式为
H=−∑(Pi)ln(Pi), (2)
Pi 表示第 i 个种占总属的比例。有机污染物在河流中完成自净, 并形成连续的污化带, H 值与河流污染带类别及水质的对应情况如表 1 所示。
1.3.3数据分析
通过非度量多维尺度分析(NMDS), 基于样品间 Bray-Curtis 距离, 探究浮游植物群落的物种组成, 进一步通过相似性分析(ANOSIM)检验浮游植物群落组成的组间差异。使用 VIF 方差膨胀因子(varian-ce inflation factor)分析过滤掉呈现共线性的环境变量(VIF>10), 并通过冗余分析(RDA)确定筛选后的环境变量对浮游硅藻的影响。上述分析通过 R 语言(v3.5.2)的 vegan, ggplot2 和 maptools 等程序包实现。此外, 还使用 STAMP 软件(v2.1.3)识别季节偏好性藻种。使用 SPSS 18.0 进行单因素方差分析(one-way ANOVA), 用于检验多样性指数和环境变量的季节差异性。
表1 H值与河流污染状况的对应[28]
Table 1 Correspondence between H and pollution level in river[28]

H污染带类别水质 H<1多污带水体重污染 1≤H<2α-中污带水体中污染 2≤H<3β-中污带水体轻污染 H≥3寡污带水质清洁
黄河玛曲至临河段共鉴定出硅藻 2 纲 9 目 12 科13 属 24 种, 硅藻的细胞密度及生物量的沿程分布如图 2 所示。春季硅藻细胞密度在 3.00×104~82.0× 104 个/L 之间波动, 生物量在 0.045~1.650 mg/L 之间波动; 秋季硅藻细胞密度在 6.5×104~273.3×104 个/L 之间波动, 生物量在 0.055~3.467mg/L 之间波动。春季的细胞密度和生物量均低于秋季, 且硅藻的细胞密度和生物量在春秋两季的变化基本上一致。春季硅藻的细胞密度和生物量在青铜峡水库下游的青铜峡(QTX)和临河(LH)最高。青铜峡水库为“汛期排沙, 汛末拉沙”的运行模式, 5 月正处于青铜峡水库的排沙期, 因此下游河段呈淤积状态[29]。河段淤积会使水流变缓, 甚至呈现静水状态[30], 导致水体透明度升高及营养盐累积等问题[31], 进而促进硅藻细胞密度和生物量的增加。玛曲(MQ)站点硅藻细胞密度和生物量在春秋两季(尤其秋季)较高, 可能由两个方面的因素导致。其一, 该采样断面地势平坦、水流平缓; 其二, 附近的玛曲渔场排放充足的营养物质, 为硅藻的生长提供有利条件[32]。
硅藻属水平的物种分布见图 3。该河段硅藻优势属(相对丰度超过 1%)依次为 Cyclotella (32.19%), Synedra (18.62%),Navicula (9.04%),Asterionella (8.29%), Achnanthes (8.28%), Diatoma (8.02%), Nitz-schia (7.08%), Fragilaria (4.47%), Cymbella (1.76%)和 Gomphonema (1.52%)。本研究与前人对黄河的上对黄河上游龙羊峡至积石峡段的研究表明硅藻门游部分河段中硅藻的研究结果类似, 如陈燕琴等[33]的 Cyclotella, Diatoma, Asterionella, Fragilaria 和 Sy-nedra 等在水体中占据优势地位, 曲修杰[34]发现Synedra 和 Navicula 是黄河玛曲段优势硅藻。

图2 硅藻细胞密度在春季(a)和秋季(b)以及硅藻生物量在春季(c)和秋季(d)的沿程分布
Fig.2 Cell density in spring (a) andautumn (b), as well as the biomass in spring (c) and autumn (d) of the diatoms
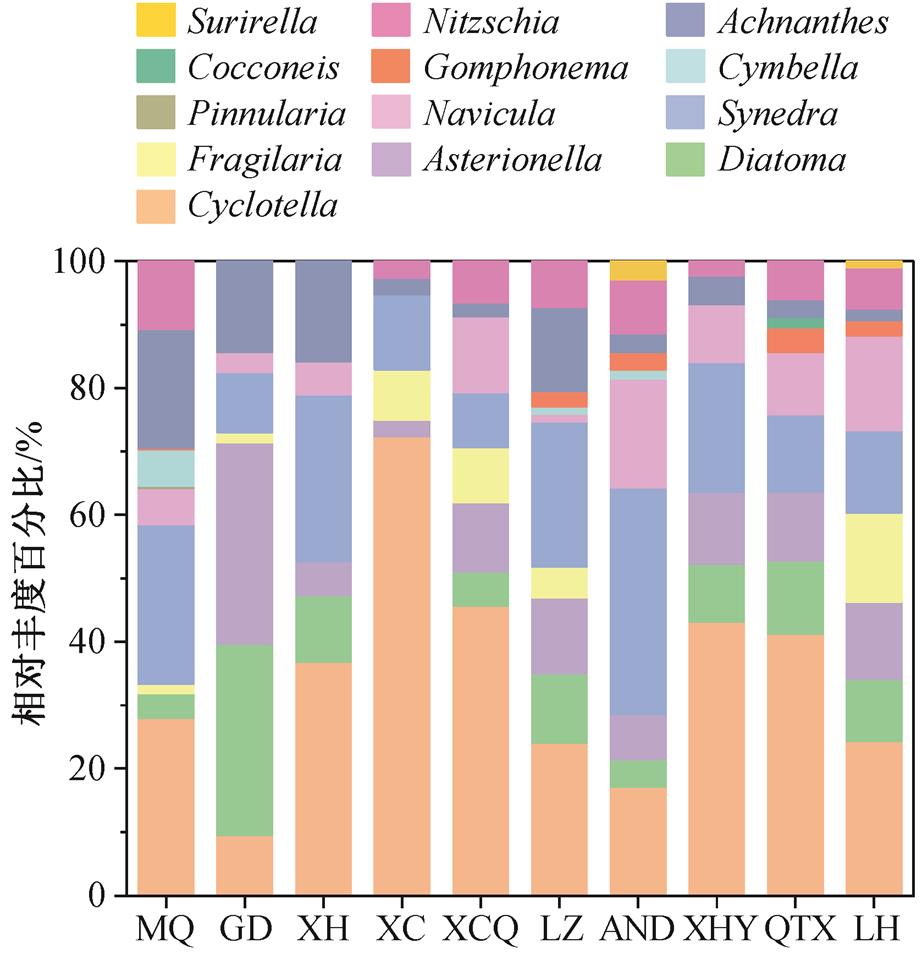
图3 硅藻群落在属水平的物种组成
Fig.3 Composition of the diatom community at the genus level
玛曲至临河段在春季和秋季分别鉴定出硅藻23 和 16 种, 春季的硅藻丰富度(95.83%)高于秋季(66.67%)。其中, 春季特有种为 Diatoma sp., Navicula radiosa, Navicula anglica, Pinnularia sp., Cymbella cymbiformis, Gomphonema intricatum, Cocconeis placentula 和 Nitzschia intermedia, 秋季特有种为Cocconeis pediculus。NMDS (图 4(a))和ANOSIM (图 4(b))分析结果表明, 硅藻群落的组成结构具有显著的季节差异(R=0.64, p=0.001)。使用STAMP 软件探究具有明显季节差异的浮游硅藻, 发现 Asterionella formosa, Diatoma sp., Navicula radiosa 和 Navicula cryptocephala 表现出显著的春季偏好性, 而 Cyclotella sp.表现出显著的秋季偏好性(图 4(c))。研究表明, 硅藻群落的季节演替可能由季节变化及不同藻种的季节敏感性共同决定, 例如硅藻对温度变化比较敏感, 不同季节偏好性的硅藻对季节的变化反应不同, 冷水性硅藻更适合在冬天生存, 温水性硅藻更适合在夏天生存[35-36]。
2.3.1基于硅藻指示生物的水质评价
部分硅藻对环境适应度较低, 只能在特定的环境中生存, 常作为水质指示生物, 指示水体营养水平及污染状况[6,37]。本研究鉴定出的 24 种硅藻中, 有 3 种已被报道用做水质指示种。其中, Diatoma vulgare 是废水污染的指示种[8], Cymbella affinis 是水体中营养状态的指示种[38], Nitzschia palea 可以指示多污带[39], 这 3 个指示藻种在玛曲至临河段的分布见图 5。Diatoma vulgare 检出较少, 仅春季在临河(LH)站点、秋季在贵德(GD)站点检出。Cymbella affinis 春、秋季分别在兰州(LZ)、玛曲(MQ)站点检出。兰州是西北最重要的城市, 人类活动排放的工业废水和生活污水等会影响水质, 而玛曲站点受渔场营养物质排放的影响, 水体呈中营养状态[34]。Nitzschia palea 在春秋两季的临河、青铜峡、兰州和玛曲等多个站点检出, 表明该河段部分站点处于多污带。整体而言, 玛曲至临河段处于中营养状态, 水质为轻度-中度污染。冯慧等[14]使用指示生物法对黄河龙羊峡-刘家峡河段进行水质评价, 检出指示水体中营养的小环藻属(Cyllotella)和指示水体富营养的针杆藻属(Synedra)等, 认为该河段为轻度污染。本文结果与之相似。
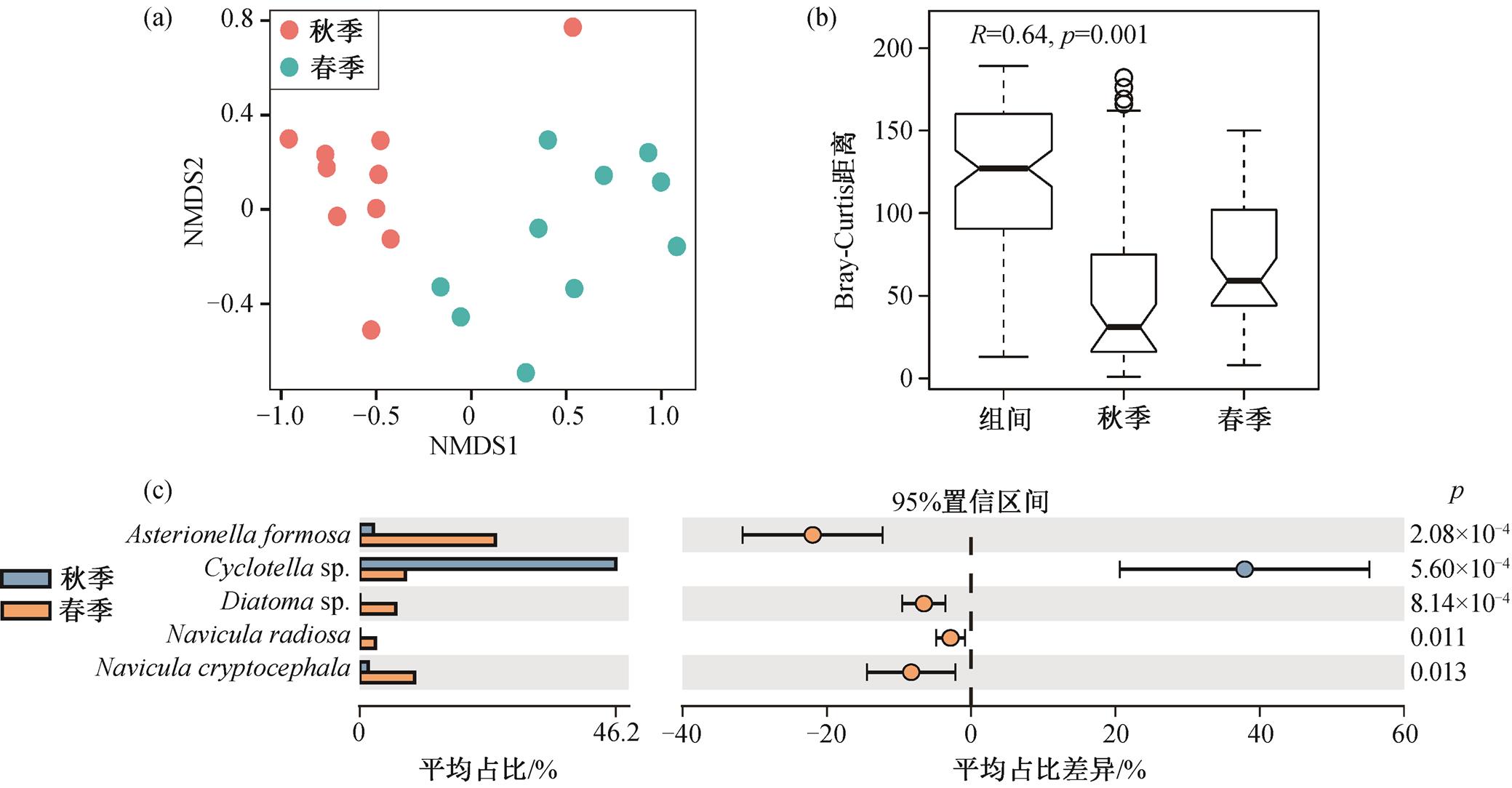
图4 NMDS分析(a)和ANOSIM分析(b)揭示春季和秋季硅藻群落的组成差异以及具有显著季节差异的硅藻种(c)
Fig.4 NMDS (a) and ANOSIM (b) analysis showing the composition differences of diatom community between spring and autumn, diatom species exhibiting significant seasonal differences (c)
2.3.2基于香农多样性指数的水质评价
硅藻香农多样性指数的沿程分布如图 6 所示, 玛曲至临河段的 H 值在 1.32~2.34 之间。该河段香农多样性整体上较低, 处于中污带, 属轻度-中度污染, 春秋两季的硅藻多样性有显著差异(p=0.028)。春季生物多样性较高(H=1.91±0.67), 虽整体上属于α-中污带, 但玛曲、兰州、安宁渡、青铜峡和临河站点属 β-中污带(2≤H<3), 水质较好, 污染较轻。秋季生物多样性较低(H=1.58±0.49), 除玛曲站点属 β-中污带, 其他均为 α-中污带, 水质为中度污染。综上所述, 玛曲至临河段水质为轻度-中度污染, 与硅藻指示生物法所得结果一致。本文研究结果与前人对黄河的上游部分河段水质评价结果相似, 如白海锋等[40]利用浮游动物多样性指数对黄河兰州市区段水质进行评价, 认为该河段处于轻-中度污染, 冯慧等[14]的研究结果表明龙羊峡-刘家峡河段浮游植物的香农多样性指数为 1.41~2.83, 处于轻度污染。
香农多样性指数反映硅藻的群落多样性, 硅藻对环境变化敏感, 群落结构易受环境因子影响。本研究同时测定了水体的理化指标, 结果见图 7。该河段水体的 pH 值在 8.2~8.5 波动, 呈弱碱性。溶解氧浓度(7.7±1.8mg/L)、化学需氧量(2.20±1.9mg/L)和氨氮浓度(0.25±0.15mg/L)均满足《地表水环境质量标准》(GB 3838—2002)中Ⅱ类水标准。通过单因子方差分析, 发现光照、流量、溶解氧和降水量存在显著的季节差异, 其中, 春季的直接光照辐射(20531.70±2078.70kJ/(m2·d))高于秋季(15631.70±1540.30kJ/(m2·d)), 春季流量(920.20±770.20m3/s)高于秋季(583.50±419.50m3/s), 春季溶解氧(7.93±2.03mg/L)高于秋季(7.46±1.04mg/L), 春季降水量(53.40± 60.60mm)低于秋季(39.50±39.50 mm)。
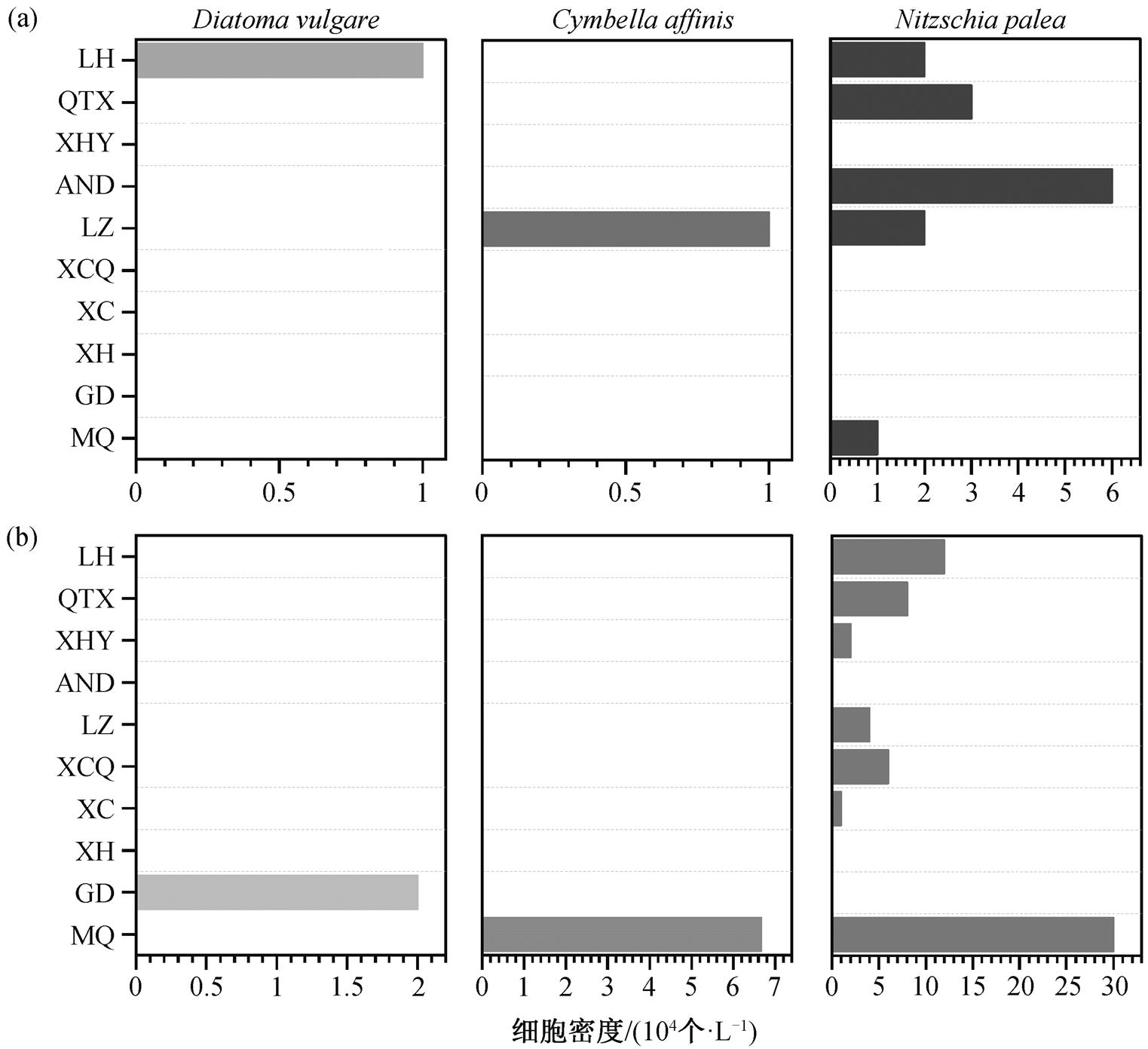
图5 3种典型水质指示藻种在春季(a)和秋季(b)的分布
Fig.5 Distribution of three typical species used for evalua-ting the water quality in spring (a) and autumn (b)
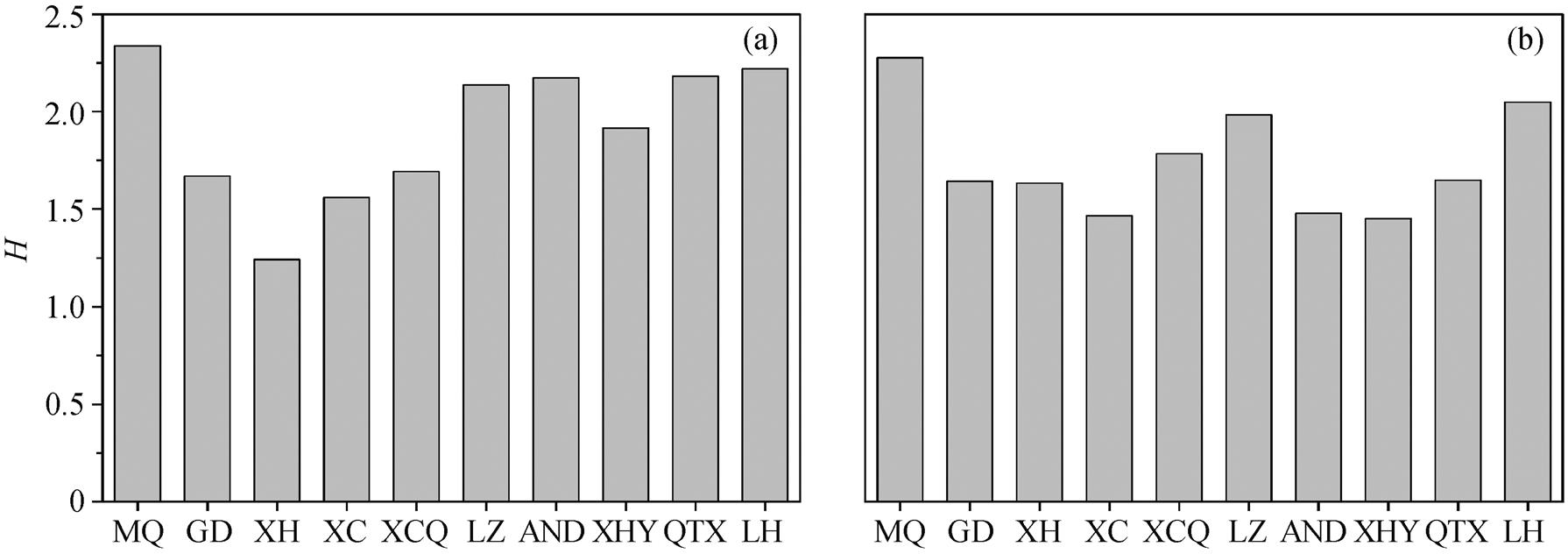
图6 H值在春季(a)和秋季(b)的沿程分布
Fig.6 Distribution of H in spring (a) and autumn (b)

图7 环境因子的沿程分布
Fig.7 Distributions of environmental factors
进一步探究影响硅藻群落组成的关键影响因素。如图 8 所示, 冗余分析(RDA)前两个轴的解释度之和为 63.20%, 表明这些环境因子显著地影响硅藻群落的组成结构, 其中光照强度(DNR)的影响最大(R2=0.3909, p=0.011)。光照是硅藻光合作用的重要条件, 光照辐射强度会影响硅藻的代谢和分布[41]。与王爱军等[42]对东海赤潮高发区硅藻生长与演替的研究结果类似, 即光照是硅藻群落结构的主要驱动因子。因此, 春季较高的光照辐射可能有利于硅藻生长, 导致春季硅藻多样性高于秋季。

图8 RDA分析表明环境因子对硅藻群落组成的影响
Fig.8 RDA analysis showing the influence of environmental parameters on diatom community
本文对黄河玛曲至临河段硅藻的群落结构特征进行探究, 并进行水质评价, 得到如下结论。
1)镜检共鉴定出硅藻 2 纲 9 目 12 科 13 属 24 种, Cyclotella 和 Synedra 是玛曲至临河段的硅藻优势属, 相对丰度均超过 10%。
2)硅藻群落的组成在春秋季有明显的差异, 春季硅藻细胞密度和生物量在青铜峡和临河最高, 而秋季在玛曲最高, 秋季细胞密度和生物量高于春季。Asterionella formosa, Diatoma sp., Navicula radiosa 和 Navicula cryptocephala具有显著的春季偏好性, Cyclotella sp.具有明显的秋季偏好性。
3)黄河玛曲至临河段的水质在春季(H=1.91)略好于秋季(H=1.58)。光照条件是硅藻群落结构的主要驱动因素, 可能促进春季较高的硅藻多样性。
4)玛曲至临河段硅藻多样性较低, 整体水质为轻-中度污染, 表明玛曲至临河段生态较脆弱, 迫切需要加强生态保护。
参考文献
[1]Lembi C A .Limnology, lake and river ecosystems.Journal of Phycology, 2001, 37(6): 1146-1147
[2]Thangaraj S, Sun J.The biotechnological potential of the marine diatom Skeletonema dohrnii to the ele-vated temperature and pCO2 concentration.Marine Drugs, 2020, 18(5): 259
[3]Thomas M K, Kremer C T, Klausmeier C A, et al. A global pattern of thermal adaptation in marine phy-toplankton.Science, 2012.338: 1085-1088
[4]Sellers T, Bukaveckas P A.Phytoplankton production in a large, regulated river: a modeling and mass balance assessment.Limnology and Oceanography, 2003, 48(4): 1476-1487
[5]García-Seoane R, Fernández J A, Villares R, et al.Use of macroalgae to biomonitor pollutants in coastal waters: optimization of the methodology.Ecological Indicators, 2017, 84: 710-726
[6]Chen X, Zhou W, Pickett S T A, et al.Diatoms are better indicators of urban stream conditions: a case study in Beijing, China.Ecological Indicators, 2016, 60: 265-274
[7]Moniz M B J, Kaczmarska I.Barcoding diatoms: is there a good marker?.Molecular Ecology Resources, 2009, 9(Suppl 1): 65-74
[8]Bellinger B J, Cocquyt C, O’Reilly C M.Benthic diatoms as indicators of eutrophication in tropical streams.Hydrobiologia, 2006, 573(1): 75-87
[9]Apothéloz-Perret-Gentil L, Cordonier A, Straub F, et al.Taxonomy-free molecular diatom index for high-throughput eDNA biomonitoring.Molecular Ecology Resources, 2017, 17(6): 1231-1242
[10]Bogatov V V, Fedorovskiy A S, Nikulina T V.Role of hydrological factors in species diversity of algal communities: a case study of the Komarovka River, Primorye, Russia.Russian Journal of Ecology, 2013, 44(6): 468-474
[11]Xu Hangzhou, Zhang Shasha, Ma Guangxiang, et al.18S rRNA gene sequencing reveals significant influ-ence of anthropogenic effects on microeukaryote di-versity and composition along a river-to-estuary gra-dient ecosystem.Science of the Total Environment, 2020, 705: 135910
[12]周杰.黄河兰州段水体生物群落结构演替规律研究[D].郑州: 河南农业大学, 2012
[13]张东, 隋正红, 王春燕, 等.一株海洋微型硅藻 的形态学和分子生物学鉴定.海洋学报(中文版), 2010, 32(2): 168-173
[14]冯慧, 张建军, 杨兴中, 等.黄河龙羊峡-刘家峡河段浮游植物调查及水质的生物评价.安徽农业科学, 2008, 36(33): 14716-14717
[15]Sun J, Liu D.Geometric models for calculating cell biovolume and surface area for phytoplankton.Jour-nal of Plankton Research, 2003, 25(11): 1331-1346
[16]Zhang J L, Zheng B H, Liu L S, et al.Seasonal variation of phytoplankton in the DaNing River and its relationships with environmental factors after impounding of the Three Gorges Reservoir: a four-year study.Procedia Environmental Sciences, 2010, 2: 1479-1490
[17]Li H M, Tang H J, Shi X Y, et al.Increased nutrient loads from the Changjiang (Yangtze) River have led to increased Harmful Algal Blooms.Harmful Algae, 2014, 39: 92-101
[18]陈豪, 左其亭, 张永勇, 等.淮河中上游浮游植物群落结构特征及营养状况评价.中国农村水利水电, 2019(2): 1-6
[19]Amano Y, Takahashi K, Machida M.Competition between the cyanobacterium Microcystis aeruginosa and the diatom Cyclotella sp.under nitrogen-limited condition caused by dilution in eutrophic lake.Jour-nal of Applied Phycology, 2012, 24(4): 965-971
[20]王玉智.水环境监测和评价中的硅藻指数运用.陕西水利, 2020(11): 112-113
[21]薛浩, 孟凡生, 郑丙辉, 等.硅藻指数在嫩江支流甘河的适用性评估.环境科学研究, 2020, 33(3): 617-625
[22]辛晓云.河南南湾水库浮游硅藻的种群结构与水质污染评价初步研究.生态学杂志, 2003, 22(5): 125-126
[23]马佳宁, 高艳红.近50年黄河上游流域年均降水与极端降水变化分析.高原气象, 2019, 38(1): 124-135
[24]任珺, 王刚.黄河上游水质分析与污染治理对策研究.北京: 中国环境科学出版社, 2008
[25]魏印心.中国淡水藻志.北京: 科学出版社, 2014
[26]Yuxin L, Xuming X U, Ting W, et al.Microscopic view of phytoplankton along the Yangtze River.Sci-ence China (Technological Sciences), 2019, 62(11): 1873-1884
[27]Wang J, Liu Q, Zhao X, et al.Molecular biogeogra-phy of planktonic and benthic diatoms in the Yangtze River.Microbiome, 2019, 7(1): 153
[28]朱娜, 杨丽坤, 孙绍永, 等.辽河辽阳段浮游植物多样性调查及水质评价.河北渔业, 2013(8): 35-36
[29]孙赞盈, 王育杰, 郑艳爽, 等.青铜峡水库排沙对下游河道冲淤的影响.人民黄河, 2014, 36(10): 9-11
[30]Bonecker C C, Simões N R, Minte-Vera C V, et al.Temporal changes in zooplankton species diversity in response to environmental changes in an alluvial valley.Limnologica — Ecology and Management of Inland Waters, 2013.43(2): 114-121
[31]Fushun W, Maberly S C, Baoli W, et al.Effects of dams on riverine biogeochemical cycling and ecology.Inland Waters, 2018, 8(2): 130-140
[32]张军燕, 张建军, 杨兴中, 等.黄河上游玛曲段春季浮游生物群落结构特征.生态学杂志, 2009, 28 (5): 983-987
[33]陈燕琴, 申志新, 刘玉婷.黄河上游龙羊峡至积石峡段春秋季浮游植物群落结构及多样性评价.水生态学杂志, 2014, 35(5): 52-59
[34]曲修杰.黄河玛曲段水产种质资源保护区的调查研究[D].北京: 中国农业科学院, 2009
[35]Xiang K F, Guang G.Hypothesis on cyanobacteria bloom-forming mechanism in large shallow eutrophic lakes.Acta Ecologica Sinica, 2005, 25(3): 589-595
[36]Diehl S, Berger S, Ptacnik R, et al.Phytoplankton, light, and nutrients in a gradient of mixing depths: field experiments.Ecology, 2002, 83(2): 399-411
[37]Potapova M G, Charles D F, Ponader K C, et al.Quantifying species indicator values for trophic dia-tom indices: a comparison of approaches.Hydrobio-logia, 2004, 517(1/2/3): 25-41
[38]董旭辉, 羊向东, 王荣.长江中下游地区湖泊富营养化的硅藻指示性属种.中国环境科学, 2006, 26 (5): 570-574
[39]Ector L, Dohet A, Hoffmann L, et al.Identification of benthic invertebrate and diatom indicator taxa that distinguish different stream types as well as degraded from reference conditions in Luxembourg.Animal Biology, 2008, 58(4): 419-472
[40]白海锋, 王丰, 张星朗, 等.黄河兰州市区段秋季浮游动物群落结构特征.水生态学杂志, 2015, 36 (5): 51-57
[41]Domingues R B, Anselmo T P, Barbosa A B, et al.Light as a driver of phytoplankton growth and pro-duction in the freshwater tidal zone of a turbid estua-ry.Estuarine Coastal & Shelf Science, 2011, 91(4): 526-535
[42]王爱军, 王修林, 王江涛, 等.光照对东海赤潮高发区春季硅藻生长的影响.中国海洋大学学报(自然科学版), 2006, 36(增刊1): 173-178
Diatom Community Structure and Water Quality Evaluation in the Maqu-Linhe Section of the Yellow River
Abstract To further investigate the water quality in the Maqu-Linhe section of the Yellow River, which is an important water source, diatoms were collected from ten sites in spring and autumn of 2015.Based on the morphological identification method, 24 species belonging to 2 classes, 9 orders, 12 families, and 13 genera were characterized.The cell density and biomass of diatom were lower in spring than those in autumn, which was further proved by NMDS and ANOSIM analysis.Water quality assessment based on indicator diatoms revealed that Nitzschia palea indicating polysaprobic zone was detected in some sites such as Linhe, Qingtongxia, Lanzhou, and Maqu, which was consistent with the assessment from the Shannon diversity index (H).Water quality was characterized as slight-moderate pollution with low diatom diversity in the Maqu-Linhe section of the Yellow River.The water quality of this river section in spring (H=1.91±0.67) was slightly better than that in autumn (H=1.58±0.49), which might be related to the higher DNR in spring.
Key words Maqu-Linhe section of the Yellow River; diatom; composition; water quality assessment
doi: 10.13209/j.0479-8023.2021.124
收稿日期: 2021-03-18;
修回日期: 2021-04-21
中国博士后科学基金(2020M680243)资助