全氟辛烷磺酸类物质(perfluorooctane sulfonate,PFOS, 包括全氟辛烷磺酸及其盐类物质)是持久性有机污染物(POPs)的典型代表。近年来, 越来越多的研究发现 PFOS 对水生生物具有广泛的毒性效应[1]。此外, 早在 20 世纪 70 年代就出现有关海洋环境中塑料碎片的报道[2]。2004 年, Thompson 等[3]第一次提出微塑料(Microplastics, MP)概念, 国际上通常将直径小于 5 mm 的塑料碎片或颗粒定义为微塑料[4]。海洋中微塑料污染的来源比较广泛, 主要分为 3 个方面: 1) 陆源输入; 2) 海源输入; 3) 海岸线上人类活动带来的微塑料污染。
微塑料广泛存在, 在自然作用下能够变成更小的表面更加不规则的微粒, 这些微粒具有较大的比表面积, 可以吸附海水中其他污染物, 成为这些污染物进入水生生物的载体。因此, 要阐明微塑料在水环境中真实的生态风险, 对微塑料单一毒性效应的研究远远不够, 需要结合微塑料与其他污染物之间的相互作用来进行综合评估。目前, 微塑料与其他污染物综合生态风险效应的研究在目标污染物选取方面集中在多环芳烃(PAHs)、有机氯农药、石油烃、双酚 A、多氯联苯(PCBs)、多溴联苯醚(PBDEs)[5–8]和一些重金属(如铜、铬和铅等)[9–10]。近年来, 全氟化合物、药物及个人护理品(PPCPs)等新型污染物与微塑料相互作用的研究逐渐增多[11–12]。对微塑料在水生生物中复合毒性效应的研究与单一毒性效应的研究类似, 主要毒理指标包括滤食行为、死亡率、生长产卵情况、氧化应激系统响应情况、相关炎症反应以及特定基因表达等分子生物学层面的效应。有关污染物在水环境中的毒性效应,一般选取底栖生物作为研究对象,特别是贻贝类(如翡翠贻贝和紫贻贝), 通常作为评估水生环境健康状况和监测海洋污染的指示生物。
基于上述背景, 本研究针对海洋生态研究的最新趋势, 探索 PFOS 或微塑料单独暴露以及二者复合暴露对翡翠贻贝滤食率、活性氧水平(ROS)、抗氧化系统(超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、谷胱甘肽巯基转移酶(GST)活性和谷胱甘肽还原酶(GR)活性)以及丙二醛(MDA)含量的影响, 以期为海洋水质评价、水产品安全评估及微塑料和PFOS 污染的有效控制提供科学依据。
1 材料与方法
1.1 试剂与材料
全氟辛烷磺酸钾(C8F17KO3S, >98%)、二甲基亚砜(DMSO)、磷酸缓冲盐溶液(PBS)和中性红均购自上海麦克林生化科技有限公司, 纯度为 AR 级。微塑料小球购自加拿大 Invitrogen 公司, 材质为聚苯乙烯, 直径为 0.2 μm。蛋白试剂盒、ROS 试剂盒、SOD 试剂盒、CAT 试剂盒、GSH-ST 试剂盒、GR 试剂盒和 MDA 试剂盒均购自南京建成生物工程研究所。实验用水为 Milli-Q 超纯水。
野生型翡翠贻贝(Perna viridis)购自广东省深圳市蛇口海鲜市场。暴露实验前, 将翡翠贻贝在实验室驯化一周。驯化容器为两个 30 L 塑料容器, 驯化用海水取自远离海岸的深层自然海水, 经 0.7 μm 滤膜过滤。驯化期间海水温度维持在 25°C 左右, 盐度维持在 32‰, 12 小时交替施加人工光源, 昼夜不间断地曝气。喂食用小球藻 Chlorella vulgaris 购自湖北省武汉市中国科学院水生生物研究所, 喂养浓度维持在 1.25×106 cells/L。驯化结束后, 选择色泽健康且身长在 7~8 cm 的翡翠贻贝进行暴露实验。
1.2 毒性实验
驯化完毕后, 使用 10 L 塑料容器进行暴露实验。加入 8 L 过滤后的自然海水(未检出 PFOS), 定量地添加 PFOS 溶液和微塑料溶液, 二者混合暴露实验浓度设置如表 1 所示。PFOS 使用 DMSO 助溶,助溶剂浓度≤ 0.1 mL/L。待污染物在固液两相分配平衡后, 加入大小均匀(7~8 cm)的 14 只翡翠贻贝,调节温度为 25 °C, 盐度为 32‰。通过不断地曝气,既可以满足翡翠贻贝的需氧量, 还有助于微塑料小球分散均匀。调节人工光照, 保持昼夜各 12 小时,每天早晚两次定时投喂小球藻, 每两天更换一次海水。同时设置溶剂空白对照体系(加入 0.8 mL DMSO, 不加 PFOS 和微塑料)和平行实验体系(3 组平行)。暴露实验时长为 7 天。
表1 PFOS 和微塑料暴露实验二元混合设计方案
Table 1 Experimental design of PFOS and microplastics exposure
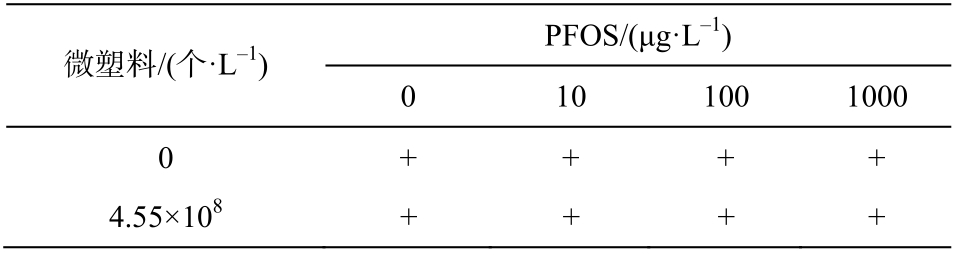
微塑料/(个·L‒1) PFOS/(μg·L‒1)0 10 100 1000 0 + + + +4.55×108 + + + +
1.3 滤食率的测定
滤食率的测定参考 Cooper 等[13]的研究方法。7天暴露实验完成后, 从各暴露组随机取出一只翡翠贻贝, 放入 500 mL 塑料烧杯中。每个烧杯中加入200 mL 1 mg/L 的中性红溶液, 避光静置 2 小时。每个暴露组进行 3 次滤食率的测定。使用紫外–可见分光光度计(DR6000, 美国哈希公司)测量滤食前、后烧杯中溶液的吸光度(波长设定为 530 nm), 利用标准曲线换算出对应的中性红浓度, 进一步根据下式计算各暴露组翡翠贻贝的滤食率。

其中, m 代表滤食率(mL/(只·h)), M 代表中性红溶液的体积(M=200 mL), n 代表测试中翡翠贻贝的个数(n=1), t 代表测定时长(t=2 h), C0 代表中性红溶液原始浓度, Ct 代表滤食2 小时后中性红的浓度。
1.4 活性氧、脂质过氧化水平及氧化应激酶的测定
活性氧的测定采用荧光探针法。首先使用酶消化法, 将翡翠贻贝各器官制备成单细胞悬液, 随后加入 DCFH-DA (2,7-dichlorofuorescin diacetate), 初始工作浓度为 10 µM。37°C 孵育细胞 30 分钟, 收集孵育(探针标记)后的单细胞悬液, 1000g 离心 5~10 分钟, 收集单细胞, 用 PBS 洗涤 1~2 次, 离心收集细胞沉淀物重悬后, 利用多功能微孔板酶标仪(Envision 2104, 美国 PerkinElmer 公司)进行荧光测定, 激发波长为 500 nm、发射波长为 520 nm。同时取部分单细胞悬液, 经匀浆破碎处理后, 进行蛋白的测定。ROS 结果表示为荧光度值/毫克蛋白。
SOD 活性、CAT 活性、GSH-ST 活性、GR 活性和 MDA 含量的测定均按试剂盒说明书操作。首先将翡翠贻贝各器官利用全自动研磨机(JXFSTPRP-32,上海净信公司)研磨成组织匀浆, 再按照预实验推算出的各指标测定最佳浓度进行稀释。需要注意的是, 测定 MDA 使用的是离心前的组织匀浆。各指标最佳测定浓度、取样量、对应的测定波长和测定方法列在表 2 中。最佳测定浓度和最佳取样量均根据试剂盒说明书, 进行多次实验测试得出, 为本实验翡翠贻贝特定的测定浓度和取样量。除CAT 活性的测定使用酶标仪以外, 其他酶活性和MDA 浓度的测定均使用紫外–可见分光光度计。
表2 氧化应激各指标最佳测定浓度、取样量、对应的测定波长和测定方法
Table 2 Measurement methods and the optimal testing concentration, sampling volume, corresponding measurement wavelength for different oxidative stress indicators using tissues homogenate
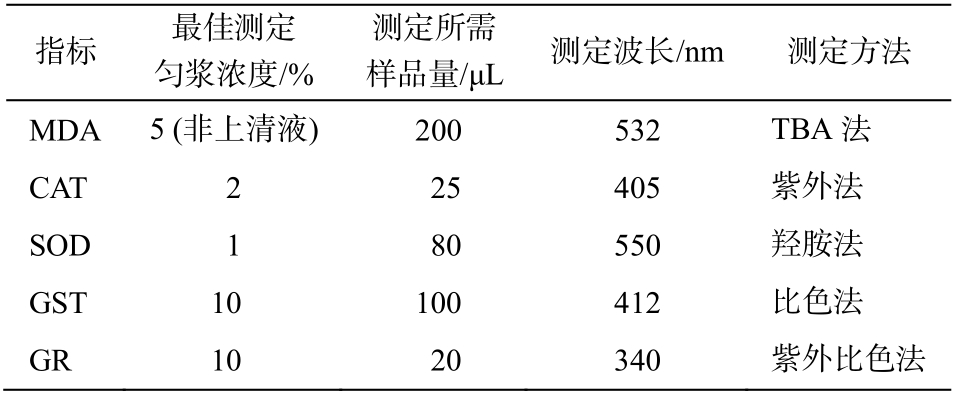
指标 最佳测定匀浆浓度/%测定所需样品量/μL 测定波长/nm 测定方法MDA 5 (非上清液) 200 532 TBA 法CAT 2 25 405 紫外法SOD 1 80 550 羟胺法GST 10 100 412 比色法GR 10 20 340 紫外比色法
1.5 数据分析
实验数据用平均值±标准差的形式表示。方差齐性检验采用 Levene 检验。组间比较采用单因素方差分析(One-way ANOVA), 两两比较方差齐者采用 LSD 检验。显著性差异值被设定为 3 个梯度(p<0.05, p<0.01, p<0.001)。所有的数据分析均在 SPSS 20.0 软件上进行。
2 结果与讨论
2.1 微塑料和 PFOS 对翡翠贻贝滤食率的影响
如图 1 所示, 无论单独暴露于微塑料, 或单独暴露于 PFOS, 或共暴露于 PFOS 和微塑料后, 翡翠贻贝中滤食率比溶剂对照组有些微提升, 但显著性检验结果显示, 这种提升不显著。并且, 微塑料和PFOS 共暴露比 PFOS 单独暴露没有显著地影响翡翠贻贝的滤食率。Liu 等[14]同样发现, 贝类滤食率对全氟辛酸(PFOA)缺乏显著的响应。Cooper 等[13]在前期实验中也发现, 河蚬暴露于有机磷杀虫剂后,其滤食率并没有发生显著的变化。
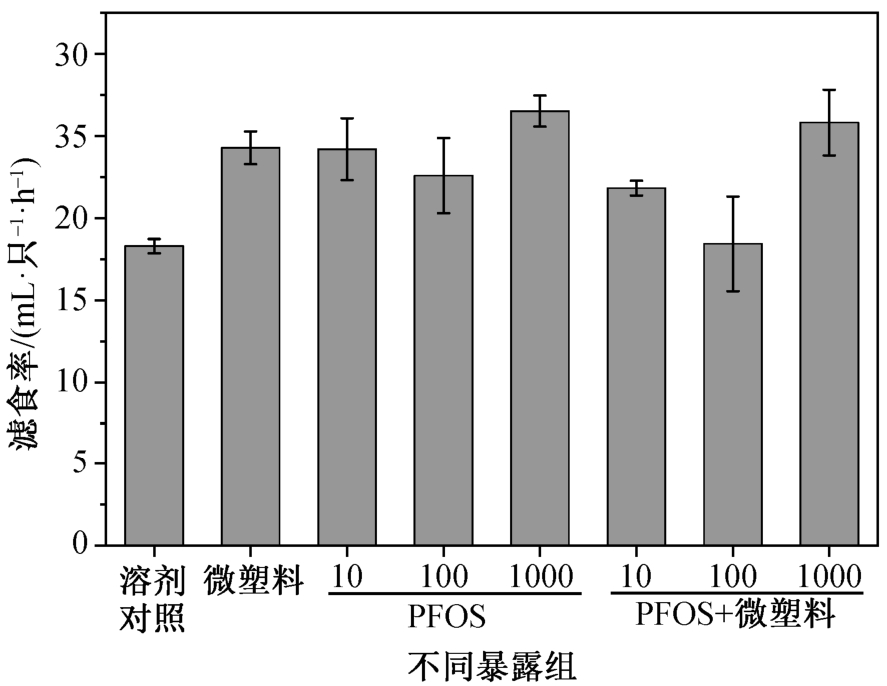
图1 暴露于微塑料和PFOS 后翡翠贻贝的滤食率
Fig. 1 Filtration rate of Perna viridis exposed to PFOS and microplastics (MP)
n=3; 10, 100, 1000 代表 PFOS 暴露浓度分别为 10, 100和 1000 μg/L; 微塑料暴露浓度为 4.55×108 个/L; PFOS+微塑料代表微塑料和 PFOS 共同暴露实验组。下同
一般来说, 贝类的滤食率会随着污染物的暴露而降低。Liu 等[15]的研究结果显示, 在翡翠贻贝暴露于 PFOS 后, PFOS 暴露浓度最高时, 滤食率比空白对照组显著降低。该研究认为, 双壳类动物打开它们的入水管, 通过鳃促进水的自由循环, 利用该过程呼吸和进食, 而这种基本的生理活动会受到PFOS 暴露的影响。Yan 等[16]发现, 河蚬 Corbicula fluminea 的滤食率在受到污染后呈下降趋势, 说明磷酸三酯(TBEP)和磷酸三丁酯(TBP)的暴露触发了河蚬对污染物的防御系统。也有研究表明, 随着体内污染物的增加, 贝类会选择通过关闭瓣膜, 减少滤食, 进而降低代谢率、心跳和耗氧量[17]。本研究中未发现微塑料和 PFOS 的暴露对翡翠贻贝的滤食率产生显著影响, 可能与暴露时间长短、翡翠贻贝来源、PFOS 浓度和微塑料浓度等因素有关。
2.2 PFOS 和微塑料暴露对 ROS 水平的影响
由图 2 可知, 无论单一的 PFOS 暴露, 还是联合的 PFOS-MP 暴露, 翡翠贻贝体内的 ROS 水平均随PFOS 暴露浓度的升高而升高。Liu 等[18]发现, 淡水罗非鱼(Oreochromis niloticus)中的 ROS 水平也与PFOA 的暴露剂量成正比。Li 等[19]研究了 2,4–二氯苯酚(2,4-DCP)对草鱼Ctenopharyngodon idella 的影响, 结果显示, 2,4-DCP 显著提高了草鱼中的 ROS水平, 并诱导原代肝细胞的凋亡。Dong 等[20]研究五氯酚(PCP)对黑鲫 Carassius carassius 肝细胞的影响后发现, PCP 诱导细胞内 ROS 的生成, 而且 ROS极有可能参与 PCP 诱导的肝细胞凋亡。另外, 在本研究中, 当翡翠贻贝仅暴露于微塑料时, 内脏团中ROS 水平显著升高, 鳃和性腺中 ROS 水平未见明显变化。Jeong 等[21]的研究也发现, 仅暴露于微塑料会导致轮虫(Brachionus koreanus)中 ROS 水平升高。上述研究结果表明, ROS 在生物体对污染物的应激反应中起到关键性纽带作用, 而 PFOS 和微塑料的暴露都有可能引起 ROS 水平的提高。
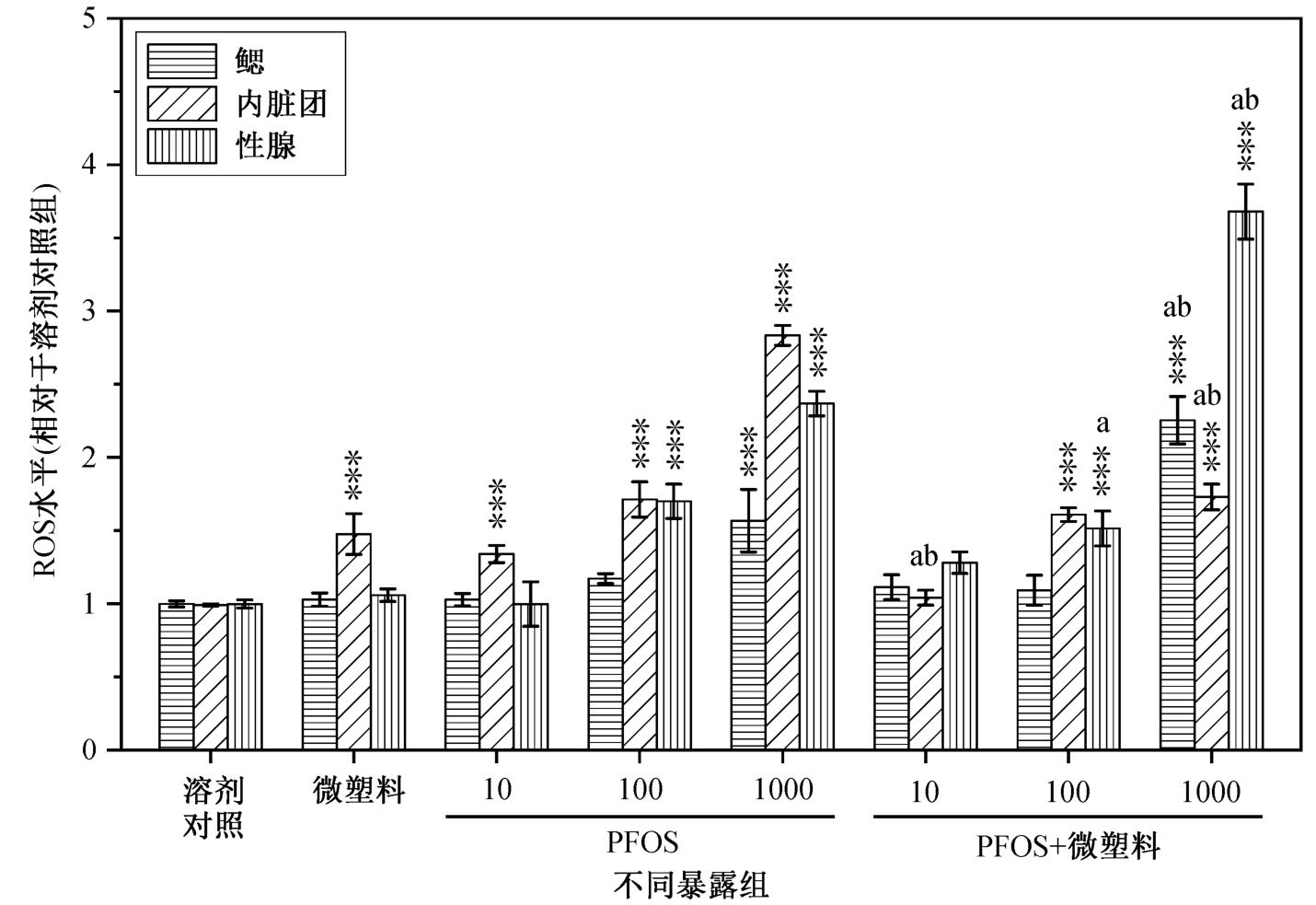
图2 暴露于微塑料和PFOS 后翡翠贻贝体内不同器官(鳃、内脏团和性腺)的ROS 水平
Fig. 2 Effect of microplastics (MP) and PFOS on reactive oxygen species levels (ROS) in gills,visceral mass and gonads of Perna viridis
n=3 或4; 星号表示与溶剂对照组有显著性差别(*p<0.05; **p<0.01; ***p<0.001), 字母“a”或“b”分别表示与微塑料或PFOS 单一暴露组有显著性差异(p<0.05); 下同
2.3 PFOS 和微塑料暴露对 MDA 含量的影响
脂质过氧化是氧化应激的标志, 可以通过测定丙二醛(MDA)来进行评价[22]。本研究中, 与溶剂对照组(鳃、内脏团和性腺 MDA 含量分别为 12.24,19.45 和 27.63 nmol/mgprot)相比, MDA 含量在微塑料单独暴露实验组和 1000 μg/L PFOS 单独暴露实验组均显著提高(图 3)。另外, 与 1000 μg/L PFOS 单独暴露实验组或微塑料单独暴露实验组相比, 1000 μg/L PFOS-MP 共暴露实验组中鳃和内脏团的 MDA含量显著提高(p<0.001)。Dong 等[20]研究五氯酚(PCP)对黑鲫 Carassius carassius 肝细胞的影响, 发现 MDA 剂量依赖性增加, 而谷胱甘肽(GSH)剂量依赖性减少, 表明 PCP 通过影响多个靶点诱导肝细胞的凋亡。杨涛等[23]研究菲对红鳍笛鲷的影响, 结果表明在各种暴露浓度条件下, 暴露时间越长, 目标生物肝和鳃组织中的 MDA 含量越高。有研究发现,MDA 含量的增加可能是由 ROS 的增加引起的[24]。因此, 本研究中 MDA 含量的增加极有可能是受到ROS 水平的影响。
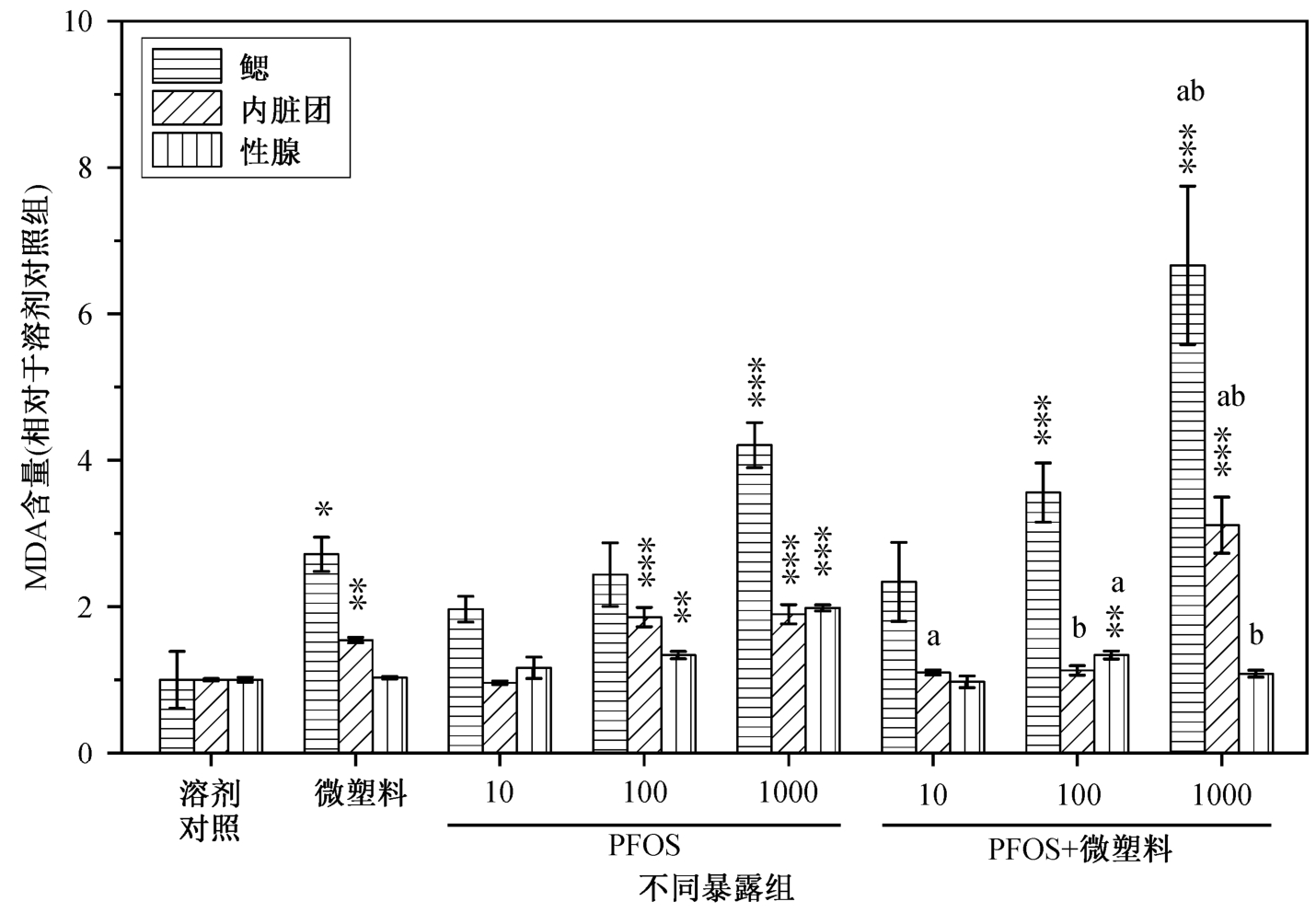
图3 暴露于微塑料和 PFOS 后翡翠贻贝体内不同器官(鳃、内脏团和性腺)的 MDA 含量
Fig. 3 Effect of microplastics (MP) and PFOS on MDA content in gills, visceral mass and gonads of Perna viridis
也有研究发现, MDA 的含量并不是简单地随着暴露浓度和时间的增加而显著地增加, 在不同的实验条件下, MDA 含量会出现不同的结果。王贺威等[25]的研究表明, 翡翠贻贝暴露于 PFOS 后, 外套膜中的 MDA 含量显著提高, 但在内脏团中, 随着暴露时间的增加, MDA 含量出现先抑制后促进的情况。黄志斐等[26]研究一溴联苯醚(BDE3)对翡翠贻贝的影响, 发现内脏团中 MDA 的含量随着暴露时间的增加并未出现一致性地增加或减少, 而是在提高和抑制间无规律地不断变化, 且低浓度暴露组在第三天时 MDA 含量最高, 比对照组显著地提高26.04%; 高暴露组在第 7 天时 MDA 含量最低, 相比对照组显著地降低 14.92%。此外, 随着暴露时间增加, 外套膜中 MDA 含量呈先升高再降低的趋势。
2.4 PFOS 和微塑料暴露对 SOD 和 CAT 活性的影响
超氧化物歧化酶(SOD)是一种重要的抗氧化酶,通过催化超氧化物自由基突变为过氧化氢(H2O2)或普通分子氧(O2)来阻止脂质过氧化物的形成[27], CAT则会催化 H2O2 转化为分子水。这些抗氧化酶在保护机体免受氧化应激中起着重要的作用。本研究中, 暴露于微塑料和 PFOS 后, 与溶剂对照组(SOD活性: 鳃、内脏团和性腺分别为 40.76, 15.38 和124.51 U/mgprot; CAT 活性: 鳃、内脏团和性腺分别为 14.58, 5.24 和 20.89 U/mgprot)相比, 大部分实验组的 SOD 和 CAT 活性在 3 个器官中均显著地提高(p<0.05)(图 4(a)和(b))。Avio 等[28]的研究表明,贻贝暴露于微塑料和芘以后, 体内的 CAT 活性会发生异常。Liu 等[15]的研究表明, 翡翠贻贝体内 CAT活性在 PFOS 浓度为 100 μg/L 时受到影响。在本研究中, 翡翠贻贝中 CAT 的活性在 10 μg/L 时即受到影响。在性腺中, 与 10 μg/L PFOS 单独暴露组相比,10 μg/L PFOS-MP 共暴露组中 SOD 的活性显著提高(p<0.05)。然而, 与 100 μg/L PFOS 单独暴露组相比,100 μg/L PFOS-MP 共暴露组中的 SOD 活性显著降低(p<0.05)。这一结果与通常认为的共暴露能提高SOD 活性的观点相反。Li 等[29]研究单壁碳纳米管(SWCNTs)和 PFOS 对斑马鱼的影响, 结果表明在肝脏中 PFOS 单独暴露提高 SOD 的活性, 而单壁碳纳米管和 PFOS 在共暴露 72 小时和 96 小时后降低SOD 的活性, 肠道中 SOD 的活性也受到抑制。此外, 在鳃中, 单壁碳纳米管和 PFOS 共暴露 24 小时和 48 小时后, SOD 的活性显著增加。在脑中, 两者共暴露 24 小时后诱导 SOD 活性的显著增加, 而在PFOS 单独作用下, SOD 的活性保持不变。这些结果表明, 共暴露对 SOD 活性的影响可能是促进作用, 也可能是抑制作用, 但无论是抑制还是促进,共暴露均可引起斑马鱼 SOD 酶活性的显著变化。本研究中, 无论是 PFOS 单独暴露, 还是 PFOS 和微塑料共暴露, CAT 活性的最低值均出现在 100 μg/L的 PFOS 浓度条件下。此外, 除微塑料和 100 μg/L PFOS 单独暴露组外, 其他各暴露组 CAT 的活性均显著高于溶剂对照组。尽管不同浓度的 PFOS 会产生不同的结果, 但是 SOD 和 CAT 活性结果表明, 微塑料和 PFOS 共暴露会使酶活性升高或下降, 不同的酶在微塑料和不同 PFOS 浓度下表现出不同的活性变化, 这可能与机体的适应机制有关[30]。
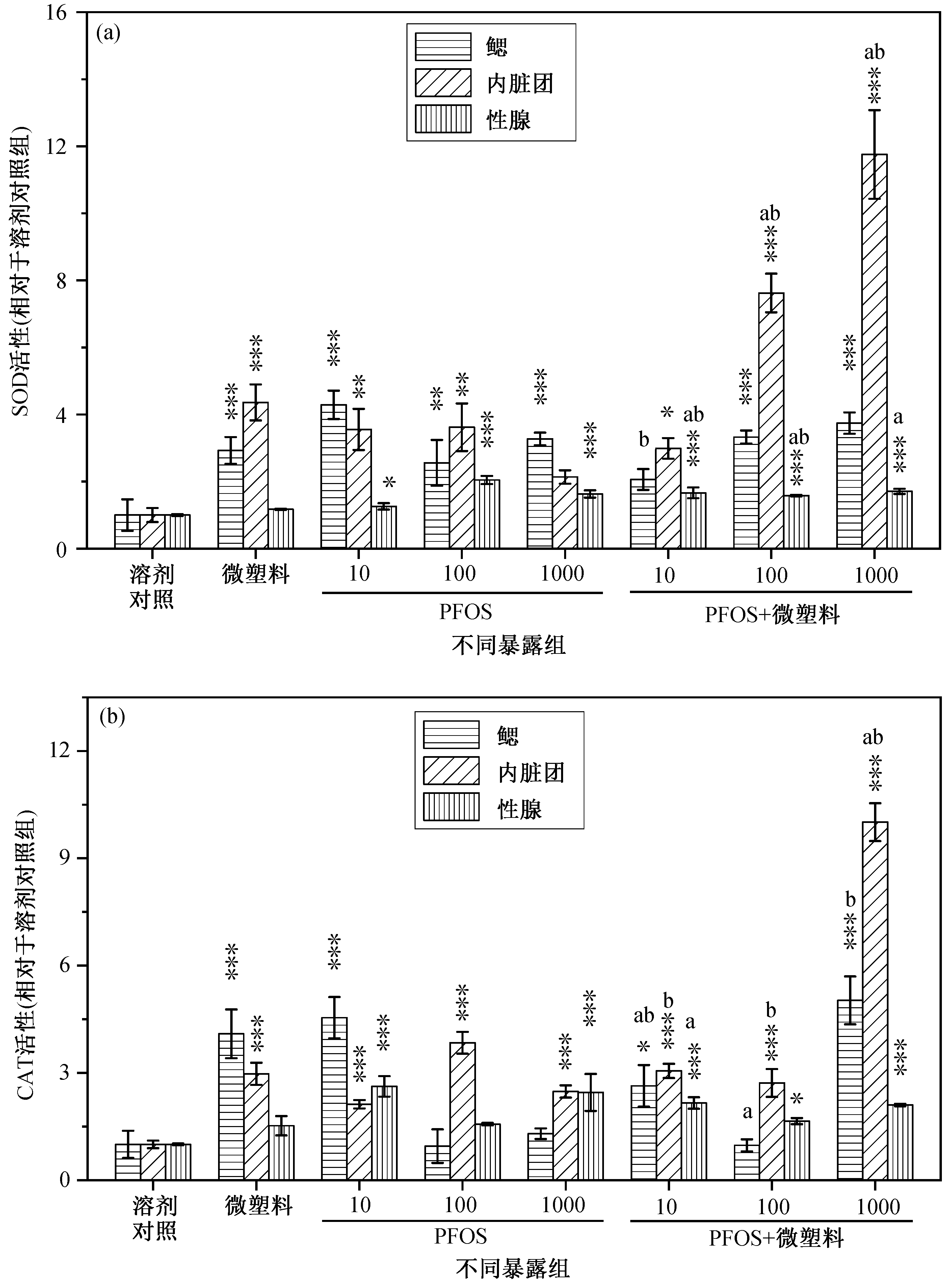
图4 暴露于微塑料和PFOS 后翡翠贻贝体内不同器官(鳃、内脏团和性腺)的SOD (a)和CAT (b)活性
Fig. 4 Effect of microplastics (MP) and PFOS on SOD (a) and CAT (b) activities in gills, visceral mass and gonads of Perna viridis
2.5 PFOS 和 微 塑 料 暴 露 对 GST 和 GR 活 性 的影响
GST 能够催化谷胱甘肽(GSH)与多种亲电性以及疏水性化合物(包括 PFOS)结合, 并将这些代谢物转化为易于排泄的亲水化合物, 因此 GST 在细胞内解毒中发挥重要作用[31]。本研究中, 除 10 μg/L PFOS-MP 共暴露组外, 其他共暴露组中内脏团和性腺中 GST 的活性均显著高于溶剂对照组(鳃、内脏团以及性腺 GST 活性分别为 7.58, 9.90 和 10.30 U/mgprot)、PFOS 单独暴露组及微塑料单独暴露组(图5(a))。这些结果表明, GST 在保护贻贝免受各种环境压力方面发挥了重要的作用, 而共暴露促进了GST 的活性。Gülsever 等[32]将贻贝暴露于 6 种不同浓度的 PFOS 中, 结果表明, 与对照组相比, PFOS导致所有实验组肝胰腺 GST 活性显著地增加。
GR 通过将氧化态谷胱甘肽(GSSG)还原为 GSH来维持谷胱甘肽的胞质浓度[33]。本研究中, 除鳃中10 μg/L PFOS-MP 共暴露组外, 各暴露组鳃和性腺中的 GR 活性均比溶剂对照组(鳃、内脏团和性腺GR 活性分别为 11.73, 31.14 和 8.16 U/gprot)显著地提升(p<0.05)(图 5(b))。Liu 等[18]发现, PFOS 的暴露浓度达到 30 mg/L 后, 淡水罗非鱼(Oreochromis niloticus)的 GR 活性才会显著地提升, 该浓度远高于本研究采用的 PFOS 浓度。这种差异可能是由不同实验模型的敏感性以及不同的曝光介质等因素造成的。也有研究表明, 污染物暴露还可能抑制 GR 的活性。Yan 等[16]发现, 当 TBP 浓度为 2000 μg/L 时,河蚬 Corbicula fluminea 中 GR 的活性比对照组显著地降低(p<0.05)。
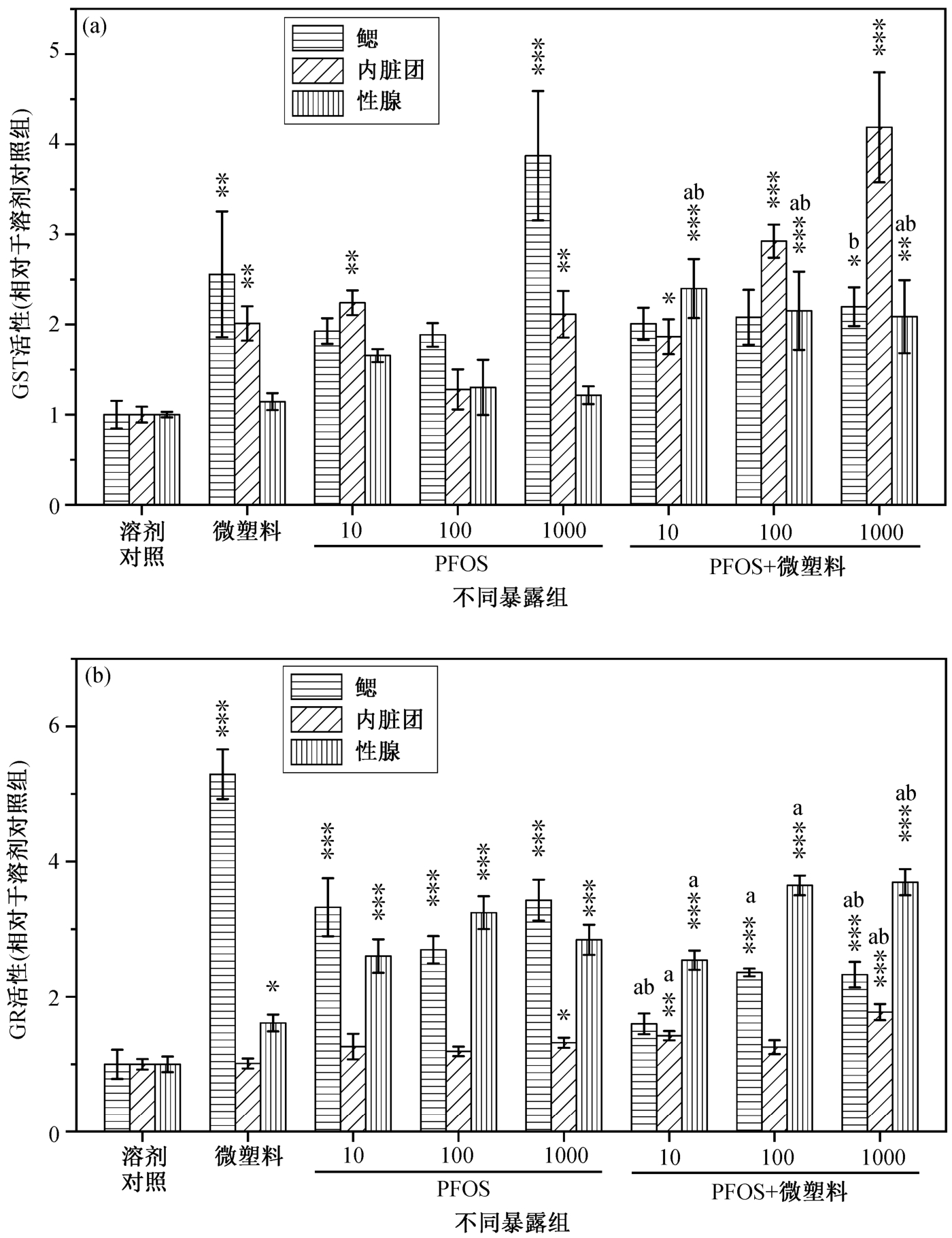
图5 暴露于微塑料和 PFOS 后翡翠贻贝体内不同器官(鳃、内脏团和性腺)的GST (a)和GR (b)活性
Fig. 5 Effect of microplastics (MP) and PFOS on GST (a) and GR (b) activities in gills, visceral mass and gonads of Perna viridis
本研究涉及贻贝 3 个器官中 6 种氧化应激指标的响应, 虽然实验结果并未表现出一致的趋势, 但是依然能够发现一些规律。与低浓度的 PFOS 相比,高浓度的 PFOS 更易引起酶活性的改变; 本研究所用微塑料能够显著地提高内脏团中的 ROS 水平, 进而造成 MDA 的升高; 与单独暴露相比, PFOS 和微塑料共暴露会影响各个酶的活性, 说明微塑料的参与使得 PFOS 对贻贝的毒性效应更加复杂, 可能与微塑料的吸附及载体作用有关。未来, 需要进一步深入研究共暴露的毒性机制。
3 结论
1) 暴露于微塑料和 PFOS 后, 翡翠贻贝的滤食率比溶剂对照组没有显著地变化, 与 PFOS 单独暴露组相比, 微塑料和 PFOS 共暴露对翡翠贻贝的滤食率没有显著的影响。
2) SOD, CAT 和 GR 的活性在单独暴露于 10,100 和 1000 μg/L PFOS 时均显著提高, 而 ROS 水平以及 MDA 含量仅在单独暴露于 100 和 1000 μg/L PFOS 时显著提高, GST 的活性仅在单独暴露于1000 μg/L PFOS 时显著提高。
3) 单独暴露于微塑料后, 在鳃、内脏团和性腺中均观察到酶活性的改变, 表明微塑料能够影响贻贝的氧化应激系统。
4) 在微塑料和 1000 μg/L PFOS 共同暴露下, 与PFOS 单独暴露组相比, 鳃中 ROS 水平、MDA 含量和 CAT 的活性显著提高, GST 和 GR 的活性显著下降; 内脏团中 ROS 水平显著降低, MDA 含量以及SOD、CAT 和 GR 的活性显著提高; 性腺中 ROS 水平、GST 和 GR 的活性显著提高, MDA 含量显著降低。这些结果说明微塑料会改变翡翠贻贝对 PFOS的氧化应激响应。
[1] Hagenaars A, Stinckens E, Vergauwen L, et al. PFOS affects posterior swim bladder chamber inflation and swimming performance of zebrafish larvae. Aquatic Toxicology, 2014, 157: 225–235
[2] Wong C S, Green D R, Cretney W J. Quantitative tar and plastic waste distributions in the Pacific Ocean.Nature, 1974, 247: 30–32
[3] Thompson R C, Olsen Y, Mitchell R P, et al. Lost at sea: where is all the plastic?. Science, 2004, 304: 838
[4] Guzzetti E, Sureda A, Tejada S, et al. Microplastic in marine organism: environmental and toxicological effects. Environmental Toxicology and Pharmacology,2018, 64: 164–171
[5] Bakir A, Rowland S J, Thompson R C. Competitive sorption of persistent organic pollutants onto microplastics in the marine environment. Marine Pollution Bulletin, 2012, 64(12): 2782–2789
[6] Fisner M, Taniguchi S, Moreira F, et al. Polycyclic aromatic hydrocarbons (PAHs) in plastic pellets:variability in the concentration and composition at different sediment depths in a sandy beach. Marine Pollution Bulletin, 2013, 70(1/2): 219–226
[7] Rios L M, Moore C, Jones P R. Persistent organic pollutants carried by synthetic polymers in the ocean environment. Marine Pollution Bulletin, 2007, 54(8):1230–1237
[8] Teuten E L, Rowland S J, Galloway T S, et al. Potential for plastics to transport hydrophobic contaminants. Environmental Science & Technology, 2007, 41(22): 7759–7764
[9] Ashton K, Holmes L, Turner A. Association of metals with plastic production pellets in the marine environment. Marine Pollution Bulletin, 2010, 60(11): 2050–2055
[10] Holmes L A, Turner A, Thompson R C. Interactions between trace metals and plastic production pellets under estuarine conditions. Marine Chemistry, 2014,167: 25–32
[11] Wang F, Shih K M, Li X Y. The partition behavior of perfluorooctanesulfonate (PFOS) and perfluorooctanesulfonamide (FOSA) on microplastics. Chemosphere, 2015, 119: 841–847
[12] Wu C, Zhang K, Huang X, et al. Sorption of pharmaceuticals and personal care products to polyethylene debris. Environmental Science and Pollution Research, 2016, 23(9): 8819–8826
[13] Cooper N L, Bidwell J R. Cholinesterase inhibition and impacts on behavior of the Asian clam, Corbicula fluminea, after exposure to an organophosphate insecticide. Aquatic Toxicology, 2006, 76(3/4): 258–267
[14] Liu C, Gin K Y H, Chang V W C, et al. Novel perspectives on the bioaccumulation of PFCs — the concentration dependency. Environmental Science &Technology, 2011, 45(22): 9758–9764
[15] Liu C, Gin K Y H, Chang V W C. Multi-biomarker responses in green mussels exposed to PFCs: effects at molecular, cellular, and physiological levels. Environmental Science and Pollution Research, 2014, 21(4): 2785–2794
[16] Yan S, Wu H, Qin J, et al. Halogen-free organophosphorus flame retardants caused oxidative stress and multixenobiotic resistance in Asian freshwater clams(Corbicula fluminea). Environmental Pollution, 2017,225: 559–568
[17] Liao C, Jou L, Chen B. Risk-based approach to appraise valve closure in the clam Corbicula fluminea in response to waterborne metals. Environmental Pollution, 2005, 135(1): 41–52
[18] Liu C, Ke Y, Shi X, et al. Induction of oxidative stress and apoptosis by PFOS and PFOA in primary cultured hepatocytes of freshwater tilapia (Oreochromis niloticus). Aquatic Toxicology, 2007, 82(2): 135–143
[19] Li H, Zhang X, Qiu Q, et al. 2,4-Dichlorophenol induces apoptosis in primary hepatocytes of grass carp (Ctenopharyngodon idella) through mitochondrial pathway. Aquatic Toxicology, 2013, 140/141:117–122
[20] Dong Y, Zhou P, Jiang S, et al. Induction of oxidative stress and apoptosis by pentachlorophenol in primary cultures of Carassius carassius hepatocytes. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2009, 150(2): 179–185
[21] Jeong C, Won E, Kang H, et al. Microplastic sizedependent toxicity, oxidative stress induction, and p-JNK and p-p38 activation in the monogonont rotifer(Brachionus koreanus). Environmental Science &Technology, 2016, 50(16): 8849–8857
[22] Wang J, Dong B, Yu Z, et al. The impact of acute thermal stress on green mussel Perna viridis: oxidative damage and responses. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2018, 222: 7–15
[23] 杨涛, 陈海刚, 蔡文贵, 等. 菲胁迫对红鳍笛鲷急、慢性毒性效应的研究. 水产学报, 2011, 35(2):298–304
[24] Liu C, Du Y, Zhou B. Evaluation of estrogenic activities and mechanism of action of perfluorinated chemicals determined by vitellogenin induction in primary cultured tilapia hepatocytes. Aquatic Toxicology,2007, 85(4): 267–277
[25] 王贺威, 马胜伟, 张喆, 等. 全氟辛烷磺酸盐(PFOS)胁迫对翡翠贻贝抗氧化酶的影响. 生态毒理学报, 2012, 7(5): 508–516
[26] 黄志斐, 马胜伟, 张喆, 等. BDE3 胁迫对翡翠贻贝(Perna viridis) SOD、MDA 和 GSH 的影响. 南方水产科学, 2012, 8(5): 25–30
[27] Ryu H S, Han J H, Song J A, et al. Effects of total residual oxidant on oxidative stress in juvenile olive flounder Paralichthys Olivaceus. Ozone: Science &Engineering, 2020, 42(3): 277–285
[28] Avio C G, Gorbi S, Milan M, et al. Pollutants bioavailability and toxicological risk from microplastics to marine mussels. Environmental Pollution, 2015, 198:211–222
[29] Li Y, Men B, He Y, et al. Effect of single-wall carbon nanotubes on bioconcentration and toxicity of perfluorooctane sulfonate in zebrafish (Danio rerio).Science of the Total Environment, 2017, 607/608:509–518
[30] Oruç E Ö, Usta D. Evaluation of oxidative stress responses and neurotoxicity potential of diazinon in different tissues of Cyprinus carpio. Environmental Toxicology and Pharmacology, 2007, 23(1): 48–55
[31] Jemec A, Drobne D, Tišler T, et al. Biochemical biomarkers in environmental studies — lessons learnt from enzymes catalase, glutathione S-transferase and cholinesterase in two crustacean species. Environmental Science and Pollution Research, 2010, 17(3):571–581
[32] Gülsever G, Parlak H. Effects of perfluorooctane sulfonate compounds on the biochemical activities in mussels (Mytilus galloprovincialis). Ege Journal of Fisheries and Aquatic Sciences, 2018, 35(4): 417–422
[33] Shaw A K, Bhardwaj P K, Ghosh S, et al. βaminobutyric acid mediated drought stress alleviation in maize (Zea mays L.). Environmental Science and Pollution Research, 2016, 23(3): 2437–2453