水稻(Oryza satiza L.)是重要的粮食作物, 种植面积占我国粮食作物总面积的 20%以上[1]。研究表明, 作物叶片的光合碳同化与作物产量的相关程度很高[2-3], 因此提高叶片光合能力可能有助于提高粮食产量。
在自然条件下, 由于太阳高度角、云量和风向风速的变化, 叶片常常经历剧烈的光强变化。冠层内部叶片接受到的、常常接近于冠层顶部光强的短时光照被称为“光斑”。以往大多数研究都关注森林中林下植物, 这些林下植物大部分时间处于较低的光强下, 光斑时间短, 但辐射能量高, 是叶片碳同化能量的重要来源[4]。水稻和小麦等作物的冠层内部也存在光斑现象, 近年来受到关注[5-6]。
叶片在变动光强下的光合过程主要包括由 1,5-二磷酸核酮糖(RuBP)再生、1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)激活和气孔运动驱动的光合诱导以及光照减弱后光合碳固定这两个过程[7-8]。改进叶片动态光合响应能力对提高产量可能具有一定的应用潜力[9]。
位于冠层不同高度的叶片所处的光环境不同。位于顶部的叶片常常接收到更多的太阳直射辐射,下部叶片则受到叶片相互遮阴的影响, 大部分时间处在较弱的散射光辐射中, 偶尔才会得到短暂的、具有较高辐射能量的光斑[5,10]。
不同的生长光环境会影响叶片的光合特性[11]。减少叶片生长时的光通量密度会改变水平生长的藤本植物的光合特征, 如光系统 II、细胞色素 f 与叶绿素含量之比(Cyt f/Chl)以及叶绿素 a 与 b 含量比(Chl a/b) [12], 进而可能减弱叶片的光合能力。水稻有关研究也提供了类似的光强变化改变叶片光合特征的证据[13]。与冠层顶部叶片相比, 作物冠层下部叶片的最大光合速率、最大羧化速率和最大电子传输速率都比较低[10]。这些研究均表明植株不同位置的叶片在稳定光强下的光合特性会受到冠层内部光环境的影响, 但目前缺少有关水稻冠层不同位置叶片动态光合的研究。
工业革命以来, 大气中 CO2 浓度急剧增加, 预计到 2080 年将超过 550 μmol/mol[14]。作为光合作用的底物, CO2 在环境中的浓度增加可能会影响水稻的光合作用[15-17]。同时, 高 CO2 浓度可能会影响上层叶片的叶绿素含量[18], 增加上层叶片对光的吸收[19], 进而导致下层叶片接受的光质和光强发生变化[18-19]。因此, 在分析叶片光合特征及光环境的影响时, 也要考虑环境 CO2 浓度的升高。为探讨未来大气 CO2 浓度升高环境下动态光合特性的变化, 我们观测了生长在当前大气 CO2 浓度下以及在600 μmol/mol 的开顶箱中的水稻动态光合特性, 以期实现如下研究目标: 1) 描述开顶箱内外的水稻冠层不同高度光合有效辐射特征; 2) 观测并揭示开顶箱内外水稻冠层不同高度的动态和稳定光合特性;3) 探讨光合特征与光环境之间可能的关系及其在高 CO2 环境下发生的变化。
1 材料与方法
1.1 实验站点
研究站点位于南京信息工程大学农业气象与生态实验站内(32°16′N, 118°46′E), 该地属于亚热带季风气候区, 多年平均气温为 15.6°C, 年平均降水量为 1100 mm, 平均日照时数超过 1900 小时, 无霜期为 237 天[16-17]。供试土壤为潴育型水稻土, 灰马肝土属, 耕层土壤质地为壤质黏土, 土壤有机碳含量为 11.95 g/kg, 全氮含量为 1.19 g/kg, 土壤容重为1.57 g/cm, pH(H2O)为6.3[17,20]。
在研究站点采用开顶箱(open top chamber, OTC)模拟大气 CO2 浓度升高的环境。其中, OTC 外形为正八边形棱柱状, 高 3 m, 对边直径为 3.75 m, 底面积约为 10 m2, 侧面由铝合金框架和高透光性的普通玻璃组成, 玻璃的透光度约为 80%, 在中央处有较大开口, 开口向内倾斜 45°以便聚拢气体[16,20]。以背景大田 CO2 浓度(约 400 μmol/mol)为参照值, OTC箱中的 CO2 浓度比参照值提高 200 μmol/mol (约 600 μmol/mol)。
供试的水稻品种为南粳 9108, 全生育期为 149~153 天, 在 2017 年 5 月进行播种, 6 月移栽到试验大田及 OTC 中, 载插密度为 30 穴/m2。氮肥用量为17.6 gN/m, 氮肥组成包括复合肥(N : P2O5 : K2O = 15% :15% : 15%)和尿素(有效成分占 46.7%), 其中基肥占40%, 分蘖肥和穗肥各占 30%[17]。水分及其他田间管理措施统一采用当地常规栽培模式。观测时,OTC 内外水稻的植株高度为 95~100 cm, 未发现OTC 内外叶冠层空间结构的可视差异。
1.2 光环境测量
水稻灌浆期间, 在 OTC 内外选择水稻株丛中央位置进行光环境测量。经测量, 大田和 OTC 内水稻的剑叶平均离地约 90 cm, 水稻的第二片叶子离地约 45 cm, 因此在离泥土约 90 cm 和约 45 cm 处, 分别水平设置光量子传感器(测量型号分别为 MIJ-14PAR Type2 和 LI-190SB, 实验前已测试证明两个传感器对光强的响应能力一致)。光量子传感器的数据记录频率为每秒一次。在 2017 年 9—10 月期间, 10:00—16:30 进行观测记录, 并记录天气状况(晴天/阴天)。OTC 外上、下位置的光环境数据在晴天有 3 组, 阴天有 2 组, OTC 内上、下位置的光环境数据在晴天和阴天各有 1 组。选取 OTC 内外晴天和阴天各一组数据进行计算。
1.3 气体交换参数测量
2017 年 9 月中旬到 10 月期间, 每天上午 9 时至下午 4 时, 分别在 OTC 内外各选取 4 株水稻苗的剑叶及倒二叶(分别称为上部叶片和下部叶片)进行气体交换测量(图 1)。使用 Li-Cor 6400 型光合仪, 配置红蓝 LED 光源, 并利用 CO2 注入系统来控制 CO2浓度: 先用纯碱石灰除去进入测量室的气流中的CO2, 然后使用 CO2 小气瓶控制随后的 CO2 浓度。在测量叶片的光诱导曲线时, 温度为 30°C, 空气湿度控制在 60%~65%之间。测量 OTC 外的叶片时,CO2 设置为 400 μmol/mol; 测量 OTC 内的叶片时,CO2 设定为 600 μmol/mol。先设定叶室内的光强为1500 μmol/(m2·s), 维持 10 分钟后, 将光强减弱至100 μmol/(m2·s), 维持 30 分钟, 然后将光强迅速升高增加至 1500 μmol/(m2·s)。在测量 40 分钟后, 叶片达到高光下的稳定状态, 再将光强迅速降低 50 μmol/(m2·s), 并保持 10 分钟, 最后将光强减弱至 0,测量 5 分钟。用 t0~t5 表征上述光强变化的时间节点(图 2)。

图1 水稻冠层不同高度叶片光合作用观测现场
Fig. 1 Field measurement of leaf photosynthesis at different rice canopy heights
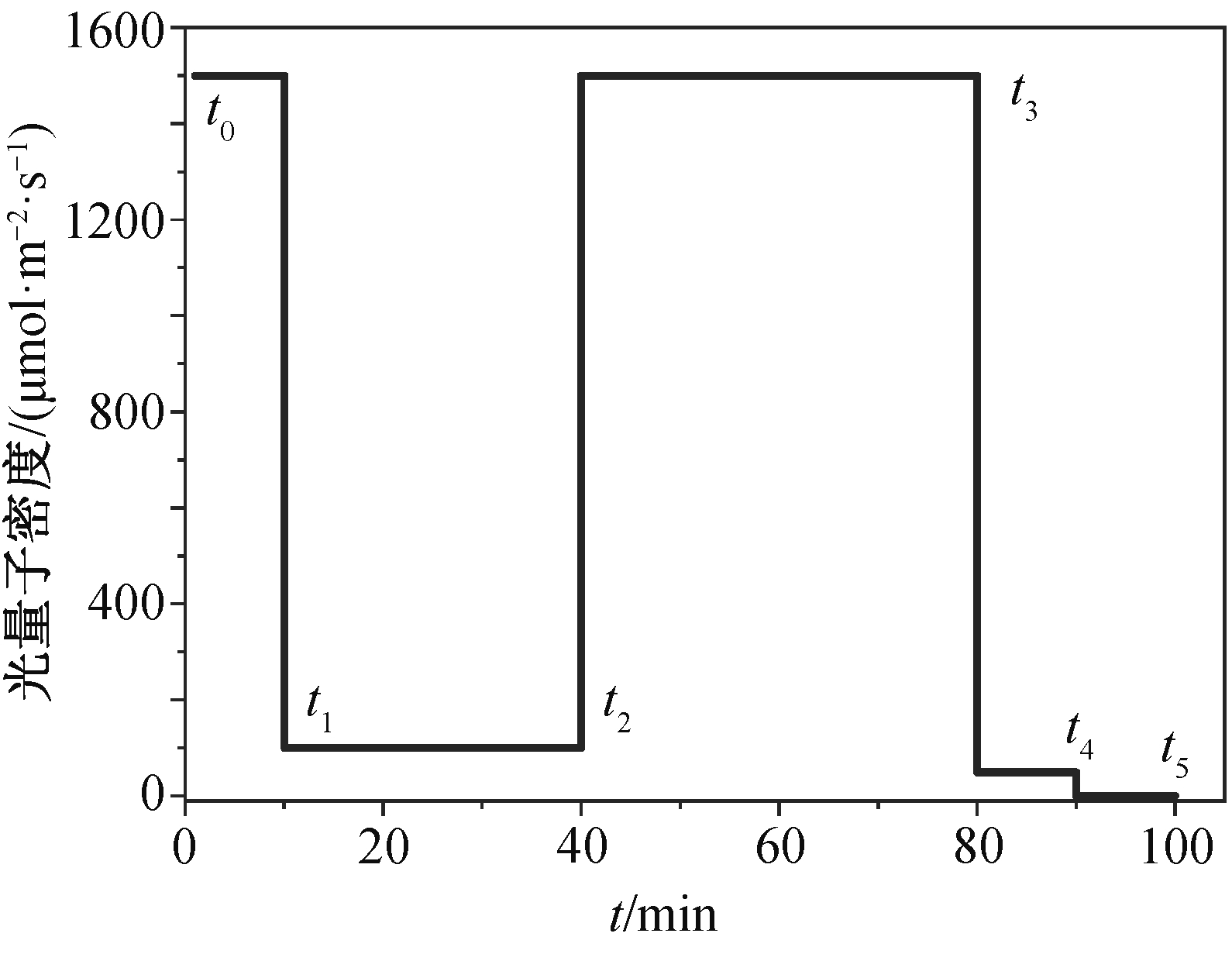
图2 动态光合作用测定时的光强变化
Fig. 2 Time course of light intensity applied for measurement of dynamic photosynthesis
1.4 计算公式和分析方法
1) 光环境的量化。分别量化 OTC 内外晴天和阴天时层不同位置光环境的特征, 包括计算测量期间强度在 0~50, 50~100, 100~200, 200~500, 500~1000 和>1000 μmol/(m2·s)范围内光量子累计总量及其与一天总光量子之比以及各范围内光强累计时间及其与总测量时间之比, 统计一天内光强的均值、标准差、变异系数、最大值和最小值, 同时计算光强每秒的变化量 ΔP FDt 1 = PFD t 2 - PFDt1(其中 t2-t1=1 s)。若 | ΔP FD t1|>5 μmol/(m2·s), 则判断 PFDt 1为快速变化的动态光。最后, 统计动态光在总光量子数中的占比 PFD 动/PFD 总。
2) 拟合光响应曲线。采用指数函数模型[21-22],使用最小二乘法, 将光合速率在光强 0, 50, 100 和1500 μmol/(m2·s)下的稳定值进行拟合, 获得叶片光响应曲线的参数:
其中, L 是光强(μmol/(m2·s)); Amax 是最大光合速率(μmol/(m2·s)), 拟合中用放大系数 k 与 Ahigh 的乘积表示, Ahigh 为叶片在高光下的光合速率; α 为初始量子效率, 是光响应曲线在光强为零时的斜率, 本文使用光强为 0 与 50 μmol/(m2·s)两个点之间的斜率。获得拟合曲线的参数后, 代入计算叶片在光强为 0,50, 100, 200, 300, ..., 2000 μmol/(m2·s) (省略号表示以 100 μmol/(m2·s)递增的光强)情况下的叶片稳定光合速率。每个叶片共获得 22 个拟合的稳定光合值,分别计算在不同位置、不同生长条件下作为重复的 4 个叶片稳定光合值均值和标准误差, 并据此绘制不同处理下叶片的光响应曲线。
3) 计算计算累积碳同化量、累积蒸腾量、累积潜在水分利用效率和累积表观水分利用效率:

4) 计算 t2 ~ t4 之间动态光合的碳损失比和光减弱碳固定比:
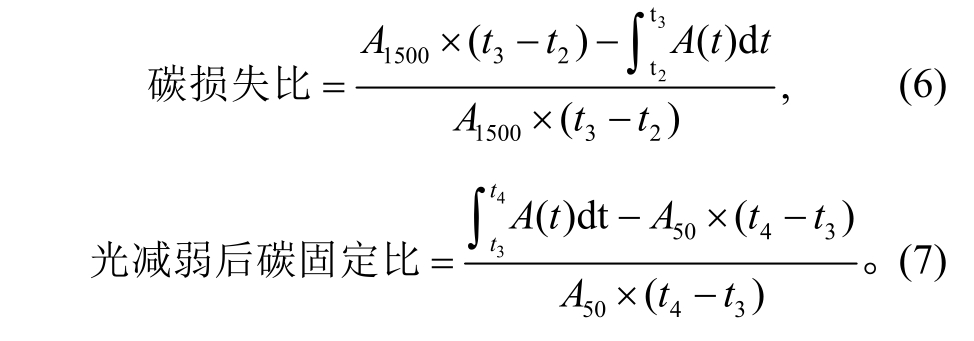
5) 使用 t 检验方法, 分析 OTC 内外冠层下层叶片光合特征的差异(α=0.05)。统计分析使用 Python 3.6 的 Scipy.stats 包完成, 图片使用 Origin 2018 软件绘制。
2 结果
2.1 水稻冠层不同高度光合有效辐射的动态特征
在 OTC 内外, 晴天到达水稻冠层下部叶片的累积光量子数为上部叶片的 24%~37%, 阴天该比例为 24%~26% (图 3 和表 1)。如图 4 和 5 所示, 晴天到达上层叶片光合有效辐射的光强均大于 200 μmol/(m2·s), 一天(10:00—16:30)之中有约 80%光量子的光强大于 1000 μmol/(m2·s)。阴天到达上层叶片阳光的光强均大于 100 μmol/(m2·s), 约 60%光量子的光强为 500~1000 μmol/(m2·s)。无论晴天还是阴天,到达 OTC 外下部叶片的 80%以上光合有效辐射的量子密度大于 200 μmol/(m2·s)。到达冠层上部叶片的光合有效辐射在一天当中贡献能量最多的光强范围占据的时间也最多(图 5)。对于下部叶片, 晴天大于 500 μmol/(m2·s)光合有效辐射的时间占比仅为 14%~16%, 却贡献了总光合有效辐射量的 42%以上。

图3 OTC 内、外水稻叶冠层内离水田土壤高约 45 cm 和90 cm 处在晴天和阴天观测到的光合有效辐射的时间变化
Fig. 3 Diurnal traces of photosynthetic active radiation at 45 cm and 90 cm above the paddy field soil within the rice canopies,outside/inside the OTC on sunny and overcast days
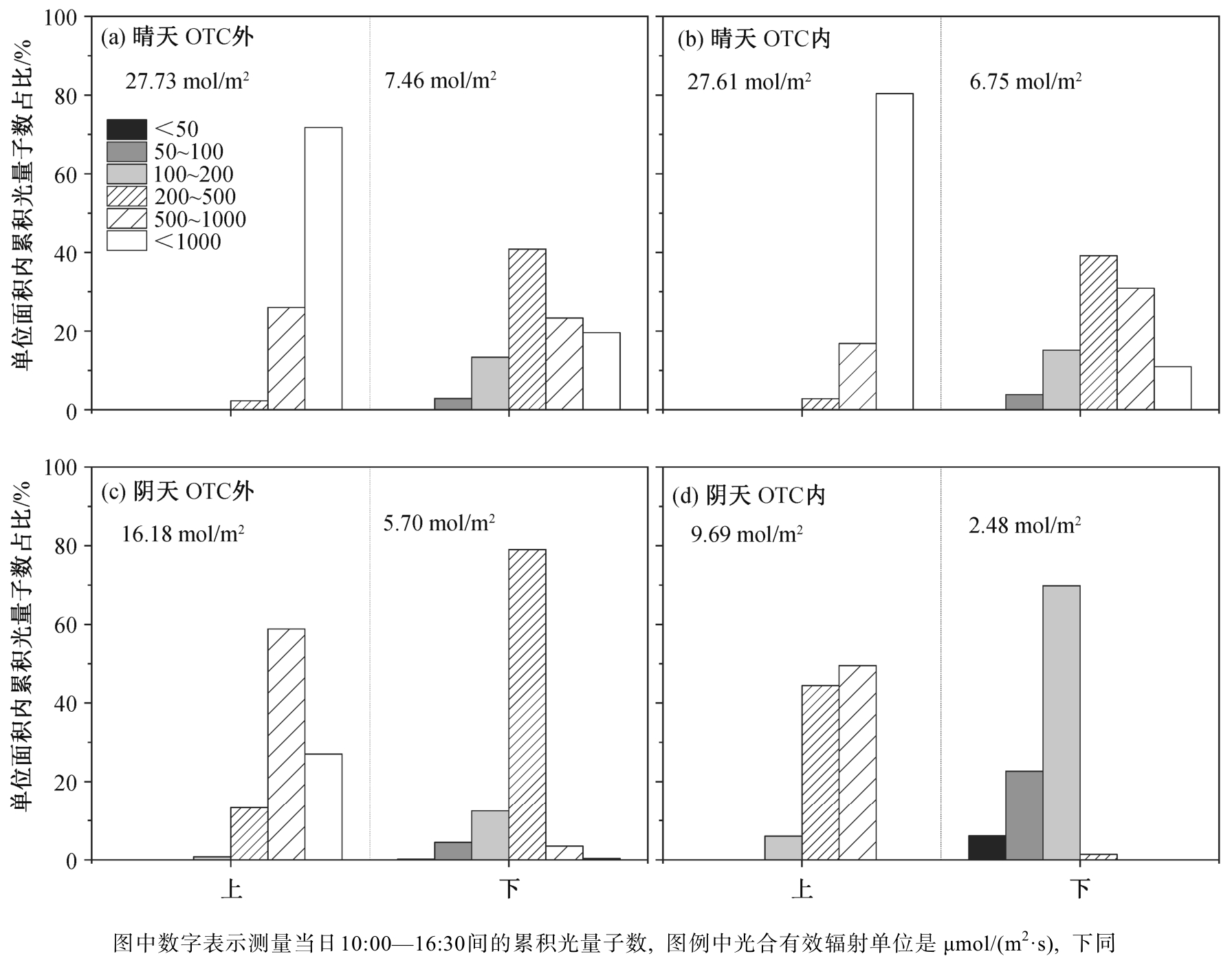
图4 水稻冠层内不同高度光合有效辐射的光强频率分布
Fig. 4 Frequency distribution of incident photosynthetically active radiation light intensity at two heights within rice canopies
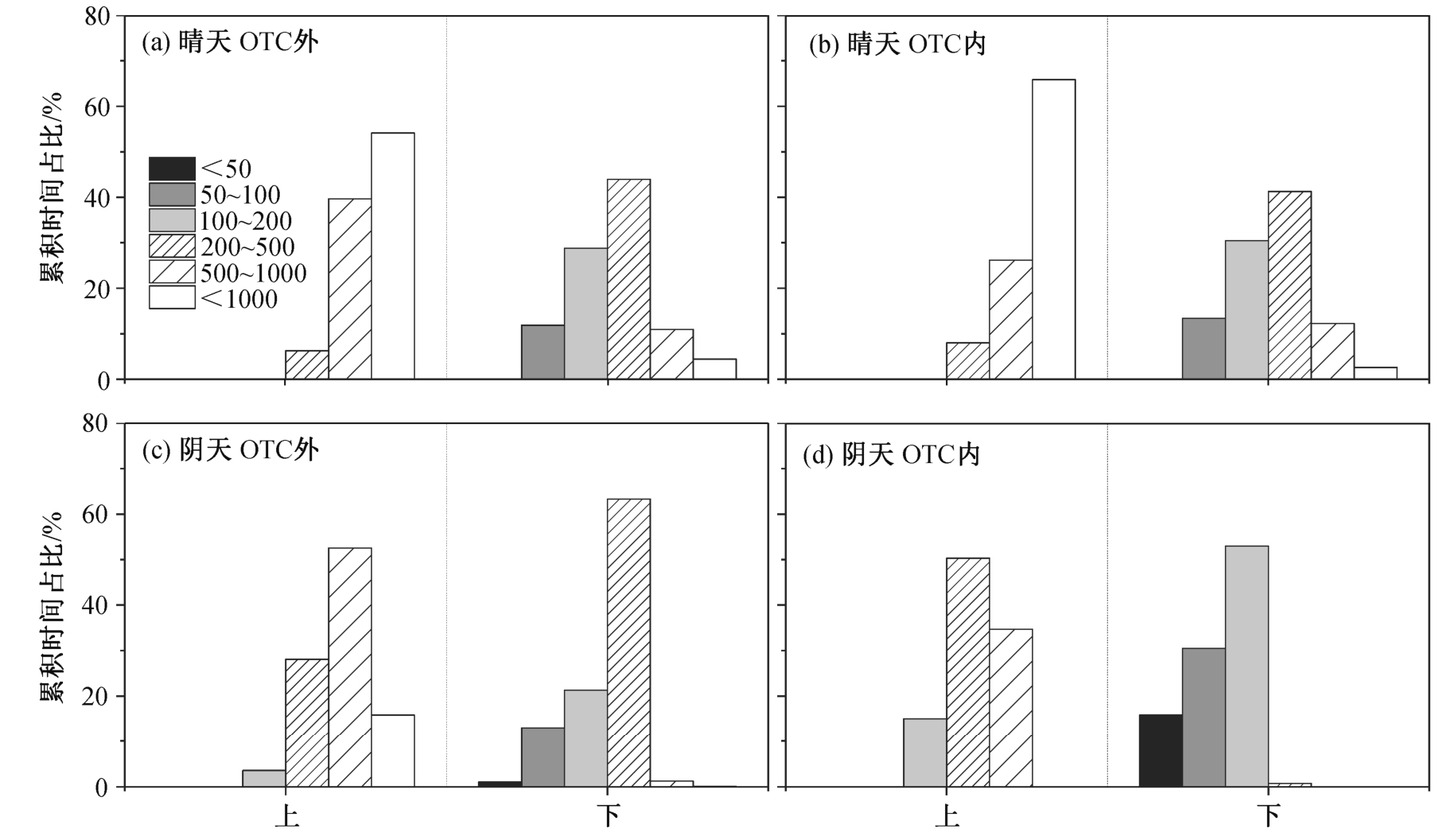
图5 水稻冠层内不同高度光合有效辐射的时间频率分布
Fig. 5 Frequency distribution of incident photosynthetic active radiation at two heights within rice canopies on sunny and overcast days
表1 水稻冠层不同高度的累积光量子通量密度以及衰减百分比
Table 1 Accumulated photon flux density and light attenuation at different heights of the rice canopy
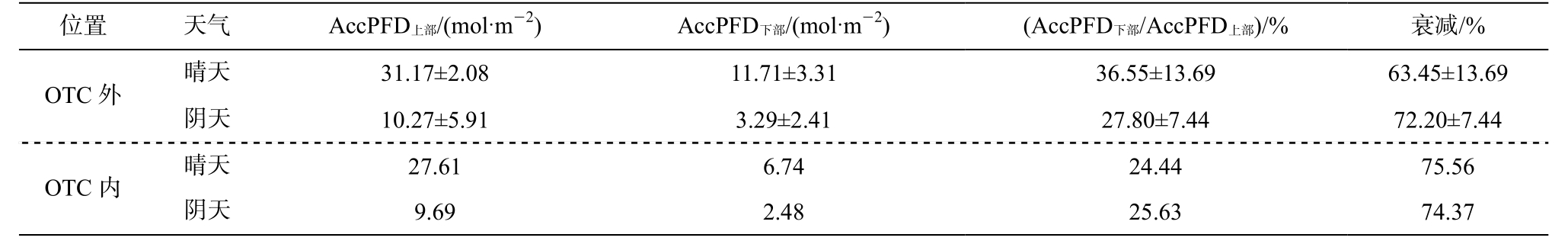
说明: 衰减百分比为(AccPFD 上部-AccPFD 下部)/AccPFD 下部×100%, AccPFD 为测量当日 10:00 ― 16:30 的累积光量子数; 其中 OTC 外的光强数据表示为均值±标准误差(晴天 n=3, 阴天 n=2)。
位置 天气 AccPFD 上部/(mol·m-2) AccPFD 下部/(mol·m-2)OTC 外晴天 31.17±2.08 11.71±3.31阴天 10.27±5.91 3.29±2.41 OTC 内 晴天 27.61 6.74阴天 9.69 2.48(AccPFD 下部/AccPFD 上部)/% 衰减/%36.55±13.69 63.45±13.69 27.80±7.44 72.20±7.44 24.44 75.56 25.63 74.37
如表 2 所示, 在晴天, 到达 OTC 内外冠层上部的累积光合有效辐射为下部叶片的 3~4 倍, 但变异系数比下部低 55%~60%, 到达下部叶片的光合有效辐射的动态光(即一秒钟内观测到的光合有效辐射量的差异大于 5 μmol/(m2·s)的光)在总辐射中的占比也远高于上部叶片。在阴天, 水稻上、下叶片一天内接收到的光强的变异系数没有显著差别。
表2 OTC 内外晴天阴天情况下水稻叶冠层不同高度的光环境特征
Table 2 Light environment at different heights of rice canopy inside and outside the OTC on sunny and cloudy day, respectively

测量 位置 均值/(μmol·m-2·s-1)标准差/(μmol·m-2·s-1)(μmol·m-2·s-1) 变异系数 最大值/(μmol·m-2·s-1)中位数/最小值/(μmol·m-2·s-1)(PFD PFD )动 总 //%晴天OTC 外 上 1185 507 1054 0.43 2597 345 38.37下 319 300 229 0.94 2002 54 56.45晴天OTC 内 上 1180 418 1303 0.35 1799 329 8.27下 288 254 210 0.88 1584 64 23.75阴天OTC 外 上 691 322 706 0.47 1969 123 6.09下 244 120 252 0.49 1137 41 3.63阴天OTC 内 上 414 160 410 0.39 710 123 0.40下 106 44 108 0.41 208 28 0.33
2.2 水稻冠层不同高度的动态和稳态光合特性
OTC 内外, 水稻冠层剑叶在高光下的稳定光合速率和气孔导度均高于下部叶, 但在低光下(<100μmol/(m2·s)), 下部叶的光合速率倾向于高于剑叶或与剑叶相等(图 6 和表 3)。由表 3 可知, 下部叶的表观量子效率和暗呼吸速率均低于剑叶。在 OTC 外,下部叶的光补偿点低于剑叶, 但在 600 μmol/mol CO2 浓度的 OTC 内, 下部叶的光补偿点与剑叶相近。水稻叶冠层剑叶在整个动态光合测量期间的累积碳同化量、累积蒸腾量、光损失以及光减弱后的 CO2 固定均高于下部叶, 下部叶的潜在和表观水分利用效率则高于剑叶。
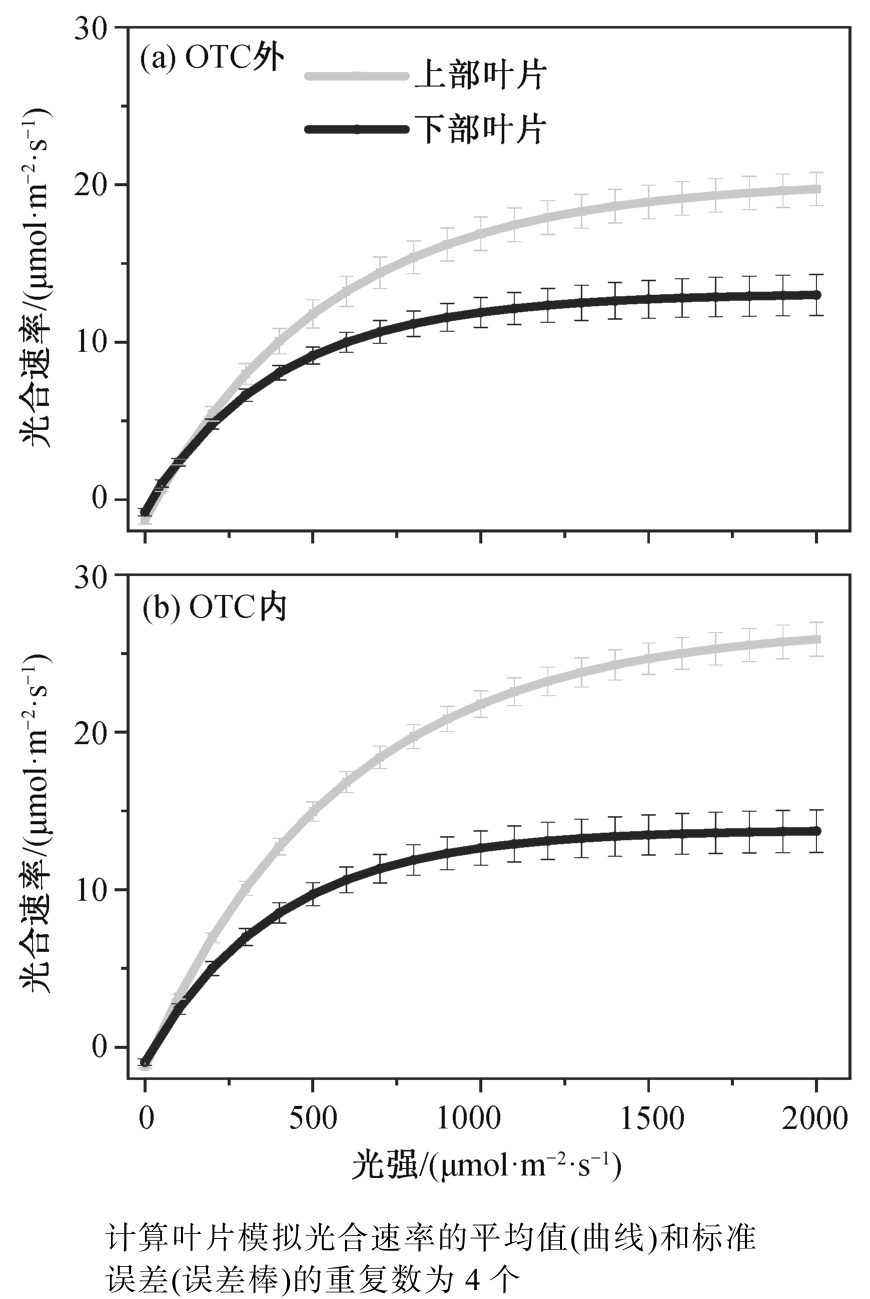
图6 水稻叶冠层不同高度的光响应曲线
Fig. 6 Light response curves of rice leaves at different heights of rice canopy inside and outside OTC
2.3 OTC 高 CO2 对水稻叶冠层不同高度叶片光环境及光合能力的影响
在晴天, 到达 OTC 内外的光合有效辐射中大部分的光强范围一致, 但在阴天, 到达 OTC 内冠层上下的光合有效辐射中主要部分的光强强度比 OTC外略低(图 4)。无论是晴天还是阴天, OTC 内冠层光强的衰减幅度均大于 OTC 外, 但不存在统计学上的显著差异(表 1)。在高 CO2 浓度的 OTC 中生长的水稻叶片倾向于具有更高的饱和光合速率、暗呼吸速率、光补偿点以及整个动态光合期间的累积碳同化量和水分利用效率(表3)。
3 讨论
3.1 水稻下层叶片的光环境
在晴天, 相比于水稻下层叶片经历的短暂而频繁的光斑, 上层叶片处于较高的平均光强, 经历更多的短暂低光强辐射, 这一光强变化特征主要是云的变动造成的[5]。OTC 内风的影响很小, 短暂的低光辐射更明显, 如低于 1000 μmol/(m2·s)的低光辐射约占 35%的时间, 仅提供约 15%的总辐射能。对下部叶片来说, 200~500 μmol/(m2·s)的光强占 41%~44%的时间, 提供的光合有效辐射占总量的 39%~41%, 而 500 μmol/(m2·s)以上的光照仅占一天观测时间的 14%~16%, 却提供高达 42%以上的光合有效辐射能量(图 3~5)。上述结果说明迅速利用变动的光合有效辐射对水稻下部叶提高光能利用效率十分重要。
3.2 水稻叶冠层不同高度叶片的稳定和动态光合特征
水稻上层的剑叶比下层的叶片在高光下具有较强的光合能力, 与前人研究结果[10,23-25]一致。与上层剑叶相比, 下层叶片的叶龄更大, 光环境的总光强较低, 这两个因素都会影响水稻叶片的光合物质含量, 进而影响其光合能力[13,24,26]。研究表明, 随着叶龄增加, 叶片的 Rubisco 酶、细胞色素 f (Cytochrome f)等物质的含量会下降[27-28]。这些物质是光合碳同化过程中电子传递与卡尔文循环的重要组成部分, 其含量减少会导致叶片电子传递能力与羧化能力下降, 进而表现为光合速率下降。同时, 生长环境中光强减弱也会导致 Rubisco 酶含量、光系统 II含量和细胞色素Cyt f/Chl、Chl a/b 等光合特征指标下降[12]。然而, 在光照较弱(<100 μmol/(m2·s))时,下部叶片的光合速率高于剑叶(图 6), 这与荫叶适应较弱光环境的结果相符, 与下部叶片较低的暗呼吸速率及光补偿点有关(表 3)。考虑到上层叶片在阴天和晴天测量时间内接收到的光强几乎均大于200 μmol/(m2·s), 而对于下层叶, 小于 200 μmol/(m2·s)的光强在晴天贡献 15%以上的能量(图 4), 该特征有利于低层叶片在相对低的光强环境下进行光合碳同化[10]。综上所述, 我们认为叶片老化和光环境两个因素均会对下层叶片的光合能力产生影响,但对两个因素的相对贡献比例需要进一步研究。
下层叶片的水分利用效率, 尤其是潜在水分利用效率远高于剑叶, 主要是由于下部叶片的蒸腾量以及气孔导度均为上部剑叶的一半左右(表 3)。剑叶是灌浆期水稻主要的光合能量来源, 因此下层片叶较高的水分利用效率有利于减少整株植物的水分散失。
在 OTC 外, 下层叶片的诱导光合损失几乎与上部剑叶相等, 但在 OTC 内, 下层叶片的诱导光损失少于剑叶(表 3), 这可能意味着, 尽管光强在冠层内的衰减在高 CO2 环境下有所增大, 下层叶可能对光的增强反而有更快的响应能力, 能够更好地利用高 CO2 环境中的光斑。另一方面, 我们发现光减弱后上部叶片的光合效率有所增加, 表明与下部叶片相比, 上部叶片能够更好地利用呈下降趋势的光强变化, 原因可能是光合速率较高的剑叶有更多的卡尔文循环中间代谢物、还原型辅酶Ⅱ(NADPH)、三磷酸腺苷(ATP)和更强的质子动力势[29-31], 因此在强光间隙或光强忽然减弱时, 上部叶片的 CO2 固定能够维持更长的时间。
表3 水稻下层叶片的动态和稳态光合特性及其占上层叶片的比例
Table 3 Steady-state and dynamic photosynthetic characteristics of lower leaves and their propotion in upper leaves of rice
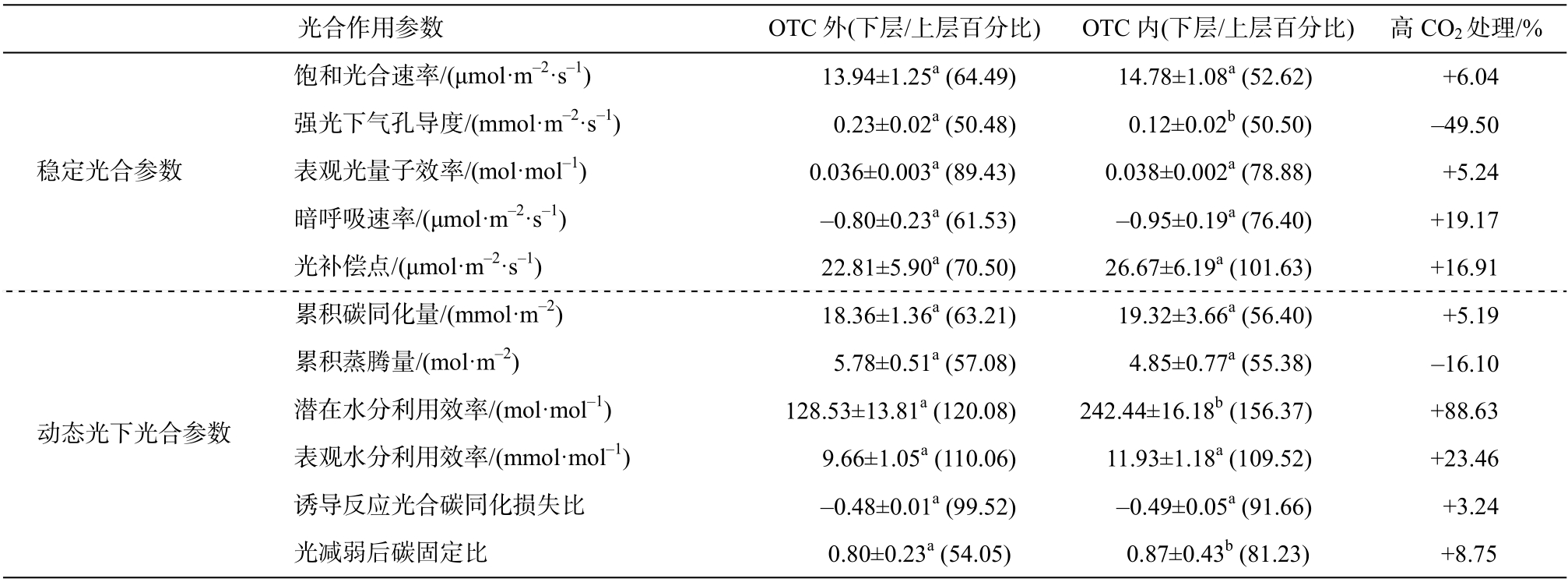
注: 相同的小写字母表示数据在5%水平上无显著性差异(t 检验), 不同表示有显著差异。
光合作用参数 OTC 外(下层/上层百分比) OTC 内(下层/上层百分比) 高CO2 处理/%饱和光合速率/(μmol·m-2·s-1) 13.94±1.25a (64.49) 14.78±1.08a (52.62) +6.04稳定光合参数动态光下光合参数强光下气孔导度/(mmol·m-2·s-1) 0.23±0.02a (50.48) 0.12±0.02b (50.50) -49.50表观光量子效率/(mol·mol-1) 0.036±0.003a (89.43) 0.038±0.002a (78.88) +5.24暗呼吸速率/(μmol·m-2·s-1) -0.80±0.23a (61.53) -0.95±0.19a (76.40) +19.17光补偿点/(μmol·m-2·s-1) 22.81±5.90a (70.50) 26.67±6.19a (101.63) +16.91累积碳同化量/(mmol·m-2) 18.36±1.36a (63.21) 19.32±3.66a (56.40) +5.19累积蒸腾量/(mol·m-2) 5.78±0.51a (57.08) 4.85±0.77a (55.38) -16.10潜在水分利用效率/(mol·mol-1) 128.53±13.81a (120.08) 242.44±16.18b (156.37) +88.63表观水分利用效率/(mmol·mol-1) 9.66±1.05a (110.06) 11.93±1.18a (109.52) +23.46诱导反应光合碳同化损失比 -0.48±0.01a (99.52) -0.49±0.05a (91.66) +3.24光减弱后碳固定比 0.80±0.23a (54.05) 0.87±0.43b (81.23) +8.75
3.3 OTC 高 CO2 对水稻叶冠层不同高度叶片光环境及光合能力的影响
OTC 外的光环境中光强快速变动的时间比OTC 内更多(图 3(a)和(c), 表 2)。这可能是因为OTC 结构降低了气体交换的速率——维持 OTC 内部 CO2 浓度在所需水平的同时也降低了风速。OTC 外较大的风速会造成整株植物的晃动或单叶的飘动, 改变叶片位置, 进而提升叶片接收到的光强变动频率[7,32-33]。由于 OTC 玻璃透明度较高, 中央处有较大的开口, 在太阳高度角较大时, OTC 内外光环境除风速外没有太大差异。
冠层下部接收到的光包括上层叶片的透射光以及通过间隙的直射光及散射光, 因此光强随冠层深度递减的规律受到上层叶片性质(如叶片厚度和叶绿素含量等)、冠层结构(如叶面积[34-35]、叶朝向及倾角[36]和叶片卷曲度[37]等)和风的影响[38]。OTC内晴天和阴天的光强衰减比例均高于 OTC 外, 可能意味着在 OTC 高 CO2 处理下, 下部叶片接收到的光强更弱, 但在 OTC 内晴天和阴天的光强只有一组测量值, 因此该结果是否具有普遍性有待进一步研究。如果该现象确实存在, 可能的原因有两方面。1) 高 CO2 改变了上层叶片性质及冠层结构, 增加了上层叶片对光的吸收, 进而影响冠层内光的分布。研究发现高 CO2 可以增加冠层叶面积指数[39]和叶片厚度[18,40], 叶片厚度的增加可能意味着增厚的栅栏组织以及更多的吸光色素[18]。2) OTC 内较弱的风减少了下层叶片通过间隙接收到的直射光及散射光, 使得下部叶片接收到的光更弱。本研究 OTC 内的光强数据有限, 且 OTC 装置本身可能间接地影响下部光环境, 因此暂时无法得出明确的结论。
我们之前的研究以及同平台的相关研究结果表明, 升高 CO2 浓度会显著地增加水稻剑叶的饱和光合速率[16], 图 6(b)中剑叶的光响应曲线与该结论相符。这可能是由于剑叶的光合作用在目前的 CO2 浓度下处于 Rubisco 限制, 而 CO2 浓度的增加可以增加 Rubisco 的羧化效率, 并抑制氧化反应, 进而增加光合速率[41]。高 CO2 浓度处理对下层叶的光合速率没有显著的影响(图 6), 可能的原因如下。1)水稻叶片在出叶之后, 随着叶片老化, Rubisco 酶含量下降[42-43]。同时, 有研究报道一单子叶作物下层叶片的 RuBP 最大羧化速率 Vc,max 在高 CO2 环境下比上叶的下降幅度更大[23], 这些因素均可能导致下层叶片的光合能力在长时间的高 CO2 处理下降的幅度更大, 使得增加CO2 浓度不会显著地增加叶片的饱和光合速率。2) 在高 CO2 浓度的处理下, 水稻冠层内的光分配情况也可能发生变化, 使得下层叶片对高 CO2 的响应也受到变化的光环境(如更弱的平均光强)的调控。总而言之, OTC 高 CO2 处理对剑叶和下层叶的光合速率影响的差异导致在高 CO2 处理下, 上、下叶片动态光合累积期间的同化量差异增大(下部叶片占上部叶片累积同化量之比: OTC 外为 63.2%, OTC 内为 53.4%), 可能进一步改变水稻不同叶片的物质累积情况, 需要未来进一步的研究。
4 结论
本研究对水稻叶冠层不同高度的光环境及叶片光合特征进行初步探索, 通过比较 CO2 添加的 OTC内外光环境和动态光合作用, 得到如下结论: 1) 下部叶片光环境的变动程度比上部大, 但这一差异对动态光合作用的生态意义需进一步探讨; 2) 上部叶片的照后 CO2 固定以及动态光期间的累积同化量比下部叶片高, 可能存在对具短暂低光量辐射的光环境的适应问题; 3) OTC 内冠层内部的光衰减率可能比 OTC 外大, 这个差异是否完全由 CO2 浓度差异导致, 需要今后通过实验佐证。综上所述, 水稻冠层(也许可以外推到其他冠层)上、下部叶片的稳定和动态光合特性对光环境的平均光合有效辐射强度及其强度的时间变化都有所响应, 而高 CO2 环境可能通过影响叶片光合能力来影响光环境的垂直分布。但是, 本研究的数据具有一定的局限性, 如 OTC 内外可能存在除 CO2 浓度之外影响光环境和叶片光合属性的变量(如 OTC 设施的影响等), 这些因素需要在今后的研究中加以考虑。
[1] 陈印军, 易小燕, 方琳娜, 等. 中国耕地资源与粮食增产潜力分析. 中国农业科学, 2016, 49(6): 1117-1131
[2] Long S P, Zhu X, Gnaidu S L, et al. Can improvement in photosynthesis increase crop yields?. Plant Cell &Environment, 2010, 29(3): 315-330
[3] Long S P, Marshall Colon A, Zhu X G. Meeting the global food demand of the future by engineering crop photosynthesis and yield potential. Cell, 2015, 161(1): 56-66
[4] Way D A, Pearcy R W. Sunflecks in trees and forests:from photosynthetic physiology to global change biology. Tree Physiology, 2012, 32(9): 1066-1081
[5] Kaiser E, Morales A, Harbinson J. Fluctuating light takes crop photosynthesis on a rollercoaster ride.Plant Physiology, 2018, 176(2): 977-989
[6] Taylor S H, Long S P. Slow induction of photosynthesis on shade to sun transitions in wheat may cost at least 21% of productivity. Philosophical Transactions of the Royal Society B: Biological Sciences, 2017,372: 20160543
[7] Slattery R A, Walker B J, Weber A P M, et al. The impacts of fluctuating light on crop performance.Plant Physiology, 2018, 176(2): 990-1003
[8] Kaiser E, Morales A, Harbinson J, et al. Dynamic photosynthesis in different environmental conditions.Journal of Experimental Botany, 2015, 66(9): 2415-2426
[9] Kromdijk J, Głowacka K, Leonelli L, et al. Improving photosynthesis and crop productivity by accelerating recovery from photoprotection. Science, 2016, 354:857-861
[10] Townsend A J, Retkute R, Chinnathambi K, et al.Suboptimal acclimation of photosynthesis to light in wheat canopies. Plant Physiology, 2018, 176(2):1233-1246
[11] Nishimura S, Itoh K, Tang Y, et al. Difference in diurnal courses of microclimate and gas exchange on rice (Oryza sativa L.) leaves with various orientations in a paddy field. Journal of the Japanese Agricultural Systems Society, 2000, 16: 156-162
[12] Hikosaka K. Effects of leaf age, nitrogen nutrition and photon flux density on the organization of the photosynthetic apparatus in leaves of a vine (Ipomoea tricolor Cav.) grown horizontally to avoid mutual shading of leaves. Planta, 1996, 198(1): 144-150
[13] Yamazaki J Y, Kamimura Y, Okada M, et al. Changes in photosynthetic characteristics and photosystem stoichiometries in the lower leaves in rice seedlings.Plant Science, 1999, 148(2): 155-163
[14] IPCC. Summary for policymakers. Cambridge: Cambridge University Press, 2014
[15] Ainsworth E A, Long S P. What have we learned from 15 years of free-air CO2 enrichment (FACE)? A metaanalytic review of the responses of photosynthesis,canopy properties and plant production to rising CO2.New Phytologist, 2005, 165(2): 351-372
[16] 刘晓萌, 于凌飞, 黄耀, 等. CO2 浓度升高下粳稻叶片光合作用对光强变化的响应. 生态学杂志, 2018,37(4): 1051-1057
[17] 范佩佩, 冯芳, 刘超, 等. 不同 CO2 浓度升高水平对粳稻叶片荧光特性的影响. 应用生态学报, 2019,30(11): 3735-3744
[18] Arnone J A, Körner C. Influence of elevated CO2 on canopy development and red : far-red ratios in twostoried stands of Ricinus communis. Oecologia, 1993,94(4): 510-515
[19] Gielen B, Liberloo M, Bogaert J, et al. Three years of free-air CO2 enrichment (POPFACE) only slightly affect profiles of light and leaf characteristics in closed canopies of Populus. Global Change Biology,2003, 9(7): 1022-1037
[20] 孙文娟, 张晨希, 刘晓萌, 等. 不同 CO2 浓度升高水平对粳稻灌浆速率的影响. 农业现代化研究,2018, 39(01): 148-154
[21] 闫小红, 尹建华, 段世华, 等. 四种水稻品种的光合光响应曲线及其模型拟合. 生态学杂志, 2013,32(03): 604-610
[22] Bassman J H, Zwier J C. Gas exchange characteristics of Populus trichocarpa, Populus deltoides and Populus trichocarpa × P. deltoides clones. Tree Physiology, 1991, 8(2): 145-159
[23] Osborne C P, La Roche J, Garcia R L, et al. Does leaf position within a canopy affect acclimation of photosynthesis to elevated CO2? Analysis of a wheat crop under free-air CO2 enrichment. Plant Physiology,1998, 117(3): 1037-1045
[24] Murchie E H, Hubbart S, Chen Y, et al. Acclimation of rice photosynthesis to irradiance under field conditions. Plant Physiology, 2002, 130(4): 1999-2010
[25] Zhang D Y, Wang X H, Chen Y, et al. Determinant of photosynthetic capacity in rice leaves under ambient air conditions. Photosynthetica, 2005, 43(2): 273-276
[26] Seneweera S, Makino A, Hirotsu N, et al. New insight into photosynthetic acclimation to elevated CO2: the role of leaf nitrogen and ribulose-1,5-bisphosphate carboxylase/oxygenase content in rice leaves. Environmental and Experimental Botany, 2011, 71(2):128-136
[27] Hidema J, Makino A, Mae T, et al. Photosynthetic characteristics of rice leaves aged under different irradiances from full expansion through senescence.Plant Physiology, 1991, 97(4): 1287-1293
[28] Jiang C Z, Ishihara K, Satoh K, et al. Loss of the photosynthetic capacity and proteins in senescing leaves at top positions of two cultivars of rice in relation to the source capacities of the leaves for carbon and nitrogen. Plant and Cell Physiology, 1999,40(5): 496-503
[29] Kirschbaum M, Oja V, Laisk A. The quantum yield of CO2 fixation is reduced for several minutes after prior exposure to darkness: exploration of the underlying causes. Plant Biology, 2005, 7(1): 58-66
[30] Laisk A, Kiirats O, Oja V. Assimilatory power (postillumination CO2 uptake) in leaves: measurement,environmental dependencies, and kinetic properties.Plant Physiology, 1984, 76(3): 723-729
[31] Sharkey T D, Seemann J R,Pearcy R W. Contribution of metabolites of photosynthesis to postillumination CO2 assimilation in response to lightflecks. Plant Physiology, 1986, 82(4): 1063-1068
[32] Roden J S, Pearcy R W. Effect of leaf flutter on the light environment of poplars. Oecologia, 1993, 93(2):201-207
[33] Tang Y, Washitani I, Tsuchiya T, et al. Fluctuation of photosynthetic photon flux density within a Miscanthus sinensis canopy. Ecological Research, 1988, 3(3):253-266
[34] Gu J, Chen Y, Zhang H, et al. Canopy light and nitrogen distributions are related to grain yield and nitrogen use efficiency in rice. Field Crops Research,2017, 206: 74-85
[35] 李艳大. 水稻株型与光能利用的模拟研究[D]. 南京: 南京农业大学, 2010
[36] Nishimura S, Koizumi H, Tang Y. Spatial and temporal variation in photon flux density on Rice (Oryza sativa L.) leaf surface. Plant Production Science, 1998, 1(1):30-36
[37] 郎有忠, 张祖建, 顾兴友, 等. 水稻卷叶性状生理生态效应的研究Ⅰ. 叶片姿态、群体构成及光分布特征. 作物学报, 2004, 30(8): 806-810
[38] Nishimura S, Tang Y, Itoh K, et al. Photosynthetic light-use efficiency in rice (Oryza sativa L.) leaf under light with fluctuating intensities at two different ambient humidities. Plant Production Science,2000, 3(2): 79-83
[39] Nijs I, Impens I, Behaeghe T. Leaf and canopy responses of Lolium perenne to long-term elevated atmospheric CO2 concentration. Planta, 1989, 177(3):312-320
[40] Radoglou K M, Jarvis P G. Effects of CO2 enrichment on four poplar clones. I. Growth and leaf anatomy.Annals of Botany, 1990, 65(6): 617-626
[41] Long S P, Ainsworth E A, Rogers A, et al. Rising atmospheric carbon dioxide: plants FACE the future.Annual Review of Plant Biology, 2004, 55(1): 591-628
[42] Fukayama H, Uchida N, Azuma T, et al. Light dependent activation of CO2 assimilation and the ratio of Rubisco activase to Rubisco during leaf aging of rice (Oryza sativa). Physiologia Plantarum, 1998,104(4): 541-548
[43] Weng X Y, Xu H X, Jiang D A. Characteristics of gas exchange, chlorophyll fluorescence and expression of key enzymes in photosynthesis during leaf senescence in rice plants. Journal of Integrative Plant Biology,2005, 47(5): 560-566