表1 模拟废水微量元素浓缩液配方表
Table 1 Components of trace element solutions
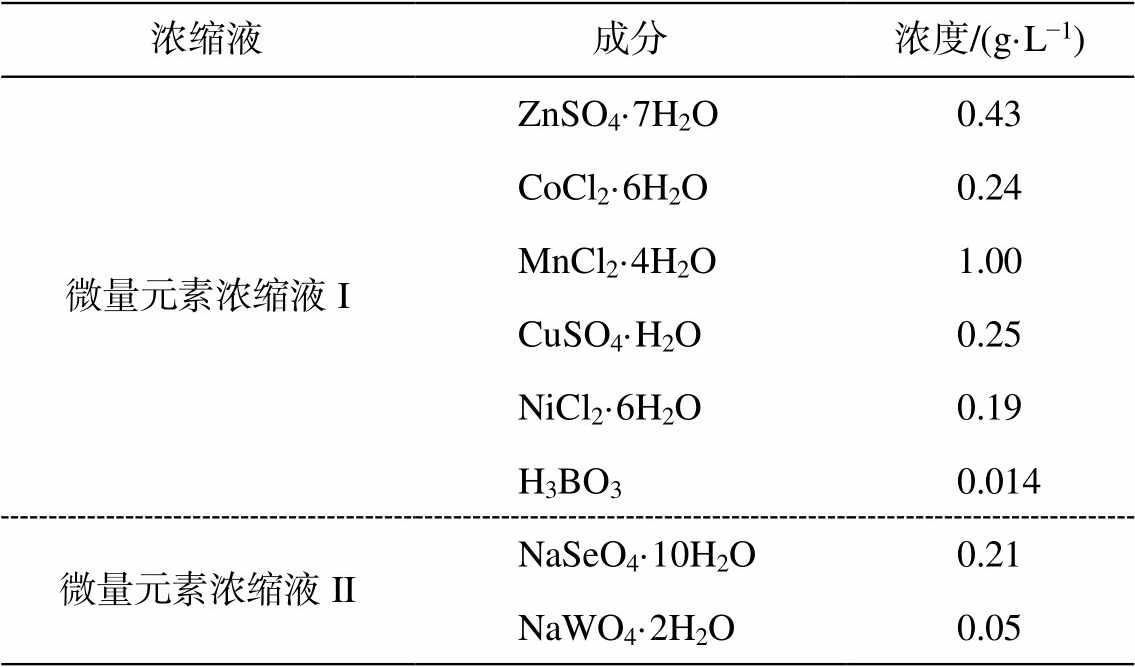
浓缩液成分浓度/(g·L−1) 微量元素浓缩液IZnSO4·7H2O0.43 CoCl2·6H2O0.24 MnCl2·4H2O1.00 CuSO4·H2O0.25 NiCl2·6H2O0.19 H3BO30.014 微量元素浓缩液IINaSeO4·10H2O0.21 NaWO4·2H2O0.05
摘要 为了探究有机碳对厌氧氨氧化的长期影响, 向厌氧氨氧化膜生物反应器中添加不同浓度的丙酸钠, 研究对反应器的除氮效能以及微生物的种群结构和功能变化。结果表明: 反应器主要的脱氮过程由 Candidatus Brocadia 完成, 当丙酸钠浓度为 100mg/L 时, 反应器中由于异养细菌的生长, 可实现碳氮的同步去除, 平均总氮去除率可达 91.9%。当丙酸钠浓度为 200mg/L时, 对 Candidatus Brocadia 的抑制作用导致反应器除氮性能下降, Candidatus Brocadia 的丰度降至 41.2%, 总氮去除率降至 78.8%。在有机碳抑制作用解除后, 反应器的除氮性能恢复为 86.8%, Candidatus Brocadia 丰度增加到 54.0%, 但群落多样性下降, 属水平的微生物组成有较大的改变。
关键词 厌氧氨氧化; 丙酸盐; 氮去除率; 种群结构; Candidatus Brocadia
厌氧氨氧化(anaerobic ammonium oxidation, Anammox)细菌在 19 世纪 90 年代首先发现于废水污泥中[1]。Anammox 过程指在厌氧或缺氧的条件下, 以亚硝氮为电子受体, 将铵氧化为氮气[2]。该过程不需要氧气和有机碳源, 且污泥产量低, 氮去除率高[3], 极大地节省能源和成本, 在污水处理领域具有良好的应用前景。Anammox 工艺常用于老龄垃圾渗滤液和污泥消化液等高氨氮、低有机碳废水的处理[4–5], 已在超过 100 个废水处理项目中应用Anammox工艺处理这类含氮废水[6]。
垃圾渗滤液成分复杂, 有机物和氨氮含量高。随着填埋年限增加, 垃圾渗滤液中有机物含量逐渐降低。在老龄垃圾渗滤液中, 生物可降解有机质(BOD)含量低于 500mg/L, 总氮含量高于 1000 mg/L[7]。通常采用组合工艺来处理这类废水, 包括短程硝化–厌氧氨氧化组合工艺(SHARON-Anammox)[8]、部分亚硝化–厌氧氨氧化耦合工艺(PN-Anammox)[9]和短程硝化反硝化–厌氧氨氧化联合工艺(SNAD)[10–11]等, 通过其他反应器与 Anammox反应器串联, 实现有机碳和氮的同步去除。
在 Anammox 反应器中起主要作用的 Anammox细菌是以 CO2 为碳源的化能自养微生物。早期研究认为, 有机碳会对 Anammox 细菌产生不良影响[12]。随着混合营养型 Anammox 细菌的发现, 研究认为适当的有机碳可能会促进 Anammox 细菌的生长或增强 Anammox 的活性[13]。有机碳对 Anammox 细菌的影响包括抑制作用和促进作用两个方面, 甲醇和乙醇等小分子有机物以及乙炔、醛类、酚类和抗生素等有毒有机物会抑制酶的活性, 从而对 Anammox细菌造成不可逆的毒性抑制[14–16]。竞争抑制作用取决于有机物的浓度, 由于异养细菌的生长速度大于自养细菌, 在有机物浓度较高时, 反硝化等异养细菌的生长会抑制 Anammox 细菌的生长。当有机物浓度较低时, Anammox 和反硝化的协同作用可以实现碳氮的同时去除。低浓度小分子有机物的添加可以激发 Anammox 细菌的有机营养代谢特性, 以有机碳为电子供体来还原硝酸盐, 有利于进一步提高总氮去除率[16]。Feng 等[18]通过微生物转录组学和代谢组学分析表明, 在 COD 浓度为 60mg/L 的条件下, 混合营养型 Anammox 细菌比自养型 Anammox细菌的生物质产量更高, 胞外聚合物(EPS)的产量也更大; 在 C/N 为 0.3 时, NADH、NAD+以及 ATP消耗量增加, 表明 Anammox 的活性显著增加。Tao等[19]使用 13C 标记的乙酸盐和丙酸盐对 Anammox富集培养物进行研究, 发现使用乙酸盐和丙酸盐的富集效率是碳酸氢钠的 10 倍以上, 且丙酸盐的富集效率高于乙酸盐。Anammox 细菌的混合营养特性表明, 它们在自然和工程生态系统中可能具有更广泛的生态位, 在污水处理领域具有更广泛的应用前景。
在垃圾渗滤液中, 可挥发性脂肪酸(VFAs)主要以乙酸盐和丙酸盐等形式存在。丙酸盐是厌氧生物处理过程中常见的中间代谢产物之一, 有研究表明, 在一定浓度范围内, Anammox 系统对丙酸盐具有较强的适应性[20–21]。了解 Anammox 细菌群落结构随丙酸钠浓度变化的规律, 有利于在污水处理过程中针对污水组成成分和浓度, 更好地控制污泥组成。因此, 本研究以丙酸钠为有机碳源, 探究不同浓度的丙酸盐对 Anammox 脱氮能力和种群结构的长期影响, 以期为 Anammox 工艺应用于低 C/N 废水的处理提供理论依据。
本研究采用有效容积为 1.5L 的膜生物反应器(membrane bioreactor, MBR), 设有进水泵、出水泵、取泥口和曝气口。利用循环水浴加热装置, 保证反应器的运行温度为 35ºC±0.5ºC, 通过每天定时向反应器内曝入 Ar-CO2 (95%/5%)混合气体, 控制反应器的 pH 为 7.0~8.0, 同时也保证反应器中培养物处于厌氧环境。搅拌装置以 120rpm 的转速运行。反应器的水力停留时间(HRT)为 24 小时。用锡箔纸包裹反应器罐体, 防止光照对培养物产生影响。
接种污泥取自实验室已稳定运行一年以上的Anammox 反应器。实验废水为人工配比的模拟含氮废水, 以碳酸氢钠为无机碳源, 以亚硝酸钠和氯化铵为氮源, 并含有必要的矿物质、微量元素和维生素, 用于满足微生物生长的需要。营养液配方组成如下: MgCl2·6H2O (0.0813g/L), KH2PO4 (0.01g/L), CaCl2·2H2O (0.015g/L)和 EDTA-Na2 (0.00625g/L), 以及微量元素 I 和 II (组成见表1)(1 mL/L)[22]。
丙酸盐长期影响试验共历时 183 天。根据进水中丙酸钠的浓度变化, 将反应器的运行分为 5 个阶段。阶段 I 为稳定运行时期(414~451 天), 进水中NO2−-N 和 NH4+-N 浓度均为 1000mgN/L, 丙酸钠浓度为 0mg/L。阶段 II(452~482 天)、III(483~520天)和 IV (521~539 天)分别调整进水中丙酸钠浓度为50, 100 和 200mg/L, 并始终保持进水中 NH4+-N 浓度为 1000mgN/L。进水 NO2−-N 浓度, 阶段 II 为1000~1060mgN/L, 阶段 III 和 IV 为 1060~1090mgN/ L。由于阶段 IV 出水中 NO2−-N 浓度开始积累, 反应器除氮性能下降, 因此阶段 IV 共历时 18 天。阶段 V(540~597 天)为反应器的恢复时期, 调整进水中丙酸钠的浓度为 0mg/L, 并调低进水中氮负荷, NO2−-N 和 NH4+-N 浓度分别为 520 和 500mgN/L, 并逐步提升至 1000 mgN/L。
表1 模拟废水微量元素浓缩液配方表
Table 1 Components of trace element solutions

浓缩液成分浓度/(g·L−1) 微量元素浓缩液IZnSO4·7H2O0.43 CoCl2·6H2O0.24 MnCl2·4H2O1.00 CuSO4·H2O0.25 NiCl2·6H2O0.19 H3BO30.014 微量元素浓缩液IINaSeO4·10H2O0.21 NaWO4·2H2O0.05
在反应器运行过程中, 每 2~3 天定期收集反应器出水, 经 0.22μm 滤膜过滤后测定“三氮”浓度, 实验方法参照国家环保总局颁布的《水和废水监测和分析方法》。亚硝氮(NO2−-N)测定采用N-(1-萘基)-乙二胺分光光度法, 氨氮(NH4+-N)测定采用纳氏试剂分光光度法, 硝氮(NO3−-N)测定采用双波长紫外分光光度法。化学需氧量(COD)的测定参照标准方法[23]。
参照试剂盒方法, 选择 PowerSoilTM 试剂盒(MoBio Laboratories Inc., Carlsbad, 美国)提取细菌基因组 DNA。使用 515F (3'-GTGYCAGCMGCCG CGGTAA-5')和 806R (5'-GGACTACNVGGGTWTC TAAT-3')通用引物扩增细菌 16S rRNA 基因的 V4区。用 TaKaRa MiNiBEST DNA 片段纯化试剂盒Ver.4.0 (TaKaRa, 日本)纯化 PCR 产物, 然后用凝胶电泳进行质量检查。选择 Illumina Hiseq 2500 平台, 对 16S rRNA V4 区进行高通量测序, 得到测序长度为 2×250 bp 的双端测序数据。
在反应器运行过程中共收集 18 个样品点, 阶段I 为 D414, D424, D434, D443 和 D451, 阶段 II 为D458, D465 和 D472, 阶段 III 为 D489, D497, D504, D512 和 D520, 阶段 IV 为 D539, 阶段 V 为 D563, D580, D587 和 D597。使用 FastQC [24]和 Trimmo-matic [25]软件对测序原始数据进行过滤, 去除低质量的序列。使用 QIIME2 软件[26], 对过滤后的 16S rRNA 基因序列进行分析。如果非重复序列的相似度大于 97%, 则聚类为同一个可操作分类单元(ope-rational taxonomic units, OTU)。使用 SILVA 数据库(release 132)对 OTU 进行分类注释[27], 并计算 α 多样性。
根据 16S rRNA 基因序列的分类注释结果, 使用 FAPROTAX 软件[28]预测群落功能。使用 Gephi (v0.9.2)软件[29]的 Force Atlas 算法, 对二分网络图进行可视化。
图 1(a)显示反应器运行期间进出水中亚硝态氮(NO2−-N)、氨氮(NH4+-N)和硝态氮(NO3−-N)的浓度变化。阶段 I (第 414~451 天), 反应器进水中未添加有机碳源, 以 CO2 和 HCO3−为唯一碳源, 出水中NO2−-N, NH4+-N 和 NO3−-N 浓度分别为 3.9±2.7, 94.4± 14.5 和 150.6±33.2mgN/L, 总氮去除率为 87.6%± 1.8%。阶段 II (第 452~482 天), 进水中丙酸钠浓度为50mg/L, 出水中 NO3−-N 浓度变为 135.4±14.0mgN/L, 总氮去除率变化不大, 为 87.3%±1.4%。阶段 III (第483~520 天), 进水中丙酸钠浓度调整为 100mg/L, 出水中 NO3−-N 浓度比上一阶段有所增加, 为 151.2± 16.4mgN/L, 总氮去除率略有增加, 为 88.5%±3.2%。当进水中丙酸钠浓度低于 100mg/L 时, 对反应器的除氮性能无明显影响, Ni 等[12]认为, 低浓度的有机碳不会明显地影响 NO2−-N 和 NH4+-N 的去除率, 而反硝化细菌的存在可以还原 NO3−-N, 从而提高总氮去除率。阶段 IV (第 521~539 天), 进水中丙酸钠浓度为 200mg/L 时, 出水中 NO2−-N 浓度开始积累, 最高达到 217.45mgN/L, NH4+-N 去除率下降, 反应器总氮去除率下降为 78.8%±5.1%。Huang 等[30]的研究结果也表明, 240mg/L 的乙酸盐和 400mg/L 的丙酸盐分别使 NH4+-N 去除率降低 33%和 29%。阶段 V(第 540~597 天), 停止进水中有机碳的投加, 反应器的除氮性能逐渐恢复, 出水中平均 NO2−-N浓度下降到 3.8±1.8mgN/L, 反应器的平均总氮去除率增加为86.8%±2.6%。
根据 Anammox 反应方程式, NO2−-N 与 NH4+-N消耗比例的理论值为 1.32:1, NO3−-N 产生量与NH4+-N 消耗量比例的理论值为 0.26:1[31]。NO2−-N与 NH4+-N 消耗量的比值以及 NO3−-N 产生量与NH4+-N 消耗量的比值会随着反应器类型、运行状况以及 Anammox 细菌生理状况的变化而变化[32], 可以反映反应器中微生物种群的代谢及生存状态[33]。图 1(b)显示, NO2−-N 与 NH4+-N 实际消耗比值以及 NO3−-N 产生量与 NH4+-N 消耗量比值均小于理论值, 这是由于 Anammox 过程产生的 NO3−-N 会通过反硝化过程或异化硝酸盐还原成铵(DNRA)过程, 被进一步转化为铵盐[11]。Anammox 细菌可能同时具有 Anammox 代谢和 DNRA 代谢途径[34], 在DNRA 过程中以丙酸盐作为电子供体, 一部分NO3−-N 作为电子受体, 被还原成 NH4+-N[18]。在阶段 IV 中, 由于丙酸盐抑制了 Anammox 细菌的活性, 导致 NH4+-N 的消耗量下降, 与前面的阶段相比, NO2−-N 与 NH4+-N 实际消耗量的比值有所增加, 同时, 反硝化菌对 NO3−-N 的还原作用也导致出水中NO3−-N 浓度降低。丙酸盐的增加导致 NH4+-N 消耗量降低, 表明丙酸盐和铵盐作为电子供体在竞争亚硝酸盐, 与已有研究[14]的结论一致。
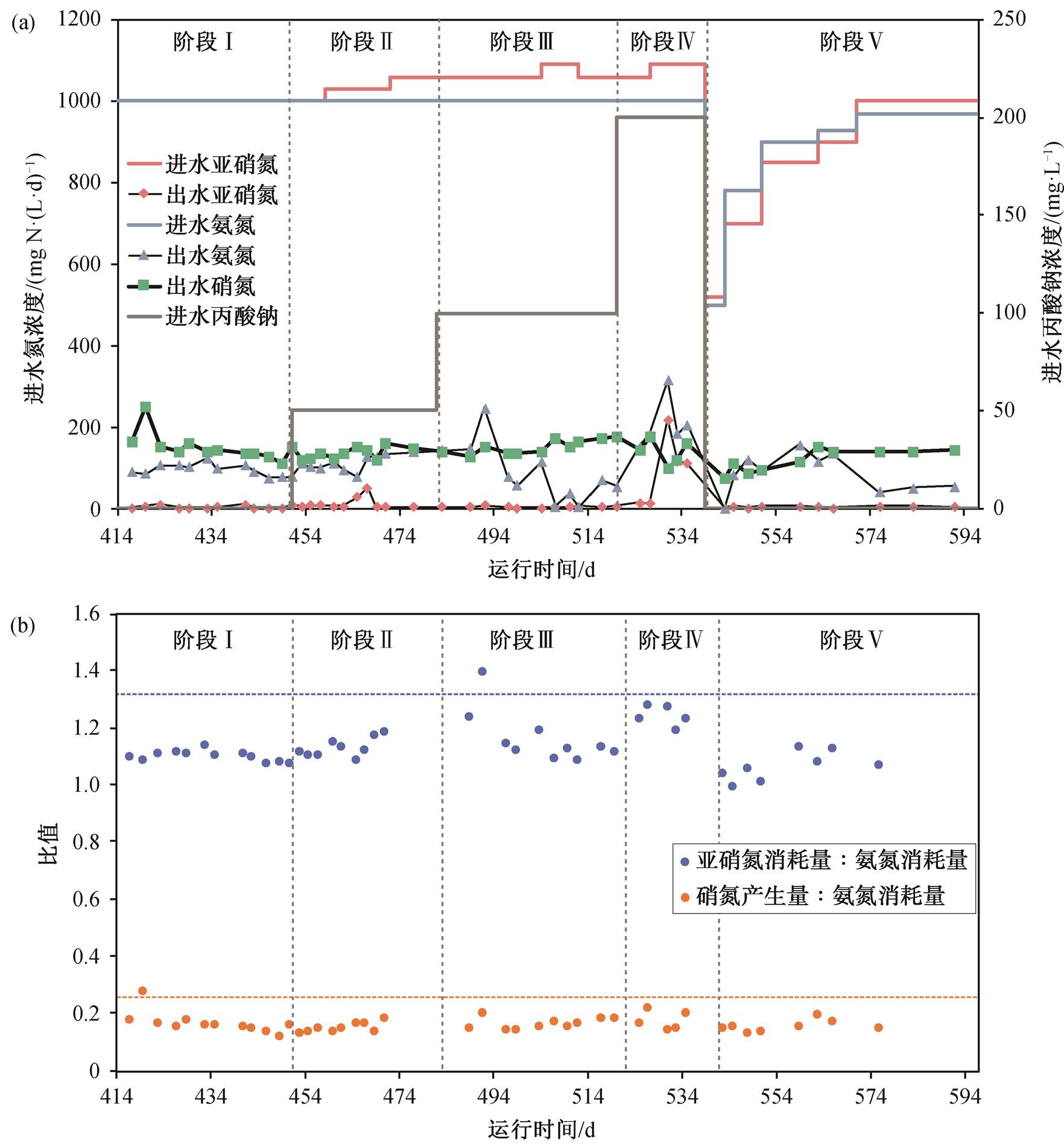
图1 反应器进、出水中亚硝氮、氨氮、硝氮浓度变化(a)和亚硝氮消耗量与氨氮消耗量比值、硝氮产生量与氨氮消耗量比值(b)
Fig. 1 Concentration of nitrite, ammonium and nitrate in the influent and effluent (a) and the radio of nitrite consumption to ammonium consumption, the ratio of nitrate production to ammonium consumption (b)
在本试验中, 阶段 II 和 III 出水中 COD 浓度均低于检出限(50mg/L O2), 阶段 IV 出水中 COD 浓度为 80mg/L O2 (图2), Anammox 反应器对 COD 的去除率可达 90%以上, 丙酸盐的添加可以激发 Anam-mox 细菌的有机营养代谢能力, 作为电子供体转化硝酸盐, 此外丙酸盐还可能被体系中其他异养细菌利用。
为了探究反应器运行过程中微生物种群结构的动态变化, 对 18 个时间点的 DNA 样品进行 16S rRNA 基因测序分析。共聚类得到 1057 个 OTU, 每个样品的覆盖度均大于 0.99, 说明测序深度可以覆盖样品信息, 测序数据量合理(表2)。
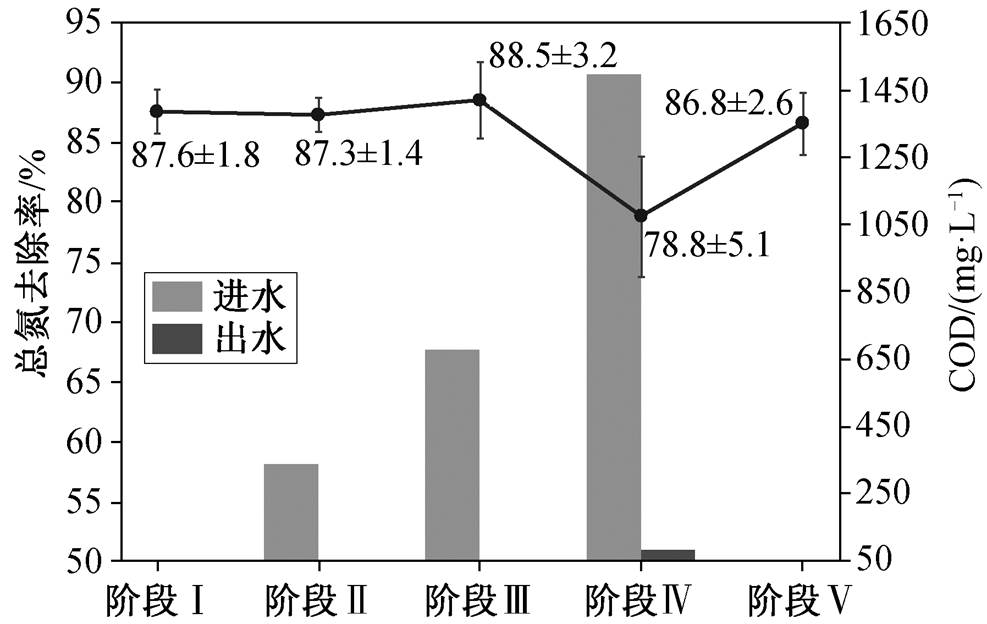
图2 反应器中 5 个阶段的总氮去除率及进出水中 COD浓度变化
Fig. 2 Total nitrogen removal efficiency and COD concen-trations in the influent and effluent over five phases
表2 样品中α多样性指标统计
Table 2 Alpha diversity index in the samples
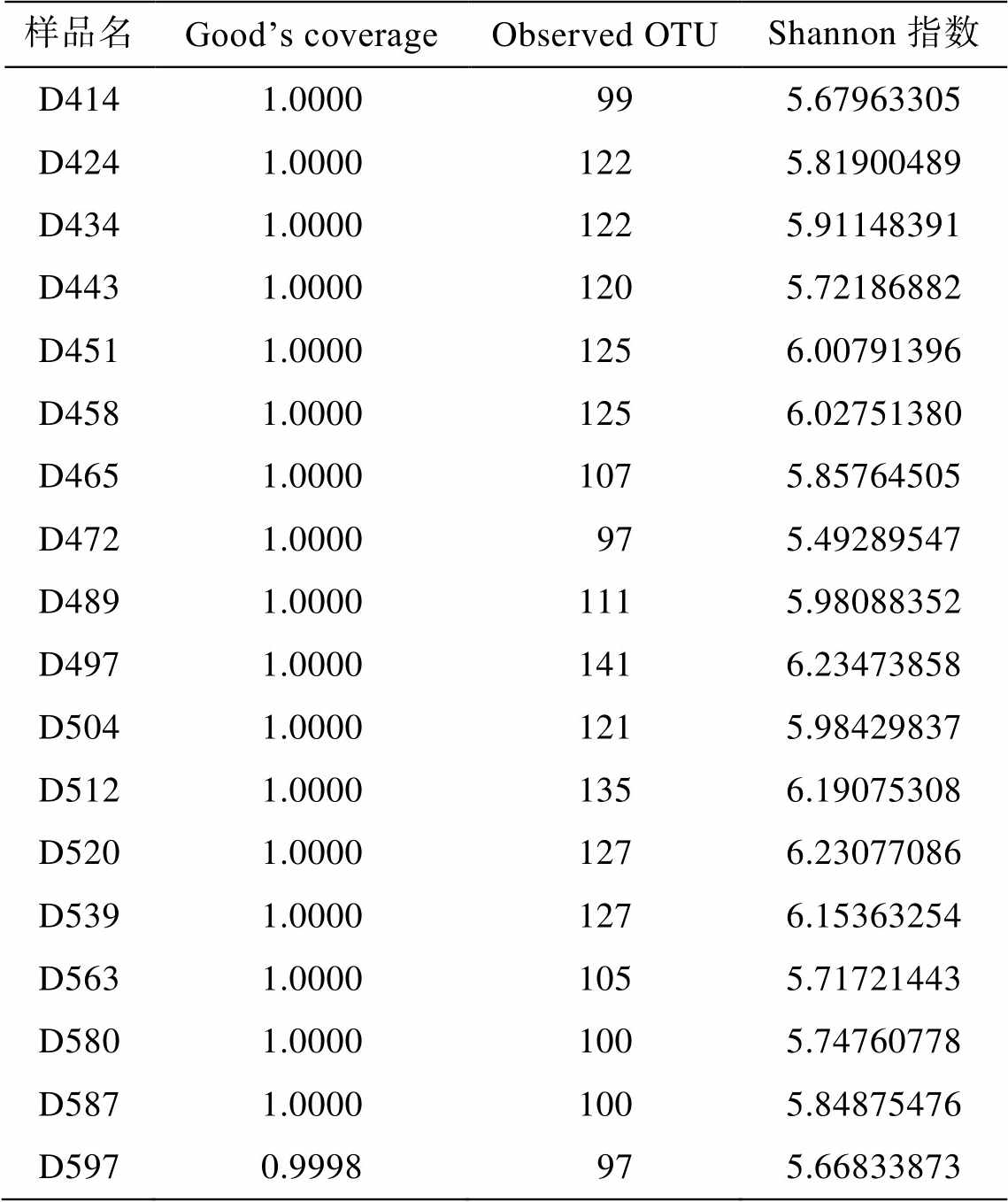
样品名Good’s coverageObserved OTUShannon指数 D4141.0000 995.67963305 D4241.00001225.81900489 D4341.00001225.91148391 D4431.00001205.72186882 D4511.00001256.00791396 D4581.00001256.02751380 D4651.00001075.85764505 D4721.0000 975.49289547 D4891.00001115.98088352 D4971.00001416.23473858 D5041.00001215.98429837 D5121.00001356.19075308 D5201.00001276.23077086 D5391.00001276.15363254 D5631.00001055.71721443 D5801.00001005.74760778 D5871.00001005.84875476 D5970.9998 975.66833873
计算反应器在 5 个运行时期中的 α 多样性变化, 探究物种多样性的变化趋势。Observed OTU 指数表征物种丰富度, 从图 3(a)中可以看出, 在阶段 III时, Observed OTU 指数最高, 表明当丙酸钠浓度为100mg/L 时, 群落中的物种数量最多, 比较适宜Anammox 细菌群落的生长。在阶段 V 时, Observed OTU 指数最低, 说明在恢复时期, 群落中的物种数量最少, 可能是上一阶段进水中丙酸钠浓度为 200 mg/L 时, 对反应器中微生物生存造成影响。Shan- non 指数综合考虑群落中物种的丰富度和均匀度, 从图 3(b)可以看出, 从阶段 I 到阶段 III, Shannon 指数不断增加, 说明当进水中丙酸钠浓度为 50 和 100mg/L 时, 反应器中微生物的物种多样性不断上升。在阶段 IV, Shannon 指数有所下降, 在阶段 V, Shannon 指数最低。这表明, 当丙酸钠浓度为 200 mg/L 时, 反应器中的微生物受到影响, 物种多样性下降, 在阶段 V 恢复时期, 尽管反应器的除氮效能恢复, 但微生物的多样性水平下降。
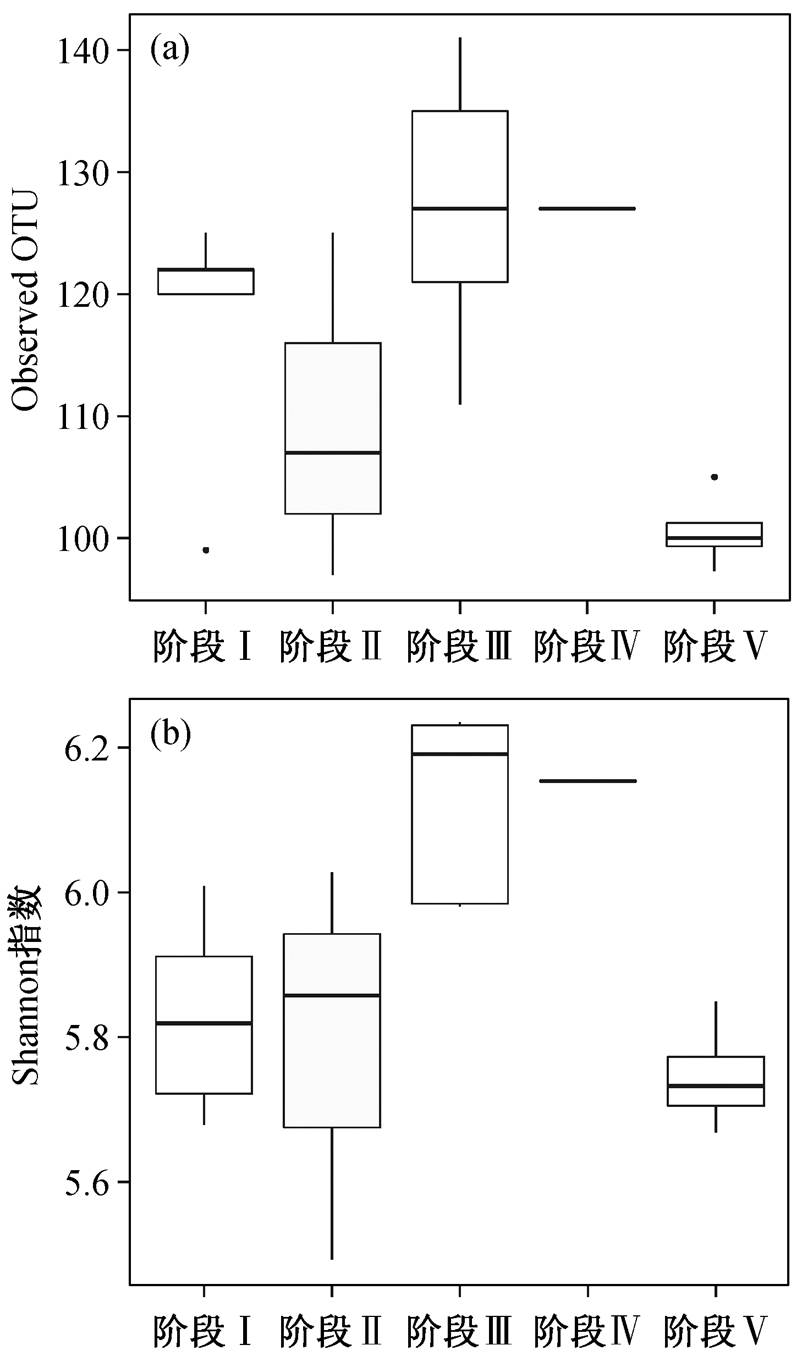
图3 反应器5个运行阶段中α多样性变化
Fig. 3 Alpha diversity in five operational phases
在 Anammox 细菌群落中, 共检测到 19 个门的微生物。从门水平来看, 浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)是体系中丰度最高的门, 占整个系统的 90%以上(图4(a)), 这 4 个门的微生物建立了稳定的种群结构。在其他 Anammox 反应器中, 尽管反应器的种类、运行条件和进水基质浓度各有差异, 但绿弯菌门、拟杆菌门和浮霉菌门的微生物均占较大的比例[35–37], 表明它们之间存在普遍的相互作用关系[38]。在活性污泥中, 绿弯菌门微生物通常与 Anammox 生物质同时存在[39–41]。本研究的 5 个阶段中, 浮霉菌门微生物始终占据主导地位, 绿弯菌门微生物的平均丰度分别为 15.7%±2.4%, 11.4%±2.5%, 21.8%±4.7%, 23.8%和 16.5%±1.9%。可以看出, 当进水中丙酸盐浓度高于 100mg/L 时, 绿弯菌门细菌丰度有较大幅度的增加。绿弯菌门微生物属于异养细菌, 可以降解和利用因细胞衰亡而产生的大分子物质, 此外, 绿弯菌门微生物还可以合成胞外多糖, 有利于污泥团聚体的形成[42]。有机碳的添加会促进 Anammox 细菌分泌胞外聚合物[18], 促进异养细菌的生长。因此, 在丙酸盐浓度为 100和 200mg/L 时, 有利于 Anammox 细菌分泌 EPS, 从而促进绿弯菌门微生物的生长。拟杆菌门微生物属于丝状细菌, 在颗粒污泥的形成中起重要作用[43]。Pijuan 等[44]通过探究 SBR 反应器中 COD 对 Anammox群落结构的长期影响, 认为长期添加 COD 会导致Anammox 活性被抑制, 变形菌门细菌丰度下降, 拟杆菌门细菌丰度增加。本研究中变形菌门细菌丰度与拟杆菌门细菌丰度变化与之相反, 这是由于Anammox 的恶化过程是逐渐发生的, 当丙酸钠浓度为 200mg/L 时, 对 Anammox 细菌有一定的抑制作用, 此时 Anammox 过程仍然占主导地位。
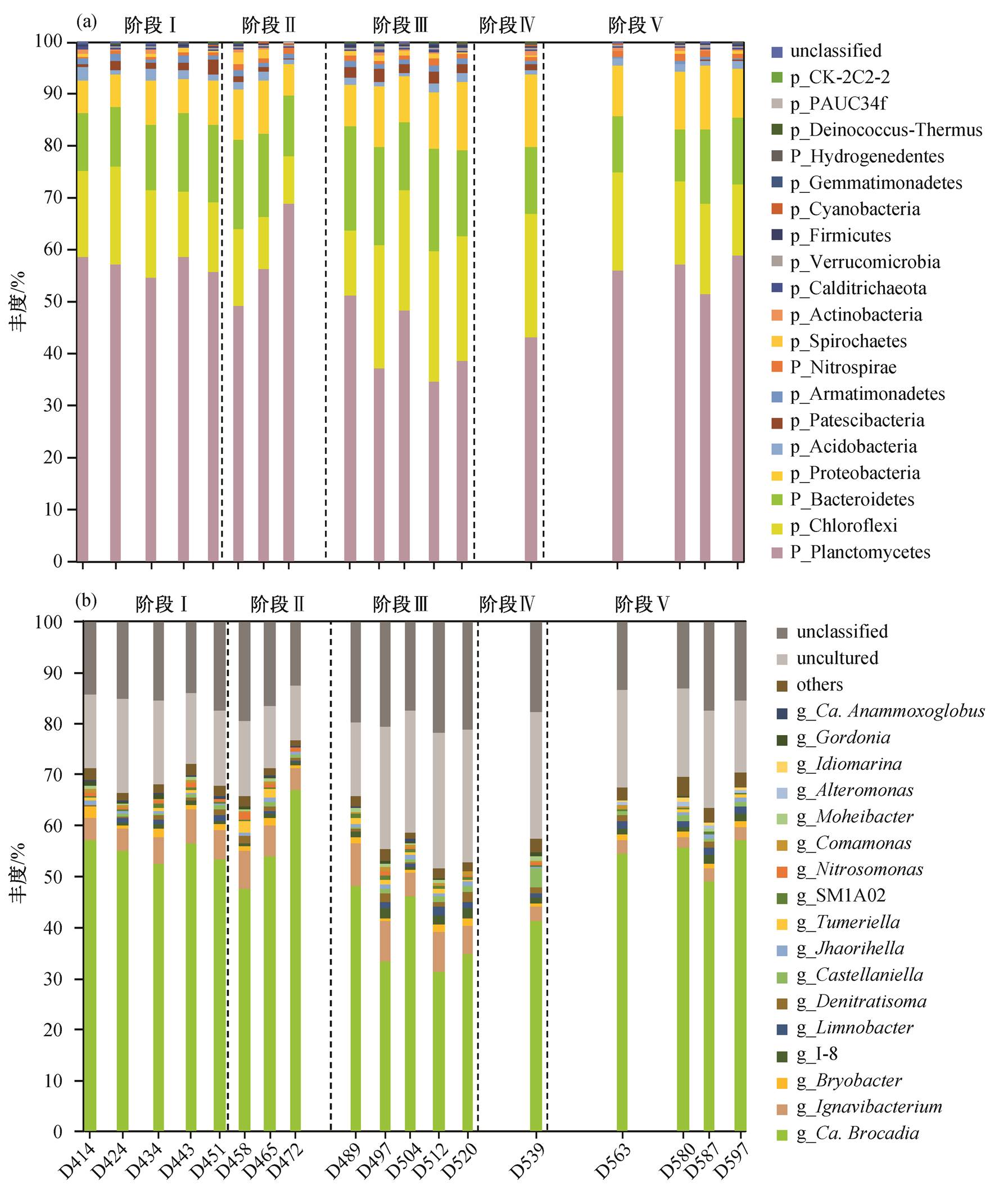
图4 微生物在门水平(a)和属水平(b)的丰度动态变化
Fig. 4 Community structure dynamic changes at phylum level (a) and genus level (b)
图 4(b)显示每个样品中丰度排在前 10 位的属, 其中被注释为 Anammox 细菌的属为 Candidatus Brocadia。在 5 个阶段中, 其平均丰度分别为 54.9%± 1.9%, 56.0%±8.1%, 38.7%±7.0%, 41.2%和 54.0%± 3.1%。Candidatus Brocadia 的丰度总体上呈现先下降、后上升的变化趋势, 说明丙酸钠浓度低于 50 mg/L 时, 对 Candidatus Brocadia 的生长无明显影响。少量小分子有机物的添加会激发 Anammox 细菌的有机营养代谢特性[17], Anammox 细菌能够以硝酸盐或亚硝酸盐为电子受体, 同时进行丙酸盐氧化和 Anammox 过程, 最终将丙酸盐转化为 CO2[14]。当丙酸钠浓度高于 100mg/L 时, 对 Candidatus Bro-cadia 的生长起抑制作用。在阶段 III 中, Candidatus Brocadia 的丰度明显下降, 这是由于丙酸钠可以作为电子供体, 导致其他细菌与 Anammox 细菌竞争反应底物, 抑制 Anammox 细菌的生长, 出水中硝酸盐的浓度降低, 因此反应器的总氮去除率变化不大。此后, 当进水中丙酸盐浓度再降低至 0mg/L时, Candidatus Brocadia 的丰度可以恢复到原有水平。目前, 已经发现 5 个属的 Anammox 细菌, 其中Candidatus Kuenenia, Candidatus Brocadia, Candida-tus Anammoxoglobus 和 Candidatus Jettenia 常存在于废水污泥中, Candidatus Scalindua 通常存在于海洋环境中[45–46]。它们具有不同的生理特性, 在Anammox 富集培养物中, 通常只有一个属能够竞争成为优势种[47]。在阶段 V 中, Candidatus Bro-cadia 的丰度恢复到原有水平, 说明有机碳对Anam-mox 细菌的抑制作用是可逆的。在高浓度有机碳条件下, Anammox 活性会受到抑制, 但有机碳浓度降低后, Anammox 细菌丰度可以迅速恢复[48]。
除 Anammox 细菌外, 体系中具有氮代谢功能的微生物还包括反硝化菌、氨氧化细菌(ammonia oxidizing bacteria, AOB)和亚硝酸盐氧化菌(nitrite-oxidizing bacteria, NOB)。图 5 显示不同氮代谢微生物在 5 个阶段的丰度变化, 反应器中 Denitratisoma属是一种异养反硝化菌, 具有完整的反硝化代谢途径, 可以将 NO3−-N 转化为 N2[49], 在阶段 IV 中丰度最高, 为 1.21%。由于反硝化菌对 NO3−-N 的转化作用, 导致阶段 IV 出水中 NO3−-N 浓度降低。在阶段V 中, 由于进水中不添加有机碳源, 反硝化菌的丰度降低为 0.53%。Anammox 细菌与反硝化细菌的丰度呈现相反的变化趋势, 表明在反应器中 Candidatus Brocadia 与 Denitratisoma 存在竞争关系。在阶段 III中, 由于反硝化细菌的生长速度较快, Candidatus Brocadia 的平均丰度降低为 38.7%±7.0%, Denitratis-oma的平均丰度增加为 1.1%, 在体系中 Anammox作用和反硝化的协同作用使反应器的总氮去除率达到 88.5%±3.2%, 超过未添加丙酸盐时反应器的总氮去除率。AOB (Nitrosomonas)将部分 NH4+-N 氧化为 NO2−-N, 作为 Anammox 细菌的反应底物被消耗, 还可以消耗培养基中微量的溶解氧, 为 Anammox细菌的生存创造更好的生态位。在 Anammox 颗粒污泥中, AOB 通常分布于颗粒表面, 将 Anammox 细菌包裹在颗粒内部, 为 Anammox 细菌提供厌氧的生存条件[50], 因此 Anammox 颗粒污泥对氧气的存在具有一定的耐受性。反应器中 AOB 的丰度低于1%, 表明微生物处于比较严格的厌氧环境。与NOB 相比, AOB 对氧的半饱和常数更低, 对氧的利用速度更快[51], 溶解氧成为 NOB 生长的限制条件, 因此在反应器中 NOB (Nitrospira)的丰度极低(低于0.1%), 防止 NOB 与 Anammox 细菌竞争 NO2−-N。
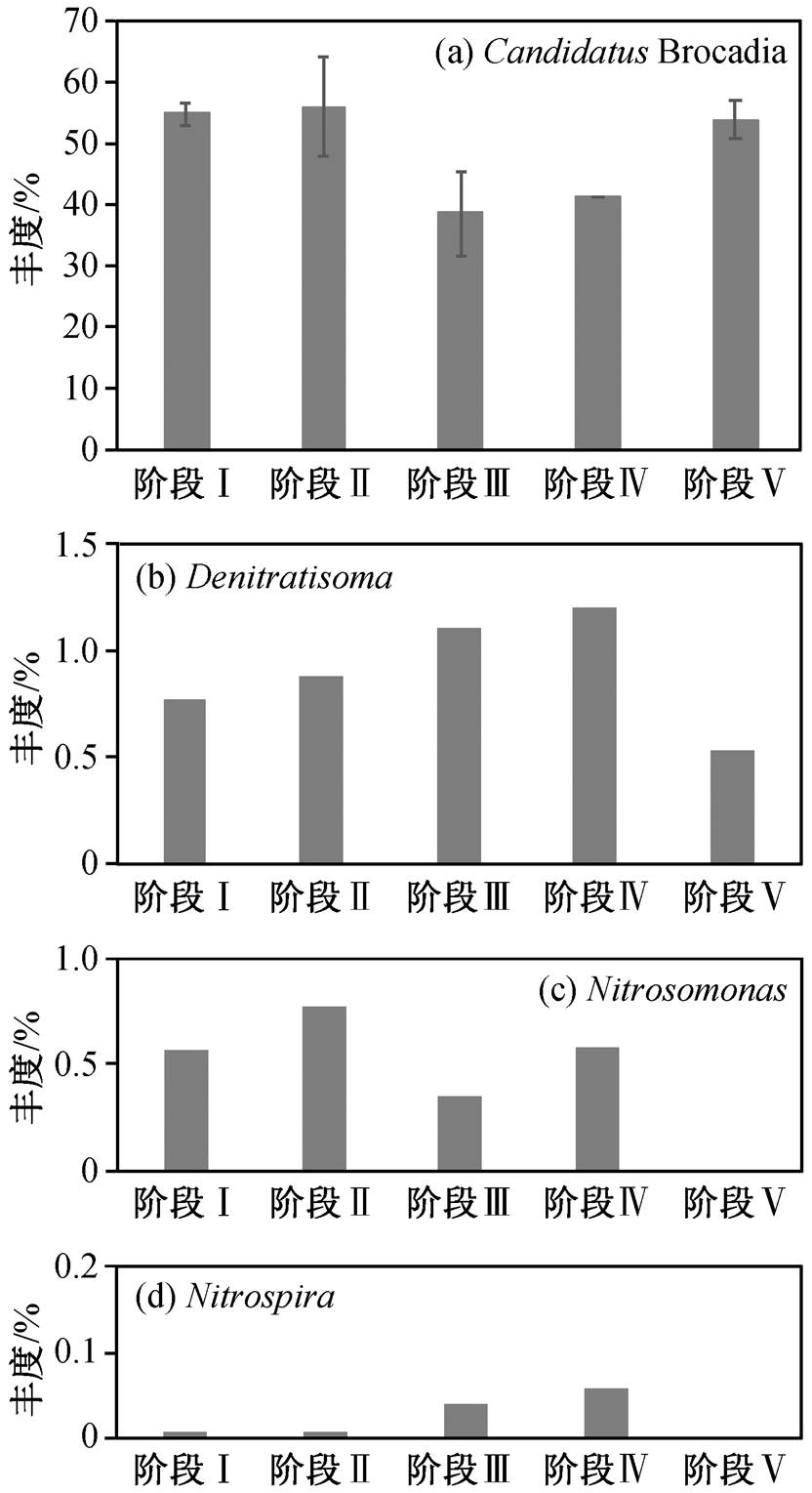
图5 氮代谢相关微生物丰度变化
Fig. 5 Abundance of nitrogen metabolic bacteria
为了研究反应器中群落功能的变化, 使用FAPROTAX 软件对各微生物进行功能注释。结果表明, 19.1%的 OTU 至少可以分配到一个功能组。图 6 显示群落中不同代谢功能组的丰度变化, 与氮代谢相关的功能组丰度较高, 包括硝化作用、氨氧化作用、亚硝酸盐氧化作用、硝酸盐还原作用和反硝化作用等。其中, Anammox、氮呼吸和亚硝酸盐呼吸在体系中丰度最高, 表明 Candidatus Brocadia作为反应器中的关键物种, 在除氮作用中占主导地位[40]。
选择 3 个时间点的样品 D451, D539 和 D597, 分别代表阶段 I(未添加丙酸盐)、阶段 IV(丙酸盐浓度为 200mg/L)和阶段 V (恢复时期)的种群结构, 构建属水平微生物与样本的二分网络图(图 7)。在这 3个阶段中, 有 10 个属的微生物始终存在, Candidatus Brocadia 的丰度最高, 在阶段 IV 中 Anammox 活性被抑制, 丰度下降, 待抑制作用解除后, 丰度恢复到原有水平。Ignavibacterium 是体系中丰度仅次于Candidatus Brocadia 的属, 属于一种厌氧发酵细菌,可以还原由 Anammox 细菌产生的硝酸盐[35]。在阶段 III 中, Ignavibacterium 的丰度最高(6.9%±1.55%), 与 Candidatus Brocadia 具有协同作用。阶段 I 和阶段 IV 共有的属有 8 种, 阶段 V 与阶段 IV 共有的属为 Paludbaculum, 与阶段 I 共有的属为 UTBOD1, 表明恢复时期的微生物构成与之前相比有较大的改变。在 3 个阶段中, 分别有 6 种, 7 种和 9 种独有的属。有研究者在两个 UASB 反应器中分别加入 40 mg/L 乙酸盐(R1)和 30mg/L 丙酸盐(R2), 发现与未添加有机碳(R0)相比, R1 与 R2 的微生物丰富度和多样性均增加, 且 R1 与 R0 共有的 OTU 数目大于R2 与 R0 共有的 OTU 数目[13], 说明丙酸盐的添加会使微生物的组成发生较大的改变, 本文研究结论与之一致。总之, 丙酸盐对 Candidatus Brocadia的抑制作用是可逆的, 在降低进水中有机碳浓度后, 反应器的除氮性能以及 Candidatus Brocadia 的丰度可以恢复到原有水平, 但是群落的微生物组成有较大的变化, 且物种丰富度降低。
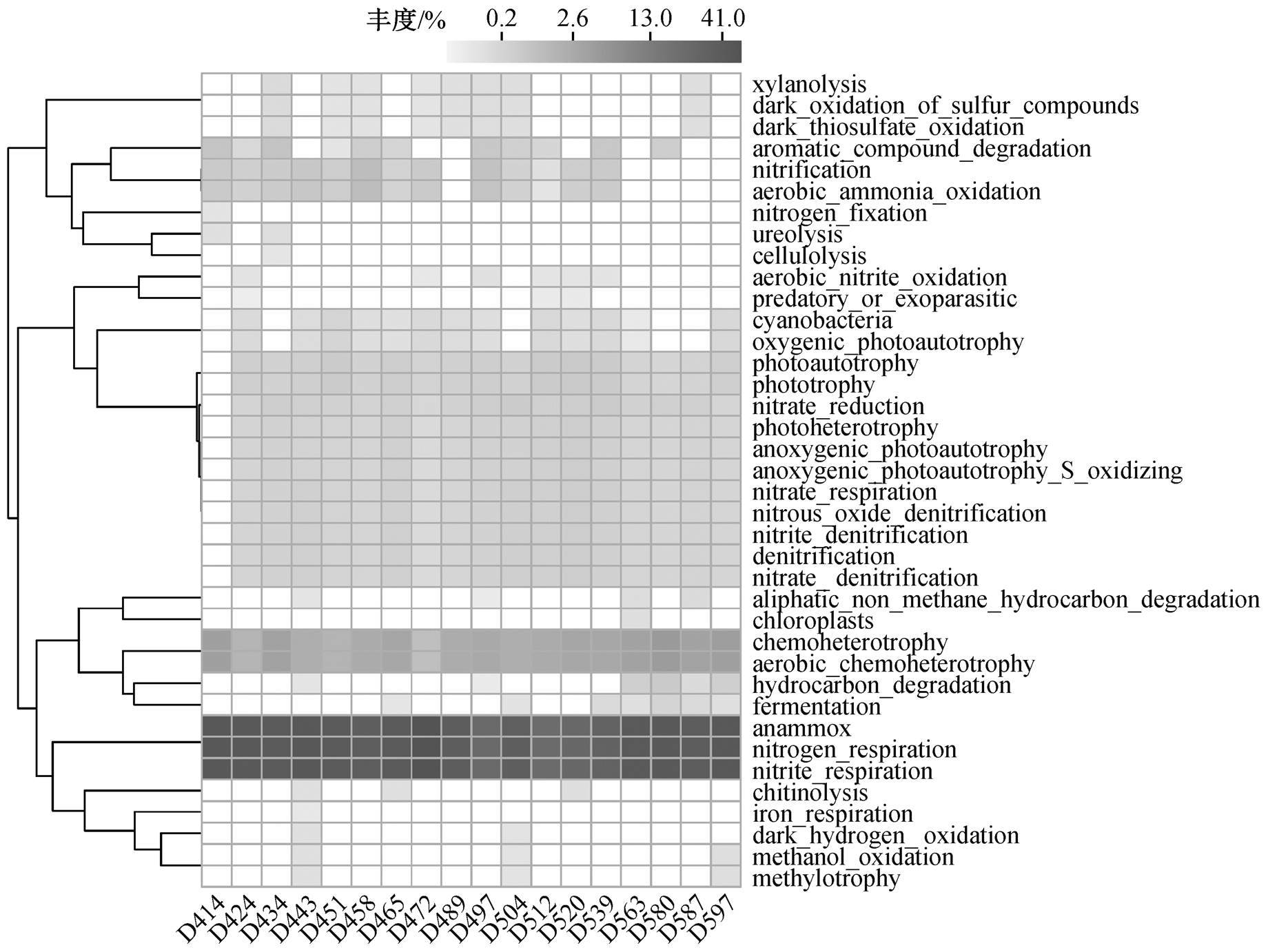
图6 微生物群落功能分组预测
Fig. 6 Functional groups predicted by FAPROTAX
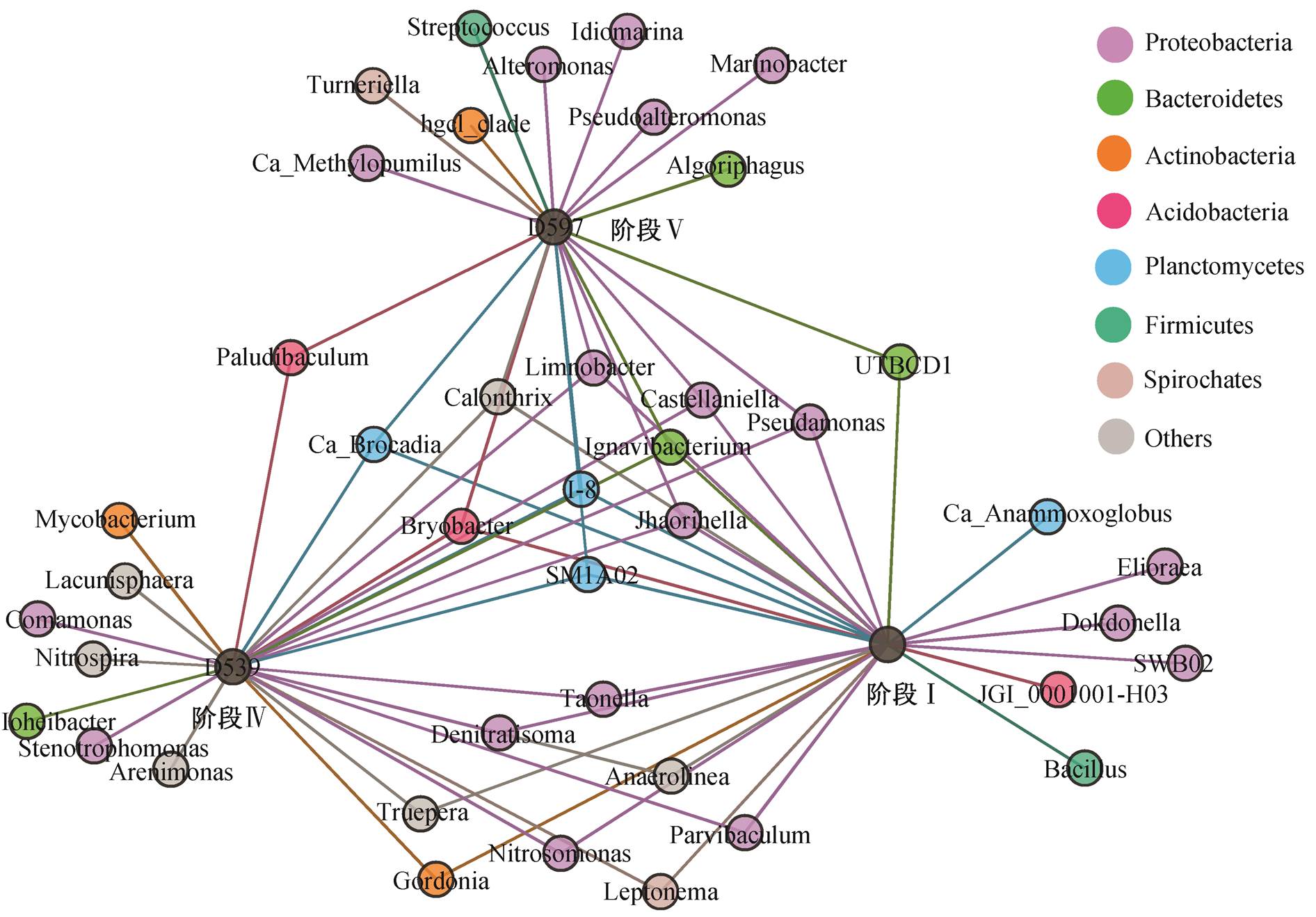
图7 3个阶段共有属水平微生物的二分网络分析
Fig. 7 Bipartite network analysis of the shared genera between three phases
在 Anammox 反应器中, 主要的脱氮过程由Candidatus Brocadia 完成, 其丰度最高达 66.8%。当丙酸钠浓度为 100 mg/L 时, Anammox 活性不被抑制, 体系中绿弯菌门等异养细菌的生长可以去除COD, 实现碳氮的同步去除, 总氮去除率达到91.9%; 当丙酸盐浓度为 200mg/L 时, 反硝化菌丰度增加, 但丙酸盐对 Candidatus Brocadia 的抑制作用导致反应器的总氮去除率下降。在解除有机碳抑制作用后, 反应器的除氮效能恢复, 但微生物的多样性下降, 属水平微生物组成有较大变化。因此, 在实际应用中, 应控制进水有机碳的浓度, 维持Anammox 与反硝化的平衡, 达到最优的氮去除率。
参考文献
[1] Kuenen J G. Anammox bacteria: from discovery to application. Nat Rev Microbiol, 2008, 6(4): 320–326
[2] Strous M, Fuerst J A, Kramer E H M, et al. Missing lithotroph identified as new planctomycete. Nature, 1999, 400: 446–449
[3] Jetten M, Cirpus I, Kartal B, et al. 1994–2004: 10 years of research on the anaerobic oxidation of am-monium. London: Portland Press Limited, 2005
[4] Ruscalleda M, Lopez H, Ganigue R, et al. Hetero-trophic denitrification on granular anammox SBR trea-ting urban landfill leachate. Water Sci Technol, 2008, 58(9): 1749–1755
[5] Furukawa K, Inatomi Y, Qiao S, et al. Innovative treatment system for digester liquor using anammox process. Bioresource Technology, 2009, 100(22): 5437–5443
[6] Lackner S, Gilbert E M, Vlaeminck S E, et al. Full-scale partial nitritation/anammox experiences — an application survey. Water Res, 2014, 55: 292–303
[7] Wang Z, Peng Y, Miao L, et al. Continuous-flow combined process of nitritation and ANAMMOX for treatment of landfill leachate. Bioresour Technol, 2016, 214: 514–519
[8] Ma B, Wang S, Cao S, et al. Biological nitrogen removal from sewage via anammox: recent advances. Bioresour Technol, 2016, 200: 981–990
[9] Bagchi S, Biswas R, Nandy T. Autotrophic ammonia removal processes: ecology to technology. Critical Reviews in Environmental Science and Technology, 2012, 42(13): 1353–1418
[10] Wang Y M, Gong B Z, Lin Z Y, et al. Robustness and microbial consortia succession of simultaneous partial nitrification, ANAMMOX and denitrification (SNAD) process for mature landfill leachate treatment under low temperature. Biochemical Engineering Journal, 2018, 132: 112–121
[11] Wang Y, Lin Z, He L, et al. Simultaneous partial ni-trification, anammox and denitrification (SNAD) pro-cess for nitrogen and refractory organic compounds removal from mature landfill leachate: performance and metagenome-based microbial ecology. Bioresour Technol, 2019, 294: 122166
[12] Ni S Q, Ni J Y, Hu D L, et al. Effect of organic matter on the performance of granular anammox process. Bioresour Technol, 2012, 110: 701–705
[13] Liang Y, Li D, Zhang X, et al. Nitrate removal by organotrophic anaerobic ammonium oxidizing bacte-ria with C2/C3 fatty acid in upflow anaerobic sludge blanket reactors. Bioresour Technol, 2015, 193: 408–414
[14] Guven D, Dapena A, Kartal B, et al. Propionate oxidation by and methanol inhibition of anaerobic ammonium-oxidizing bacteria. Appl Environ Micro-biol, 2005, 71(2): 1066–1071
[15] Isaka K, Suwa Y, Kimura Y, et al. Anaerobic am-monium oxidation (anammox) irreversibly inhibited by methanol. Appl Microbiol Biotechnol, 2008, 81(2): 379–385
[16] Jensen M M, Thamdrup B, Dalsgaard T. Effects of specific inhibitors on anammox and denitrification in marine sediments. Appl Environ Microbiol, 2007, 73 (10): 3151–3158
[17] 魏凡凯, 王昕竹, 吴鹏, 等. 碳源对厌氧氨氧化菌活性影响的研究进展. 工业水处理, 2019, 39(6): 7–12
[18] Feng Y, Zhao Y, Guo Y, et al. Microbial transcript and metabolome analysis uncover discrepant metabolic pathways in autotrophic and mixotrophic anammox consortia. Water Res, 2018, 128: 402–411
[19] Tao Y, Huang X, Gao D, et al. NanoSIMS reveals unusual enrichment of acetate and propionate by an anammox consortium dominated by Jettenia asiatica. Water Res, 2019, 159: 223–232
[20] Zhu W, Zhang P, Dong H, et al. Effect of carbon source on nitrogen removal in anaerobic ammonium oxidation (anammox) process. J Biosci Bioeng, 2017, 123(4): 497–504
[21] 张少辉, 李聪. 有机碳源条件下的厌氧氨氧化研究. 武汉理工大学学报, 2011, 33(3): 130–135
[22] Van de Graaf A A, de Bruijn P, Robertson L A, et al. Autotrophic growth of anaerobic ammonium-oxidi-zing micro-organisms in a fluidized bed reactor. Mic-robiology, 1996, 142(8): 2187–2196
[23] Greenberd A E, Clesceri L S, Eaton A D. Standard methods for the examination of water and wastewater. 18th ed. Alexandria: APHA, 2012
[24] Chen S, Zhou Y, Chen Y, et al. Fastp: an ultra-fast all-in-one FASTQ preprocessor. Bioinformatics, 2018, 34(17): 884–890
[25] Bolger A M, Lohse M, Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data. Bioin-formatics, 2014, 30(15): 2114–2120
[26] Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data. Nat Methods, 2010, 7(5): 335–336
[27] Pruesse E, Quast C, Knittel K, et al. SILVA: a com-prehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB. Nucleic Acids Res, 2007, 35(21): 7188–7196
[28] Louca S, Parfrey L W, Doebeli M. Decoupling func-tion and taxonomy in the global ocean microbiome. Science, 2016, 353: 1272–1277
[29] Bastian M, Heymann S, Jacomy M. Gephi: An open source software for exploring and manipulating net-works // Proceedings of the Third International Con-ference on Weblogs and Social Media. San Jose, 2009: 361–362
[30] Huang X L, Gao D W, Tao Y, et al. C2/C3 fatty acid stress on anammox consortia dominated by CandidatusJettenia asiatica. Chemical Engineering Journal, 2014, 253: 402–407
[31] Strous M, Heijnen J, Kuenen J G, et al. The sequen-cing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing micro-organisms. Applied Microbiology and Biotechnology, 1998, 50(5): 589–596
[32] Rothrock M J Jr, Vanotti M B, Szogi A A, et al. Long-term preservation of anammox bacteria. Appl Micro-biol Biotechnol, 2011, 92(1): 147–157
[33] Zhang Y, Niu Q, Ma H, et al. Long-term operation performance and variation of substrate tolerance ability in an anammox attached film expanded bed (AAFEB) reactor. Bioresour Technol, 2016, 211: 31–40
[34] Li Z, Peng Y, Gao H. Enhanced long-term advanced denitrogenation from nitrate wastewater by anammox consortia: Dissimilatory nitrate reduction to ammo-nium (DNRA) coupling with anammox in an upflow biofilter reactor equipped with EDTA-2Na/Fe(II) ratio and pH control. Bioresour Technol, 2020, 305: 123083
[35] Gonzalez-Gil G, Sougrat R, Behzad A R, et al. Mic-robial community composition and ultrastructure of granules from a full-scale anammox reactor. Microb Ecol, 2015, 70(1): 118–131
[36] Li X R, Du B, Fu H X, et al. The bacterial diversity in an anaerobic ammonium-oxidizing (anammox) reactor community. Syst Appl Microbiol, 2009, 32(4): 278–289
[37] Gonzalez-Martinez A, Rodriguez-Sanchez A, Munoz-Palazon B, et al. Microbial community analysis of a full-scale DEMON bioreactor. Bioprocess Biosyst Eng, 2015, 38(3): 499–508
[38] Lawson C E, Wu S, Bhattacharjee A S, et al. Meta-bolic network analysis reveals microbial community interactions in anammox granules. Nat Commun, 2017, 8(1): 15416
[39] Xiao Y, Zeng G M, Yang Z H, et al. Coexistence of nitrifiers, denitrifiers and Anammox bacteria in a sequencing batch biofilm reactor as revealed by PCR-DGGE. J Appl Microbiol, 2009, 106(2): 496–505
[40] Wu Y, Wang Y, de Costa Y G, et al. The co-existence of anammox genera in an expanded granular sludge bed reactor with biomass carriers for nitrogen removal. Appl Microbiol Biotechnol, 2019, 103(3): 1231–1242
[41] Keren R, Lawrence J E, Zhuang W, et al. Increased replication of dissimilatory nitrate-reducing bacteria leads to decreased anammox bioreactor performance. Microbiome, 2020, 8: 7
[42] Gao D, Liu L, Liang H, et al. Aerobic granular sludge: characterization, mechanism of granulation and application to wastewater treatment. Crit Rev Biotechnol, 2011, 31(2): 137–152
[43] Guo F, Zhang T. Profiling bulking and foaming bac-teria in activated sludge by high throughput sequen-cing. Water Res, 2012, 46(8): 2772–2782
[44] Pijuan M, Ribera-Guardia A, Balcazar J L, et al. Effect of COD on mainstream anammox: evaluation of process performance, granule morphology and nitrous oxide production. Sci Total Environ, 2020, 712: 136372
[45] Kartal B, de Almeida N M, Maalcke W J, et al. How to make a living from anaerobic ammonium oxidation. FEMS Microbiol Rev, 2013, 37(3): 428–461
[46] Oshiki M, Satoh H, Okabe S. Ecology and physiology of anaerobic ammonium oxidizing bacteria. Environ Microbiol, 2016, 18(9): 2784–2796
[47] Bhattacharjee A S, Wu S, Lawson C E, et al. Whole-community metagenomics in two different anammox configurations: process performance and community structure. Environ Sci Technol, 2017, 51(8): 4317–4327
[48] Du R, Peng Y, Cao S, et al. Advanced nitrogen remo-val with simultaneous Anammox and denitrification in sequencing batch reactor. Bioresour Technol, 2014, 162: 316–322
[49] Jia S, Han H, Zhuang H, et al. The pollutants removal and bacterial community dynamics relationship within a full-scale British Gas/Lurgi coal gasification waste-water treatment using a novel system. Bioresour Technol, 2016, 200: 103–110
[50] Speth D R, in't Zandt M H, Guerrero-Cruz S, et al. Genome-based microbial ecology of anammox gra-nules in a full-scale wastewater treatment system. Nat Commun, 2016, 7: 11172
[51] Nozhevnikova A N, Simankova M V, Litti Y V. Application of the microbial process of anaerobic ammonium oxidation (ANAMMOX) in biotechnolo-gical wastewater treatment. Applied Biochemistry and Microbiology, 2012, 48(8): 667–684
Influence of Propionate on Performance and Community Structure of an Anammox Reactor
Abstract In order to study the long-term influence of organic carbon on performance and community structure of an Anammox reactor, propionate was amended stepwise into an enriched Anammox reactor to investigate the dynamic change of the structure and function of the community. The results suggested that nitrogen removal process was mainly achieved by Candidatus Brocadia. Carbon and nitrogen were simultaneously removed by the growth of heterotrophic bacteria under 100 mg/L propionate, while total nitrogen removal efficiency reached 91.9%. A suppression of growth of Candidatus Brocadia and a significant reduction of total nitrogen removal were observed at the present of 200 mg/L propionate. The relative abundance of Candidatus Brocadia and total nitrogen removal efficiency decreased to 41.2% and 78.8% respectively. After propionate concentration recovered to 0 mg/L, the nitrogen removal efficiency of the reactor improved to 86.8% and the abundance of Candidatus Brocadia was recovered to 54.0%. However, the community diversity decreased and the microbial composition at genus level changed a lot.
Key words anaerobic ammonium oxidation; propionate; nitrogen removal rate; community structure; Candidatus Brocadia
doi: 10.13209/j.0479-8023.2021.031
国家自然科学基金(51709005)资助
收稿日期: 2020-03-26;
修回日期: 2020-04-12