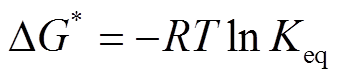 ,
,摘要 对 PKUAC-SCTE542 藻蓝蛋白的耐热性进行测试, 探究其热稳定性能。同时, 在不同光周期和不同光质光源组合条件下培养嗜热蓝细菌 PKUAC-SCTE542, 研究其生长情况和藻蓝蛋白含量, 探索适用于藻蓝蛋白生产的光照条件。选取 30°C, 40°C, 50°C, 60°C, 65°C, 70°C, 80°C, 90°C 为实验组, 25°C 和 4°C 为对照组, 放置时间设为 5 小时和 14 天, 用紫外分光光度计测定藻蓝蛋白全光谱图, 考察不同温度和放置时间对藻蓝蛋白的影响, 再将 E542-PC 的 α 链和 β 链与蛋白质晶体结构数据库中藻蓝蛋白进行比对, 深入了解其耐热机制。分别在光波长为白光(400~800nm)、红光(654nm)、绿光(511nm)和蓝光(454nm), 光周期为 8L/16D, 12L/12D 和 16L/8D 的条件下培养蓝细菌, 测定其生物质干重以及藻蓝蛋白含量。结果表明, PKUAC-SCTE542 藻蓝蛋白在 65°C 环境可以保持稳定, 60°C 放置 14 天仍表现出 60%的热稳定性。光质为红光、光周期为 16L/8D 的条件下, 藻蓝蛋白绝对产量最大; 光质为红光、光周期为 8L/16D 时, 藻蓝蛋白产率最高。实验结果表明 PKUAC-SCTE542 藻蓝蛋白的耐热性能较好, 经过光照条件筛选, 藻蓝蛋白产量可提高近 100 mg/gDCW。
关键词 嗜热蓝细菌; 藻蓝蛋白; 热稳定性; 光照条件
蓝细菌(Cyanobacteria)又称蓝藻, 属于蓝藻门(Cyanophyta), 作为一种光合自养原核生物, 可将光能和 CO2 直接转化为生物基热稳定性物质。藻胆蛋白是蓝细菌细胞内一组具有发色团的水溶性蛋白, 负责光合作用过程中的光捕获, 并将能量逐级传递给叶绿素。
蓝细菌中藻胆蛋白含量可以达到细胞总蛋白的50%[1]。根据其吸收波长最大值及色基结构, 可分为四大类: 别藻蓝蛋白(λmax = 650~660nm)、藻蓝蛋白(λmax = 610~625nm)、藻红蛋白(λmax = 490~570nm)和藻红蓝蛋白(λmax = 560~600nm)[2]。其中, 藻蓝蛋白(C-PC)是一种由 α 亚基和 β 亚基构成的六聚体[3], 在实验中表现出抗氧化性[4–5]、抗癌性[6–7]和抗炎性[8], 具有优异的临床应用潜力。作为一种天然色素分子, 藻蓝蛋白已被用作某些食品和饮料中蓝色的来源, 但因其蓝色不稳定、不宜受热和对酸碱度要求高等问题, 无法用于需要高温处理的食品。目前主要通过额外添加防腐剂或低浓度的糖, 来提高蛋白质稳定性[9]。耐热性成为藻蓝蛋白市场开发的阻碍因子之一。因此, 开发新型热稳定藻蓝蛋白是拓宽其食品工业市场的首要研究方向。嗜热蓝细菌作为一种最适宜生长温度高于 45ºC 的微生物, 其胞内酶和蛋白质在高温时非常稳定, 因此可能是热稳定性藻蓝蛋白的一个潜在来源。天然藻蓝蛋白的产量是其开发应用的另一阻碍因子。藻蓝蛋白是光系统色素蛋白, 而光合细菌的光合作用过程受光质和光周期等条件影响, 不同色素的积累会因光质而改变[10], 光照时间过长会减少色素的合成[11]。
本文主要选取嗜热蓝细菌 PKUAC-SCTE542 为研究对象, 对 PKUAC-SCTE542 藻蓝蛋白的耐温性进行考察, 为其潜在的市场价值提供科学依据; 同时探索光质和光周期对其藻蓝蛋白积累情况的影响, 为利用嗜热蓝细菌生产藻蓝蛋白的光照条件提供优化策略, 以期探讨开发嗜热蓝细菌、提取藻蓝蛋白的可行性。
实验所用菌株 PKUAC-SCTE542 (简称 E542)分离于四川甘孜州温泉带, 保存于北京大学环境与能源学院微藻藻种资源库[12]。实验室常规培养嗜热蓝细菌选用 BG-11 培养基[13]。1×105Pa 高温高压灭菌, 固体培养基的配制另加琼脂粉 12 g/L。
用无菌环挑取 BG-11 平板菌株, 接种到装有 30 mL 新鲜 BG-11 培养基的锥形瓶(100mL)中, 置于45ºC 摇床式光照培养箱中进行培养, 转速设定为 120 r/min, 光暗比设定为 16/8 小时(光周期L/D), 白炽灯照明, 光照强度为 70μmol/(m2∙s), 培养至对数生长期(3~5 天); 用 10%的种子液+90%的 BG-11培养基起始, 连续培养 14 天。
用已称重的 50mL 离心管收集嗜热蓝细菌生长液, 4000r/min 条件下离心 10 分钟, 倒掉上清液, −80°C 条件下预冷 1 小时, 置于冷冻干燥机中干燥24 小时, 测定嗜热蓝细菌生物质干重量。
使用 Bennett 等[14]的方法检测藻蓝蛋白含量。取 50mg 冻干后的藻粉, 用 15 mL 的 0.05mol/L 磷酸盐缓冲液(pH=6.8, 含 Na2HPO4 和 KH2PO4)将藻粉重悬。将混合液放置于−20ºC 冷冻 4~5 小时, 然后在 9ºC±1ºC 的水浴中慢慢解冻。将溶解的样品溶液进行超声破碎(将装有样品藻液的离心管放入冰水混合物中, 用超声波均化器将样品处理 90 秒, 输出 9 秒, 占空比为 65%)。将得到的粗提物以 10000 r/min (4ºC, 10 分钟)的速度离心去除细胞碎片, 并收集上清液(实验过程中将样品保存在冰块上并置于黑暗中, 避免提取过程中色素降解)。利用分光光度计, 分别测量上清液在 615nm 和 652nm 波长处的吸光度 A, 并根据下式计算藻蓝蛋白(phycocyanin, C-PC)的含量:
C-PC (mg/mL) = (A615 −0.474A652)/5.34。
1.5.1 温度
以嗜热蓝细菌 E542 藻蓝蛋白(E542-PC)溶液OD615=1.0 为初始浓度, 开展不同温度的耐受实验。选取 30°C, 40°C, 50°C, 60°C, 65°C, 70°C, 80°C, 90°C 为实验组, 25°C 和 4°C 为对照组, 放置时间设为 5 小时。采用紫外分光光度计测定藻蓝蛋白全光谱图, 考察不同温度对藻蓝蛋白的影响, 每组实验设置 3 个平行样。
1.5.2放置时间
设置上述相同温度梯度及对照组, 将放置时间延长至 14 天。采用紫外分光光度计测定藻蓝蛋白全光谱图, 考察延长放置时间对藻蓝蛋白的影响, 每组实验设置 3 个平行样。
1.5.3种间对照
选取 Geb 公司提供的 SP-PC 配制 OD615=1.0 的溶液, 开展与 E542-PC 一致的实验(包括温度和放置时间), 作为种间对照组。采用紫外分光光度计测定藻蓝蛋白全光谱图, 每组实验设置 3 个平行样。
基于上述实验数据, 使用非线性拟合 Sigmoid函数, 获取变性过程中热力学参数。藻蓝蛋白最大吸收峰达到 50%的温度(T50%)采用热稳定实验中 S型曲线计算, 焓(ΔH*)和熵(ΔS*)值可以利用 van’t Hoff plots演算, 公式如下:
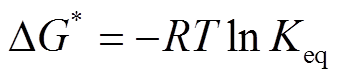 ,
,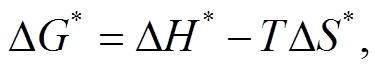
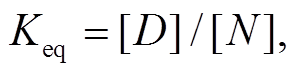
式中, ΔG*为自由能; [D]为变性蛋白的浓度值, [N]为天然蛋白的浓度值, 浓度单位均为 mg/mL。
由热稳定实验数据, 利用 sigmoidal 函数拟合, 获得线性公式:
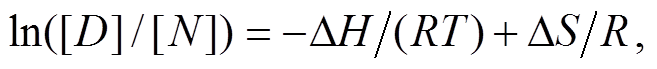
通过斜率和截距分别计算焓值和熵值。
1.5.4多序列比对
主要通过将 α 链和 β 链与蛋白质晶体结构数据库(PDB)中嗜热和嗜中温藻蓝蛋白进行比对, 选择被替换的氨基酸残基, 分析其稳定性机制。主要执行软件为 Geneious 9.1.5 (Biomatters, 澳大利亚), 选择默认的 Geneious 比对算法和 Blosum 62 矩阵。
根据预实验结果, 70μmol/(m2∙s)为最适宜 E542生长的光照强度。弱光下 E542-PC 比例上升, 但生物质很低, 总产量不高; 强光则使 E542 无法生长。因此, 本文选择光周期和光质两种因子进行优化, 实验方法如下。
1.6.1 光周期
采用 1.3 节描述的 E542 种子液培养条件(选择相应的光周期), 待嗜热蓝细菌进入生长对数期时, 从种子液锥形瓶(100mL)中吸取 10mL, 转移至装有 90mL 新鲜 BG-11+0.1M NaHCO3 培养基的锥形瓶(250mL)中, 光周期为 8L/16D, 12L/12D 和 16L/ 8D, 培养周期为 14 天, 利用 1.4 节描述的方法提取并计算藻蓝蛋白含量, 每组实验设计 3 个平行样。
1.6.2 光质
采用 1.3 节描述的 E542 种子液培养条件(选取相应光质作为光源), 待嗜热蓝细菌进入生长对数期时, 从种子液锥形瓶(100mL)中吸取 10mL , 转移至装有 90mL 新鲜 BG-11+0.1M NaHCO3 培养基的锥形瓶(250mL)中, 光波长设置为白光(400~800 nm)、红光(654nm)、绿光(511nm)和蓝光(454nm), 培养周期为 14 天, 利用 1.4 节描述的方法提取并计算藻蓝蛋白含量, 每组实验设计3个平行样。
本文在 4°C~90°C 之间设置 10 个温度点, 每个温度点保持 5 小时, 考察温度变化对 E542-PC 稳定性的影响。如图 1(a)所示, 藻蓝蛋白在 615nm 处有最大吸收峰, 故以此处吸光度作为分析其热稳定性的参考值。可以看出, 70°C 是 E542-PC 热稳定性发生明显变化的临界温度。70°C 以下, 吸光度曲线在615nm处均有明显的峰值; 70°C 以上, 吸光度曲线在 615nm 处没有明显吸收峰。因此, E542-PC 在低于 70°C 时能够维持热稳定性, 超出这一温度则可能破坏藻蓝蛋白的结构。
通过对比放置 5 小时与 14 天的嗜热蓝细菌E542-PC 的相对吸光度(%), 同时将相同放置条件下的螺旋藻 SP-PC 作为对照, 进一步探究放置时间对嗜热蓝细菌 E542-PC 耐热性的影响, 结果如图1(b)所示。对比不同温度下两个放置时长的相对吸光度, 发现 E542-PC 热稳定性因放置时间延长而降低。温度低于 30°C 时, 放置时间的延长没有显著地影响其热稳定性, 吸光度值变化小于 10%; 当温度达到 60°C 时, 放置时间延长会使其热稳定性大幅度降低, 吸光度值变化达 45%。放置时间为 5 小时的SP-PC 在温度低于 30°C 时与 E542-PC 具有相似的变化趋势, 但达到 40°C 后, 其热稳定性均低于60%。放置 14 天后, SP-PC 在高于 30°C 的环境中基本上失活。从 Thermosynechococcs vulcanus 和 Ther-mosynechococcus elongatus TA-1 分离的藻蓝蛋白[15]与本研究中 E542-PC 的稳定性具有相似的变化趋势, 但是 E542-PC 在 50°C 孵育 5 小时可以保持 90%以上的热稳定性, 而 TA-1-PC 在 50°C 孵育 5 小时仅保持 80%以上的热稳定性[15]。
放置时间延长至 14 天后, E542-PC 的热稳定性下降。随温度升高, 这种趋势更加显著。相较于SP-PC 短期孵育 40°C 和长期孵育 30°C 热稳定性降低的情况, E542-PC 在短期和长期孵育两个实验组都表现出更高的热稳定性。
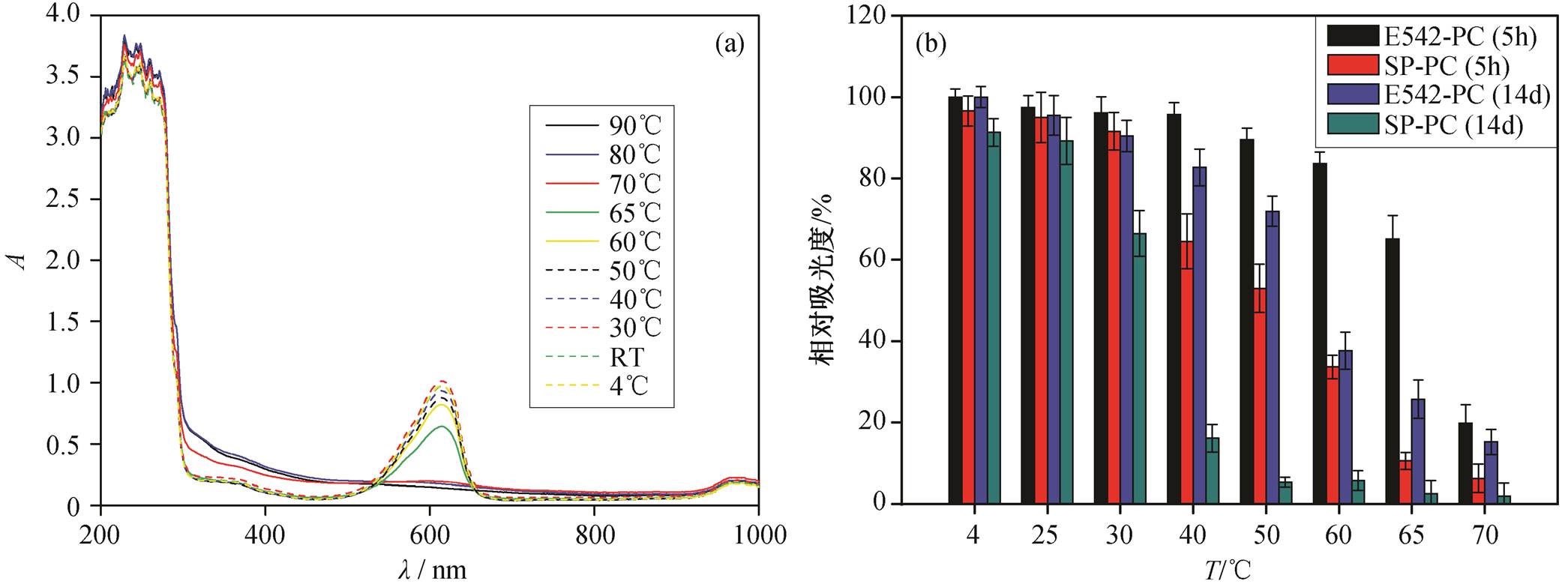
(a)不同温度下E542-PC孵育5小时紫外/可见光谱吸光度; (b)延长放置时间后E542和螺旋藻藻蓝蛋白的稳定性
图1 E542-PC稳定性特征
Fig. 1 Stability characteristics of E542-PC
利用 sigmoidal 函数, 拟合不同温度点放置 5 小时的 E542-PC 和 SP-PC 的相对吸光度, 得出 E542-PC 的 T50%= 66.92°C (表 1), 显著高于分离于热带海洋的 RS9907 M16.1 WH7803的T50% (50°C)[16],但低于 Cyanidioschyzon merolae 的 T50% (83°C)[17](后者孵育时间仅为 30 分钟, 而 E542-PC 为 5 小时); SP-PC的 T50% (51°C)明显低于 E542-PC。比较两株菌株的藻蓝蛋白在 55°C 下的自由能可知, SP-PC 的热变性是一个自发过程, 而 E542-PC 却不是如此, 这与已报道的螺旋藻藻蓝蛋白稳定性研究结果[18–19]相一致, 进一步表明嗜热蓝细菌 E542-PC 的热稳定性具有显著优势。
为了更深入地分析 E542 的稳定性机制, 选择 9株蓝细菌进行多序列比对, 菌株名称及比对结果如图 2 所示。E542-PC 与 Thermosynechococcus vul- canus, Thermosynechococcus elongatus 以及 Synech-ococcus sp. PCC 6715 的 α 亚基同源性超过97%, 其中, Thermosynechococcus elongatus 与 E542-PC 的 β亚基同源性在 97%以上。序列的高相似性表明, E542-PC 与其蛋白晶体结构相似度高。对结果做进一步的比对, 发现嗜温蓝细菌和嗜热蓝细菌的藻蓝蛋白氨基酸残基具有显著差异。藻蓝蛋白 α亚基氨基酸残基存在特定的取代形式, 如在嗜热聚球藻属中, 精氨酸取代了原本嗜温蓝细菌中的谷氨酰胺, 形成谷氨酰胺–藻胆素键, 使其藻胆蛋白更稳定。
表1 E542和螺旋藻藻蓝蛋白孵育5小时蛋白失活热力学和动力学参数
Table 1 Thermodynamic and kinetic parameters of inactivation of purified E542-PC and Spirulina C-PC calculated for 5-hour incubation
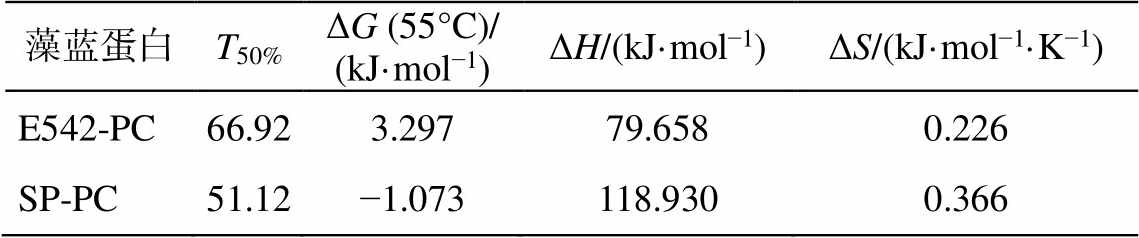
藻蓝蛋白T50%ΔG (55°C)/ (kJ·mol−1)ΔH/(kJ·mol−1)ΔS/(kJ·mol−1·K−1) E542-PC66.923.29779.6580.226 SP-PC51.12−1.073118.9300.366
表 2 为不同光照条件下 E542 生物质干重及藻蓝蛋白含量对比。白光条件下各实验组的生物质干重与光暗比正相关, 增加光照时间, 可以促进嗜热蓝细菌 E542 的生物量积累。藻蓝蛋白含量没有因光暗比的增大而明显增加, 同时, 藻蓝蛋白在生物质中的占比也随光暗比的增大而减小。光照时间增加对藻蓝蛋白的积累没有明显的促进作用, 单位质量生物质的藻蓝蛋白含量存在降低的趋势。
红光、16L/8D 条件下培养的 E542 生物质干重值最大, 藻蓝蛋白积累总量为 189 mg/gDCW, 在 12个实验组中总产量最高。光源为红光时, 光周期12L/12D 的实验组收获的生物质干重大于 8L/16D实验组, 但前者的藻蓝蛋白积累量比后者少近 10 mg/gDCW。这一实验结果与蓝细菌 Pseudanabaena和 Anabaena circinalis 在不同光质下的色素积累特征一致[9], 可能是由于光周期的改变促发蓝细菌的调节机制, E542 在光照时间较长时, 通过降低藻蓝蛋白的积累来获取最大的可用光能捕获效率。与白光实验组对比可知, 在光周期同为 8L/16D 时, 红光条件下 E542 的干重(974mg/L)远大于白光(724mg/L), 与白光、16L/8D 条件下的干重(995mg/L)接近, 可能是由于红光对 E542 的生长有较好的促进作用。
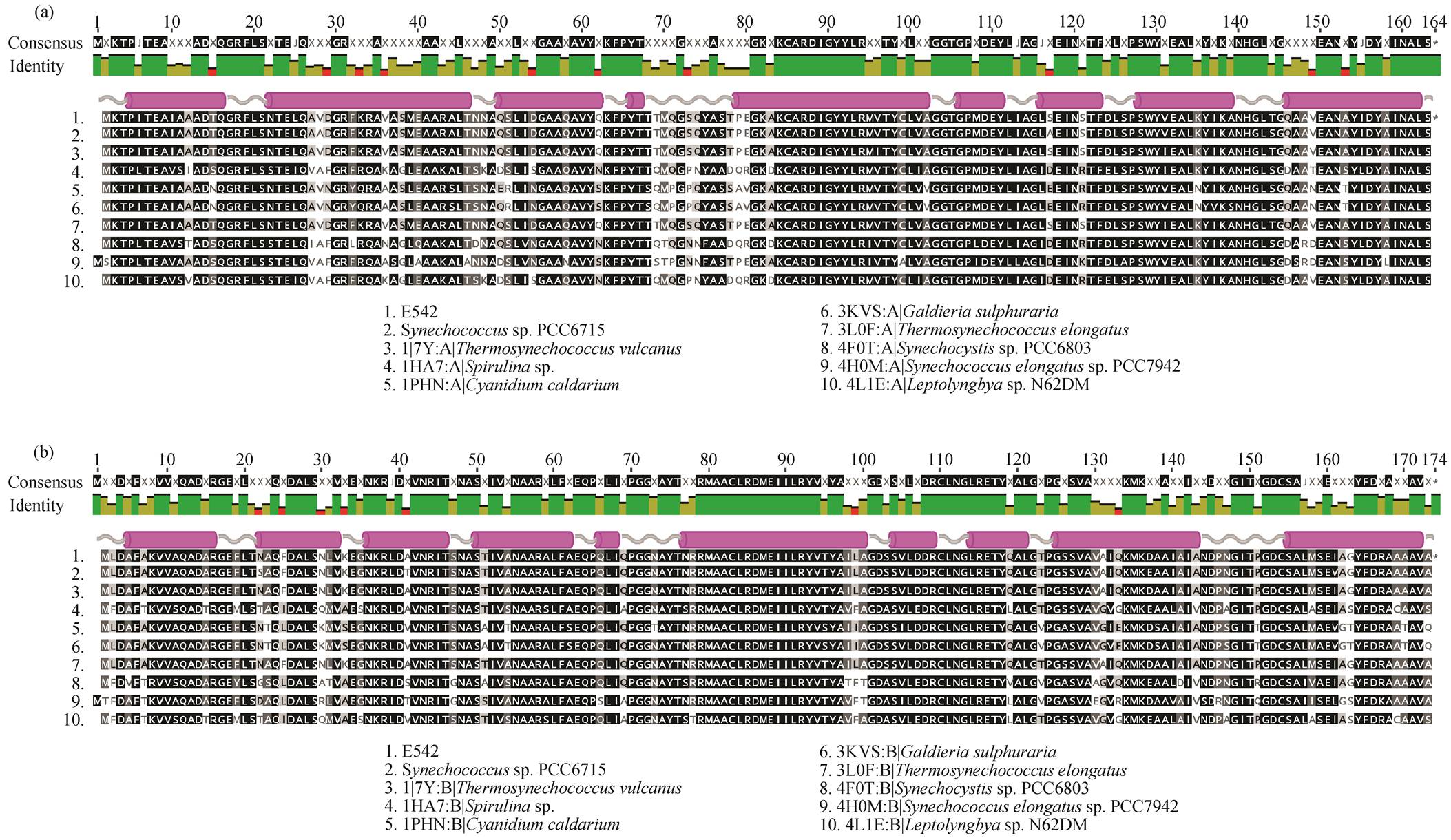
图2 藻蓝蛋白α亚基(a)与β亚基(b)的多重序列比对
Fig. 2 Multiple sequence alignment of C-phycocyanin chain α (a) and chain β (b)
表2 不同光照条件E542藻蓝蛋白含量对比
Table 2 Summary of phycocyanin production of E542 under different light conditions

光质光周期(L/D)生物质干重/ (mg∙L−1)藻蓝蛋白/ (mg∙gDCW−1)占生物质的比例/% 白光8/16 724±35 108±15 14.9 12/12 895±22 109±8 12.1 16/8 995±34 116±19 11.6 红光8/16 974±43 175±25 17.9* 12/12 1168±66 168±9 14.3 16/8 1432±78* 189±17* 13.1 绿光8/16 516±81 58±6 11.2 12/12 400±39 42±12 10.5 16/8 328±52 34±14 10.3 蓝光8/16 403±25 42±5 10.4 12/12 306±45 28±3 9.15 16/8 241±53** 24±5** 9.95
说明: 采用 Duncan’s mulitiple range test 方法分析; * 表示 p<0.05, **表示 p<0.01 (n=3)。
绿光培养下的各实验组, 生物质干重和藻蓝蛋白积累量均随光照时长的增加而降低。对比白光实验组可知, 光周期为 8L/16D 时, 白光下的生物质干重比绿光高 40%, 藻蓝蛋白是绿光培养的两倍。同时, 绿光下的藻蓝蛋白占比远低于白光, 差值达3.7%。同样的情况也出现在另两个光周期中, 其差距甚至比 8L/16D 条件下更大。可以推断, 绿光不仅对 E542 的生长有明显的抑制作用, 对其藻蓝蛋白的积累也有很大的影响。
蓝光培养下 E542 的生物质干重与有促进作用的红光实验组数据差异显著, 蓝光实验组在光周期为 16L/8D 时收获的生物量最小, 约为红光同一光周期收获量(最大值)的 16.7%; 其藻蓝蛋白产量仅有 24mg/gDCW, 约为红光同一光周期实验组的12.5%。此外, 蓝光实验组藻蓝蛋白占生物质的比例基本上低于 10%, 表明蓝光抑制 E542 生长的同时, 也会抑制其藻蓝蛋白的积累过程。
分析不同光质条件下的藻蓝蛋白含量可知, 红光条件下积累的藻蓝蛋白含量最高, 白光次之, 绿光和蓝光积累量较低。与模式菌 Synechococcus elon-gatus PCC7942 和 Synechocystis sp. PCC6803 相似[20], E542 基因组中并不具备藻红蛋白相关编码基因, 无法实现颜色适应(CCA)调节。红光实验组中的嗜热蓝细菌 E542 收获量较高, 可能是因为实验中采用的红光(662nm)不仅可以被叶绿素吸收, 还可以被别藻蓝蛋白吸收, 提高光合效率, 促使藻蓝蛋白积累量增高[2,21–23]; 而蓝光可能导致传递光合电子的PSII 能力不足, 光合作用效率降低[24–27], 使得 E542生物量降低, 影响藻蓝蛋白产量。光周期变化时, 总藻蓝蛋白产量的提升主要归因于生物量的提高, 光周期 8L/16D 条件下藻蓝蛋白的占比高于其他两个光周期。光照时间越长, 意味着光合细菌吸收的光能越多, 从而导致光合磷酸化活动频繁, 削弱色素合成通路, 使得色素合成量相应地下降[11]。
本文对 E542-PC 在不同温度、不同放置时间下的热稳定性及结构稳定性进行测定, 同时与 SP-PC耐热性能进行对照实验。通过改变光照条件, 筛选最优的 E542-PC 积累培养条件, 得出如下结论。1) E542-PC 在 65°C 放置 5 小时后, 二级结构稳定, 仍保持热稳定性; 放置时间延长至 14 天后, E542-PC仍能在 60°C 条件下保持 60%的热稳定性; 5 小时孵育条件下, 其失活温度远高于 SP-PC。2)与白光相比, 红光(662nm)对 E542 生长和藻蓝蛋白积累均存在促进作用, 光周期为 8L/16D 时藻蓝蛋白合成更多, 单位质量嗜热蓝细菌的藻蓝蛋白可提升近 100 mg。
综上所述, E542-PC 比目前市场应用的藻蓝蛋白热稳定性能良好, 嗜热蓝细菌 E542 是未来市场化应用开发藻蓝蛋白的一个非常具有潜力的研究对象。但是, 仅针对光照条件进行筛选是不够的, 还需多方位优化培养条件, 必要时可以利用基因工程技术进行优化, 进一步提高其市场化价值。
参考文献
[1] McInerney M J, Bryant M P, Pfennig N. Anaerobic bacterium that degrades fatty-acids in syntrophic association with methanogens. Archives of Micro-biology, 1979, 122(2): 129–135
[2] MacColl R. Allophycocyanin and energy transfer. Biochimica et Biophysica Acta-Bioenergetics, 2004, 1657(2/3): 73–81
[3] Adir N, Dines M, Klartag M, et al. Assembly and disassembly of phycobilisomes // Complex Intracellular Structures in Prokaryotes. Berlin, 2006: 47–77
[4] Romay C, Armesto J, Remirez D, et al. Antioxidant and anti-inflammatory properties of C-phycocyanin from blue-green algae. Inflammation Research, 1998, 47(1): 36–41
[5] 黄峰, 郭云飞, 陈昱, 等. 螺旋藻(Spirulina platen-sis)生物转化富硒形态对自由基的清除作用. 暨南大学学报(自然科学与医学版), 2015, 36(3): 202–207
[6] Zhang L X, Cai C E, Guo T T, et al. Anti-cancer effects of polysaccharide and phycocyanin from porphyra yezoensis. Journal of Marine Science and Technology-Taiwan, 2011, 19(4): 377–382
[7] 陈红兵, 郭云良, 孙圣刚, 等. 藻蓝蛋白对大鼠脑缺血再灌流后神经元损伤的保护作用. 中国全科医学, 2004, 7(8): 527–530
[8] Ravi M, Tentu S, Baskar G. et al. Molecular me-chanism of anti-cancer activity of phycocyanin in triple-negative breast cancer cells. BMC Cancer, 2015, 15(1): 768–781
[9] Martelli G, Folli C, Visai L, et al. Thermal stability improvement of blue colorant C-phycocyanin from Spirulina platensis for food industry applications. Process Biochemistry, 2014, 49(1): 154–159
[10] Tandeau de Marsac N. Phycobilisomes and comple-mentary chromatic adaptation in cyanobacteria. Bul-letin de L’Institut Pasteur, 1983, 81(3): 201–254
[11] Khajepour F, Hosseini SA, Nasrabadi RG, et al. Effect of light intensity and photoperiod on growth and biochemical composition of a local isolate of Nostoc calcicola. Applied Biochemistry and Biotechnology, 2015, 176(8): 2279–2289
[12] Tang J, Jiang D, Luo Y F, et al. Potential new genera of cyanobacterial strains isolated from thermal sp-rings of western Sichuan, China. Algal Research-Biomass Biofuels and Bioproducts, 2018, 31: 14–20
[13] Stanier R Y, Kunisawa R, Mandel M, et al. Purifi-cation and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews, 1971, 35(2): 171–205
[14] Bennett A, Bogorad L. Complementary chromatic adaptation in a filamentous blue-green alga. Journal of Cell Biology, 1973, 58(2): 419–435
[15] Leu J Y, L Lin T H, Selvamani M J P, et al. Charac-terization of a novel thermophilic cyanobacterial strain from Taian hot springs in Taiwan for high CO2mitigation and C-phycocyanin extraction. Process Bio-chemistry, 2013, 48(1): 41–48
[16] Pittera J, Partensky F, Six C. Adaptive thermostability of light-harvesting complexes in marine picocyano-bacterial. The ISME Journal, 2017, 11(1): 112–124
[17] Rahman D, Sarian F, Van Wijk A, et al. Thermostable phycocyanin from the red microalga Cyanidioschyzon merolae, a new natural blue food colorant. Journal of Applied Phycology, 2017, 29(3): 1233–1239
[18] Braga A R C, Figueira F d S, Silveira J T d, et al. Improvement of thermal stability of C-phycocyanin by nanofiber and preservative agents. Journal of Food Processing and Preservation, 2016, 40(6): 1264–1269
[19] Patel A, Pawar R, Mishra S, et al. Kinetic studies on thermal denaturation of C-phycocyanin. Indian Jour-nal of Biochemistry and Biophysics, 2004, 41(5): 254–257
[20] Christophe S, Jean-Claude T, Laurence G, et al. Diversity and evolution of phycobilisomes in marine Synechococcus spp.: a comparative genomics study. Genome Biology, 2007, 8(12): R259
[21] Glazer A N, Bryant D A. Allophycocyanin B (λmax 671, 618 nm): a new cyanobacterial phycobiliprotein. Archives of Microbiology, 1975, 104(1): 15–22
[22] Lemasson C, Tandeaud N, Cohenbaz G. Role of allo-phycocyanin as a light-harvesting pigment in cyano-bacteria. Proceedings of the National Academy of Sciences of the United States of America, 1973, 70 (11): 3130–3133
[23] Luimstra V M, Schuurmans J M, Verschoor A M, et al. Blue light reduces photosynthetic efficiency of cyanobacteria through an imbalance between photo-systems I and II. Photosynthesis Research, 2018, 138 (2): 177–189
[24] Kirilovsky D. Modulating energy arriving at photo-chemical reaction centers: orange carotenoid protein-related photoprotection and state transitions. Photo-synthesis Research, 2015, 126(1): 3–17
[25] Murakami A, Kim S J, Fujita Y. Changes in photo-system stoichiometry in response to environmental conditions for cell growth observed with the cyano-phyte Synechocystis PCC 6714. Plant and Cell Phy-siology, 1997, 38(4): 392–397
[26] Myers J, Graham J R, Wang R T. Spontaneous pigment mutants of anacystis-nidulans selected by growth under far-red light. Archives of Microbiology, 1980, 124(2/3): 143–148
[27] Solhaug K A, Xie L, Gauslaa Y. Unequal allocation of excitation energy between photosystem II and I re-duces cyanolichen photosynthesis in blue light. Plant and Cell Physiology, 2014, 55(8): 1404–1414
Thermophilic Cyanobacteria PKUAC-E542 Phycocyanin Heat Resistance and Effects of Different Light Conditions on Its Accumulation
Abstract This paper studied the heat resistance of phycocyanin and the accumulation of phycocyanin under different light conditions in thermophilic cyanobacteria. With 30°C, 40°C, 50°C, 60°C, 65°C, 70°C, 80°C, 90°C as the experimental group, 25°C and 4°C as the control group, the placement time was set to 5 hours and 14 days. Alignments of both chain α and β were conducted to figure out the heat resistant mechanism. PKUAC-SCTE542 was cultured under different photoperiods and different combinations of light sources, and its growth and phycocyanin content were studied to explore the light conditions which were suitable for phycocyanin production. Shaking incubators with narrow band light at following wavelengths: white (400–800nm), red (654 nm), green (511 nm), and blue (454 nm), photoperiods of 8L/16D, 12L/12D, and 16L/8D, were tested. Dry weight and content of extracted phycocyanin were measured. PKUAC-SCTE542 phycocyanin kept stable at 65°C environments, and still maintained 60% activity after being placed at 60°C for 14 days. Under the conditions of red light and photoperiod of 8L/16D, the yield of phycocyanin was the highest; while the productivity of phycocyanin was the highest when red light and photoperiod of 16L/8D were set. In result, PKUAC-SCTE542 showed great heat resistance ability in this research. With light screening done, the phycocyanin yield increased by nearly 100 mg/gDCW.
Key words thermophilic cyanobacteria; phycocyanin; heat resistance; light condition
doi: 10.13209/j.0479-8023.2021.029
深圳市知识创新计划基础研究项目(JCYJ20180302153648993)和国家自然科学基金(32071480)资助
收稿日期: 2020-03-19;
修回日期: 2021-02-18