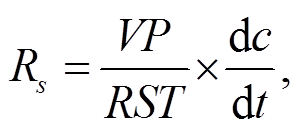
摘要 对河北塞罕坝机械林场樟子松(Pinus sylvestris var. mongolica)人工林采取不同的处理方式(对照(CK)、凋落物移除(−L)、凋落物添加(+L)、根系去除(−R)、凋落物和根系同时去除(−R−L)、凋落物添加和根系去除(−R+L)), 基于处理后第一个生长季(2019 年 5—9 月)的测定结果, 研究不同的植物残体输入方式对土壤呼吸及其温度敏感性的影响, 得到以下结果。1)土壤呼吸速率存在显著的季节动态, 7—8 月最高, 9 月底最低。CK, −L, +L, −R, −R−L和−R+L 处理组的生长季内平均土壤呼吸速率(平均值±标准误差, 下同)分别为2.20±0.17, 1.24±0.09, 2.40±0.07, 2.05±0.11, 1.04±0.07, 2.28±0.17 µmol/(m2·s), −L 和−R−L处理分别使土壤呼吸速率降低 43.6%和 52.7%。2)不同处理方式下, 生长季内土壤呼吸与土壤温度显著指数相关(p<0.01), 各处理样地土壤呼吸的温度敏感 Q10 值分别为 2.32±0.13, 2.37±0.05, 2.41±0.09, 2.42±0.14, 2.09±0.08, 2.87±0.11。地上凋落物处理对土壤呼吸生长季平均值和 Q10 都有显著的影响(p<0.05), 而根系处理对其均无显著影响(p> 0.05)。3)与对照组相比, 在根系去除的处理(−R, −R−L和−R+L)中, 土壤湿度显著升高, 可能与根系停止吸收水分有关, 但土壤温度没有显著的变化。在大部分处理(除−R 和−R+L 外)中, 生长季内土壤呼吸与土壤湿度呈显著的抛物线式关系, 土壤湿度的阈值为 15%左右。综合来看, 凋落物去除对樟子松林土壤呼吸和温度敏感性均产生显著的影响, 而根系去除的影响在第一个生长季不显著。
关键词 凋落物添加; 凋落物去除; 根系去除; 樟子松人工林; 土壤呼吸; 温度敏感性
土壤是陆地生态系统第二大碳库, 碳含量是大气碳库的 3.3 倍, 包含超过 3/4 的地球陆地碳, 通过碳释放和碳封存, 对全球气候变化产生显著影响[1]。森林生态系统的土壤碳输入取决于地上凋落物的输入和地下根系的周转, 土壤碳输出主要通过土壤呼吸和可溶性有机碳的淋溶[2]。森林土壤排放的 CO2 (土壤呼吸)是陆地到大气最大的碳通量。因此, 土壤 CO2 通量是调节气候变化的重要因子, 在局地、区域和全球尺度的碳平衡中起关键的作用[3]。
研究发现, 随着大气中 CO2 浓度和温度的升高, 植被净初级生产力增加, CO2 升高对植物地下生物量和根际沉积的影响大于对地上生物量的影响[4]。氮沉降和降水模式的变化导致生态系统物种组成以及地上和地下生物量分配比例发生变化, 从而改变植物地上和地下凋落物的产量和质量[5]。
凋落物是土壤中重要的碳和营养物质的来源。土壤有机质对凋落物变化的响应是动态的, 复杂的。在森林生态系统中, 凋落物的添加与移除可以改变土壤有机碳的供应, 从而影响微生物新陈代谢过程以及土壤呼吸[6-7]。许多研究表明凋落物输入量与土壤呼吸呈线性正相关关系[5-6,8], 然而也有研究认为凋落物输入量与土壤呼吸之间呈现非线性相关关系[9]。随着凋落物的增加, 土壤呼吸呈现不成比例的增加趋势, 这表明增加碳投入可能通过激发效应加速现有土壤碳的分解[10-13]。由于凋落物引发的激发效应, 凋落物添加导致的土壤呼吸增加量比凋落物移除导致的土壤呼吸降低量更高[14]。
土壤呼吸速率受到多种生物和非生物因素的影响, 土壤温度和土壤水分是其中两个最重要的非生物因素[15-16]。土壤呼吸速率与土壤温度之间通常呈密切的指数关系[17]。土壤呼吸的温度敏感性(Q10)指温度每升高 10°C, 土壤呼吸速率增加的倍数, 是评估土壤碳排放与气候变暖之间反馈强度的关键参数[18]。Boone 等[17]认为, 生长季内, Q10 不仅是温度对于土壤呼吸的影响, 而是植物碳输入、微生物底物和土壤水分等因素的共同影响。
目前, 国内外对森林植物残体处理影响土壤呼吸及其温度敏感性开展了一些研究。但是, 这些研究通常只关注植物地上凋落物处理(添加或移除)对土壤呼吸的影响, 忽视植物地下根系处理及地上凋落物和地下根系同时处理对土壤呼吸的影响。此外, 现有研究集中在热带和亚热带的阔叶林中[19-21], 对较寒冷地区的针叶林鲜有报道。针叶林和阔叶林的凋落物(主要是叶片)质量存在一定的差异, 对土壤呼吸的影响可能不同。为此, 本研究以温带樟子松人工林为研究对象, 设置对照、凋落物去除、凋落物添加、根去除、凋落物和根去除、凋落物添加与根去除 6 个处理, 探讨不同植物残体输入(凋落物或根系)处理对土壤呼吸及其温度敏感性的影响以及控制因素, 以期为理解大气 CO2浓度升高和气候变化引起植物残体输入改变背景下的温带人工林土壤碳排放动态提供借鉴。
研究区位于河北省承德市围场县北京大学塞罕坝生态定位站, 地理位置为 42°24′53″N, 117°14′ 43″E, 海拔 1431 m。塞罕坝地区属于温带大陆性季风气候: 冬季漫长, 低温寒冷; 春季短暂, 干燥多风; 夏季温度变化不明显, 光照强烈。此外,该区域昼夜温差大, 降水量偏少, 风大风多, 蒸发量大于降水量。根据近年的气象资料, 定位站年均温为−1.4°C, 1 月均温为 21.8°C, 7 月均温为 16.2°C, 年均降水量为 453mm, 最大年降水量为 636mm, 最小年降水量为 258mm, 年均降水日数为 134 天, 6—8月份降水量占年降水量的 68%; 年均蒸发量为 1388mm。该地区土壤为风沙土, 主要成土母质为风积物、残积物和冲积物[22]。主要植被为人工种植的落叶松(Larix principis-rupprechtii)和樟子松(Pinus sylvestris var. mongolica)。
采用随机区组设计实验, 于 2018 年 9 月在樟子松人工林(32 年生)中一共设置 5 个样方(10m×10m, Block), 每个重复样方相距 10m 以上, 每个样方中设置 6 个小样方(1m×1m, Plot), 分别采取 6 种不同的处理方式, 每种处理均设置 5 个重复。
1)对照(control, CK): 在自然状态下不做任何处理, 设置 5 个重复样方, 与其他处理进行对比。
2)凋落物去除处理(litter removal, −L): 首先清除小样方内地上现存的枯落物, 在距地面 5 cm 处放置由 0.15mm 孔径尼龙网制成的 1m×1m 凋落物收集框, 防止凋落物进入该样方内。
3)凋落物添加处理(litter addition, +L): 每隔半个月, 将−L 样方内收集到的凋落物均匀地撒在该样方内。
4)根系去除处理(root removal, −R): 采用壕沟法, 在小样方四周挖 60cm 深的壕沟, 将 0.3mm 厚的 PVC 板放入壕沟内, 隔离根系, 防止根生长进小样方内。
5)凋落物和根系去除处理(litter removal and root removal, −L−R): 清除掉小样方内地上现存的枯落物, 在距地面 5cm 处放置 1m×1m 的凋落物收集框; 同时采用壕沟法, 在小样方四周挖 60cm 深的壕沟, 将 0.3mm 厚的 PVC 板放入壕沟内, 隔离根系。
6)凋落物添加和根系去除处理(litter addition and root removal, +L−R): 将从−L−R样方内收集到的凋落物均匀地撒在该样方内, 同时采用壕沟法, 在小样方四周挖 60cm 深的壕沟, 将 0.3mm 厚的PVC 板放入壕沟内, 隔离根系。
使用 PS-2000 开路式土壤碳通量测定系统(北京理加联合科技有限公司)测定土壤呼吸, 该仪器自带探针, 可测定土壤 5cm 深度的温度和湿度(体积含水量 v/v, %)。将直径为 20cm, 高度为 15cm 的PVC 土壤呼吸环插入距土壤表层 5cm 深的位置, 砸实, 防止漏气。每次测定前, 需要除去环内杂草等干扰物质, 保持整个土壤呼吸环在测量期内位置不变。在 2019 年 5—9 月, 每月测定两次, 每两周测定一次, 一共测定 9 次, 每次测定的时段为 8:00—12:00。
土壤呼吸速率(Rs)计算公式为
其中, V 是呼吸仪的呼吸箱体积(本实验中为 0.00347 m3), P 是呼吸箱内气体压强(Pa), R 为气体常数(8.314 Pa·m3/(K·mol)), S 是呼吸仪箱底面积(本实验中为 0.0299m2), T 为呼吸箱内空气温度(K)。dc/dt表示单位时间内 CO2 体积分数的变化率。
本研究使用指数模型拟合土壤呼吸与土壤温度间的关系[23]:
Rs=aebT ,
其中, Rs 为土壤呼吸速率(µmol/(m2∙s), a 是土壤温度为 0°C 时的土壤呼吸速率, b 为温度反应常数, T 为土壤温度(°C)。土壤呼吸的温度敏感性(Q10)计算式[24]为
Q10=e10b。
使用二元多项式模型拟合土壤呼吸与土壤含水量(W)间的关系:
Rs= aW 2+bW+c ,
其中, a, b 和 c 均为常数。
使用线性混合效应模型(linear-mixed effects model)[25]分别分析凋落物(Litter)、根系(Root)、采样时间(Time)和样方区组(Block)对土壤呼吸、土壤温度、土壤湿度以及 Q10 的影响, 上述过程用 R 语言中 nlme 包来实现。使用单因素方差分析法(one-way ANOVA with Turkey’s test)检验凋落物和根系处理对土壤呼吸、土壤温度、土壤水分和 Q10 的影响, 并进行方差分析和多重比较(α=0.05), 上述分析在软件 SPSS 20.0 (SPSS Inc., Chicago, IL, USA)中进行。使用软件 GraphPad Prism 7.04 (GraphPad Software Inc., CA, USA)作图。本文的数据用平均值±标准误差表示。
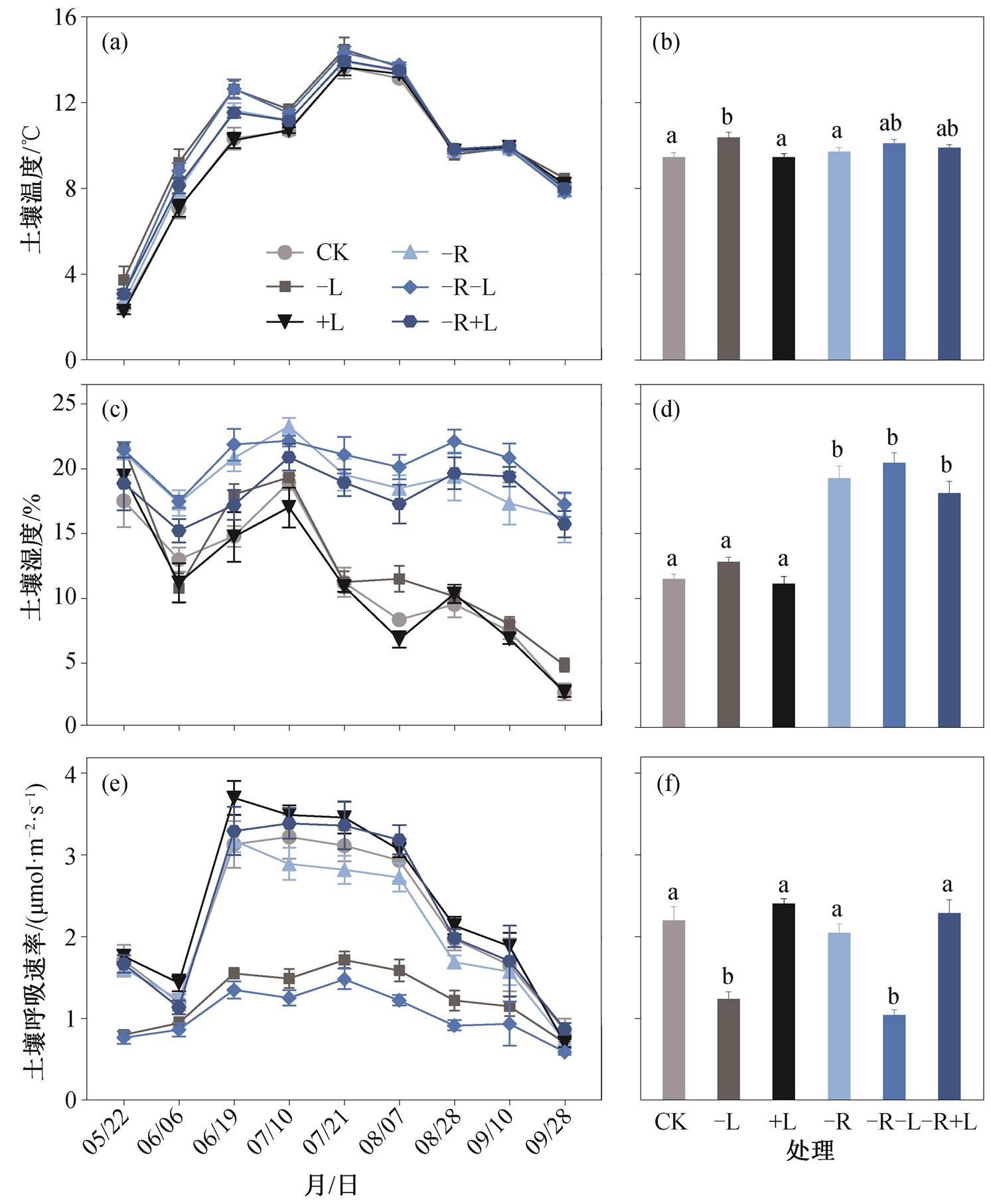
在樟子松林中, 从 2019 年 5 月开始, CK, −L, +L, −R, −R−L 和−R+L 处理的土壤温度逐月递增, 7 月达到峰值(图 1(a)), 分别为 13.64, 14.49, 13.64, 13.92, 14.34 和 13.95°C, 随后逐渐降低。生长季土壤温度平均值分别为 9.46±0.21°C, 10.38±0.24°C, 9.47±0.14°C, 9.72±0.19°C, 10.06±0.17°C 和 9.92±0.13°C(图 1(b))。不同处理的土壤温度均存在显著的时间动态(p<0.001, 表 1)。但与对照相比, −L 处理的土壤温度升高 0.92°C (p<0.05), 其他处理与对照之间均无显著差异(图 1(b))。
从 2019 年 5 月开始, CK, −L, +L, −R, −R−L 和−R+L 处理的土壤湿度呈无规律性波动, 且存在显著的时间差异(p<0.01, 表 1)。其中, 对照(CK)和有根处理(−L 和+L)的土壤湿度在 9 月底出现最低值, 分别为(2.78±0.66)%, (4.85±0.52)%和(2.78±0.38)%; 而去除根处理(−R, −R−L 和−R+L)在 7 月初出现峰值, 分别为(23.30±0.66)%, (22.16±0.41)%和(20.91± 1.03)% (图 2(c))。CK 和 5 种处理(−L, +L, −R, −R−L和−R+L)的土壤湿度生长季平均值为(11.52±0.34)%, (12.84±0.32)%, (11.14±0.54)%, (19.30±0.93)%, (20.45±0.78)%和(18.14±0.87)% (图 2(d))。与对照相比, −R, −R-L 以及−R+L 处理下土壤湿度分别提高 7.78%, 8.93%和 6.62%。如表 1 所示, 凋落物和根系处理对土壤温度和湿度均有显著影响(p<0.01)。
6 种处理(CK, −L, +L, −R, −R−L和−R+L) 的土壤呼吸速率均有显著的季节动态(p<0.01) (表1), 最大值出现在 6—8 月, 分别为 3.22, 1.71, 3.69, 3.17, 1.48 和 3.38µmol/(m2∙s), 最小值出现在 9 月底, 分别为 0.85, 0.70, 0.69, 0.72, 0.59 和 0.87µmol/(m2∙s) (图 1(e))。凋落物和根系处理对土壤呼吸均有显著影响(p<0.01, 表 1), 在整个实验期间, +L 处理各月份的土壤呼吸均高于对照, 而−L, −R 和−R−L 处理各月份的土壤呼吸均低于对照(图 1(f))。具体地, CK, −L, +L, −R, −R−L 和−R+L 处理的土壤呼吸速率生长季平均值分别为 2.20±0.17, 1.24±0.09, 2.40± 0.07, 2.05±0.11, 1.04±0.07 和 2.28±0.17µmol/(m2∙s)。与对照相比, −L 和−R−L 处理使土壤呼吸速率显著降低 43.6%和 52.7%, +L 和−R+L处理使土壤呼吸速率升高, −R 处理使土壤呼吸速率降低, 但均不显著(图 1(f))。
不同小写字母表示处理间差异显著(p<0.05), 下同
图1 不同处理下土壤温度、土壤温度和土壤呼吸在2019年生长季内的动态及均值
Fig. 1 Dynamics and mean values of soil temperature, soil moisture and soil respiration under different treatments in the growing season of 2019
表1 根系处理、凋落物处理、取样时间及其交互作用对土壤温度、土壤湿度和土壤呼吸的影响
Table 1 Summary of the linear-mixed effects model for the effect of root, litter treatment, sampling date and their interactive effects on soil temperature, soil moisture and soil respiration

因子 土壤温度土壤湿度土壤呼吸根系F1,210 = 6.14*F1,210 = 745.91***F1,211 = 11.77***凋落物F2,210 = 44.96***F2,210 = 18.45***F2,211 = 332.57***时间F8,210 = 1341.2***F8,210 = 67.34***F8,211 = 145.07***根系×凋落物F2,210 = 12.21***F2,210 = 0.79F2,211 = 0.79根系×时间F8,210 = 3.14**F8,210 = 25.72***F8,211 = 0.47凋落物×时间F16,210 = 5.32***F16,210 = 1.32F16,211 = 12.84***根系×凋落物×时间F16,210 = 1.11F16,210 = 1.06F16,211 = 0.58
注: *p<0.05, **p<0.01, ***p<0.001, 下同。
不同处理下土壤呼吸速率与土壤温度均呈显著的指数相关关系(p<0.01, 图 2)。CK, −L, +L, −R, −R−L 和−R+L 处理中土壤温度分别解释了 22.9%, 55.8%, 29.0%, 32.2%, 39.4%和 44.4%的土壤呼吸速率的季节变化(图 2)。通过对土壤呼吸速率和土壤湿度的关系进行二次项曲线关系模型拟合, 发现在CK, −L, +L 和−R−L 处理中, 土壤湿度可以解释土壤呼吸速率变化的 16.8%~29.8% (p<0.01), 而在−R和−R+L 处理中, 土壤呼吸速率与土壤湿度无显著的相关关系(图 3)。
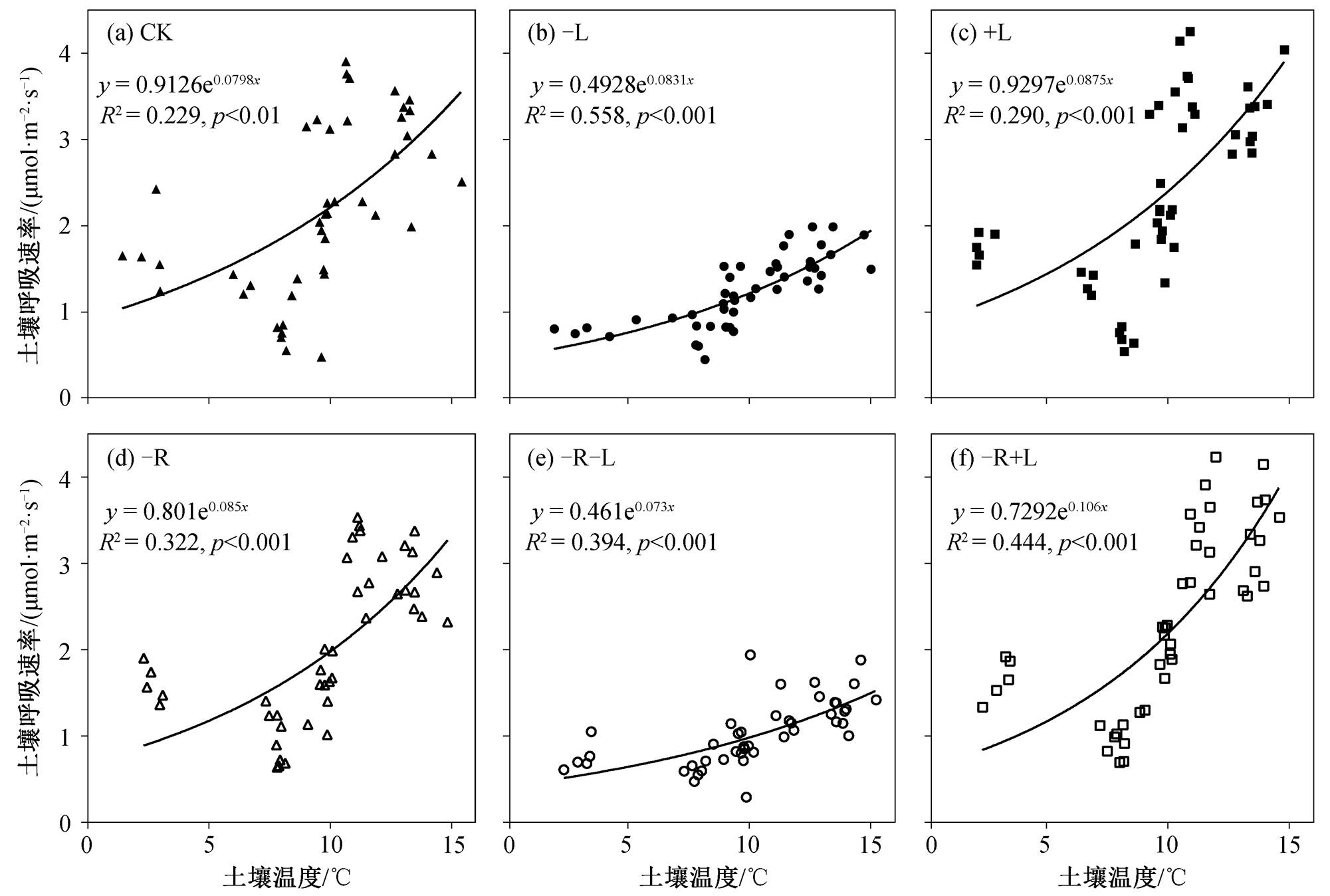
图2 不同处理下土壤呼吸速率与5 cm深度土壤温度的关系
Fig. 2 Regression relationships between soil respiration rate and soil temperature at 5 cm depth under different treatments
凋落物处理对 Q10 有显著的影响(p<0.01), 而根系处理对 Q10 的影响不显著(p>0.05, 表 2)。本研究中, CK, −L, +L, −R, −R−L 和−R+L处理的 Q10 值分别为 2.32±0.13, 2.37±0.05, 2.41±0.09, 2.42±0.14, 2.09± 0.08, 2.87±0.11。不同处理下 Q10 值的排序为−R+ L>−R>+L>−L>CK>−R−L (图 4)。与对照相比, 在−R+L 处理下, Q10 值显著升高 23.7% (p<0.05), −L, +L 和−R 处理下的 Q10 值均高于 CK, 而−R−L 处理下的 Q10 值低于 CK, 但均不显著(图 4)。
受全球气候变化的影响, 植物初级生产力可能会发生改变, 地上凋落物和地下根系对土壤碳的输入也会发生变化[12]。凋落物是土壤中碳和营养物质的重要来源, 也是微生物代谢底物的主要来源,其输入量的改变会引起土壤有机碳含量、土壤微生物活性和群落结构与功能发生变化[26], 从而对土壤呼吸产生影响。本文研究结果表明, 去除凋落物后, 土壤呼吸速率显著下降 43.6%, 与文献[27-28]下降约 25%~60%的结果相接近。本研究中凋落物添加使土壤呼吸增加 9.3%, 凋落物去除导致土壤呼吸下降的幅度大于凋落物添加导致土壤呼吸增加的幅度。有研究表明, 地上凋落物添加对土壤呼吸的促进作用明显大于凋落物去除引起的抑制作用[9,14], 原因是凋落物添加会引起激发效应(priming effect), 从而加速土壤有机碳分解。Sayer 等[29]进行的一项大规模长期实验表明, 凋落物的添加引起激发效应, 约 34%的土壤呼吸增量来自激发效应产生的土壤碳分解, 即额外的易分解碳输入可能刺激土壤有机碳矿化。本研究中凋落物添加使土壤呼吸增加的幅度小于凋落物去除使土壤呼吸下降的幅度, 其原因可能与实验设计和处理有关。本研究中的凋落物去除(−L)处理不仅去除当年的新鲜凋落物, 并且在实验之初(2018 年 9 月)对地表所有的凋落物进行清理, 因此该处理下土壤呼吸的下降来源于两者的共同贡献(移除地表累积的凋落物和新产生的凋落物)。
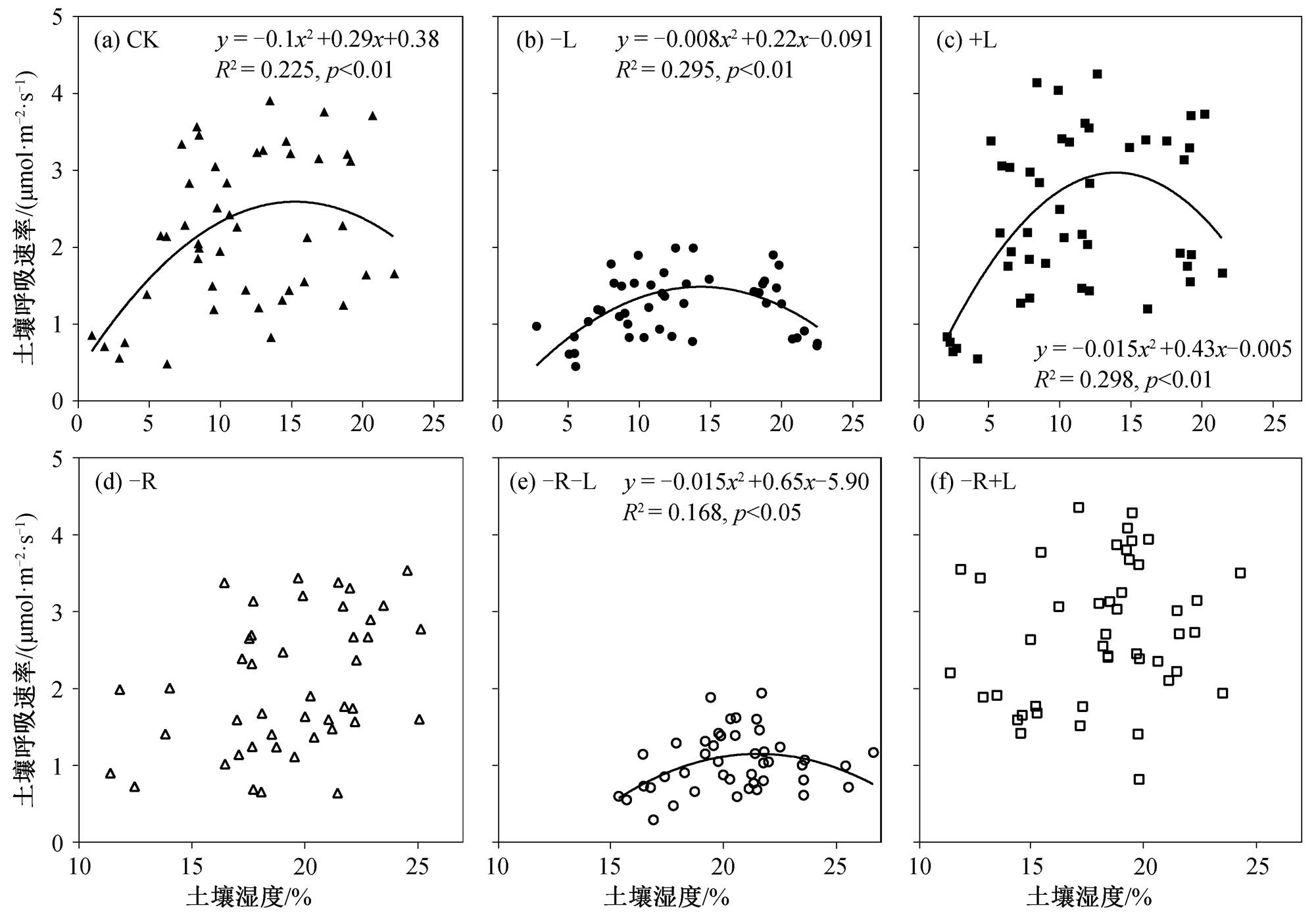
图3 不同处理下土壤呼吸速率与5 cm深度土壤湿度的关系
Fig. 3 Relationships between soil respiration rate and soil moisture at 5 cm depth under different treatments
表2 根系处理、凋落物处理及其交互作用对生长季土壤呼吸平均值和温度敏感性(Q10)的影响
Table 2 Summary of the linear-mixed effects model for the effect of root, litter treatment and their interactive effects on the mean value of soil respiration and the temperature sensitivity of soil respiration (Q10) during the growing season of 2019

因子土壤呼吸Q10根系F1,20 = 0.69F1,20 = 1.13凋落物F2,20 = 56.44***F2,20 = 8.53**根系×凋落物F2,20 = 2.09F2,20 = 6.47**
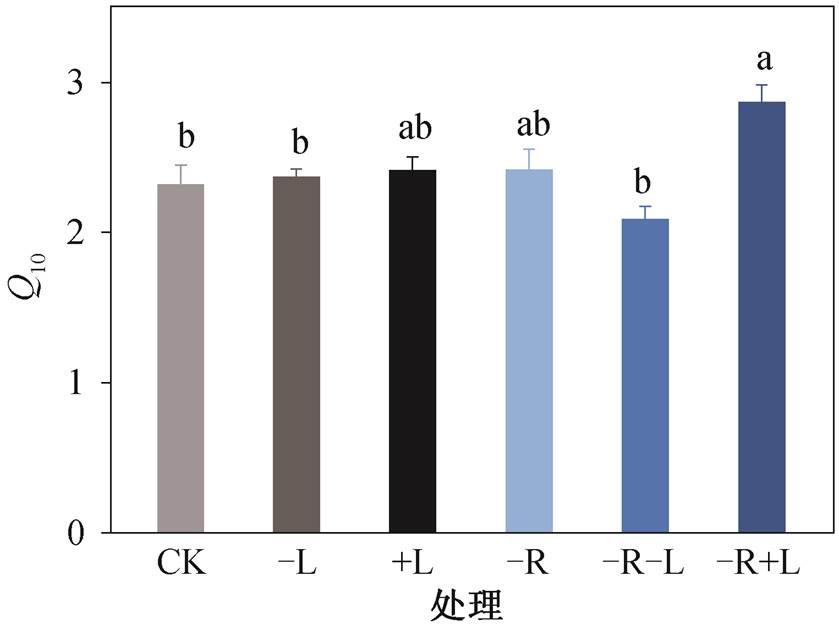
图4 不同处理方式下土壤呼吸的温度敏感性Q10值
Fig. 4 The temperature sensitivity of soil respiration (Q10) under different treatments
除地上凋落物外, 地下根系输送碳的数量和质量也会影响土壤呼吸等碳循环过程。有研究表明, 根系分泌物比其他化合物分解得更慢[30], 从而促进更多的土壤碳储存。本研究中, −R−L 处理使土壤呼吸速率显著降低 52.7%, 而−R 处理使土壤呼吸速率下降 6.8%, −R+L 处理使土壤呼吸速率上升 4.0%, 但均不显著(图 2(f))。根系处理对土壤呼吸没有表现出显著影响(p<0.05, 表 2)。Sulzman 等[6]在美国俄勒冈州针叶林开展的实验表明, 土壤有机质分解、地表枯落物分解和根际呼吸分别为土壤呼吸总CO2 排放量贡献 58%, 19%和 23%。根系去除阻碍光合产物从植物的地上部分分配到地下部分, 也阻止根系碳释放到土壤中, 进而影响土壤微生物生物量和活性。根系去除通过直接影响植物地下碳分配和降低根系活动, 以及间接降低微生物活性, 对土壤呼吸产生较大的抑制作用[31]。本研究中根系处理不影响土壤呼吸的结果可能与处理时间较短以及土壤湿度变化有关。本研究采用壕沟法将根系切断去除, 并在 8 个月之后开始测定土壤呼吸, 未完全分解的根系会贡献一部分 CO2 释放来抵消根系去除后的土壤呼吸降低量[32]。Bond-Lamberty 等[33]发现, 挖壕沟留下的残根分解占该处理土壤呼吸的 5%~ 10%, 因此, 在短期内壕沟法可能低估根系对土壤呼吸的贡献。此外, 根系切断后, 由于根系对水分的吸收和树木的蒸腾作用缺失, 使土壤湿度有所增加(图 1(d)), 进而对土壤呼吸产生影响。
地上凋落物通过增加水对土壤的渗透以及减少地表径流和蒸发来调节土壤温度和土壤含水量[34], 而凋落物驱动土壤温度和土壤含水量变化, 反过来影响微生物对凋落物和土壤有机质的分解。地上凋落物主要通过阻断土壤与大气之间的热量交换, 起到减缓土壤温度变化的作用[35]。本研究中, 与对照相比, 所有处理的土壤温度均有上升趋势, 但只有−L 处理中土壤温度显著提高 0.92°C (图 1(a)), 可能是凋落物去除后, 土壤暴露在地表导致温度升高。温度主要通过影响土壤微生物活性和植物根系生长来影响土壤呼吸[36]。本研究通过对土壤呼吸和土壤温度建立模型, 发现二者呈显著的指数关系(p< 0.01), 且−L, +L, −R, −R−L 和−R+L 处理下土壤呼吸与土壤温度的相关系数 R2 均大于对照, 表明凋落物和根系处理使温度对土壤呼吸变异的解释程度提高(图 2), 但单一的土壤温度指标对土壤呼吸变异的解释度总体上还很低。除土壤温度外, 其他土壤性质(如总有机碳、活性有机碳含量)以及生物指标(如根系生物量和活性、微生物生物量、群落组成和酶活性等)也会影响土壤呼吸。这些因素对土壤呼吸的影响需要在未来的工作中进一步探讨。
研究表明, 凋落物添加对土壤水分的影响不大[12,26]。然而, 在凋落物阻截雨水, 使其难以到达土壤表面的情况下, 凋落物添加反而减少土壤水分, 凋落物移除可能增加土壤湿度[37]。本文结果与上述研究一致, −L 处理下土壤湿度有上升的趋势, +L 处理下土壤湿度有下降的趋势(图 2)。通常, 去除根系后, 根系对土壤水分的吸收会降低, 导致土壤水分增加。本研究中, −R, −R−L 和−R+L 处理下土壤湿度分别显著提高 7.78%, 8.93%和 6.62%。土壤湿度对土壤呼吸的影响较为复杂, 通常与土壤温度、微生物生理活性、土壤通气性和气体扩散有关[38]。将土壤呼吸与土壤湿度进行相关拟合, 发现CK, −L, +L 和−R−L 处理中二者呈显著的抛物线关系(p<0.05), 在−R 和−R+L 处理中, 土壤呼吸速率与土壤湿度无显著的相关关系(图 3), 表明土壤湿度过低或过高都会抑制土壤呼吸: 过低时, 微生物活性受到抑制; 过高时, 不利于气体扩散[38-39]。
全球土壤温度敏感性(Q10)的变化范围为 1.9~ 5.7[40-41]。本研究中 Q10 值表现为−R+L (2.87) >−R (2.42) > +L (2.41) > −L (2.37) > CK (2.32) > −R−L (2.09), 在−L, +L 和−R 处理下, Q10 值有上升的趋势, 在−R−L 处理下 Q10 值有下降的趋势, 在−R+L 处理下 Q10 值显著上升 23.7%。本文研究结果与 Chen 等[14]对全球凋落物与根系野外试验进行的 meta 分析结果一致。在−L 处理下, Q10 值有上升的趋势, 可能是因为新鲜凋落物被移除, 留下较多难分解的碳基质, 而 Q10 值随着基质难分解程度增加而增加[18,42]。添加凋落物后, Q10 值没有明显下降, 反而有上升的趋势, 可能是由于基质利用率(底物浓度)增加的正面效应抵消了不稳定碳基质增加对 Q10 的负面效应。由于土壤中大多数微生物群落是碳限制的, 增加底物浓度可以增大 Q10 值[18,43-44]。−R 和−R−L 处理下 Q10 值均无显著变化, 部分原因可能是去除根系导致土壤湿度增加(图 1(d)), 氧气供应不足, 从而掩盖了 Q10 值的变化。Boone 等[17]在哈佛森林进行的一项长期凋落物实验表明, 根系去除处理的 Q10值为 2.5, 本文结果(2.42)与之较为接近。本研究中凋落物处理对 Q10 值有显著影响(p<0.01), 而根系处理对 Q10 值无显著影响(表 2), 可能是受到样方中残余死根的影响。通常情况下, 随着土壤温度的升高, 土壤呼吸的 Q10 值下降; 土壤水分过高或过低时, Q10 值下降[45]。同时, Q10 值不仅受到底物质量和底物供应的影响, 还与地理位置特征及生态系统类型有关[18]。
本研究通过野外处理实验, 评估不同植物残体(凋落物和根系)的添加和去除对土壤呼吸及土壤水热因子的影响。凋落物处理对土壤呼吸以及 Q10 值产生显著的影响, 凋落物和根系处理则对土壤温度和土壤湿度产生显著影响。不同处理方式下, 土壤呼吸与土壤温度和土壤湿度的相关关系不同, 土壤呼吸与土壤温度指数相关, 与土壤湿度呈二次项曲线关系。
由于只有一年的实验数据, 特别是缺乏土壤采样测定的理化性质和微生物群落数据, 本研究所得结论具有一定的局限性, 驱动机理还需要进一步探究。后续工作中将对该样地进行长期观测, 丰富凋落物和根系处理对土壤温湿度、土壤呼吸、Q10 以及微生物群落和碳储量的影响, 同时为全球变化背景下该地区土壤呼吸与气候反馈机制的研究提供数据支撑。
参考文献
[1] Jackson R B, Lajtha K, Crow S E, et al. The ecology of soil carbon: pools, vulnerabilities, and biotic and abiotic controls. Annual Review of Ecology, Evolu-tion, and Systematics, 2017, 48: 419–445
[2] Epron D, Nouvellon Y, Deleporte P, et al. Soil carbon balance in a clonal Eucalyptus plantation in Congo: effects of logging on carbon inputs and soil CO2 eff-lux. Global Change Biology, 2006, 12(6): 1021–1031
[3] Baggs E M. Partitioning the components of soil res-piration: a research challenge. Plant and Soil, 2006, 284: 1–5
[4] De Graaff M A, Van Groenigen K J, Six J, et al. Interactions between plant growth and soil nutrient cycling under elevated CO2: a meta-analysis. Global Change Biology, 2006, 12(11): 2077–2091
[5] Sayer E J, Heard M S, Grant H K, et al. Soil carbon release enhanced by increased tropical forest litterfall. Nature Climate Change, 2011, 1(6): 304–307
[6] Sulzman E W, Brant J B, Bowden R D, et al. Contri-bution of aboveground litter, belowground litter, and rhizosphere respiration to total soil CO2 efflux in an old growth coniferous forest. Biogeochemistry, 2005, 73(1): 231–256
[7] Crow S E, Lajtha K, Bowden R D, et al. Increased coniferous needle inputs accelerate decomposition of soil carbon in an old-growth forest. Forest Ecology and Management, 2009, 258(10): 2224–2232
[8] Miao Renhui, Ma Jun, Liu Yinzhan, et al. Variability of aboveground litter inputs alters soil carbon and nitrogen in a coniferous-broadleaf mixed forest of central China. Forests, 2019, 10(2): 188
[9] Fontaine S, Bardoux G, Abbadie L, et al. Carbon input to soil may decrease soil carbon content. Eco-logy Letters, 2004, 7(4): 314–320
[10] Carney K M, Hungate B A, Drake B G, et al. Altered soil microbial community at elevated CO2 leads to loss of soil carbon. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(12): 4990–4995
[11] Fontaine S, Barot S, Barré P, et al. Stability of organic carbon in deep soil layers controlled by fresh carbon supply. Nature, 2007, 450: 277–280
[12] Sayer E J. Using experimental manipulation to assess the roles of leaf litter in the functioning of forest ecosystems. Biological Reviews, 2006, 81(1): 1–31
[13] Schaefer D A, Feng W T, Zou X M. Plant carbon inputs and environmental factors strongly affect soil respiration in a subtropical forest of southwestern China. Soil Biology and Biochemistry, 2009, 41(5): 1000–1007
[14] Chen X L, Chen H Y H. Global effects of plant litter alterations on soil CO2 to the atmosphere. Global Change Biology, 2018, 24(8): 3462–3471
[15] Raich J W, Schlesinger W H. The global carbon dioxide flux in soil respiration and its relationship to vegetation and climate. Tellus B, 1992, 44(2): 81–99
[16] Feng Jiguang, Wang Jingsheng, Song Yanjun, et al. Patterns of soil respiration and its temperature sensi-tivity in grassland ecosystems across China. Biogeo-sciences, 2018, 15(17): 5329–5341
[17] Boone R D, Nadelhoffer K J, Canary J D, et al. Roots exert a strong influence on the temperature sensitivity of soil respiration. Nature, 1998, 396: 570–572
[18] Davidson E A, Janssens I A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change. Nature, 2006, 440: 165–173
[19] 李晓杰, 刘小飞, 熊德成, 等. 中亚热带杉木人工林和米槠次生林凋落物添加与去除对土壤呼吸的影响. 植物生态学报, 2016, 40(5): 447–457
[20] Wang Qingkui, Yu Youzhi, He Tongxin, et al. Above-ground and belowground litter have equal contribu-tions to soil CO2 emission: an evidence from a 4-year measurement in a subtropical forest. Plant and Soil, 2017, 421(1/2): 7–17
[21] Wan Songze, Liu Zhanfeng, Chen Yuanqi, et al. Effects of lime application and understory removal on soil microbial communities in subtropical eucalyptus L’Hér Plantations. Forests, 2019, 10(4): 338
[22] Ma Yuecun, Piao Shilong, Sun Zhenzhong, et al. Stand ages regulate the response of soil respiration to temperature in a Larix principis-rupprechtii planta-tion. Agricultural and Forest Meteorology, 2014, 184: 179–187
[23] Rey A, Pegoraro E, Tedeschi V, et al. Annual variation in soil respiration and its components in a coppice oak forest in Central Italy. Global Change Biology, 2002, 8(9): 851–866
[24] Fang Changming, Moncrieff J B. The dependence of soil CO2 efflux on temperature. Soil Biology and Biochemistry, 2001, 33(2): 155–165
[25] Pinheiro J, Debroy S, Bates D. Nlme: linear and nonlinear mixed effects models. R package version 3. 1–120. R Foundation for Statistical Computing, Vien-na, 2015
[26] Xu Shan, Liu Linli, Sayer E J. Variability of above-ground litter inputs alters soil physicochemical and biological processes: a meta-analysis of litterfall-manipulation experiments. Biogeosciences, 2013, 10 (11): 7423–7433
[27] Buchmann N. Biotic and abiotic factors controlling soil respiration rates in Picea abies stands. Soil Bio-logy and Biochemistry, 2000, 32(11/12): 1625–1635
[28] Prévost-Bouré N C, Soudani K, Damesin C, et al. Increase in aboveground fresh litter quantity over-stimulates soil respiration in a temperate deciduous forest. Applied Soil Ecology, 2010, 46(1): 26–34
[29] Sayer E J, Powers J S, Tanner E V J. Increased litterfall in tropical forests boosts the transfer of soil CO2 to the atmosphere. PLoS One, 2007, 2(12): e1299
[30] Schmidt M W I, Torn M S, Abiven S, et al. Persis-tence of soil organic matter as an ecosystem proper-ty. Nature, 2011, 478: 49–56
[31] Rasse D P, Rumpel C, Dignac M F. Is soil carbon mostly root carbon? Mechanisms for a specific sta-bilisation. Plant and Soil, 2005, 269(1/2): 341–356
[32] Lee M S, Nakane K, Nakatsubo T, et al. Seasonal changes in the contribution of root respiration to total soil respiration in a cool-temperate deciduous forest. Plant and Soil, 2003, 255(1): 311–318
[33] Bond-Lamberty B, Wang Chuankuan, Gower S T. Contribution of root respiration to soil surface CO2 flux in a boreal black spruce chronosequence. Tree Physiology, 2004, 24(12): 1387–1395
[34] Adekalu K O, Olorunfemi I A, Osunbitan J A. Grass mulching effect on infiltration, surface runoff and soil loss of three agricultural soils in Nigeria. Bioresource Technology, 2007, 98(4): 912–917
[35] 潘开文, 何静, 吴宁. 森林凋落物对林地微生境的影响. 应用生态学报, 2004, 15(1): 153–158
[36] Vose J M, Ryan M G. Seasonal respiration of foliage, fine roots, and woody tissues in relation to growth, tissue N, and photosynthesis. Global Change Biology, 2002, 8(2): 182–193
[37] Deutsch E S, Bork E W, Willms W D. Soil moisture and plant growth responses to litter and defoliation impacts in Parkland grasslands. Agriculture, Ecosys-tems & Environment, 2010, 135(1/2): 1–9
[38] Davidson E A, Belk E, Boone R D. Soil water content and temperature as independent or confounded factors controlling soil respiration in a temperate mixed hardwood forest. Global Change Biology, 1998, 4(2): 217–227
[39] Zhang W, Parker K M, Luo Y, et al. Soil microbial responses to experimental warming and clipping in a tallgrass prairie. Global Change Biology, 2005, 11(2): 266–277
[40] Ohashi M, Gyokusen K, Saito A. Measurement of carbon dioxide evolution from a Japanese cedar (Cryptomeria japonica D. Don) forest floor using an open-flow chamber method. Forest Ecology and Management, 1999, 123(2/3): 105–114
[41] Bahn M, Rodeghiero M, Anderson-Dunn M, et al. Soil respiration in European grasslands in relation to climate and assimilate supply. Ecosystems, 2008, 11(8): 1352–1367
[42] Conant R T, Steinweg J M, Haddix M L, et al. Ex-perimental warming shows that decomposition tem-perature sensitivity increases with soil organic matter recalcitrance. Ecology, 2008, 89(9): 2384–2391
[43] Davidson E A, Janssens I A, Luo Yiqi. On the varia-bility of respiration in terrestrial ecosystems: moving beyond Q10. Global Change Biology, 2006, 12(2): 154– 164
[44] Zhu Biao, Cheng Weixin. Rhizosphere priming effect increases the temperature sensitivity of soil organic matter decomposition. Global Change Biology, 2011, 17(6): 2172–2183
[45] 杨庆朋, 徐明, 刘洪升, 等. 土壤呼吸温度敏感性的影响因素和不确定性. 生态学报, 2011, 31(8): 2301–2311
Effects of Altered Plant Detritus Input on Soil Respiration and Its Temperature Sensitivity in a Pinus sylvestrisvar. mongolica Plantation
Abstract Six treatments (control (CK), litter removal (−L), litter addition (+L), root removal (−R), litter and root removal (−R−L), litter addition and root removal (−R+L)) were conducted in a Pinus sylvestris var. mongolica plantation in Saihanba, Hebei Province. Based on the results of the first growing season (May–September 2019) after the treatments, we aimed to evaluate the effects of different plant detritus input on soil respiration and its temperature sensitivity. The results show that: 1) soil respiration rate exhibited significant seasonal dynamics, with peak value in July–August and minimum value in late September. The average soil respiration rates of control, litter removal, litter addition, root removal, litter and root removal, litter addition and root removal treatments were (mean±SE) 2.20±0.17, 1.24±0.09, 2.40±0.07, 2.05±0.11, 1.04±0.07 and 2.28±0.17 µmol/(m2·s) respectively. Compared to the CK, −L and −R−L significantly reduced soil respiration rate by 43.6% and 52.7%, respectively; 2) soil respiration in the growing season was significantly and exponentially correlated with soil temperature (p<0.01) among different treatments. The temperature sensitivity of soil respiration (Q10 values) were 2.32±0.13, 2.37±0.05, 2.41±0.09, 2.42±0.14, 2.09±0.08 and 2.87±0.11, respectively. Aboveground litter treatment had significant effects on both average rate and Q10 value of soil respiration (p<0.05), while belowground root treatment did not (p>0.05); 3) compared to CK, soil moisture was significantly higher in all root removal treatments (−R, −R−L, −R+L) likely due to the lack of water uptake by roots, but soil temperature did not change significantly. In most treatments (except −R and −R+L), soil respiration and soil moisture showed a significant parabolic relationship during the growing season, and the threshold of soil moisture was about 15% (v/v). In conclusion, the results showed that litter removal had significant effects on growing season soil respiration and its temperature sensitivity in the Pinus sylvestris var. mongolica plantation, but root removal had no significant effect in the first growing season after the manipulation.
Key words litter addition; litter removal; root removal; Pinus sylvestris var. mongolica plantation; soil respiration; temperature sensitivity
doi: 10.13209/j.0479-8023.2021.010
国家自然科学基金(31670525, 31988102)和中国科学院仪器设备功能开发技术创新项目(2019g0075)资助
收稿日期: 2020–03–04;
修回日期: 2020–08–03