碳纳米管对天然有机质氯化消毒副产物生成的影响
李慧敏1 陈学姣2 尤明涛1 孙卫玲1,†
1.北京大学环境科学与工程学院, 水沙科学教育部重点实验室, 北京 100871; 2.北京大学深圳研究生院环境与能源学院, 深圳市重金属污染控制与资源化重点实验室, 深圳 518055; †通信作者, E-mail: wlsun@pku.edu.cn
摘要 以应用广泛的碳纳米材料多壁碳纳米管(CNTs)和水体中普遍存在的天然有机质(NOMs)为研究对象, 探讨 CNTs 对两种不同种类 NOMs (Suwannee river standard humic acid, HASR 和 Suwannee river standard fulvic acid, FASR)氯化生成消毒副产物的影响。结果表明, 与单一 NOMs 体系相比, CNTs 的存在会增加 HASR 和FASR 氯化生成三卤甲烷(trihalomethanes, THMs)和卤代乙酸(halogenated acetic acid, HAAs)的产量和初始速率。这是由于 CNTs 和 NOMs 均可以作为消毒副产物的前体物, 混合体系中氯化反应活性位点数量增多, 因此产量和速率都有所提升。并且, 无论体系中是否存在 CNTs, HASR 生成 THMs 和 HAAs 的初始速率均高于FASR, 这是因为 HASR 的芳香共轭程度高于 FASR, 更易与次氯酸反应。此外, 由于 CNTs 对 HASR 的吸附量高于 FASR, 因此 CNTs 对 HASR 氯化生成消毒副产物的影响大于 FASR。
关键词 碳纳米材料; 天然有机物; 消毒副产物; 氯化
碳纳米材料由于其优异的机械和热电性能而广泛地应用于水处理、传感器和航天材料等领域[1-3], 产量和市场份额与日俱增[4-5]。在生产、运输、储存和处理处置过程中, 碳纳米材料会不可避免地释放到环境介质中[6]。有研究发现, 水样中碳纳米管(carbon nanotubes, CNTs)在消毒过程中可以生成消毒副产物, 如三卤甲烷(trihalomethanes, THMs)、卤代乙酸(halogenated acetic acid, HAAs)和 N-亚硝基二甲胺等[7-9]。与其母体相比, 氯化后的碳纳米材料往往性质更稳定, 流动性和迁移性更强, 因此潜在的危害性可能会增大[10-11]。也有研究表明, CNTs对水体中双酚 A 氯化生成 THMs 有抑制作用, 且抑制程度与 CNTs 的浓度和官能团种类有关[12]。
天然有机质(natural organic matters, NOMs)是一种含氧、氮和硫等官能团的芳香族和脂肪族有机化合物的非均相混合物, 普遍存在于水体中[13-14]。在氯消毒过程中, NOMs 的羧酸、烯醇氢、酚羟基、醇羟基、醚、酮、醛、酯、内酯、酰胺和胺等官能团均能与氯或其他消毒剂发生氧化、加成和取代反应[15], 生成消毒副产物。NOMs 中疏水性和亲水性官能团含量的不同会影响 THMs 和 HAAs 的形成, 疏水性 NOMs 更有利于 HAAs 的产生[16]。
消毒副产物具有潜在的致畸、致癌和致突变性, 且在氯化饮用水中普遍存在[17-18], 因此研究消毒副产物的形成机制对公共卫生和人体健康具有重要意义。迄今为止, 消毒副产物的研究大多只关注单一的有机物体系[19-22]或单一的碳纳米材料体系[7-9], 针对有机物-碳纳米材料混合体系氯化过程中消毒副产物形成的研究较少。由于碳纳米材料的排放量日益增长, 进入水环境中的碳纳米材料会不可避免地与水体中的 NOMs 发生相互作用, 从而影响其氯化消毒副产物的生成[23-25]。目前, 关于这一混合体系的反应机制仍不清楚。
本研究以典型碳纳米材料——多壁碳纳米管和水体中普遍存在的 NOMs 为研究对象, 探讨 CNTs对 NOMs 氯化过程消毒副产物生成的影响及机理, 研究结果可为碳纳米材料和 NOMs 复合污染体系氯消毒过程中消毒副产物生成的预测与控制提供科学依据。
1 材料与方法
1.1 主要试剂
次氯酸钠(NaClO)溶液(4%)和硫代硫酸钠购自Macklin Biochemical Co., Ltd (中国上海)。羧基(2.56%)碳纳米管购自中国科学院成都有机化学有限公司, 纯度>95%, 外径为 8~15nm, 内径为 3~5nm, 长度为 0.5~2 μm。
两种 NOMs 从国际腐殖酸协会(International Humic Substances Society, IHSS)购买, 分别为Su-wannee river standard HA (HASR)和 Suwannee river standard FA (FASR)。NOMs 储备液配制方法: 取 30mg 的 NOMs 固体溶解于 20mL 超纯水中(加入少量NaOH 溶解), 在 25°C 条件下振荡 24 小时, 置于棕色瓶中避光冷藏。
1.2 消毒实验
氯化消毒实验在 125mL 碘量瓶中进行, 用磷酸盐缓冲溶液(7.4±0.2, 20mM)控制体系的 pH 值。将CNTs (10mg/L)或 NOMs (5mg/L)加入碘量瓶中, 然后加入次氯酸钠溶液, 初始氯浓度(以 Cl2 计)为 10mg/L。将碘量瓶置于培养箱中, 在 180rpm 和 25± 1°C 条件下反应。在不同的时间取出碘量瓶, 并用0.5gNa2S2O3 进行淬灭反应, 取 5mL 悬浮液测定消毒副产物的浓度。在相同的条件下, 按照相同的程序, 对 NOMs-CNTs 混合体系进行氯化实验。
1.3 NOMs表征方法
荧光光谱分析采用分子荧光光谱仪(Model Ca-ry Eclipse, Varian, 美国), 测定不同 NOMs 的三维荧光光谱(excitation emission matrix, EEM)。激发波长范围为 190~550nm, 发射波长范围为 190~550nm, 扫描速度为 800nm/min, 电压为 800 V。
紫外吸收光谱分析采用紫外分光光度计(UV-1800, Shimadzu, 日本), 测定 NOMs 紫外可见光吸收光谱, 波长扫描范围为 200~900nm。测定前, 将样品 DOC 浓度稀释到 8~10mg/L(采用总有机碳分析仪(TOC-VCPN, Shimadzu, 日本)测定 DOC 浓度)。计算样品在 254 nm 时吸光度与 DOC 浓度的比值, 求得样品的单位 DOC 紫外吸收强度(specific ultraviolet absorbance, SUVA)。
NOMs元素组成、13C NMR 碳形态分布以及官能团含量数据来自 IHSS 网站 (http://humic-substances. org/)。
1.4 CNTs表征方法
用纳米粒度仪(ZS90, Malvern Instruments Ltd., Worcestershire, 英国), 在 pH 为 7.4 的条件下测量CNTs 和 CNTs-NOMs 的粒径及 Zeta 电位随时间的变化。利用 Smoluchowski 模型计算 Zeta 电位的电泳迁移率, 每个样品至少测量6次。
1.5 消毒副产物分析方法
1.5.1 THM浓度测定
用吹扫捕集(Teledyne Tekmar)-气相色谱/质谱(GC-MSD, Agilent 7890B和5977B)分析 THMs, 通过外标法计算 THMs 浓度。吹扫捕集样品浓缩器条件: 样品/水稀释比(体积比)为 1/1, 样品体积为 5mL, N2 吹扫流量为 40mL/min, 吹扫时间为 11min(40°C), 解吸时间为 2min(190°C), 烘烤时间为 8 min(200°C)。
使用 30m×0.25mm I.D., 0.14μm 膜厚度 DB-624 (J&W Scientific, 美国)毛细管柱进行色谱分离。GC 在不分流模式下操作, 喷射器端口温度在200°C 下进行正常操作。GC-MS 界面温度为 250°C。载气流速为 1mL/min。GC 温度程序设定为 38°C (保持 1.8min), 然后以 10°C/min 的速度升至 120°C, 最后以 15°C/min的速度升至 240 °C (保持2 min)[12]。
1.5.2 HAAs浓度测定
用气相色谱法分析样品中的 HAAs, 以甲基叔丁基醚(MTBE)为萃取剂, 通过内标法计算 HAAs浓度, 使用 30 m×0.32 mm I.D., 0.25 μm膜厚度的石英毛细管柱进行色谱分析。气相色谱条件的设定参考标准方法《水质卤代乙酸类化合物的测定气相色谱法》(HJ758—2015)。
1.5.3余氯浓度测定
利用分光光度法分析样品中的余氯, 以N,N-二乙基-1,4-苯二胺为显色剂, 采用 10mm 比色皿, 在515nm 波长下测定吸光度, 具体操作流程参考《水质游离氯和总氮的测定 N, N-二乙基-1,4-苯二胺分光光度法》(HJ/T 586—2010)。
1.6 数据分析
氯化后 THMs (或 HAAs)的初始生成速率 Ri (μg/(L·h))的计算公式[26]为
Ri = d[THMs] / dt, (1)
其中, [THMs]为时刻 t 的 THMs 浓度(μg/L), t 为反应时间(h)。
2 结果与讨论
2.1 NOMs性质表征
HASR 和 FASR 样品元素组成以及 13C NMR 分析结果见表 1。相对于其他元素, HASR 和 FASR 的含碳量和含氧量较高。HASR 含碳量(52.63%)高于FASR (52.34%), 含氧量(42.04%)低于 FASR(42.98%)。有机物氧、氮含量之和与含碳量的摩尔比即为极性指数, 可用于估算有机物分子的吸附性能[27]。FASR的极性指数稍高于 HASR。根据 13CNMR 分析结果, 可计算有机物的芳香度, 即芳香碳含量 Cm芳与脂族碳含量 Cm脂之比[28]。HASR 的芳香度(0.43)高于FASR (0.35), 表明 HASR 疏水性强, 极性弱, 与元素组成分析结果一致。
对比不同 NOMs 官能团含量, HASR 的羧基含量(9.13%)低于 FASR (11.7%), 酚羟基含量(3.72%)高于 FASR (2.84%)(图 1(b))。根据 HASR 和 FASR 的紫外全扫描曲线(图 1(a)), 可计算出 SUVA 和 E2/E3 (图 1(b))。其中, SUVA 表示 254nm 波长时, 单位DOC 的紫外吸收强度。SUVA 值越高, 有机物含有的芳香不饱和键越多, 芳香碳的含量也越高[29]。HASR的 SUVA 值高于 FASR, 表明 HASR 芳香碳含量较高[30], 与元素组成和 13C NMR 的分析结果一致。
E2/E3 表示在 250 nm 和 365 nm 波长下吸光度的比值, 其值越高, 说明有机物中碳原子结合程度越低。E2/E3 与 NOMs 腐殖化程度(即有机物的分解)、分子量、芳香性和极性等性质相关[31], 通常随着芳香度和分子量的降低而增加[32]。HASR 的 E2/E3 值低于 FASR, 说明 HASR 的芳香度更高, 与 SUVA分析结果一致。
表1 NOMs样品元素组成和13CNMR分析结果
Table 1 Elemental compositions and 13C NMR for NOMs samples
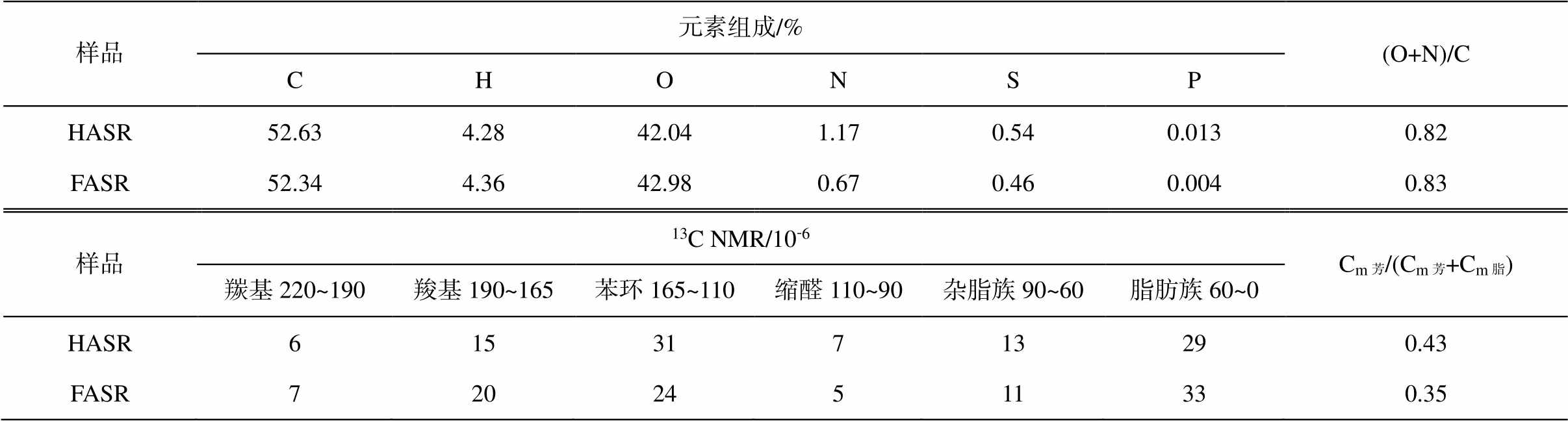
样品元素组成/%(O+N)/C CHONSP HASR52.634.2842.041.170.540.0130.82 FASR52.344.3642.980.670.460.0040.83 样品13C NMR/10-6Cm芳/(Cm芳+Cm脂) 羰基220~190羧基190~165苯环165~110缩醛110~90杂脂族90~60脂肪族60~0 HASR61531713290.43 FASR72024511330.35
说明: 数据来自国际腐殖质协会网站(http://humic-substances.org/)。
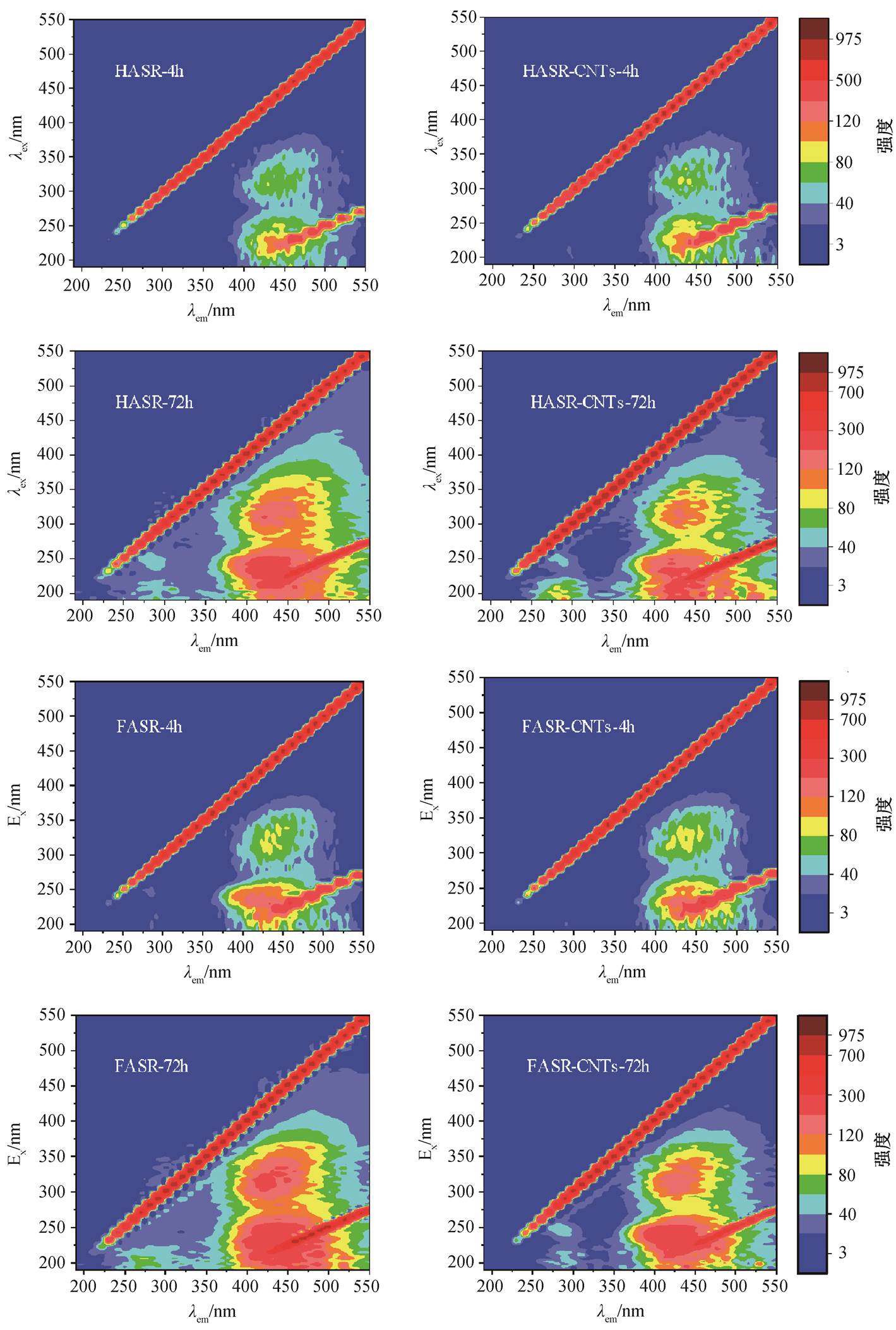
根据荧光光谱中激发和发射波长的范围, 可区分 HASR (250nm<λex<420nm, 380nm<λem<520nm)与 FASR (λex<250nm, λem>350nm)[33]。如图 1(c)和(d)所示, 样品中存在两个特征峰, α 峰位于 λex/λem= 350/460nm 处, α'峰位于 λex/λem=230/440nm 处, 与文献[34]一致。HASR 样品中两个特征峰强度比值(Iα'/Iα)为 1.19, FASR 样品中 Iα'/Iα为 1.20。Patel-Sorrentino 等[35]发现, 河流水样在不同的 pH 条件下, α'峰均呈现出比 α 峰更强的荧光强度, 本研究的三维荧光结果与之一致。
2.2 消毒副产物生成动力学
2.2.1 CNTs氯化生成消毒副产物动力学
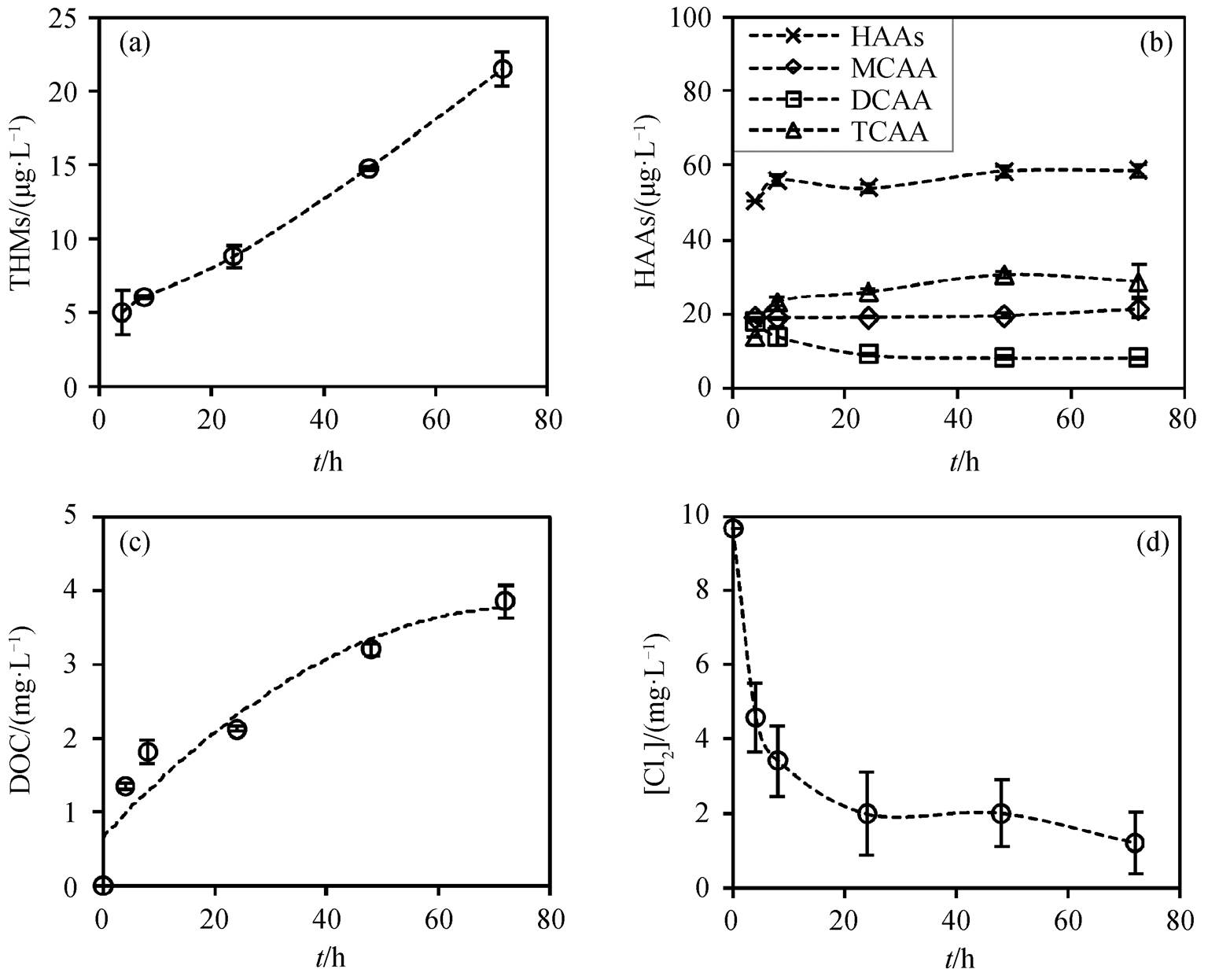
在 CNTs 氯化过程中, 检出的 THMs 主要是三氯甲烷[12]; 检出 3 种 HAAs, 分别为一氯乙酸(monoch-loroacetic acid, MCAA)、二氯乙酸(dichloroacetic acid, DCAA)和三氯乙酸(trichloroacetic acid, TCAA)。
氯化反应 4 小时后, CNTs 快速形成 THMs, 浓度为 5.87µg//L, 随后 THMs 生成量稳步增加(图 2 (a))。初始反应速率 Ri 为 1.26µg/(L·h), 显著低于文献[12]报道的反应速率, 主要原因是本实验中[Cl2]0浓度为 10mg/L, 明显低于文献[12]中的氯浓度。
HAAs 生成量随氯化反应的进行而升高, 并在24 小时达到平衡(图 2(b))。初始反应速率 Ri 为 12.7 µg/(L∙h)。3 种 HAAs 生成量排序为 TCAA>MCAA> DCAA,这是因为前体物 CNTs 中 α-OH 和共轭结构较多, 更有利于生成 TCAA[36]。对比不同的消毒副产物, HAAs 生成量(59.2µg/L)明显高于 THMs (21.6µg/L)。Verdugo 等[9]也发现, CNTs 氯化生成的HAAs 量(102µg/L)高于 THMs (35µg/L), 本研究结果与之相似。文献[9]中较高的消毒副产物产生量可能是初始氯浓度较高(15 mg/L)所致。
随着消毒时间增加, 反应体系中 DOC 含量逐渐上升(图 2(c)), 主要原因是 CNTs 被氯氧化生成小分子的有机碳。氯的初始消耗速率非常快, 反应前4 小时, 氯浓度从 10mg/L 快速降至 4.59mg/L, 并在 72 小时内降至 1.19mg/L(图 2(d)), 进一步证实体系中的 CNTs 被氯氧化, 且反应速率较快。
2.2.2 NOMs氯化生成消毒副产物动力学
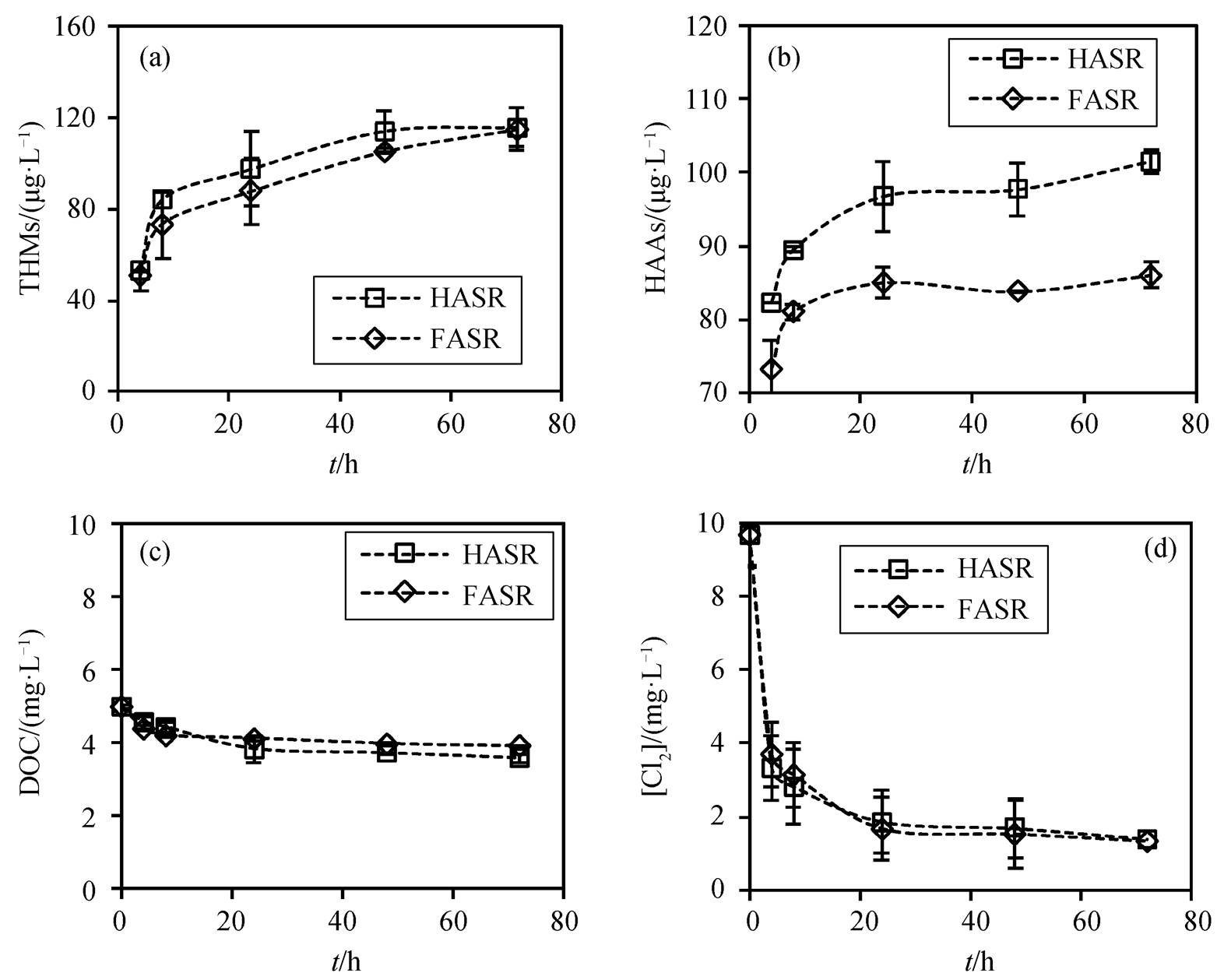
随着氯化时间增长, NOMs 氯化产物中 THMs生成量在 48 小时内呈增加趋势, 48~72 小时内基本上保持稳定, HAAs 生成量 24 小时基本上达到平衡。Lu 等[37]发现, 消毒副产物浓度随着反应时间的增加而增加, 但在 48~168 小时内未观察到显著的差异。本研究的消毒副产物生成规律与之相似,原因可能是 NOMs 的活性消毒副产物前体位点在 48 小时内几乎被氯耗尽。NOMs 的 THMs 生成量高于HAAs (图 3(a)和(b)), 而 CNTs 的 THMs 生成量低于HAAs, 可能是因为 CNTs 共轭结构的含量高于NOMs, 更有利于HAAs的生成[16]。
两种 NOMs, HASR 和 FASR 生成 THMs 的初始反应速率分别为 7.75 和 5.71µg/(L∙h), 生成HAAs 的初始速率分别为 13.3 和 12.6µg/(L∙h)。HASR 的THMs 和 HAAs 生成量高于 FASR, 与文献[38]报道结果相同, 可能是 HASR 的 SUVA 值较高导致。这可能是由于次氯酸分子更易进入 HASR大分子的活性位点中,与 HASR 结合形成氯化中间体,再与中间体结合生成消毒副产物[39]。
氯化过程中, 反应体系中 DOC 的含量略有下降(图 3(c)), 这是由于氯可以在一定程度上矿化NOMs[40], 使体系中的有机碳转化为无机碳。氯的初始消耗速率非常快, 反应前 4 小时, 氯的浓度从10mg/L 快速降至 3.33mg/L (HASR)和 3.69mg/L (FASR), 并在 72 小时内降至 1.33 mg/L (图 3(d))。
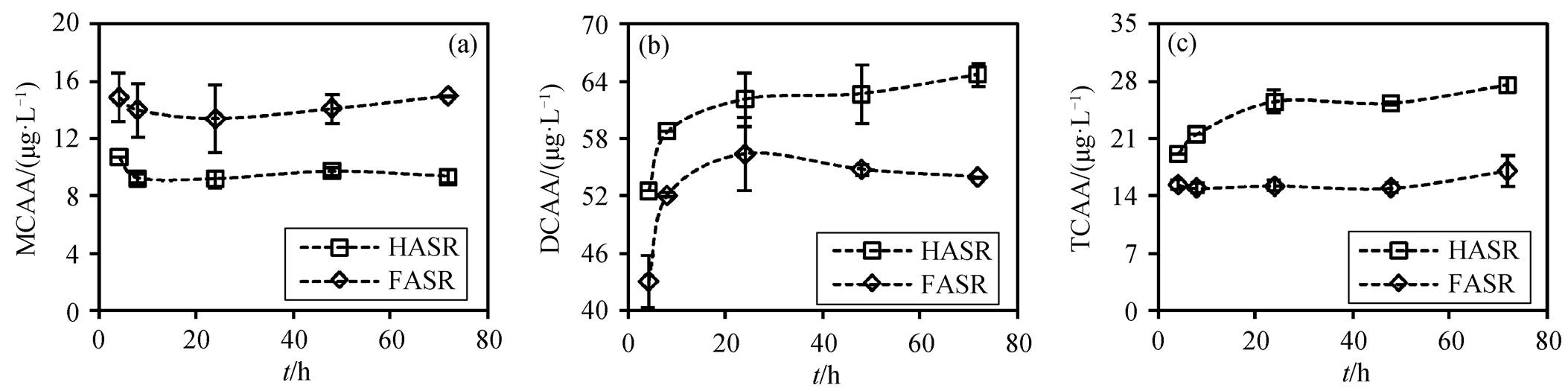
HASR 和 FASR 氯化生成 HAAs 含量排序为DCAA>TCAA>MCAA, 与文献[41-42]报道的结果相似。对比不同的有机质, HASR 生成的 DCAA和TCAA 量高于 FASR, 生成的 MCAA 量低于 FASR(图 4)。Reckhow 等[38]指出 HASR 比同一来源的FASR 产生更多的 DCAA 和 TCAA, 本研究结果与之一致。在氯化过程中, NOMs 活性位点的 α-H被Cl 取代, 经水解后生成 DCAA[43]。TCAA 的生成机理有两种: 1) DCAA 的氯取代; 2) TCAA 衍生物与氯反应生成[38]。Reckhow 等[38]指出, DCAA 含吸电子基团, 氯取代较难发生, 而 TCAA 衍生物含共轭结构, 电子云密度较高, 更有利于次氯酸进攻。因此, 推测 TCAA 的生成机理为上述第 2 种, 且当 α-OH 或共轭结构含量较高时, 体系中更容易生成TCAA[36,38,43-44]。
2.2.3 CNTs对NOMs氯化生成消毒副产物的影响
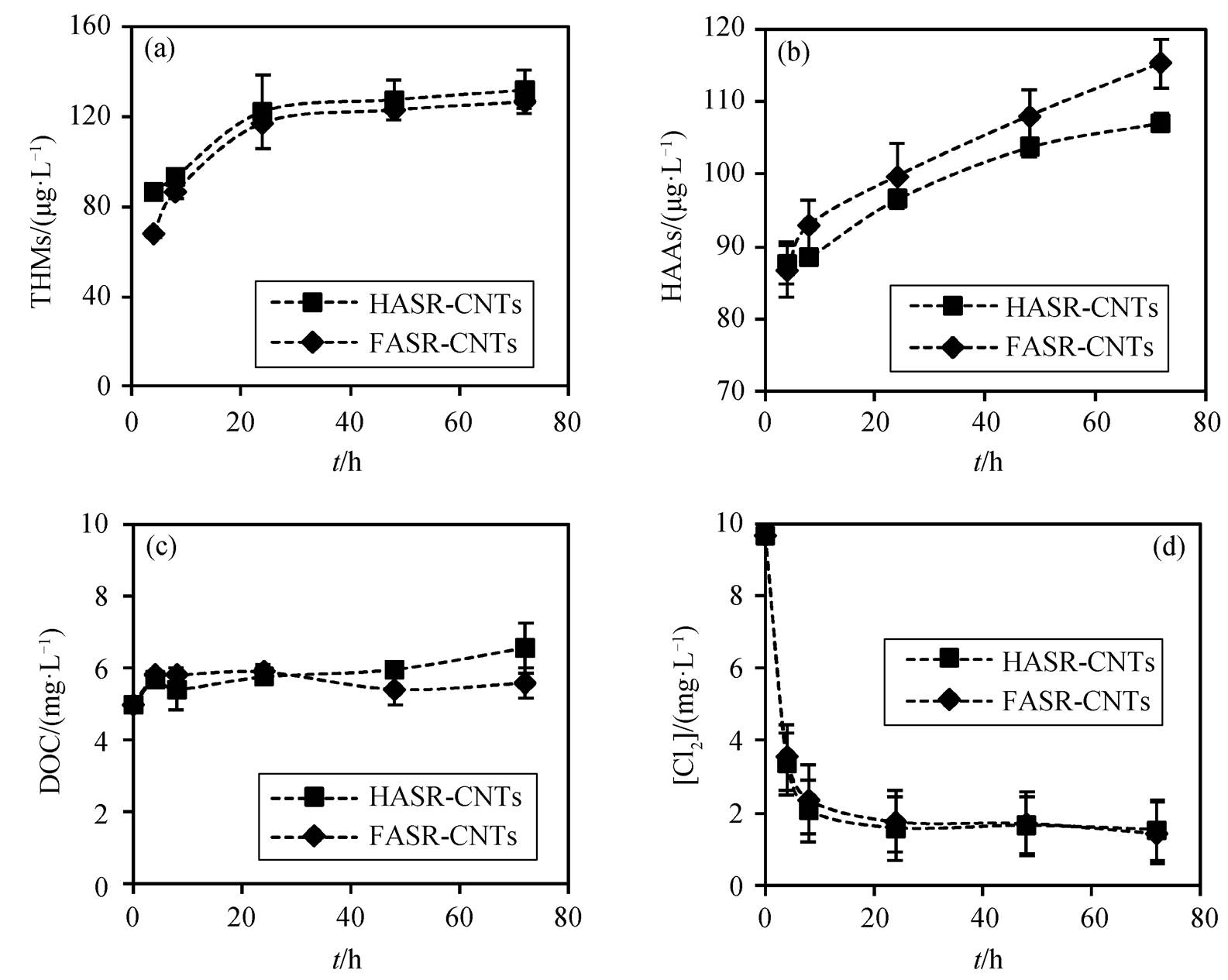
NOMs-CNTs 混合体系中, THMs 生成量在 24小时达到平衡(图 5(a)), HASR-CNTs 和 FASR-CNTs混合体系的 THMs 初始生成速率 Ri 分别为 21.7 和16.9µg/(L∙h), HASR-CNTs 生成的 THMs 量略高于FASR-CNTs, 这与单一体系 HASR 生成 THMs 量高于 FASR 一致。HAAs 生成量在 72 小时仍未达到平衡(图 5(b)), HASR-CNTs 和 FASR-CNTs 混合体系的HAAs 初始生成速率 Ri 分别为 21.9 和 21.6µg/(L∙h), HASR-CNTs 生成的 HAAs 量略低于 FASR-CNTs, 其原因将在 2.3 节讨论。随着消毒时间增加, 混合体系中 DOC 含量有所增加(图 5(c)), 主要原因是CNTs 可以与氯反应生成小分子含碳有机物, 从而增加体系中 DOC 含量。氯消耗速度很快, 反应前 4小时, 氯浓度减少 50%以上, 从 10mg/L 快速降至3.36mg/L (HASR-CNTs)和 3.53mg/LSR (FASR-CNTs),并在 24 小时消耗近90% (图5(d))。
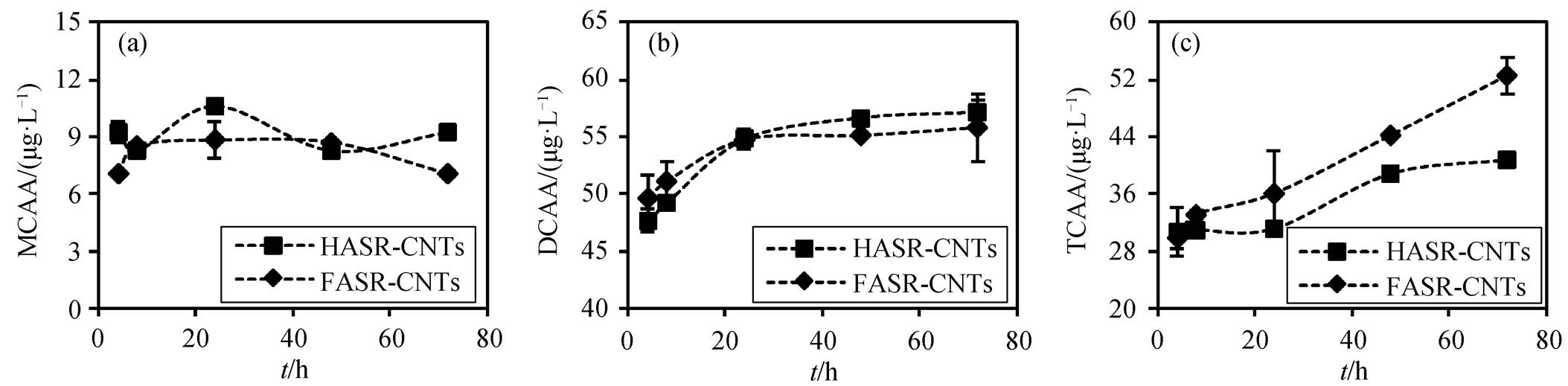
混合体系 HASR-CNTs 和 FASR-CNTs 生成的HAAs 排序为 DCAA>MCAA, 且分别在 48 和 4 小时达到平衡(图 6(a)和(b))。TCAA 的生成量在 72 小时仍未达到平衡(图 6(c)), 因此 NOMs-CNTs 混合体系中 HAAs 生成量平衡时间延长。混合体系中, HASR-CNTs 的 HAAs 生成量稍低于 FASR-CNTs(图 5 (b))。进一步分析 3 种 HAAs 的生成动力学可知, HASR-CNTs 体系的 MCAA 和 DCAA 生成量稍高于 FASR-CNTs (图 6(a)和(b)), 与单一体系规律一致。但是, TCAA 的生成量明显低于 FASR-CNTs (图 6(c)), 导致其产生的 HAAs 总量低于 FASR-CNTs 体系。尽管 CNTs 的 α-OH 含量和共轭程度更高, 但在混合体系中, CNTs 和 HASR 的相互作用强于 CNTs 和 FASR, 导致 CNTs 表面更多的活性位点被 HASR 占据, 因此 HASR-CNTs 氯化生成的TCAA 量低于FASR-CNTs。
对比不同反应体系消毒副产物生成量可知, 混合体系的 THMs 和 HAAs 生成量均高于单一体系, 而低于两个单一体系的加和(表 2), 推测是由于混合体系中 CNTs 和 NOMs 均可以生成消毒副产物, 相比于单一体系, 前体物浓度提高, 因此生成的消毒副产物含量高于单一体系。在混合体系中, CNTs和 NOMs 可能会相互作用, 导致生成消毒副产物的活性位点减少, 同时反应过程中氯的含量不断减少, 因此混合体系中消毒副产物的产量低于两个单一体系的加和。
由表 2 可知, 混合体系的初始反应速率均高于单一体系。不同体系生成 THMs 的初始速率 Ri 排序为 HASR-CNTs (21.7μg/(L·h))>FASR-CNTs (16.9μg/ (L·h))>HASR (13.3μg/(L·h))>FASR (12.6 μg/(L·h))。不同体系生成 HAAs 的初始速率 Ri 排序为 HASR-CNTs (21.9μg/(L·h))>FASR-CNTs (21.6μg/(L·h))>HASR (20.6μg/(L·h))>FASR (18.3μg/(L·h))。这是由于混合体系中 CNTs 和 NOMs 均可作为前体物, 体系中产生消毒副产物的活性位点数量多于单一体系, 同时反应初期氯浓度较高并不是主要的速率限制因素, 因此混合体系的初始速率高于单一体系。
表2 不同体系消毒副产物生成动力学参数
Table 2 Kinetic parameters of DBPs formation in different systems
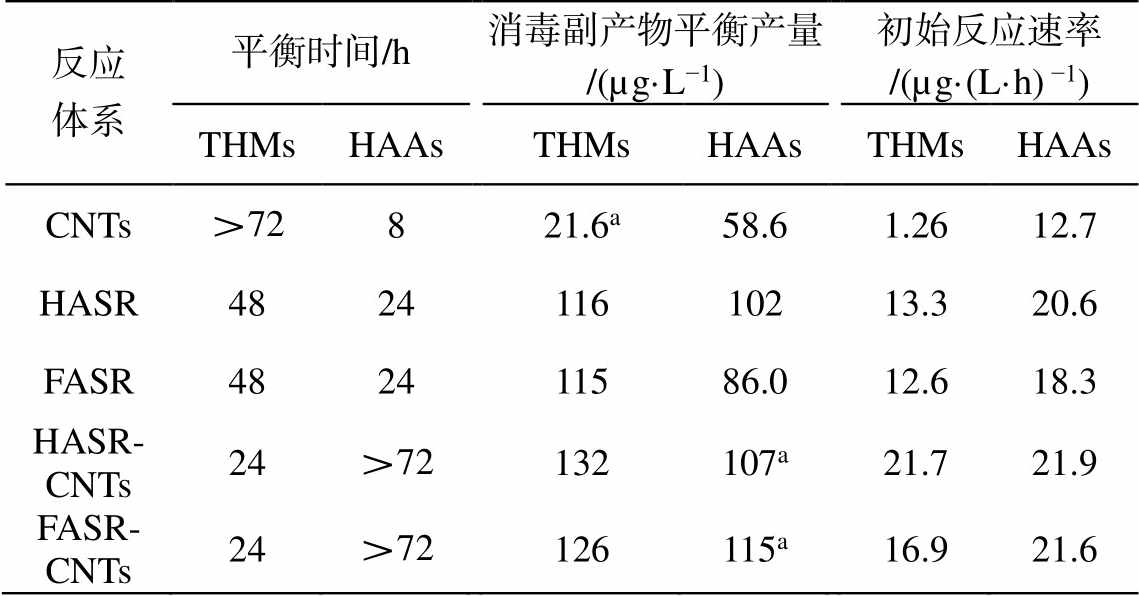
反应体系平衡时间/h消毒副产物平衡产量/(µg·L−1)初始反应速率/(µg·(L·h) −1) THMsHAAsTHMsHAAsTHMsHAAs CNTs>72821.6a58.61.2612.7 HASR482411610213.320.6 FASR482411586.012.618.3 HASR-CNTs24>72132107a21.721.9 FASR-CNTs24>72126115a16.921.6
注: a表示该体系中反应未达到平衡, 显示为 72 小时的产量。
在平衡时间方面, THMs 和 HAAs 的生成表现出不同的规律(表 2)。混合体系生成 THMs 的平衡时间为 24 小时, 相比于单一体系(CNTs 生成 THMs 的平衡时间>72 小时,NOMs 生成 THMs 的平衡时间为 48 小时), CNTs 的存在缩短了 THMs 生成达到平衡的时间, 推测是 CNTs 与 NOMs 的相互作用, 导致前体物团聚程度降低, 生成消毒副产物的活性位点更加暴露, 因此平衡时间缩短。混合体系生成HAAs 在 72 小时仍未达到平衡, 而单一体系 CNTs和 NOMs 分别在 8 和 24 小时就达到平衡, 说明CNTs 的存在延长了生成 HAAs 达到平衡的时间, 推测是由于 CNTs 主要通过 π-π 共轭作用和疏水作用吸附 NOMs, 因此 NOMs 共轭结构主要与 CNTs作用, 不利于次氯酸的进攻, 导致混合体系生成HAAs 的平衡时间增加。
2.3 CNTs 影响 NOMs 氯化产生消毒副产物的机理
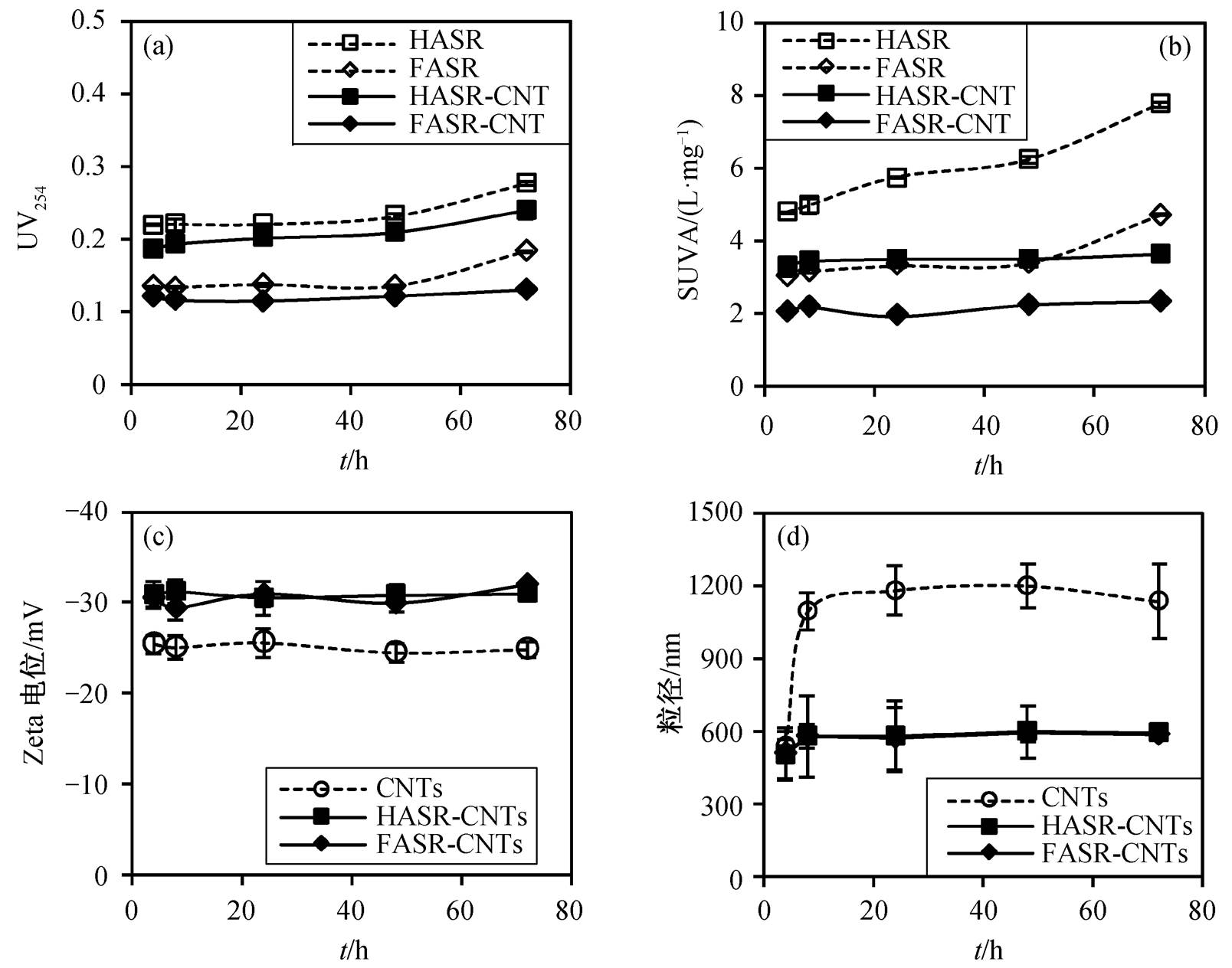
随着消毒时间增加, UV254 有增加的趋势(图 7 (a)), 可能是由于反应中生成的新物质增加了体系的吸光度。混合体系 UV254 均低于单一体系, 说明混合体系的上清液中 NOMs 含量下降, 证实 CNTs对 NOMs 的吸附作用。单一体系 HASR 的 SUVA 明显高于 FASR(图 7(b)), 这是因为 HASR 的芳香度较高[30](表 1)。NOMs-CNTs 混合体系的 SUVA 低于单一体系, 说明单一体系的芳香度高于混合体系, 即混合体系中芳香度高的 NOMs 被 CNTs 吸附。考虑到 CNTs 的高度共轭结构, 可推测二者之间的作用机理为疏水作用和 π-π 共轭作用, 这也与文献中结果[23,30,45]一致。由于 CNTs 对 NOMs 的吸附量与有机物的芳香性有很好的正相关关系[23,30], 因此CNTs 对芳香碳含量较高的 HASR 吸附量高于FASR, 导致 CNTs 对 HASR-CNTs 混合体系中THMs 和 HAAs 的生成动力学影响比对 FASR-CNTs混合体系的影响更强。
CNTs 的 zeta 电位为−24.8mV, 粒径约为 1200 nm, NOMs 因其表面含酚羟基和羧基等官能团而带负电荷(图 7), 二者存在静电斥力作用。但是, CNTs通过疏水作用和 π-π 共轭作用吸附 NOMs[23,30,45], 吸附 NOMs 后 CNTs 的 zeta 电位下降(约为−31.0 mV), 使得 CNTs 颗粒之间静电斥力增大, 抑制 CNTs 团聚, 粒径变小(590nm)(图 7(c)和(d))。混合体系中的CNTs 团聚程度降低, 更有利于次氯酸的进攻, 这也可能是混合体系中 THMs 和 HAAs 初始生成速率高于单一体系的原因之一。
随着氯化时间的延长, 单一体系和混合体系的荧光强度都在增加(图 8), 与 UV254 和 SUVA的 变化规律相同。反应 72 小时后, 在 λex/λem=200/295nm和 λex/λem=250/295nm 处增加两个荧光吸收峰, 推测为 NOMs 与氯反应生成的氧化产物[46-47]。对比单一体系 NOMs 和混合体系 NOMs-CNTs 的荧光光谱, 氯化 4 小时后, 两个体系荧光强度相近; 氯化 72 小时后, 单一体系的荧光强度明显高于混合体系。这是由于混合体系中消毒副产物的产量更高, 消耗的NOMs 前体物较多, 或部分 NOMs 被 CNTs 吸附, 导致混合体系的荧光强度降低, 与紫外吸收结果(图7(a))一致。
3 结论
本文研究 CNTs 对 HASR 和 FASR 氯化过程中生成 THMs 和 HAAs 的影响。CNTs 单一体系中, CNTs 氯化生成的 HAAs 量高于 THMs。NOMs 单一体系中, 氯化 THMs 生成量高于 HAAs。由于HASR 的芳香程度高于 FASR, 导致 HASR 生成的消毒副产物的量更高。
NOMs-CNTs 混合体系氯化消毒副产物产生量高于 CNTs 和 NOMs 单一体系。CNTs 的存在缩短了混合体系生成 THMs 的平衡时间, 但延长了生成HAAs 的平衡时间。相比于单一体系, 混合体系的初始反应速率较快。不同体系生成 THMs 的初始速率 Ri (μg/(L·h))排序为 HASR-CNTs (21.7)>FASR-CNTs (16.9)>HASR (13.3)>FASR (12.6), 不同体系生成 HAAs 的初始速率 Ri (μg/(L·h))排序为 HASR-CNTs (21.9)>FASR-CNTs (21.6)>HASR (20.6)>FASR(18.3)。CNTs 可通过疏水作用和 π-π 共轭作用吸附 NOMs, 且对芳香性更强的 HASR 吸附量高于FASR, 因此CNTs 对 HASR 氯化生成消毒副产物的影响强于FASR。
参考文献
[1] Mauter M S, Elimelech M. Environmental applica-tions of carbon-based nanomaterials. Environmental Science & Technology, 2008, 42(16): 5843–5859
[2] Pan Bo, Xing Baoshan. Adsorption mechanisms of organic chemicals on carbon nanotubes. Environmen-tal Science & Technology, 2008, 42(24): 9005–9013
[3] Mao H Y, Laurent S, Chen W, et al. Graphene: pro-mises, facts, opportunities, and challenges in nano-medicine. Chemical Reviews, 2013, 113(5): 3407–3424
[4] Lehman J H, Terrones M, Mansfield E, et al. Evaluating the characteristics of multiwall carbon nanotubes. Carbon, 2011, 49(8): 2581–2602
[5] Ren Wencai, Cheng Huiming. The global growth of graphene. Nature Nanotechnology, 2014, 9(10): 726–730
[6] Petersen E J, Zhang L, Mattison N T, et al. Potential release pathways, environmental fate, and ecological risks of carbon nanotubes. Environmental Science & Technology, 2011, 45(23): 9837–9856
[7] Du Tingting, Wang Yingying, Yang Xin, et al. Me-chanisms and kinetics study on the trihalomethanes formation with carbon nanoparticle precursors. Che-mosphere, 2016, 154: 391–397
Verdugo E M, Krause C, Genskow K, et al. N-functionalized carbon nanotubes as a source and precursor of N-nitrosodimethylamine: implications for environmental fate, transport, and toxicity. Environmental Science & Technology, 2014, 48(16): 9279–9287
[8] Verdugo E M, Nelson K J, Bako C M, et al. Formation of trihalomethanes and haloacetic acids during chlori-nation of functionalized carbon nanotubes. Environ-mental Science: Nano, 2016, 3(6): 1327–1339
[9] Li Yao, Yang Nan, Du Tingting, et al. Transformation of graphene oxide by chlorination and chloramina-tion: Implications for environmental transport and fate. Water Research, 2016, 103: 416–423
[10] Wu J, Li W, Fortner J D. Photoenhanced oxidation of C60 aggregates (nC60) by free chlorine in water. Environmental Science: Nano, 2017, 4(1): 117–126
[11] Chen Xuejiao, You Mingtao, Wei Jingmiao, et al. Carbon nanotubes affect the formation of trihalome-thanes during chlorination of bisphenol A. Chemical Engineering Journal, 2019, 370: 337–345
[12] Matilainen A, Vepsalainen M, Sillanpaa M. Natural organic matter removal by coagulation during drink-ing water treatment: a review. Advances in Colloid and Interface Science, 2010, 159(2): 189–197
[13] Kim K T, Edgington A J, Klaine S J, et al. Influence of multiwalled carbon nanotubes dispersed in natural organic matter on speciation and bioavailability of copper. Environmental Science & Technology, 2009, 43(23): 8979–8984
[14] Thurman E M. Organic geochemistry of natural wa-ters. Dordrecht: Springer Netherlands, 1985
[15] Hua G H, Reckhow D A. Characterization of disin-fection byproduct precursors based on hydrophobicity and molecular size. Environmental Science & Tech-nology, 2007, 41(9): 3309–3315
[16] Bull R J, Birnbaum L S, Cantor K P, et al. Water chlorination: essential process or cancer hazard. Fundamental & Applied Toxicology, 1995, 28(2): 155–166
[17] Villanueva C M, Cantor K P, Cordier S, et al. Disinfection byproducts and bladder cancer: a pooled analysis. Epidemiology, 2004, 15(3): 357–367
[18] Hu J Y, Aizawa T, Ookubo S. Products of aqueous chlorination of bisphenol A and their estrogenic activity. Environmental Science & Technology, 2002, 36(9): 1980–1987
[19] Gallard H, von Gunten U. Chlorination of natural organic matter: kinetics of chlorination and of THM formation. Water Research, 2002, 36(1): 65–74
[20] Vikesland P J, Fiss E M, Wigginton K R, et al. Halogenation of bisphenol-A, triclosan, and phenols in chlorinated waters containing iodide. Environmen-tal Science & Technology, 2013, 47(13): 6764–6772
[21] Lane R F, Adams C D, Randtke S J, et al. Chlorina-tion and chloramination of bisphenol A, bisphenol F, and bisphenol A diglycidyl ether in drinking water. Water Research, 2015, 79: 68–78
[22] Hyung H, Kim J H. Natural organic matter (NOM) adsorption to multi-walled carbon nanotubes: effect of NOM characteristics and water quality parameters. Environmental Science & Technology, 2008, 42(12): 4416–4421
[23] Zhang S, Shao T, Karanfil T. The effects of dissolved natural organic matter on the adsorption of synthetic organic chemicals by activated carbons and carbon nanotubes. Water Research, 2011, 45(3): 1378–1386
[24] Yang Kun, Xing Baoshan. Adsorption of fulvic acid by carbon nanotubes from water. Environmental Pollution, 2009, 157(4): 1095–1100
[25] Zhang H C, Huang C H. Oxidative transformation of triclosan and chlorophene by manganese oxides. Environmental Science & Technology, 2003, 37(11): 2421–2430
[26] Kang S H, Xing B S. Humic acid fractionation upon sequential adsorption onto goethite. Langmuir, 2008, 24(6): 2525–2531
[27] 刘畅, 欧阳华. 胡敏酸(富啡酸)热力学参数计算. 东北林业大学学报, 2004, 32(2): 89–90
[28] Hur J, Lee B M, Shin H S. Microbial degradation of dissolved organic matter (DOM) and its influence on phenanthrene-DOM interactions. Chemosphere, 2011, 85(8): 1360–1367
[29] Sun Weiling, Xia Jing, Li Si, et al. Effect of natural organic matter (NOM) on Cu(II) adsorption by multi-walled carbon nanotubes: relationship with NOM properties. Chemical Engineering Journal, 2012, 200-202: 627–636
[30] Peuravuori J, Pihlaja K. Molecular size distribution and spectroscopic properties of aquatic humic sub-stances. Anal Chim Acta, 1997, 337(2): 133–149
[31] Uyguner C S, Bekbolet M. Implementation of spec-troscopic parameters for practical monitoring of na-tural organic matter. Desalination, 2005, 176(1/2/3): 47–55
[32] Chen W, Westerhoff P, Leenheer J A, et al. Fluores-cence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter. En-vironmental Science & Technology, 2003, 37(24): 5701–5710
[33] 李明堂, 王继红, 赵兰坡. 玉米高产田土壤水溶性有机物组成和结构特征. 东北林业大学学报, 2013, 41(6): 88–92
[34] Patel-Sorrentino N, Mounier S, Benaim J Y. Excitation-emission fluorescence matrix to study pH influence on organic matter fluorescence in the Amazon basin rivers. Water Research, 2002, 36(10): 2571–2581
[35] Reckhow D A, Singer P C. Mechanisms of organic halide formation during fulvic acid chlorination and implications with respect to preozonation // Jolley R L. Water chlorination: chemistry, environmental im-pact and health effects. Volume 5. Chelsea, MI: Lewis Publishers Inc, 1985: 1229–1257
[36] Lu J, Zhang T, Ma J, et al. Evaluation of disinfection by-products formation during chlorination and chlora-mination of dissolved natural organic matter fractions isolated from a filtered river water. Journal of Hazar-dous Materials, 2009, 162(1): 140–145
[37] Reckhow D A, Singer P C, Malcolm R L. Chlorination of humic materials-by-product formation and chemical interpretations. Environmental Science & Technology, 1990, 24(11): 1655–1664
[38] Jimenez M C S, Dominguez A P, Silverio J M C. Reaction-kinetics of humic-acid with sodium-hypochlorite. Water Research, 1993, 27(5): 815–820
[39] Li T, Jiang Y, An X, et al. Transformation of humic acid and halogenated byproduct formation in UV-chlorine processes. Water Research, 2016, 102: 421–427
[40] Wang H, Zhu Y, Hu C, et al. Treatment of NOM fractions of reservoir sediments: effect of UV and chlorination on formation of DBPs. Separation and Purification Technology, 2015, 154: 228–235
[41] Yang X, Shang C, Lee W, et al. Correlations between organic matter properties and DBP formation during chloramination. Water Research, 2008, 42(8/9): 2329–2339
[42] Nikolaou A D, Lekkas T D. The role of natural organic matter during formation of chlorination by-products: a review. Acta Hydroch Hydrob, 2001, 29(2/3): 63–77
[43] Rook J J. Chlorination reactions of fulvic acids in natural-waters. Environmental Science & Technology, 1977, 11(5): 478–482
[44] Yang K, Lin D H, Xing B S. Interactions of humic acid with nanosized inorganic oxides. Langmuir, 2009, 25(6): 3571–3576
[45] 曹艳丹, 李莹, 冯萃敏, 等. 氯消毒对再生水中溶解性有机物特性的影响. 环境工程, 2018, 36(12): 64–68
[46] Wang Y H, Chen K C. Removal of disinfection by-products from contaminated water using a synthetic goethite catalyst via catalytic ozonation and a biofil-tration system. International Journal of Environmen-tal Research and Public Health, 2014, 11(9): 9325–9344
Effects of Carbon Nanotubes on Formation of Disinfection By-Products during Chlorination of Natural Organic Matters
LI Huimin1, CHEN Xuejiao2, YOU Mingtao1, SUN Weiling1,†
1. College of Environmental Sciences and Engineering, Peking University, The Key Laboratory of Water and Sediment Sciences, Ministry of Education, Beijing 100871; 2. Shenzhen Key Laboratory for Heavy Metal Pollution Control and Reutilization, School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055; † Corresponding author, E-mail: wlsun@pku.edu.cn
Abstract Multi-wall carbon nanotubes (CNTs) and natural organic matters (NOMs) were chosen as target pollutants in this study. The effects of CNTs on the formation of disinfection by-products during chlorination of different types of NOMs (Suwannee river standard humic acid (HASR) and Suwannee river standard fulvic acid (FASR)) were investigated. Compared with the single system of CNTs or NOMs, the presence of CNTs increased the yields and initial formation rates of trihalomethanes (THMs) and halogenated acetic acids (HAAs) in the binary systems. Both CNTs and NOMs could serve as precursors of disinfection by-products, leading to more active sites for chlorination in NOMs-CNTs system. Therefore, the yields and initial formation rates of binary systems increased. Moreover, the initial formation rate of THMs and HAAs formed by HASR were higher than those formed by FASR in the absence and presence of CNTs. This was due to the higher aromaticity of HASR than FASR, which favored the attack of hypochlorous acid. In addition, the adsorption amount of HASR to CNTs was greater than FASR, which resulted in its stronger effects on the formation of disinfection by-products than FASR.
Key words carbon nanomaterials; natural organic matters; disinfect by-products; chlorination
doi: 10.13209/j.0479-8023.2020.115
国家自然科学基金(51879001)资助
收稿日期: 2020–01–16;
修回日期: 2020–02–28