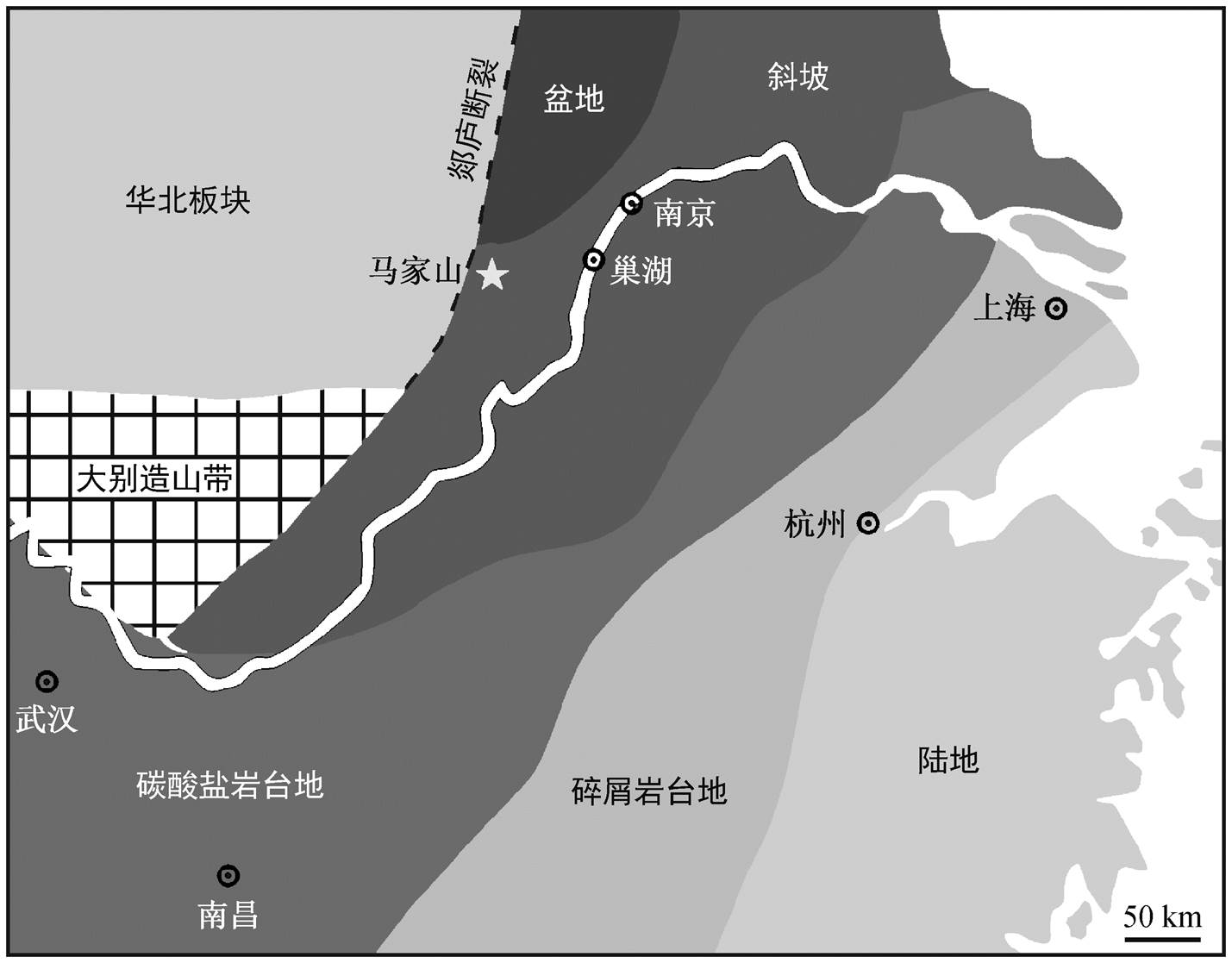
图1 研究剖面的古地理位置[39-40]
Fig. 1 Paleogeography of the locality and section in this study[39-40]
摘要 以安徽省巢湖地区下三叠统和龙山组顶部的黑色泥页岩段及其产出的含鱼化石碳酸盐岩结核为研究对象, 综合岩相学、地球化学(主微量元素和碳、氧同位素)和环境矿物学等分析手段, 探讨富有机质页岩中含鱼化石碳酸盐岩结核的形成机制及可能的地质环境指示意义。结核中心三维保存的鱼化石和较高的碳酸盐含量(80%)表明结核形成于早期成岩阶段, 结核内部呈同心环状结构, 从中心至边缘, 碳酸盐矿物含量降低, 硅质碎屑矿物增多并逐渐出现纹层, Fe 和 S 含量升高、δ13C 值增高、δ18O 值降低和 TOC 含量逐渐增多等特征均表明结核为同心生长模式。对围岩中草莓状黄铁矿的粒径分析结果表明, 结核形成于硫化还原环境。结核出现在斯密斯亚阶与斯帕斯亚阶界线(SSB)之下 1m 处, 与界线层有机碳埋藏增加、碳同位素组成快速正漂移(δ13C = −1.3‰~1.9‰)和水体硫化还原事件吻合, 有潜力作为华南地区SSB的辅助识别标志。
关键词 碳酸盐岩结核; 同心生长; 硫化; 早三叠世; 巢湖
碳酸盐岩结核常见于富有机质的泥岩和页岩中, 其中常保存完整的化石骨架和纤细易碎的生物结构, 甚至易腐化的软组织, 形成著名的化石库, 如西澳大利亚晚泥盆世 Gogo 组化石库[1-3]和巴西早白垩世 Santana 组化石库[4-5]等。目前, 已在全球多个地区下三叠统海相地层中发现含化石的碳酸盐岩结核, 如非洲东部的马达加斯加[6-7]和西南部的安哥拉[8], 欧洲北极圈内的斯匹兹卑尔根群岛[9-10]和格陵兰群岛[11], 北美洲加拿大的不列颠哥伦比亚[12]和美国的爱达荷州[13], 亚洲印度的喜马拉雅地区[14]和中国的华南地区[15], 呈现在泛大洋沿岸分布的古地理格局[16]。这些碳酸盐岩结核以保存数量庞大、完整精美的多类群鱼类化石为特征, 并可能伴生两栖类及多门类无脊椎动物化石, 成为研究三叠纪早期鱼群多样性及其演化[17]和从顶端捕食者角度探讨二叠纪末生物大灭绝后, 三叠纪早期海洋生态系统重建的重要素材[18-19]。
对于碳酸盐岩结核的生长模式一直存在争议。传统的观点是同心生长模式, 即碳酸盐围绕结核中心, 以同心环的形式在边缘不断沉淀[20-23]。另一种观点是均一生长模式, 早期形成的矿物搭建一个有大量孔隙的胶结团块, 新形成的矿物围绕这些团块不断地生长, 最终将孔隙完全填充, 结核内岩相学和地球化学性质均一[20-21,23]。也有学者将两种模型整合, 认为二者并不矛盾, 两种模式不同程度地影响着结核的生长[21,24]。地球化学及矿相学是研究含鱼化石结核成因的有效方法, 但目前相关研究的开展较为有限。
中国华南地区下三叠统含鱼化石的碳酸盐岩结核因鱼类分类学研究而引起学术界关注, 曾报道见于安徽和县驷马山[25]、巢湖市马家山和平顶山地区[15,26], 湖北黄石[27], 江苏句容市东昌镇青山采石场和南京市龙潭镇青龙山采石场[28-31]。除鱼类分类学研究外, Tintori 等[17]首次基于逐层化石发掘获得的第一手资料, 以自然层为单位, 记述安徽巢湖马家山剖面下三叠统和龙山组顶部含鱼化石碳酸盐岩结核的地层序列。其后, 周敏等[16]将马家山剖面“鱼瘤层”与早三叠世奥伦尼克期斯密斯亚期与斯帕斯亚期的年代地层界线(Smithian-Spathian boundary, SSB)以及界限层生物-环境事件[32-36]等方面的研究进展做了归纳总结和时空对比分析。Qiu 等[37]研究了江苏句容下三叠统下青龙组顶“鱼瘤”化石群的生物地层学、解剖学和埋藏学特征, 并进行简略的全球对比。Liu 等[38]选择含鱼化石结核的赋存地层进行系统的牙形石生物地层研究, 证实安徽巢湖和龙山组顶部、江苏句容和龙潭下青龙组上部的含鱼化石碳酸盐岩结核具有相同的地质时代, 为早三叠世奥伦尼克期晚斯密斯亚期最晚期。
本文在前人研究的基础上, 以马家山剖面和龙山组顶部出露的含鱼化石碳酸盐岩结核及其围岩为研究对象, 综合岩相学、地球化学(主微量元素和碳、氧同位素)和环境矿物等分析手段, 探讨富有机质页岩中含鱼化石碳酸盐岩结核的形成机制及其可能的地质环境指示意义。
安徽省巢湖地区在早三叠世处于下扬子海盆边缘的深水陆棚(图 1), 水深约为 300~500m[39,41-43]。位于巢湖市西北郊的马家山剖面(31°49′17″N, 117° 52′57″E)下三叠统连续发育, 出露良好, 自下而上为殷坑组、和龙山组和南陵湖组, 跨越二叠系-三叠系、下三叠统印度阶-奥伦尼克阶、奥伦尼克阶斯密斯亚阶-斯帕斯亚阶等重要年代地层界线, 并发育两个重要的脊椎动物化石群(和龙山组顶部的晚斯密斯亚期鱼群和南陵湖组中上段的巢湖龙动物群[26])。殷坑组的岩性为泥岩夹泥灰岩、瘤状灰岩及少量微晶灰岩, 韵律清晰。和龙山组的岩性主要为泥岩、瘤状灰岩和泥晶灰岩, 向上泥晶灰岩增多, 厚度为 21.24m, 表征潮下低能强还原环境[44]。南陵湖组下部以中-薄层泥质灰岩为主, 存在瘤状灰岩夹层, 中部以瘤状灰岩夹钙质泥岩为主, 上部为中-薄层泥质灰岩及泥页岩。
本研究的目标层段及含鱼化石碳酸盐岩结核位于马家山剖面下三叠统奥伦尼克阶和龙山组顶部, 厚度约为 2.5m, 岩性表现为黑色薄层钙质泥页岩与薄层瘤状灰岩、泥质灰岩互层(图 2), 相当于Song 等[43]所指的和龙山组顶部黑色泥灰岩组合(black marlstone unit, BMU)。该段地层自下而上由23 个自然层组成, 对应梁丹等[35]所指的和龙山组第51~52 层和周敏等[16]划分的 483~493 层。目标层段对应 Song 等[43]提出的早三叠世第三次碳同位素组成正漂移且热带地区海水表层年均温度持续降低过程, 且第 15 层对应由牙形石 Novispathodus pingding-shanensis 首次出现为标志的斯密斯亚阶-斯帕斯亚阶界线[35], 上距和龙山组-南陵湖组界线 2.2m。自然层第 5 层主要由黑色泥页岩组成, 自下而上发现数量庞大、顺层分布的两层碳酸盐岩结核, 其围岩的纹层绕过或弯曲地穿过结核。含鱼碳酸盐岩所处的黑色页岩层层面普遍分布鱼类、双壳类、节肢动物、菊石及丰富的粪化石, 还普遍分布黄铁矿和干沥青。

图1 研究剖面的古地理位置[39-40]
Fig. 1 Paleogeography of the locality and section in this study[39-40]
针对本研究目标层段, 选取 2.5m ´ 2.0m 的样方, 以自然层为单位, 逐层发掘并采集含鱼化石碳酸盐岩结核 20 余块, 地球化学分析样品 17 件。选取两块未受风化作用影响的碳酸盐岩结核样品(CN1, CN2)和 17 件围岩样品进行地球化学分析。为了研究碳酸盐岩结核的内部结构和组分, 每个结核都被垂直于纹层切开, 然后制成岩石薄片用于岩相学观察; 用手钻从结核底部到顶部依次钻取粉末样品, 用于化学成分分析。
围岩和碳酸盐岩结核的岩石样品共计制作 23个薄片。岩石薄片岩相学和化石岩石学观察在偏光显微镜下进行, 生物学和矿物学微细结构观察和照相在北京大学地球与空间科学学院教育部造山带与地壳演化重点实验室的扫描电子显微镜下进行, 仪器型号为 FEI Quanta 650 FEG, 工作电压为 10 V。对 17 片薄片进行草莓状黄铁矿的观察和颗粒粒径测量及量化统计, 该项工作在扫描电子显微镜背散射模式(BSED)下放大 2500 倍完成。为保证统计分析的有效性, 每个薄片测量不少于 100 个数据(两个含草莓状黄铁矿极少的薄片除外)。由于用这种方法测得的数据并不总是代表真实直径, 因此会有<10%的误差[45]。
主量元素和微量元素的测试工作在北京大学地球与空间科学学院教育部造山带与地壳演化重点实验室的 Spectro Blue Sop 电感耦合等离子体发射光谱仪(ICP-OES)上完成, 样品称重后用醋酸-醋酸铵缓冲溶液充分溶解, 取溶液进行测量, 分析误差<10%。样品碳、氧同位素的测试工作在核工业北京地质研究院用磷酸法完成, 所用仪器为 Delta V Advantage 气体同位素质谱仪。碳、氧同位素均以PDB 为标准, 分析误差<0.20‰。总有机碳(TOC)的测试在中国石油大学(北京)的碳硫分析仪 LECO CS230 上完成, 测试误差<1‰。
主要产出两层碳酸盐岩结核, 靠下部产出的结核个体较大(长轴多大于 15cm), 形态各异(多为圆饼形), 含鱼化石或生物核极少; 靠上部产出的结核个体相对较小(长轴小于 10cm), 多呈长椭球形, 上表面比下表面平坦, 长轴方向平行于岩层的层面, 沿长轴方向保存鱼化石, 俗称“鱼瘤”。碳酸盐岩结核内部所含鱼化石通常为长纺锤形的裂齿鱼类[15]。从结核纵切面来看, 以近三维保存的鱼化石为核心, 从中心向外呈现肉眼可见的同心环状结构(图 3)。根据岩性和矿物组成, 从由鱼构成的核心向外可划分为 4 个区域。

(a)地层中出露的结核(白色箭头所指); (b)不含鱼化石的结核, 其围岩岩层发生弯曲而绕过结核; (c)含鱼化石结核; (d)围岩岩性薄片显微镜下照片(第15层); (e)草莓状黄铁矿; (f)有机质颗粒
图2 巢湖马家山剖面“鱼瘤层”
Fig. 2 The “fish nodular layer” of the Majiashan Section of Chaohu
区域 I 由近三维保存的鱼化石构成, 厚度约为 5 mm, 鱼体被一圈呈黄棕色的有同心环状纹层的鱼鳞包围, 鱼体内部空腔被结晶较好的亮晶方解石颗粒(粒径为 200~500μm)充填(图 3(c)), 未发现硅质碎屑矿物, 经扫描电子显微镜能谱分析, 鱼体内环状和不规则黄棕色网状结构的成分为磷酸钙, 环状结构可能是鱼的肋骨。
区域 II 为包围着鱼化石的的致密微晶灰岩, 厚度约为 10mm, 纹层不发育, 主要由微晶方解石和重结晶的有孔虫组成, 含微量硅质碎屑矿物颗粒(石英和黏土矿物)和黄铁矿, 硅质碎屑颗粒散乱分布, 黄铁矿颗粒为半自形晶, 多围绕有孔虫分布(图3(a)和(d))。
区域 III 由等量的方解石和硅质碎屑矿物组成, 硅质碎屑颗粒形成层状格架, 方解石胶结物、生物碎屑及少量黄铁矿充填其中, 可见明显的纹层。这些近水平的纹层向结核的中心部分弯曲(图 3(a), (e)和(f)), 纹层延续到结核边缘, 与围岩纹层相接, 说明其与围岩纹层同源。有孔虫、腹足类和贝壳碎片比区域 II 中含量高, 并呈现更高程度的压实作用。区域 III 与区域 II 的界限不明显, 呈现向外硅质碎屑含量逐渐增大、压实程度逐渐增高的缓慢过渡。
最外层的区域 IV 由 70%的方解石和 30%的硅质碎屑颗粒组成, 未见纹层, 含生物碎屑颗粒, 以半自形黄铁矿组成的同心状环带为典型特征(图 3 (g)和(h)), 结核被与自身成分差异很大的钙质泥页岩包裹, 被鱼化石分割开的结核上下两部分呈现大体上近似对称的内部结构。区域Ⅳ与区域 III 的界限也不明显。

(a)单偏光下的结核内部区域, 从内到外分为 4 个区域, 呈现“亮-暗-亮”特征, 区域 III 可见纹层, 结核内可见腹足、有孔虫和介形虫化石; (b)结核 CN1 的纵切面, 以鱼化石为核心, 向外逐渐出现横向上向心弯曲的纹层, 结核边缘出现大量呈环带分布的黄铁矿; (c)区域I, 鱼鳞化石包围的亮晶方解石; (d)区域I I, 硅质碎屑颗粒(灰黑色)散乱地排布在方解石胶结物(灰白色)中; (e)和(f)区域 II 和区域 III, 区域 III 中硅质碎屑颗粒层状分布; (g)区域 III 和区域 IV, 区域IV 中有黄铁矿环带, 白色方框为(h)的范围; (h)自形-半自形的黄铁矿(白色)集簇。Ost:介形虫; Gas:腹足类; Sp:有孔虫; py:黄铁矿
图3 含鱼化石结核的内部结构和构造
Fig. 3 Internal structure of fish-bearing concretion
表1 碳酸盐岩结核的同位素及元素组成
Table 1 Isotopic and elemental compositions of the carbonate concretions
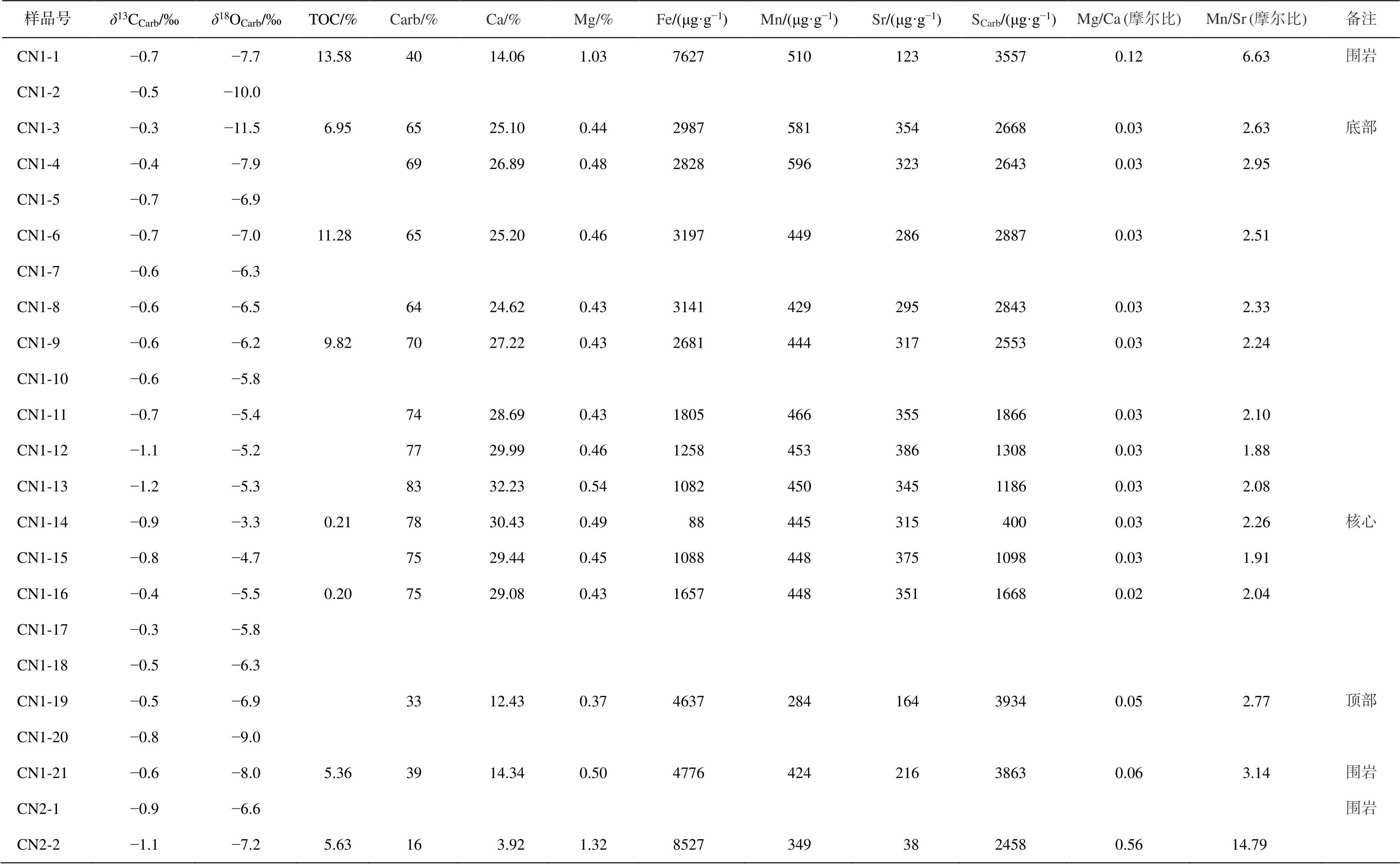
样品号δ13CCarb/‰δ18OCarb/‰TOC/%Carb/%Ca/%Mg/%Fe/(μg·g−1)Mn/(μg·g−1)Sr/(μg·g−1)SCarb/(μg·g−1)Mg/Ca (摩尔比)Mn/Sr (摩尔比)备注 CN1-1−0.7−7.713.584014.061.03762751012335570.126.63围岩 CN1-2−0.5−10.0 CN1-3−0.3−11.56.956525.100.44298758135426680.032.63底部 CN1-4−0.4−7.96926.890.48282859632326430.032.95 CN1-5−0.7−6.9 CN1-6−0.7−7.011.286525.200.46319744928628870.032.51 CN1-7−0.6−6.3 CN1-8−0.6−6.56424.620.43314142929528430.032.33 CN1-9−0.6−6.29.827027.220.43268144431725530.032.24 CN1-10−0.6−5.8 CN1-11−0.7−5.47428.690.43180546635518660.032.10 CN1-12−1.1−5.27729.990.46125845338613080.031.88 CN1-13−1.2−5.38332.230.54108245034511860.032.08 CN1-14−0.9−3.30.217830.430.49884453154000.032.26核心 CN1-15−0.8−4.77529.440.45108844837510980.031.91 CN1-16−0.4−5.50.207529.080.43165744835116680.022.04 CN1-17−0.3−5.8 CN1-18−0.5−6.3 CN1-19−0.5−6.93312.430.37463728416439340.052.77顶部 CN1-20−0.8−9.0 CN1-21−0.6−8.05.363914.340.50477642421638630.063.14围岩 CN2-1−0.9−6.6围岩 CN2-2−1.1−7.25.6316 3.921.3285273493824580.56 14.79
续表
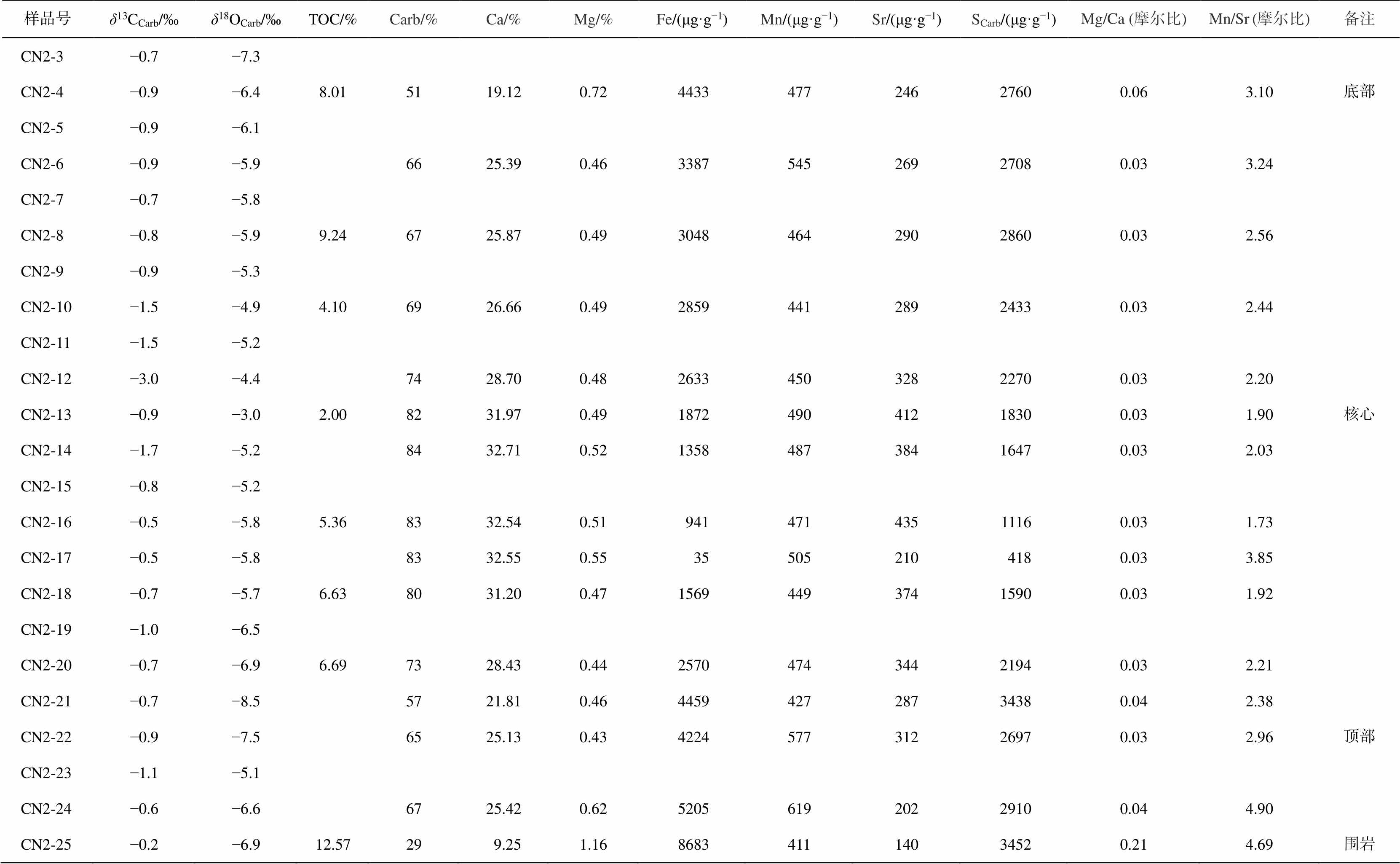
样品号δ13CCarb/‰δ18OCarb/‰TOC/%Carb/%Ca/%Mg/%Fe/(μg·g−1)Mn/(μg·g−1)Sr/(μg·g−1)SCarb/(μg·g−1)Mg/Ca (摩尔比)Mn/Sr (摩尔比)备注 CN2-3−0.7−7.3 CN2-4−0.9−6.48.015119.120.72443347724627600.063.10底部 CN2-5−0.9−6.1 CN2-6−0.9−5.96625.390.46338754526927080.033.24 CN2-7−0.7−5.8 CN2-8−0.8−5.99.246725.870.49304846429028600.032.56 CN2-9−0.9−5.3 CN2-10−1.5−4.94.106926.660.49285944128924330.032.44 CN2-11−1.5−5.2 CN2-12−3.0−4.47428.700.48263345032822700.032.20 CN2-13−0.9−3.02.008231.970.49187249041218300.031.90核心 CN2-14−1.7−5.28432.710.52135848738416470.032.03 CN2-15−0.8−5.2 CN2-16−0.5−5.85.368332.540.5194147143511160.031.73 CN2-17−0.5−5.88332.550.55355052104180.033.85 CN2-18−0.7−5.76.638031.200.47156944937415900.031.92 CN2-19−1.0−6.5 CN2-20−0.7−6.96.697328.430.44257047434421940.032.21 CN2-21−0.7−8.55721.810.46445942728734380.042.38 CN2-22−0.9−7.56525.130.43422457731226970.032.96顶部 CN2-23−1.1−5.1 CN2-24−0.6−6.66725.420.62520561920229100.044.90 CN2-25−0.2−6.912.5729 9.251.16868341114034520.214.69围岩
说明: Carb代表碳酸盐成分, 空白区域代表未分析, 下同。
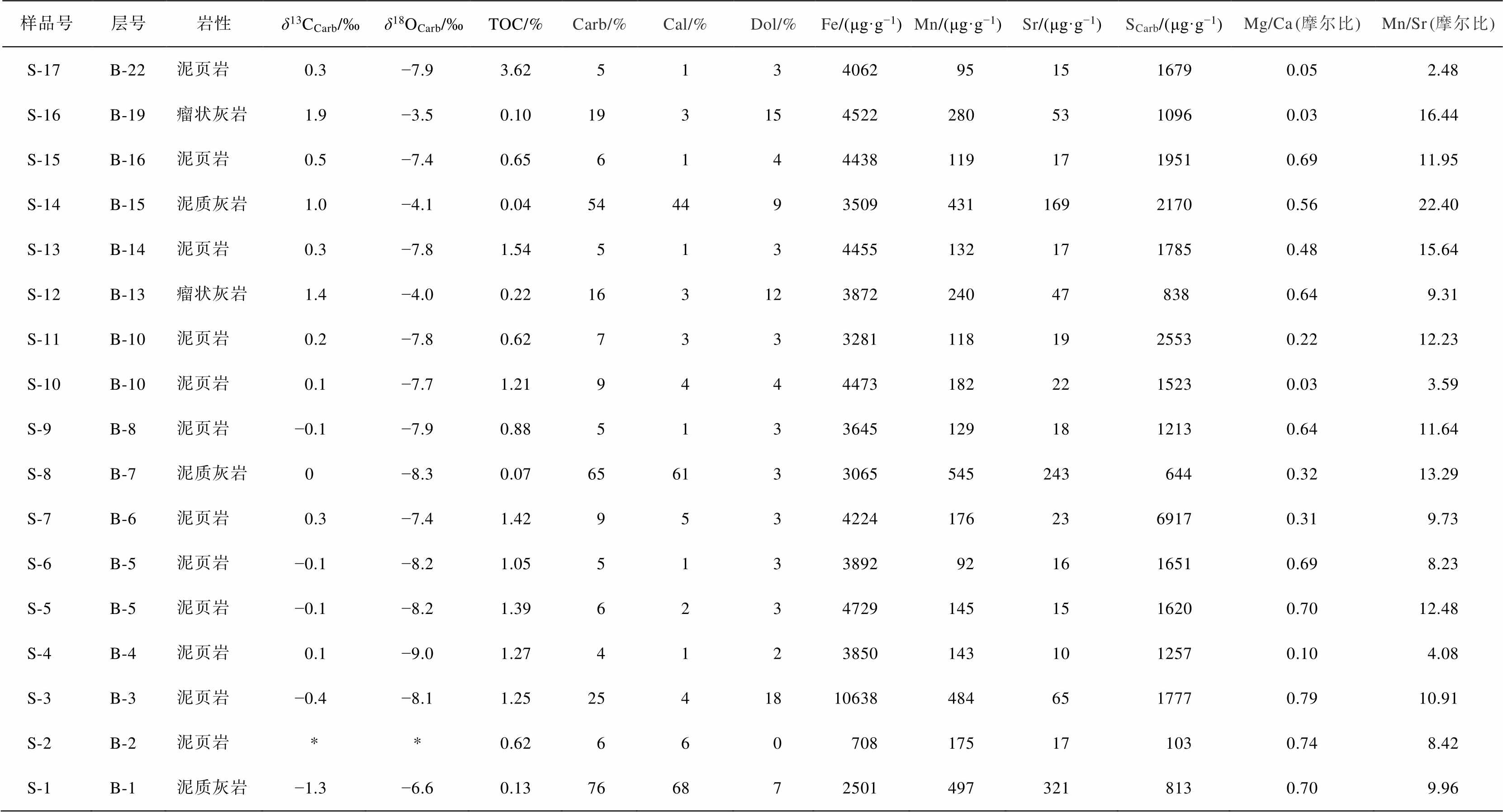
表2 马家山剖面中围岩的同位素和元素化学组成
Table 2 Isotopic and elemental compositions of the host rocks in the Majiashan section
样品号层号岩性δ13CCarb/‰δ18OCarb/‰TOC/%Carb/%Cal/%Dol/%Fe/(μg·g−1)Mn/(μg·g−1)Sr/(μg·g−1)SCarb/(μg·g−1)Mg/Ca (摩尔比)Mn/Sr (摩尔比) S-17B-22泥页岩0.3−7.93.625134062 951516790.052.48 S-16B-19瘤状灰岩1.9−3.50.101931545222805310960.0316.44 S-15B-16泥页岩0.5−7.40.6561444381191719510.6911.95 S-14B-15泥质灰岩1.0−4.10.0454449350943116921700.5622.40 S-13B-14泥页岩0.3−7.81.5451344551321717850.4815.64 S-12B-13瘤状灰岩1.4−4.00.2216312387224047 8380.649.31 S-11B-10泥页岩0.2−7.80.6273332811181925530.2212.23 S-10B-10泥页岩0.1−7.71.2194444731822215230.033.59 S-9B-8泥页岩−0.1−7.90.8851336451291812130.6411.64 S-8B-7泥质灰岩 0−8.30.07656133065545243 6440.3213.29 S-7B-6泥页岩0.3−7.41.4295342241762369170.319.73 S-6B-5泥页岩−0.1−8.21.055133892 921616510.698.23 S-5B-5泥页岩−0.1−8.21.3962347291451516200.7012.48 S-4B-4泥页岩0.1−9.01.2741238501431012570.104.08 S-3B-3泥页岩−0.4−8.11.2525418106384846517770.7910.91 S-2B-2泥页岩**0.6266070817517 1030.748.42 S-1B-1泥质灰岩−1.3−6.60.13766872501497321 8130.709.96
说明: Cal代表方解石, Dol代表白云石; *代表没有检测到, 下同。
保存含鱼化石碳酸盐岩结核的围岩为黑色钙质泥页岩, 发育明显的水平纹层(图 2(d)), 主要由硅质碎屑颗粒(石英等)组成, 含少量碳酸盐颗粒, 普遍见层状分布的黄铁矿颗粒, 主要为草莓状黄铁矿(图 2(e)), 也见有机质颗粒(图2(f))。
表 1 和 2 分别列出含鱼化石碳酸盐岩结核和围岩的地球化学测试数据。
如表 1 所示, 在结核 CN1 中, Ca 含量很高, 均值约为 24.98%, 说明结核主要由方解石组成, 低Mg 含量(约为 0.49%)和低 Mg/Ca 值(约为 0.03)表明结核未白云岩化。如图 4 所示, 结核 CN1 内大多数区域碳酸盐含量(Carb(%) = (m(CaCO3) + m(MgCO3) + m(FeCO3)) / m ´100%)较高, 从核心(约为 80%)到区域 III (55%)缓慢降低, 在区域 IV 出现微弱的增长(约为 60%), 在边缘快速地降低(约为 30%), 与岩相学观察结果吻合。碳酸盐含量最高值出现在区域 II中最靠近化石的采样点, 而不是区域 I 中, 可能是由于采样时区域 I 中样品中混入部分磷酸钙质鱼鳞所致。与碳酸盐含量相反, Fe 和 S (碳酸盐中的 S)含量呈现出从核心向边缘递增的趋势(分别从 88μg/g增至 7627μg/g, 从 400μg/g 增至 3557μg/g), 但在区域 IV 有微弱的下降。Fe 含量与 S 含量正相关, 相关系数为 0.79; 二者都与 Ca 含量负相关, 相关系数分别为 0.80 和 0.79。结核内 Mn/Sr 值为 1.88~6.63, 平均 2.68, 中心比边缘低。结核 CN2 的元素含量分布与 CN1 相似。

图4 结核内元素及同位素组成的分布
Fig. 4 Distributions of the element content and isotope in the concretions
该段地层围岩中, 碳酸盐含量的范围为 4%~ 76%; Fe 和 S 含量分别为 708~10638μg/g 和 103~ 6917μg/g, 平均值分别为 4110 和 1741μg/g; Mg/Ca和 Mn/Sr 分别介于 0.03~0.79 和 2.48~22.40 之间, 平均值分别为 0.45 和 10.75。与结核相比, 第 5 自然层(结核层)中碳酸盐含量极低(仅 6%), Fe 和 S 含量(分别为 4729 和 1620μg/g)高于结核内部平均值, 且具有更高的 Mg/Ca 值(0.70)和 Mn/Sr 值(12.48)。
从核心到边缘, 两个鱼化石结核的碳、氧同位素均呈现明显的变化趋势(图 4)。在结核 CN1 中, δ13C 值在−1.2‰~−0.3‰之间, 平均−0.6‰, 呈现从核心向边缘总体上增长的趋势, 在区域 III 有微弱的减小, 最小值出现在区域 II 最靠近化石的采样点, 最大值位于区域 III。δ18O 值在−11.5‰~−3.3‰之间, 平均−6.7‰, 呈现从核心向边缘逐渐减小的趋势, 最大值位于区域 I, 最小值位于区域 IV。结核 CN2内碳、氧同位素变化趋势与 CN1 相同。图 5 显示, 结核内碳同位素与氧同位素组成非线性相关(R2= 0.17), 可以排除后期成岩改造的影响。
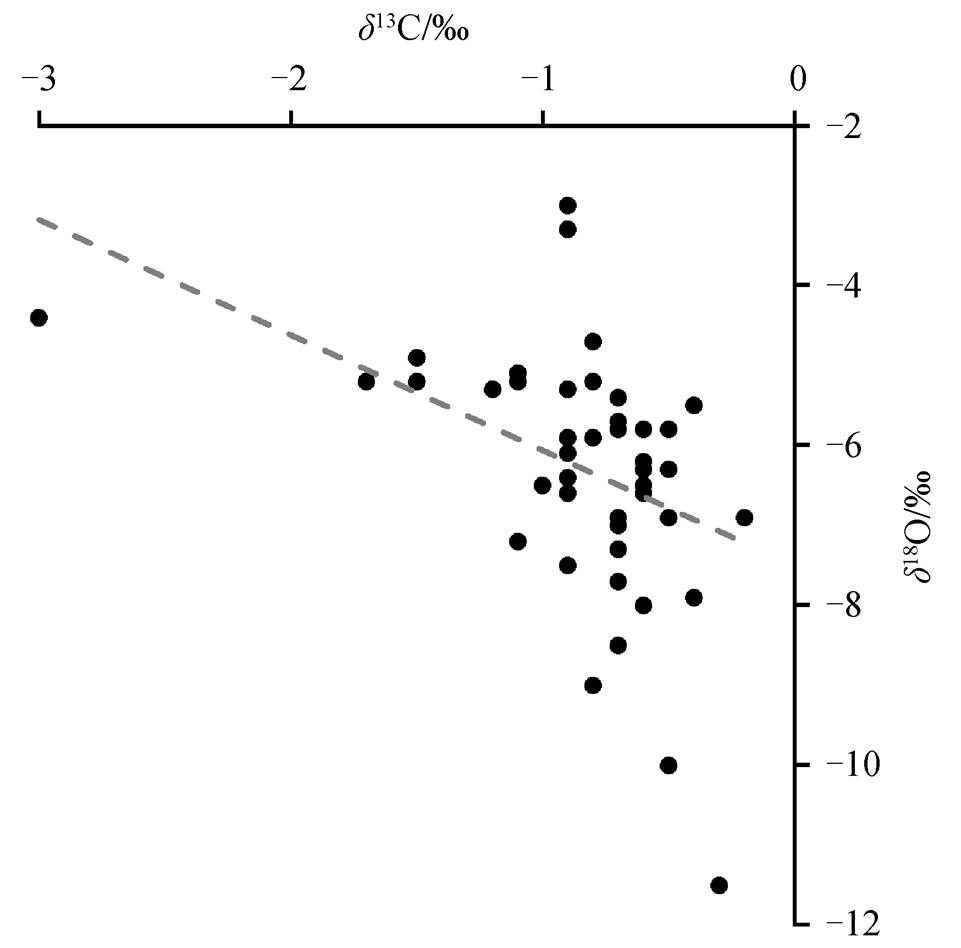
图5 结核内δ13C与δ18O的散点图
Fig. 5 Plot diagram of δ13C and δ18O values of the concretions
该段地层的 δ13C 值为−1.3‰~1.9‰, 平均−0.3‰, δ18O 值为−9.0‰~−3.5‰, 平均−7.1‰。从图 6 可以看出, δ13C 值的总体趋势为正漂移, 并且由负转正; δ18O 值稳定。图 7 显示, 围岩的 δ13C 与 δ18O 弱线性相关(R2=0.51), 可能受成岩改造的影响。第 5 自然层中 δ13C (−0.1‰)高于结核内平均值, δ18O (−8.2‰)低于结核内平均值。

(a)中 TOC和碳同位素数据引自文献[43], 牙形石分带引自文献[35,46]。Nv.: Novispathodus; Ns.: Neospathodus; ping.: pingdingshanensis; T.: Triassospathodus
图6 马家山剖面的化学地层及草莓状黄铁矿的粒径分布
Fig. 6 Chemostratigraphy and the size distribution of framboidal pyrites of the Majiashan Section
含鱼化石结核 CN1 和 CN2 中, 总有机碳(TOC)含量分别介于 0.2%~13.58%和 2.0%~12.57%之间, 平均值分别为 6.77%和 6.70%, 两个结核中 TOC 均表现出从核心向边缘增加的趋势(图 4)。该段地层岩石中 TOC 含量总体上较高, 泥页岩和灰岩中平均值分别为 1.29%和 0.11%。第 5 自然层中的 TOC 含量(1.22%)低于结核内平均值。
地层中草莓状黄铁矿的粒度分布如表 3 和图 6所示, 平均粒径对标准偏差的二元图解如图 8 所示。该段地层内保存的草莓状黄铁矿形状完好, 在岩石中呈层状聚集分布或单个出现, 从 16 块围岩样品的 14 块中发现 1676 个草莓状黄铁矿。第 2 和第19 自然层中未发现草莓状黄铁矿, 第 1 和第 13 层的草莓状黄铁矿很少, 测量数据未达到 100 个。草莓状黄铁矿粒径的平均值为 5.56μm, 最大可以达到27.92 μm。
4.1.1 物质来源和形成时间
一般认为, 形成结核的自生碳酸盐来自有机质在细菌硫酸盐还原(bacterial sulphate reduction, BSR)带或甲烷生成带的生物矿化作用[20,47], 但有机质提供的碳源不足以形成同体积的碳酸盐岩结核, 因此必须有外来碳源作为补充[20,48]。马家山含鱼化石结核内部 TOC 平均含量为 6%, 围岩 TOC 含量大于1%, 表明当时环境中有充足的有机碳为碳酸盐岩结核的形成提供碳源。
结核内偏负的 δ13C 值和大量存在的黄铁矿指示其可能形成于细菌硫酸盐还原带[21,24,47], BSR 作用生成的碳酸盐 δ13C 值一般为−25‰[21], 而结核中δ13C 值在−3‰~−0.2‰之间, 说明结核中的碳酸盐还有其他富 13C 的物质来源。结核的围岩是钙质泥页岩, 含 6%碳酸盐, δ13C 值为−0.1‰, 可能是 BSR之外的第二种物质来源。尽管 BSR 作用会生成 H2S, 使得 pH 值降低, 不利于碳酸盐沉淀, 但 Berner[49]认为细菌对有机质进行分解时, 生物体中的氨基酸也会被分解, 产生的 NH3 会使 pH 值升高, 有利于碳酸盐的沉淀。因此, 鱼体的分解可能使得局部环境呈碱性, 碳酸盐围绕鱼体沉淀, 结核以鱼体为核心生长。
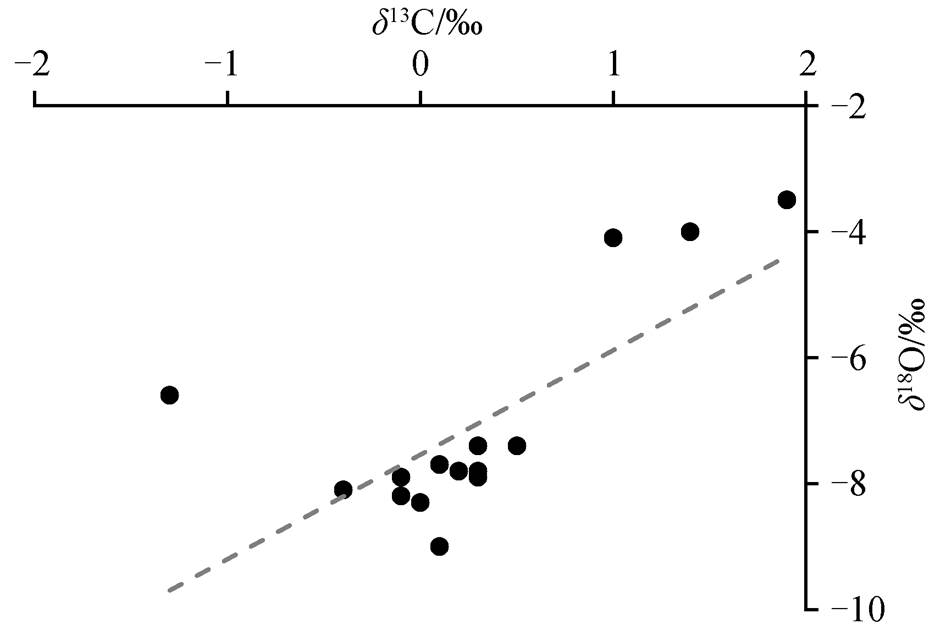
图7 围岩中δ13C与δ18O的散点图
Fig. 7 Plot diagram of δ13C and δ18O values of the host rocks
依据结核内化石保存情况和结核与围岩的接触关系, 可以推断结核的形成时间。结核内三维保存的化石是指示结核形成于早期成岩阶段的可靠证据[21,48]。因此, 马家山含鱼化石碳酸盐岩结核中三维保存的鱼化石说明其形成于浅埋藏的早期成岩阶段。区域 II 中硅质碎屑散乱分布在碳酸盐胶结物中, 也说明结核在孔隙度高且未压实的沉积物中已经开始形成(图 3(d)), 而区域 III 中出现横向上向中心弯曲的纹层(图 3(a)和(e))是结核形成过程中受压实作用的结果。围岩与结核交接部位的纹层弯曲绕过现象(图 2(b))指示结核形成后, 压实作用仍在继续[48,50]。因此, 马家山含鱼化石结核在压实作用之前就开始形成, 并随着压实作用的增强继续生长。
4.1.2 生长模式
马家山含鱼化石结核内部呈环带状结构, 可划分出不同的区域(图 3)。从结核中心向边缘, 碳酸盐含量逐渐降低, 硅质碎屑颗粒不断增多, Ca 和 Sr含量逐渐减少, Fe 和 S 元量逐渐加大, δ13C 值增大, δ18O 值减小, TOC 逐渐增加(图 4), 表明结核的形成模式为同心生长方式。虽然均一生长模式下因各阶段作用效果的差异也可形成有一定变化规律的地球化学特征, 但马家山含鱼化石结核从核心向边缘表现出不同压实程度的内部结构, 因此可以排除均一生长模式。Heimhofer 等[4]通过研究巴西早白垩世Santana 组的含鱼化石结核, 发现结核内碳同位素与氧同位素强负相关, 并将其解释为两期碳酸盐相混合的结果, 进而认为结核为均一生长模式。马家山含鱼化石结核内碳同位素与氧同位素非线性相关, 不存在两期碳酸盐相的混合现象, 为同心生长模式。对于结核内 δ13C 逐渐增大, 可以解释为在生长过程中, 有机质作为碳源的比例不断减少, 无机碳作为碳源的比例增大, 导致新生成的碳酸盐 δ13C值增大。
表3 马家山剖面草莓状黄铁矿的粒径分布
Table 3 Pyrite framboid size distributions in the Majiashan Section
样品号层号岩性自形黄铁矿丰度草莓状黄铁矿丰度草莓状黄铁矿数量粒径/μm推测的氧化还原条件 平均值中位数最大值标准差 S-16B-22泥页岩极少大量1194.94.910.181.1硫化 S-15B-19瘤状灰岩大量无无****贫氧 S-14B-16泥页岩极少大量1365.25.212.981.4硫化 S-13B-15泥质灰岩大量少量1185.35.112.081.6硫化 S-12B-14泥页岩少量大量1195.35.38.691.4硫化 S-11B-13瘤状灰岩大量极少108.57.020.165.2贫氧 S-10B-10泥页岩大量少量1185.54.927.923.2贫氧 S-9B-8泥页岩极少大量1195.65.69.791.2缺氧 S-8B-7泥质灰岩少量大量1356.87.29.841.8缺氧 S-7B-6泥页岩大量少量1206.35.812.462.0缺氧 S-6B-5泥页岩极少大量1195.35.210.711.2硫化 S-5B-5泥页岩极少大量1264.94.88.311.1硫化 S-4B-4泥页岩极少大量2574.64.48.191.2硫化 S-3B-3泥页岩少量大量1204.13.910.271.1硫化 S-2B-2泥页岩极少无无****贫氧 S-1B-1泥质灰岩少量少量60 10.9 10.024.204.6贫氧
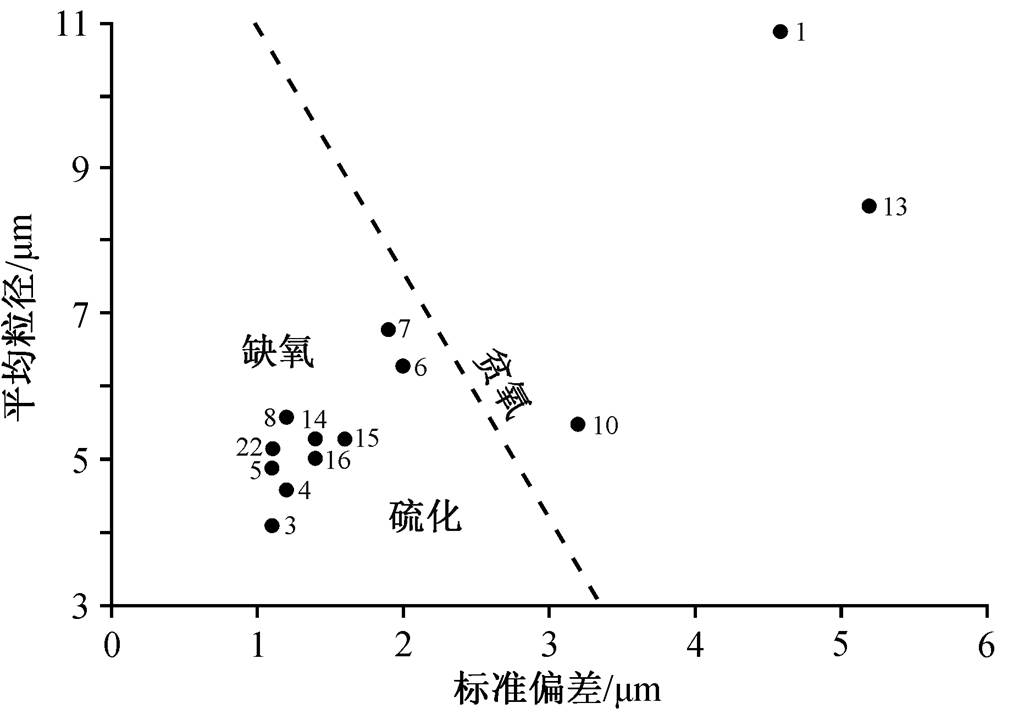
虚线将氧化还原条件分为贫氧和缺氧/硫化[45]; 数字代表层号
图8 马家山剖面草莓状黄铁矿平均粒径对标准偏差的二元图解
Fig. 8 Mean diameter versus standard deviation of framboid sizes of Majiashan Section
通过上述分析, 并在 Qiu 等[37]的研究基础上, 本文推测含鱼化石结核可能的形成过程如图 9 所示。第 1 步, 在海水上层富氧环境中生活的鱼类, 死亡后下沉落入沉积物中, 由于沉积物表面是平静的缺氧水体环境, 尸体不会马上被破坏(图 9(a))。第 2 步, 细菌围绕鱼体开始分解作用, 导致局部碳酸盐浓度升高, pH 值也升高[49], 鱼鳞阻隔沉积物进入鱼体腔内, 形成的空腔被亮晶方解石充填, 形成区域 I; 鱼体外的松散沉积物中, 方解石以鱼为核心向外生长, 形成区域 II (图 9(b))。第 3 步, 埋藏加深, 结核周围沉积物形成纹层, 并逐渐被压实; 此时结核仍在生长, 并将周围已经出现纹层的泥质沉积物胶结其中, 形成区域 III (图 9(c))。第 4 步, 结核基本上成型后, 成岩作用继续, 压溶作用导致结核边缘沉淀大量方解石和黄铁矿, 形成区域 IV (图 9(d))。
4.2.1 氧化还原条件
马家山含鱼化石结核形成的地质时期为晚斯密斯亚期。前人的研究表明, 早三叠世晚斯密斯亚期的古海洋环境具有高温、缺氧和酸化等特点[32-34,36], 泥页岩中的碳酸盐岩结核则被认为形成于缺氧的还原环境[48]。通过对结核所在围岩中草莓状黄铁矿的粒径分析, 发现研究区地层大多数沉积于缺氧环境中, 仅第 1 和第 13 层处于贫氧环境, 结核所在的第 5 层中草莓状黄铁矿平均粒径为 5μm, 指示当时硫化缺氧的水体环境[45,51]。该分析结果与 Song 等[43]通过铁组分、草莓状黄铁矿和硫同位素分析得出的巢湖马家山和龙山组顶部黑色泥灰岩组合(BMU)处于硫化还原环境的结论相吻合。此外, Qiu 等[37]对句容“鱼瘤层”的草莓状黄铁矿粒径分析也认为当时水体为硫化还原环境。因此, 中国华南地区晚斯密斯亚期大量成层分布的碳酸盐岩结核可能指示一次大范围的海水缺氧硫化事件。
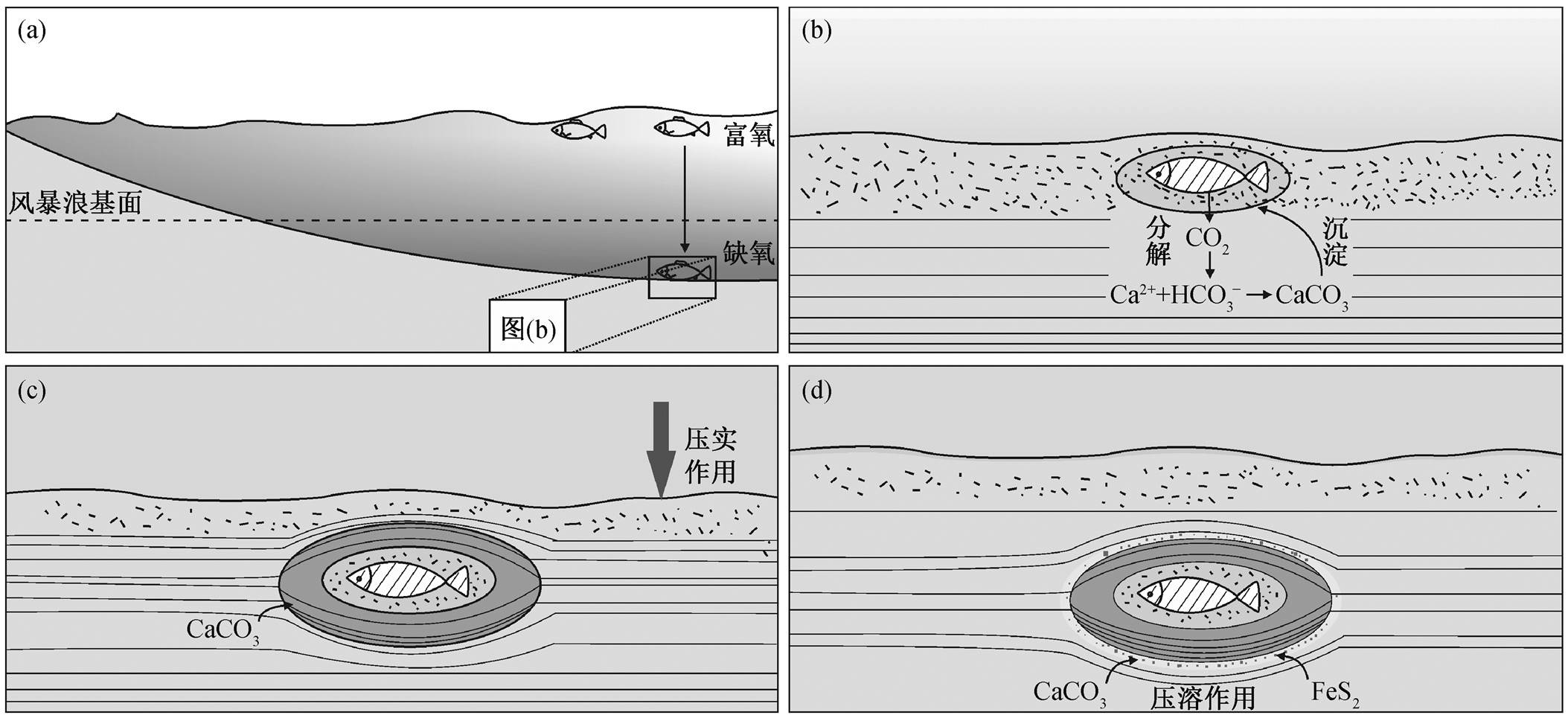
图9 含鱼化石结核的可能形成过程
Fig. 9 Possible formation process of fish-bearing concretions
4.2.2 “鱼瘤层”碳同位素特征
早三叠世全球碳同位素组成波动频繁。Song 等[52]通过对全球 3 个典型剖面的分析, 将早三叠世碳同位素组成的变化趋势划分为 4 次主要的负漂移和 3 次主要的正漂移, SSB 处存在一次快速的大幅度正漂移, 是初级生产力升高和有机质大量埋藏的结果[43]。周敏等[16]对比马家山“鱼瘤层”与梁丹等[35]研究的平顶山地层后, 认为“鱼瘤层”处于碳同位素组成快速正漂移的阶段, 并提出将“鱼瘤层”作为SSB 的参考标志之一。本文研究的“鱼瘤层”内碳同位素组成虽然受到成岩改造的影响, 但在 2.5m 厚的地层中仍表现出 δ13C 值从−1.3‰ 快速正漂移到 1.9‰的趋势, 且“鱼瘤层”具有高 TOC 含量(图 6),表明含鱼化石碳酸盐岩结核形成于初级生产力升高、有机质大量埋藏的海洋环境中。此外, 梁丹等[35]提出将 δ13C 值快速正漂移穿越 0 值点作为 SSB 的参考标志, 而含鱼化石结核所在的第 5 自然层 δ13C 值恰好为 0, 位于 SSB 之下约 1m 处。Liu 等[38]对含鱼化石结核的赋存地层进行系统的牙形石生物地层研究, 证实安徽巢湖和龙山顶部、江苏句容和龙潭下青龙组上部产出的含鱼瘤化石的地层具有相同的地质时代, 为早三叠世奥伦尼克期晚斯密斯亚期最晚期。因此, 本文研究结果支持周敏等[16]的观点, 含鱼化石碳酸盐岩结核可能是华南地区 SSB 的辅助识别标志之一。
本文通过对安徽省巢湖地区马家山剖面下三叠统奥伦尼克阶斯密斯亚阶和龙山组顶部的含鱼化石碳酸盐岩结核及其围岩进行岩相学和地球化学分析, 获得以下结论。
1)结核内所含鱼化石多呈三维实体保存, 发育细纹层, 表明该类鱼化石形成于早期成岩阶段, 且压实作用发生后结核继续生长。以化石鱼类为核心, 从中心向边缘, 呈现环带状结构, 主量元素和微量元素以及碳、氧同位素组成呈现规律性的变化, 这些特征显示该类结核的生长模式为同心生长方式。
2)围岩中草莓状黄铁矿的粒径分析结果表明, 结核形成时水体处于硫化厌氧环境, 因此, 黑色页岩中的碳酸盐岩结核或许指示硫化还原的底层海水环境。
3)含鱼化石碳酸盐岩结核处于斯密斯亚期-斯帕斯亚期界线附近碳同位素组成快速正漂移过程中, 与该时期海水硫化事件相对应, 可能是斯密斯亚期-斯帕斯亚期界线识别的辅助标志之一, 在华南地区有良好的识别效果。
参考文献
[1] Melendez I, Grice K, Trinajstic K, et al. Biomarkers reveal the role of photic zone euxinia in exceptional fossil preservation: an organic geochemical perspec-tive. Geology, 2013, 41(2): 123‒126
[2] Long J A, Trinajstic K. The Late Devonian Gogo Formation lӓgerstatte of western Australia: exceptio-nal early vertebrate preservation and diversity. Annual Review of Earth and Planetary Sciences, 2010, 38: 255‒279
[3] Trinajstic K, Sanchez S, Dupret V, et al. Fossil mus-culature of the most primitive jawed vertebrates. Science, 2013, 341: 160‒164
[4] Heimhofer U, Meister P, Bernasconi S M, et al. Isotope and elemental geochemistry of black shale-hosted fossiliferous concretions from the Cretaceous Santana Formation fossil Lagerstätte (Brazil). Sedi-mentology, 2017, 64(1): 150‒167
[5] Heimhofer U, Hesselbo S P, Pancost R D, et al. Evidence for photic-zone euxinia in the Early Albian Santana Formation (Araripe Basin, NE Brazil). Terra Nova, 2008, 20(5): 347‒355
[6] Marramà G, Lombardo C, Tintori A, et al. Redescrip-tion of “Perleidus” (Osteichthyes, Actinopterygii) from the Early Triassic of northwestern Madagascar. Ri-vista Italiana di Paleontologia e Stratigrafia, 2017, 123(2): 219‒242
[7] Falconnet J, Andriamihaja M, Läng É, et al. First procolophonid (Reptilia, Parareptilia) from the Lower Triassic of Madagascar. Comptes Rendus Palevol, 2012, 11(5): 357‒369
[8] Antunes M T, Maisey J G, Marques M M, et al. Triassic fishes from the Cassange Depression (R. P. de Angola). Ciências de Terra (UNL), 1990(Numero Especial): 1‒64
[9] Stensiö E. Triassic fishes from Spitzbergen. Wien: A Holzhausen, 1921
[10] Romano C, Brinkmann W. A new specimen of the hy-bodont shark Palaeobates polaris with three-dimen-sionally preseved Meckel’s cartilage from the Smithian (Early Triassic) of Spitsbergen. Journal of Vertebrate Paleontology, 2010, 30(6): 1673‒1683
[11] Stensiö E. Triassic fishes from East Greenland. Medd Grønland, 1932, 83(3): 1‒305
[12] Mutter R J. Jaws and dentition in an Early Triassic, 3-dimensionally preserved eugeneodontid skull (Chon-drichthyes). Acta Geologica Polonica, 2008, 58(2): 223‒227
[13] Romano C, Kogan I, Jenks J, et al. Saurichthys and other fossil fishes from the late Smithian (Early Triassic) of Bear Lake County (Idaho, USA), with a discussion of saurichthyid palaeogeography and evo-lution. Bulletin of Geosciences, 2012, 87(3): 543‒570
[14] Romano C, Ware D, Brühwiler T, et al. Marine Early Triassic Osteichthyes from Spiti, Indian Himalayas. Swiss Journal of Palaeontology, 2015, 135(2): 275‒ 294
[15] Tong J, Zhou X, Erwin D H, et al. Fossil fishes from the Lower Triassic of Majiashan, Chaohu, Anhui Pro-vince, China. The Paleontological Society, 2006, 80 (1): 146‒161
[16] 周敏, 付宛璐, 张超, 等. 下三叠统奥伦尼克阶含鱼化石结核地质意义初探. 地层学杂志, 2015, 39 (4): 395‒402
[17] Tintori A, Hitij T, Jiang D Y, et al. Triassic actinop-terygian fishes: the recovery after the end-Permian crisis. Integrative Zoology, 2014, 9(4): 394‒411
[18] Scheyer T M, Romano C, Jenks J, et al. Early Triassic marine biotic recovery: the predators’ perspective. PLOS One, 2014, 9(3): e88987
[19] Romano C, Koot M B, Kogan I, et al. Permian-Triassic Osteichthyes (bony fishes): diversity dynamics and body size evolution. Biological Reviews, 2016, 91: 106‒147
[20] Coleman M L, Raiswell R. Source of carbonate and origin of zonation in pyritiferous carbonate concre-tions: evaluation of a dynamic model. American Jour-nal of Science, 1995, 295: 282‒308
[21] Raiswell R, Fisher Q J. Mudrock-hosted carbonate concretions: a review of growth mechanisms. Journal of the Geological Society, 2000, 157: 239‒251
[22] Raiswell R. The growth of Cambrian and Liassic concretions. Sedimentology, 1971, 17(3/4): 147‒171
[23] Mozley P S. The internal structure of carbonate con-cretions in mudrocks: a critical evaluation of the conventional concentric model of concretion growth. Sediment Geology, 1996, 103(1/2): 85‒91
[24] Bojanowski M J, Clarkson E N K. Origin of siderite concretions in microenvironments of methanogenesis developed in a sulfate reduction zone: an exception or a rule?. Journal of Sedimentary Research, 2012, 82 (8): 585‒598
[25] 苏德造. 记裂齿鱼属(Perleidus)一新种. 古脊椎动物与古人类, 1981, 19(2): 107‒112
[26] Sun Z Y, Tintori A, Jiang D Y, et al. A new Perlei- did from the Spathian (Olenekian, Early Triassic) of ChaoHu, Anhui Province, China. Rivista Italiana di Paleontologia e Stratigrafia, 2013, 119(3): 275‒285
[27] 苏德造, 黎作骢. 记湖北大冶群一新的裂齿鱼类. 古脊椎动物与古人类, 1983, 21(1): 9‒16
[28] Li Q G. A new parasemionotid-like fish from the Lower Triassic of Jurong, Jiangsu Province, South China. Palaeontology, 2009, 52(2): 369‒384
[29] 刘冠邦, 冯洪真, 王菊香, 等. 江苏句容青山早三叠世鱼类. 古生物学报, 2002, 41(1): 27‒52
[30] 钱迈平, 朱士鹏, 赵凤鸣, 等. 江苏句容早三叠世鱼类化石之发现及其意义. 江苏地质, 1997, 21(2): 65‒71
[31] Tintori A, Huang J D, Jiang D Y, et al. A new saurichthys (Actinopteryg) from the Spathian (Early Triassic) of Chaohu (Anhui Province, China). Rivista Italiana di Paleontologia e Stratigrafia, 2014, 120(2): 157‒164
[32] Romano C, Goudemand N, Vennemann T W, et al. Climatic and biotic upheavals following the end-Permian mass extinction. Nature Geoscience, 2012, 6(1): 57‒60
[33] Honisch B, Ridgwell A, Schmidt D N, et al. The geo-logical record of ocean acidification. Science, 2012, 335: 1058‒1063
[34] Sun Y D, Joachimski M M, Wignall P B, et al. Lethally hot temperatures during the Early Triassic greenhouse. Science, 2012, 338: 366‒370
[35] 梁丹, 童金南, 赵来时. 安徽巢湖平顶山西坡剖面早三叠世 Smithian-Spathian 界线地层研究. 中国科学: 地球科学, 2011(2): 149‒157
[36] Song H J, Wignall P B, Chu D L, et al. Anoxia/high temperature double whammy during the Permian-Triassic marine crisis and its aftermath. Scientific Reports, 2014, 4(4): 4132
[37] Qiu X C, Xu Y L, Chen Z Q, et al. The Early Triassic Jurong fish fauna, South China: age, anatomy, ta-phonomy, and global correlation. Global and Plane-tary Change, 2019, 180: 33‒50
[38] Liu S, Sun Z Y, Ji C, et al. Conodont biostratigraphy and age of the Early Triassic fish-bearing-nodule levels from Nanjing and Jurong, Jiangsu Province, South China. Journal of Earth Science, 2020, 31(2): 9‒21
[39] 冯增昭, 鲍志东, 李尚武. 中国南方早中三盆世岩相古地理. 北京: 石油工业出版社, 1997
[40] 付宛璐. 早三叠世安徽巢湖动物群古环境背景分析[D]. 北京: 北京大学, 2016
[41] 童金南, Yuri D Z, 吴顺宝. 安徽巢湖地区早三叠世菊石序列(英文). 古生物学报, 2004, 43(2): 192‒204
[42] Li S Y, Tong J N, Liu K Y, et al. The Lower Triassic cyclic deposition in Chaohu, Anhui Province, China. Palaeogeography, Palaeoclimatology, Palaeoecology, 2007, 252: 188‒199
[43] Song H Y, Du Y, Algeo T J, et al. Cooling-driven oceanic anoxia across the Smithian/Spathian boundary (mid-Early Triassic). Earth-Science Reviews, 2019, 195: 133‒146
[44] 左景勋, 童金南, 邱海鸥, 等. 巢湖地区早三叠世碳氧同位素地层对比及其古生态环境意义. 地质地球化学, 2003, 31(3): 26‒33
[45] Wilkin R T, Barnes H L, Brantley S L. The size distribution of framboidal pyrite in modern sediments: an indicator of redox conditions. Geochimica et Cos-mochimica Acta, 1996, 60(20): 3897‒3912
[46] Zhao L S, Orchard M J, Tong J N, et al. Lower Triassic conodont sequence in Chaohu, Anhui Pro-vince, China and its global correlation. Palaeogeo-graphy, Palaeoclimatology, Palaeoecology, 2007, 252 (1/2): 24‒38
[47] Irwin H, Coleman M, Curtis C. Isotopic evidence for source of diagenetic carbonates formed during burial of organic-rich sediments. Nature, 1977, 269: 209‒ 213
[48] Marshall J D, Pirrie D. Carbonate concretions — explained. Geology Today, 2013, 29(2): 53‒62
[49] Berner R A. Chemical changes affecting dissolved calcium during the bacterial decomposition of fish and clams in sea water. Marine Geology, 1969, 7(3): 253‒274
[50] Selles-Martinez J. Concretion morphology, classifica-tion and genesis. Earth-Science Reviews, 1996, 41(3): 177‒210
[51] Bond D P G, Wignall P B. Pyrite framboid study of marine Permian-Triassic boundary sections: a complex anoxic event and its relationship to contemporaneous mass extinction. Bulletin of the Geological Society of America, 2010, 122(7/8): 1265‒1279
[52] Song H Y, Tong J N, Algeo T J, et al. Large vertical δ13CDIC gradients in Early Triassic seas of the South China craton: implications for oceanographic changes related to Siberian Traps volcanism. Global and Pla-netary Change, 2013, 105: 7‒20
Late Smithian (Early Triassic) Fish-bearing Concretions from Chaohu Area: Geochemistry and Its Significance
Abstract Fish-bearing carbonate concretions are found in the organic-rich shale at the top of Helongshan Formation, Lower Triassic in Chaohu area, Anhui Province. In order to study the formation mechanism and environmental significance of the carbonate concretions, petrography, major and trace elements, carbon and oxygen isotopes and environmental minerals were analyzed for the concretions and surrounding rocks. The 3D-preserved fish fossils and high carbonate content (80%) in the center of concretions indicate that concretions were formed in the early diagenetic stage. Concretions have a concentric zoning structure inside. From the center to the edge, the content of carbonate decreases, the content of siliceous clastic increases and laminae gradually appears, the content of Fe and S elements increases, δ13C values increase, δ18O values decrease, and TOC contents gradually increases, all indicating a concentric growth of concretions. The analysis of the size of framboidal pyrites in the host rock indicates a euxinic environment where concretions were formed. The level of concretions appears 1 m below the Smithian-Spathian boundary (SSB), consistent with the increased burial of organic carbon, rapid positive excursion of δ13C (−1.3‰ to 1.9‰) and seawater euxinic event. The concretions have the potential to be regarded as an auxiliary identification marker of SSB in South China.
Key words carbonate concretion; concentric growth; euxinic; Early Triassic; Chaohu
收稿日期: 2020–02–02;
修回日期: 2020–05–11
doi: 10.13209/j.0479-8023.2020.117
国家自然科学基金(41872164 , 41972003)和国家重点研发计划(2016YFC053301)资助