表1 Hoechst 33342/PI 双染细胞形态
Table 1 Morphology of cells with Hoechst 33342/PI double staining

细胞类型染色判定 活细胞淡蓝色, 核呈正常结构 早期凋亡细胞深蓝色, 核呈固缩状或圆珠状 晚期凋亡细胞粉红色, 可见明显的染色质凝集 非凋亡的死亡细胞大红色, 核呈正常结构
研究简报
摘要 采用 Cell Counting Kit-8 (CCK-8)和 Hoechst 33342/PI 等, 分析十溴联苯醚(BDE-209)对人正常肝L-02细胞增殖和凋亡的影响。结果显示, 在不同浓度水平(0~70μg/mL)的 BDE-209 中暴露 24 小时后, 细胞增殖抑制率随着 BDE-209 浓度的升高而升高。经 SPSS-Probit-Logit 法计算, 得出 BDE-209 对人正常肝 L-02 细胞 24小时的 IC50 为 127.08±24.93μg/mL。在不同浓度水平(0~15μg/mL)的 BDE-209 中暴露 24 小时后, 与对照组相比, 各剂量组细胞未出现明显的细胞形态变化, 仅在 15μg/mL 剂量组观察到细胞减少的现象。凋亡染色后, 荧光显微镜检发现, 随着 BDE-209 浓度升高, 亮蓝、淡粉染色细胞数量增大, 人正常肝 L-02 细胞的凋亡率增高。与对照组相比, 各剂量组差异均具有统计学意义。分析结果表明, BDE-209可引起人正常肝L-02细胞增殖受到抑制, 并诱导细胞凋亡率增加。
关键词 BDE-209; 人肝L-02细胞; 细胞增殖; 细胞凋亡
作为溴代阻燃剂, 多溴联苯醚(poly brominated diphenyl ethers, PBDEs)广泛应用于塑料制品、电子电气设备、纺织品与生活用品, 已成为全球范围内的持久性环境污染物[1]。PBDEs 释放到环境介质中持久存在且难降解, 造成环境污染, 并通过食物链进入人体, 危害人体健康。PBDEs 不仅能影响生物体的生长、神经发育和生殖, 还可在细胞和分子水平导致氧化应激, 促使自由基的产生, 影响相关基因的表达, 甚至引起细胞死亡[2]。
十溴联苯醚(BDE-209)是多溴联苯醚中含溴原子数最多的一种化合物, 由于价格低廉, 性能优越, 急性毒性在所有溴联苯醚中最低, 所以在全球使用最广, 如用于电子电器和自动控制设备、建材、纺织品和家具等产品中。据统计, 其使用总量占阻燃剂总量的 75%以上。BDE-209在环境中经光解、高温分解、生物及微生物降解, 极易发生脱溴反应, 产生低溴代联苯醚, 其危害性不容忽视[3]。
吴伟等[4]研究了多溴联苯醚胁迫下鲫鱼肝脏微粒体类固醇诱导性同工酶(CYP3A1)和谷胱甘肽转移酶(GST)的响应, 发现鲫鱼暴露于 0.10~5.00 mg/L的 BDE-47 和 5.00~50.0 mg/L 的 BDE-209 中 15 天后, 肝微粒体中 CYP3A1 被诱导, 呈显著的剂量-效应关系。那广水等[5]将 BDE-47 等 5 种溴阻燃剂与人肝 L-02 细胞共同培养, 采用四甲基偶氮噻唑蓝比色法(MTT)检测 5 种溴代阻燃剂对人肝 L-02 细胞的相对增殖率, 并按照 GB/T16886.5—2003/ISO10993 —5: 1999 标准, 评价 5 种溴阻燃剂对人肝 L-02 细胞的毒性。体外实验表明, 5 种溴阻燃剂对人肝 L-02细胞均具有抑制作用, 其中 BDE-47, BDE-99 和HBCD 呈现剂量依赖关系。因此, 本研究选取 BDE- 209 为代表性多溴联苯醚类化合物, 以人肝 L-02 细胞系为体外实验系统, 采用 CCK-8 等方法, 评价BDE-209 对人正常肝 L-02 细胞增殖和凋亡的影响, 为探讨 BDE-209 毒性作用机制提供基础数据和科学依据。
人正常肝 L-02 细胞购自 ATCC, 深圳市疾病预防控制中心保种。
BDE-209 购自 Sigma-Aldrich 公司, 1640 培养基和胎牛血清购自 Gibco 公司, CCK-8 购自同仁公司, Hoechst 33342/PI 购自碧云天公司, 盐类购自上海生工生物有限公司。
1.2.1 BDE-209贮存与配置
称取适量的 BDE-209 粉末溶于 DMSO, 用 1640完全培养基(含 10%胎牛血清)依次稀释至实验所需浓度, 并使 DMSO 终浓度低于 0.5%, 用 0.22μm 无菌滤膜过滤除菌, 现用现配。
1.2.2 细胞培养
将冻存的人正常肝 L-02 细胞从液氮罐中取出, 迅速放入 40~42ºC 水浴中, 轻轻晃动冻存管, 使细胞迅速解冻, 待冻存液全部溶解后, 在无菌条件下将冻存细胞液转移至 15mL 离心管中, 加 5mL 1640完全培养基洗涤细胞, 1000rpm离心 5 分钟, 弃上清液, 加入 5mL 1640 完全培养基重悬细胞, 将细胞悬液转移至 25cm2 培养瓶中, 在37ºC 5% CO2条件下进行培养、传代和冻存保种。
1.2.3细胞活力测定
使用 0.25% Trypsin-EDTA 消化肝 L-02 细胞, 1640 完全培养基终止消化, 1000 rpm 离心 5 分钟, 弃上清液, 加入 1640 完全培养基重悬细胞, 以 1× 103 个/孔密度接种于 96 孔板中, 在 37ºC 5% CO2条件下培养 24 小时, 待细胞贴壁生长至 70%~80%的丰度后, 按照空白对照(1640 培养基对照)组、阴性对照(1640 培养基+肝 L-02 细胞)组和不同剂量组(10, 20, 30, 40, 50, 60, 70 μg/mL), 依次加入 BDE-209 溶液, 每个剂量做 6 个复孔。在 37ºC 5% CO2条件下培养 24 小时后, 每孔加入 10μL CCK-8, 在37ºC 5% CO2 条件下孵育 2~3 小时, 用酶标仪在 450 nm 处读取 OD 值。按以下公式计算: 细胞生长抑制率=[(阴性对照组 OD −实验组 OD)]/阴性对照组OD×100%。采用 SPSS 19.0 软件 Logit 法计算受试物对人正常肝 L-02 细胞的半抑制浓度 IC50。
1.2.4细胞凋亡观察
将对数生长期人正常肝 L-02 细胞以 1×105 个/孔的密度接种于 6 孔板中, 在 37ºC5% CO2 条件下培养 24 小时, 待细胞贴壁生长至 70%~80%的丰度后, 分别加入 0, 3.75, 7.5和15 μg/mL BDE-209 溶液(各组 DMSO 终浓度为 0.5%), 对照组加入 1640 培养基和 0.5% DMSO, 每个剂量做 3 个复孔。在 37ºC 5% CO2 条件下培养 24 小时, 弃去细胞培养基, 预冷 1×PBS 清洗 2 次, 加入 0.5~1mL Hoechst 33342染色液, 置于室温避光染色 30 分钟, 弃染色液, 预冷 1×PBS 清洗 2 次, 加入 0.5~1mLPI(终浓度 5μg/ mL)避光染色 15 分钟。预冷 PBS 清洗一遍, 再加入预冷的 PBS, 倒置于荧光显微镜下镜检计数。Hoechst 33342/PI 双染细胞在荧光显微镜下可见 4种形态(表1)。
对视野内的凋亡细胞进行计数, 每个视野计数的总细胞数(活细胞+非凋亡的死亡细胞+早期凋亡细胞+晚期凋亡细胞)为 100 个, 计数 10 个视野。凋亡率(%)=(早期凋亡细胞+晚期凋亡细胞)/100×100%。
1.2.5统计分析
采用 SPSS 19.0 软件分析数据, 实验结果用均值±标准差(Mean±SD)表示。组间比较采用单因素方差分析, 方差齐性时组间两两比较采用 LSD 法, 方差非齐性时采用 Tamhame’s T2 法, p<0.05 为差异有统计学意义。
在 0, 10, 20, 30, 40, 50, 60 和 70 μg/mL BDE-209中暴露 24 小时后, 测得人正常肝 L-02 细胞的细胞抑制率范围为(0.00±0.89)%~(20.20±0.81)% (图 1), 细胞增殖抑制率随着 BDE-209 浓度的升高而升高。经 SPSS-Probit-Logit 法计算, 得出 BDE-209 对人正常肝 L-02 细胞 24 小时的 IC50 为 127.08±24.93 μg/mL。
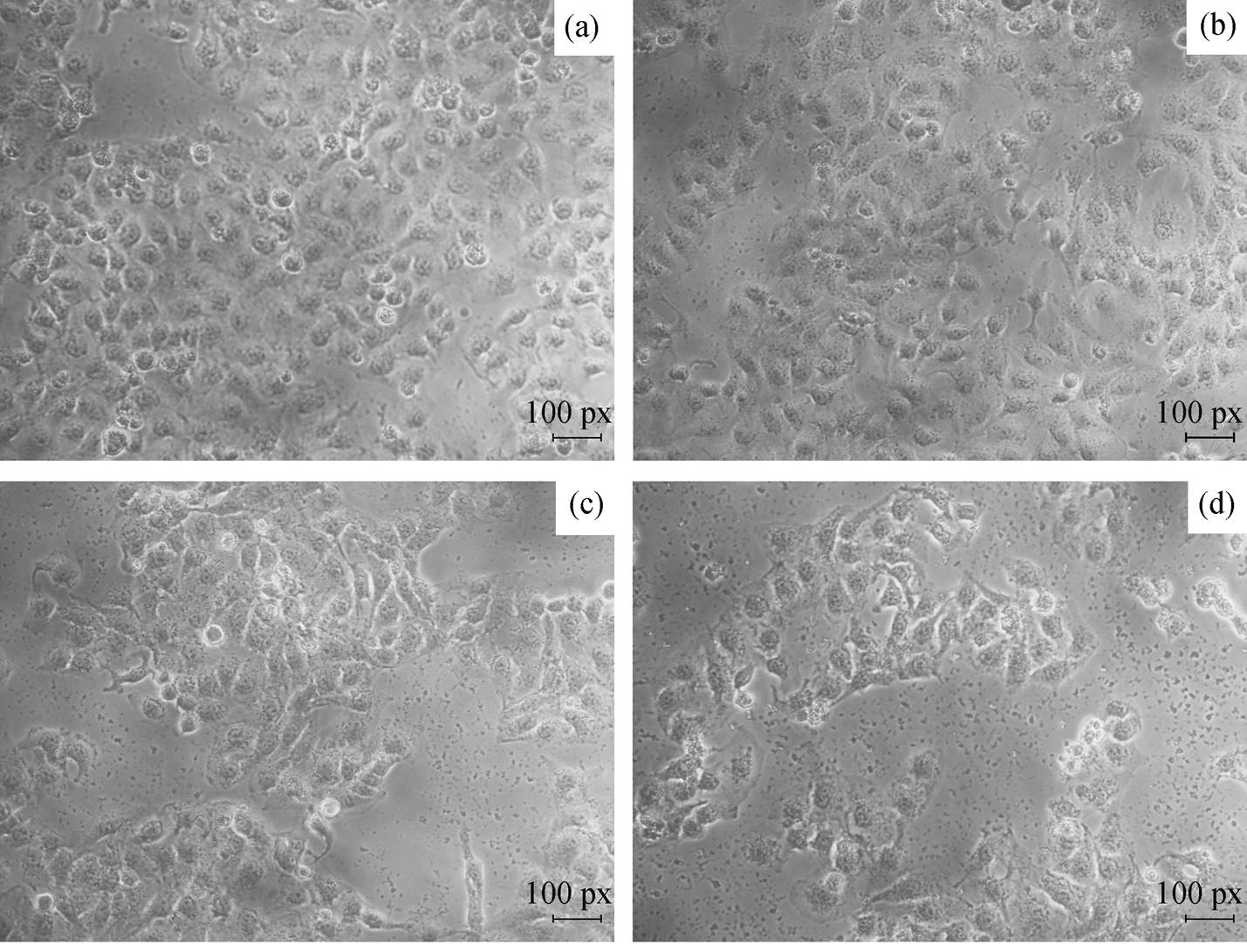
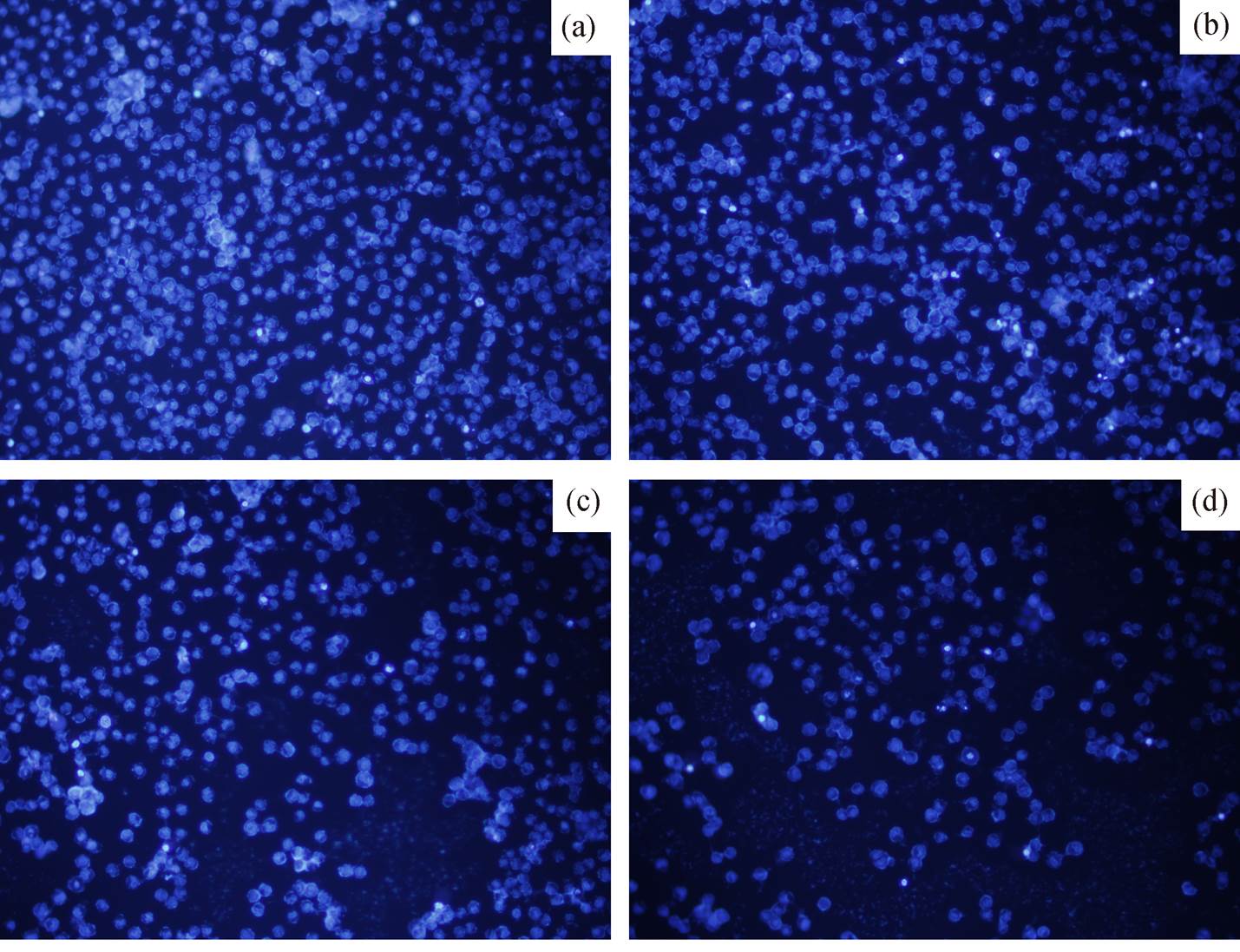
如图 2 所示, 0, 7.5, 15 和 30 μg/mL BDE-209 暴露 24 小时后, 与对照组相比, 各剂量组细胞没有出现明显的细胞形态变化, 仅在 15 μg/mL 剂量组观察到细胞减少的现象。凋亡染色后, 经荧光镜检发现, 亮蓝和淡粉染色细胞随着 BDE-209 浓度的升高而增加(图 3)。经计数后得出, 0, 7.5, 15 和 30μg/mL BDE-209 暴露 24 小时后, 人正常肝 L-02 细胞的凋亡率分别为 6.2%±0.92%, 8.9%±1.10%, 9.1%±0.91%和 9.3%±0.95% (p<0.01), 与对照组相比, 各剂量组差异均具有统计学意义(图 4)。
表1 Hoechst 33342/PI 双染细胞形态
Table 1 Morphology of cells with Hoechst 33342/PI double staining

细胞类型染色判定 活细胞淡蓝色, 核呈正常结构 早期凋亡细胞深蓝色, 核呈固缩状或圆珠状 晚期凋亡细胞粉红色, 可见明显的染色质凝集 非凋亡的死亡细胞大红色, 核呈正常结构

图1 BDE-209 暴露 24 小时后人正常肝 L-02细胞的增殖抑制率
Fig. 1 Proliferation inhibitory rate of human normal liver L-02 cells exposed to BDE-209 for 24 hours
(a) 0 μg/mL; (b) 7.5 μg/mL; (c) 15 μg/mL; (d) 30 μg/mL
图2 BDE-209暴露24小时后人正常肝L-02细胞形态图(200×)
Fig. 2 Morphological chart in human normal liver L-02 cells after 24 hours exposure to BDE-209 (200×)
(a) 0 μg/mL; (b) 7.5 μg/mL; (c) 15 μg/mL; (d) 30 μg/mL
图3 BDE-209暴露24小时后人正常肝L-02细胞凋亡荧光图(200×)
Fig. 3 Apoptotic fluorescence of human normal liver L-02 cells 24 hours after exposure to BDE-209 (200×)
随着 PBDEs 的大量使用, 造成的环境污染也日益严重, 迄今已在土壤、空气和底泥等各种环境介质以及生物体中发现 PBDEs 污染。PBDEs 亲脂性强, 化学性质稳定, 不易降解, 可以随着食物链生物富集和放大, 还能通过母乳、胎盘和脐带血转移到下一代的体内[6-7]。动物研究表明, PBDEs 具有一定的致癌和致畸毒性, 其中 BDE-209 暴露会导致肝脏和甲状腺肿瘤病变[8]。还有报道表明, BDE-209 能引起雌性或雄性生殖功能的损伤[9]。周俊等[10]发现, 母鼠怀孕期间暴露于 BDE-209 后, 其后代的淋巴细胞分化受到严重影响。
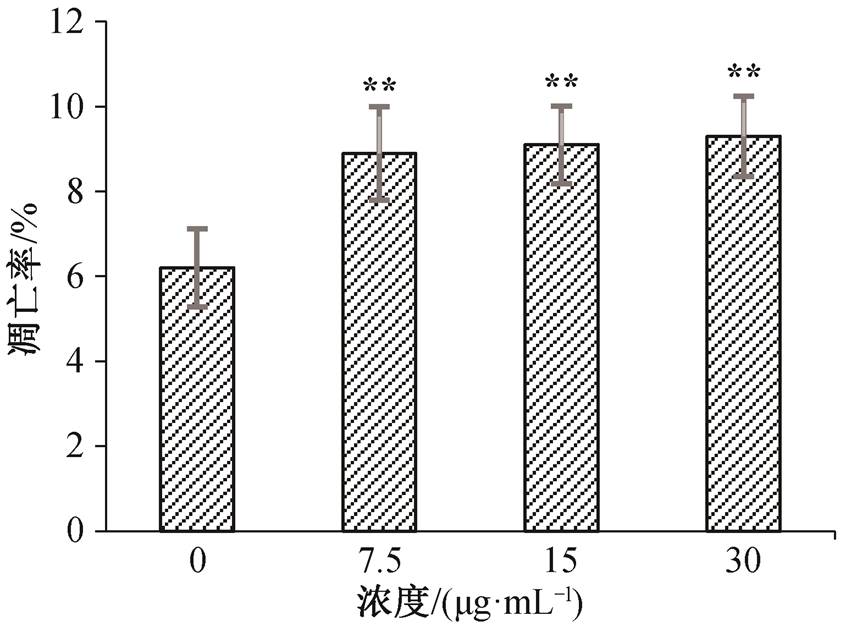
* p<0.05; ** p<0.01
图4 BDE-209暴露24小时后人正常肝L-02细胞凋亡率
Fig. 4 Apoptotic rate of L-02 cells in human normal liver after exposure to BDE-209 for 24 hours
肝脏是 PBDEs 的主要靶器官, BDE-209 对于肝细胞的毒性机制尚不明确。细胞增殖抑制率和细胞凋亡率是多数学者采用的一种评定细胞毒性的参数, CCK-8 实验方法可以快速、准确地判断环境污染物的细胞毒性, 评价化学污染物的环境危害及人体健康风险。本文细胞增殖结果显示, BDE-209 显著抑制肝 L-02 细胞的增殖, 对细胞形态影响不明显, 但会造成细胞数量减少。细胞凋亡结果显示, BDE-209 可显著地诱导肝 L-02 细胞的凋亡, 镜下可见明显的荧光信号, 15μg/mL PBDE-209 暴露即可引起显著的细胞凋亡变化。BDE-209 对小鼠神经母细胞瘤(Neuro-2a)具有明显的细胞毒性作用, 通过活性氧的形成对人神经母细胞瘤细胞具有基因毒性, 能显著降低 Neuro-2a 细胞的活力, 抑制细胞生长, 増加细胞死亡率, 呈剂量和时间依赖性地诱导 Neuro-2a 细胞调亡[11]。PBDEs 暴露可诱导肝HepG2 细胞细胞活力抑制、凋亡率增加、细胞周期阻滞和 DNA 损伤, 这可能与自由基升高、抗氧化系统受损导致氧化应激反应的改变有关[12]。因此, 可能是由于 BDE-209 诱导细胞凋亡抑制了肝 L-02细胞的增殖。
综上所述, BDE-209 是一种以肝脏为靶器官的环境持久性污染物, 可以通过诱导细胞凋亡引起肝L-02 细胞的生长抑制, 这可能是其肝毒性的机制之一。
参考文献
[1] 秦佩恒, 倪宏刚, 刘阳生, 等. 深圳市表层土壤中 PBDEs 空间分布特征及蓄积量估算. 北京大学学报(自然科学版), 2011, 47(1): 127-132
[2] Doucet J, Tague B, Arnold D L, et al. Persistent organic pollutant residues in human feta lliver and placenta from Greater Montreal, Quebec: a longitu-dinal study from 1998 through 2006. Environmental Health Perspectives, 2009, 117(4): 605-610
[3] Qian Bo, Wang Chengqiang, Zhao Chaochao, et al. Effects of maternal exposure to BDE209 on neuronal development and transcription of iodothyronine deio-dinase in offspring mice. Toxicology mechanisms and methods, 2019, 29(1): 1-24
[4] 吴伟, 瞿建宏, 聂凤琴, 等. 多溴联苯醚胁迫下鲫鱼肝脏微粒体 CYP3A1 和 GST 的响应. 生态环境学报, 2009, 18(3): 805-810
[5] 那广水, 孙丽娟, 张雯雯, 等. 溴阻燃剂对肝细胞的毒性. 生态毒理学报, 2012, 7(5): 570-573
[6] 万斌, 郭良宏. 多溴联苯醚的环境毒理学研究进展, 环境化学, 2011, 30(1): 143-152
[7] Chen D, Hale R C. A global review of polybrominated diphenyl ether flame retardant contamination in birds. Environment International, 2010, 36(7): 800-811
[8] Darnerud P O. Toxic effects of brominated flame retardants in man and in wildlife. Environment In-ternational, 2003, 29(6): 841-853
[9] 李向阳, 朱玉鹏, 张崇海, 等. BDE-209 通过 DNA损伤反应信号通路介导的细胞周期阻滞和凋亡诱导雄性生殖毒性 // 2019 全国呼吸毒理与卫生毒理学术研讨会论文集. 厦门, 2019: 034
[10] 周俊, 陈敦金, 廖秦平, 等. 孕期、哺乳期暴露十溴联苯醚对 3 代大鼠免疫功能的影响. 南方医科大学学报, 2006, 26(6): 738-741
[11] 陈红梅. 两种多溴联苯醚(BDE-47和BDE-209)诱导Neuro-2a的细胞毒性与细胞凋亡及分子调控机制研究[D]. 青岛: 中国海洋大学, 2015
[12] An Jing, Li Shuhui, Zhong Yufang, et al. The cytotoxic effects of synthetic 6-hydroxylated and 6-methoxylated polybrominated diphenyl ether 47 (BDE47). Environmental Toxicology, 2011, 26(6): 591-599
Effects of Decabrominated Diphenylether-209 on Cell Proliferation and Cell Apoptosis in Human Liver L-02 Cells
Abstract The effects of BDE-209 (decabrominated diphenylether-209) on the proliferation and apoptosis of human normal liver L-02 cells were analyzed by CCK-8 and Hoechst 33342/PI methods. The results showed that the inhibition rate of cell proliferation increased with the increase of BDE-209 concentration after 24 hours exposure at different concentration levels (0-70 μg/mL). The IC50 of BDE-209 on human normal L-02 cells for 24 hours was 127.08±24.93 μg/mL, which was analyzed by SPSS-Probit-Logit method. After 24 hours exposure to BDE-209 at different concentration levels (0-15 μg/mL), there was no significant change in cell morphology in each dose group compared with the control group, and only cell reduction was observed in the 15 μg/mL dose group. After apoptotic staining, fluorescence microscopy showed that the number of cells stained with brilliant blue and light powder increased with the increase of BDE-209 concentration, and the apoptosis rate of human normal liver L-02 cells increased with the increase of BDE-209 concentration. Compared with the control group, the difference of each dose group was statistically significant. The results showed that BDE-209 could inhibit the proliferation of human normal liver L-02 cells and increase the apoptotic rate.
Key words decabrominated diphenylether-209; human liver L-02 cell; cell proliferation; cell apoptosis
收稿日期: 2019-08-13;
修回日期: 2020-05-18
深圳市知识创新计划基础研究项目(JCYJ20160531114757157)和深圳市环境科研课题(SZCG2019194864)资助