
图1PCC6715的培养光质
Fig. 1 Culture light quality conditions of PCC6715
摘要 使用光合有效光量子数密度(PAR)均为 100μmol/(m2∙s)的白光(对照)、红光和蓝光, 对对数生长期的嗜热蓝细菌 PCC6715 进行培养, 以期探明不同光质对不表达藻红素的蓝细菌光适应生长的影响。结果表明, 在不同光质培养对数生长期 PCC6715 的过程中, 与白光相比, 干重在蓝光下明显增加, 红光下明显减少; 红、蓝光质对光合色素合成产生影响的开始时间和持续时间有所不同; 最大光能转化效率(Fv/Fm)在蓝光下明显提高, 红光下明显降低, 培养 6 天后, 红、蓝光条件下的 Fv/Fm 均趋于稳定。蓝光有利于 PCC6715 的生长, 红光不利于 PCC6715 的生长; 同时, PCC6715 在红、蓝光质中均产生适应性生长, 藻蓝素的减少使 PCC6715 在红光中发生适应性生长, 蓝光中 PCC6715 发生适应性生长是由于藻蓝素的增加。
关键词 蓝细菌; 嗜热蓝细菌; 光质; 光适应生长; 藻蓝素
嗜热蓝细菌分离于 45ºC 以上的温泉地带, 是2000 余种蓝细菌的重要组成菌种[1–2]。蓝细菌不仅对水体生态系统的维持有重要作用, 而且遗传学研究发现, 嗜热蓝细菌的存在是地球上能够出现其他生命体的重要原因[3–6]。蓝细菌是地球上重要的初级生产力, 环境中的光质和光强对其合成有机物的能力具有决定性的影响[4,7–9]。
近年来, 对嗜热蓝细菌的研究受到极大的关注。Liang 等[10]得到嗜热蓝细菌捕光色素蛋白质在不同温度和 pH 条件下的稳定结构。Eberly 等[11]通过测定嗜热蓝细菌在不同 CO2 浓度中的生长状况, 评估嗜热蓝细菌作为工业排放 CO2 的主要治理方式的可能性。Nikolova 等[12]和 Pedersen 等[13]研究嗜热蓝细菌对温度产生适应时, 承担光合作用相关组分的变化情况。MacColl[14]及 Wiltbank 等[4]等从光适应性生长的观点出发, 总结在不同光质条件下表达藻红素的蓝细菌生长发生变化的原因。这些研究为嗜热蓝细菌对环境要素的响应提供了依据, 但对蓝细菌光适应性生长的机理研究仍有不足之处, 相关研究以表达藻红素的蓝细菌为主, 对不表达藻红素的蓝细菌研究明显不足[15]。由于蓝细菌光适应性生长研究的局限, 可能会限制蓝细菌光适应生长研究成果的工程应用范围。
为补充对不表达藻红素的蓝细菌光适应生长的研究, 本文以 Liang 等[10]通过系统发育树方法鉴定出的不表达藻红素的对数生长期的嗜热蓝细菌PCC6715 为对象, 研究其在不同光质培养过程中的生长变化情况。
PCC6715 购自德克萨斯大学奥斯汀分校的藻类培养中心, 由北京大学深圳研究生院环境与能源学院环境生物能源实验室进行扩大培养, 具体步骤如下: 将购买的藻种按照 1:5 (藻种:BG11 培养基)进行稀释, 在有效光子数密度(PAR)为 100μmol/(m2·s)的白色 LED 光源(Ra=70)、光暗比=16 h : 8 h、45ºC 恒温摇床、150 r/min 的条件下进行培养, 待其生长至稳定期后, 将此时的藻种在相同的培养条件下进行第二次稀释培养, 待其生长至对数生长初期时, 取第二次生长到对数生长初期的藻种, 将其稀释到OD730nm=0.09 左右, 在如图 1 所示特征的蓝光(454nm, Ra=68)、红光(654nm, Ra=70)和白光(6500K, 400~700nm)中连续培养 7 天, 每种光质条件下设置 3 组独立的平行实验组。
配制 BG-11 培养基[1], 使用 HCl 或 NaOH 将培养基的 pH 调整至 7.1 左右, 121ºC 灭菌 30 分钟, 室温冷却后, 4ºC冷藏备用。

图1PCC6715的培养光质
Fig. 1 Culture light quality conditions of PCC6715
通过测定藻种的干重确定生长状况。取 10mL藻液, 在 4000r/min 的条件下离心 10 分钟, 弃上清液, 置于冻干机中 24 小时, 计算冻干处理前后的质量差值, 即为藻种的干重。
取 1mL 菌株培养悬浮液, 在 4ºC 条件下以15000g离心 7 分钟, 小心移去上清液, 加入 1mL预冷至 4ºC 的甲醇, 混匀样品后, 使用铝箔纸覆盖, 在 4ºC 冰箱孵育 20 分钟以提取来自细胞的色素, 孵育完成后, 以 15000g, 4ºC 的超速离心机中离心 7 分钟, 以甲醇作为空白校准分光光度计, 分别测定上清液与空白对照在 470, 665 和 720nm 处的吸光度。根据下式计算色素含量:
Chl.a(μg/mL)=12.9447(OD665nm−OD720nm) , (1)
 (2)
(2)取 10mL 菌液, 以 4000r/min 的转速在 4ºC 离心 15 分钟, 去上清液, 加入磷酸盐缓冲液(0.5mol/ L, pH=7.0)混合均匀, 用超声细胞破碎机破碎细胞3 分钟, 超声细胞破碎机的设置为输出 9 秒, 占空比65%。破碎完成后, 以 15000g 的速度在 4ºC 超速离心机中离心 7 分钟, 上层清液即为含藻胆素的提取液。整个过程尽量在黑暗环境中进行, 在冰上操作以避免高温的影响。通过分光光度计测量 615, 652和 562nm 处的吸光度, 根据文献[16]中公式计算藻胆蛋白含量。
使用 1mL 移液枪, 准确地移取 2mL 藻液, 在黑暗处静置 1 小时, 然后使用叶绿素荧光仪, 在 10μmol/(m2∙s)的 620nm 波段的红光条件下测得PCC6715 光合系统的初始荧光 F0, 在 210μmol/ (m2∙s)的 620nm波段的红光条件下测得 PCC6715 光合系统的最大荧光 Fm, 最大光能利用效率的测定公式为
Fv=Fm −F0 , (3)
Qy =Fv /Fm 。 (4)
本研究使用 Excel 2010 计算实验数据, 使用Graphpad Prism5.0 软件进行单因素方差分析(One-way ANOVA)。
在不同光质的培养过程中, 对照组与实验组中PCC6715 的干重均呈增加的趋势(图 2)。与对照组白光相比, PCC6715 的干重在蓝光下较高, 红光下较低。相对于白光, 蓝光对 PCC6715 的生长有显著的促进作用, 红光不利于对数生长期 PCC6715 的生长。
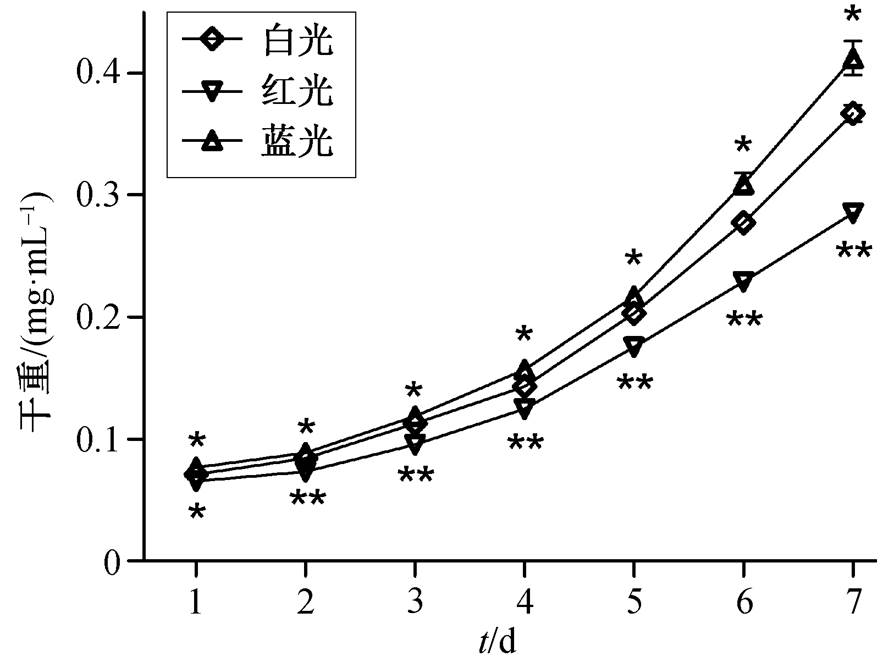
*P<0.05, **P<0.01, ***P<0.001, 下同
图2 PCC6715在不同光质培养过程中的干重差异
Fig. 2 Difference in dry weight of PCC6715 during different light quality cultures
PCC6715 的光合色素含量在不同光质中均呈现上升趋势, 最大光能转化效率均呈现先增加、后趋于稳定的趋势。PCC6715 叶绿素 a 含量的变化如图3(a)所示, 与白光对照组相比, PCC6715 在蓝光培养过程中叶绿素 a 含量明显升高, 红光条件下生长至第 5 天时叶绿素 a 含量才开始显著降低; 与红光相比, 蓝光对 PCC6715 叶绿素 a 的合成产生影响的时间更早, 且持续时间更长。图 3(b)显示 PCC6715 在不同光质培养下藻胆素含量的变化, 与白光相比, PCC6715 藻胆素的含量在蓝光下始终较高, 在红光下的含量从第 6 天开始出现明显的减少; 与红光相比, 蓝光对 PCC6715 藻胆素的合成产生影响的时间更早, 且持续时间更长。不同光质条件下 PCC6715的 Fv/Fm 变化如图 3(c)所示, 与白光对照组相比, PCC6715 的最大光能转化效率在蓝光培养下明显升高, 在红光条件下明显下降; 但是, 在不同光质培养过程中, PCC6715 的最大光能转化效率都表现出先增加、后归于平稳的变化趋势。图 3(d)显示不同光质中 PCC6715 生长过程中类胡萝卜素含量的变化, 与白光相比, PCC6715 类胡萝卜素含量在蓝光条件下培养至第 7 天开始明显地增多, 而在红光条件下从第 3 天即开始明显地降低; 与红光相比, 蓝光对 PCC6715 类胡萝卜素的合成产生影响的时间较晚。
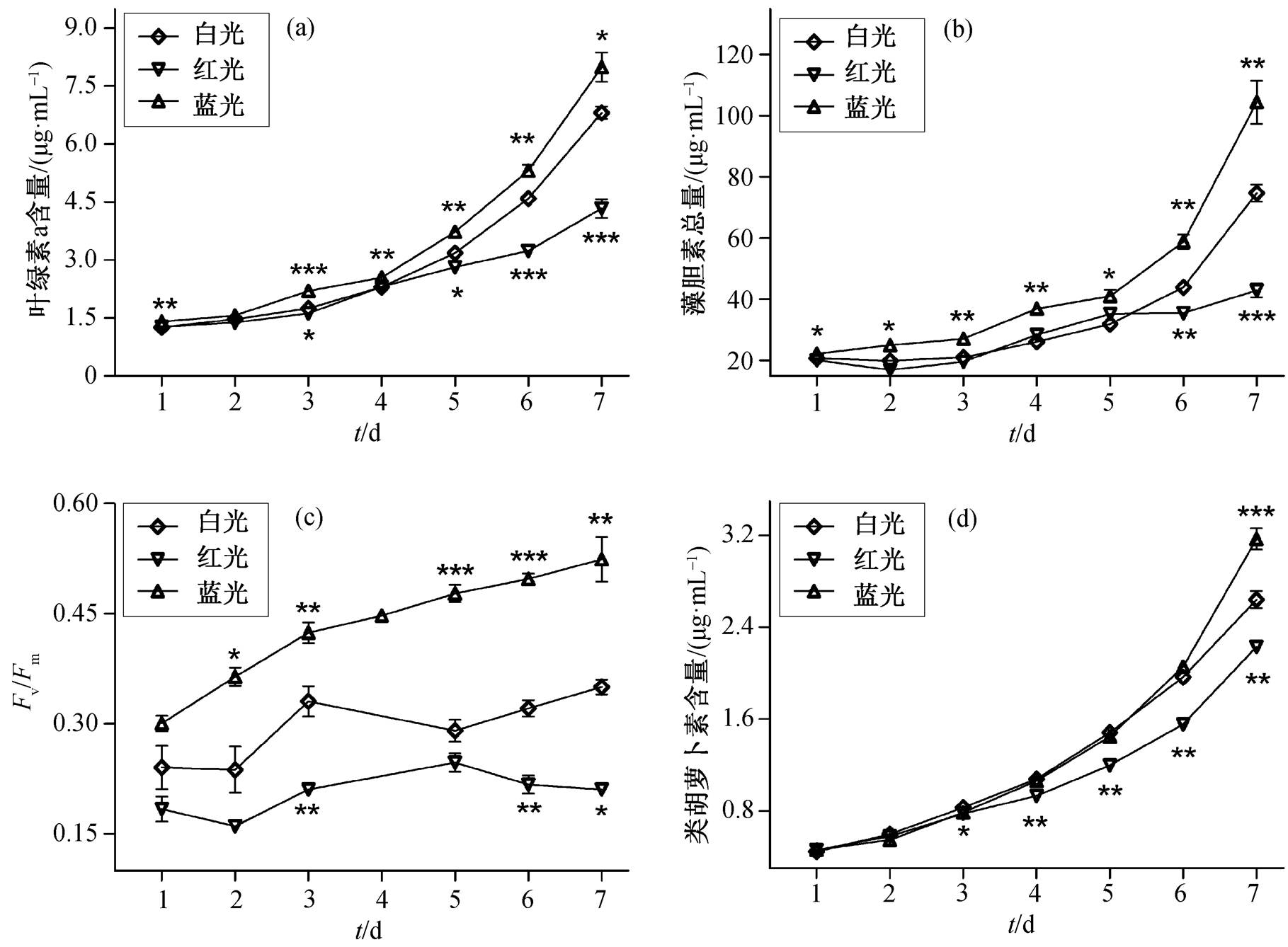
图3 不同光质条件下培养PCC6715时的光合色素与Fv/Fm特征
Fig. 3 Photosynthetic pigments and Fv/Fm characteristics of PCC6715 under different light quality conditions
对 PCC6715 进行全光谱扫描, 确定其光合色素的组成种类, 结果如图 4(a)所示。PCC6715的光合色素由叶绿素 a (吸收峰 435 和 675nm)、类胡萝卜素(吸收峰 490nm)以及捕光色素−藻蓝素(吸收峰 625nm)和别藻蓝素(吸收峰 650nm)共同构成。对不同光质 PCC6715 藻蓝素和别藻蓝素相对含量的测定结果见图 4(b)。在白光、红光和蓝光中, PCC6715别藻蓝素和藻蓝素的相对含量均降低; 与白光相比, 在蓝光条件的整个培养过程中 PCC6715 别藻蓝素和藻蓝素的相对含量均显著降低, 在红光培养的第2, 4, 6 和 7 天明显升高; PCC6715 中别藻蓝素和藻蓝素的相对含量在白光、蓝光与红光条件下培养 6 天后都趋于稳定。对 PCC6715 在不同光质中别藻蓝素含量的测定结果见图 4(c)。与白光对照组相比, PCC6715 的别藻蓝素含量在红光和蓝光中无显著变化。PCC6715 在不同光质中藻蓝素含量的测定结果见图 4(d)。与白光相比, PCC6715 藻蓝素的含量在蓝光条件下始终较高, 在红光条件下培养至第 6 天明显减少; 与红光相比, 蓝光对 PCC6715 藻蓝素的合成产生影响的时间更早, 且持续时间更长。
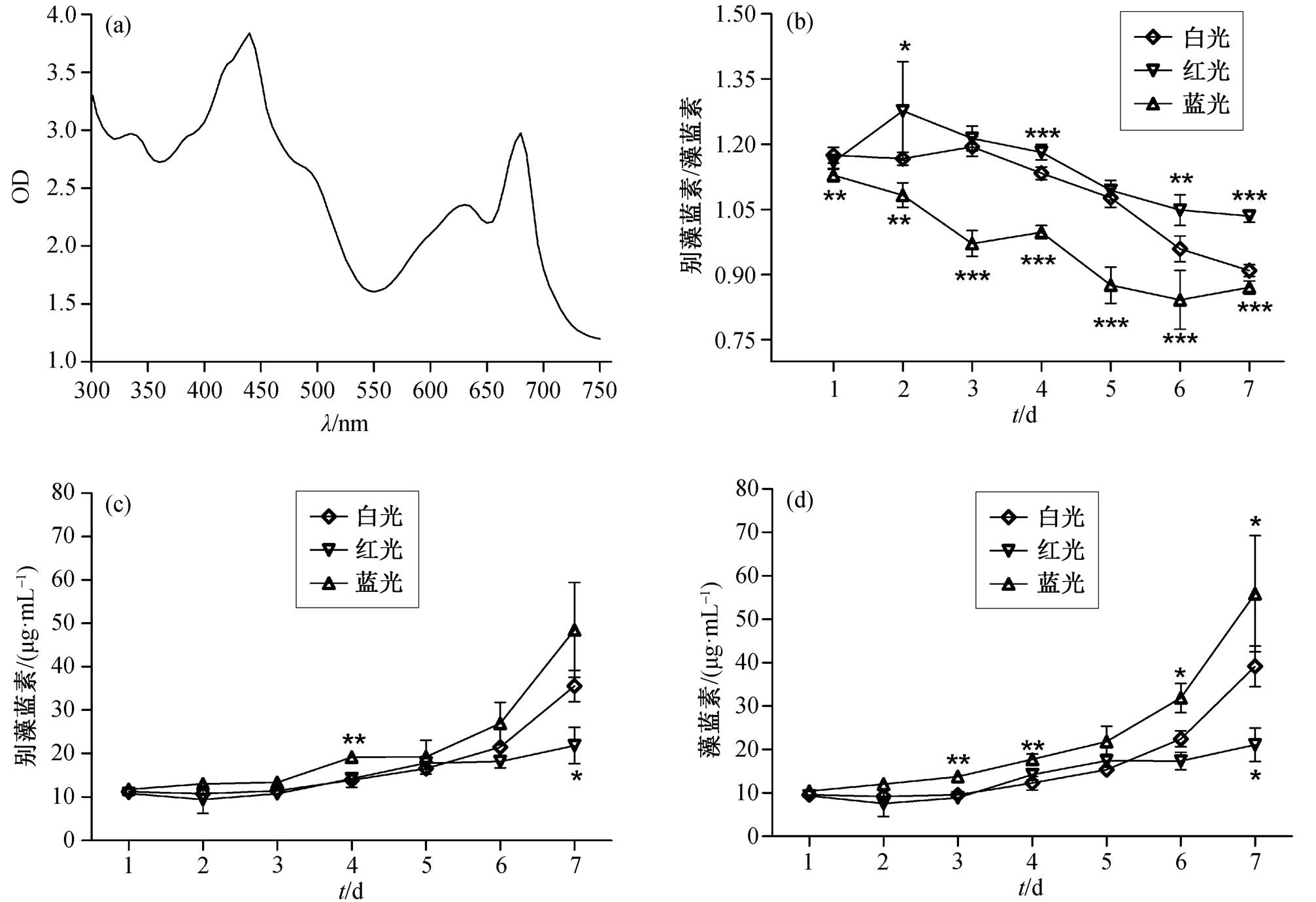
图4 PCC6715 的捕光色素在不同光质培养过程中的变化
Fig. 4 Changes of light-harvesting pigments of PCC6715 during different light quality culture processes
植物及藻类的干重反映其净光合作用的大小[17], 植物及藻类通过由光合反应中心色素与捕光色素共同组成的光合色素进行光合作用, 捕光色素将捕获到的 95%以上的光能传递至光合反应中心[18], 光合反应中心在利用光能时产生叶绿素荧光现象, 由光合反应中心叶绿素荧光现象获得的最大光能利用效率直接反映植物及藻类光合作用过程中发生的变化[19]。
本实验中, PCC6715 的干重在蓝光处理组中始终高于红光处理组, 实验结果与刘洪艳等[20]和韩军军[21]关于不同光质对蓝、红藻生长影响的实验结果相似。叶绿素 a、类胡萝卜素和藻胆素共同构成嗜热蓝细菌 PCC6715 的光合色素[3]。虽然在培养过程中, 蓝光条件下 PCC6715 的光合色素总量高于红光条件下, 但由于红、蓝光对 PCC6715 不同色素开始产生影响的时间或影响持续的时间不同, 所以PCC6715 在红、蓝光质中的干重差异不仅仅取决于光合色素的总量差异。另外, 最大光能利用效率代表光合系统对光能的利用效率, 由于蓝光条件下PCC6715 的最大光能利用效率始终大于红光培养条件下, 所以最大光能利用效率也是导致 PCC6715 在不同光质中差异生长的重要原因。
蓝细菌通过调整自身捕光色素的相对含量来实现在不同波长光照下的生长, 这一现象称为光适应生长[22]。最大光能利用效率不仅反映藻类在所处环境中的生长状态, 同时, 如果在培养环境中藻类出现最大光能利用效率发生变化但最终趋于稳定的现象, 则说明藻类在该培养环境中发生了适应性生长[23–24]。对含藻红素的蓝藻是否发生光适应性的判定依据是, 藻红素与藻蓝素的相对含量是否发生变化[25], 但对不含藻红素的蓝细菌发生光适应性的机制研究尚无定论。对于含有藻红素的蓝藻和红藻, 光能的捕获和传递具有严格的方向性, 首先由藻红素捕获光能, 并将捕获的 95%以上的能量传递至藻蓝素, 藻蓝素再将从藻红素获取的 95%的能量传递至别藻蓝素, 别藻蓝素再将从藻蓝素获取的95%的能量传递到光合反应中心[26]。虽然 PCC6715属于不含藻红素的蓝细菌, 但由于蓝细菌中光能捕获结构的稳定性, 所以能量捕获和传递的方向性在PCC6715 中依然适用。本实验中 PCC6715 的最大光能利用效率在蓝、红光条件下培养至第 6 天时结束波动变化, 并趋于稳定, 表明 PCC6715 在蓝、红光中产生光适应性生长。作为 PCC6715 的捕光色素, PCC6715 的别藻蓝素与藻蓝素相对含量经蓝、红光处理 6 天后基本上不再发生变化, 说明对数生长期 PCC6715 通过调整别藻蓝素与藻蓝素的含量以适应不同的光质。通过对 PCC6715 在蓝、红光中别藻蓝素与藻蓝素的含量分析, 我们发现PCC6715别藻蓝素的含量在蓝、红光中基本上一致; PCC6715藻蓝素的含量在蓝光中明显高于红光中。
综上所述, 如图 5 所示, PCC6715 通过调整捕光色素的含量在蓝、红光中产生适应性生长, 藻蓝素含量的改变是引发 PCC6715 在蓝、红光下产生光适应性生长的主要原因。
本实验在不同光质条件下处理 PCC6715, 得到其在不同光质中生长的差异, 探究不含藻红素的蓝细菌产生光适应生长的原因。为了进一步明晰不表达藻红素的嗜热蓝细菌在蓝、红光质中产生适应性生长时基因表达的变化, 下一步还需以基因工程为手段, 运用基因组学进行深入的研究。

图5 不同光质条件下PCC6715的光适应性特征
Fig. 5 Characteristics of light adaptability of PCC6715 under different light quality conditions
参考文献
[1] 张艳婷, 江东, 唐杰, 等. 两株采自惠州的细鞘丝藻亚科(Leptolyngbyaceae)嗜热蓝细菌的分离鉴定及细胞组分分析. 微生物学通报, 2019, 46(3): 481–493
[2] Hutchins P R, Miller S R. Genomics of variation in nitrogen fixation activity in a population of the ther-mophilic cyanobacterium Mastigocladus laminosus. Isme Journal, 2017, 11(1): 78–86
[3] 洪剑明. 蓝藻的光合器与光合色素. 生物学通报, 1997, 32(9): 6–8
[4] Wiltbank L B, Kehoe D M. Diverse light responses of cyanobacteria mediated by phytochrome superfamily photoreceptors. Nature Reviews Microbiology, 2019, 17(1): 37–50
[5] Averina S, Velichko N, Senatskaya E, et al. Far-red light photoadaptations in aquatic cyanobacteria. Hy-drobiologia, 2018, 813(1): 1–17
[6] Ranawat P, Rawat S. Radiation resistance in thermo-philes: mechanisms and applications. World Journal of Microbiology & Biotechnology, 2017, 33(6): 112
[7] Hoppe C J M, Klaas C, Ossebaar S, et al. Controls of primary production in two phytoplankton blooms in the Antarctic Circumpolar Current. Deep Sea Research Part II Topical Studies in Oceanography, 2017, 138: 63–73
[8] Cullen J J. On models of growth and photosynthesis in phytoplankton. Deep Sea Research Part A: Oceano-graphic Research Papers, 1990, 37(4): 667–683
[9] 郑洁, 胡美君, 郭延平. 光质对植物光合作用的调控及其机理. 应用生态学报, 2008, 19(7): 1619–1624
[10] Liang Y, Kaczmarek M B, Kasprzak A K, et al. Thermosynechococcaceae as a source of thermostable C-phycocyanins: properties and molecular insights. Algal Research, 2018, 35: 223–235
[11] Eberly J O, Ely R L. Photosynthetic accumulation of carbon storage compounds under CO₂ enrichment by the thermophilic cyanobacterium Thermosynechococ-cus elongatus. Journal of Industrial Microbiology & Biotechnology, 2012, 39(6): 843–850
[12] Nikolova D, Weber D, Scholz M, et al. Temperature-induced remodeling of the photosynthetic machinery tunes photosynthesis in a thermophyllic alga Cyani-dioschyzon merolae. Plant Physiology, 2017, 174(1): 35–46
[13] Pedersen D, Miller S R. Photosynthetic temperature adaptation during niche diversification of the ther-mophilic cyanobacterium Synechococcus A/B clade. ISME Journal, 2016, 11(4): 1053–1057
[14] MacColl R. Cyanobacterial phycobilisomes. Journal of Structural Biology, 1998, 124(2/3): 311–334
[15] Edwards M R, Gantt E. Phycobilisomes of the thermophilic blue-green alga Synechococcus lividus. Journal of Cell Biology, 1971, 50(3): 896–900
[16] Bennett A, Bogorad L. Complementary chromatic adaptation in a filamentous blue-green alga. Journal of Cell Biology, 1973, 58(2): 419–435
[17] 王燕, 张亚见, 何茂盛, 等. 光质对植物形态结构和生长的影响. 安徽农业科学, 2018, 46(19): 22–25
[18] 王肖肖. 藻类光合作用捕光色素蛋白复合物—藻胆体的结构、性质及功能研究[D]. 曲阜: 曲阜师范大学, 2018
[19] 韩丽丽. 浅水水体浮游藻类光合活性研究[D]. 武汉: 华中科技大学, 2013
[20] 刘洪艳, 潘伶俐, 施定基. 不同光质对紫球藻生长及藻胆素含量的影响. 天津科技大学学报, 2007, 22(1): 26–28
[21] 韩军军. 光质对坛紫菜生长和生理学特性的影响及坛紫菜丝状体蓝光效应的转录组分析[D]. 上海: 上海海洋大学, 2017
[22] Kehoe D M. Chromatic adaptation and the evolution of light color sensing in cyanobacteria. Proc Natl Acad Sci USA, 2010, 107(20): 9029–9030
[23] Zhao Longsheng, Li Kang, Wang Qianmin, et al. Nitrogen Starvation Impacts the Photosynthetic Per-formance of Porphyridium cruentum as Revealed by Chlorophyll a Fluorescence. Sci Rep, 2017, 7(1): 8542
[24] 韩军军, 钟晨辉, 何培民, 等. 不同光质 LED 光源对坛紫菜自由丝状体生长和生理特性的影响. 水产学报, 2017, 41(2): 230–239
[25] Palenik B. Chromatic adaptation in marine Synecho-coccus strains. Applied & Environmental Microbio-logy, 2001, 67(2): 991–994
[26] 王肖肖, 秦松, 杨革, 等. 藻胆体的结构与能量传递功能. 海洋科学, 2017, 41(12): 139–145
Effects of Different Light Qualities on the Growth of Thermophilic Cyanobacteria Synechococcus sp. PCC6715
Abstract In order to understand the lighting quality effects on the light-adaptive growth of cyanobacteria which does not express phycoerythrin, the thermophilic cyanobacteria PCC6715 in logarithmic growth phase was cultured by using white light (control), red light, and blue light with photosynthetically effective photon quantum density (PAR) of 100 μmol/(m2∙s). Compared with the growth characteristics of PCC6715 under white light conditions, the changes in the measured and analyzed values of PCC6715 under other light qualities were as follows:the dry weight of PCC6715 significantly increased under blue light and significantly reduced under red light; the red and blue light have different effects on the start time and duration of the photosynthetic pigment synthesis of PCC6715; the maximum light energy conversion efficiency (Fv/Fm) of PCC6715 significantly increased under blue light and decreased significantly under red light; after 6 days of culture, the Fv/Fm of PCC6715 under red and blue light conditions tends to stable. In conclusion, the blue spectrum lighting promotes the growth of PCC6715, while red light inhibits the growth of PCC6715. At the same time, PCC6715 produces light-adaptive growth under both red and blue light, the reduction of phycocyanin content caused light-adaptive growth of PCC6715 in red light, and the light-adaptive growth of PCC6715 in blue light was due to the increase of phycocyanin content.
Key words cyanobacteria; thermophilic cyanobacteria; light quality; light-adaptive growth; phycocyanin
doi: 10.13209/j.0479-8023.2020.036
深圳市协同创新计划国际合作研究项目(GJHZ20180928162210431)资助
收稿日期: 2019–04–28;
修回日期: 2020–04–07