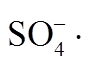 和·OH 两种自由基, 表明NPC@Cu是一种性能良好的催化材料。
和·OH 两种自由基, 表明NPC@Cu是一种性能良好的催化材料。摘要 以铜基 MOF (HKUST-1, [Cu3(BTC)2], BTC 为 1,3,5-苯三甲酸)为模板, 利用一步碳化法制备负载零价铜的纳米多孔碳材料 NPC@Cu。以此 NPC@Cu 为催化剂, 活化过一硫酸氢钾(PMS), 在常温常压下异相催化氧化处理模拟的偶氮染料废水。采用电子显微镜(SEM)、X 射线衍射(XRD)和 X 射线光电子能谱(XPS)等技术对催化剂进行表征, 并研究反应过程中催化剂投加量、氧化剂投加量和初始 pH 值对降解效率的影响。实验结果表明, 在催化剂用量为 0.1g/L, PMS 浓度为 2.00mmol/L, pH 值为 7 的条件下, 反应进行 45 分钟后, 浓度为 0.10mmol/L 的 RhB 降解率可达到 100%。通过自由基捕捉实验, 证明体系中存在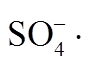 和·OH 两种自由基, 表明NPC@Cu是一种性能良好的催化材料。
和·OH 两种自由基, 表明NPC@Cu是一种性能良好的催化材料。
关键词 MOF材料; 纳米多孔碳材料; 零价铜; 过硫酸盐; 罗丹明B (RhB)
作为纺织品生产大国, 我国染料废水产生量大, 对水环境质量造成严重的影响。对于染料废水的处理, 传统的物理法、化学法和生物法很难满足日益严格的排放标准。一种新兴的高级氧化技术——过硫酸盐氧化技术, 能够产生有强氧化能力的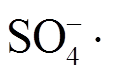 自由基和·OH 自由基, 可以氧化大部分难降解的有机污染物, 因此受到越来越多的关注[1–2]。对过硫酸盐的活化有多种方式: 热活化[3]、紫外光活化[4]、电化学活化[5]、超声活化[6]和过渡金属离子(Mn+)活化[7]等。热活化、紫外光活化、电化学活化和超声活化都要消耗较多的能量, 在成本方面不具有优势, 不适宜大规模应用。以过渡金属氧化物为代表的高价态过渡金属离子的催化效率和催化速率也不令人满意。因此, 寻找一种高效、廉价的活化方式迫在眉睫。
自由基和·OH 自由基, 可以氧化大部分难降解的有机污染物, 因此受到越来越多的关注[1–2]。对过硫酸盐的活化有多种方式: 热活化[3]、紫外光活化[4]、电化学活化[5]、超声活化[6]和过渡金属离子(Mn+)活化[7]等。热活化、紫外光活化、电化学活化和超声活化都要消耗较多的能量, 在成本方面不具有优势, 不适宜大规模应用。以过渡金属氧化物为代表的高价态过渡金属离子的催化效率和催化速率也不令人满意。因此, 寻找一种高效、廉价的活化方式迫在眉睫。
Liang 等[8]指出, 零价金属可以通过产生低价的金属离子, 有效地诱导过硫酸盐产生活性自由基, 比传统的过渡金属离子活化更加有效, 并且不消耗额外的能量, 是一种成本与效率兼顾的方法。零价铜是一种能有效地活化 PMS, 产生活性自由基的金属, 可以在酸性条件下产生 Cu+, 激活 PMS 产生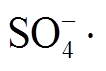 和·OH 自由基[9]。然而, 由于金属粒子间的相互作用力使得 Cu 的纳米粒子有很强的团聚趋势, 这种团聚会降低 Cu 的纳米粒子的性能, 降低其比表面积和孔隙率, 影响其稳定性及催化活性。克服团聚的一种有效方法就是将 Cu 粒子负载在石墨、活性炭、沸石、黏土、多层的碳纳米管和聚合物等多孔材料上。纳米多孔碳材料(nanoporous carbons, NPCs)具有应用广泛、成本低、比表面积和孔隙率大、孔径分布范围窄、化学稳定性和对有机污染物亲和度好等优点, 是一种应用前景广阔的材料[10]。
和·OH 自由基[9]。然而, 由于金属粒子间的相互作用力使得 Cu 的纳米粒子有很强的团聚趋势, 这种团聚会降低 Cu 的纳米粒子的性能, 降低其比表面积和孔隙率, 影响其稳定性及催化活性。克服团聚的一种有效方法就是将 Cu 粒子负载在石墨、活性炭、沸石、黏土、多层的碳纳米管和聚合物等多孔材料上。纳米多孔碳材料(nanoporous carbons, NPCs)具有应用广泛、成本低、比表面积和孔隙率大、孔径分布范围窄、化学稳定性和对有机污染物亲和度好等优点, 是一种应用前景广阔的材料[10]。
利用金属有机框架(metal organic framework, MOF)材料作为模板合成 NPCs, 已被证明是一种制备负载金属的纳米多孔碳材料(NPC@M)的有效方法[11–12]。通过在惰性气体中高温裂解 MOF 材料, 可以直接合成负载零价金属的纳米多孔碳材料。与传统方法相比, 该方法具有金属负载率高、形貌良好的优点, 有利于催化氧化反应。HKUST-1 是以Cu(II)离子为金属配位中心, 以均三苯甲酸为有机配体的MOF 材料[13], 具有合成简单、易功能化和孔径分布规则等优点, 是合成 NPC@Cu 的理想模板[13–17]。
本文通过在氩气氛围下高温裂解类 HKUST-1模板, 利用一步碳化法, 直接原位制备负载零价铜的纳米多孔碳材料(NPC@Cu), 并且将其应用在过一硫酸盐体系(peroxymonosulfate system, PMS)中, 氧化降解模拟的罗丹明 B (RhB)染料废水。探究NPC @Cu 的用量、PMS 的用量和初始 pH 值对降解反应的影响, 并分析参与降解反应的活性自由基, 探讨可能的反应机理。
主要试剂有三水合硝酸铜(Cu(NO3)2·3H2O, 广州化学试剂厂)、1,3,5-苯三甲酸(H3BTC, 上海阿拉丁生化科技股份有限公司, 98%)、无水乙醇(南京化学试剂股份有限公司)、叔丁醇(上海凌峰化学试剂有限公司)、罗丹明B (天津市科密欧化学试剂有限公司)和过硫酸氢钾复合盐(上海阿拉丁生化科技股份有限公司)等, 试剂均为分析纯, 采用去离子水配制。
主要仪器包括 pH 计(pH610, Trans Wiggens Instruments, 德国)、紫外可见光分光光度计(DR-6000, Hach Company, 美国)、超声仪(SK8200H, 上海科导超声仪器有限公司)、电子分析天平(A124S, 德国赛多利斯)、真空干燥箱(DZF-6020, 上海浦东荣丰科学仪器有限公司)和原子吸收分光光度计(TAS990, 北京普析通用)。
1.2.1 类 HKUST-1 模板的合成
按照 Chui 等[13]的方法制备类 HKUST-1 模板。首先, 称取 5.0g 的 Cu (NO3)2·3H2O (24mmol), 加入盛有 250mL 去离子水的烧杯中, 称取 10.0g(43mmol)1,3,5-苯三甲酸, 加入盛有 250mL 无水乙醇的烧杯中。超声溶解后, 先后加入盛有 250mL DMF 的 1 L 宽口玻璃瓶中。然后, 将 1 L 宽口玻璃瓶密封, 放到真空干燥箱中, 在 85℃下加热 20 小时。产生小的八面体晶体。冷却至室温后拿出该玻璃瓶, 倒出剩余反应液, 用DMF 洗涤(3×10mL)。在装有样品的三角瓶中装满二氯甲烷, 放置 3 天, 在此期间, 活化溶剂更换 3 次。最后, 通过真空170℃加热将溶剂去除, 获得MOF材料。
1.2.2 NPC@Cu的制备
按照 Pachfule 等[18]的方法制备 NPC@Cu。将活化后的类 HKUST-1 模板转移到陶瓷皿中, 并将该陶瓷皿放入管式炉内, 通氩气。以 5℃/min 的速率, 将样品从室温加热至 650℃, 然后在氩气流中恒温保持 2 小时。炉子在氩气的氛围下自然冷却到室温, 得到 NPC@Cu材料。
本文采用场发射扫描电子显微镜(SEM, ZEISS SUPRA® 55, 德国Carl Zeiss)检测样品的结构及形貌特征。采用 X 射线衍射仪(XRD, D8-Advance, 德国 Bruker)测定晶相结构。采用 X 射线光电子能谱仪(XPS, ESCALAB 250X, 英国 Thermo Fisher 公司)分析价态。用比表面积分析仪(ASAP 2020 HD88, 麦克默瑞提克(上海)仪器有限公司)测试比表面积。
移取 100 mL 的罗丹明 B 溶液(0.10mmol/L)于250mL 锥形瓶中, 加入一定量的 PMS 氧化剂, 用HCl 和 NaOH 溶液(100mmol/L)调节至 pH=7, 快速加入适量催化剂后, 立即将锥形瓶放入摇床中, 在150r/min 和 25℃条件下开始降解反应。反应开始后, 按设计的时间间隔, 移取 1mL 水样于比色管中, 并立刻加入等体积的乙醇, 淬灭未反应的自由基。将水样稀释至 1/10 后, 采用紫外–可见光分光光度计在 554 nm 波长下测定其中罗丹明 B 的浓度。降解反应结束后, 用玻璃纤维膜过滤分离催化剂, 用乙醇和水反复洗涤后烘干回用。
图 1(a)和(b)为 HKUST-1 的低倍数(500 倍)和高倍数(5000 倍) SEM 图像。从图 1(a)可以看出, 所制备的 MOF 粒径分布均匀, 基本上在 6~30μm 的范围内, 基本形态为正八面体, 分散性好。从图 1(b)可以看出, HKUST-1 表面光滑, 形状规整, 能清晰地看到八面体结构。HKUST-1 的电镜扫描图像与文献[19]一致, 表明 HKUST-1 被成功地合成。图 1(c)和(d)分别为制备的 NPC@Cu 的低倍数(1000 倍)和高倍数(10000 倍) SEM 图像。从图 1(c)可以看出, 在碳化之后, 虽然原有的结构表面被破坏, 但仍然在一定程度上保持 HKUST-1 晶体的原始形态。NPC@Cu 的大小和形状与模板材料 HKUST-1 相似, 粒径保持在 6~30μm 的范围内, 分散性好, 没有明显的团聚现象。从图 1(d)可以看出, 碳化后, 材料表面产生大量的孔隙和沟壑, 原来的 HKUST-1 结构已被破坏。
NPC@Cu 的 XRD 图谱如图 2 所示, 所得产物存在 5 个衍射峰, 最强衍射峰出现在 2θ=43.37°, 50.49°和 74.13°处, 均与单质铜(JCPDS-PDF#04-0836)的衍射峰相匹配, 说明主要产物含铜单质。同时, 有两个较弱的衍射峰出现在 35.58°和 38.66°处, 与 CuO 的衍射峰相吻合(JCPDS-PDF#45-0937), 说明还有部分CuO生成。
NPC@Cu 的 XPS 图谱如图 3 所示。图 3(a)为 Cu的 CuLM2 价态电子图谱, 在 568.5 和 572.3eV 处的峰分别对应 Cu 和 Cu(I)。图 3(b)为 Cu 的 Cu2p 的价态电子图谱, 在 932.7 和 933.9eV 处的峰分别对应Cu 和 Cu(II)。说明合成的材料里 Cu 的 3 种价态都存在, 与前面的 XRD 分析结果一致。

图1 HKUST-1和NPC@Cu的SEM图像
Fig. 1 Typical SEM images of HKUST-1 and NPC@Cu catalyst
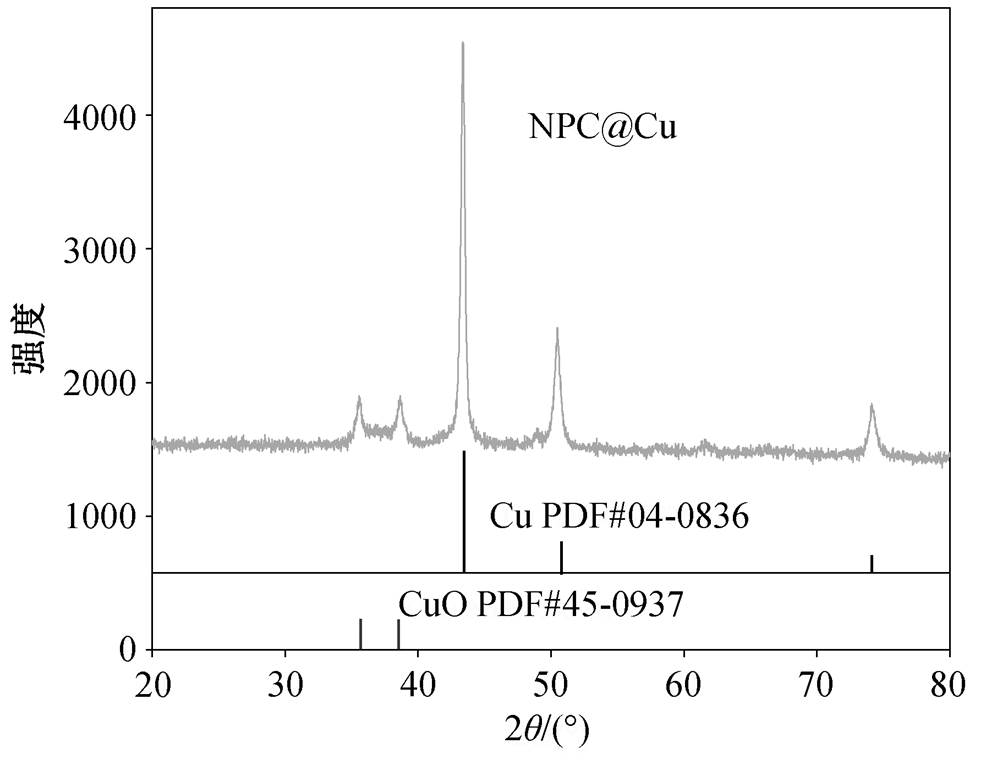
图2 NPC@Cu的XRD图谱
Fig. 2 XRD patterns of NPC@Cu catalyst
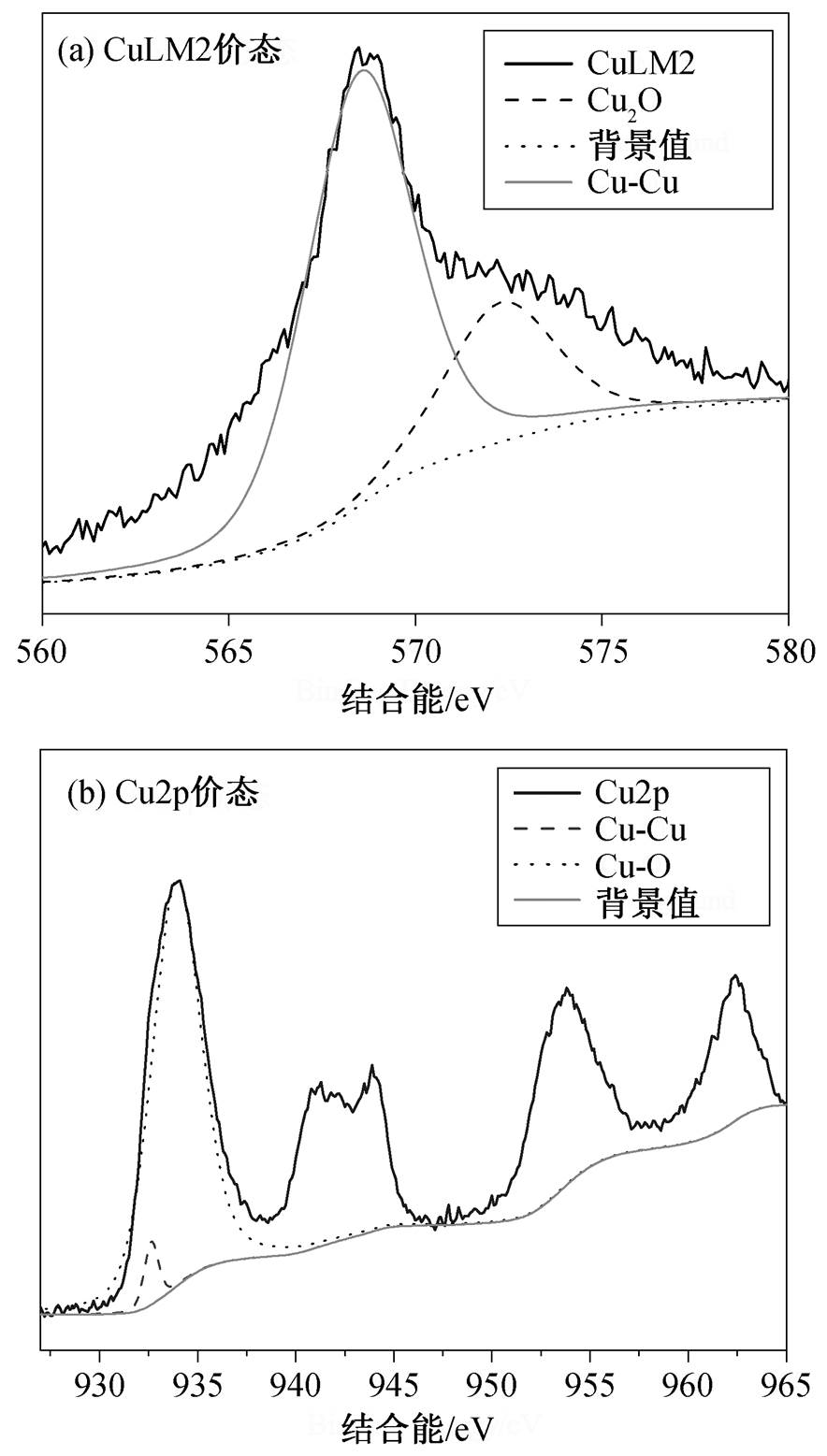
图3 NPC@Cu的XPS图谱
Fig. 3 XPS patterns of NPC@Cu
2.2.1 NPC@Cu投加量的影响
是否投加 NPC@Cu 对 PMS 降解罗丹明 B 效率的影响情况如图 4 所示。反应条件为[RhB]=0.10 mmol/L, [NPC@Cu]= 0.10 g/L, [PMS]=2.00 mmol/L,初始 pH=7.0。当体系中只存在 NPC@Cu 时, 对罗丹明 B 的去除率约为 12.07%, 说明 NPC@Cu 对 RhB有一定的吸附效果。只有 PMS 存在的条件下, 罗丹明 B 的去除率可达 74.36%, 说明PMS 能够氧化部分的 RhB, 但是降解不彻底。当体系中同时存在NPC@Cu 和 PMS 时, 罗丹明 B 的降解速率和降解率显著提高, 120min 降解率达到 99.63%。可见, NPC@Cu能够强化 PMS 的氧化能力, 提高对罗丹明 B 的降解效率[20]。
PMS 体系中催化剂投加量对罗丹明 B 降解效果的影响情况如图 5 所示。可以看出, 在 NPC@Cu 浓度从 0.05g/L 增至 0.10g/L 的过程中, RhB 降解率有显著的提升, 并且 0.05g/L 的最终降解率稳定在92%左右, 而 0.10g/L 的最终降解率为 99.13%, 基本上实现完全降解。其原因可能是, 当 PMS 充足时, 催化剂浓度的增加提供了更多的反应活性位点。但是, 在 NPC@Cu 浓度从 0.10g/L 增加至 0.25g/L的过程中, 反应速率并没有明显的提升, 最终也实现完全降解。可能的原因是, 催化剂有效活化位点已近饱和, PMS 浓度反而成为罗丹明 B 降解的限制条件[21], 因此确定 NPC@Cu 的最佳投加量为 0.10 g/L。
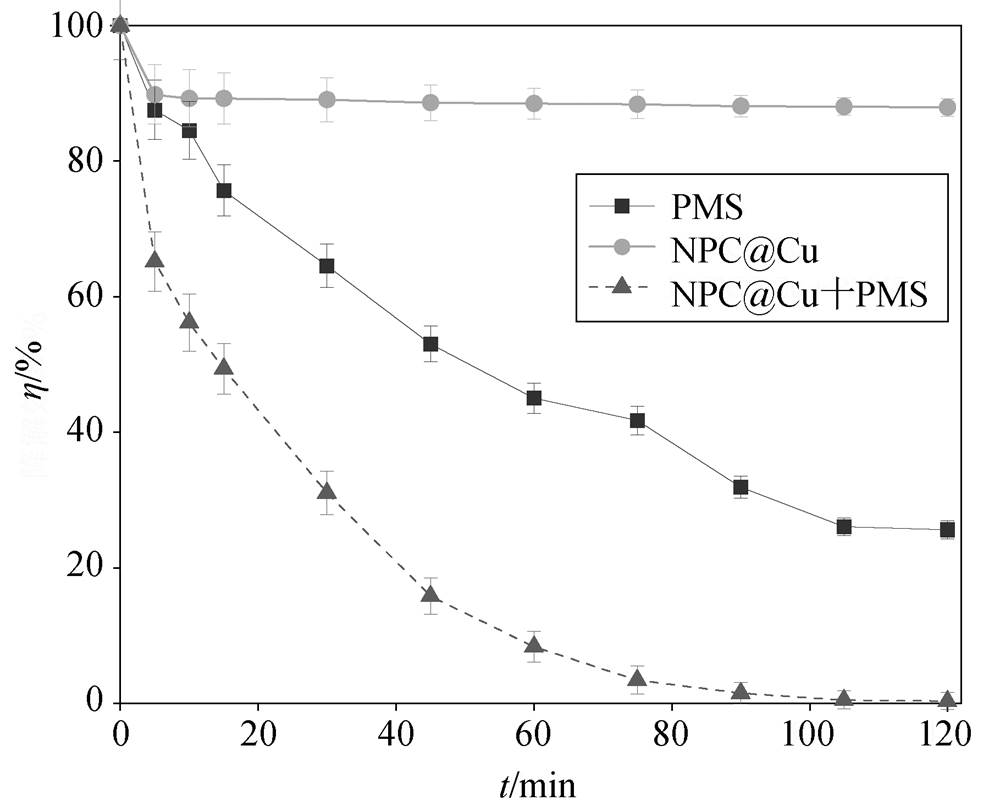
η=Ct/C0×100%, Ct为 t 时刻的浓度, C0 为初始浓度, 下同; [RhB]=0.10mmol/L, [NPC@Cu]=0.10g/L, [PMS]=2.00 mmol/L,初始pH = 7.0
图4 PMS投加NPC@Cu对罗丹明B的降解效果
Fig. 4 Effect comparison of degradation of RhB by NPC@Cu
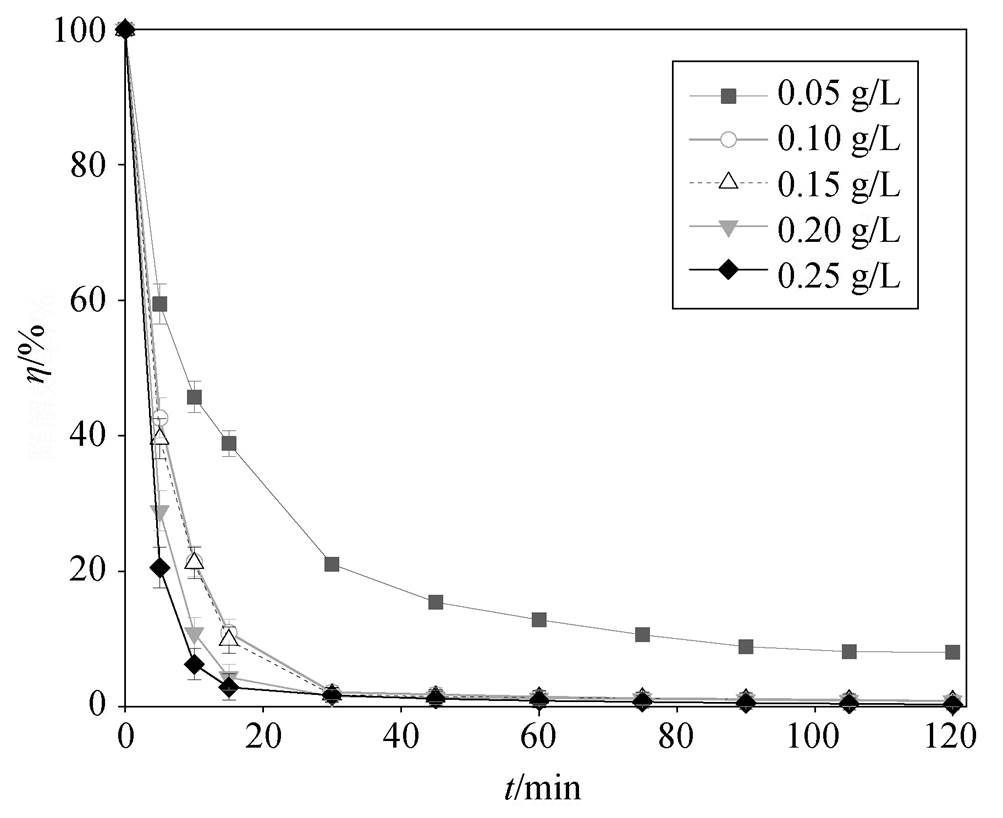
[RhB]=0.10 mmol/L, [PMS]=2.00 mmol/L, 初始pH=7.0
图5 NPC@Cu投加量对罗丹明B降解效果的影响
Fig. 5 Effect of NPC@Cu dosage on the degradation of RhB
2.2.2 PMS投加量的影响
PMS 的投加量对罗丹明 B 降解效率的影响情况如图 6 所示。当 PMS 浓度从 1mmol/L 增至 2mmol/L时, 罗丹明 B 的降解率有明显的提升, 从 78.12%增至 99.74%, 基本上实现完全降解。但是, 在 PMS 浓度从 2mmol/L 增至 5mmol/L 的过程中, 罗丹明 B 的降解速率和降解率不增反降, 在反应进行到 120min 时, 只有 2mmol/L 的 PMS 实现对罗丹明 B 的完全降解。因此可以推断, 在 NPC@Cu 非均相催化PMS 降解 RhB 的情况下, PMS 与 RhB 之间存在一个最佳摩尔比。经过计算得出, PMS 与 RhB 的最佳摩尔比约为 20:1, 该结果与 Chu 等[22]的研究结果相符。可能的原因是, 当 PMS 浓度增加到饱和值以后, 催化剂催化 PMS 产生的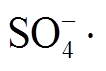 会与多余的 PMS反应产生
会与多余的 PMS反应产生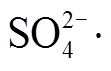 , 从而降低体系中
, 从而降低体系中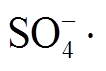 自由基的数量, 使反应变慢[23]。因此, 确定 PMS 的最佳投加量为2 mmol/L。
自由基的数量, 使反应变慢[23]。因此, 确定 PMS 的最佳投加量为2 mmol/L。
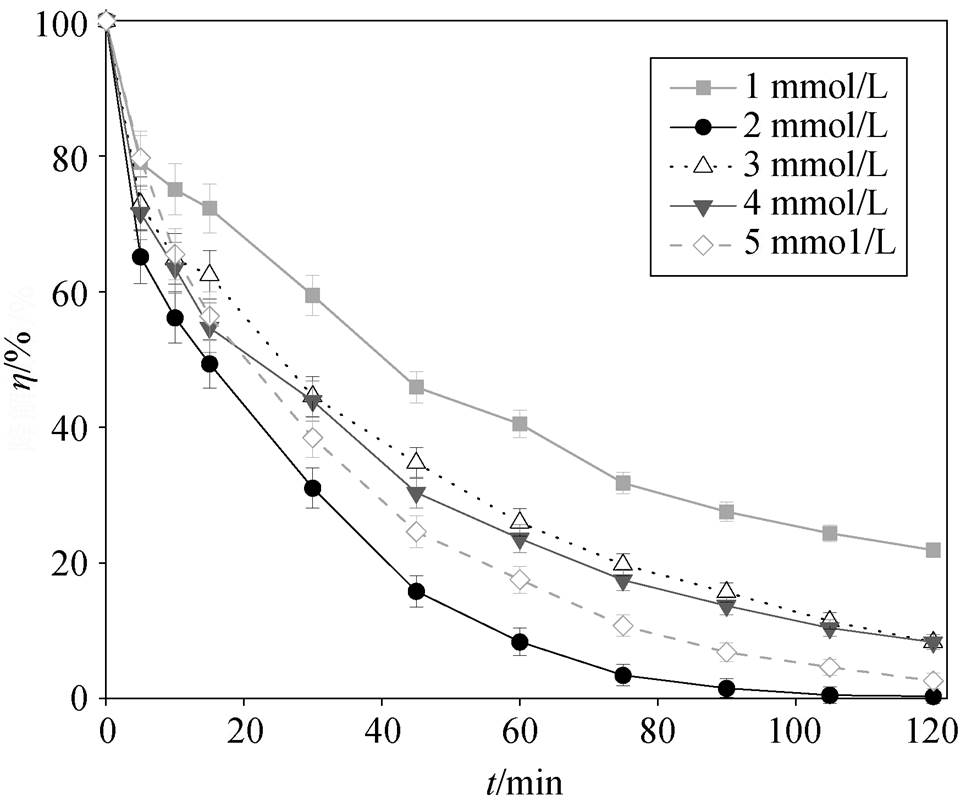
[RhB]=0.10 mmol/L, [NPC@Cu]= 0.10 g/L, 初始pH = 7.0
图6 PMS 投加量对罗丹明B降解效果的影响
Fig. 6 Effect of PMS dosage on the degradation of RhB
2.2.3 初始 pH 的影响
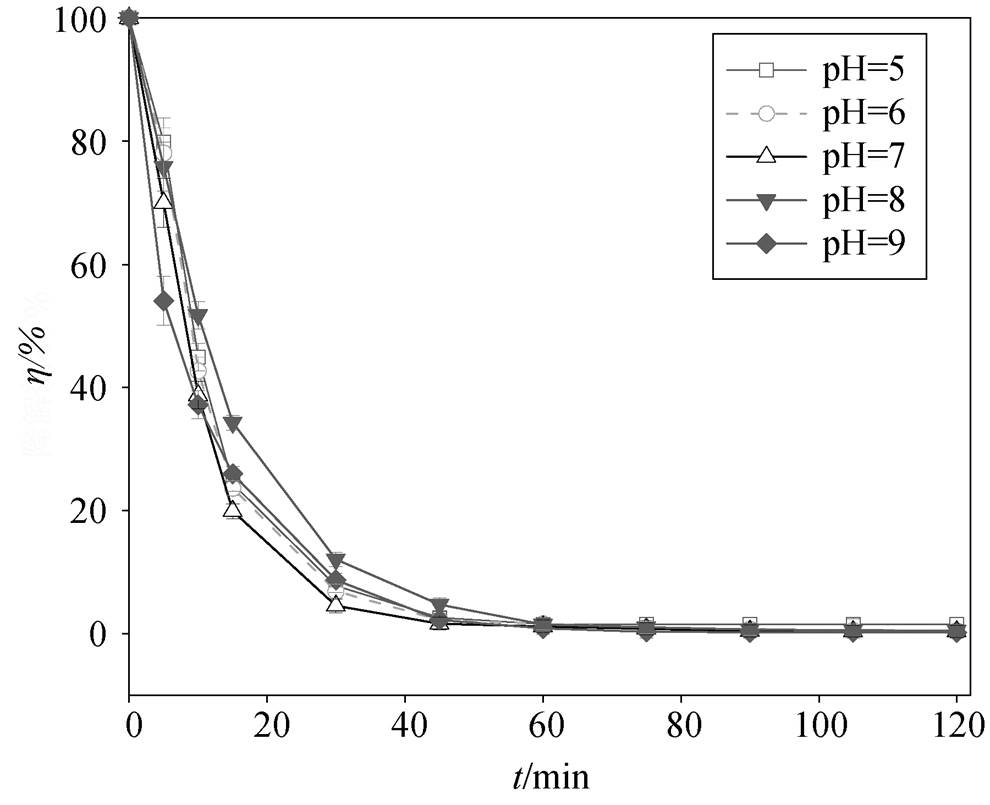
初始 pH 对罗丹明 B 降解效果的影响情况如图 7所示。在初始 pH 为 5~9 的范围内可以观察到虽然pH 会对罗丹明 B 的去除效果产生一定的影响, 但是影响不大, 基本上均能够完全去除罗丹明 B。从图7 可以看出, 在中性(pH=7)或偏弱碱性(pH=8~9)条件下, 罗丹明 B 的去除效果优于弱酸性(pH=5 时去除率为 98.42%)条件。Liang 等[24]指出, 在酸性、中性或碱性条件下, 虽然产生的方式不同, 但都会产生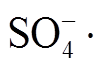 自由基, 都能够降解罗丹明 B。所以, NPC @Cu 在较广的初始 pH 条件(pH 为 5~9)下均可有效地去除罗丹明 B, 这个特性拓宽了其实际应用的水质范围。本研究选择 pH=7 为最优 pH值。
自由基, 都能够降解罗丹明 B。所以, NPC @Cu 在较广的初始 pH 条件(pH 为 5~9)下均可有效地去除罗丹明 B, 这个特性拓宽了其实际应用的水质范围。本研究选择 pH=7 为最优 pH值。
Cu 能够在酸性溶液中原位产生 Cu+, Cu+的活性高, 在溶液中可迅速氧化为 Cu2+, 并活化 O2 产生H2O2, 从而诱导 H2O2 产生·OH[25]。所以, Cu+可能也是活化 PMS 体系产生自由基的重要中间产物。NPC@Cu 催化 PMS 体系可能的机理如下: 首先, Cu单质被 PMS 氧化为 Cu(I), 然后 PMS 将 Cu(I)迅速氧化为 Cu(II), 并产生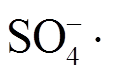 自由基, 然后
自由基, 然后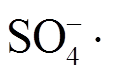 自由基再将 H2O 或 OH–氧化, 产生·OH 自由基, 反应式如下:
自由基再将 H2O 或 OH–氧化, 产生·OH 自由基, 反应式如下:
[RhB]= 0.10 mmol/L, [NPC@Cu]= 0.10 g/L, [PMS]= 2.00 mmol/L
图7 初始pH对罗丹明B降解效果的影响
Fig. 7 Effect of pH on the degradation efficiency of RhB
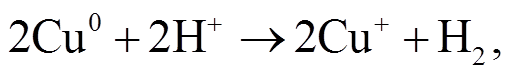 (1)
(1)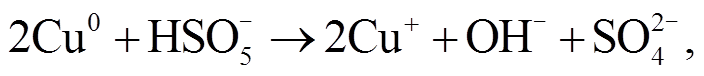 (2)
(2)
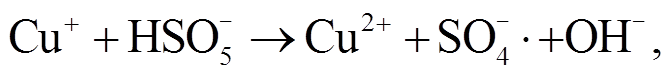 (3)
(3)
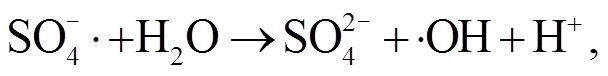 (4)
(4)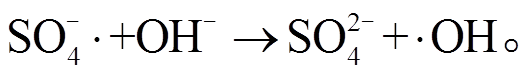 (5)
(5)
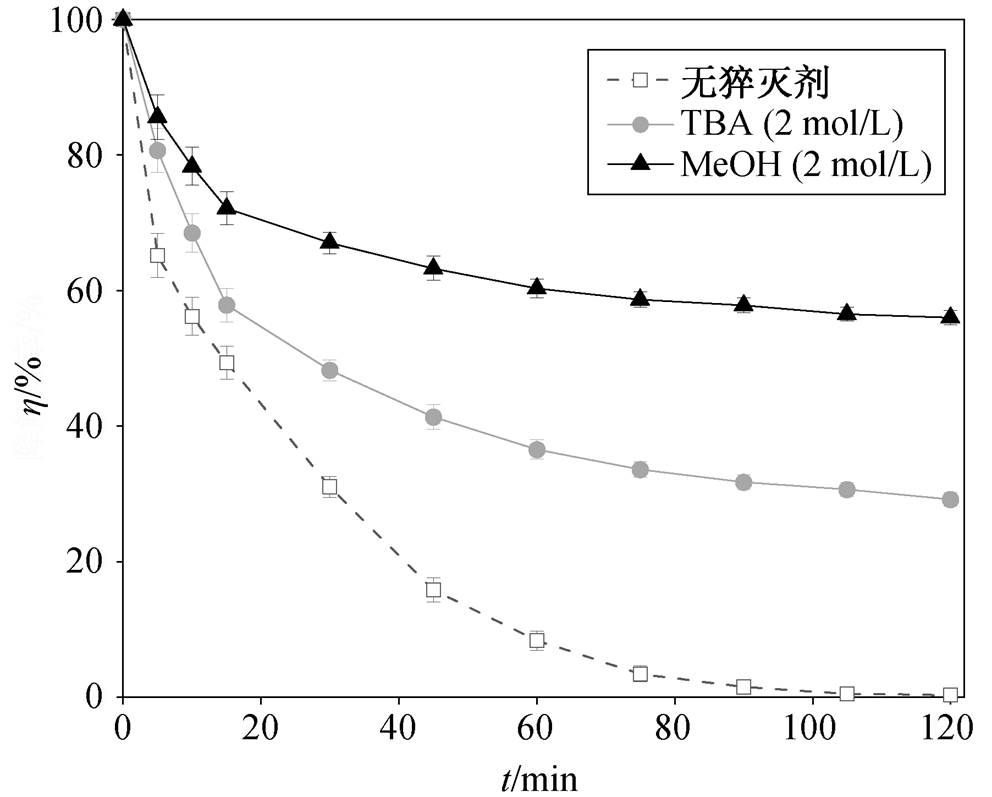
为了探究 NPC@Cu 在活化 PMS 的过程中产生的自由基, 本文设计自由基淬灭实验进行验证。·OH 淬灭剂采用常用的叔丁醇(TBA)[26], 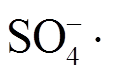 和·OH淬灭剂采用常用的甲醇(MeOH)[27]。
和·OH淬灭剂采用常用的甲醇(MeOH)[27]。
实验中, 自由基捕获剂与氧化剂按浓度 2000:1进行投加。如图 8 所示, 加入 2 mol/L叔丁醇后, 反应 120min 后的降解率为 70.56%, 而加入 2mol/L甲醇的体系中, 罗丹明 B 的去除率比加入叔丁醇有所下降, 降解反应进一步被抑制, 降解率只达到43.37%, 表明 NPC@Cu 催化 PMS 体系中同时存在·OH和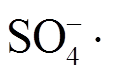 两种自由基, 共同降解罗丹明 B。
两种自由基, 共同降解罗丹明 B。
本文提出以 HKUST-1 为模板, 在惰性气体中采用一步法制备负载铜单质的纳米多孔碳材料NPC@Cu 的方法, 并应用 SEM, XRD 和 XPS, 对制备的 NPC@Cu 微观结构进行表征, 然后将其应用在过一硫酸盐体系 PMS 中, 氧化降解模拟的罗丹明 B 染料废水。应用 NPC@Cu/PMS 体系降解 0.1mmol/ L 的 RhB 的最优试验条件为 NPC@Cu 投加量 0.10 g/L, PMS 投加量 2.00mmol/L, 初始 pH=7。该条件下, 反应 45min 可实现罗丹明 B 的近完全降解。其中, PMS 和罗丹明 B 的最佳摩尔比为 20:1。自由基猝灭实验表明, NPC@Cu 催化 PMS 体系产生·OH和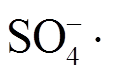 两种自由基。实验结果证明, NPC@Cu 是一种性能良好的催化材料。
两种自由基。实验结果证明, NPC@Cu 是一种性能良好的催化材料。
[RhB]=0.10 mmol/L, [NPC@Cu]=0.10 g/L, [PMS]=2.00 mmol/L, 初始pH = 7.0
图8 甲醇、叔丁醇存在时 NPC@Cu/PMS 体系对 RhB的降解效果
Fig. 8 Degradation of RhB using NPC@Cu/PMS systemin the presence of MeOH and TBA
参考文献
[1] Lin Xueming, Ma Yongwen, Wang Yan, et al. Lithium iron phosphate (LiFePO4) as an effective activator for degradation of organic dyes in water in the presence of persulfate. RSC Advances, 2015, 5: 94694–94701
[2] Oh W D, Lim T T. Design and application of hetero-geneous catalysts as peroxydisulfate activator for organics removal: an overview. Chemical Enginee-ring Journal, 2019, 358: 110–133
[3] Waldemer R H, Tratnyek P G, Johnson R L, et al. Oxidation of chlorinated ethenes by heat-activated persulfate: kinetics and products. Environmental Science & Technology, 2007, 41(3): 1010–1015
[4] Malato S, Blanco J, Richter C, et al. Enhancement of the rate of solar photocatalytic mineralization of organic pollutants by inorganic oxidizing species. Ap-plied Catalysis B: Environmental, 1998, 17(4): 347–356
[5] Moreira F C, Boaventura R A R, Brillas E, et al. Electrochemical advanced oxidation processes: a re-view on their application to synthetic and real waste-waters. Applied Catalysis B: Environmental, 2017, 202: 217–261
[6] Wei Zongsu, Villamena F A, Weavers L K. Kinetics and mechanism of ultrasonic activation of persulfate: an in situ EPR spin trapping study. Environmental Science & Technology, 2017, 51(6): 3410–3417
[7] Xu Xiangrong, Li Xiangzhong. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion. Separation and Purification Technology, 2010, 72(1): 105–111
[8] Liang Chenju, Guo Yiyu. Mass transfer and chemical oxidation of naphthalene particles with zerovalent iron activated persulfate. Environmental Science & Technology, 2010, 44(21): 8203–8208
[9] Zhou Peng, Zhang Jing, Zhang Yongli, et al. Degrada-tion of 2,4-dichlorophenol by activating persulfate and peroxomonosulfate using micron or nanoscale zero-valent copper. Journal of Hazardous Materials, 2018, 344: 1209–1219
[10] Datta K K R, Reddy B V S, Ariga K, et al. Gold nanoparticles embedded in a mesoporous carbon ni-tride stabilizer for highly efficient three-component coupling reaction. Nanoparticle Catalysts, 2010, 49 (34): 5961–5965
[11] Liu Bo, Shioyama H, Jiang Hailong, et al. Metal-organic framework (MOF) as a template for syntheses of nanoporous carbons as electrode materials for supercapacitor. Carbon, 2010, 48(2): 456–463
[12] Salunkhe R R, Kaneti Y V, Kim J, et al. Nanoarchi-tectures for metal-organic framework-derived nano-porous carbons toward supercapacitor applications. Accounts of Chemical Research, 2016, 49(12): 2796–2806
[13] Chui S S Y, Lo S M F, Charmant J P H, et al. A chemically functionalizable nanoporous material [Cu3(TMA)2(H2O)3]n. Science, 1999, 283: 1148–1150
[14] Huang Yuanbiao, Liang Jun, Wang Xusheng, et al. Multifunctional metal-organic framework catalysts: synergistic catalysis and tandem reactions. Chemical Society Reviews, 2017, 46(1): 126–157
[15] Lustig W P, Mukherjee S, Rudd N D, et al. Metal-organic frameworks: functional luminescent and pho-tonic materials for sensing applications. Chemical Society Reviews, 2017, 46(11): 3242–3285
[16] Zhao Meiting, Yuan Kuo, Wang Yun, et al. Metal-organic frameworks as selectivity regulators for hy-drogenation reactions. Nature, 2016, 539: 76–80
[17] Zhao Shenlong, Wang Yun, Dong Juncai, et al. Ul-trathin metal-organic framework nanosheets for elec-trocatalytic oxygen evolution. Nature Energy, 2016, 1: 1–10
[18] Pachfule P, Shinde D, Majumder M, et al. Fabrication of carbon nanorods and graphene nanoribbons from a metal–organic framework. Nature Chemistry, 2016, 8: 718–724
[19] Tan Peng, Xie Xiaoyan, Liu Xiaoqin, et al. Fabri-cation of magnetically responsive HKUST-1/Fe3O4 composites by dry gel conversion for deep desul-furization and denitrogenation. Journal of Hazardous Materials, 2017, 321: 344–352
[20] Tan Chaoqun, Dong Yujie, Fu Dafang, et al. Chloram-phenicol removal by zero valent iron activated pero-xymonosulfate system: Kinetics and mechanism of radical generation. Chemical Engineering Journal, 2018, 334: 1006–1015
[21] Pu Jiayi, Wan Jinquan, Wang Yan, et al. Different Co-based MOFs templated synthesis of Co3O4 nanopar-ticles to degrade RhB by activation of oxone. RSC Advances, 2016, 6(94): 91791–91797
[22] Chu Wei, Lau T K, Fung S C. Effects of combined and sequential addition of dual oxidants (H2O2/S2O82–) on the aqueous carbofuran photodegradation. Journal of Agricultural and Food Chemistry, 2006, 54(26): 10047–10052
[23] Yu Xiaoying, Bao Zhenchuan, Barker J R. Free radical reactions involving Cl·,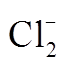 , and
, and 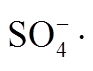 in the 248 nm photolysis of aqueous solutions containing S2O82– and Cl–. Journal of Physical Chemistry A, 2004, 108(2): 295–308
in the 248 nm photolysis of aqueous solutions containing S2O82– and Cl–. Journal of Physical Chemistry A, 2004, 108(2): 295–308
[24] Liang Bingqing, Pang Daolin, Jin Chao, et al. Photo-oxidative degradation of poly(p-dioxanone) under ul-traviolet light source. Polymer Degradation and Sta-bility, 2012, 97(11): 2162–2169
[25] Wen Gang, Wang Shengjun, Ma Jun, et al. Oxidative degradation of organic pollutants in aqueous solution using zero valent copper under aerobic atmosphere condition. Journal of Hazardous Materials, 2014, 275: 193–199
[26] Muthukumari B, Selvam K, Muthuvel I, et al. Pho-toassisted hetero-Fenton mineralisation of azo dyes by Fe(II)-Al2O3 catalyst. Chemical Engineering Jour-nal, 2009, 153: 9–15
[27] Zhao Jinying, Zhang Yaobin, Quan Xie, et al. En-hanced oxidation of 4-chlorophenol using sulfate radicals generated from zero-valent iron and peroxy-disulfate at ambient temperature. Separation and Purification Technology, 2010, 71(3): 302–307
Study on the Catalytic Oxidation of Rhodamine B by Nanoporous Carbon Materials Loaded with Zero Valence Copper
Abstract Nanoporous carbon material loaded with zero-valent copper NPC@Cu was synthesized by one-step carbonization method using copper-based MOF (HKUST-1, [Cu3(BTC)2], BTC as 1,3,5-benzenetricarboxylic acid) as template. With NPC@Cu as catalyst, peroxymonosulfatesulfate (PMS) was activated as oxidant to treat simulated azo dye wastewater by heterogeneous catalytic oxidation at ambient pressure and room temperature. The catalysts were characterized by electron microscopy (SEM), X-ray diffraction (XRD) and X-ray photoelectron spectroscopy (XPS), etc. The effect of degradation efficiency of the catalyst dosage, oxidant dosage and initial pH during the reaction were studied. The experimental results showed that the degradation rate of 0.10 mmol/L RhB can reach 100% after 45 minutes of reaction at a catalyst dosage of 0.1 g/L, a PMS concentration of 2.00 mmol/L and a initial pH of 7. Through the free radical trapping experiment, it proved that there are two free radicals in the system—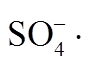 and ·OH, and NPC@Cu is a catalytic material with good catalytic performance.
and ·OH, and NPC@Cu is a catalytic material with good catalytic performance.
Key words MOF materials; nanoporous carbon materials; zero-valent copper; persulfate; Rhodamine B (RhB)
doi: 10.13209/j.0479-8023.2020.033
深圳市基础研究项目(JCYJ20180503182130795)和流域生态工程学学科建设资金(深发改[2017]542号)资助
收稿日期: 2019–05–13;
修回日期: 2019–05–22