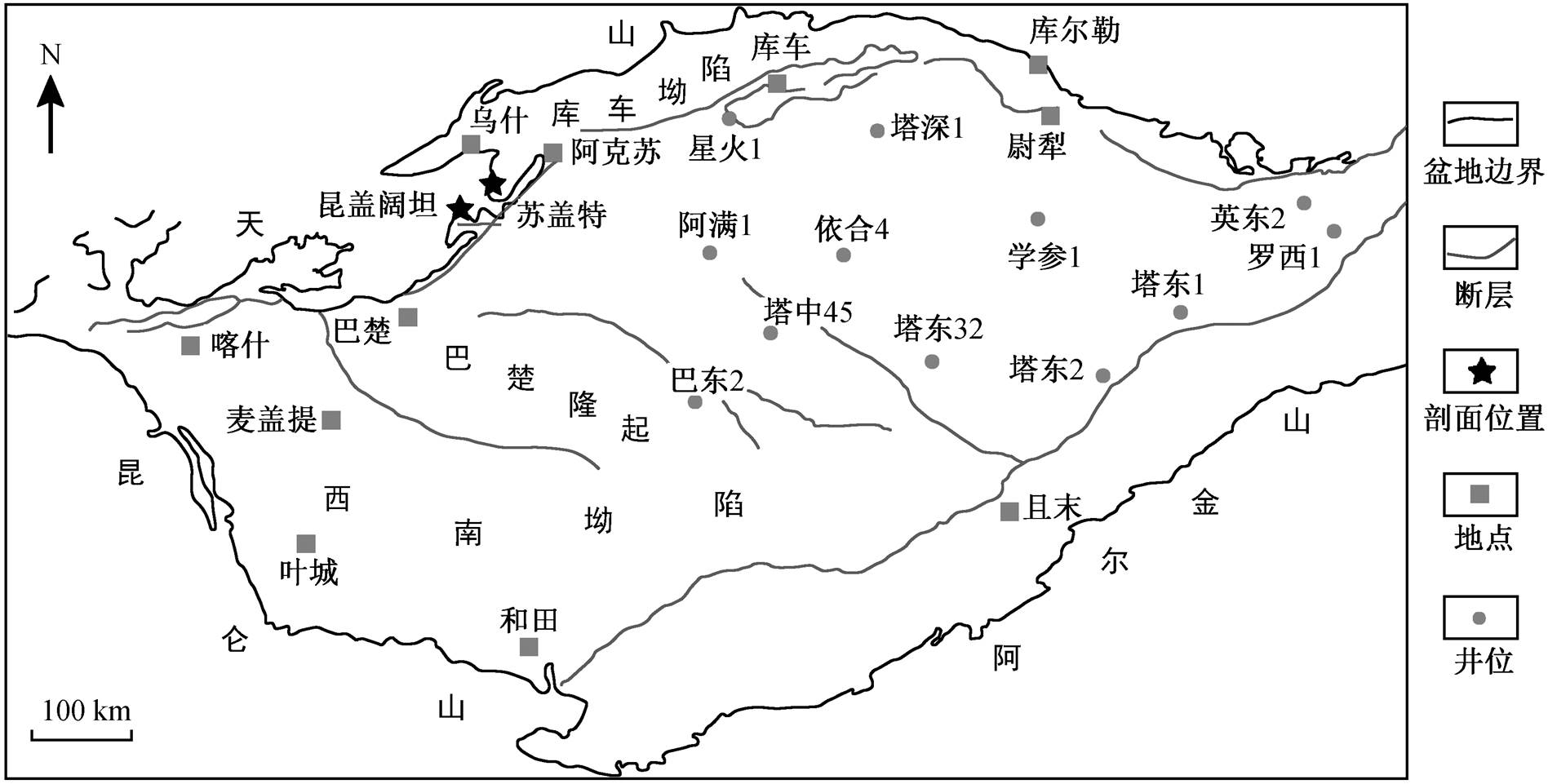
图1 塔里木盆地构造示意图及阿克苏地区玉尔吐斯组剖面位置(据文献[8]修改)
Fig. 1 Simplified tectonic map of Tarim Basin and sampling localities of Yurtus Formation in Aksu area (modified from Ref. [8])
摘要 对塔里木盆地西缘下寒武统玉尔吐斯组 3 个典型的剖面开展岩石学及地球化学研究, 探讨玉尔吐斯组沉积时期水体氧化‒还原环境及初级生产力, 为玉尔吐斯组烃源岩分布及资源潜力评价提供理论依据。玉尔吐斯组下部较高含量的 Ba (>1000μg/g)说明其沉积时期表层水体初级生产力较高, 产出的大量有机质埋藏于沉积物中, 与玉尔吐斯组产出的大量浮游植物化石及较高的 TOC 值相一致。与之对应层位中, 较高的δ15N (>8‰)说明水体中发生反硝化作用和/或厌氧氨氧化作用, 表明有机物在从表层向深层水体沉降过程中发生降解作用, 不断地消耗水体中的氧气, 使得海洋内部形成偏还原的水体环境。同时, 玉尔吐斯组下部硅质岩具有极低的 Ge/Si 值, 表明正常海水是硅质的主要来源。硅质过饱和的水体促进沉积物快速胶结, 可能对有机物的保存具有重要作用。
关键词 玉尔吐斯组; Ge/Si; Ba 含量; 氮同位素; 初级生产力
作为我国最大的富含海相油气资源的大型复合型克拉通盆地, 塔里木盆地发育多期次含油气地层序列, 均有工业性油气流产出[1]。塔里木盆地下古生界发育良好的烃源岩[2‒4], 以下寒武统玉尔吐斯组为代表。玉尔吐斯组有机质丰度极高, 为我国海相烃源岩中之最[5]。优质的烃源岩与其上覆地层中的礁滩相白云岩储层、厚层膏岩和泥岩构成良好的生‒储‒盖组合[6], 对油气勘探及开采有重要意义。前人对玉尔吐斯组沉积相及分布范围的研究结果[1,5,7‒9]与测井及地震资料吻合良好, 但有关其沉积环境的研究相对缺乏, 高丰度有机质的聚集及埋藏机制也较为模糊。初级生产力的大小直接影响海洋的整体状态以及有机物的生成[10], 因此, 恢复玉尔吐斯组沉积时期的化学环境对理解烃源岩的发育有良好的指示作用。
前寒武纪‒寒武纪转换时期是地球历史上生物与环境演化的重要转折阶段。中元古代时期, 地球上的氧气仅为现今的 0.1%[11‒13], 新元古代出现的碳同位素负漂移事件代表着海洋深部发生氧化事件, 导致发生有机物再矿化作用[14‒15]。氧气浓度提升的同时伴随着真核生物的繁盛以及埃迪拉卡生物群[16]的演化, 生物矿化作用及以遗迹化石为标志的生物扰动作用对前寒武纪‒寒武纪转换这一关键时期生态系统的演化有重要的指示意义[17‒18]。然而, 这一时期生物演化与氧化‒还原环境的关系依然较为模糊, 部分研究者认为在前寒武纪‒寒武纪转换时期海洋整体上处于缺氧状态[19‒20], 可能对埃迪卡拉纪末期生物多样性的减少有重要的影响; 也有部分研究者认为埃迪卡拉动物群的减少与氧逸度的变化无明显的相关性[21]。
虽然寒武纪动物的出现被认为是继大氧化事件后对氧气浓度又一次提升的响应, 但寒武纪生物大爆发与新元古代氧化事件的时间相差 10~30 Ma, 并且, 由于目前对于寒武纪初期水体氧逸度的研究较少[11], 因此氧化‒还原环境与生物协同演化的关系值得在更精细的尺度上进行探讨。前人研究中, 一部分认为是由环境变化驱动了生物的演化, 主要与大气及海洋氧化状态的改变[22]以及全球尺度的冰期[23]有关; 另一部分认为生物自身的驱动力导致其演化, 包括新的生态相互作用[24]以及新基因的演化和表达[25]。因此, 新元古代氧化事件的发生、埃迪卡拉生物的演化与绝灭以及寒武纪生物大爆发之间的内在联系有待研究。
沉积于塔里木盆地西缘的下寒武统玉尔吐斯组, 其地层沉积时代为前寒武纪‒寒武纪转换时期。对于玉尔吐斯组的生物种类及岩石成因类型, 已有较好的研究基础[26‒28], 有利于通过岩石学和地球化学手段开展生物与环境协同演化的研究。玉尔吐斯组富含有机质的黑色岩系可以进行全球尺度的对比, 富含有机质的硅质岩沉积分布也较普遍[29‒31], 因此恢复玉尔吐斯组沉积时期水体的地球化学环境以及初级生产力, 对理解前寒武纪‒寒武纪界线的环境演化以及有机物的聚集与保存方式有重要的意义, 可为探究埃迪卡拉纪末期至寒武纪生物大爆发前这一转折时期生物与环境的协同演化问题提供支持。
本研究采用钡元素含量(Ba)、氮同位素(δ15N)以及锗硅比值(Ge/Si)等地球化学指标, 恢复玉尔吐斯组沉积环境及初级生产力的情况, 以期对有机物的聚集、保存及烃源岩的形成机制有更好的认识。
塔里木盆地(塔里木板块)是中国大陆板块中主要的构造单元, 也是最古老的大陆板块之一, 被北部的天山断裂带、西南部的昆仑断裂带和东南部的阿尔金隆起包围[32]。塔里木板块的基底是前寒武纪岩体, 由暗灰色的角闪岩、灰色片麻岩和花岗片麻岩等组成, Sm-Nd 年龄和 Pb-Pb 年龄为 1.28~1.66Ga。塔里木盆地是世界上最大的含烃陆内盆地之一, 也是中国唯一的海相油气高产率克拉通盆地。晚古生代碳酸盐岩储层是油气开发的重点区域, 奥陶系是目前找到的含油气最多的储库。
阿克苏地区位于塔里木盆地的西北边缘。早寒武世, 该区域位于发育初期的南天山洋的南部边缘[32], 并经历裂谷后的沉降作用和大规模的海进作用, 沉积了分布面积十分广阔的玉尔吐斯组层状硅质岩和黑色页岩[33]。下寒武统的玉尔吐斯组不整合地覆盖于具有岩溶结构的新元古代顶部的奇格布拉克组白云岩之上, 并位于下寒武统肖尔布拉克组含三叶虫的白云岩之下[34]。玉尔吐斯组的下部与扬子板块的梅树村阶下部或其他地区的 Nemakit-Daldynian 阶相对应[26]。玉尔吐斯组下部富含丰富的小型带刺疑源类化石[26‒27], 指示寒武纪动物大爆发期间可能存在一次浮游植物的大辐射, 这可能为地层中有机碳的积累提供了证据。
本研究中 3 个剖面的位置见图 1。其一为昆盖阔坦东剖面, 位于阿克苏地区西南方向 120km 处。岩性从下至上为埃迪卡拉系奇格布拉克组的白云岩以及玉尔吐斯组的黑色页岩与硅质岩互层(图 2(a)和(d))、黑色页岩(图 2(b)和(c))、黑色页岩与碳酸盐岩互层(图 2(a))、白云岩(图 2(g))。下部硅质岩‒页岩以薄层状互层方式产出, 未见厚层硅质岩; 上部白云岩有机质含量较低, 白云石晶粒为半自形至它形。玉尔吐斯组底部的硅质岩与奇格布拉克组的白云岩以平行不整合的形式接触。其二为昆盖阔坦西剖面, 位于阿克苏市西南部, 与昆盖阔坦东剖面相距 500~1500m, 采样范围为玉尔吐斯组底部向上约 14m。岩性主要为黑色泥岩与薄层灰岩互层, 底部有薄层硅质岩发育, 与下伏地层呈平行不整合式接触。由于昆盖阔坦东、西两剖面距离较小, 因此两者的岩性特征相近。其三为苏盖特剖面, 位于阿克苏市西南部, 采样范围为玉尔吐斯组底部向上约15m。底部岩性为黑色硅质岩夹页岩, 其上有一层1m 厚的页岩夹黄绿色磷块岩, 中部为灰色细晶白云岩, 上部为灰色微晶灰岩与黑色页岩互层。3 个剖面硅质岩的光学显微镜下结构(图 2(e)、(f)、(h)和(i))显示, 玉尔吐斯组硅质岩中富含分布不均匀的有机质, 呈球粒和团块状赋存, 形成颜色深浅的差异; 硅质分布较均一, 未见交代残余现象。本研究对上述 3 个剖面自下而上进行系统的采样, 对样品进行详细的沉积学及地球化学研究。

图1 塔里木盆地构造示意图及阿克苏地区玉尔吐斯组剖面位置(据文献[8]修改)
Fig. 1 Simplified tectonic map of Tarim Basin and sampling localities of Yurtus Formation in Aksu area (modified from Ref. [8])
称取约 50mg 样品粉末于 10mL 离心管中, 然后加入5mLpH 约为 4.5 的醋酸铵‒醋酸(NH4COOH-CH3COOH)缓冲溶液, 震荡离心管, 使粉末与缓冲溶液充分接触, 放入振荡频率为 120~150 次/min 的恒温(50℃)水浴震荡箱中 48 小时。将离心管取出, 在离心机中以 3200r/min 的转速分离 10 分钟, 取0.5mL 上清液于新的试管中, 加入 4.5mL2%的硝酸(HNO3)溶液混合, 将原溶液浓度稀释至 1/10。最后, 用等离子体光谱仪 ICP-OES 测试溶液中的主量元素和微量元素含量。
用去离子水将碳酸盐岩组分溶解步骤中残留的碎屑清洗 3 次, 去除其表面残留的离子。清洗后烘干, 重新称量, 放入 PFA 溶样罐中, 加入 3mL 浓HNO3 和 1mL 浓氢氟酸(HF), 放至 120℃恒温电热板上加热 12 小时。将溶液蒸干, 再次加入 5mL 浓HNO3, 将多余的 F 离子除掉, 继续放至 120℃恒温电热板上加热 12 小时。再次将溶液蒸干, 加入 5mL 2%的 HNO3, 并转移至 10 mL 离心管中, 用等离子光谱仪 ICP-OES 测试溶液中的主量元素和微量元素含量。
准确地称量 200mg 样品, 放入 PFA 溶样罐中, 加入 3mL 浓 HNO3 及 1mL 浓 HF, 进行 1 小时超声处理后, 置于恒温电热板上加热 24 小时。将样品蒸干, 重复加入混合浓酸加热的步骤进行再次溶解, 保证样品完全溶解。将样品蒸干, 加入 5mL 浓HNO3 再次溶解, 进行 1 小时超声处理后, 置于恒温电热板上加热 24 小时, 去除体系中的 F 离子。待溶液澄清后, 再次蒸干, 用 5mL2%的 HNO3 溶解, 取其中 0.5mL 样品放入 15mL 离心管中, 再次加入4.5mL2%的 HNO3, 用等离子体质谱仪 ICP-MS 测试Ge含量。

(a)昆盖阔坦东剖面玉尔吐斯组露头照片; (b)昆盖阔坦东剖面黑色页岩显微镜下照片; (c)苏盖特剖面黑色页岩显微镜下照片; (d)昆盖阔坦东剖面下部硅质岩‒页岩露头照片; (e)昆盖阔坦东剖面硅质岩显微镜下照片; (f)苏盖特剖面硅质岩显微镜下照片; (g)昆盖阔坦东剖面上部白云岩显微镜下照片; (h)昆盖阔坦东剖面硅质岩显微镜下照片; (i)为(h)的放大照片
图2 玉尔吐斯组野外剖面及显微镜下照片
Fig. 2 Field photographs and transmitted light photomicrographs of Yurtus Formation
取约 100mg 样品粉末于 15mL 离心管中, 加入10mL 浓度为 3mol/L 的盐酸(HCl), 震荡至粉末与溶液充分接触, 静置 12小时, 在离心机中用 3200r/min 的转速分离, 倒掉上清液, 然后用去离子多次清洗残留的碎屑组分, 去除掉附着在碎屑组分上的HCl。每次清洗后静置 3 小时, 使得悬浮固体颗粒物自由沉降至离心管底部。当清洗液的上清液 pH> 5 时, 清洗完成。将碎屑组分烘干, 称量 50mg残留物放入小型锡纸杯中, 送至美国路易斯安那州立大学同位素实验室, 测定有机质中碳同位素(δ13Corg)和氮同位素(δ15N)组成。
玉尔吐斯组硅质岩 7 个样品的主量元素和微量元素含量及 Ge/Si 值测试结果见表 1。可以看出, 玉尔吐斯组硅质组分含量较高, 硅化程度较完全, 黏土组分(Al2O3)和碳酸盐组分(MgO+CaO)含量较少。所有的硅质岩具有相同的极低 Ge/Si 值, 平均值为 0.31μmol/mol, 与主量元素和微量元素含量无明显的对应性。
表1 玉尔吐斯组硅质岩的主量数据及Ge/Si比值
Table 1 Elemental compositions and Ge/Si ratios of cherts from the lower part of Yurtus Formation
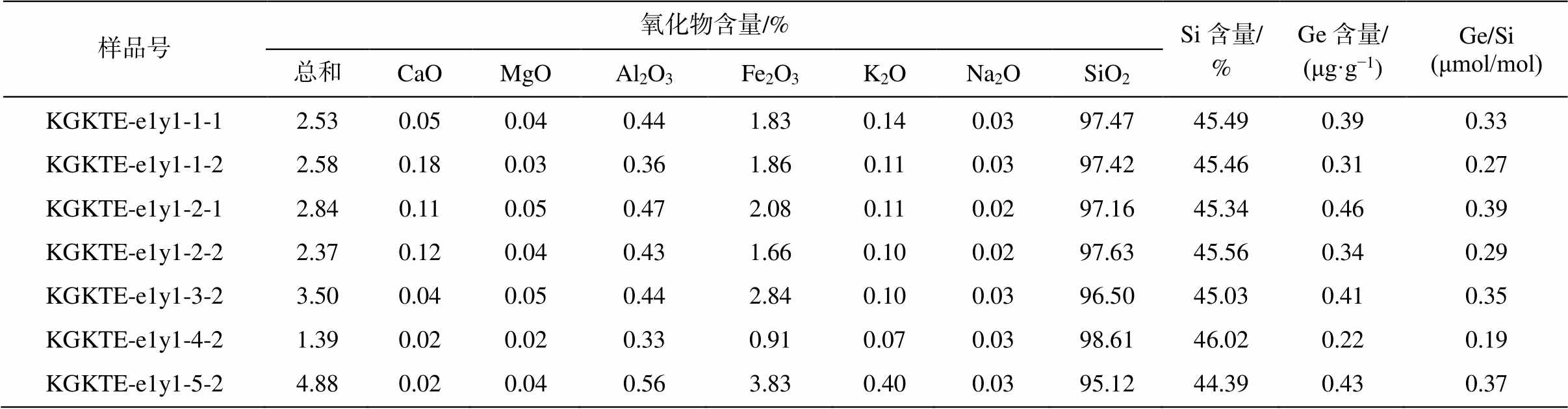
样品号氧化物含量/%Si含量/%Ge含量/(μg·g−1)Ge/Si(μmol/mol) 总和CaOMgOAl2O3Fe2O3K2ONa2OSiO2 KGKTE-e1y1-1-12.530.050.040.441.830.140.0397.4745.490.390.33 KGKTE-e1y1-1-22.580.180.030.361.860.110.0397.4245.460.310.27 KGKTE-e1y1-2-12.840.110.050.472.080.110.0297.1645.340.460.39 KGKTE-e1y1-2-22.370.120.040.431.660.100.0297.6345.560.340.29 KGKTE-e1y1-3-23.500.040.050.442.840.100.0396.5045.030.410.35 KGKTE-e1y1-4-21.390.020.020.330.910.070.0398.6146.020.220.19 KGKTE-e1y1-5-24.880.020.040.563.830.400.0395.1244.390.430.37
玉尔吐斯组碳酸盐组分的地球化学数据见表2。由于部分页岩层中碳酸盐组分含量较少(<1%), 因此对其地球化学数据不做分析。3 个剖面中, 碳酸盐组分含量(<1%~97.30%)和 Mg/Ca 值(0~2.12)的变化无明显的规律, 部分碳酸盐组分的 Mg/Ca 值较小(<0.05), 因此玉尔吐斯组中部分碳酸盐岩并非白云岩夹层, 而是灰岩夹层。昆盖阔坦西剖面和苏盖特剖面均出现碳酸盐组分中 Ba 的富集层段(Ba 含量>1000 μg/g)。
表2 玉尔吐斯组碳酸盐组分占比、Mg/Ca及Ba含量
Table 2 Proportion of carbonate components, Mg/Ca ratios and Ba concentrations of Yurtus Formation
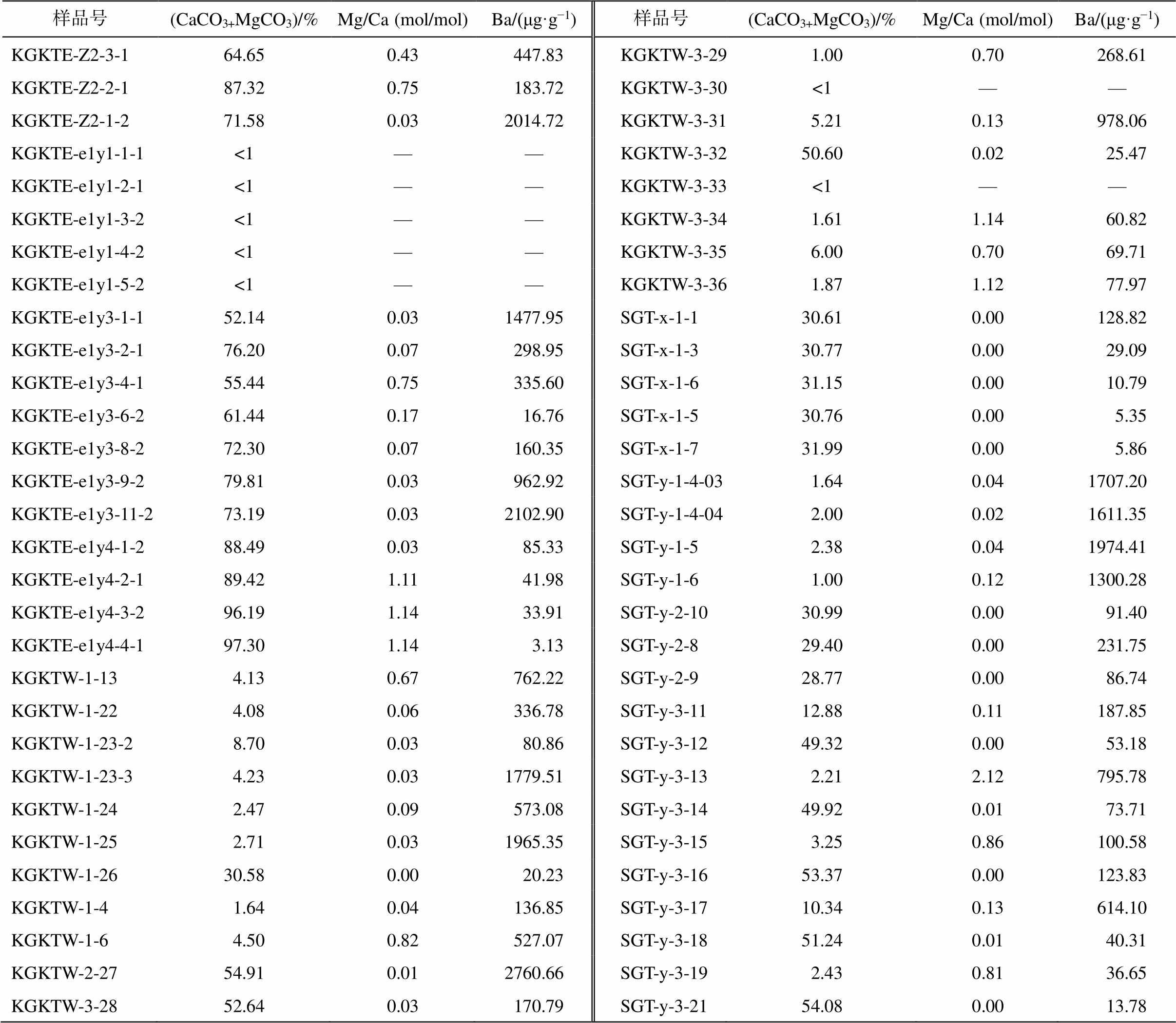
样品号(CaCO3+MgCO3)/%Mg/Ca (mol/mol)Ba/(μg·g−1)样品号(CaCO3+MgCO3)/%Mg/Ca (mol/mol)Ba/(μg·g−1) KGKTE-Z2-3-164.650.43 447.83KGKTW-3-29 1.000.70 268.61 KGKTE-Z2-2-187.320.75 183.72KGKTW-3-30<1—— KGKTE-Z2-1-271.580.032014.72KGKTW-3-31 5.210.13 978.06 KGKTE-e1y1-1-1<1——KGKTW-3-3250.600.02 25.47 KGKTE-e1y1-2-1<1——KGKTW-3-33<1—— KGKTE-e1y1-3-2<1——KGKTW-3-34 1.611.14 60.82 KGKTE-e1y1-4-2<1——KGKTW-3-35 6.000.70 69.71 KGKTE-e1y1-5-2<1——KGKTW-3-36 1.871.12 77.97 KGKTE-e1y3-1-152.140.031477.95SGT-x-1-130.610.00 128.82 KGKTE-e1y3-2-176.200.07 298.95SGT-x-1-330.770.00 29.09 KGKTE-e1y3-4-155.440.75 335.60SGT-x-1-631.150.00 10.79 KGKTE-e1y3-6-261.440.17 16.76SGT-x-1-530.760.00 5.35 KGKTE-e1y3-8-272.300.07 160.35SGT-x-1-731.990.00 5.86 KGKTE-e1y3-9-279.810.03 962.92SGT-y-1-4-03 1.640.041707.20 KGKTE-e1y3-11-273.190.032102.90SGT-y-1-4-04 2.000.021611.35 KGKTE-e1y4-1-288.490.03 85.33SGT-y-1-5 2.380.041974.41 KGKTE-e1y4-2-189.421.11 41.98SGT-y-1-6 1.000.121300.28 KGKTE-e1y4-3-296.191.14 33.91SGT-y-2-1030.990.00 91.40 KGKTE-e1y4-4-197.301.14 3.13SGT-y-2-829.400.00 231.75 KGKTW-1-13 4.130.67 762.22SGT-y-2-928.770.00 86.74 KGKTW-1-22 4.080.06 336.78SGT-y-3-1112.880.11 187.85 KGKTW-1-23-2 8.700.03 80.86SGT-y-3-1249.320.00 53.18 KGKTW-1-23-3 4.230.031779.51SGT-y-3-13 2.212.12 795.78 KGKTW-1-24 2.470.09 573.08SGT-y-3-1449.920.01 73.71 KGKTW-1-25 2.710.031965.35SGT-y-3-15 3.250.86 100.58 KGKTW-1-2630.580.00 20.23SGT-y-3-1653.370.00 123.83 KGKTW-1-4 1.640.04 136.85SGT-y-3-1710.340.13 614.10 KGKTW-1-6 4.500.82 527.07SGT-y-3-1851.240.01 40.31 KGKTW-2-2754.910.012760.66SGT-y-3-19 2.430.81 36.65 KGKTW-3-2852.640.03 170.79SGT-y-3-2154.080.00 13.78
昆盖阔坦东剖面碎屑岩组分的主量元素数据、有机碳含量(TOC)、有机碳同位素组成(δ13Corg)及氮同位素组成(δ15N)见表 3。在玉尔吐斯组底部硅质岩‒页岩层段, 出现 Ba 含量富集现象(Ba 含量>1000 μg/g), 且与陆源输入无明显相关性(Al 含量<5%)。Zhou 等[33]的研究表明, 黑色页岩层段中出现大量的重晶石结核, 同样说明这一地层中 Ba 的含量较高。在同一层段出现 δ15N 升高(>7‰)。从昆盖阔坦西剖面和苏盖特剖面的 δ13Corg 和 δ15N 数据(表 4)中, 同样发现有 δ15N 升高的层段(>10‰), 且与碳酸盐组分中Ba含量升高的层段具有一定的相关性。
作为海洋生态系统中的基础参数之一, 初级生产力影响着生态系统演化的整体状态、氧化‒还原环境以及一系列营养元素的循环[35]。同时, 生物泵体系对海洋的化学性质及全球碳循环有着重要的调控作用[36‒37]。因此, 恢复玉尔吐斯组沉积时期生物泵的效率对恢复海洋的输出生产力以及聚碳机制有重要意义。现代海洋中, 初级生产者主要为生活在表层海水中的单细胞浮游植物[10], 与之相关的有机物可以沉降至海底, 并且保存在沉积物中。海洋中的颗粒有机碳(POC)与颗粒 Ba 通量有明显的相关 性[38‒39], Ba (以硫酸钡(BaSO4)颗粒为主)通常作为指示有机碳输出及初级生产力的良好指标[40]。通常, 沉积物中的 BaSO4 颗粒主要来源于热液作用[41‒42]、成岩作用[41]及海洋自生作用[43]。由于成岩作用及热液作用形成的 BaSO4 颗粒无法准确地记录海水的化学性质及生产力大小[44], 因此确定 Ba 的来源十分重要。
现代海洋中最常见的 BaSO4 颗粒是海洋自生的, 主要形成于生产力较高的浅水区域[45‒46], 最终保存在沉积岩中。由于现代海洋中 BaSO4 处于不饱和状态[47], 因此海洋自生 BaSO4 的形成主要受微生物降解有机物过程中局部微环境控制。近期的研究表明, 细菌的生物膜(以胞外聚合物为主)上的多磷单元可以为 Ba 提供聚集的位点, 而多磷单元可以被 SO42−替代, 从而形成 BaSO4 颗粒[48], 这一结论与过去研究中 BaSO4 颗粒的聚集与细菌活动相对应[49]是一致的。因此, 在生产力较高的区域, 大量有机物在沉降过程中遭受微生物的降解作用, 有机物表面的胞外聚合物对 Ba 起到聚合作用, 并形成成核位点, 最终导致 BaSO4 颗粒的沉积。作为古生产力的指标, BaSO4 颗粒较难溶解, 且在氧化环境下有较高的埋藏率(Ba沉降通量的 30%~50%)[38] (有机碳的埋藏率小于 10%[50])。即使在不利于 BaSO4颗粒保存的还原环境中, 沉积物中高浓度的 Ba 同样可以作为强有力的古生产力指标[51‒53]。
表3 昆盖阔坦东剖面玉尔吐斯组主量数据、Ba含量、δ13Corg及δ15N数据
Table 3 Elemental compositions, Ba concentrations, δ13Corg and δ15N of Yurtus Formation at East Kungaikuotan section
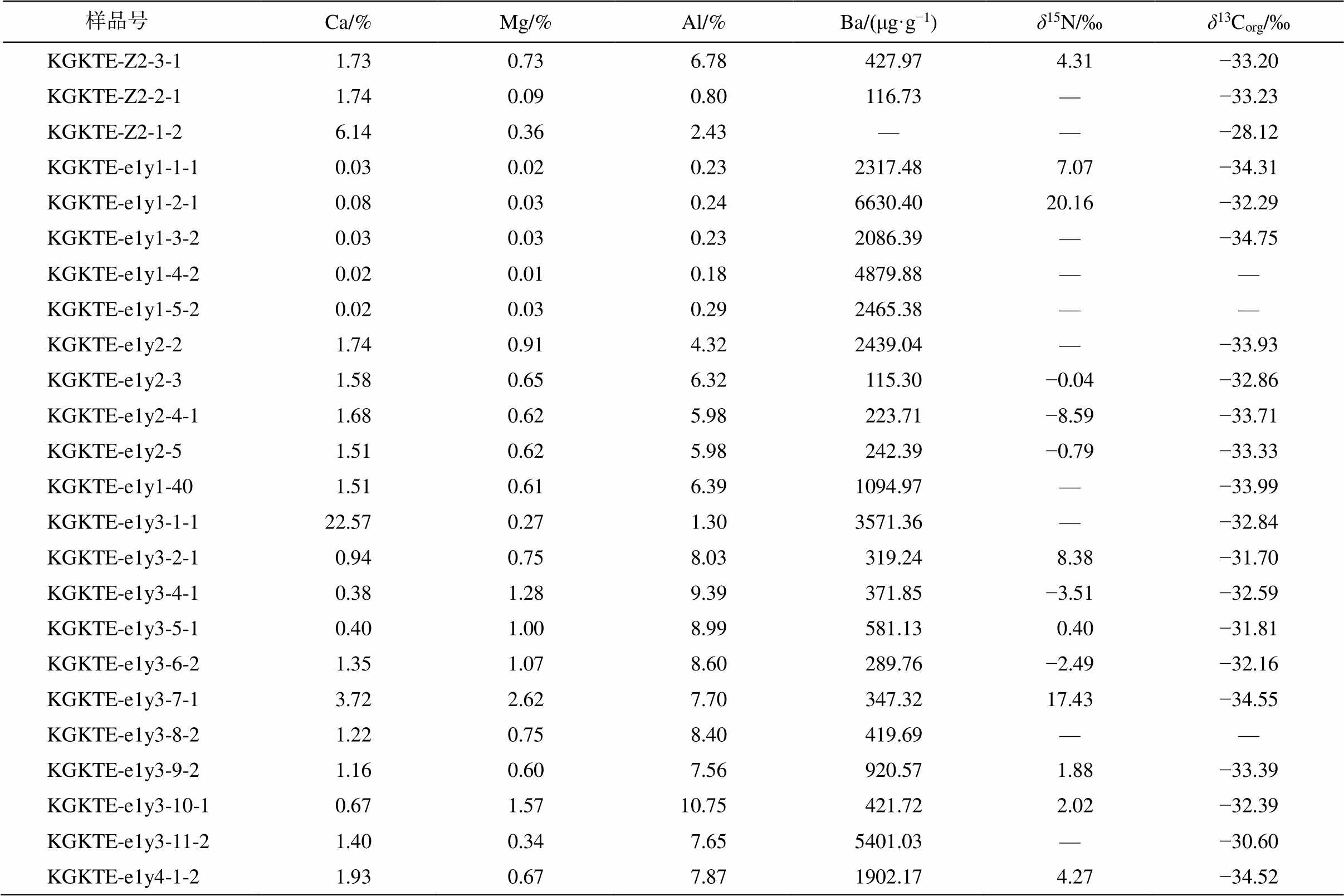
样品号Ca/%Mg/%Al/%Ba/(μg·g−1)δ15N/‰δ13Corg/‰ KGKTE-Z2-3-1 1.730.73 6.78 427.97 4.31−33.20 KGKTE-Z2-2-1 1.740.09 0.80 116.73—−33.23 KGKTE-Z2-1-2 6.140.36 2.43——−28.12 KGKTE-e1y1-1-1 0.030.02 0.232317.48 7.07−34.31 KGKTE-e1y1-2-1 0.080.03 0.246630.4020.16−32.29 KGKTE-e1y1-3-2 0.030.03 0.232086.39—−34.75 KGKTE-e1y1-4-2 0.020.01 0.184879.88—— KGKTE-e1y1-5-2 0.020.03 0.292465.38—— KGKTE-e1y2-2 1.740.91 4.322439.04—−33.93 KGKTE-e1y2-3 1.580.65 6.32 115.30−0.04−32.86 KGKTE-e1y2-4-1 1.680.62 5.98 223.71−8.59−33.71 KGKTE-e1y2-5 1.510.62 5.98 242.39−0.79−33.33 KGKTE-e1y1-40 1.510.61 6.391094.97—−33.99 KGKTE-e1y3-1-122.570.27 1.303571.36—−32.84 KGKTE-e1y3-2-1 0.940.75 8.03 319.24 8.38−31.70 KGKTE-e1y3-4-1 0.381.28 9.39 371.85−3.51−32.59 KGKTE-e1y3-5-1 0.401.00 8.99 581.13 0.40−31.81 KGKTE-e1y3-6-2 1.351.07 8.60 289.76−2.49−32.16 KGKTE-e1y3-7-1 3.722.62 7.70 347.3217.43−34.55 KGKTE-e1y3-8-2 1.220.75 8.40 419.69—— KGKTE-e1y3-9-2 1.160.60 7.56 920.57 1.88−33.39 KGKTE-e1y3-10-1 0.671.5710.75 421.72 2.02−32.39 KGKTE-e1y3-11-2 1.400.34 7.655401.03—−30.60 KGKTE-e1y4-1-2 1.930.67 7.871902.17 4.27−34.52
表4 昆盖阔坦西剖面和苏盖特剖面的δ13Corg及δ15N数据
Table 4 δ13Corg and δ15N of Yurtus Formation at West Kungaikuotan section and Sugaitbulak section
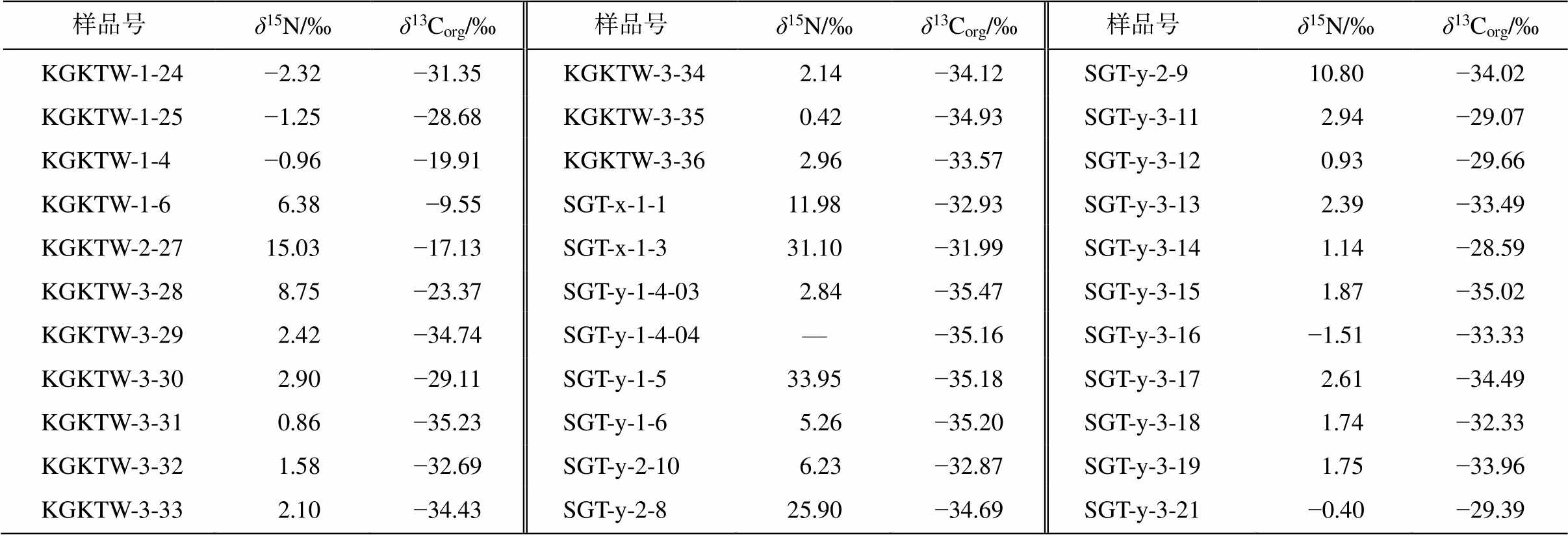
样品号δ15N/‰δ13Corg/‰样品号δ15N/‰δ13Corg/‰ 样品号δ15N/‰δ13Corg/‰ KGKTW-1-24−2.32−31.35KGKTW-3-34 2.14−34.12SGT-y-2-910.80−34.02 KGKTW-1-25−1.25−28.68KGKTW-3-35 0.42−34.93SGT-y-3-11 2.94−29.07 KGKTW-1-4−0.96−19.91KGKTW-3-36 2.96−33.57SGT-y-3-12 0.93−29.66 KGKTW-1-6 6.38 −9.55SGT-x-1-111.98−32.93SGT-y-3-13 2.39−33.49 KGKTW-2-2715.03−17.13SGT-x-1-331.10−31.99SGT-y-3-14 1.14−28.59 KGKTW-3-28 8.75−23.37SGT-y-1-4-03 2.84−35.47SGT-y-3-15 1.87−35.02 KGKTW-3-29 2.42−34.74SGT-y-1-4-04—−35.16SGT-y-3-16−1.51−33.33 KGKTW-3-30 2.90−29.11SGT-y-1-533.95−35.18SGT-y-3-17 2.61−34.49 KGKTW-3-31 0.86−35.23SGT-y-1-6 5.26−35.20SGT-y-3-18 1.74−32.33 KGKTW-3-32 1.58−32.69SGT-y-2-10 6.23−32.87SGT-y-3-19 1.75−33.96 KGKTW-3-33 2.10−34.43SGT-y-2-825.90−34.69SGT-y-3-21−0.40−29.39
本研究的 3 个剖面中, 玉尔吐斯组均出现 Ba 富集层段(表 2 和 3, 图 3)。研究表明, 玉尔吐斯组底部早期形成的硅质岩主要为热液交代成因[28,54‒55], 但我们发现 3 个剖面中玉尔吐斯组底部薄层硅质岩均与页岩互层产出(图 2 和 3), 主要为有机质球粒或团块硅质岩(图 2(e)和(f)), 未见交代残余结构或热液流体的通道保存, 缺少前人提及的残余白云石硅质岩等类型[28]。由于本研究的 3 个剖面距前人定义的肖尔布拉克地区热液喷流中心较远, 未产出初期由热液作用形成的硅质岩, 因此剖面中硅质岩为热液成因的可能性较小。另外, 极低的 Ge/Si 值也表明本研究的剖面中的硅质岩更接近海水沉积成因, 加上页岩层中未出现受热液改造影响的现象[33], 因此本文剖面的玉尔吐斯组中 Ba 富集现象可能与热液活动无关。同时, 玉尔吐斯组沉积于中缓斜坡, 在成岩阶段不会形成强蒸发环境, 并且未发现典型的蒸发相矿物, 因此 Ba 的富集不大可能源于其在成岩过程中对 Ca 离子的替代作用[41]。另外, 如果以 Al 作为陆源输入的指示元素[38], 将 Ba 与 Al 的含量进行比较, 发现在 Ba 富集的层段Al 的含量极低, 且与 Ba 含量无相关性(表 3), 表明测得的 Ba 绝大部分来自海水而非陆源输入。因此, 玉尔吐斯组中富集的 Ba 很可能来自海洋自生的BaSO4颗粒[33]。
昆盖阔坦东剖面中碎屑岩 Ba 浓度较高(表 2 和图 3), 代表在沉积过程中形成并保存了较多 BaSO4颗粒; 昆盖阔坦西剖面和苏盖特剖面中碳酸盐组分中 Ba 浓度较高(表 3 和图 3), 说明沉积水体中 Ba 较为富集, 同样印证了有机物降解时局部富 Ba 的现象。总体来说, 较高的 Ba 含量表明玉尔吐斯组沉积区域的表层水体初级生产力较高。大量重晶石晶体的出现也说明在玉尔吐斯组沉积时期发生大量的Ba 聚集[33], 也印证了早寒武世由于全球气候逐渐变暖, 玉尔吐斯组沉积区域浮游生物较为繁盛的现象, 并与保存良好的化石证据[26‒27]相互印证。
氮是生物活动必需的主要元素, 可以调节初级生产力的大小[56]。氮在海洋中主要以硝酸根离子(NO3−)的形式存在, 伴有较低浓度的亚硝酸根离子(NO2−)和铵根离子(NH4+)。固氮作用是海洋中氮输入的主要方式, 而反硝化作用及厌氧氨氧化作用是从生物可利用氮储库中移除氮的过程, 不同过程的速率及控制因素影响海洋氮循环的模式, 并伴随不同程度的同位素分馏。因此, 保留在有机物中的氮同位素可以反映海洋的氧化‒还原状态以及生物的新陈代谢过程。
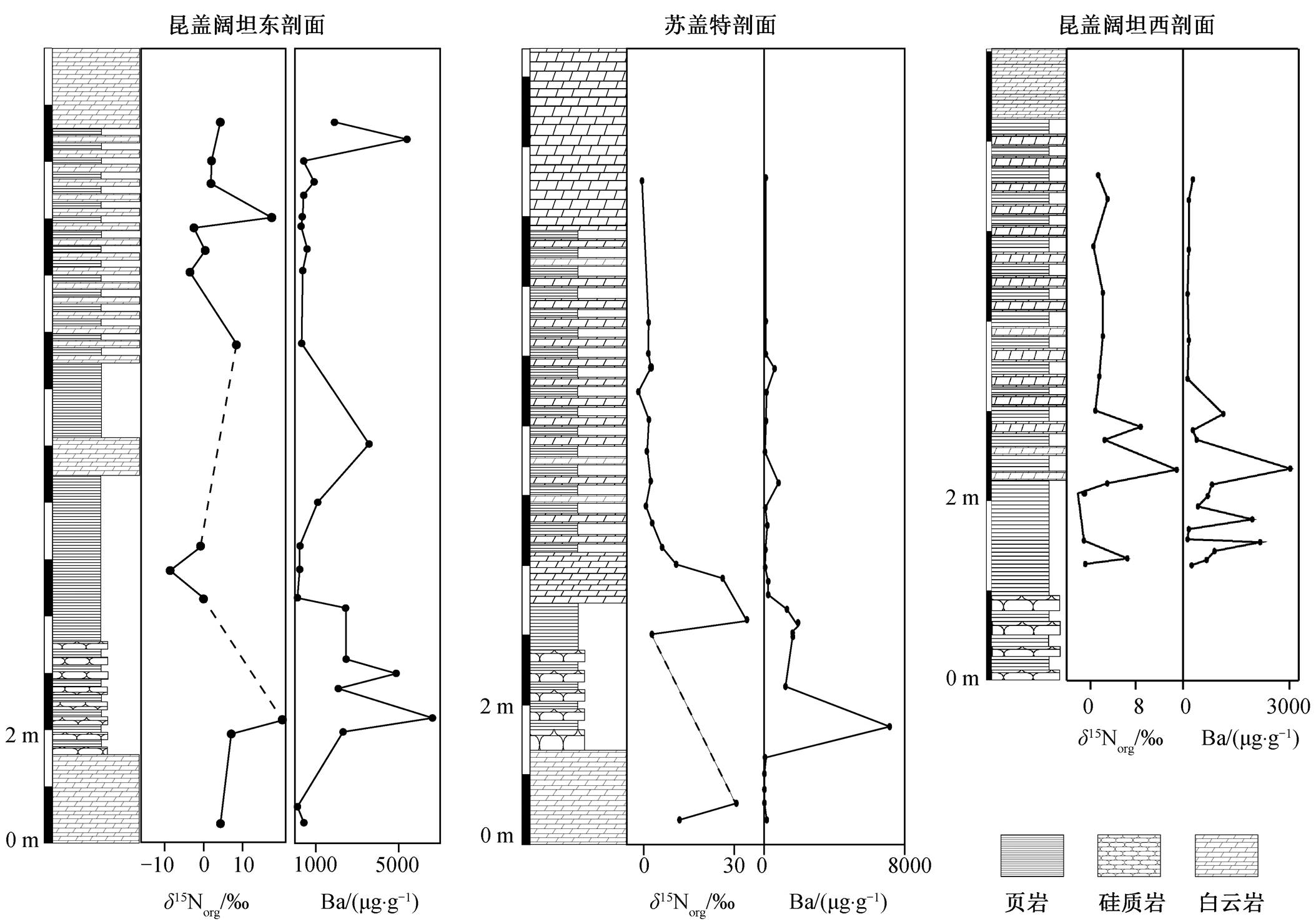
昆盖阔坦东剖面为碎屑岩组分中的 Ba, 昆盖阔坦西剖面和苏盖特剖面为碳酸盐组分中的 Ba
图3 昆盖阔坦东剖面、昆盖阔坦西剖面和苏盖特剖面玉尔吐斯组δ15N 及 Ba 含量
Fig. 3 δ15N signals and Ba concentrations of Yurtus Formation at East Kungaikuotan, West Kungaikuotan and Sugaitbulak sections
需氧或厌氧自养生物的固氮过程中, 氮同位素的分馏程度很低(δ15N=−2‰~+1‰)[57]。生物固定下来的氮会通过硝化作用形成 NO3−, 成为需氧生物的主要氮来源, 这一过程通常进行得较为完全, 并且与固氮生物体相比, 硝化作用形成的 NO3−有更轻的氮同位素组成[58‒59]。现代海洋中, 沉积物的平均δ15N 为+5‰ (分布范围为+3‰~+14‰)[60], 这是由于反硝化作用影响氮同位素的分布。反硝化作用将部分 NO3−还原成 N2, 在现代海洋中, 反硝化作用一般发生于贫氧区域(如氧气最小带)。当反硝化作用发生在沉积物中时, 净分馏值为 0; 如反硝化作用发生在水体中, 由于反应产物 N2 具有更轻的同位素组成, 剩余的 NO3−具有更重的同位素组成(δ15N= −30‰~−5‰, 平均−25‰)[57]。残留的 NO3− 可以被生物利用, 以有机质的形式埋藏保存。因此, 可以利用有机质中氮同位素组成特征来恢复海洋氧化‒还原环境与生物活动之间的关系。
我们在 3 个剖面的玉尔吐斯组中均发现 δ15N明显升高的峰值层段(δ15N>+8‰)(表 3 和 4, 图 3), 一方面说明在这一沉积时期, 海洋中发生了反硝化作用, 使得海洋中生物可利用的 NO3−中 δ15N 较高; 另一方面, 由于反硝化作用需要相对缺氧的还原环境(类似现代海洋中的最小氧化带), 因此表明海洋内部或沉积物上方的水体较为偏还原环境。虽然苏盖特剖面中 Ba 富集层段的 δ15N 数据较少, 但昆盖阔坦东剖面和昆盖阔坦西剖面的 δ15N 升高层段与 Ba富集层段较为吻合, 表明缺氧水体的出现可能与极高生产力形成的有机物降解过程有关(图 4)。玉尔吐斯组沉积于斜坡环境, 初级生产者在表层水体的透光带中较为繁盛, 大量的有机质在沉降过程中通过降解作用不断地消耗海洋中的氧气, 使得氧气浓度不断下降, 为反硝化作用的发生提供了良好的条件, 造成海洋中的 NO3−浓度及有机物中的 δ15N 升高。同时, 有机物的降解过程也是 BaSO4 富集并沉淀的过程。因此, Ba 的富集与 δ15N 的升高有一定程度的耦合关系。另外, 缺氧的环境更适合有机物的保存, 为有机物的聚集提供更理想的条件, 也为后期的成烃作用提供了充足的物质基础。综上所述, 可为玉尔吐斯组中硅质岩及上部页岩成为优质烃源岩层段提供合理的解释。
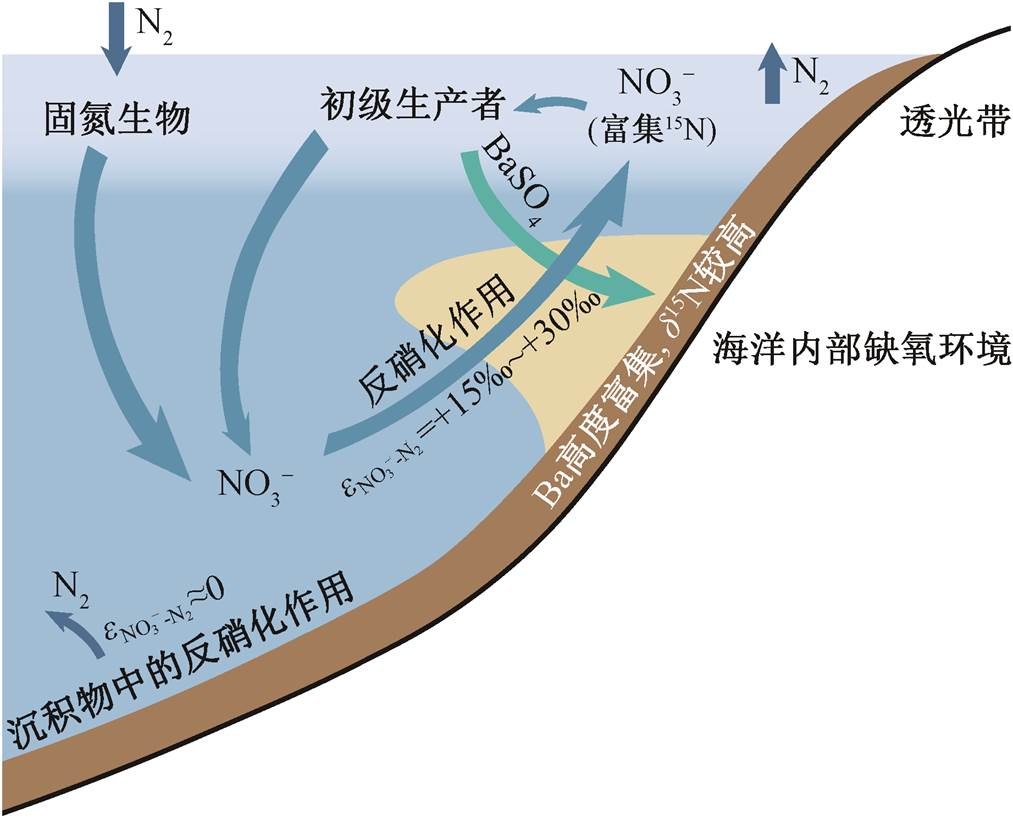
图4 玉尔吐斯组沉积环境示意图
Fig. 4 Schematic diagram of depositional environment of Yurtus Formation
玉尔吐斯组底部由灰黑色薄层硅质岩与页岩互层组成, 有机质含量较高, 为主要的优质烃源岩层段[5], 可以与全球同时期黑色岩系进行对比。硅质岩的形成机制与硅质胶结的过程对有机质的聚集及保存是否起重要作用, 有待进一步研究。
本文采用 Ge/Si 值判断硅质的来源[29,61‒62]。Ge和 Si 位于元素周期表的同一主族, 有相似的电价及电子构型[63], 因此 Ge 可以在硅酸盐矿物中替代 Si的位置[64]。现代海洋中, Si 的来源主要为热液流体或正常海水, 而正常海水是由热液流体与陆源风化输入物质混合而成的稳定状态产物。现代海水受陆源风化影响较强[65], 由于风化过程中 Si 倾向于进入水体, 而 Ge 倾向于保留在原岩中[66], 所以河流中的Ge/Si 值为 0.31~1.24μmol/mol,而正常海水表现出低Ge/Si 值(≈0.72μmol/mol)的性质[67‒69]。热液流体表现出显著富 Ge 的性质, Ge/Si值(≈11μmol/mol)比正常海水高 1 个数量级[70]。因此, 可以用硅质岩中的Ge/Si 值来限制古海洋的硅质来源, 低 Ge/Si 值说明正常海水对硅质沉积的贡献较大。
本文 3 个剖面中玉尔吐斯组底部硅质岩层较薄, 且与页岩互层(图 2(d)), 硅质化程度较高, 并且较均一(SiO2>95%, 表 1), 有机质含量丰富(图 2(e)和(f)), 主要由有机质球粒硅质岩及有机质团块硅质岩组成, 未见残余白云石或其他矿物的交代特征。玉尔吐斯组硅质岩由西向东逐渐减薄, 从大套厚层硅质岩逐渐过渡为薄层的与页岩互层的硅质岩[55], 说明沿前人定义的热液喷流中心向外, 热液硅质对硅质岩形成的贡献逐渐减小[28,54]。本文 3 个剖面距热液喷流中心较远, 且无明显的热液通道保留及残余交代现象, 因此可能热液活动的影响较小。硅质岩的Ge/Si 值为 0.19~0.39 μmol/mol (表 1), 显著低于热液流体的 Ge/Si 值, 表明热液流体不是玉尔吐斯组硅质岩沉积的主要 Si 来源。然而, 硅质岩中的 Ge/Si值与现代海水较为接近, 表现出由海水直接沉积硅质岩的可能性。在玉尔吐斯组沉积时期的早寒武世, 硅藻等吸收硅质的生物还未演化出来[71], 放射虫及硅质海绵还未占据主要生态位[72‒73], 由生物作用将海水中的硅质聚集并沉积的可能性不大。因此, 玉尔吐斯组硅质岩的形成很可能是溶解态 Si 从海水中直接沉淀的过程。同时, 沉积学及地球化学证据表明, 全球其他区域部分同时期的硅质岩也来自海水的直接沉积, 未受热液作用的影响[29‒30]。
海水成因硅质岩的出现或硅质胶结环境的存在, 可能对有机质的保存及埋藏有着重要的作用。表层生产者产生的有机物在沉降和埋藏过程中都会发生降解作用, 从而降低有机物的埋藏效率。在高浓度的硅质环境下, 硅质沉积或胶结作用较为快速, 由松散的沉积颗粒物转变为沉积岩的时间较短, 大大减少了有机物经历降解作用的时间, 因此埋藏的有机物较多。这种硅质胶结的环境也可能持续至页岩沉积阶段, 从而使快速胶结成岩的页岩保存较多的有机质, 为之后的生烃作用提供了有效的物质基础。因此, 海水中高浓度硅质的环境为有机质的保存提供了较为理想的条件。
本文对塔里木盆地西缘下寒武统玉尔吐斯组 3个典型剖面的岩石学及地球化学研究, 结论如下。
1)玉尔吐斯组下部硅质岩‒页岩层段中较高浓度的 Ba (>1000μg/g)说明, 沉积时期表层初级生产力较高, 大量的有机物由表层沉降至海水内部, 对BaSO4 的形成起到促进作用, 较高的初级生产力对大量有机物的产生及埋藏起主导作用。
2)较高的 δ15N (>+8‰)表明 NO3−在水体中发生了反硝化作用或厌氧氨氧化作用, 两种过程均发生在相对缺氧的环境中。因此, 高初级生产力产生的有机物可能在降解过程中不断地消耗水体中的氧气, 使得水体内部至水‒岩界面附近的环境偏于还原性。同时, 缺氧的水体环境对有机物的保存及埋藏有重要的促进作用。
3)本文 3 个剖面中玉尔吐斯组下部硅质岩低Ge/Si 值(<0.5μmol/mol)说明其硅质岩中 Si 的主要来源是正常海水而非热液。快速的硅质胶结作用有利于大量有机物的保存, 减少有机物的降解时间, 为后期的成烃作用提供良好的物质基础。
参考文献
[1] 潘文庆, 陈永权, 熊益学, 等. 塔里木盆地下寒武统烃源岩沉积相研究及其油气勘探指导意义. 天然气地球科学, 2015, 26(7): 1224‒1232
[2] 傅国友, 宋岩, 赵孟军, 等. 烃源岩对大中型气田形成的控制作用——以塔里木盆地喀什凹陷为例. 天然气地球科学, 2007, 18(1): 62‒66
[3] 邢卫新, 汤达祯, 马新海, 等. 塔里木盆地东北缘孔雀河地区烃源岩演化特征及成藏条件研究. 天然气地球科学, 2007, 18(1): 57‒61
[4] Li S, Amrani A, Pang X, et al. Origin and quantitative source assessment of deep oils in the Tazhong Uplift, Tarim Basin. Org Geochem, 2015, 78: 1‒22
[5] Zhu G, Chen F, Chen Z, et al. Discovery and basic characteristics of high-quality source rocks found in the Yuertusi Formation of the Cambrian in Tarim Basin, China. Journal of Natural Gas Geoscience, 2016, 1(1): 21‒33
[6] 罗平, 王石, 李朋威, 等. 微生物碳酸盐岩油气储层研究现状与展望. 沉积学报, 2013, 31(5): 807‒823
[7] 崔海峰, 田雷, 张年春, 等. 塔西南坳陷寒武系玉尔吐斯组烃源岩分布特征. 天然气地球科学, 2016, 27(4): 577‒583
[8] 熊冉, 周进高, 倪新锋, 等. 塔里木盆地下寒武统玉尔吐斯组烃源岩分布预测及油气勘探的意义. 天然气工业, 2015, 35(10): 49‒56
[9] 胡广, 刘文汇, 腾格尔, 等. 塔里木盆地下寒武统泥质烃源岩成烃生物组合的构造‒沉积环境控制因素. 石油与天然气地质, 2014, 35(5): 685‒695
[10] Sigman D M, Hain M P. The biological productivity of the ocean. Nature Education Knowledge, 2012, 3(10): 21‒37
[11] Lyons T W, Reinhard C T, Planavsky N J. The rise of oxygen in Earth’s early ocean and atmosphere. Na-ture, 2014, 506: 307‒315
[12] Planavsky N J, Reinhard C T, Wang X, et al. Low mid-Proterozoic atmospheric oxygen levels and the delayed rise of animals. Science, 2014, 346: 635‒638
[13] Reinhard C T, Planavsky N J, Robbins L J, et al. Proterozoic ocean redox and biogeochemical stasis. Proc Natl Acad Sci USA, 2013, 110(14): 5357‒5362
[14] Fike D A, Grotzinger J P, Pratt L M, et al. Oxidation of the Ediacaran ocean. Nature, 2006, 444: 744‒747
[15] Shields-Zhou G A, Och L M. The case for a Neo-proterozoic oxygenation event: geochemical evidence and biological consequences. GSA Today, 2011, 21 (3): 4‒11
[16] Narbonne G M. The ediacara biota: neoproterozoic origin of animals and their ecosystems. Annu Rev Earth Planet Sci, 2005, 33(1): 421‒442
[17] Hua H, Chen Z, Yuan X L, et al. Skeletogenesis and asexual reproduction in the earliest biomineralizing animal Cloudina. Geology, 2005, 33(4): 277‒280
[18] Droser M L, Tarhan L G, Gehling J G. The rise of animals in a changing environment: global ecological innovation in the Late Ediacaran. Annual Review of Earth and Planetary Sciences, 2017, 45(1): 593‒617
[19] Schroder S, Grotzinger J P. Evidence for anoxia at the Ediacaran-Cambrian boundary: the record of redox-sensitive trace elements and rare earth elements in Oman. J Geol Soc London, 2007, 164(1): 175‒187
[20] Kimura H, Watanabe Y. Oceanic anoxia at the Pre-cambrian-Cambrian boundary. Geology, 2001, 29(11): 995‒998
[21] Darroch S A, Sperling E A, Boag T H, et al. Biotic replacement and mass extinction of the Ediacara biota. Proc Biol Sci, 2015, 282: 917‒933
[22] Mills D B, Canfield D E. Oxygen and animal evolu-tion: did a rise of atmospheric oxygen “trigger” the origin of animals?. Bioessays, 2014, 36(12): 1145‒ 1155
[23] Hoffman P F, Kaufman A J, Halverson G P, et al. A Neoproterozoic snowball earth. Science, 1998, 281: 1342‒1346
[24] Marshall C R. Explaining the Cambrian “explosion” of animals. Annu Rev Earth Planet Sci, 2006, 34(1): 355‒384
[25] Davidson E H, Erwin D H. An integrated view of pre-cambrian eumetazoan evolution. Cold Spring Harbor Symposia on Quantitative Biology, 2010, 74: 65‒80
[26] Yao J X, Xiao S H, Yin L M, et al. Basal Cambrian microfossils from Yurtus and Xishanblaq formations (Tarim, North-West China): systematic revision and biostratigraphic correlation of Micrhystridium-like acritarchs. Palaeontology, 2005, 48(4): 687‒708
[27] Dong L, Xiao S H, Shen B, et al. Basal Cambrian microfossils from the Yangtze Gorges area (South China) and Aksu area (Tarim Block, Northwestern China). J Paleontol, 2009, 83(1): 30‒44
[28] 杨宗玉, 罗平, 刘波, 等. 塔里木盆地阿克苏地区下寒武统玉尔吐斯组硅质岩分类及成因. 地学前缘, 2017, 24(5): 245‒264
[29] Dong L, Shen B, Lee C T A, et al. Germanium/silicon of the Ediacaran-Cambrian Laobao cherts: implica-tions for the bedded chert formation and paleoen-vironment interpretations. Geochemistry Geophysics Geosystems, 2015, 16(3): 751‒763
[30] Ramseyer K, Amthor J E, Matter A, et al. Primary silica precipitate at the Precambrian/Cambrian boun-dary in the South Oman Salt Basin, Sultanate of Oman. Mar Pet Geol, 2013, 39(1): 187‒197
[31] Banerjee D M, Schidlowski M, Siebert F, et al. Geo-chemical changes across the Proterozoic-Cambrian transition in the Durmala phosphorite mine section, Mussoorie Hills, Garhwal Himalaya, India. Palaeo-geogr, Palaeoclimatol, Palaeoecol, 1997, 132(1): 183‒194
[32] Yu B S, Dong H L, Widom E, et al. Geochemistry of basal Cambrian black shales and cherts from the Northern Tarim Basin, Northwest China: implications for depositional setting and tectonic history. JAESC, 2009, 34(3): 418‒436
[33] Zhou X Q, Chen D Z, Dong S F, et al. Diagenetic barite deposits in Yurtus Formation in Tarim Basin, NW China: implications for barium and sulfur cycling in the earliest Cambrian. Precambrian Res, 2015, 263: 79‒87
[34] 高振家, 王务严, 彭昌文, 等. 新疆阿克苏‒乌什地区震旦系. 乌鲁木齐: 新疆人民出版社, 1986
[35] Schoepfer S D, Shen J, Wei H Y, et al. Total organic carbon, organic phosphorus, and biogenic barium fluxes as proxies for paleomarine productivity. Earth Sci Rev, 2015, 149: 23‒52
[36] Meyer K M, Ridgwell A, Payne J L. The influence of the biological pump on ocean chemistry: implications for long-term trends in marine redox chemistry, the global carbon cycle, and marine animal ecosystems. Geobiology, 2016, 14(3): 207‒219
[37] Paytan A, Kastner M, Chavez F P. Glacial to interg-lacial fluctuations in productivity in the equatorial pacific as indicated by marine barite. Science, 1996, 274: 1355‒1357
[38] Dymond J, Suess E, Lyle M. Barium in deep-sea sediment: a geochemical proxy for paleoproductivity. Paleoceanography, 1992, 7(2): 163‒181
[39] Dymond J, Collier R. Particulate barium fluxes and their relationships to biological productivity. DSR, 1996, 43(4): 1283‒1308
[40] Paytan A, Griffith E M. Marine barite: recorder of variations in ocean export productivity. DSR, 2007, 54: 687‒705
[41] Lambert I B, Donnelly T H, Dunlop J S R, et al. Stable isotopic compositions of Early Archaean sul-fate deposits of probable evaporitic and volcano-genic origins. Nature, 1978, 276: 808‒811
[42] Torres M E, Bohrmann G, Dubé T E, et al. Formation of modern and Paleozoic stratiform barite at cold methane seeps on continental margins. Geology, 2003, 31(10): 897‒900
[43] Dehairs F, Chesselet R, Jedwab J. Discrete suspended particles of Barite and the Barium Cycle in the open ocean. Earth Planet Sci Lett, 1980, 49(2): 528‒550
[44] Paytan A, Mearon S, Cobb K M, et al. Origin of marine barite deposits: Sr and S isotope characteri-zation. Geology, 2002, 30(8): 747‒750
[45] Bishop J K B. The barite-opal-organic carbon associa-tion in oceanic particulate matter. Nature, 1988, 332: 341‒343
[46] Schmitz B. Barium, equatorial high productivity, and the northward wandering of the Indian continent. Pa-leoceanography, 1987, 2(1): 63‒77
[47] Monnin C, Jeandel C, Cattaldo T, et al. The marine barite saturation state of the world’s oceans. Mar Chem, 1999, 65(3/4): 253‒261
[48] Martinez-Ruiz F, Jroundi F, Paytan A, et al. Barium bioaccumulation by bacterial biofilms and implica-tions for Ba cycling and use of Ba proxies. Nat Commun, 2018, 9(1): 1619‒1628
[49] Gonzalez-Muñoz M T, Martinez-Ruiz F, Morcillo F, et al. Precipitation of barite by marine bacteria: a possi-ble mechanism for marine barite formation. Geology, 2012, 40(8): 675‒678
[50] Paytan A, Kastner M. Benthic Ba fluxes in the central Equatorial Pacific, implications for the oceanic Ba cycle. Earth Planet Sci Lett, 1996, 142(3): 439‒450
[51] Martinez-Ruiz F, Paytan A, Kastner M, et al. A comparative study of the geochemical and mineralogi-cal characteristics of the S1 sapropel in the western and eastern Mediterranean. Palaeogeogr, Palaeocli-matol, Palaeoecol, 2003, 190: 23‒37
[52] Martinez-Ruiz F, Kastner M, Paytan A, et al. Geo-chemical evidence for enhanced productivity during S1 sapropel deposition in the eastern Mediter-ranean. Paleoceanography, 2000, 15(2): 200‒209
[53] Bąk K. Organic-rich and manganese sedimentation during the Cenomanian-Turonian boundary event in the Outer Carpathian basins; a new record from the Skole Nappe, Poland. Palaeogeogr, Palaeoclimatol, Palaeoecol, 2007, 256(1): 21‒46
[54] 杨宗玉, 罗平, 刘波, 等. 塔里木盆地阿克苏地区下寒武统玉尔吐斯组两套黑色岩系的差异及成因. 岩石学报, 2017, 33(6): 1893‒1918
[55] Zhou X Q, Chen D Z, Qing H R, et al. Submarine silica-rich hydrothermal activity during the earliest Cambrian in the Tarim Basin, Northwest China. Inter-national Geology Review, 2014, 56(15): 1906‒1918
[56] Casciotti K L. Nitrogen and oxygen isotopic studies of the marine nitrogen cycle. Annual Review of Marine Science, 2016, 8(1): 379‒407
[57] Stueken E E, Kipp M A, Koehler M C, et al. The evolution of Earth’s biogeochemical nitrogen cycle. Earth Sci Rev, 2016, 160: 220‒239
[58] Casciotti K L. Inverse kinetic isotope fractionation during bacterial nitrite oxidation. Geochim Cosmo-chim Acta, 2009, 73(7): 2061‒2076
[59] Casciotti K L, Sigman D M, Ward B B. Linking Di-versity and stable isotope fractionation in Ammonia-Oxidizing Bacteria. Geomicrobiol J, 2003, 20(4): 335‒353
[60] Tesdal J E, Galbraith E D, Kienast M. Nitrogen iso-topes in bulk marine sediment: linking seafloor ob-servations with subseafloor records. Biogeosciences, 2013, 10(1): 101‒118
[61] Shen B, Ma H, Ye H, et al. Hydrothermal origin of syndepositional chert bands and nodules in the Me-soproterozoic Wumishan Formation: implications for the evolution of Mesoproterozoic cratonic basin, Nor-th China. Precambrian Res, 2018, 310: 213‒228
[62] Shen B, Lee C T A, Xiao S H. Germanium/silica ratios in diagenetic chert nodules from the Ediacaran Doushantuo Formation, South China. Chem Geol, 2011, 280(3/4): 323‒335
[63] Lugolobi F, Kurtz A C, Derry L A. Germanium-silicon fractionation in a tropical, granitic weathering en-vironment. Geochim Cosmochim Acta, 2010, 74(4): 1294‒1308
[64] Bernstein L R. Germanium geochemistry and minera-logy. Geochim Cosmochim Acta, 1985, 49(11): 2409‒ 2422
[65] Tréguer P, Nelson D M, Aleido J V B, et al. The silica balance in the world ocean: a reestimate. Science, 1995, 268: 375‒379
[66] Kurtz A C, Derry L A, Chadwick O A. Germanium-silicon fractionation in the weathering environment. Geochim Cosmochim Acta, 2002, 66(9): 1525‒1537
[67] Froelich P N, Mortlock R A, Shemesh A. Inorganic germanium and silica in the Indian Ocean: biological fractionation during (Ge/Si)OPAL formation. Glob Bio-geochem Cycles, 1989, 3(1): 79‒88
[68] Froelich P N, Hambrick G A, Andreae M O, et al. The geochemistry of inorganic germanium in natural-waters. Journal of Geophysical Research-Oceans, 1985, 90(C1): 1133‒1141
[69] Mortlock R A, Frohlich P N. Continental weathering of germanium: Ge/Si in the global river discharge. Geochim Cosmochim Acta, 1987, 51(8): 2075‒2082
[70] Mortlock R A, Froelich P N, Feely R A, et al. Silica and germanium in Pacific Ocean hydrothermal vents and plumes. Earth Planet Sci Lett, 1993, 119(3): 365‒378
[71] Falkowski P G, Katz M E, Knoll A H, et al. The evo-lution of modern eukaryotic phytoplankton. Science, 2004, 305: 354‒360
[72] Yin Z, Zhu M, Davidson E H, et al. Sponge grade body fossil with cellular resolution dating 60 Myr before the Cambrian. Proc Natl Acad Sci USA, 2015, 112(12): E1453‒E1460
[73] Racki G, Cordey F. Radiolarian palaeoecology and radiolarites: is the present the key to the past?. Earth Sci Rev, 2000, 52: 83‒120
Paleoenvironment Interpretation of Early Cambrian Yurtus Formation, Tarim Basin, and Its Mechanism for Organic Carbon Accumulation
Abstract This study scrutinizes the petrological and geochemical signatures by systematically sampling three sections of Yurtus Formation, which deposited during the early Cambrian in the western margin of Tarim Basin. The redox conditions together with the intensity of primary productivity during Yurtus Formation deposition are reconstructed, which provide theoretical basis for the distribution of source rocks and evaluation of reservoir potentials. The extremely high Ba content (>1000 μg/g) and appearance of barite in the lower part of Yurtus Formation implies high primary productivity, which explains the substantive organic matter in the surface ocean and is also consistent with the abundant phytoplankton fossil record and high TOC content. The large positive excursion of δ15N (>8‰) in the lower parts of Yurtus Formation probably is resulted from denitrification or annamox, both of which occur only when O2 is depleted. It may indicate that organic matter transporting from the surface ocean to deeper ocean could consume dissolved oxygen by the process of degradation, which would drive the condition of deeper ocean more reduced. Meanwhile, low Ge/Si values of cherts in the lower part of Yurtus Formation indicate normal seawater origin of Si input. Oversaturation state of silica promotes the organic matter preservation due to relatively fast cementation.
Key words Yurtus Formation; Ge/Si; Ba content; nitrogen isotope; primary productivity
doi: 10.13209/j.0479-8023.2020.045
国家科技重大专项(2016ZX05007-003)、中国石油天然气股份有限公司重大专项(2019B-0605)和国家自然科学基金(41672334, 41402025)资助
收稿日期: 2019‒07‒16;
修回日期: 2020‒04‒04