表1 研究区样地特征
Table 1 Plot information
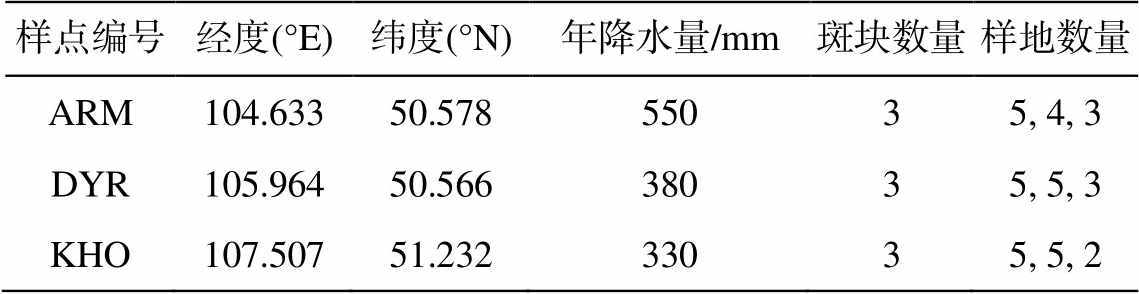
样点编号经度(°E)纬度(°N)年降水量/mm斑块数量样地数量 ARM104.63350.57855035, 4, 3 DYR105.96450.56638035, 5, 3 KHO107.50751.23233035, 5, 2
摘要 为了研究木质部细胞、树木个体和森林群落 3 个尺度之间的关联, 在西伯利亚南部以西伯利亚落叶松(Larix sibirica)和欧洲赤松(Pinus sylvestris)为主的 3 个采样点 37 个样地, 测量 725 根树芯的树木年轮宽度, 采用系统随机的方法选择其中 195 个树芯进行管胞大小的测量和计算。结果表明, 尽管局地环境和树种组成有所不同,但在树木个体和森林群落两个水平上,管胞大小与树木径向生长的年际变化显著相关。较小的平均管胞尺寸指示更低的年际生长量和更高的年际生长波动。平均管胞大小对半干旱区针叶林生境湿度和森林生长适应性具有指示作用, 揭示树木通过调节管胞的大小在生长适应与生长安全性二者间的权衡机制。
关键词 森林草原交错带; 生长波动; 管胞; 气候因子; 适应性
森林生态系统以不同的形式响应气候变化, 其中森林区边缘的半干旱区森林尤为敏感[1]。西伯利亚南部的森林–草原交错带地处北方针叶林的南缘, 森林对气候变化的响应复杂[2]。在全球变暖导致的气候干旱化背景下, 准确地预测森林–草原交错带的未来适应能力至关重要[3–4]。为了实现这一目标, 研究不同生命组建水平(细胞、树木个体和森林群落)的生长关系具有重要意义。
水分亏缺是威胁半干旱区森林生长和生存的主要因子之一。严重的干旱甚至导致区域性的森林死亡[5]。在个体水平上, 作为一个重要的生态指标, 反映树木生长情况的树木年轮宽度常用于重建气候和评估气候变化的影响[6]。在细胞水平上, 木质部及其负责水分运输的特性可能影响树木对水分亏缺的适应性。Poorter 等[7]的研究表明, 木质部导管的性状与树木生长密切相关。作为水分运输通道, 木质部管胞细胞的大小可作为衡量树木相对适应水分亏缺的指标。然而, 由于树木个体之间的相互作用, 仍然不清楚这种适应性是否可以在森林群落水平上应用。
作为生态系统的研究热点, 植物功能属性的重要性日益增加, Sterck 等[8]和 Russo 等[9]研究管胞属性及其与气候的关系, 其中管胞细胞大小(或直径)是常见和关键的属性之一[10]。Zabuga 等[11]的研究表明, 俄罗斯西伯利亚后贝加尔地区欧洲赤松(Pinus sylvestris)木质部管胞的直径主要由环境温度决定, 而每年管胞的数量与年平均温度等指标显著相关。灌溉实验结果进一步表明, 欧洲赤松在没有灌溉的对照组, 管胞明显增大; 然而, 在同一实验中, 短柔毛栎(Quercus pubescens)在干旱条件下形成较小的导管[12]。在澳大利亚, 桉树的导管随干旱程度增加而变细[13]。这些研究表明, 在干旱胁迫条件下, 针叶树倾向于发育更大的管胞细胞, 而一些阔叶树种倾向于形成更小的导管。目前仍不清楚上述特征在其他树种和森林群落中是否存在。
基于上述研究背景, 本文对后贝加尔地区森林–草原交错带的西伯利亚落叶松(Larix siberica)和欧洲赤松进行研究。我们假设木质部管胞大小可以指示这两种森林类型在树木个体和森林群落水平上对水分亏缺的响应。
尽管灌溉实验可以显示树木对人为添水的反应, 但无法揭示长期干旱胁迫的影响。因此, 本文在受长期且严重干旱胁迫的西伯利亚南部半干旱区森林–草原交错带进行实地调查, 分析管胞大小与树木个体和森林水平的年轮生长变化的关系。与通过测量管腔和细胞壁厚度来关注树木个体对气候的生理适应的经典植物解剖学研究[14–15]不同, 本文选择管胞大小作为指标, 通过系统随机抽样的方法, 估计森林群落水平的管胞大小与水分亏缺的关系[16–18]。森林衰退常常伴随径向增长的减少[19], 在针叶林中, 死树的树木年轮宽度比活树具有较大的年际变化[20], 这种变异可以有效指示森林抗旱能力[21]。因此, 本文采用树木年轮宽度的年际变化作为树木和森林适应能力的指示指标。
本文研究区位于俄罗斯境内后贝加尔地区的西伯利亚泰加林南缘, 地形复杂, 海拔在 500~2400 m之间。这一地区属于典型大陆性气候, 温差大, 1 月平均气温为–29.5℃, 7 月平均气温为 19℃; 年平均降水量为 330~550mm (表 1)。研究区森林生长季为5—9 月, 主要植被类型为不连续的明亮针叶林和半干旱草原。
本研究沿干旱梯度选择 3 个采样点: Armark(ARM, 50.578°N, 104.633°E)、Dyrestui (DYR, 50.566°N, 105.964°E)和 Khooshooh-Uzurh (KHO, 51.232°N, 107.507°E)。采用 Hill 模型对采样点的湿度条件评估[22]表明, ARM 在 3 个采样点中最为湿润, 位于森林–草原交错带上部的连续森林附近, 是西伯利亚落叶松森林带的边缘。KHO 具有典型的森林草原特征, 森林斑块仅生长在阴坡, 主要由西伯利亚落叶松与欧洲赤松组成, 阳坡为草原。DYR 最为干旱, 位于森林边缘, 主要树种为欧洲赤松(图 1)。在每个采样点取 3 个大小不同的森林斑块, 按照坡位高低和斑块大小, 在每个斑块选取 3~5 个样地, 每个样地大小为 10m×20m (表 1)。2012 年测量 37 个样地中每棵树的树高和胸径(DBH), 使用测树仪(DQY-1, 哈尔滨光学仪器厂, 中国)测量树木冠层高度。在每个样地中测量至少 5 棵树的树高, 取平均值作为样地平均树高。对每个样地内直径大于 5cm 的全部树木, 沿东南、西北两个方向用生长锥钻取树芯。
表1 研究区样地特征
Table 1 Plot information

样点编号经度(°E)纬度(°N)年降水量/mm斑块数量样地数量 ARM104.63350.57855035, 4, 3 DYR105.96450.56638035, 5, 3 KHO107.50751.23233035, 5, 2
首先, 将钻取的树芯用吸管封装并编号, 用乳胶粘贴至特别准备的枕木上。将树芯样品风干后, 用400, 600 和 1200 目砂纸依次打磨剖光, 用丝绸再次打磨并清理碎屑。人工交叉定年后, 用 TSAPwin系统测量树芯的树轮宽度值以及相关信息[23], 使用Program Cofecha (XP2007)软件对测得的轮宽数据进行准确性检验。
采用软件 Program ARSTAN_41[24]对 439 棵树的 776 根树芯的轮宽数据进行预处理, 并完成各样地年表制作。由于存在幼树效应(树木幼年期生长率较高), 因此采取直线或负指数曲线法去除生长趋势及其他林分动态导致的低频波动信息, 获取树轮宽度的高频波动信息[25], 得出每个样地的树轮宽度标准化年表(以 1 为中心波动的标准化数据, 高值代表该年生长旺盛, 树轮较宽; 低值代表生长受限, 树轮较窄)。表 2 列出每个样地的树芯数、树的年龄范围和年表平均灵敏度(MS)。年表准确性及代表性通过 EPS(expressed population signal)表征。每个样地的 EPS 值均大于 0.87, 可以认为是树木生态学研究中能普遍接受的水平[26]。
在经典的木材解剖学研究中, 显微切片是量化树木解剖学特征的常用方法[18]。在制作显微切片之前, 需要进行一系列准备工作, 如样品预处理和微切片[14,17]。数字化后的解剖图像处理也会影响数据质量[18]。由于经典方法需要大量样本的长时间序列数据, 昂贵且耗时, 因此本文采用一种估算管胞尺寸的简化方法。预实验结果表明, 两种实验方法在管胞尺寸的测定结果方面没有显著差异。
由于管胞尺寸测量精度较高, 在样品测量前使用 1600 目砂纸进一步打磨。为了降低误差, 提高管胞尺寸数据的可靠性, 选择具有足够数量样本的时期(1985—2011 年)进行所有奇数年份的管胞尺寸测量。每个样地随机取 5 根树芯, 用显微镜(Leica DM 5000B)测量管胞尺寸。在所研究的 14 年内, 每根树芯每年随机选取 3 个标准窗口(200 μm×200 μm), 计算每个窗口中具有完整形状管胞的数量(图 2(c))。同时, 对窗口左边缘和上边缘的部分细胞计数, 右边缘与下边缘的部分细胞不计数。基于此原则测量管胞数量, 用窗口面积与管胞细胞的比值来估计管胞尺寸。计算 3 个选定窗口的平均值, 用以减少误差(图 2)。在充分考虑并减小实验误差和人为误差等操作基础上, 完成对 725 个已测树木中 195 个系统随机样本的木质部管胞尺寸的测量, 在重复取样求均值减小误差后, 共获得 2730 个可靠实验数据。
表2 样地年表信息
Table 2 Dendrochronological features for each plot

样地树芯数量最大/平均树龄平均敏感度(MS)子样本信号强度(EPS) ARML125102/31.60.4380.921 ARML228125/28.30.4370.970 ARML314112/64 0.5000.972 ARML411106/89.30.4480.912 ARML5793/71.30.4170.928 ARMM129104/56.70.5130.965 ARMM21769/53.80.5020.975 ARMM33292/58.30.4870.943 ARMM43469/53.00.4570.980 ARMS13243/26.20.6050.986 ARMS228114/47.20.5020.957 ARMS34163/34.20.5750.985 DYRL1775/65.10.3680.901 DYRL233139/81.40.4380.987 DYRL315145/98.50.4260.946 DYRL434139/82.20.3930.986 DYRL5991/77.90.3290.963 DYRM11071/63.20.4300.959 DYRM22174/65.30.4610.983 DYRM32676/56.90.4240.990 DYRM43194/57.30.4650.993 DYRM51864/51.70.4040.980 DYRS116142/70.10.4640.947 DYRS218167/94.40.4560.954 DYRS32272/56.40.3920.979 KHOL114154/86.90.4520.872 KHOL226126/93.90.5170.971 KHOL317128/76.20.4610.949 KHOL415113/45.20.3870.936 KHOL515113/84.50.4970.972 KHOM115169/47.80.5310.976 KHOM225180/69.40.5730.967 KHOM32471/51.30.6090.985 KHOM43670/51.40.5950.962 KHOM53671/57.30.6160.990 KHOS11267/40.30.6270.963 KHOS21660/35.30.5060.970
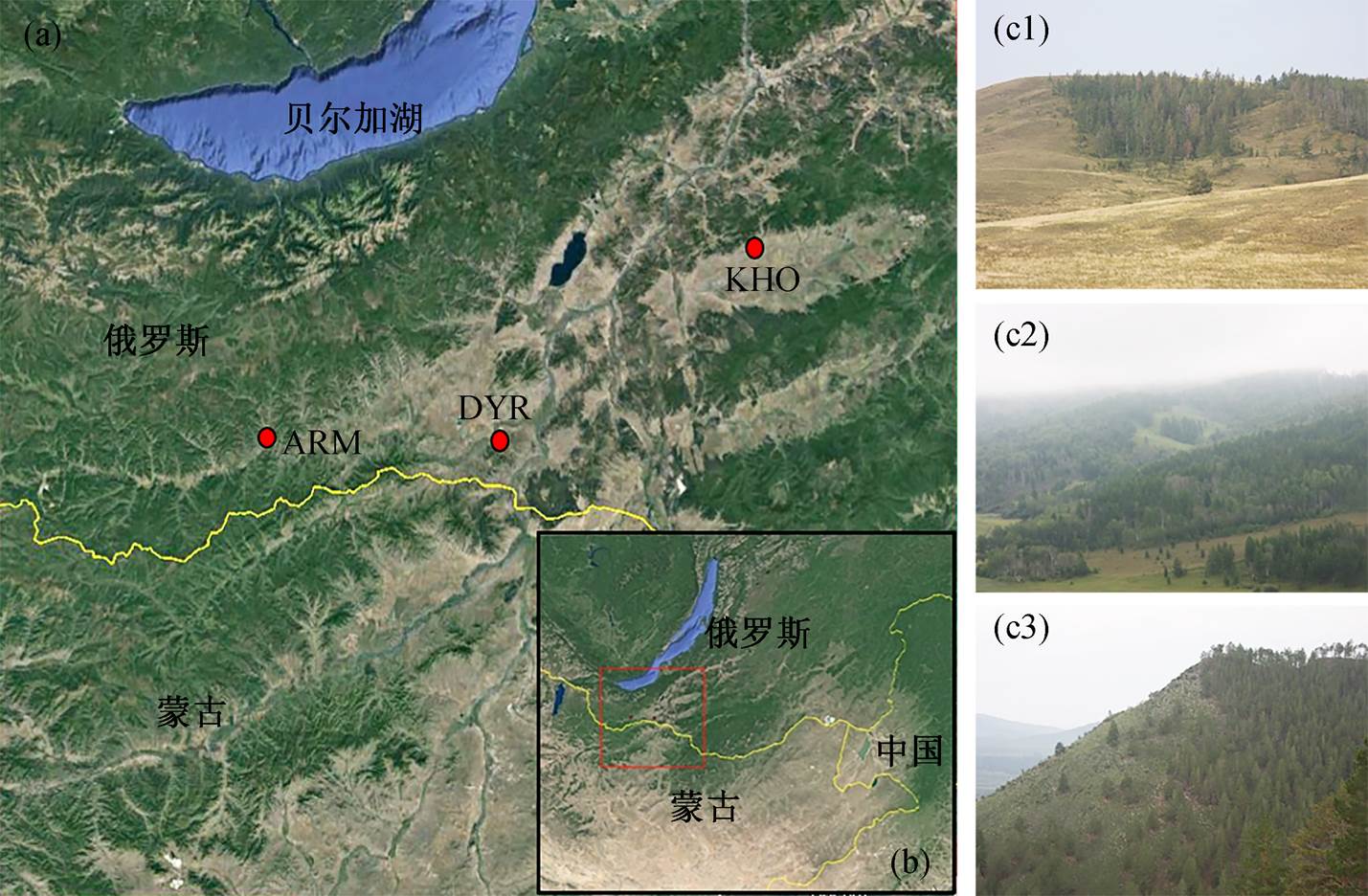
(a)为采样点(红色点); (b)为研究区域(红色矩形)在东亚的地理位置(图片来自谷歌地球, 拍摄于 2017 年 4 月 12 日); (c1)~(c3)为研究区森林景观(2013年拍摄)
图1 研究区与采样点分布
Fig. 1 Study area and location of the sampling sites

(a)径向生长测量, (b)管胞测量, (c)随机窗口管胞测量(200μm×200μm); 根据本文设定的计数规则, 用红色圆圈标记的细胞被计数, 窗口中的单元格数为 39
图2 树轮宽度测量、管胞测量实验视野及窗口
Fig. 2 Views of radial growth measurement, tracheid cell measurement in a unit year, and tracheid cell mea-surement in a random window
在天然水分梯度下, 定性地分析每个样地中树木径向生长与对应的管胞尺寸之间的关系。使用软件 SPSS 15.0版(SPSS, Inc., Chicago IL, 美国), 将树木径向生长量与管胞尺寸做线性拟合。R2 指代由管胞大小预测径向生长量的解释率大小, p 值用来确定线性关系是否显著(显著性水平=0.05)。
进一步地, 从树木个体水平与群落水平上来分析数据。首先在个体水平上, 将已测细胞大小的对应树木轮宽从全部轮宽数据中提取出来, 对每棵树对应年间(1985—2011 奇数年)的树轮宽度求变异系数(CV), 将其作为轮宽波动强弱(即树木生长调节潜力)的表征。将树轮宽度变异系数按照大小排列, 选择变异系数值前 15%和后 15%分别代表树木径向增长中的高波动强度与低波动强度树木样本。同时, 分别计算高、低波动强度样本的平均管胞大小, 进一步分析树木个体水平上的径向生长变化强弱与管胞大小的关系。
在群落水平上, 将各样地树轮标准年表作为该样地群落生长调节能力的代表, 分别计算各样地年表的变异系数并排序。对每个样地随机抽取的 5 棵树的管胞大小求均值, 作为该群落在研究时段内木质部管胞大小的代表, 对比年表波动最高(n=5)与最低样地(n=5)管胞大小的差异。
对个体与群落水平分别进行独立的配对 t 检验, 以便评估不同管胞尺寸与其生长波动的关系。
树木年轮宽度指数(RWI)的变化趋势在 3 个采样点基本上一致, 但年际变化和五年尺度变化的趋势有所不同(图 3)。RWI 的变异系数反映的年际生长波动在相对湿润的样点更小(ARM: 0.38, DYR: 0.35), 在最干燥的样点 KHO 最大(0.58)。在森林类型尺度上, 混交林(KHO)的 CV 值远高于其他两个纯林(ARM 和DYR)。
研究结果显示, 全部样地管胞细胞的多年平均尺寸为 1644.2mm2 (ARM 为 1968.3mm2, DYR 为1295.8mm2, KHO为1668.5mm2)。每个样地平均管胞尺寸的频率分布显示拖尾现象, 缺少较小管胞(<1000mm2)的分布(图 4)。在不同样点的森林斑块水平上, 管胞大小与冠层高度之间的相关性不显著(p>0.1, 图 5)。
在树木个体和森林群落水平上, 管胞大小与轮宽的年际变化(CV)具有显著的相关性。具有较小管胞的树木具有较大的生长年际波动。在 1985—2011 年期间, 树木个体中生长年际波动大的树木, 其管胞尺寸小于生长波动小的树木(图 6)。t 检验结果表明, 在具有高年际生长 CV 值的树中, 管胞显著较小(p<0.01, t=2.16, df=13)。
在群落水平上, 具有较小平均管胞尺寸的森林也在标准年表中显示更大的年际变化。在对应的年份, 生长波动剧烈群落的平均管胞尺寸小于生长相对稳定的群落(图 7)。t 检验结果同样表明, 具有高年际生长 CV 值的森林群落, 其管胞大小显著小于具有低年际生长 CV 值的森林群落(p<0.01, t=2.16, df=13)。不同森林群落之间稳定性的差异大于树木个体之间稳定性的差异。
本文研究结果表明, 在半干旱森林中, 无论在森林群落水平还是树木个体水平上, 具有较大年际变化的森林均呈现木质部管胞平均尺寸较小的特征, 与立地条件及树种无关。森林草原过渡带的森林群落树木密度较低, 受林分密度和环境资源限制的种内和种间竞争也主要体现在水分竞争方面[22]。在个体水平上, 拥有更小输水细胞的树木可能指示更不规则的生长和对气候更加敏感的特征, 意味着具有更高的死亡可能性[19–21]。作为针叶树木质部的主要组成部分, 管胞大小不仅是树木调节径向生长多少的一种方式[27], 也影响树木径向生长的稳定性, 从而影响树木水分运输功能的稳定性, 并进一步影响对气候变化的抵御。特别是对于半干旱森林群落, 管胞大小传达出森林是否适应干旱的信息。对区域环境变化具有强烈适应性的森林群落能在生长的年际变化上保持更好的稳定性, 不会随环境波动发生剧烈变化。在本文研究区, 平均管胞尺寸较小的森林, 生长波动性更大, 因此更容易受到水分亏缺的影响。
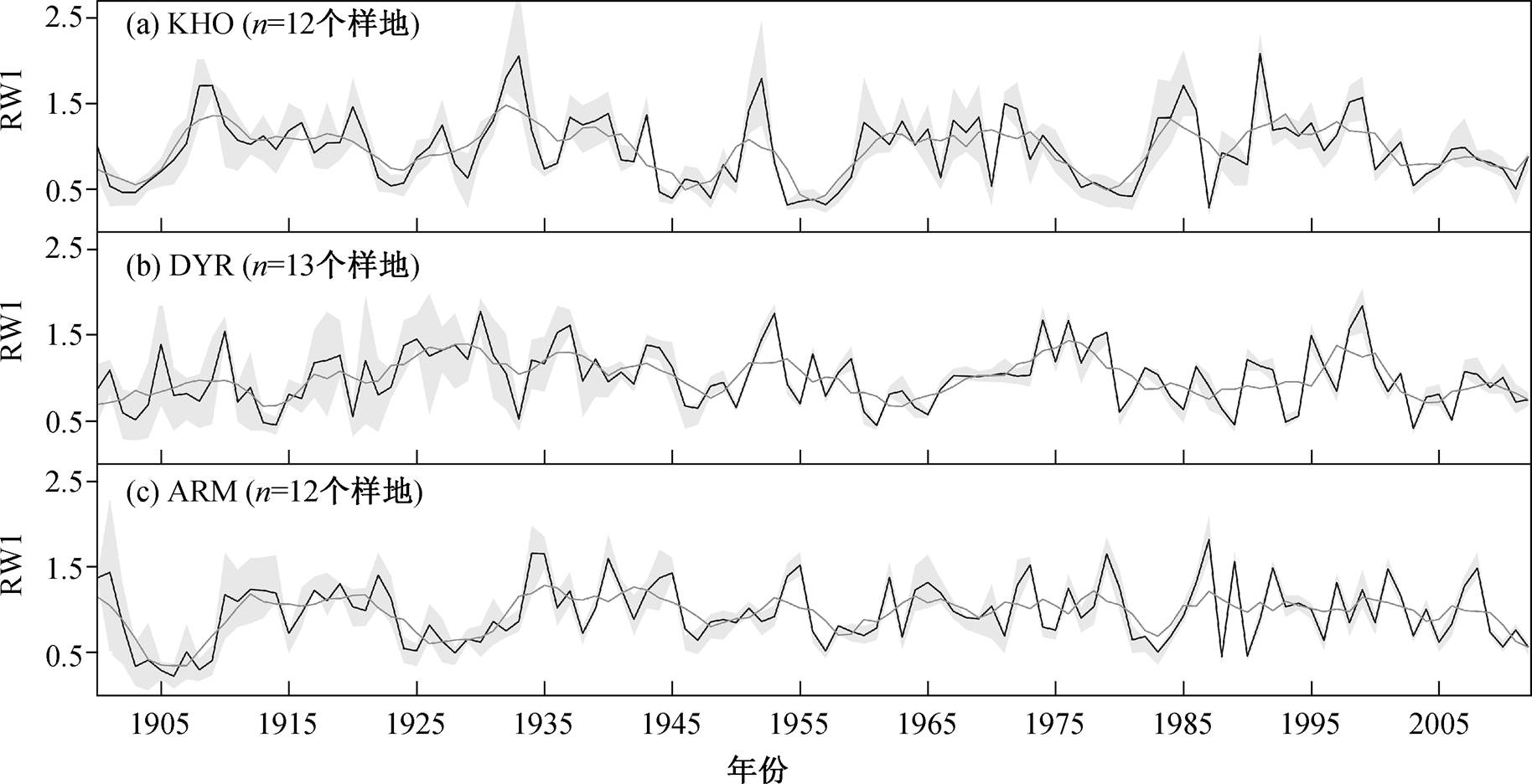
黑色实线表示年RWI平均值, 灰色实线表示以5年为单位的滑动平均值, 阴影区域表示样地年轮指数的内四分位数
图3 1900—2012年年轮宽度指数RWI的年轮标准年表
Fig. 3 Tree-ring standard chronologies of ring-width index (RWI) in 1900–2012
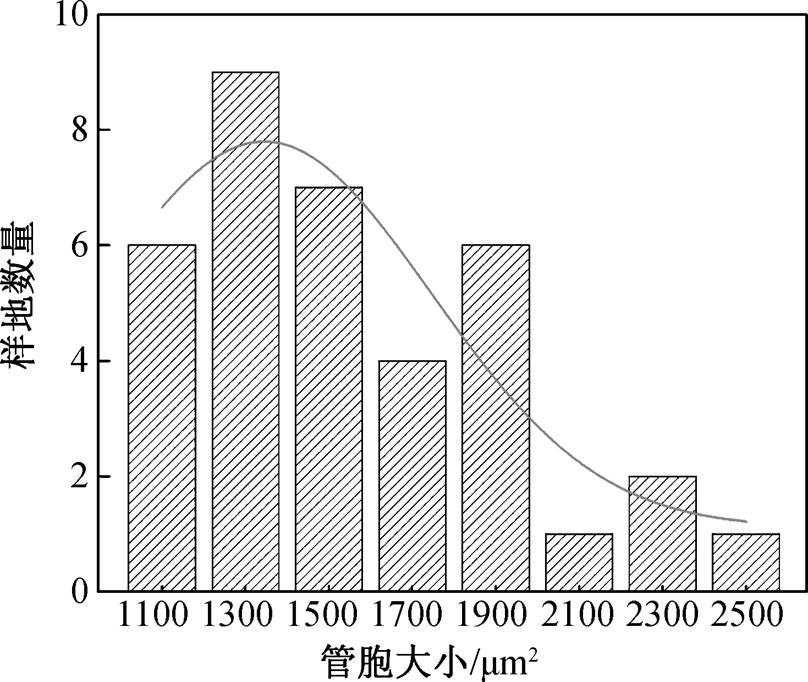
图4 管胞大小分布
Fig. 4 Frequency-distribution histogram of tracheid size
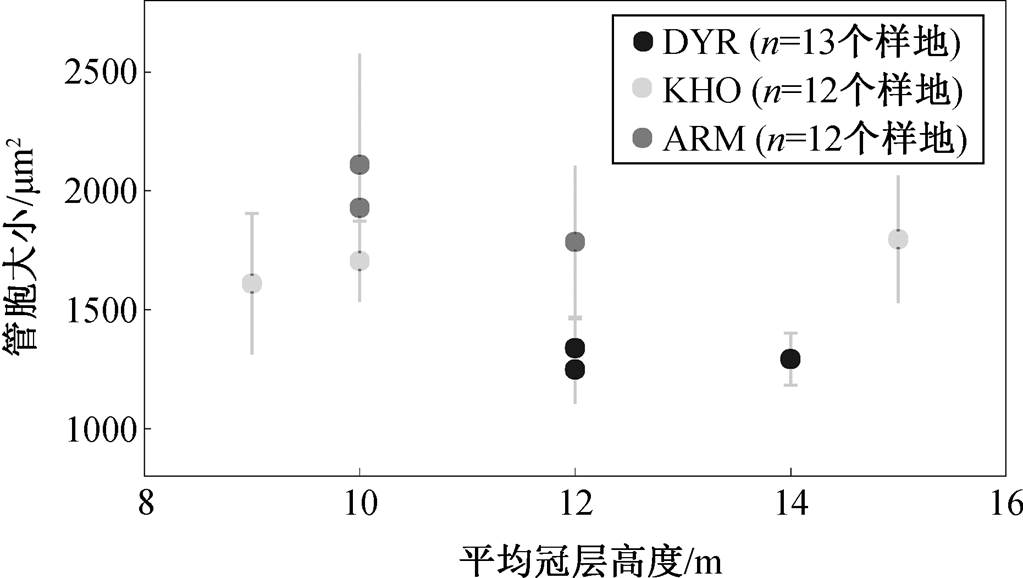
图5 管胞大小与冠层高度关系
Fig. 5 Relationships between tracheid size and average height of tree canopy in ARM, DYR, KHO sites
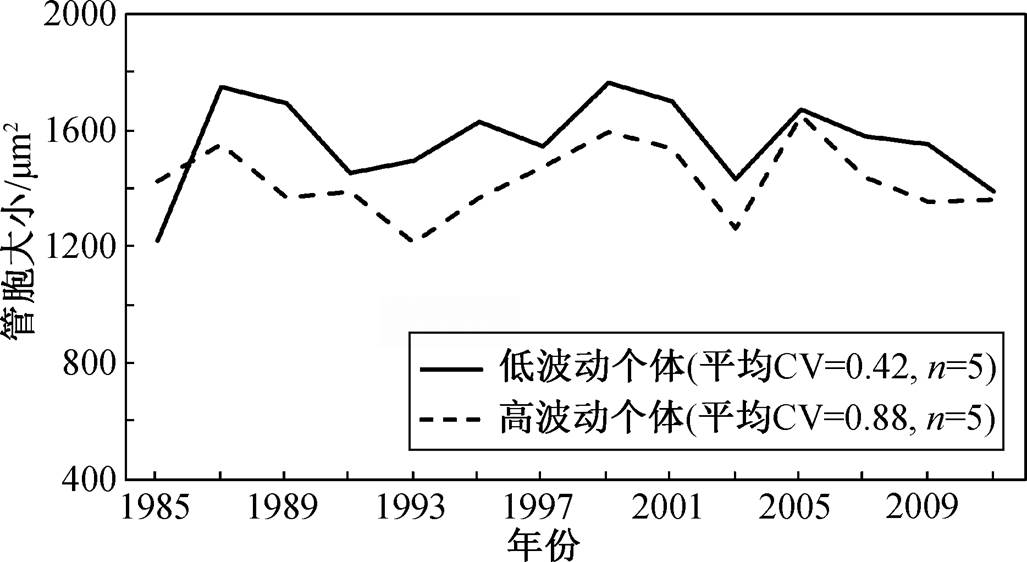
图6 管胞大小与个体生长变化的关系
Fig. 6 Relationship between the tracheid size and the growth variation at the individual level
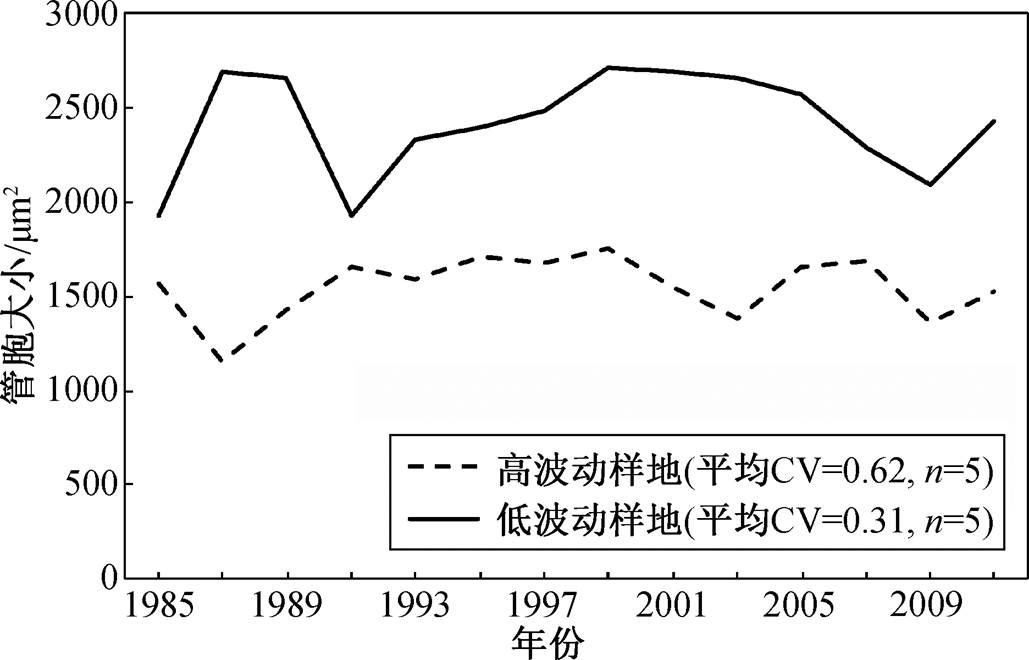
图7 管胞大小与群落生长变化的关系
Fig. 7 Relationship between the tracheid size and the growth variation at the forest community level
本文研究结果表明, 管胞大小可能是针叶树对生长适应与生长安全性之间的一种权衡。在持续干旱条件下, 更大的管胞指示更稳定的生长, 应对干旱的生长适应性更强, 但同时在极端气候条件下也存在更高的空穴以及栓塞风险[10,28]。空穴和栓塞一旦形成, 会显著地降低木质部输水细胞的水力特性[29], 甚至导致水分运输功能的丧失[30–31], 最终导致树木死亡。因此, 树木需要权衡更加稳定的生长与更加安全的极端气候应对能力, 小管胞能更安全地度过极端气候, 而大管胞有更高且更稳定的径向生长能力。
有研究表明, 在较干旱的地区, 针叶树往往形成更大的管胞[32]。同时, 具有较小管胞的树木更容易死于持续干旱。因此, 从结果上看, 小管胞树木被持续干旱气候筛选的结果是管胞大小的频率分布直方图在低值范围内的缺失(图 4)。一旦该地区的降水条件得到改善, 持续干旱气候的影响被减轻时—— 类比于 Eilmann 等[12]实验中进行的灌溉, 森林群落中由于反复和持续干旱而死亡的具有小管胞的树木个体将得到补充。
本文将观察视窗的面积(200μm×200μm)除以其内的管胞数量来估计管胞大小, 给出每个管胞的平均面积的估计。研究结果的不确定性来自本文没有提供平均管腔面积和细胞壁厚度及其与管腔直径的比值等信息。然而, 对管胞平均面积的估计确实反映它对树木径向生长的影响。同时, 本文关注的重点不在植物生理水平, 而在树木个体和群落生长水平。因此, 本文的研究方法基本上能够满足讨论树木个体和森林群落水平的木质部管胞大小与径向生长关系的需要。
根据本文结果, 木质部管胞大小是一种重要的生长属性, 指示半干旱区针叶树的生长适应性。但是, 本研究目前仅涉及两个物种: 欧洲赤松和西伯利亚落叶松, 需要研究更多的物种来确认不同树种之间生长适应性的差异程度。被子植物导管的直径远大于管胞, 导管输水效率也明显高于管胞, 因此可能影响其干旱条件下的生长适应规律[33]。同时, 未来还应调查更广泛地理区域的更多野外场地, 验证不同干旱区以及不同干旱强度下管胞尺寸的指示能力。
本文结合轮宽测量和管胞测量方法, 通过对各样地轮宽年表和细胞大小进行对比分析, 发现对于受持续干旱威胁的半干旱区的森林–草原生态交错带, 具有小管胞的树木在树木个体和森林群落水平上均呈现树木生长的不稳定变化, 使其处于不利的生存地位, 较小的平均管胞尺寸指示更少的径向生长和更大的年际生长变化, 体现出树木和森林在生长适应与生长安全之间的权衡。
参考文献
[1] Walther G R, Post E, Convey P, et al. Ecological responses to recent climate change. Nature, 2002, 416: 389–395
[2] Chapin III F S, Callaghan T V, Bergeron Y, et al. Global change and the boreal forest: thresholds, shifting states or gradual change?. AMBIO: A Journal of the Human Environment, 2004, 33(6): 361–365
[3] IPCC. Mitigation of climate change: contribution of working group III to the fifth assessment report of the intergovernmental panel on climate change. Cambri-dge: Cambridge University Press, 2014
[4] Sherwood S, Fu Q. A drier future?. Science, 2014, 343: 737–739
[5] Breshears D D, Cobb N S, Rich P M, et al. Regional vegetation die-off in response to global-change-type drought. Proceedings of the National Academy of Sciences, 2005, 102(42): 15144–15148
[6] Zhang Z. Tree-rings, a key ecological indicator of environment and climate change. Ecological indica-tors, 2015, 51: 107–116
[7] Poorter L, McDonald I, Alarcón A, et al. The im-portance of wood traits and hydraulic conductance for the performance and life history strategies of 42 rainforest tree species. New phytologist, 2010, 185 (2): 481–492
[8] Sterck F J, Martínez-Vilalta J, Mencuccini M, et al. Understanding trait interactions and their impacts on growth in Scots pine branches across Europe. Func-tional Ecology, 2012, 26(2): 541–549
[9] Russo S E, Jenkins K L, Wiser S K, et al. Interspeci-fic relationships among growth, mortality and xylem traits of woody species from New Zealand. Functional Ecology, 2010, 24(2): 253–262
[10] Pittermann J, Sperry J. Tracheid diameter is the key trait determining the extent of freezing-induced em-bolism in conifers. Tree Physiology, 2003, 23(13): 907–914
[11] Zabuga V F, Zabuga G A. Dependence of the annual-ring structure in the stem and structural roots of Scots pine (Pinus sylvestris L.) on environmental factors in the forest-steppe zone of Prebaikalia. Contemporary Problems of Ecology, 2010, 3(2): 245–251
[12] Eilmann B, Zweifel R, Buchmann N, et al. Drought-induced adaptation of the xylem in Scots pine and pubescent oak. Tree physiology, 2009, 29(8): 1011–1020
[13] Pfautsch S, Harbusch M, Wesolowski A, et al. Cli-mate determines vascular traits in the ecologically diverse genus Eucalyptus. Ecology Letters, 2016, 19(3): 240–248
[14] Bryukhanova M, Fonti P. Xylem plasticity allows rapid hydraulic adjustment to annual climatic varia-bility. Trees, 2013, 27(3): 485–496
[15] Fonti P, von Arx G, García-González I, et al. Studying global change through investigation of the plastic re-sponses of xylem anatomy in tree rings. New Phyto-logist, 2010, 185(1): 42–53
[16] Battipaglia G, Campelo F, Vieira J, et al. Structure and function of intra–annual density fluctuations: mind the gaps. Frontiers in Plant Science, 2016, 7: 00595
[17] Gärtner H, Cherubini P, Fonti P, et al. A technical perspective in modern tree-ring research—how to overcome dendroecological and wood anatomical challenges. Journal of Visualized Experiments, 2015 (97): e52337
[18] Von Arx G, Crivellaro A, Prendin A L, et al. Quan-titative wood anatomy — practical guidelines. Fron-tiers in Plant Science, 2016, 7: 00781
[19] Suarez M L, Ghermandi L, Kitzberger T. Factors predisposing episodic drought-induced tree mortality in Nothofagus: site, climatic sensitivity and growth trends. Journal of Ecology, 2004, 92(6): 954–966
[20] Kane J M, Kolb T E. Short-and long-term growth characteristics associated with tree mortality in south-western mixed-conifer forests. Canadian Journal of Forest Research, 2014, 44(10): 1227–1235
[21] Ogle K, Whitham T G, Cobb N S. Tree-ring variation in pinyon predicts likelihood of death following severe drought. Ecology, 2000, 81(11): 3237–3243
[22] Xu C, Liu H, Anenkhonov O A, et al. Long-term forest resilience to climate change indicated by mor-tality, regeneration, and growth in semiarid southern Siberia. Global Change Biology, 2017, 23(6): 2370–2382
[23] Qi Z, Liu H, Wu X, et al. Climate-driven speedup of alpine treeline forest growth in the Tianshan Moun-tains, Northwestern China. Global Change Biology, 2015, 21(2): 816–826
[24] Cook E R. A time series analysis approach to tree ring standardization [D]. Tucson: University of Arizona, 1985
[25] Cook E R, Peters K. Calculating unbiased tree-ring indices for the study of climatic and environmental change. The Holocene, 1997, 7(3): 361–370
[26] Liu H, Park Williams A, Allen C D, et al. Rapid warming accelerates tree growth decline in semi-arid forests of Inner Asia. Global Change Biology, 2013, 19(8): 2500–2510
[27] Anderegg W R L, Klein T, Bartlett M, et al. Meta-analysis reveals that hydraulic traits explain cross-species patterns of drought-induced tree mortality across the globe. Proceedings of the National Aca-demy of Sciences, 2016, 113(18): 5024–5029
[28] Hargrave K R, Kolb K J, Ewers F W, et al. Conduit diameter and drought-induced embolism in Salvia mellifera Greene (Labiatae). New Phytologist, 1994, 126(4): 695–705
[29] Sperry J S, Sullivan J E M. Xylem embolism in response to freeze-thaw cycles and water stress in ring-porous, diffuse-porous, and conifer species. Plant Physiology, 1992, 100(2): 605–613
[30] Zwieniecki M A, Holbrook N M. Confronting Max-well’s demon: biophysics of xylem embolism repair. Trends in Plant Science, 2009, 14(10): 530–534
[31] Tyree M T, Sperry J S. Vulnerability of xylem to cavitation and embolism. Annual Review of Plant Biology, 1989, 40(1): 19–36
[32] Eilmann B, Zweifel R, Buchmann N, et al. Drought alters timing, quantity, and quality of wood formation in Scots pine. Journal of Experimental Botany, 2011, 62(8): 2763–2771
[33] Sperry J S, Hacke U G, Pittermann J. Size and function in conifer tracheids and angiosperm vessels. American Journal of Botany, 2006, 93(10): 1490–1500
Indicative Significance of Tree Tracheid Size on Forest Growth and Environmental Adaptability in the Forest-Grass Ecotone of Southern Siberia
Abstract In order to study the relationship of three growth features of cell, tree and forest that indicate adaptation of trees to water deficit, we measured the tree-ring widths of 725 tree-cores sampled from sites dominated by Larix sibirica and Pinus sylvestris and then 195 of them were randomly selected to measure the tracheid size. The results show that the tracheid size is significantly correlated to the radial growth and the inter-annual variation in ring width, at both levels of the tree individual and forest community, regardless of local environment and tree species. This result suggests that small mean tracheid cells indicate low growth rate and more growth variation. The study implies that the mean tracheid size could serve as a robust indicator of tree or forest adaptation to habitat humidity for conifers in the semi-arid region and reveals the trade-off between growth adaptation and growth safety of trees by regulating tracheid size. As an important xylem trait of conifer forests, the size of tracheid is valuable for the further physiological study of drought adaptation of trees in the semi-arid region.
Key words forest-steppe ecotone; growth variation; tracheid cell; habitat humidity; adaptation
doi: 10.13209/j.0479-8023.2020.027
国家自然科学基金(41325002, 41530747)资助
收稿日期: 2019–04–26;
修回日期: 2019–05–06