图1 采样站点分布
Fig. 1 Sampling sites
摘要 在滇池外海选取 8 个样点, 调查分析主要的环境因子和浮游植物群落的季节和年际变化, 并识别其相关关系。在滇池共检测出浮游植物 6 门 49 属 84 种, 其中绿藻门的种类数最多, 占 59.2%, 其次是蓝藻门, 占16.67%, 硅藻门占 5.95%; 全年蓝藻门占优势, 春季隐球藻(Aphanocapsasp.)占优势, 其他季节微囊藻(Microcystissp.)占绝对优势。研究结果表明: 1)藻密度和生物量的季节变化不一致, 与藻类组成的季节演替以及不同藻类的生物量大小存在较大差异有关; 2)Shannon-Wiener 物种多样性指数(H)较小, 季节变化不显著; 3)藻密度和生物量与 TP 正相关, 与 NO3−和 N:P 负相关; 而 H 与 TP 负相关, 与 NO3−和 N:P 正相关; 4)营养盐是影响浮游植物群落分布的关键因子, 滇池最重要的优势种微囊藻的密度和生物量与 pH、NH4+和 TP 浓度正相关, 与 NO3−、N:P、TN、DOC 和 TOC 的浓度负相关。推测除环境因子外, 绿藻、硅藻等优势度较小的藻类受其他生物因素的影响较大(如种间竞争和捕食等), 掩盖了环境因子对藻类的真实影响。
关键词 滇池; 浮游植物; 群落结构; 环境因子; 季节变化; 空间变化
浮游植物是水生生态系统最重要的初级生产者之一, 并通过“上行控制”影响更高营养级生物的食性、捕食关系和栖息生境等, 对食物网各个营养级的结构和变化产生重要的影响[1]。同时, 浮游植物种类和数量的变化与周围环境密切相关, 受到物理、化学、生物和气候等各种环境因子的影响, 呈现一定的时空变化规律。浮游植物群落结构特征在一定程度上也能够反映水生生态系统的健康状况, 可作为评价水生生态系统健康水平和判断污染压力的生态指示生物[2–5]。针对不同水生生态系统中的浮游植物群落结构变化, 学者们探索影响群落结构的主要环境因子[6], 或对生态系统的健康状况进行评价[7–8]。
滇池是中国重点治理的“三湖”之一, 在长期的富营养化过程中, 生态系统发生较显著的演变[9–11], 生物多样性下降[12]。虽然已有研究探索过滇池浮游植物群落结构的主要特征及影响因子[11,13–20], 但由于人类活动频繁, 由此产生的干扰使滇池的生境和生物群落受到很大的影响, 不断发生变化。因此, 在历史污染物的累积影响和当前治理措施的双重作用背景下, 研究滇池当前浮游植物群落结构的时空变化及与环境因子的关系十分有必要, 可以为深入分析滇池生态系统对外部环境压力的响应机理提供参考。
在滇池外海设置 8 个监测点位(图 1), 分别于2015 年 4 , 8, 12 月以及 2016 年 4 月进行 4 批次采样。分别采集表层(0.5m)和底层水(距离沉积物 0.5m)水样, 分析指标包括水温(T)、pH、溶解氧(DO)、氨氮(NH4+)、硝氮(NO3−)、总氮(TN)、总磷(TP)、磷酸盐(PO43−)、总有机碳(TOC)、溶解性有机碳(DOC)和氮磷比(N:P)等。其中水温(T)、pH 和溶解氧(DO)采用便携式水质传感器现场测定, 其余水质指标的采样和分析按照国家标准分析方法进行。浮游植物定性样品用 25 号浮游生物网在水面采集, 带回实验室进行活体观察。浮游植物定量样品的取样方法是, 分别取表层(0.5m)和底层(距离沉积物 0.5m)水样各 5L, 混合均匀, 取混合水样 1L, 加鲁哥试剂固定, 带回实验室浓缩、分析, 具体方法参照《淡水浮游生物研究方法》[21]和《中国淡水藻类》[22]。

图1 采样站点分布
Fig. 1 Sampling sites
1.2.1浮游植物群落结构指标
浮游植物群落指标采用 Shannon-Wiener 生物多样性指数(H)[23]和优势度指数(Y)[24]:
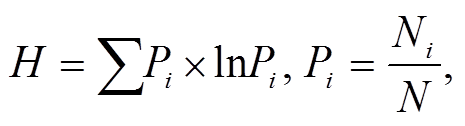 (1)
(1)Y=Pi·fi, (2)
其中, Ni 为第 i 种的个体数, N 为所有种类的总个体数, fi为第 i 种在各个站位中出现的频率。优势度指数 Y>0.02 的确定为优势种。
1.2.2统计分析
由于不确定样本数据的分布情况, 因此采用Kruskal-Walis 检验对不同季节的有关指标进行对比分析, 判断季节变化的显著性; 对浮游植物群落结构指标与环境因子之间进行 Pearson 相关性分析, 上述分析在 R3.4.3 (http://www.r-project.org/)中完成。
利用 CANOCO4.5 软件分析浮游植物、采样点与环境因子之间的关系。用于排序分析的物种需满足两个条件: 1)该物种在至少 1 个样点的相对丰度≥1%; 2)该物种在1个以上的采样点出现[25–26]。在排序分析前, 先根据物种数据进行去趋势分析(DCA), 根据梯度长度的大小选择排序类型。当梯度长度最大值>4 时, 选择单峰模型(CA 或 CCA); 当最大值<3 时, 选择线性模型(PCA 或 RDA); 当最大值介于 3~4 之间时, 可选择单峰模型或线性模型进行分析[27]。此外, 对环境因子进行 Monte Carlo显著性检验。
由于各环境因子的表、底层值差异不显著, 因此对其求均值。由于 PO43−在各个季节大部分采样点的浓度都低于检测线(0.01mg/L), 因此在各项分析中不采用这项指标。通过 KW 非参数检验得到, 滇池各个环境因子中, NH4+, NO3−, DOC, DO 和 T 的季节变化显著, 而 TN, TP, N:P, TOC 和 pH 等理化指标的季节差异不显著。另外, 各个理化指标在2015 年 4 月和 2016 年 4 月的测定值具有显著的差异, 因此滇池环境条件存在年际变化(见表1)。
本研究采集到的藻类样品分属于蓝藻门、绿藻门、硅藻门、裸藻门、甲藻门和隐藻门 6 个门 49属, 共 84 种。其中绿藻门的种类数最多, 有 50 种, 属于 25 个属, 占 59.2%; 其次是蓝藻门, 有 14 种, 属于 12 个属, 占 16.67%; 硅藻门有 10 种, 属于 5 个属, 占 5.95%; 剩余的有隐藻门 5 种, 裸藻门 3 种, 甲藻门 2 种。各个季节的优势种如表 2 所示, 蓝藻全年占绝对优势, 其中隐球藻(Aphanocapsa sp.)在春季占绝对优势, 其余季节微囊藻(Microcystis sp.) 占绝对优势, 绿藻在春季的优势度较高。李原等[14]、万能等[17]和代龚圆等[18]分别在 2001—2002 年和2008—2009 年对滇池进行调查, 得到蓝藻中的束丝藻(Aphnizomenon sp.)在初冬、春季的优势度较高, 其他季节是微囊藻占优势的结论。王华等[28]在2013 年对滇池的研究发现, 春季(3 月)绿藻中的栅藻(Scenedesmus sp.)为优势种, 其他季节均是微囊藻占优势。
表1 滇池各环境因子在不同季节的值
Table 1 Environment factors of different seasons in Lake Dianchi
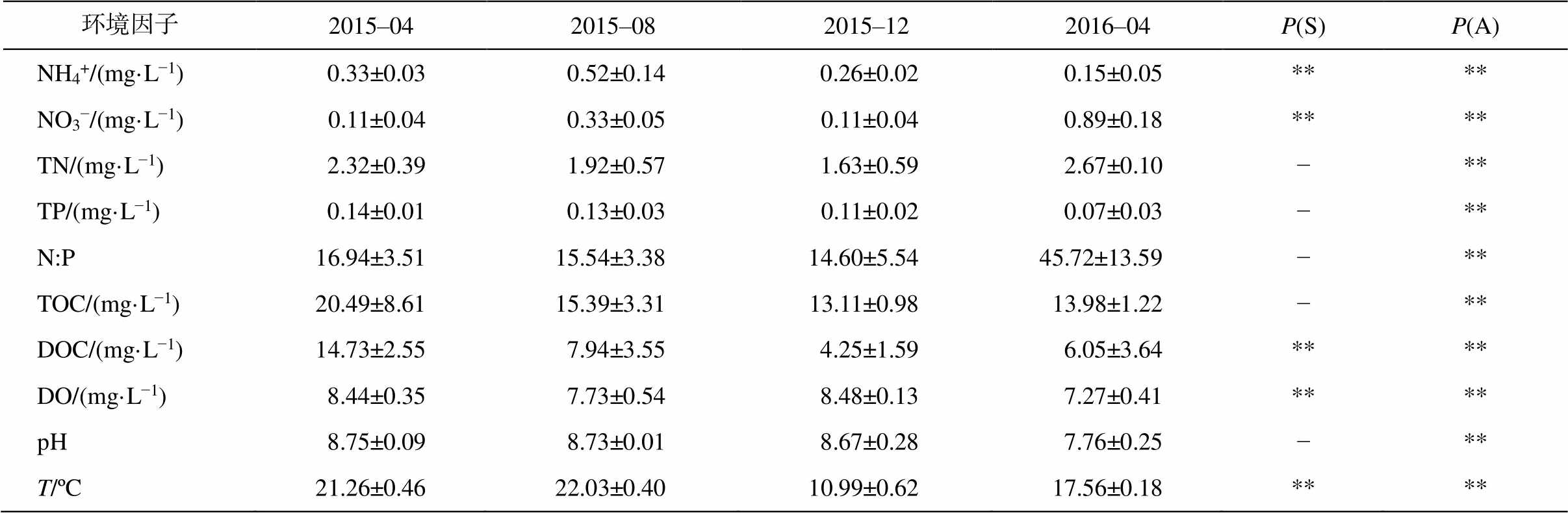
环境因子2015–042015–082015–122016–04P(S)P(A) NH4+/(mg·L−1)0.33±0.030.52±0.140.26±0.020.15±0.05**** NO3−/(mg·L−1)0.11±0.040.33±0.050.11±0.040.89±0.18**** TN/(mg·L−1)2.32±0.391.92±0.571.63±0.592.67±0.10−** TP/(mg·L−1)0.14±0.010.13±0.030.11±0.020.07±0.03−** N:P16.94±3.5115.54±3.3814.60±5.5445.72±13.59−** TOC/(mg·L−1)20.49±8.6115.39±3.3113.11±0.9813.98±1.22−** DOC/(mg·L−1)14.73±2.557.94±3.554.25±1.596.05±3.64**** DO/(mg·L−1)8.44±0.357.73±0.548.48±0.137.27±0.41**** pH8.75±0.098.73±0.018.67±0.287.76±0.25−** T/ºC21.26±0.4622.03±0.4010.99±0.6217.56±0.18****
注: **表示具有显著性差异, P<0.05; “−”表示无显著差异, P>0.05; P(S)为季节变化的显著性; P(A)为2015年4和2016年4月之间年际差异的显著性。
表2 滇池浮游植物优势种的季节变化
Table 2 Seasonal variation of dominant species of plankton community in Lake Dianchi

物种名称优势度(Y) 门种属2015–042015–082015–122016–04 蓝藻门微囊藻(Microcystis sp.)0.106*0.685*0.652*0.079* 隐球藻(Aphanocapsa sp.)0.751*0.073*0.249*0.622* 席藻(Phormidium sp.)0.01−0.013− 鱼腥藻(Anabaena sp.)−0.010−−− 伪鱼腥藻(Pseudoanabaena sp.)−0.014−0.032 束丝藻(Aphnizomenon sp.)−0.104−− 绿藻门栅藻(Scenedesmus sp.)0.027−0.0180.010 四尾栅藻(Scenedesmus quadricauda)0.0280.064−− 游丝藻(Planktonema sp.)−−−0.070 丝藻(Ulothrix sp.)0.011−0.109 空星藻(Coelastrumsp.)0.017−−−
注: “−”表示优势度值Y<0.01, *表示在8个采样点都是优势种, 其余种类只在部分站点是优势种。
滇池浮游植物密度、生物量、多样性通过 KW非参数检验得到的季节差异性如图 2 所示。藻密度存在显著的季节差异, 2015 年春季((2.18±9.66)×108 cells/L)>冬季((1.65±3.57)×108 cells/L)>夏季((9.50± 3.25)×107cells/L)>2016 年春季((5.74±4.22)×107cells/ L)。藻类生物量为冬季(4.06±0.81mg/L)>夏季(3.79± 1.82 mg/L)>2015年春季(2.56±1.10mg/L)>2016 年春季(1.44±1.24mg/L), 但季节差异不显著。2015 年春季与 2016 年春季之间的藻密度及生物量都存在显著差异, 年际之间的变化显著。全年蓝藻的密度最高, 占藻类总密度的比例为 73.3%~97.5%, 其中春季(2016 年 4 月)的蓝藻密度和占藻类总密度的比例最低, 分别为(4.21±3.2)×107cells/L 和 73.3%, 冬季(2015 年 12 月)最高, 为(1.61±0.36)×108cells/L 和97.6%。在春季, 绿藻密度和占藻类总密度的比例最高, 2016 年 4 月为(1.49±1.38)×107cells/L 和26.0%。在夏季(2015 年 8 月)和冬季(2015 年 12 月), 蓝藻生物量占优势, 分别为 3.14±1.88mg/L 和5.85± 6.06mg/L, 占藻类总生物量的 82.8%和 94.5%。在春季(2015 年 4 月和 2016 年 4 月), 绿藻生物量占优势, 分别为 1.57±1.0mg/L (61.1%)和 1.14±1.0mg/L (79.2%)。王华等[28]2013 年对滇池的调查得到, 春季绿藻的密度最高, 占 54.2%, 其次为蓝藻, 占27.6%。本研究中, 全年都是蓝藻占绝对优势。贺小芮[16]发现滇池藻类生物量的季节变化有以下规律, 一年中有两个生物量高峰, 一般出现在夏季和秋冬季, 绿藻多在夏季形成优势, 蓝藻多在秋季和早春形成优势。本研究同样发现藻类生物量在夏、冬季存在两个高峰, 与前人的结论相似, 但不同的是绿藻生物量在春季占优势, 其余时间都是蓝藻的生物量较高。
综合分析滇池藻类的种类组成、密度和生物量, 发现滇池浮游植物群落结构既有一定的稳定性(例如绿藻的种类数最多, 蓝藻密度全年占绝对优势, 根据优势种群法判断滇池的富营养化情况仍非常严峻[5,29]), 但群落结构特征和季节演替趋势还是发生了一定的变化。藻密度和藻类生物量的季节变化趋势不一致, 这与不同季节的物种组成不同, 而不同种类的生物量不同有关, 例如春季隐球藻(Aphanocapsa sp.)密度((17.19±9.1)×107 cells/L)远高于其他藻类, 生物量(0.0175±0.0169 mg/L)却远低于其他藻类, 因此春季的蓝藻类密度较高, 生物量却比较低。夏季的藻密度较低, 但束丝藻(Aphnizom-non sp.)等体型较大的藻类增加, 生物量较高。
Shannon-Wiener 生物多样性指数(H)的季节变化非常小, 变化趋势为冬季(0.94±0.15)>2015 年春季和夏季(0.92±0.34 和 0.92±0.04)>2016 年春季(0.85 ±0.05)。张梅等[30]在 2001—2002 年的调查中发现, 滇池浮游植物的 H 在 0.789~2.097 之间变动, 3 月份最高, 为 2.079, 其他季节的差别不明显。万能等[17]在 2001—2002 年的滇池调查中也得到春季是浮游植物生物多样性最高季节的结论。本研究中, 浮游植物的 H值远低于 2001—2002年。
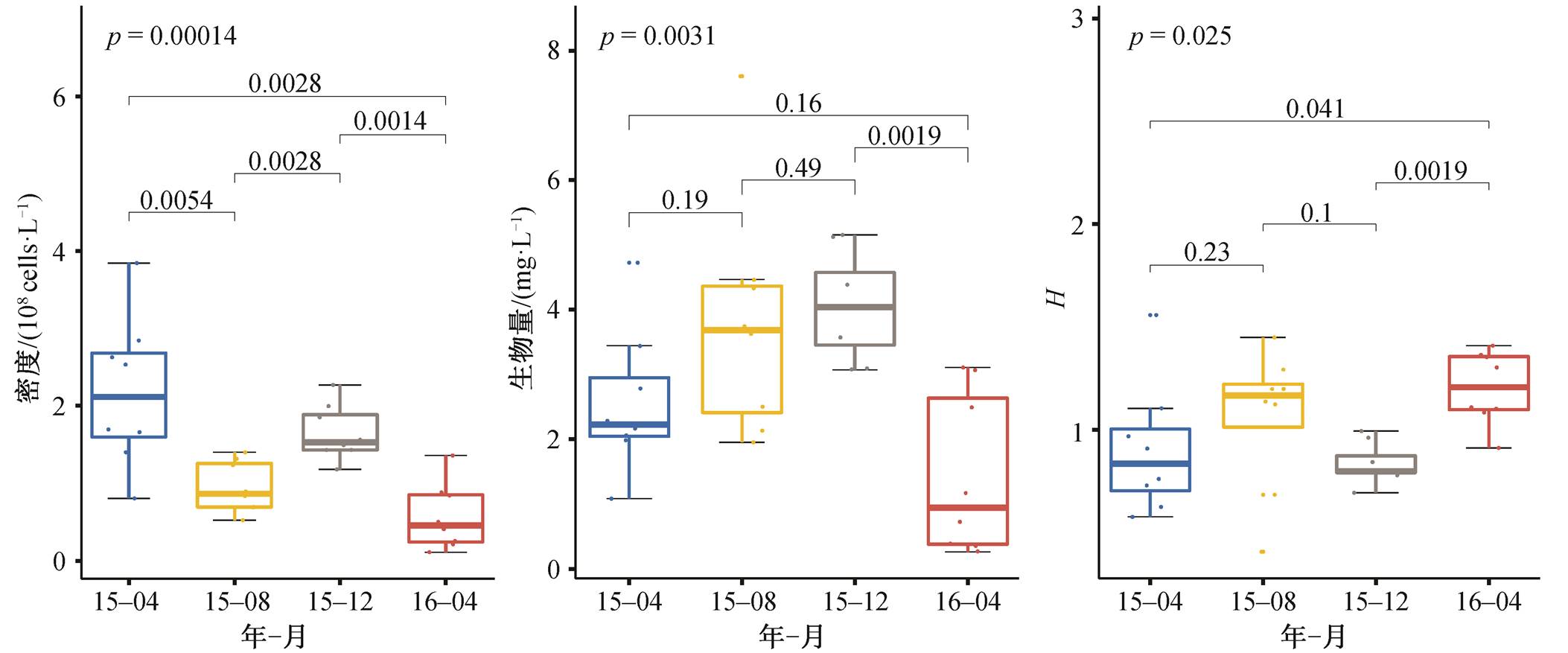
图2 滇池中浮游植物群落结构指标的季节变化
Fig. 2 Seasonal variation of plankton community structure indices in Lake Dianchi
2.3.1 Pearson相关分析
如图 3 所示, NO3−和 N:P 与浮游植物密度显著负相关, 而 TOC, DO, DOC 和 TP 与浮游植物密度显著正相关; NO3−和 N:P 与浮游植物生物量显著负相关, 而 pH, NH4+和 TP 与浮游植物生物量显著正相关; NO3−和 N:P 与 H 显著正相关, 而 TP, DO 与 H 显著负相关。其中, NO3−, TP 和 N:P 与浮游植物密度、生物量和 H 都具有显著的相关关系, 因此氮、磷营养盐是影响浮游植物群落结构的重要因素。TP 与浮游植物密度、生物量正相关, 与 H 显著负相关, NO3−和 N:P 与浮游植物密度和生物量负相关, 与 H显著正相关, 说明在滇池当前的生态环境条件下, TP 增加, N:P 下降, 能够促进藻类生长, 降低生物多样性。Kalff [31] 指出, 当溶解性 P 浓度<0.01mg/ L 时, P 是藻类主要的限制因子; 当 TP 浓度<0.1mg/ L 时, 降低 P 是最有效的降低藻类生物量方法。当前, 滇池的 TP 浓度<0.1mg/L, 且在大多数时间的大多数站点, PO43−浓度低于检测线 0.01mg/L, 因此推断与 N 相比, 在滇池 P 对藻类的限制性作用更强, 因此藻密度和生物量与 TP 显著正相关。当前在滇池, 蓝藻全年都占绝对优势, 有研究认为低 TN: TP (<29)能促进蓝藻的生长[32–33], N 和 P 浓度分别为2 和 0.2 mg/L 以及 TN:TP 为 15 是蓝藻的最适营养条件[34–36]。当前滇池绝大部分时间的 TN:TP 大于 15且低于 29, TN 浓度为 1.63~2.67mg/L, TP 为 0.07~ 0.14mg/L, 因此 TP 增加, N:P 进一步降低, 蓝藻的竞争优势会更强, 藻密度和生物量会进一步增加, 并通过种间竞争抑制其他藻类, 降低生物多样性。对于 NH4+和 NO3−两种不同形态的溶解性氮盐, 藻类会优先利用还原态的 NH4+, 只有 NH4+不足的时候才会利用 NO3− [37–38], NH4+通过硝化作用使得 NH4+降低和 NO3−增加不利于藻类的生长。另有研究发现, 微囊藻与 NH4-N:NOx-N (质量比)正相关, 即高NH4+和低 NO3−能够刺激微囊藻生物量的增加[39], 而微囊藻是滇池的绝对优势种, 因此 NO3−与藻密度和藻类生物量负相关, 与H显著正相关。
2.3.2 RDA排序分析
通过环境因子与浮游植物密度的 DCA 分析, 得到最大梯度长度为 0.97, 因此选择线性模型 RDA来探索滇池浮游植物群落的密度与环境因子之间的关系(图 4(a))。可以看出, 滇池全年最重要的优势种微囊藻的藻密度与 TN, N:P, TOC, DOC 和 NO3−负相关, 与 pH, TP 和 NH4+正相关。隐球藻属是春季最主要优势种, 藻密度与 T, NH4+, TP 和 NO3−负相关。栅藻属(Scenedesmus sp.)是绿藻中最重要的优势种属, 藻密度与 pH, TP 和 NH4+正相关, 与 N:P, TOC, TN 和 DOC 负相关; 直链藻属(Melosira sp.)是硅藻中优势度较高的种属, 其藻密度与 T, NH4+, TP 和 NO3−等负相关。
通过环境因子与浮游植物生物量的 DCA 分析,得到最大梯度长度为 1.855, 因此选择线性模型RDA 进行排序分析, 结果如图 4(b)所示。微囊藻的生物量与 NH4+, pH 和 TP 明显正相关, 与 T, N:P, TN, NO3−, DOC 和 TOC 负相关。而蓝藻其他种属以及绿藻和硅藻各种属的生物量与各环境因子的相关关系恰好与微囊藻属相反, 即与 NH4+, pH 和 TP 负相关, 与 T, N:P, TN, NO3−, DOC 和 TOC 正相关。
从以上结果看出, 滇池全年最重要的优势种属微囊藻, 无论密度还是生物量都与 pH, TP 和 NH4+ 正相关, 与 TN, N:P, NO3−, TOC 和 DOC 负相关。研究表明微囊藻在低 TN:TP 时具有竞争优势[33], 且在 P 缺乏的情况下, 与四尾栅藻和斜生栅藻等绿藻相比, 微囊藻更容易形成优势[40]。由于当前滇池的 P 限制作用更显著[31], 因此在滇池当前的环境条件下, 微囊藻具有竞争优势, 并且其密度和生物量与 TP 正相关, 与 TN 和 N:P 负相关。在富营养化的太湖同样发现, 微囊藻与 TP, pH 和 NH4-N:NOx-N (质量比)正相关[39]。有研究表明, 微囊藻适宜偏碱性的环境, 高 NH4+低 NO3−能够刺激微囊藻生物量的增加[41–42]。本文研究结果与此相似。
对于优势度相对较低的藻类, 如绿藻和硅藻, 藻密度和藻类生物量与营养盐等环境因子出现表象的负相关关系, 推测主要有以下几个原因。1)在物种多样性较低, 单一藻类占绝对优势的湖泊中, 由于当前的环境条件下优势种微囊藻等对温度、营养盐等具有更强的竞争优势, 通过竞争和分泌他感作用物质抑制其他藻类的生长, 使得硅藻和绿藻等非优势藻类出现与营养盐等环境因子的表象负相关或无相关关系[43–46]。2)除营养盐等环境因子的上行控制作用外, 浮游植物群落还受到浮游动物和鱼类等更高营养级“下行效应”的影响[47–49]。研究发现, 当湖泊中肉食性鱼类较少, 浮游食性鱼类较多时, 会导致小型浮游动物占优势[47], 对绿藻、硅藻等小型藻类和细菌的摄食压力增大。当前滇池土著的肉食性鱼类消失, 鲢鳙等浮游食性鱼类的放养, 恰恰符合上述情况, 加上富营养化的联合效应, 导致浮游动物小型化, 原生动物和轮虫增加[50–51]。并且, 微囊藻等水华藻类体积大, 口感差, 难以被浮游动物摄食, 而绿藻、硅藻等食物质量相对较高[52–54], 因此进一步增加其摄食压力[55–59]。因此, 对优势度较低的浮游植物种类, 富营养化和生物操纵等人为干扰产生的一系列“种间竞争”、“营养级联”等间接影响超过营养盐等环境因子的直接“上行控制”作用, 掩盖其真实的相关关系。3)由于不同种藻的体型差异显著, 且在不同的环境条件下会适应性的调整细胞大小, 因此浮游植物群落的生物量和密度与环境因子的相关关系不总是一致的[60]。
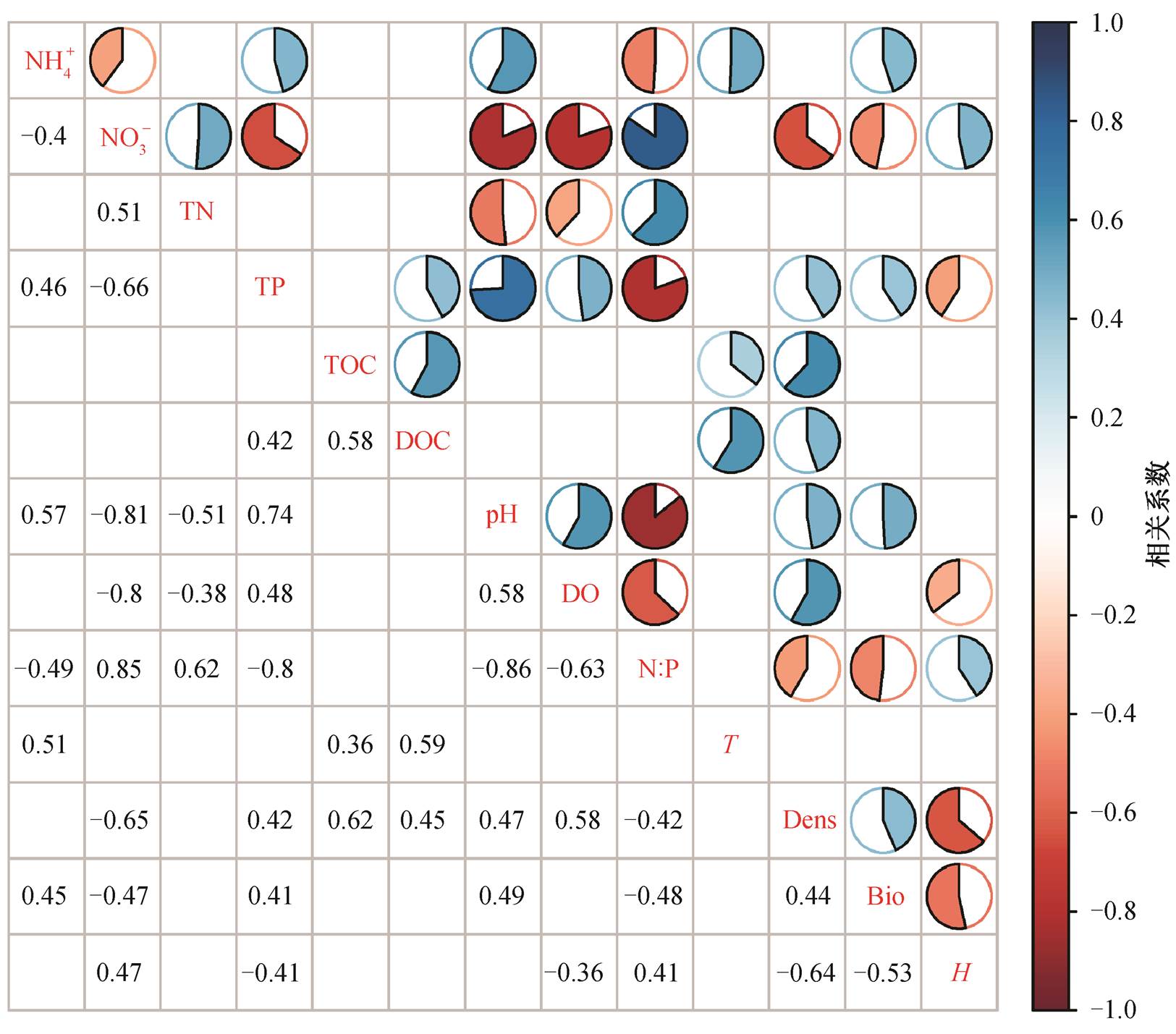
空格表示相关性不显著
图3 滇池环境因子和浮游植物群落结构指标之间的Pearson相关关系
Fig. 3 Pearson correlations between environmental factors and plankton community indices in Lake Dianchi
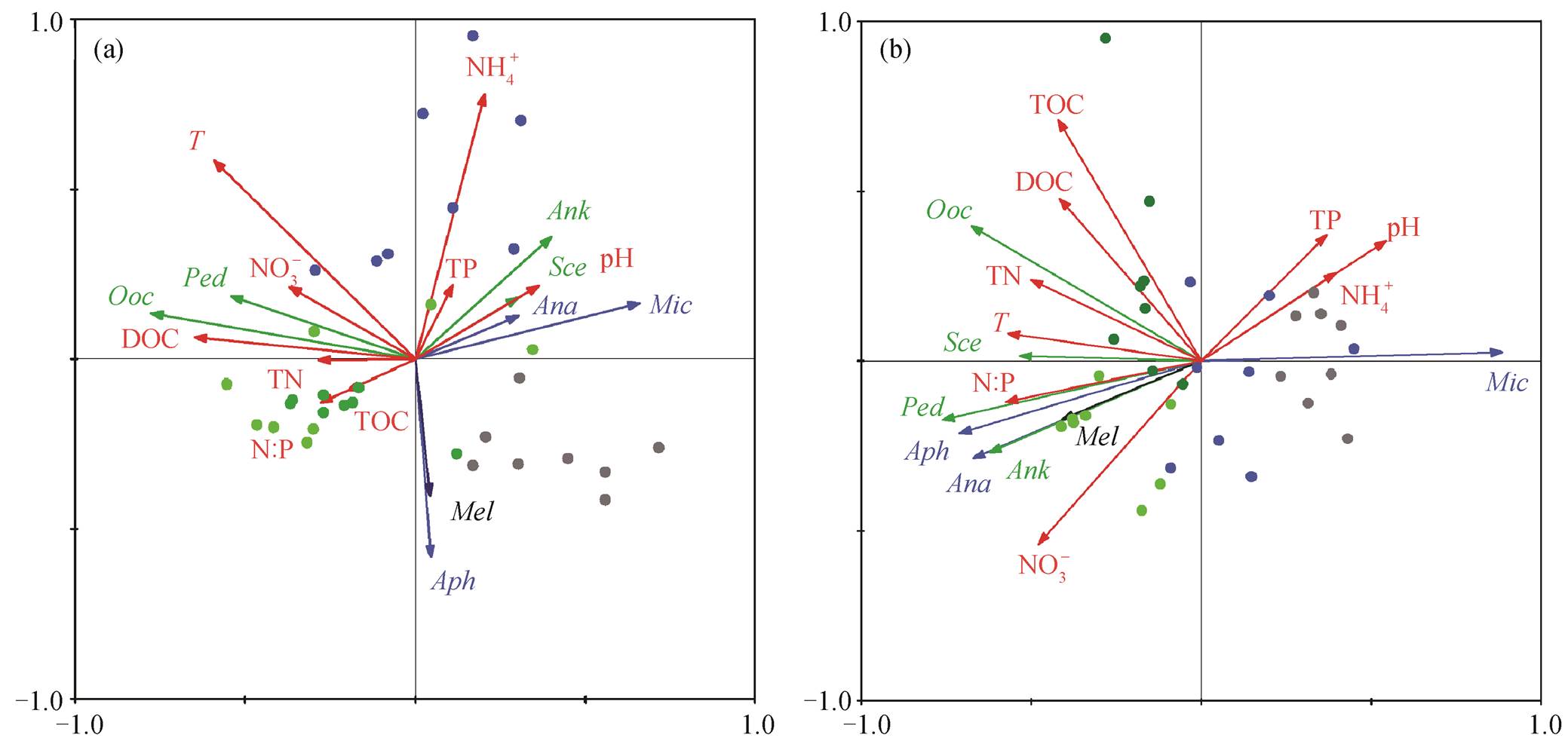
蓝藻门: Mic-微囊藻属, Aph-隐球藻属, Ana-鱼腥藻属; 绿藻门: Sce-栅藻属, Ooc-卵囊藻属, Ank-纤维藻属, Ped-盘星藻属; 硅藻门: Mel-直链藻属。实心圆点为不同季节的采样站点(浅绿色表示 2015–04, 蓝色表示 2015–08, 灰色表示 2015–12, 浅绿色表示 2016–04), 红色箭头表示环境因子, 蓝色箭头表示蓝藻门藻类, 深绿色箭头表示绿藻门藻类, 黑色箭头表示硅藻门藻类
图4 滇池浮游植物各物种的密度(a)和生物量(b)与环境因子的双序图
Fig. 4 Biplot of phytoplankton density (a) and biomass (b) and environmental factors in Lake Dianchi
因此, 浮游植物群落在一定空间范围内的梯度排序, 对于优势物种, 能够相对准确地识别出关键环境因子, 判断其相关关系; 而对于非优势的种属, 能够更准确地反映环境因子与其的表象相关关系, 判断当前生态环境条件下环境因子的变化对其产生的正负影响。
本文通过对 2015—2016 年不同季节在滇池采样得到的水质指标和浮游植物群落进行分析, 探索浮游植物群落结构的时空变化及与主要环境因子之间的关系,得到以下结论。
1)在滇池, 各环境因子、浮游植物密度、生物量和 Shannon-Wiener 生物多样性指数(H)存在不同程度的季节和年际变化。
2)浮游植物中绿藻的种类最多, 其次是蓝藻。蓝藻密度在全年都占绝对优势, 其中隐球藻在春季占优势, 其余时间微囊藻占绝对优势。春季, 绿藻的生物量最高, 其他季节则是蓝藻的生物量最高。藻密度在春季和冬季较高, 夏季较低, 而藻类生物量在夏、冬季较高, 春季较低。藻密度和藻类生物量的季节性变化规律不一致, 与不同季节的藻类组成不同, 而不同藻的生物量大小不同有关。
3)通过 Pearson 相关性分析和 RDA 排序分析, 得到营养盐是影响浮游植物群落结构的主要因素。藻类密度和生物量与 TP 正相关, 与 N:P 和 NO3−负相关, 而 Shannon-Wiener 生物多样性指数与 TP 负相关, 与 N:P 和 NO3−呈正相关关系。优势种微囊藻与 pH, TP 和 NH4+正相关, 与 TN, N:P, TOC, DOC 和NO3−负相关。对于非优势种群, 如绿藻和硅藻, RDA 排序分析反映当前生态环境条件下环境因子与其的表象相关关系, 因为竞争或捕食等间接因素可能掩盖了环境因子对种群的真实影响。
本文对环境因子与浮游植物群落指标之间关系的定量分析主要基于线性分析, 而环境因子与浮游植物群落之间存在不同类型、不同程度的非线性响应关系[61–63], 除环境因子外, 捕食和竞争等生物因素也是导致浮游植物时空变化的主要因素[64]。未来研究中, 将进一步通过非线性统计方法和生态系统动力学模型, 详细地探索多个环境因素及各生物群落与浮游植物之间的非线性响应关系和响应 机制。
参考文献
[1] 冯秋园, 吴桐, 万祎, 等. 持久性有机污染物(POPs)在水生食物网中的环境行为研究. 北京大学学报(自然科学版), 2017, 53(3): 588–596
[2] Xu F L, Tao S, Dawson R W, et al. A GIS-based method of lake eutrophication assessment. Ecological Modelling, 2001, 144(2/3): 231–244
[3] 高世荣, 潘力军, 孙凤英, 等. 用水生生物评价环境水体的污染和富营养化. 环境科学与管理, 2006, 31(6): 174–176
[4] Suikkanen S, Laamanen M, Huttunen M. Long-term changes in summer phytoplankton communities of the open northern Baltic Sea. Estuarine, Coastal and Shelf Science, 2007, 71(3/4): 580–592
[5] 韩欢欢. 黑龙江省安兴湿地藻类植物多样性及其环境相关性初步研究[D]. 哈尔滨: 哈尔滨师范大学, 2012
[6] Liu Cunqi, Liu Lusan, Shen Huitao. Seasonal variations of phytoplankton community structure in relation to physic-chemical factors in Lake Baiyangdian, China. Procedia Environmental Sciences, 2010, 2: 1622–1631
[7] 王瑜, 刘录三, 舒俭民, 等. 白洋淀浮游植物群落结构与水质评价. 湖泊科学, 2011, 23(4): 575–580
[8] Jiang Yujiao, He Qishuang, He Wei, et al. The seaso-nal and spatial variations of phytoplankton communi-ty and their correlation with environmental factors in a large eutrophic Chinese lake (Lake Chaohu). Ecolo-gical Indicators, 2014, 40: 58–67
[9] 王红梅, 陈燕. 滇池近 20a 富营养化变化趋势及原因分析. 环境科学导刊, 2009, 28(3): 57–60
[10] 张军莉, 严谷芬. 滇池水质 1999—2008 年时空变化特征. 环境科学导刊, 2014. 33(3): 1–7
[11] 董静, 李根保, 宋立荣. 抚仙湖、洱海、滇池浮游藻类功能群 1960s 以来演变特征. 湖泊科学, 2014, 26(5): 735–742
[12] 罗民波, 段昌群, 沈新强, 等. 滇池水环境退化与区域内物种多样性的丧失. 海洋渔业, 2006, 28(1): 71–78
[13] 胡俊. 滇池的内源磷及其与蓝藻水华的关系研究[D]. 武汉: 中国科学院水生生物研究所, 2005
[14] 李原, 张梅, 王若南. 滇池的水华蓝藻的时空变化. 云南大学学报(自然科学版), 2005, 27(3): 272–276
[15] 张梅, 李原, 王若南. 滇池浮游植物种类的动态变化. 云南大学学报(自然科学版), 2006, 28(1): 73–77
[16] 贺小芮. 滇池底泥藻类特征与浮游植物时空分布研究[D]. 昆明: 昆明理工大学, 2007
[17] 万能, 宋立荣, 王若南, 等. 滇池藻类生物量时空分布及其影响因子. 水生生物学报, 2008, 32(2): 184–188
[18] 代龚圆, 李杰, 李林, 等. 滇池北部湖区浮游植物时空格局及相关环境因子. 水生生物学报, 2012, 36(5): 946–955
[19] 盛虎, 郭怀成, 刘慧, 等. 滇池外海蓝藻水华爆发反演及规律探讨. 生态学报, 2012, 32(1): 56–63
[20] 施择, 李爱军, 张榆霞, 等. 滇池浮游藻类群落构成调查. 中国环境监测, 2014, 30(5): 121–124
[21] 章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991
[22] 胡鸿钧, 魏印心. 中国淡水藻类. 北京: 科学出版社, 2006
[23] Shannon C E, Weaver W. The mathematical theory of communication. Urbana: The University of lllinois Press, 1949
[24] McNaughton S J. Relationship among functional pro-sperities of California grassland. Nature, 1967, 27(5): 315–319
[25] Muylaert K, Sabbe K, Vyverman W. Spatial and tem-poral dynamics of phytoplankton communities in a freshwater tidal estuary (Schelde, Belgium). Estuar-ine, Coastal and Shelf Science, 2000, 50(5): 673–687
[26] Lopes M R M, Bicudo C E, Ferragut M C. Short term spatial and temporal variation of phytoplankton in a shallow tropical oligotrophic reservoir, southeast Bra-zil. Hydrobiologia, 2005, 542(1): 235–247
[27] Lepš J, Šmilauer P. Multivariate analysis of ecologi-cal data using CANOCO. New York: Cambridge Uni-versity Press, 2003
[28] 王华, 杨树平, 房晟忠, 等. 滇池浮游植物群落特征及与环境因子的典范对应分析. 中国环境科学, 2016, 36(2): 544–552
[29] 庞清江, 李白英. 东平湖水体富营养化评价. 水资源保护, 2003, 19(5): 42–44
[30] 张梅, 李原, 王若南. 滇池浮游植物的生物多样性调查研究. 云南大学学报(自然科学版), 2005, 27(2): 170–175
[31] Kalff J. Limnology: Inland water ecosystems. Upper Saddle River: Prentice Hall, 2002
[32] Tilman D, Kilham S S, Kilham P. Plankton commu-nity ecology: the role of limiting nutrients. Annual Review of Ecology and Systematics, 1982, 13(1): 349–373
[33] Smith V H. Low nitrogen to phosphorus ratios favor dominance by blue algal biomass in lake phytoplan-kton. Science, 1985, 221(4): 669–671
[34] 林毅雄, 韩梅. 滇池富营养化的铜绿微囊藻(Micro-cystis aeraginosa Kütz)生长因素的研究. 环境科学进展, 1998, 6(3): 82–87
[35] 杨顶田, 陈伟民, 江晶, 等. 藻类爆发对太湖梅梁湾水体中 NPK 含量的影响. 应用生态学报, 2003, 14 (6): 969–972
[36] 陈永根, 刘伟龙, 韩红娟, 等. 太湖水体叶绿素 a 与氮磷浓度的关系. 生态学杂志, 2007, 26(12): 2061–2068
[37] Turpin D H. Effects of inorganic N availability on algal photosynthesis and carbon metabolism. Journal of Phycology, 1991, 27(1): 17–20
[38] 许海. 河湖水体浮游植物群落生态特征与富营养化控制因子研究[D]. 南京: 南京农业大学, 2008
[39] 刘霞. 太湖蓝藻水华中长期动态及其与相关环境因子的研究[D]. 武汉: 华中科技大学, 2012
[40] 马祖友. 蓝藻的生长生理特征及其竞争优势研究[D]. 杨凌: 西北农林科技大学, 2005
[41] Jacoby J M, Collier D C, Welch E B, et al. En-vironmental factors associated with a toxic bloom of Microcystis aeruginosa. Canadian Journal of Fisheries and Aquatic Sciences, 2000, 57(1): 231–240
[42] 张坤. 竞争条件下环境因子对铜绿微囊藻影响的研究[D]. 上海: 上海海洋大学, 2012
[43] Keating K I. Blue-green algal inhibition of diatom growth: transition from mesotrophic to eutrophic community structure. Science, 1978, 199: 971–973
[44] Smith D W. Biological control of excessive phyto-plankton growth and the enhancement of aquacultural production. Canadian Journal of Fisheries and Aquatic Sciences, 1985, 42(12): 1940–1945
[45] 查广才, 周昌清, 黄建荣, 等. 凡纳对虾淡化养殖虾池微型浮游生物群落及多样性. 生态学报, 2004, 24(8): 1752–1759
[46] Suikkanen S, Fistarol G O, Graneli E. Effects of cyanobacterial allelochemicals on a natural plankton community. Marine Ecology Progress Series, 2005, 287: 1–9
[47] Carpenter S R, Kitchell J F, Hodgson J R. Cascading trophic interactions and lake productivity. BioScience, 1985, 35(10): 634–639
[48] Mcqueen D J, Post J R, Mills E L. Trophic relation-ships in freshwater pelagic ecosystems. Canadian Journal of Fisheries and Aquatic Sciences, 1986, 43 (8): 1571–1581
[49] 赵帅营. 营养盐加富和鲢对南亚热带贫—中营养型水库浮游生物群落的影响: 大型围隔实验[D]. 广州: 暨南大学, 2009
[50] Blancher E C. Zooplankton-trophic state relationship in some north and central Florida lakes. Hydrobiolo-gia, 1984, 109(3): 251–263
[51] 杨宇峰, 黄祥飞. 鲢鳙对浮游动物群落结构的影响. 湖泊科学, 1992, 4(3): 78–86
[52] Lűrling M, Van Donk E. Life history consequences in Daphnia pulex feeding on nutrient limited phytoplan-kton. Freshwater Biology, 2003, 38(3): 693–709
[53] Lűrling M, Beekman W. Influence of food-type on the population growth rate of the rotifer Brachionua calyciflorus in short-chronic assays. Acta Zoologica Sinica, 2006, 52(1): 70–78
[54] 朱津永, 陆开宏, 潘洁慧. 微囊藻水华对淡水浮游动物轮虫和枝角类影响的研究进展. 中国水产科学, 2008, 15(2): 367–375
[55] Elser J J, Goldman C R. Zooplankton effects on phy-toplankton in lakes of contrasting trophic status. Limnology and Oceanography, 1991, 36(1): 64–90
[56] Chen Feizhou, Xie Ping. The effects of fresh and decomposed Microcystis aeruginosa on cladocerans from a subtrophic Chinese lake. Journal of Freshwater Ecology, 2003, 18(1): 97–104
[57] 韩士群, 严少华, 范成新, 等. 长肢秀体溞对富营养化水体藻类的生物操纵. 江苏农业学报, 2006, 22(1): 81–85
[58] 张钰, 谷孝鸿, 朱光敏, 等. 太湖微囊藻对几种枝角类种群影响的实验生物学分析. 湖泊科学, 2007, 19(5): 566–571
[59] 张霞. 上行–下行作用对浮游植物群落影响的生态学研究[D]. 武汉: 中国科学院水生生物研究所, 2008
[60] 赵晓东, 潘江, 李金页, 等. 铜绿微囊藻和斜生栅藻非稳态营养盐限制条件下的生长竞争特性. 生态学报, 2011, 31(13):3710–3719
[61] 宋洪军, 张学雷, 王保栋, 等. 长江口及邻近海域浮游植物现存量的上下行控制分析. 2014, 36(8): 91–100
[62] 郭亮, 苏婧, 纪丹凤, 等. 基于 GAM 模型的太湖叶绿素 a 与营养盐相关性研究. 环境工程技术学报, 2017, 7(5): 565–572
[63] 张智渊. 太湖大气湿沉降氮、磷营养盐特征及其对浮游植物的影响[D]. 北京: 中国环境科学研究院, 2018
[64] 李奕慧. 简单海洋浮游生态系统稳态对增温的响应[D]. 厦门: 厦门大学, 2016
Seasonal and Spatial Variations of Phytoplankton Communities and Correlations with Environmental Factors in Lake Dianchi
Abstract The spatial and seasonal variations of environmental factors and phytoplankton community in Lake Dianchi was investigated. The statistical analysis found that a total of 84 phytoplankton taxon, belonging to 49 genera 6 phyla were identified, of which Chlorophyte were the most abundant, accounting for 59.2%, followed by Cyanophyta, accounting for 16.67% and diatom accounting for 5.95%. The trend of seasonal variation of algae density and biomass was not the same, which was caused by the biomass differences of various species. The Shannon Wiener index (H) was very small throughout the year, and seasonal variation was not significant. Algae density and biomass were positively correlated with total phosphorus (TP), and negatively correlated with nitrate (NO3−) and nitrogen phosphorus ratio (N:P). H was positively correlated with NO3− and N:P, while negatively correlated with TP. Nutrients had great influences on the density and biomass distributions of various taxa of phytoplankton community. The density and biomass of the most dominant species Microcystis sp.had the same relationships with the environmental factors, which were positively correlated with pH, TP and ammonia (NH4+), and negatively correlated with NO3−, N:P, total nitrogen (TN), dissolved organic carbon (DOC) and total organic carbon (TOC). Some biological factors may cause stronger effects ondensity and biomass distribution of chlorella and diatom, such as interspecific competition and predation, covering the influences of environmental factors.
Key words Lake Dianchi; phytoplankton; community structure; environmental factors; seasonal variation; spatial variation
doi: 10.13209/j.0479-8023.2019.128
国家重点基础研究发展计划(2015CB458900)资助
收稿日期: 2019–01–10;
修回日期: 2019–11–18