气温和土壤湿度对中国东部温带蒲公英黄枯普期的影响
薛婷婷 赵袁 陈效逑† 姜梦迪 梁博毅
北京大学城市与环境学院, 地表过程分析与模拟教育部重点实验室, 北京 100871; †通信作者, E-mail: cxq@pku.edu.cn
摘要 为了揭示草本植物秋季物候的时间变化及其气候归因, 利用中国东部温带 47 个站点 1992—2012 年的植物物候与气象数据和统计方法, 分析蒲公英黄枯普期的变化趋势, 并模拟黄枯普期的年际变化。结果表明: 1)在 1992—2012 年期间, 34 个站点的蒲公英黄枯普期呈推迟的趋势, 其中 22 个站点呈显著推迟的趋势, 相比之下, 13 个站点的蒲公英黄枯普期呈提前的趋势, 其中 5 个站点呈显著提前的趋势; 2)各站蒲公英黄枯普期与生长季(展叶始期到黄枯普期的期间)的平均温度主要呈负相关关系, 但与秋季土壤相对湿度和秋季日最低温度主要呈正相关关系; 3)在 30 个单站有效最优模型(p<0.05)中, 蒲公英黄枯普期受秋季土壤相对湿度影响的站点有 22 个, 受秋季日最低温度影响的站点有 19 个, 受生长季平均温度影响的站点有 21 个。此外, 模型模拟的精度受到蒲公英黄枯普期年际波动的显著影响, 即在一个站点处的黄枯普期年际波动越小, 模型的模拟精度越高。
关键词 气候变化; 草本植物秋季物候; 线性趋势; 生长季均温; 秋季低温; 土壤湿度
植物物候指受外界环境因素和植物内源调控因素影响而出现的周期性植物生长发育现象[1–2], 它是自然环境季节–年际变化的综合指示器及物理气候过程与生物地球化学循环相互作用的关键环节[2–7]。随着全球气候变暖, 北半球大部分地区的植被春季展叶物候呈提前趋势[3,8–11], 秋季叶变色和落叶物候呈推迟趋势[3,12–15], 使得生长季延长, 从而加强了植物通过光合作用对 CO2 的固定作用[16]。气候变暖和生长季长度的变化还影响着生态系统中生产者、消费者和分解者季节性活动的时间匹配程度, 进而导致生态系统营养结构的改变[17–18]。因此, 揭示物候变化对区域气候变化的响应, 对于理解植被碳吸收的季节特征以及变化环境下的生态系统结构和功能, 具有重要的科学意义[7,19]。
已有的研究主要关注植物春季物候的变化[20–21], 对秋季物候的探索[13,22–23]较少, 对秋季物候发生的机理尚无定论。此外, 在已有的秋季物候研究中, 关注木本植物的较多, 对草本植物的关注较少[24]。然而, 草本植物分布范围广, 体型小, 木质化程度低, 在根和茎中营养储存比木本植物少, 因此, 其对气候变化的响应比木本植物更加敏感[25–26]。揭示温带地区草本植物的秋季物候变化及其主要气候因子, 对于发现植物秋季物候对气候变化响应的早期信号, 改进秋季物候模型, 实现秋季物候的准确预测, 都具有重要的应用价值。
植物物候受温度、水分等条件的综合影响[27–28], 其中温度是最重要的生态因子。目前分析秋季温度对植物秋季物候影响的研究较多, 例如 Tanino 等[29]通过控制实验, 得出低温是植物秋季物候主要控制因子的结论。我国学者发现, 蒲公英黄枯普期与前期秋季气温呈显著的正相关关系, 气温越高, 黄枯普期越晚[30]。对木本植物而言, 植物叶片的寿命很可能受到积温的控制[31], 随着生长季平均温度的升高, 达到一定积温的时间变短, 致使叶片寿命缩短, 叶变色期提前。Xie 等[32]和 Liu 等[33]的研究也表明, 树木秋季物候在很大程度上受到生长季均温的控制, 然而这种生长季均温对秋季物候的控制是否适用于草本植物, 目前尚不清楚。
此外, 降水量的年际波动也会影响植物的物候[34–37]。降水对植物生长发育的影响具有间接性和滞后性, 土壤水分才是植物吸收利用水分的直接来源, 其对植物生长发育具有关键的作用[38]。目前针对土壤水分与植物秋季物候关系的研究较少, 缺乏土壤水分与降水量在模拟秋季物候有效性方面的对比分析。
基于以上的研究背景, 本文采用中国东部温带区域 47 个物候站点蒲公英黄枯普期数据和气象数据, 利用 Mann-Kendall 分析方法、偏相关和多元线性回归模型, 分析蒲公英黄枯普期的变化趋势, 进而揭示蒲公英黄枯普期与秋季低温、生长季均温、秋季降水量和秋季土壤相对湿度之间的相关关系及其空间分异特征, 并对蒲公英黄枯普期进行统计模拟。
1 材料与方法
1.1 研究区域和物种选择
根据中国气候区划, 东部温带区域包含湿润寒温带气候, 湿润、半湿润、半干旱中温带气候, 湿润、半湿润、半干旱暖温带气候 7 个气候类型区[39]。气候的基本特征是夏季高温湿润, 冬季寒冷干燥。年降水量从东南向西北递减(1000~200mm), 年平均气温从南向北逐渐降低(−5~15°C)。
蒲公英(Taraxacum mongolicum)隶属菊科, 蒲公英属, 分布于我国、朝鲜、蒙古和俄罗斯等东北亚地区, 生长在温带和亚热带中、低海拔的山坡草地、路边、田野和河滩, 是我国最常见的多年生草本植物之一。作为自然环境季节–年际动态的综合指示器, 蒲公英的物候变化具有其他草本植物物候变化所不具备的广泛的区域代表性。此外, 在中国气象局的草本植物物候观测数据库中, 蒲公英的物候观测站点最多, 且观测数据的时间序列最完整, 便于进行广大区域范围的植物物候变化及其环境归因分析。鉴于此, 我们选取蒲公英作为环境变化的“指示植物种”, 以黄枯普期作为指示叶片光合期结束进入衰老阶段的指示物候期, 开展中国东部温带多年生草本植物秋季物候的时间动态及其对气候变化响应的研究。
1.2 物候与气象数据
蒲公英物候数据取自中国气象局农业气象观测网的自然物候观测数据集。该物候观测网建立于1980 年, 目前设有 400 多个物候站点, 是中国最大的物候观测网络系统, 观测内容涉及 49 种木本植物、10 种草本植物和 11 种动物的物候期以及气象和水文现象。蒲公英的生长季节定义为从展叶始期到黄枯普期之间的时期。展叶始期的观测标准是第一批叶片完全展开的日期; 黄枯普期的观测标准是超过 50%的绿叶变黄时的日期[40]。
气象数据均来自中国气象资料共享服务系统(http://cdc.cma.gov.cn/), 其中, 土壤相对湿度(RSM, 实测土壤重量含水率与田间持水量的百分比)的观测频率为每 10 天一次(每个月的第 8, 18 和 28 日), 观测深度分别为 10, 20, 50, 70 和 100 cm, 数据的有效期限为 1992—2012 年。由于蒲公英的根系主要集中在 0~10cm 的表层土壤, 所以我们只利用 10cm 的土壤相对湿度数据并根据各站点蒲公英黄枯普期平均日期之前的月份计算月平均值。降水量和气温数据包括逐日降水量、逐日平均气温和最低气温数据(1951—2012 年)。生长季平均气温由蒲公英展叶始期至黄枯普期期间的逐日平均气温计算得到, 秋季平均日最低气温根据各站点蒲公英黄枯普期平均日期之前的月份计算月平均值得到(表 1)。
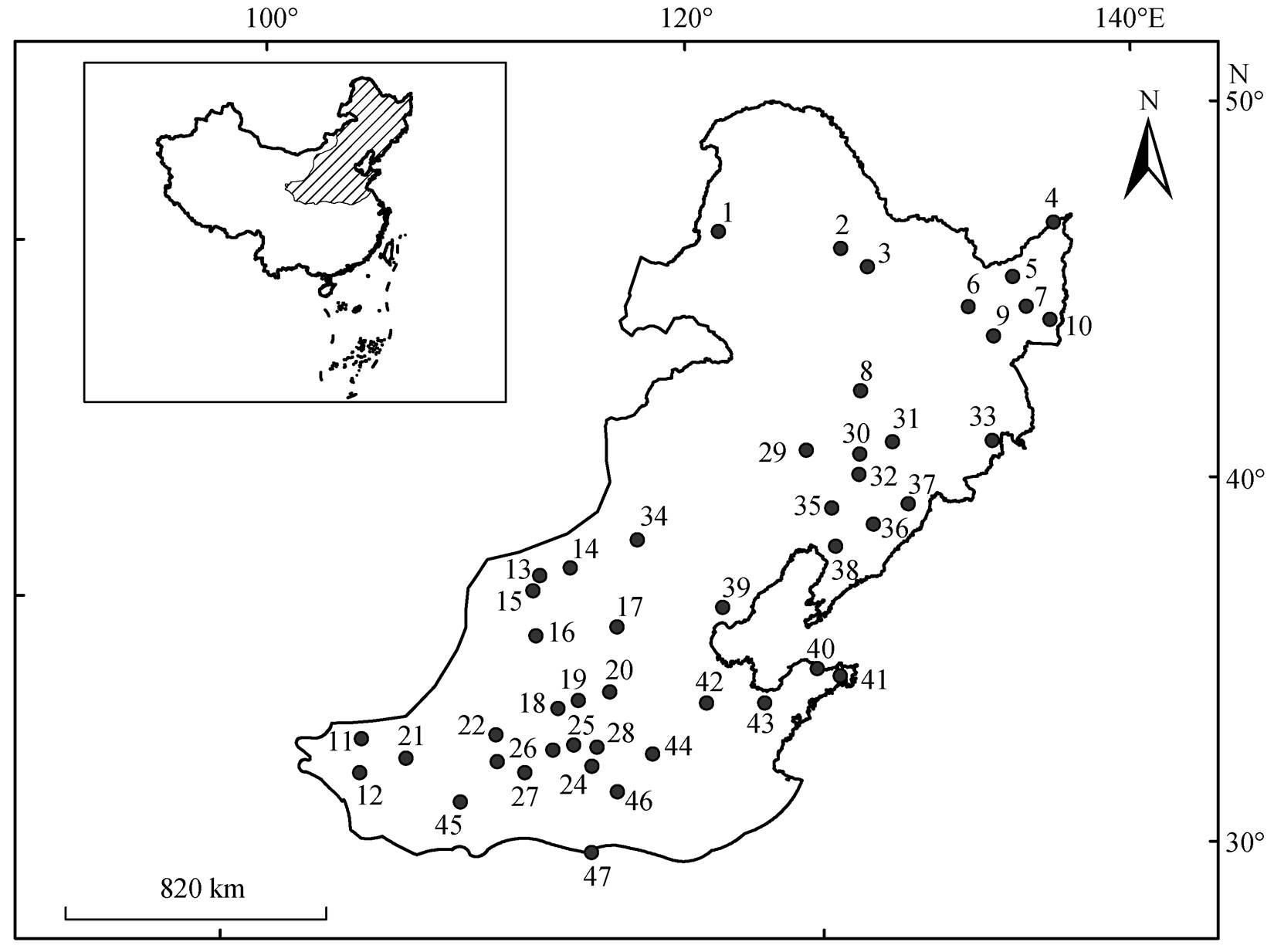
由于土壤相对湿度数据年份(1992—2012 年)的限制, 最终选择 1992—2012 年作为研究期。基于物候和气候数据的对应性原则, 我们采用 3 条标准来筛选站点: 1) 展叶始期和黄枯普期数据的时间序列长度超过 16 年, 且平均黄枯普期发生日期在秋季(9—11 月); 2)绘制每个站点的蒲公英展叶始期和黄枯普期的年际变化曲线, 并与其他草本植物的展叶始期和黄枯普期的年际变化曲线相比较, 剔除年际变化异常的站点[8]; 3)剔除气象数据(相对土壤湿度、降水量和温度)有异常和不连续的站点。共筛选出 47 个站点, 比较均匀地分布在中国东部温带区域, 具有较好的区域代表性(图 1)。
表1 气象变量及其缩写
Table 1 Meteorological variables and their abbreviations
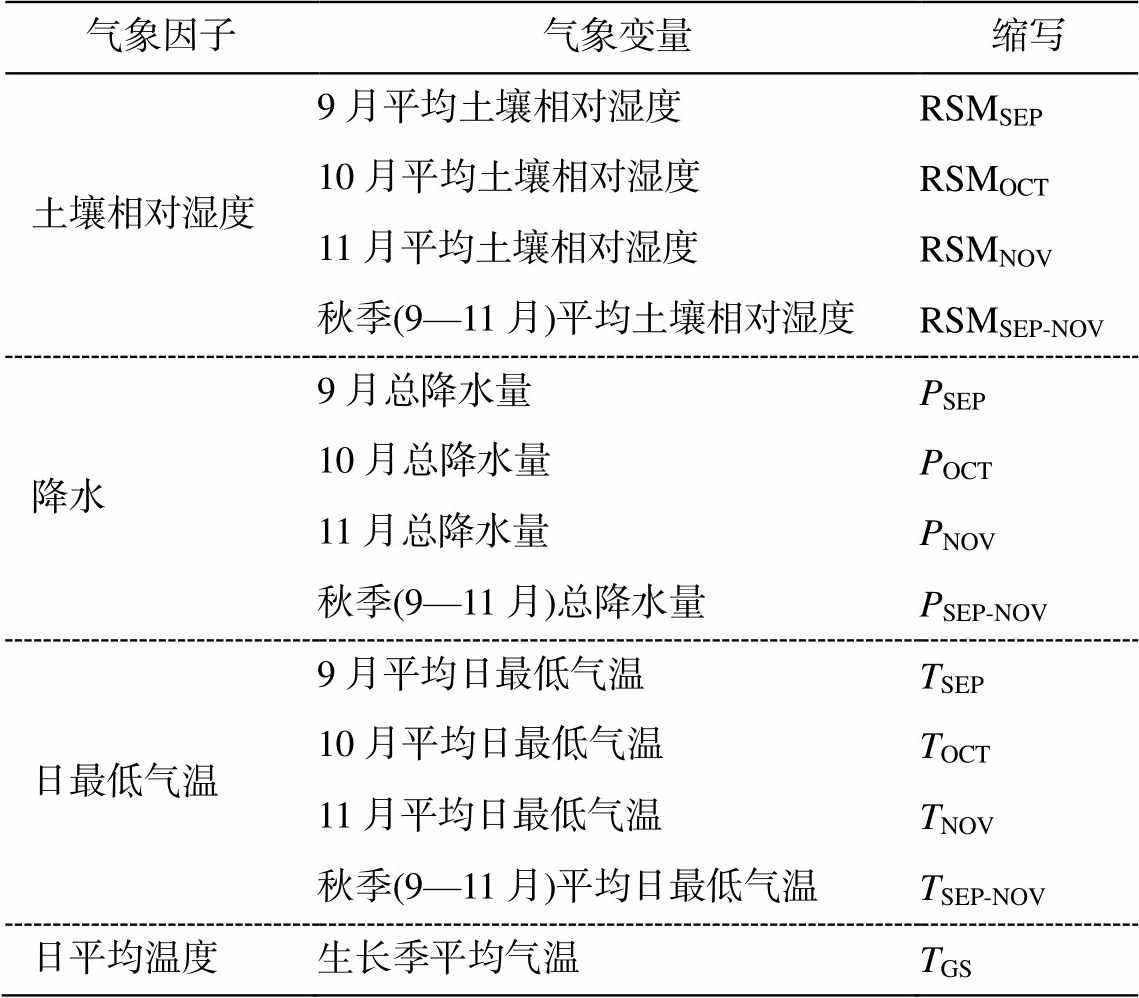
气象因子气象变量缩写 土壤相对湿度9月平均土壤相对湿度RSMSEP 10月平均土壤相对湿度RSMOCT 11月平均土壤相对湿度RSMNOV 秋季(9—11月)平均土壤相对湿度RSMSEP-NOV 降水9月总降水量PSEP 10月总降水量POCT 11月总降水量PNOV 秋季(9—11月)总降水量PSEP-NOV 日最低气温9月平均日最低气温TSEP 10月平均日最低气温TOCT 11月平均日最低气温TNOV 秋季(9—11月)平均日最低气温TSEP-NOV 日平均温度生长季平均气温TGS
1.3 研究方法
非参数的 TS-MK 检验对异常值的影响不敏感, 通常用于检测长时间序列数据的单调趋势, 已广泛应用于气候与水文等变化趋势研究中[41–42]。本文采用 Mann-Kendall 非参数检验方法分析 1992—2012年蒲公英黄枯普期的变化趋势, 采用 Theil-Sen 方法进行趋势计算与显著性检验。
偏相关分析是在排除其他变量线性影响的条件下, 计算两个变量之间的相关系数。本文采用该方法检测蒲公英黄枯普期的日期与气象因子(表 1)之间的关系, 从而确定关键的气象因子。
多元线性回归模型描述多个自变量与因变量之间的线性回归关系, 最优模型的筛选标准为均方根误差(RMSE)和赤池信息量准则(AICc)。RMSE 用来表征模拟物候日期与观测物候日期间的误差, 以RMSE 最小为原则, 确定模型的最佳参数组合; AICc用来表征模型的冗余度和效率, 以 AICc 最小为原则, 选择每个站点的最优模型[43–44]。它们的计算公式如下:
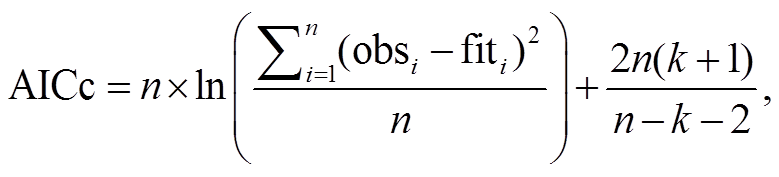 (2)
(2)
obsi 为第 i 年的物候观测值, fiti 为第 i 年的物候模拟值, n 为序列长度, k 为模型参数个数。
2 结果与分析
2.1 区域与站点尺度蒲公英平均黄枯普期的时空变化
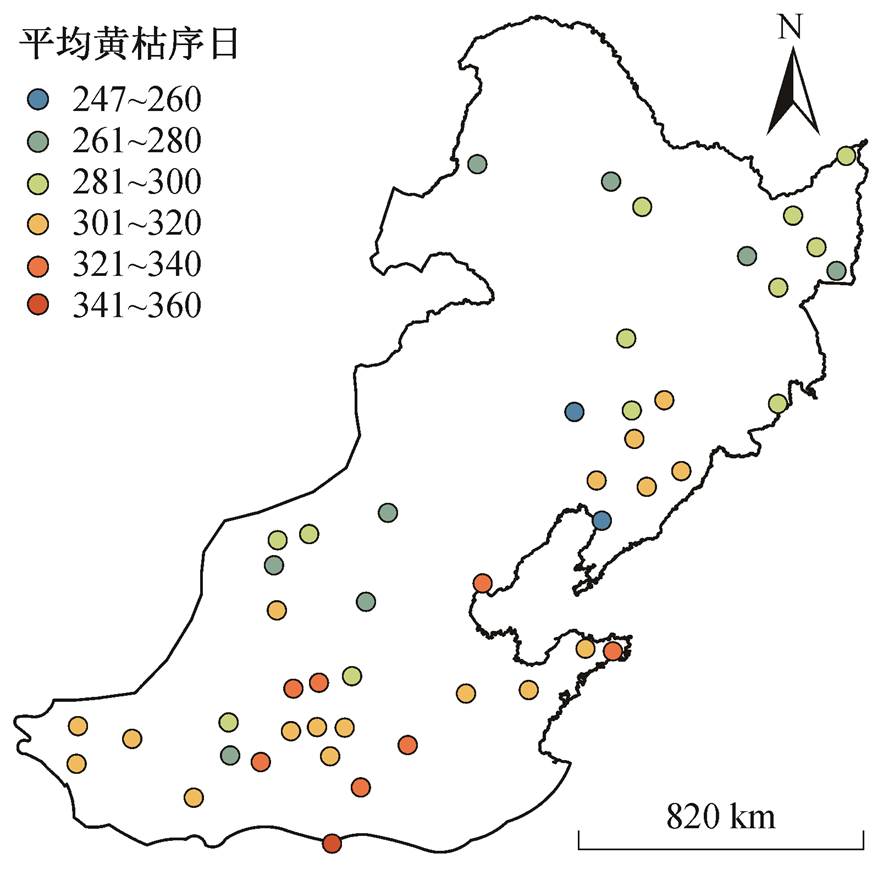
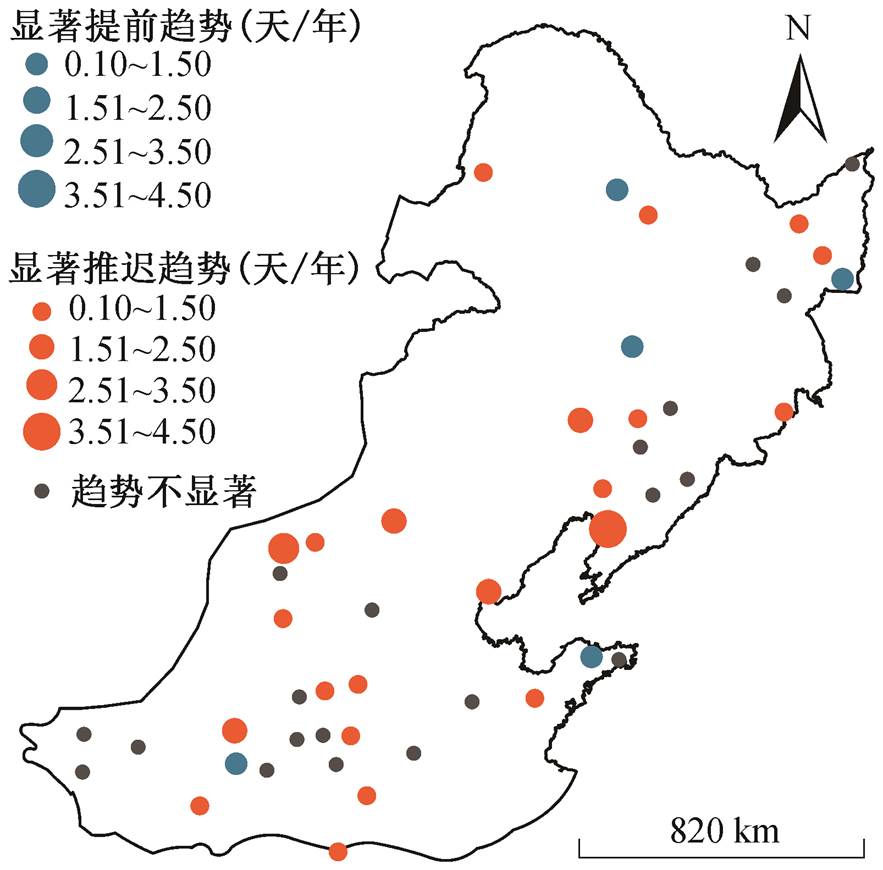
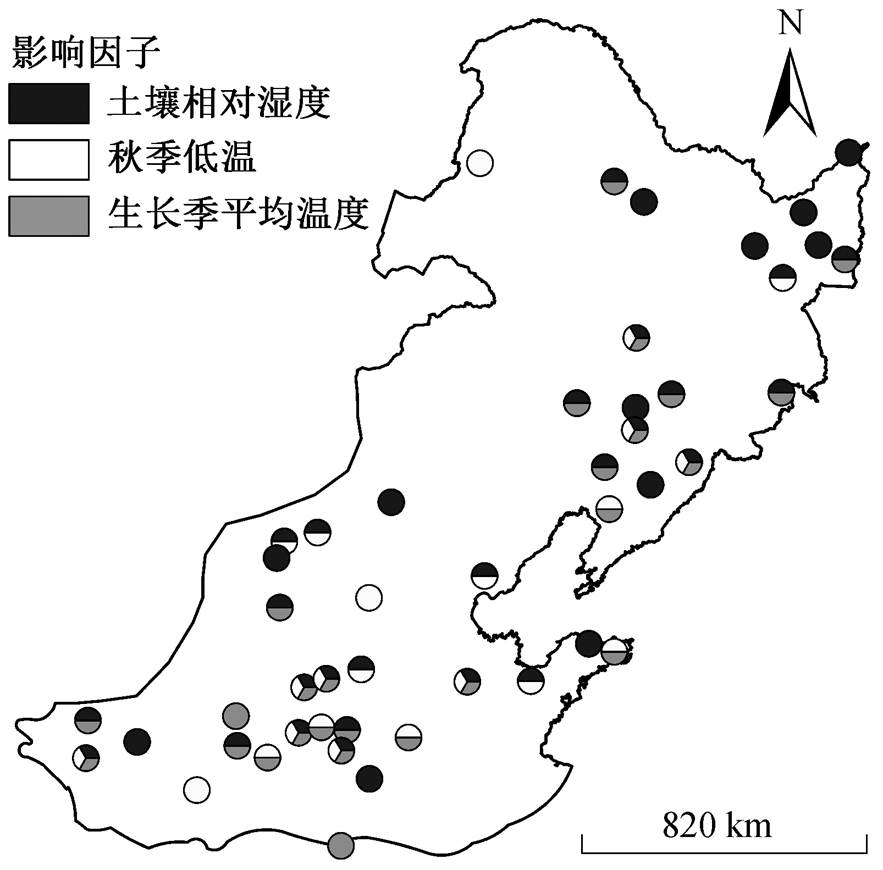
从空间变化来看, 蒲公英的黄枯普期大致呈现从东南向西北逐渐提前的变化趋势, 研究区东南部站点的黄枯普期偏晚(301~355 天), 西北部站点的黄枯普期相对较早(252~300 天)(图 2)。在区域尺度上, 通过每年 47 个站点的黄枯普期平均, 得到区域内 1992—2012 年平均黄枯普期时间序列, 进而通过TS-MK 检验计算区域尺度的平均黄枯普期变化趋势。从时间变化上来看, 在区域尺度上, 1992—2012 年期间蒲公英平均黄枯普期以 0.67 天/年的速度显著推迟(p<0.001); 在站点尺度上, 蒲公英黄枯普期在大部分站点呈显著的线性变化趋势, 且以显著推迟的趋势为主, 呈推迟趋势的站点共有 33 个(70%), 其中 22 个站点呈显著推迟趋势(p<0.05, 46.8%), 平均推迟速率为 1.44 天/年, 这些站点较为均匀地分布在研究区内, 且中部站点的黄枯普期推迟速率较高。此外, 呈提前趋势的站点共有 13 个(27.7%), 其中 5 个站点呈显著提前趋势(p<0.05, 10.6%), 平均提前速率为 0.6 天/年, 主要分布在研究区的南部和北部(图 3)。
2.2 蒲公英黄枯普期与气象因子间的偏相关关系
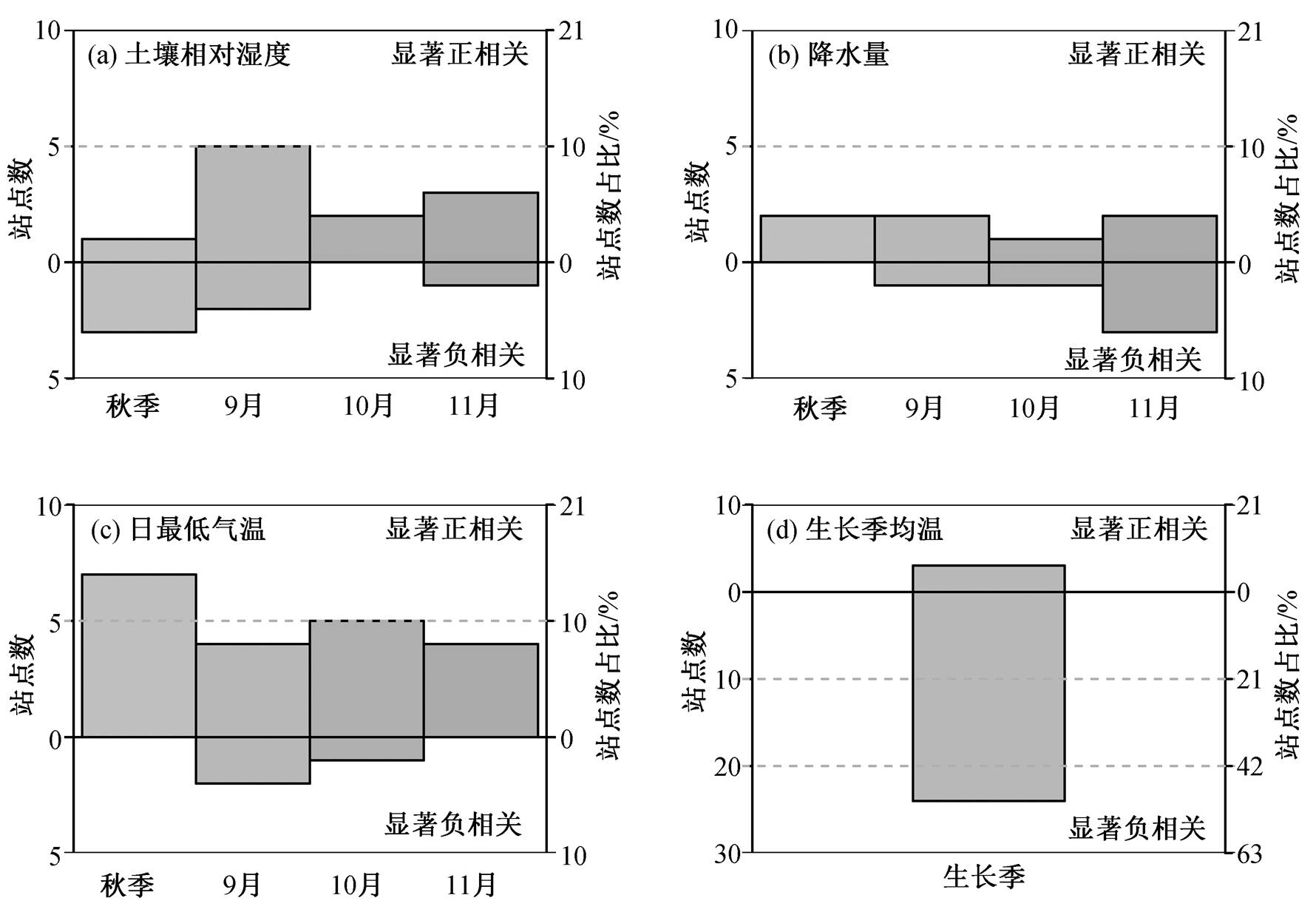
蒲公英黄枯普期与站点平均黄枯普期之前的土壤相对湿度以显著正相关关系为主, 即前期土壤相对湿度越高, 黄枯普期越晚, 其中与秋季、9 月、10 月和 11 月的平均土壤相对湿度显著正相关的站点数分别为 1, 5, 2 和 3 个, 显著负相关的站点较少, 分别为 3, 2, 0 和 1 个(图 4(a))。相比之下, 蒲公英黄枯普期与站点平均黄枯普期之前的秋季降水量显著相关的站点较少, 显著正相关的站点中秋季、9月、10 月和 11 月的站点数分别为 2, 2, 1和2 个, 显著负相关的站点数分别为 0, 1, 1 和 3 个(图 4(b))。由此可见, 与降水量相比, 土壤相对湿度数据可以更好地反映蒲公英黄枯普期的年际变化。
蒲公英黄枯普期与站点平均黄枯普期之前的秋季平均日最低气温的关系较为明显, 以显著正相关为主, 即秋季温度越低, 蒲公英黄枯普期发生越早。其中, 与秋季、9 月、10 月和 11 月最低气温呈显著正相关的站点分别为 7, 4, 5 和 4 个, 呈显著负相关的站点较少, 分别为0, 2, 1 和 0 个(图 4(c))。蒲公英黄枯普期与生长季期间均温的偏相关关系十分明显, 在 24 个站点(52%)生长季均温与黄枯普期呈显著负相关关系, 即蒲公英的生长季温度越高, 黄枯发生日期越早; 仅 3 个站点随着生长季均温的升高, 黄枯普期推迟(图 4(d))。因此, 秋季低温和生长季均温是控制黄枯普期的关键气象因素。
综上所述, 蒲公英黄枯普期与站点平均黄枯普期之前的土壤相对湿度(RSM), 生长季平均温度(Tgs)和秋季日最低气温(Tmin)的偏相关关系较强, 与前期降水量的偏相关关系较弱。此外, 降水量与土壤相对湿度存在较强的相关关系, 鉴于土壤水是植物水分的直接来源[24]且波动性小于降水, 较为稳定, 因此在水分因子中, 舍弃降水指标, 选取土壤相对湿度作为自变量, 最终利用站点平均黄枯普期之前的土壤相对湿度、秋季低温和生长季期间的平均温度建立单站的多元线性回归模型。
2.3 基于气象因子的蒲公英黄枯普期多元线性回归模拟
本文建立蒲公英黄枯普期与站点平均黄枯普期之前的秋季土壤相对湿度、秋季日最低温和生长季均温 3 个因子的多元线性统计模型, 并通过赤池信息量准则(AICc)筛选站点最优模型。在最优的47 个回归模型中, 有 30 个(64%)站点的模型通过显著性检验(p<0.05), 其中大多数站点的决定系数 R2高于 0.4, 表明通过气象因子建立的模型能较好地解释蒲公英黄枯普期的年际波动(表 2)。各站点影响蒲公英黄枯普期主要气象因子的空间分布见图5。
模型误差(RMSE)反映物候期估测的精准程度。在这 30 个站点的有效最优模型中, RMSE 的波动范围为 0.78~29.8 天, 模型 RMSE 小于 8 天的站点有 22 个(73%), 其中辽宁昌图站点的模拟误差最小, RMSE 为 0.78 天, 该模型的自变量为 11 月土壤相对湿度、9 月平均日最低气温、秋季平均日最低气温和生长季温度(表 2)。
在 30 个站点的有效最优模型中, 超过一半的站点(23 个, 77%)受两个及以上气象因子影响, 只有少数站点(7 个, 23%)的蒲公英黄枯普期只受单个气象因子影响。其中, 蒲公英黄枯普期同时受前期土壤相对湿度(RSM)、前期秋季低温(Tmin)和生长季期间均温(Tgs)影响的站点有 9 个, 同时受前期 RSM 和生长季期间 Tgs 影响的站点有 5 个, 同时受前期 Tmin 和生长季期间 Tgs 影响的站点有 5 个, 同时受前期 Tmin和前期 RSM 影响的站点有 4 个, 只受前期 RSM 影响的站点有 4 个, 只受前期 Tmin 影响的站点有 1 个, 只受生长季期间 Tgs 影响的站点有 2 个(表 2, 图 5)。由此可见, 受前期土壤相对湿度影响的站点最多(22 个), 其中 15个站点蒲公英黄枯普期与土壤相对湿度呈正相关关系; 受生长季均温影响的站点数次之(21 个), 全部站点黄枯普期与生长季期间平均温度呈负相关关系; 受前期日最低气温影响的站点数最少(19 个), 其中 16 个站点黄枯普期与前期日最低气温呈正相关关系。
综上所述, 在各站点有效最优模型中, 蒲公英黄枯普期与多年平均黄枯普期之前的土壤相对湿度和秋季最低气温主要呈正相关关系, 与生长季期间的平均温度呈负相关关系。这表明, 前期的土壤相对湿度越高, 前期秋季气温越高, 生长季期间的平均温度越低, 黄枯普期发生越晚, 且关键气象因子对站点蒲公英黄枯普期的影响不存在明显的空间分异特征。
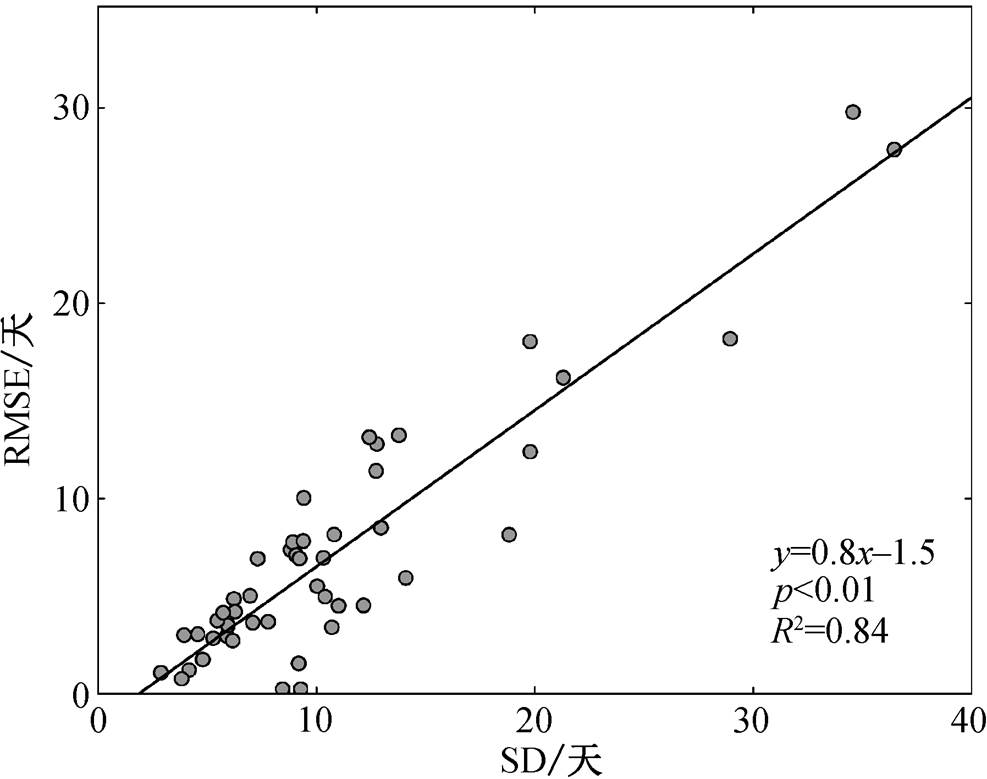
为了进一步揭示造成模型拟合效果差异性的原因, 我们分析 47 个站点最优模型 RMSE 与蒲公英黄枯普期时间序列标准差之间的关系。由图 6 可知, 站点模型的模拟精度(RMSE)与黄枯普期标准差(SD) 呈显著的正相关关系(p<0.01), SD 每增加一天, 模型的 RMSE 增加 0.8 天。这表明物候模型的模拟误差随物候年际波动的增大而增大, 即在物候年际波动越大的地方, 模型模拟的误差越大(图 6), 反映出秋季物候发生机理的复杂性和不确定性。
3 讨论
本研究结果表明, 中国东部温带区域蒲公英黄枯普期以推迟为主, 区域平均的推迟倾向率为 0.67天/年, 这与 Chen 等[30]基于 1990—2009 年站点蒲公英黄枯普期数据得到的结果(0.8 天/年)一致, 但数值略小。在站点尺度上, 蒲公英黄枯普期呈显著推迟趋势的站点占 46.8%, 略高于文献[30]中的站点百分数(37%)。由此可见, 线性趋势的计算结果高度依赖于分析的时段和地点。
对气象变量的趋势分析结果表明, 前期土壤相对湿度的升高、秋季最低气温的升高以及生长季期间平均温度的下降共同影响着 33 个站点黄枯普期的推迟。所有受土壤相对湿度影响的 25 个站点中, 有 20 个站点的前期土壤相对湿度呈现增加趋势; 所有受秋季低温影响的 16 个站点的秋季最低气温均呈现增加趋势; 所有受生长季期间平均温度影响的 25 个站点中, 有 13 个站点(52%)的生长季平均温度呈降低趋势。前期土壤相对湿度的降低和生长季平均温度的升高影响着 13 个站点黄枯普期的提前。所有受前期土壤相对湿度影响的 12 站点中, 有 10个站点的土壤相对湿度呈降低趋势; 所有受生长季均温影响的 11 个站点中, 有 10 个站点的生长季均温呈现升高趋势(表 3)。
根据站点的偏相关分析, 52%的站点生长季期间平均温度与蒲公英黄枯普期呈显著的负相关关系, 生长季期间平均温度越高的年份, 黄枯普期发生越早, 即叶片一旦展开后, 黄枯普期主要受展叶始期至黄枯普期之间平均温度的控制[33,45]。这可能是由于叶片的代谢和衰老速率会随着温度的升高而加速, 在较高的生长季温度下, 叶片会提前到达成熟, 从而使黄枯普期日期提前[31–32]。Liu 等[33]曾指出, 树木秋季叶变色期是长期的生长季均温和干旱日数以及短期的秋季低温刺激共同作用的结果。本文研究结果证明, 生长季均温也是草本植物秋季物候的关键影响因子, 其影响程度可能高于秋季低温, 从而扩展了对植物秋季叶片变色机理的认识。
表2 各站最优回归模型及其评价指标
Table 2 Optimum regression models and their evaluation indicators at each station

序号站点R2RRMSEMODEL 1内蒙额尔古纳右旗0.070.2611.97259.16+0.27T1 2黑龙江嫩江0.420.654.87345.63−18.38R2−3.39Tgs 3黑龙江德都0.420.65*1.23277.62+11.99R2 4黑龙江抚远0.600.77*3.42309.83+49.6R1−69.88R2 5黑龙江富锦0.100.327.37289.6+29.13R1−34.08R2 6黑龙江汤原0.450.677.77221.22+61.17R1+5.62R2 7黑龙江宝清0.040.1910.03277.38+12.77R1−7.94R2 8吉林前郭尔罗斯0.880.94**4.52536.58−76.07R2+0.66T1−14.42Tgs 9黑龙江勃利0.230.485.03269−14.61R2+0.29T1 10黑龙江虎林0.380.614.21332.38+17.29R2−4.14Tgs 11甘肃靖远0.680.83**4.54428.47+17.9R3−7.16Tgs 12甘肃定西0.800.90**3.65536.57+18.17R3+0.95T2−19.26Tgs 13内蒙武川0.740.86*8.16365.26+47.22R1−1.15T1+1.09T2 14内蒙察哈尔右翼中旗0.690.83*6.97330.46+7R2−0.96T1 15内蒙土默特左旗0.310.5618.05224.2+87.99R1 16山西河曲0.330.576.70443.49−1.58R1−8Tgs 17山西灵丘0.220.47*29.80141.11+1.32T1 18山西汾阳0.690.83**2.86364.77+32.18R2−17.5R3+0.26T4−3.52Tgs 19山西太谷0.810.90**5.94467+61.66R1+68.49R2−151.14R4+0.56T4−9.32Tgs 20山西昔阳0.230.483.06290.09+3.63R2+0.14T2 21宁夏固原0.210.4612.80265.69+51.96R1 22陕西延安0.580.76**18.19704.17−23.08Tgs 23山西临汾市0.650.81**5.52508.45−7.31R1+0.39T4−11.45Tgs 24山西安泽0.730.86**2.98369.41+0.2T1+0.1T3−4.63Tgs 25山西长治0.400.63**8.17441.18+16.53R1−9.07Tgs 26陕西洛川0.140.386.92362.93−4.69R1−5.31Tgs 27陕西韩城0.660.81**3.51409.66+0.3T3−4.57Tgs 28山西晋城0.620.79**12.40443.99−9.88R1+1.07T2−12.27Tgs 29内蒙通辽0.390.63**16.20481.01−52.28R1−9.76Tgs 30吉林梨树0.070.277.11278.78+12.09R2 31吉林长春0.970.99**1.56474.76−43.79R3−7.75Tgs 32辽宁昌图0.960.98**0.78314.98−30.92R3+0.54T1+0.24T4−3.47Tgs 33吉林延吉市0.600.77*8.51429.47−40.37R1+34.89R2−8.49Tgs 34内蒙太仆寺旗0.000.0113.14264.87+1.29R1 35辽宁新民0.490.704.98512.55+1.22R3−11.48Tgs 36辽宁本溪县0.440.663.01310.14+30.26R1−28.85R3 37吉林通化县0.710.84*2.73350.75+14.08R2+0.31T2−4.3Tgs 38辽宁海城0.380.62*27.88320.37+1.91T1−16.37Tgs 39河北唐山市0.760.87*3.64335.54+0.91R3+0.29T3 40山东烟台市福山区0.470.68*1.77295.62+20.07R1 41山东文登0.500.71**3.75388.59+0.29T4−5.38Tgs 42山东济阳0.790.89**3.69403.99+56.29R1−34.85R3−0.12T2−5.13Tgs 43山东潍坊市0.830.91**1.09287.59−3.42R1+0.08T2+0.15T4 44河南濮阳0.450.67**4.16409.55+0.21T3−4.62Tgs 45陕西永寿0.030.1713.24276.69+0.29T1 46河南郑州(河南农试站)0.270.52*7.83312.95+26.59R1 47河南南阳0.400.63**6.94503.37−8.22Tgs
说明: R2 为决定系数, R为复相关系数, MODEL为站点最优模型。土壤相对湿度RSMSEP, RSMOCT, RSMNOV, RSMSEP-NOV分别用R1, R2, R3和R4表示; 日最低气温TSEP, TOCT, TNOV, TSEP-NOV分别用T1, T2, T3和T4表示; * p<0.05, ** p<0.01。
此外, 蒲公英黄枯普期与站点平均黄枯普期之前的秋季各月日最低气温之间存在较好的正相关关系, 即前期秋季日最低温越高, 黄枯普期越晚, 与前人关于木本植物的研究结果[12,23,32,45–50]一致, 这说明草本植物与木本植物相似, 也存在秋季低温导致叶片光合速率下降、叶片中的叶绿素含量降低, 叶黄素显现的现象。另一方面, Hartmann 等[51]也曾指出, 秋季温度的增高会使得霜冻日数减少, 从而降低霜冻对叶片造成的损伤, 使黄枯普期推迟。
在水分因子的控制方面, 蒲公英黄枯普期年际变化与站点平均黄枯普期之前的土壤相对湿度年际变化的正相关关系比与降水量的关系更为密切, 即平均黄枯普期之前的土壤相对湿度越高, 蒲公英黄枯普期越晚。土壤相对湿度与蒲公英黄枯普期之间的正相关关系可能归因于秋季的水分胁迫, 即土壤水分的减少会抑制植物生长和光合作用的能力[52],并增加叶绿素分解的速率, 从而导致植物黄枯普期提前[53–55]。在以往的植被物候研究中, 由于土壤相对湿度数据较难获取, 多采用降水量数据作为水分因子[56], 但降水量并不是草本植物生长的直接影响因子, 它通过入渗到土壤中, 并经过根系吸收土壤水分, 间接地影响植物的生长发育。
表3 站点黄枯普期和关键气象因子线性趋势(1992—2012)
Table 3 Linear trend of common-brown date and dominant climate factors (1992–2012)
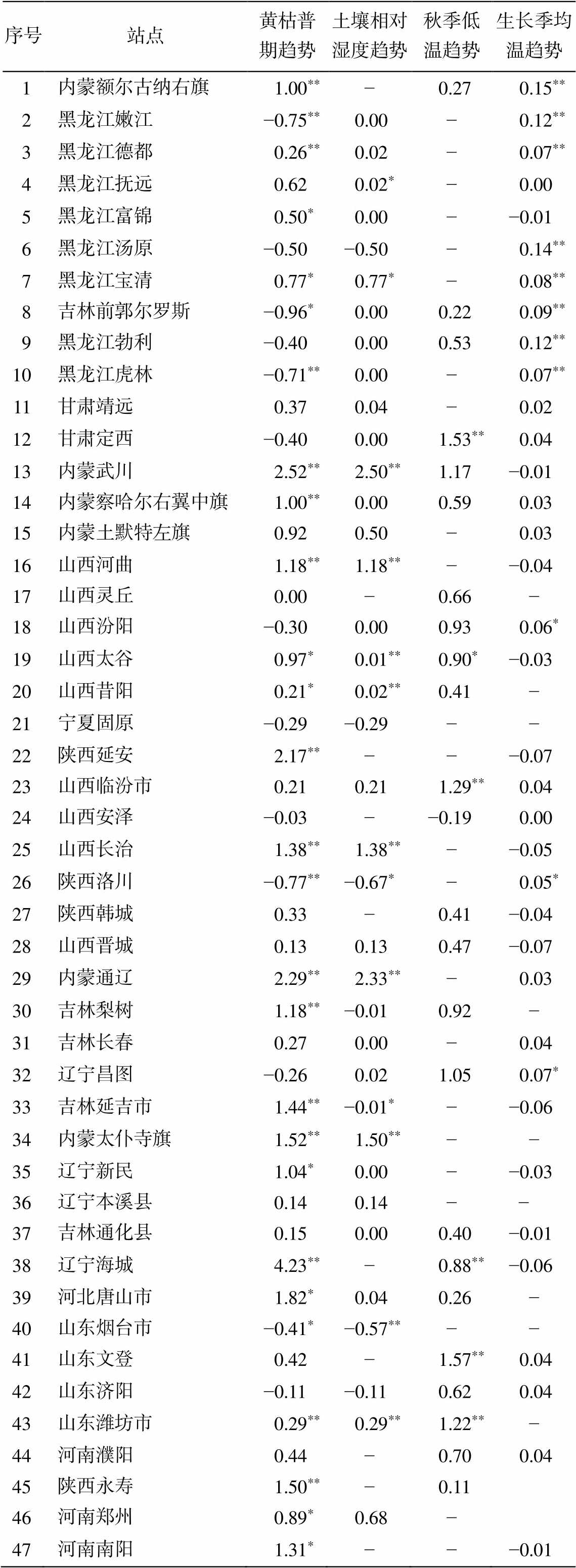
序号站点黄枯普期趋势土壤相对湿度趋势秋季低温趋势生长季均温趋势 1内蒙额尔古纳右旗1.00**−0.270.15** 2黑龙江嫩江−0.75**0.00−0.12** 3黑龙江德都0.26**0.02−0.07** 4黑龙江抚远0.620.02*−0.00 5黑龙江富锦0.50*0.00−−0.01 6黑龙江汤原−0.50−0.50−0.14** 7黑龙江宝清0.77*0.77*−0.08** 8吉林前郭尔罗斯−0.96*0.000.220.09** 9黑龙江勃利−0.400.000.530.12** 10黑龙江虎林−0.71**0.00−0.07** 11甘肃靖远0.370.04−0.02 12甘肃定西−0.400.001.53**0.04 13内蒙武川2.52**2.50**1.17−0.01 14内蒙察哈尔右翼中旗1.00**0.000.590.03 15内蒙土默特左旗0.920.50−0.03 16山西河曲1.18**1.18**−−0.04 17山西灵丘0.00−0.66− 18山西汾阳−0.300.000.930.06* 19山西太谷0.97*0.01**0.90*−0.03 20山西昔阳0.21*0.02**0.41− 21宁夏固原−0.29−0.29−− 22陕西延安2.17**−−−0.07 23山西临汾市0.210.211.29**0.04 24山西安泽−0.03−−0.190.00 25山西长治1.38**1.38**−−0.05 26陕西洛川−0.77**−0.67*−0.05* 27陕西韩城0.33−0.41−0.04 28山西晋城0.130.130.47−0.07 29内蒙通辽2.29**2.33**−0.03 30吉林梨树1.18**−0.010.92− 31吉林长春0.270.00−0.04 32辽宁昌图−0.260.021.050.07* 33吉林延吉市1.44**−0.01*−−0.06 34内蒙太仆寺旗1.52**1.50**−− 35辽宁新民1.04*0.00−−0.03 36辽宁本溪县0.140.14−− 37吉林通化县0.150.000.40−0.01 38辽宁海城4.23**−0.88**−0.06 39河北唐山市1.82*0.040.26− 40山东烟台市−0.41*−0.57**−− 41山东文登0.42−1.57**0.04 42山东济阳−0.11−0.110.620.04 43山东潍坊市0.29**0.29**1.22**− 44河南濮阳0.44−0.700.04 45陕西永寿1.50**−0.11 46河南郑州0.89*0.68− 47河南南阳1.31*−−−0.01
注: * p<0.05, ** p<0.01。
在全球变暖的情景下, 植物生长季平均温度的升高可能会抵消秋季低温升高对秋季物候的推迟作用, 导致秋季物候提前[33]。另一方面, 随着气温升高, 土壤蒸散发能力将增强, 使得土壤水分减少, 也会在一定程度上导致植物秋季物候的提前。
4 结论
本文利用中国东部温带区域 47 个站点 1992—2012 年蒲公英黄枯普期数据和气象数据进行时空统计分析, 得到如下结论。
1)所有站点平均蒲公英黄枯普期以 0.67 天/年的速率显著推迟(p<0.001); 单站蒲公英黄枯普期以推迟趋势为主, 没有明显的地域分异特征。
2)蒲公英黄枯普期的早晚主要受生长季期间平均温度、平均黄枯普期之前的秋季低温和土壤相对湿度的共同影响, 总体上表现为生长季平均温度越低, 秋季低温越高, 土壤相对湿度越高, 蒲公英黄枯普期发生越晚。作为影响蒲公英黄枯普期年际变化的水分因子, 前期土壤相对湿度的作用比降水量更为直接, 也更加重要。
3)通过生长季期间平均温度、平均黄枯普期之前的秋季低温和土壤相对湿度, 可以较好地模拟蒲公英黄枯普期的年际变化。蒲公英黄枯普期的年际波动幅度会影响模型模拟的效果, 在黄枯普期年际波动较大的地区, 模型模拟精度降低, 表明对秋季物候的模拟存在较大的不确定性。因此, 对草本植物秋季物候发生机理的揭示将成为今后研究的重要方向。
致谢 本文使用的物候数据由中国气象局气候资料室提供,在此表示感谢。
参考文献
[1] 竺可桢, 宛敏渭. 物候学. 北京: 科学出版社, 1973: 1–31
[2] Chen Xiaoqiu. Spatiotemporal Processes of Plant Phe-nology Simulation and Prediction. Berlin: Springer, 2017
[3] Root T L, Price J T, Hall K R, et al. Fingerprints of global warming on wild animals and plants. Nature, 2003, 421: 57–60
[4] Keeling C D, Chin J F S, Whorf T P. Increased acti-vity of northern vegetation inferred from atmospheric CO2 measurements. Nature, 1996, 382: 146–149
[5] Stocker T, Qin D, Plattner G, et al. IPCC, 2013: Climate change: the physical science basis, contri-bution of working group I to the fifth assessment report of the intergovernmental panel on climate change. Cambridge: Cambridge University Press, 2013, 18: 95–123
[6] Bradley N L, Leopold A C, Ross J, et al. Phenological changes reflect climate change in Wisconsin. Procee-dings of the National Academy of Sciences of the United States of America, 1999, 96(17): 9701–9704
[7] Piao Shilong, Ciais P, Friedlingstein P, et al. Net car-bon dioxide losses of northern ecosystems in response to autumn warming. Nature, 2008, 451: 49–52
[8] Chen Xiaoqiu, Xu Lin. Phenological responses of Ulmus pumila (Siberian Elm) to climate change in the temperate zone of China. International Journal of Biometeorology, 2012, 56(4): 695–706
[9] Linkosalo T, Lappalainen H K, Hari P. A comparison of phenological models of leaf bud burst and flo-wering of boreal trees using independent observations. Tree Physiology, 2008, 28(12): 1873–1882
[10] Siebert S, Ewert F. Spatio-temporal patterns of phenological development in Germany in relation to temperature and day length. Agricultural and Forest Meteorology, 2012, 152: 44–57
[11] Fu Y S, Piao S L, Vitasse Y, et al. Increased heat requirement for leaf flushing in temperate woody species over 1980–2012: effects of chilling, precipi-tation and insolation. Global Change Biology, 2015, 21(7): 2687–2697
[12] Ge Q S, W H J, Rutishauser T, et al. Phenolo- gical response to climate change in China: a meta- analysis. Global Change Biology, 2015, 21(1): 265–274
[13] Menzel A, Fabian P. Growing season extended in Europe. Nature, 1999, 397: 659
[14] Gill D S, Amthor J S, Bormann F H. Leaf phenology, photosynthesis, and the persistence of saplings and shrubs in a mature northern hardwood forest. Tree Physiology, 1998, 18(5): 281–289
[15] Fridley J D. Extended leaf phenology and the autumn niche in deciduous forest invasions. Nature, 2012, 485: 359–362
[16] Richardson A D, Andy Black T, Ciais P, et al. Influ-ence of spring and autumn phenological transitions on forest ecosystem productivity. Philosophical Tran-sactions of the Royal Society B: Biological Sciences, 2010, 365: 3227–3246
[17] Warren M S, Hill J K, Thomas J A, et al. Rapid responses of British butterflies to opposing forces of climate and habitat change. Nature, 2001, 414: 65–69
[18] Walther G R, Post E, Convey P, et al. Ecological responses to recent climate change. Nature, 2002, 416: 389–395
[19] Richardson A D, Keenan T F, Migliavacca M, et al. Climate change, phenology, and phenological control of vegetation feedbacks to the climate system. Agri-cultural and Forest Meteorology, 2013, 169: 156–173
[20] Mcewan R W, Mccarthy B C. Phenology: an integr-ative environmental science. Journal of the Torrey Botanical Society, 2005, 132 (1): 170–171
[21] Wang Xuhui, Piao Shilong, Xu Xiangtao, et al. Has the advancing onset of spring vegetation green-up slowed down or changed abruptly over the last three decades?. Global Ecology and Biogeography, 2015, 24(6): 621–631
[22] Jeong S J, Chang-Hoi H O, Gim H J, et al. Phenology shifts at start vs. end of growing season in temperate vegetation over the Northern Hemisphere for the period 1982–2008. Global Change Biology, 2011, 17(7): 2385–2399
[23] Yang Yuting, Guan Huade, Shen Miaogen, et al. Changes in autumn vegetation dormancy onset date and the climate controls across temperate ecosystems in China from 1982 to 2010. Global Change Biology, 2015, 21(2): 652–665
[24] 刘慧. 基于土壤水分和气温的草地返青模型及植被干旱研究[D]. 北京: 清华大学, 2012
[25] 张新时. 草地的生态经济功能及其范式. 科技导报, 2000(8): 3–7
[26] Sun Zhigang, Wang Qinxue, Xiao Qingan, et al. Di-verse responses of remotely sensed grassland pheno-logy to interannual climate variability over frozen ground regions in Mongolia. Remote Sensing, 2015, 7(1): 360–377
[27] Sparks T H, Jeffree E P, Jeffree C E. An examination of the relationship between flowering times and tem-perature at the national scale using long-term pheno-logical records from the UK. International Journal of Biometeorology, 2000, 44(2): 82–87
[28] Lambers H, Chapin III F S, Pons T L. Plant Physio-logical Ecology. Berlin: Springer, 2008
[29] Tanino K K, Kalcsits L, Silim S, et al. Temperature-driven plasticity in growth cessation and dormancy development in deciduous woody plants: a working hypothesis suggesting how molecular and cellular function is affected by temperature during dormancy induction. Plant Molecular Biology, 2010, 73(1/2): 49–65
[30] Chen Xiaoqiu, Tian Youhua, Xu Lin. Temperature and geographic attribution of change in the Taraxacum mongolicum growing season from 1990 to 2009 in eastern China’s temperate zone. International Journal of Biometeorology, 2015, 59(10):1437–1452
[31] Worrall J. Temperature effects on bud-burst and leaf-fall in subalpine larch. Journal of Sustainable Fores-try, 1993, 1(2): 1–18
[32] Xie Yingying, Wang Xiaojing, Silander J A. Deci-duous forest responses to temperature, precipitation, and drought imply complex climate change impacts. Proceedings of the National Academy of Sciences, 2015, 112(44): 13585–13590
[33] Liu Guohua, Chen Xiaoqiu, Zhang Qinghua, et al. Antagonistic effects of growing season and autumn temperatures on the timing of leaf coloration in winter deciduous trees. Global Change Biology, 2018, 24(8): 3537–3545
[34] 陈效逑, 李倞. 内蒙古草原羊草物候与气象因子的关系. 生态学报, 2009, 29(10): 5280–5290
[35] Van Leeuwen W J D, Davison J E, Casady G M, et al. Phenological Characterization of desert sky island vegetation communities with remotely sensed and climate time series data. Remote Sensing, 2010, 2(2): 388–415
[36] Villegas J C, Breshears D D, Zou C B, et al. Sea-sonally pulsed heterogeneity in microclimate: pheno-logy and cover effects along deciduous grassland–forest continuum. Vadose Zone Journal, 2010, 9(3): 537–547
[37] Prevéy J S, Seastedt T R. Seasonality of precipitation interacts with exotic species to alter composition and phenology of a semi-arid grassland. Journal of Eco-logy, 2015, 102(6): 1549–1561
[38] Moore L M, Lauenroth W K, Bell D M, et al. Soil water and temperature explain canopy phenology and onset of spring in a semiarid steppe. Great Plains Research, 2015, 25(2): 121–138
[39] 中华人民共和国气候图集. 北京: 地图出版社, 1979
[40] 国家气象局. 农业气象观测规范. 北京: 气象出版社, 1993: 136–141
[41] Mann H B. Nonparametric tests against trend. Econo-metrica, 1945, 13(3): 245–259
[42] Kendall M G. Rank correlation methods. British Journal of Psychology, 1990, 25(1): 86–91
[43] Siniscalco C, Caramiello R, Migliavacca M, et al. Models to predict the start of the airborne pollen sea-son. International Journal of Biometeorology, 2015, 59(7): 837–848
[44] Chuine I, Bonhomme M, Legave J M, et al. Can phenological models predict tree phenology accura-tely in the future? The unrevealed hurdle of endodor-mancy break. Global Change Biology, 2016, 22(10): 3444–3460
[45] Estrella N, Menzel A. Responses of leaf colouring in four deciduous tree species to climate and weather in Germany. Climate Research, 2006, 32(3): 253–267
[46] Delpierre N, Dufrêne E, Soudani K, et al. Modelling interannual and spatial variability of leaf senescence for three deciduous tree species in France. Agricul-tural and Forest Meteorology, 2009, 149(6/7): 938–948
[47] Vitasse Y, Porté A J, Kremer A, et al. Responses of canopy duration to temperature changes in four tem-perate tree species: relative contributions of spring and autumn leaf phenology. Oecologia, 2009, 161 (1): 187–198
[48] Archetti M, Richardson A D, O'Keefe J, et al. Pre-dicting climate change impacts on the amount and duration of autumn colors in a New England forest. PLoS One, 2013, 8(3): e57373
[49] Koike T. Autumn coloring, photosynthetic perform-ance and leaf development of deciduous broad-leaved trees in relation to forest succession. Tree Physiology, 1990, 7(1/2/3/4): 21–32
[50] Lim P O, Kim H J, Gil Nam H. Leaf senescence. Annual Review of Plant Biology, 2007, 58(1): 115–136
[51] Hartmann D L, Tank A M G K, Rusticucci M, et al. Observations: atmosphere and surface // Stocker T F, Qin D, Plattner G K, et al. Climate Change 2013: The Physical Science Basis, Contribution of Working Group I to the Fifth Assessment Report of the Inter-governmental Panel on Climate Change. Cambridge: Cambridge University Press, 2013: 159–154
[52] Tezara W, Mitchell V J, Driscoll S D, et al. Water stress inhibits plant photosynthesis by decreasing coupling factor and ATP. Nature, 1999, 401: 914–917
[53] Munné-Bosch S, Alegre L. Die and let live: leaf sene-scence contributes to plant survival under drought stress. Functional Plant Biology, 2004, 31(3): 203–216
[54] Anderegg W R L, Plavcová L, Anderegg L D L, et al. Drought’s legacy: multiyear hydraulic deterioration underlies widespread aspen forest die-off and por-tends increased future risk. Global Change Biology, 2013, 19(4): 1188–1196
[55] Dreesen F E, De Boeck H J, Janssens I A, et al. Do successive climate extremes weaken the resistance of plant communities? An experimental study using plant assemblages. Biogeosciences, 2014, 11(1): 109–121
[56] Yang Xi, Mustard J F, Tang Jianwu, et al. Regional scale phenology modeling based on meteorological records and remote sensing observations. Journal of Geophysical Research Biogeosciences, 2015, 117: G03029
Effects of Air Temperature and Soil Moisture on Common Brown-Down Date of Taraxacum mongolicum in Eastern China’s Temperate Zone
XUE Tingting, ZHAO Yuan, CHEN Xiaoqiu†, JIANG Mengdi, LIANG Boyi
College of Urban and Environmental Sciences, Laboratory for Earth Surface Processes of the Ministry of Education, Peking University, Beijing 100871; † Corresponding author, E-mail: cxq@pku.edu.cn
Abstract In order to reveal temporal variations of autumn phenology of herbaceous plants and their climatic attributions, we analyzed changing trend of the common brown-down date of Taraxacum mongolicum and simulated interannual variation of the common brown-down date using plant phenological and meteorological data at 47 phenological stations in eastern China’s temperate zone from 1992 to 2012 and statistical methods. Results show that 1) the common brown-down date of Taraxacum mongolicum was delayed at 34 stations from 1992 to 2012, of which significant delaying trends were observed at 22 stations.By contrast, the common brown-down date of Taraxacum mongolicum advanced at 13 stations, of which significant advancing trends were detected at five stations. 2) The common brown-down date of Taraxacum mongolicum at individual stations correlates mainly negative with average temperature during the growing season (the period from leaf unfolding to common brown-down) but positive with relative soil moisture and daily minimum temperature in autumn. 3) Among the 30 effective optimal models at individual stations (p<0.05), the common brown-down date of Taraxacum mongolicum was influenced by relative soil moisture at 22 stations, by daily minimum temperature at 19 stations and by average temperature during the growing season at 21 stations. Moreover, simulation accuracy of the model was signifi-cantly affected by interannual variation of the common brown-down date of Taraxacum mongolicum, namely, the smaller the interannual variation of the common brown-down date at a station, the higher the simulation accuracy of the model.
Key words climate change; autumn phenology of herbaceous plant; linear trend; growing season mean temperature; autumn low temperature; soil moisture
doi: 10.13209/j.0479-8023.2019.127
国家自然科学基金(41471033, 41771049)资助
收稿日期: 2019–01–03;
修回日期: 2019–04–25

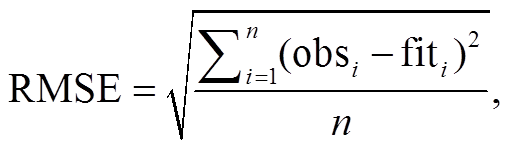 (1)
(1)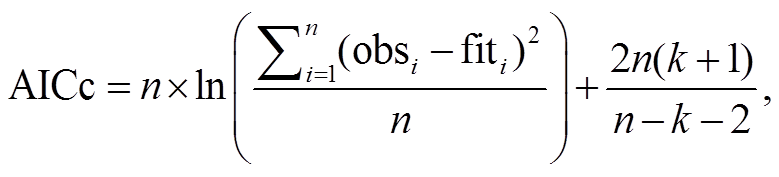 (2)
(2)