多株吡啶高效降解菌的降解性能与生物膜形成特性的研究
赵小希1 熊富忠1 温东辉1,† 李琪琳2
1.北京大学环境科学与工程学院, 北京 100871; 2.College of Civil and Environmental Engineering, Rice University, Texas 77005; †通信00作者, E-mail: dhwen@pku.edu.cn
摘要 以吡啶为目标污染物, 考察从焦化废水处理系统中分离的 12 株高效吡啶降解菌对吡啶的降解性能和生物膜形成特性, 以期为在废水处理系统中构建降解型生物膜提供理论参考。结果表明: 12 株菌都具有较高的吡啶降解活性, 其中代表性菌株 Pseudomonas sp. ZX01 和 Arthrobacter sp. ZX07 降解吡啶的最适温度是 35ºC, 最适 pH 是 7.0, 在初始吡啶浓度为 100~2000mg/L 的范围内, 降解率均达到 100%。不同菌株的生物膜形成能力差异明显, 胞外蛋白分泌量、胞外多糖分泌量和由鞭毛参与的游动能力与各株菌的生物膜形成能力之间存在显著的正相关关系。
关键词 吡啶降解菌; 环境因子; 生物膜; 胞外聚合物
焦化废水是煤化工企业产生的一种污染物浓度高、成分复杂的综合性工业废水, 极难被处理[1]。焦化废水中除含有高毒性的氰化物、硫化物和氨氮等无机污染物之外, 还有大量的难降解有机污染物, 如酚类、芳香族化合物以及含氧、硫、氮等杂环化合物[2]。吡啶就是其中一种典型的氮杂环化合物, 虽然化学结构简单, 但却具有明显的“三致”(致癌、致畸和致突变)作用, 易在生物体内富集, 对人体健康以及生态系统产生危害[3]。因此, 长期以来诸多研究探索开发对吡啶的高效处理技术。
目前, 用于处理含吡啶废水的工艺主要分为物理化学法和生物处理法两类。前者包括吸附法、高级氧化技术(如 Fenton 氧化及臭氧氧化等)。与物理化学方法相比, 生物法具有处理成本低、降解较为彻底且不产生二次污染的优势, 因此应用更加广泛, 其中以高效降解菌筛选分离为基础的生物强化技术最受关注。从土壤、废水和活性污泥等各种环境介质中分离吡啶高效降解菌的研究已有大量报道, 如Micrococcus luteus[4]、Pseudomonas putida[5]、Pa-racoccus sp.[6]和 Shinella zoogloeoides[7-8]等, 这些菌株的获得大大地拓展了吡啶的生物处理途径, 但仍有更加多样化的高效菌种资源值得发现和利用。
高效降解菌直接投加进生物处理反应器中往往会逐渐流失[9], 采用生物膜反应器可显著地提高菌群的稳定性和处理效果[10], 其中的关键就是使降解菌更多、更快地以生物膜形式附着生长在载体表面。细菌形成结构有序、功能分化的生物膜后, 可以帮助内部的细菌个体抵御外部恶劣条件的冲击[11]。生物膜的形成受多种因素的影响和机制的调控, 如群体感应效应(quorum sensing, QS)[12]、细胞第二信使环鸟苷二磷酸(c-di-GMP)[13]、胞外聚合物(extracellular polymeric substances, EPS)(如蛋白质和多糖等)的分泌[14]、细菌细胞的附属结构(鞭毛、纤毛和菌毛等)[15]、运动能力[16]和细胞表面疏水 性[17]等。因此, 探究高效降解菌的生物膜形成能力和影响因素, 对于提升成膜效率、保持降解菌活性和处理系统的稳定性具有重要意义。
本研究首先从焦化废水处理系统中分离出一系列高效吡啶降解菌, 探究各菌株的吡啶降解性能及其影响因素, 然后比较不同菌株的生物膜形成能力, 并识别其与相关生化特征(细胞疏水性、胞外蛋白分泌、胞外多糖分泌、运动能力等)的关系。研究结果可为在废水处理系统中人工构建具有吡啶降解功能的生物膜提供微生物学理论依据。
1 材料与方法
1.1 主要试剂
吡啶购自北京化工厂(中国), 胰蛋白胨和酵母提取物购自 Oxoid (英国), 琼脂购自 Sigma-Aldrich (日本), 营养肉汤(NB)培养基购自奥博星公司(中国), 结晶紫染液和牛血清蛋白购自索莱宝公司(中国)。所用化学试剂均为分析纯及以上级别。
1.2培养基
菌株纯化分离和生物降解实验中, 采用改良的无机盐培养基(mineral salt medium, MSM)[18]。菌株富集培养和生物膜培养实验中, 采用 Luria-Bertani (LB)液体培养基[19]。制作相应的固体培养基时, 需添加 1.5%~2% (质量体积比, 下同)的琼脂。所有培养基及盛装器皿在使用前均以 121ºC, 1.05kg/cm2 的高温高压蒸汽灭菌 20 min 以上。
1.3 菌株来源
实验选用的 12 个菌株是从首钢京唐焦化有限公司的焦化废水处理系统的好氧单元活性污泥中分离纯化获得, 都能以吡啶为唯一碳、氮源进行生长繁殖, 是潜在的吡啶高效降解菌株, 命名为 ZX 系列(从 ZX01 至 ZX12)菌株。基于 16SrRNA 基因片段的序列比对结果显示, ZX02 和 ZX07 属于节杆菌属(Arthrobacter sp.), 其余 10 个菌株都属于假单胞菌属(Pseudomonas sp.), 各菌株的 GenBank 序列登录号按顺序分别为 MG760359~MG760370。
1.4 吡啶降解实验
对降解菌降解性能的鉴定主要是考察其对吡啶的降解动力学及影响因素。首先富集培养菌株: 各菌株接种至 LB 液体培养基中, 置于 37ºC, 180 r/min条件下过夜培养 16~18h。取培养后的菌液, 通过6000r/min 高速离心 5min, 弃去上清液, 清洗、离心获得菌体。降解体系设置在含 200 mL MSM 培养基的锥形瓶中, 投加菌体使初始菌密度为 OD600= 0.1, 吡啶初始浓度、培养温度和培养基 pH 等根据实验要求确定。每个降解体系设置 3 个平行实验, 置于 180 r/min摇床中培养。
每隔 2~4h 用无菌注射器取样 1mL, 经 0.22mm有机系滤头过滤。另外, 即时测定培养液的菌密度OD600, 作为菌体生长量的表征。采用高效液相色谱仪(岛津 LC-20AT)分析吡啶浓度, 所用色谱柱的型号为 Diamonsil C18 反相柱, 5mm×250mm×4.6mm (DIKMA, 中国)。紫外检测器波长为 254nm, 流速为 1mL/min, 流动相比例为甲醇:水=1:1, 进样体积为 10 mL。
首先考察在吡啶初始浓度为 500mg/L, 培养条件为 30ºC, 180 r/min, pH=7.0 时, 各菌株对吡啶的降解特性, 然后从中选取具有代表性的菌株, 考察培养温度、培养基 pH 和吡啶初始浓度对降解过程的影响: 1)温度设置 4 个水平, 分别是 20, 25, 30和 35ºC, 吡啶初始浓度为 500 mg/L, 初始 pH 为7.0; 2) pH 设置 5 个水平, 分别是 3.0, 5.0, 7.0, 9.0 和 11.0, 吡啶初始浓度为 500 mg/L, 温度为 30ºC; 3)吡啶初始浓度设置 5 个水平, 分别是 100, 300, 500, 1000, 2000 和3000 mg/L, 温度为 30ºC, 初始 pH 为 7.0。
1.5 微孔板生物膜培养与半定量方法
采用较常用的微孔板生物膜培养与结晶紫染色定量法[20-21], 并进行一定的改良。用 LB 培养基稀释富集离心后的菌体至初始菌密度为 OD600=0.5。将1mL 菌液加入 12 孔板(Corning, 美国)各孔中, 用封口膜封好后于特定实验条件下培养。培养完成后, 每孔吸取 125mL 菌悬液于 96 孔板, 测定 OD600 值, 以表征浮游态细菌的生长量。结晶紫-乙醇处理生物膜后, 以 125mL 溶液的 OD595 值表征生物膜的形成量。
生物膜具体处理步骤: 孔板缓慢浸没于去离子水液面下, 轻晃, 洗去未附着的细胞, 于 60ºC 烘箱干燥 1h; 每孔加入 2mL 0.1%结晶紫染料染色 25min, 以上述方法洗去染料并于 35ºC 干燥; 加入 4mL95%乙醇, 置于 85r/min 摇床中 45min, 充分溶解附着在细胞上的结晶紫; 从每孔中吸取 125 μL溶液, 转移到96孔板中测定OD595值。
1.6 细胞生化特性测试
1.6.1细胞疏水性的测定
通过由水和对二甲苯组成的两相体系测定细胞疏水性[22]。过夜培养菌株, 离心清洗后, 菌悬液OD600 调至约为 1。加入适量对二甲苯于 1.2 mL 菌液, 使对二甲苯终浓度分别为 4%, 8%和 20%(每个浓度设置 3 个平行实验)。将溶液振荡混合 60s, 静置至水相和有机相分离, 移取 125μL 水相液体至96 孔板中, 测定 OD600。细胞疏水性用吸附到对二甲苯中的细胞百分比表征, 即原菌液的 OD600 与混合后两相体系中水相的 OD600 之差占原菌液OD600 的比例。
1.6.2胞外蛋白与胞外多糖分泌量的测定
首先提取菌株的 EPS[23]: 刮取在 LB 平板上经37oC 恒温培养 24h 的菌苔 0.5g, 以质量体积比 1:15将菌苔与 0.14mol/L 的 NaCl 溶液于 15mL 离心管混合, 剧烈振荡 1h。12000g 转速下离心 30min, 上清液重复离心一次。最后的上清液用 0.22mm 滤膜过滤, 得到除去细胞的 EPS 提取液。采用硫酸-苯酚法测定多糖浓度[24], 采用 BCA 法测定蛋白浓度[25]。
1.6.3运动能力测试
对降解菌分别考察由鞭毛或菌毛参与介导的3 种运动能力, 即游动(swimming)、群集(swarming)和蹭行(twitching)运动能力[26], 操作步骤见表 1。
2 结果与讨论
2.1 吡啶降解性能及环境影响因素
2.1.1吡啶降解动力学
12 株降解菌都可利用吡啶作为唯一碳、氮源进行生长, 在初始投菌量为 OD600=0.10, 初始吡啶浓度为 500mg/L, 初始 pH 为 7.0, 温度为 30oC, 摇床转速为 180r/min的条件下, 对吡啶的降解效率最终均能达到 99%以上, 各菌降解阶段符合零级反应动力学方程(表 2)。
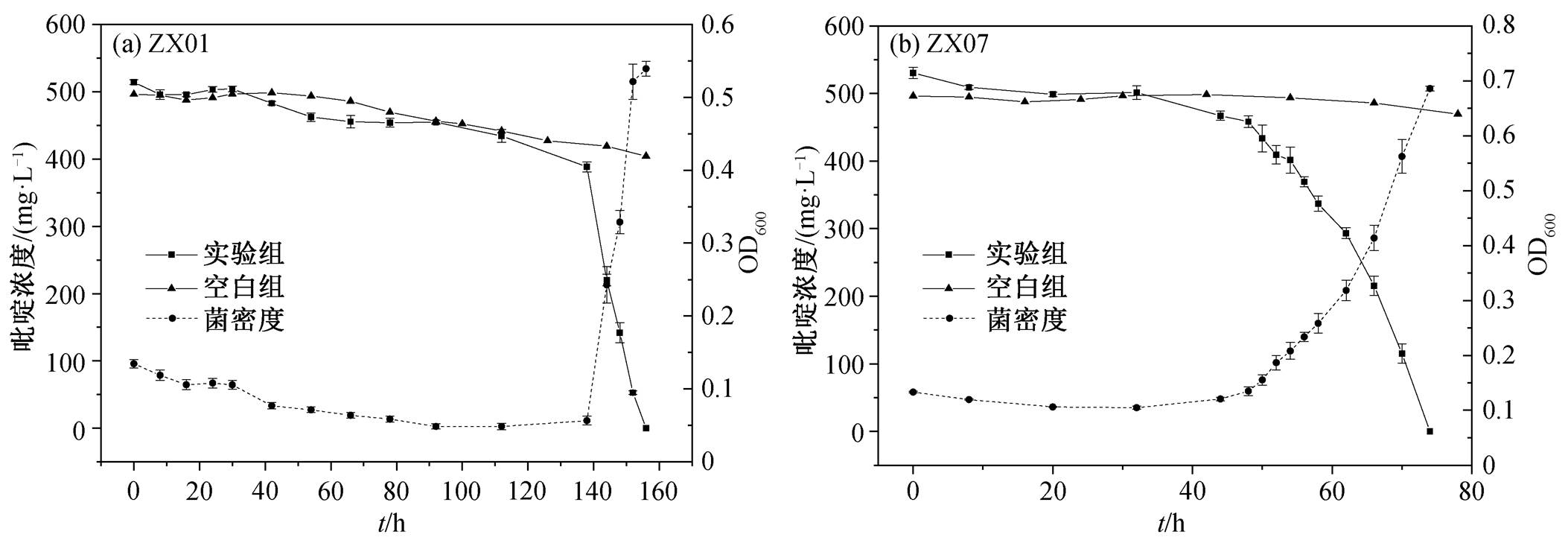
从表 2 还可看出, Pseudomonas sp. ZX01 在 Pseu-domonas 属的 10 株降解菌中, 对吡啶的降解速率常数最高, 即吡啶降解活性最强; Arthrobacter sp. ZX07 在 Arthrobacter 属的 2 株降解菌中, 对吡啶的降解速率常数最高。因此, 后续选择 ZX01 和 ZX07作为这两个菌属的代表性菌株, 对它们的降解特性进行重点分析和讨论。两株菌的生长曲线都由抑制期、对数生长期、稳定生长期和衰亡期组成。如图 1(a)所示, ZX01 抑制期较长, 约为112h; 进入快速降解期后, 菌量以指数形式增长, 降解反应速率常数为 21.69mg/(L·h); 培养至 156h, 吡啶的降解率几乎达到 100%; 随后因剩余吡啶浓度低, ZX01缺乏代谢所必需的营养物质, 进入内源呼吸阶段, 一些菌体开始死亡。在相同的初始条件下, ZX07(图 1(b))对吡啶的适应能力更强, 抑制期相对更短(48h); 74h 的降解率达到 100%, 降解反应速率常数为 17.48mg/(L·h)。
表1 细菌运动能力测试方法
Table 1 Methods for motility test

运动能力平板准备接种与观察 游动能力胰蛋白胨 10 g/L, NaCl 5 g/L, 琼脂糖 0.3 %, 吡啶200 mg/L用牙签挑取单菌落, 接种于平板中央, 封口膜密封, 30°C培养 24~48 h, 观察并测定运动直径 群集运动能力NB 培养基 8g/L, 葡萄糖 5g/L, 琼脂0.5 %, 吡啶200 mg/L平板过夜干燥后, 用牙签挑取来自游动能力平板的单菌落, 接种于平板中央, 30°C 培养24~48 h, 观察并测定运动直径 蹭行运动能力LB 半固体培养基, 琼脂1 %, 吡啶 200 mg/L用牙签挑取单菌落, 穿透培养基, 使细菌介于培养基与培养皿界面生长, 37°C 培养 24 h, 刮去培养基, 结晶紫染色, 观察并测定运动直径
表2 各菌株降解反应的零级动力学模型拟合
Table 2 Kinetic models of the pyridine-degrading processes by 12 strains

菌株降解动力学方程k/(mg·L−1·h−1)R2 ZX01y = −21.69x+3361.921.690.9844 ZX02y = −16.65x+1898.816.650.9062 ZX03y = −20.19x+1974.320.190.9605 ZX04y = −17.56x+1539.617.560.9375 ZX05y = −15.47x+1677.815.470.9104 ZX06y = −13.82x+1765.213.820.9374 ZX07y = −17.48x+1338.917.480.9653 ZX08y = −14.65x+1677.814.650.9173 ZX09y = −18.24x+1736.218.240.9389 ZX10y = −17.53x+1719.517.530.9775 ZX11y = −18.31x+1730.218.310.8736 ZX12y = −13.12x+1797.513.120.9720
俞蓉等[27]在利用副球菌 Paracoccus denitrifi-cans W12 降解吡啶时, 发现其降解过程符合零级反应动力学模型, 并且初始吡啶浓度越高, 降解期的速率常数越大。晋婷婷等[8]从一家煤焦化厂废水处理系统中分离得到一株吡啶降解菌 Shinella zoog-loeoides JB27, 发现其在初始吡啶浓度为 500 和 1000mg/L 时, 降解过程符合零级反应, 速率常数约为6.9 和 10.4mg/(L·h)。宋秀兰等[28]将一株胶质红环菌投入初始吡啶浓度为 300mg/L 的反应体系中, 经拟合后降解过程符合零级反应, 速率常数为 12.599mg/(L·h)。多数吡啶降解菌对吡啶的降解动力学符合零级反应动力学模型, 与本研究的结果相一致。此外, 与上述各菌株相比, 本研究筛选的菌株降解速率较高, 属于吡啶降解活性较强的菌种。
2.1.2温度对吡啶降解的影响
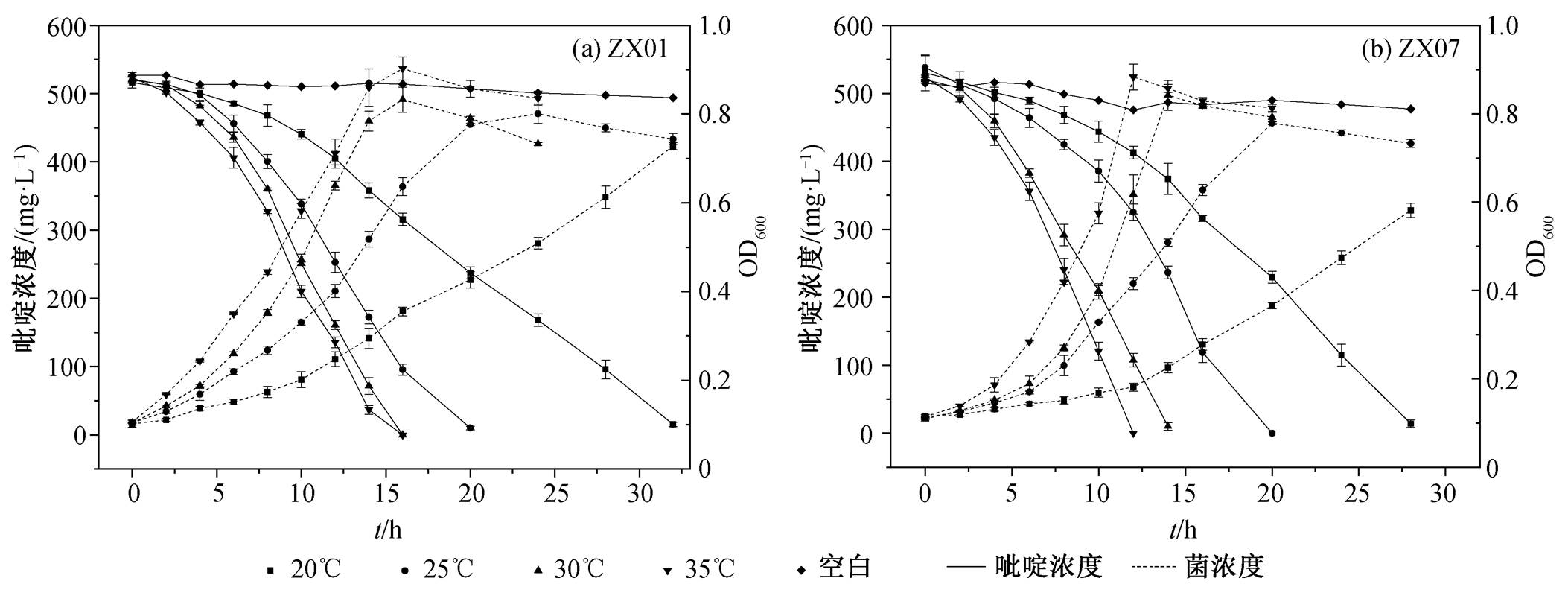
在 ZX01 和 ZX07 对吡啶的降解过程中, 有一段较长的抑制期。因此, 在环境因子对吡啶降解的影响实验中, 先将菌株在含 500mg/L 吡啶的溶液中驯化适应一段时间后, 再离心清洗菌体, 用于降解实验。温度对 ZX01 和 ZX07 降解吡啶的影响分别如图 2(a)和(b)所示, 在不加降解菌的空白对照组中, 32h 吡啶减少量小于7%。
以 ZX01 为例, 在 4 种温度条件下, 随着吡啶浓度的下降, 菌密度先增长至最大值, 后因缺乏营养, 进入内源呼吸阶段而有所下降。温度为 35oC 时, 菌密度增长量最大, OD600 最高可达 0.9, 吡啶降解也最快; 30oC 时的菌密度增长和吡啶降解速率略低于35oC; 25oC 和 20oC时的细菌生长和吡啶降解速率明显降低。在 30~35oC 的培养温度下, ZX01 在16 h 左右实现对吡啶的完全降解; 而在 25oC 和 20oC 时要实现完全降解, 分别需要 20 和 32 h。在相同实验条件下, ZX07 表现出与 ZX01 相似的降解规律: 温度为 35, 30, 25 和 20oC 时, ZX07 要实现对吡啶的完全降解, 分别需要 12, 14, 20 和 28 h。由此可见, 在实验设定的温度范围内, 温度越高, 越有利于降解菌对吡啶的降解, 原因可能是促进了降解相关酶的活性。两株菌降解吡啶的最适温度均为 35oC。
2.1.3pH对吡啶降解的影响
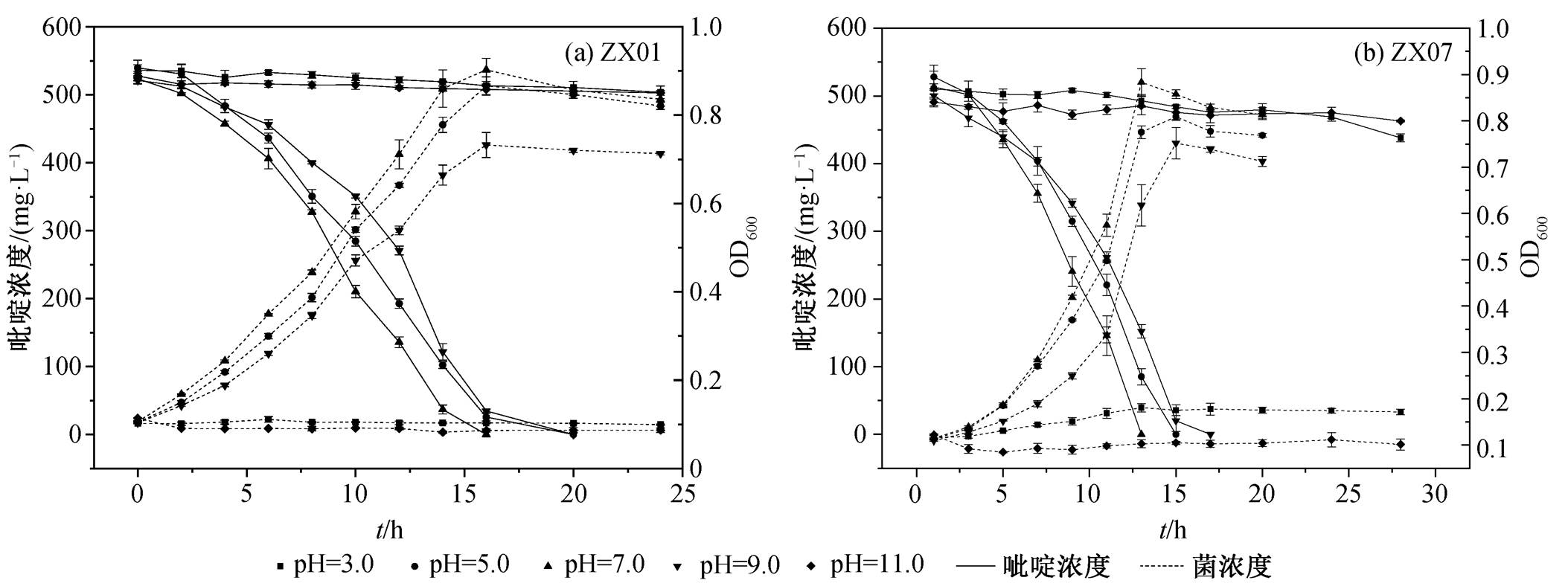
用 NaOH 和 HCl 调整降解体系的初始 pH 分别为 3.0, 5.0, 7.0, 9.0和11.0, pH 对 ZX01 和 ZX07 降解吡啶的影响分别如图 3(a)和(b)所示。
以 ZX01 为例, 实验条件下菌株的 pH 适应范围是 5.0~9.0, 在此范围内对吡啶有较高的降解活性。反应进行至 16h 时, pH 为 7.0 的溶液中吡啶降解率几乎达到 100%, 在 pH 为 5.0 和 9.0 的溶液中, 吡啶于 20h 达到完全降解。当 pH 为 3.0 或 11.0 时, 吡啶浓度基本上保持不变, 菌密度也未增长, 说明 ZX01在培养过程中未能利用吡啶进行生长繁殖, 甚至部分菌体死亡。原因可能是 pH 影响酶的离解过程, 导致菌株体内降解酶催化活性的降低[29]; 同时, 环境过酸或过碱也会破坏细胞表面电位, 使细胞结构发生改变[30]。在相同的培养条件下, ZX07 和 ZX01在不同 pH 条件下降解吡啶的表现相似。ZX07 在pH 为 7.0, 5.0 和 9.0 时, 分别在 13, 15 和 17h 达到几乎 100%的吡啶降解率; 而在 pH 为 3.0 或 11.0 时, 菌株基本上无法生长。由此可见, 过酸或过碱的环境均不利于 ZX01 和 ZX07 的生长和繁殖, 对吡啶降解有明显的抑制作用; 这两株菌降解吡啶的适宜pH范围为5.0~9.0, 最适 pH 为 7.0。
2.1.4 初始吡啶浓度对吡啶降解的影响
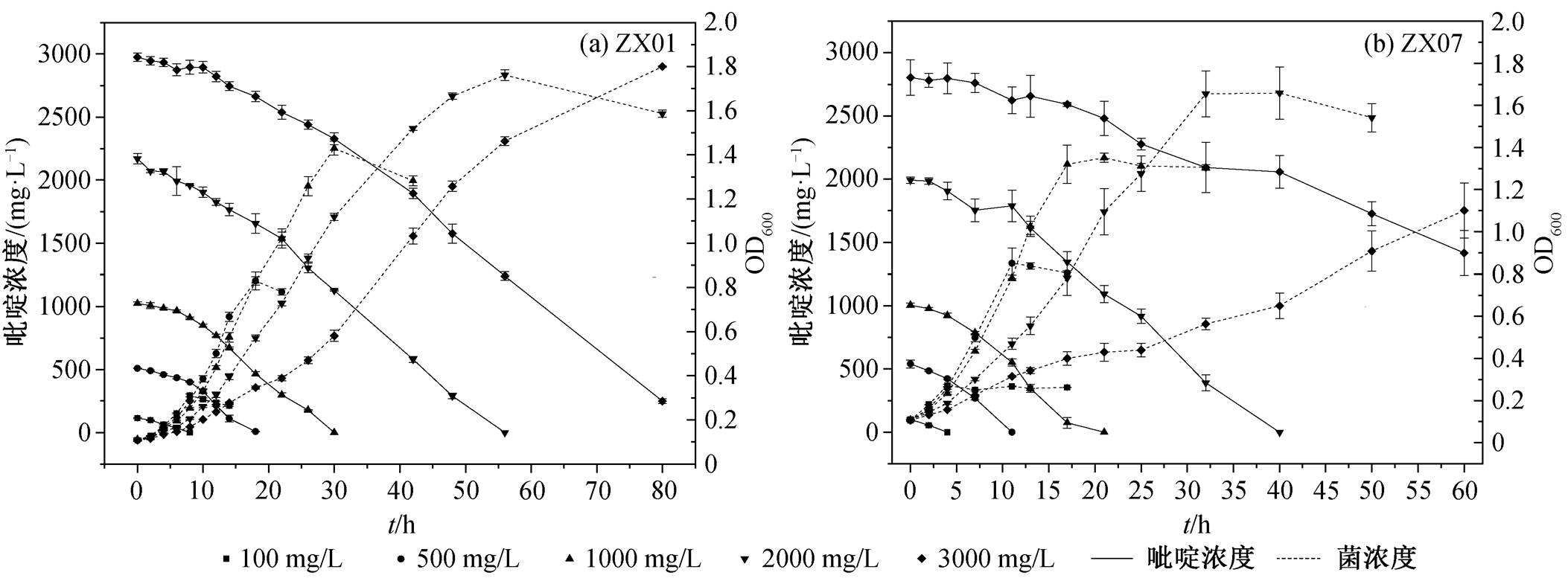
作为具有一定毒性的物质, 吡啶对细菌细胞本身也会产生负面作用, 因此探究初始吡啶浓度对降解过程的影响具有重要意义。降解体系中, 初始吡啶浓度分别设为 100, 500, 1000, 2000 和 3000 mg/L, ZX01 和 ZX07 的吡啶降解和菌体生长结果分别见图4(a)和(b)。
以 ZX01 为例, 菌株对 100~2000mg/L 浓度范围的吡啶均有很强的耐受及降解能力, 在一段时间后达到几乎 100%的降解率; 菌株可耐受 3000mg/L 高浓度的吡啶, 对其有一定的降解能力, 但抑制期很长, 80h 的吡啶降解率为 91.6%, 菌密度达到 OD600= 1.8。在反应初期, 高浓度吡啶对 ZX01 有抑制作用, 低浓度时的抑制作用不明显; 吡啶初始浓度越高, 菌株受抑制时间越长。当抑制期结束后, 菌株适应
了生长环境, 高浓度吡啶为其生长繁殖提供更充足的营养物质, 菌体的最大生长量也更大。有研究表明, 高浓度的底物可以抑制细菌细胞的活性, 影响酶促反应的发生, 进而限制其对污染物的降解[31]。
相同实验条件下, ZX07 与 ZX01 表现出相似的吡啶降解规律。在初始浓度分别为 100, 500, 1000 和 2000mg/L 时, ZX01 完全降解吡啶分别需要 10, 20, 30 和 56h, ZX07 则分别需要 4, 11, 25 和 40h, ZX07 的抑制期更短, 降解速率更高。另外, 文献报道的其他吡啶降解菌对高浓度吡啶的降解速率均低于本研究分离得到的菌株。例如菌株 Streptomyces sp.HJ02 降解 2000mg/L 的吡啶需要 192h[32], 菌株Rhizobium sp. NJUST18降解 2600mg/L 的吡啶需要230h[33], 菌株 Shinella zoogloeoides JB27 降解 1500mg/L 的吡啶需要 96h[8]。因此, 菌株 ZX01 和 ZX07对高浓度吡啶的降解性能较为优异, 具有很高的实际应用价值。
2.2 吡啶降解菌的生物膜形成能力
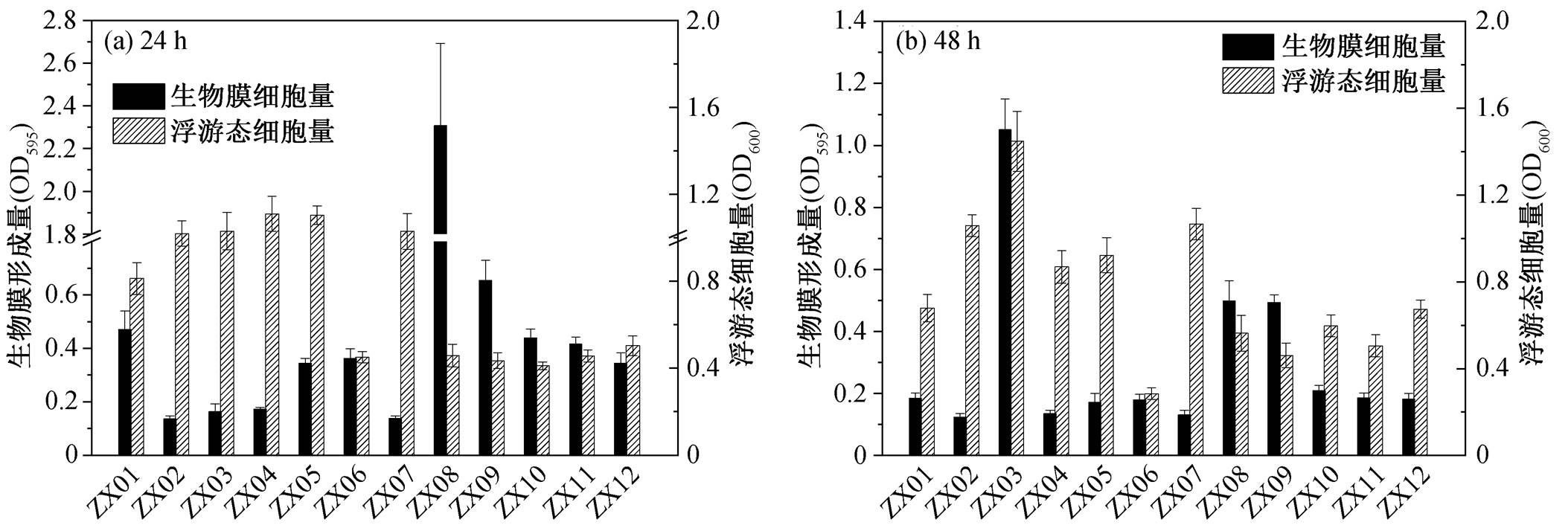
12 株菌分别培养 24 和 48h 后的生物膜形成量和浮游态细胞量如图 5 所示。24h 时, 12 株菌的成膜量存在比较明显的差异(图 5(a)): ZX08 的生物膜形成能力最佳, 成膜量达到其余 11 株菌的 4~17 倍; ZX02, ZX07 和 ZX03 在 24h 内的成膜量较少, 相应地, OD595 都在 0.2 以下; 其余菌株成膜量的 OD595在 0.3~0.8 之间。从图 5(a)还可以看到, 菌株浮游态细胞生长量与生物膜形成量大体上呈相反的趋势, 即成膜量高的菌株浮游态细胞量少, 成膜量低的菌株浮游态细胞量多。这两种生长形态存在此消彼长的趋势, 表明在微孔板培养体系中, 由于营养物质等条件的不同, 降解菌面临以生物膜形态生长和以浮游态形式生长两种生存策略的选择和偏好。Fuji-shige 等[34]报道了在微孔板中的培养条件(如营养成分和气体交换)发生变化后, 选择以生物膜形式的Rhizobium菌株生长量也发生改变。
由图 5(b)可见, 48 h 时, 除 ZX03 的成膜量上升以外, 其余各株菌的成膜量都出现不同程度的下降。一般认为, 生物膜的发展呈现一定的周期规律, 主要包括 5 个阶段: 1)细胞在载体表面发生初始黏附; 2)细胞分泌含有多种成分的 EPS 来强化黏附; 3)细胞不断分裂增殖并形成微菌落; 4)形成稳定成熟的生物膜结构; 5)生物膜老化裂解, 细胞向外逸散[35]。因此, 可以推测 24h 至 48h 这段时间内, 除ZX03 仍处于生物膜发生发展阶段外, 其他菌株则进入生物膜裂解和细胞散播阶段, 从而导致生物膜量的下降, 并伴随浮游态细胞量的增长。
此外, 不同菌株在微孔板中形成生物膜的位置有差异(图 6)。例如, ZX01 主要在孔壁的气-液-固交界面上形成生物膜, 在孔底的固-液界面上成膜较少(图 6(a)); ZX09 则主要在孔底的固-液界面上形成生物膜, 孔壁上几乎没有生物膜的形成(图 6(b))。Gomes 等[36]研究 96 孔板单个微孔内不同深度的水力剪切力差异与 Escherichia coli 生物膜定植位置的关系, 发现在 150r/min 转速下, 细菌的成膜量与剪切应变率有一定的关系: 在接近气液交界面的剪切应变率最高的部分, 成膜量最大; 随深度加深, 剪切应变率下降, 生物膜量随之降低; 但在更接近孔底的部分, 应变率几乎为零, 生物膜量反而增高。还有研究认为, 生物膜的形成与氧气及基质传输有关[37]。因此, 不同菌株生物膜形成位置的差异可能是它们对不同水力剪切力及氧气等物质传输条件的适应性不同所导致。
2.3 细胞生化特性与生物膜形成能力的关系
细菌生物膜的形成受到多种因素的影响。本研究发现 12 株降解菌的生物膜形成能力具有明显差异, 而由于各菌株生长的环境条件完全一致, 所以这些差异应主要来源于细菌本身的特征。为此, 我们选择一些可能与生物膜形成相关的生化特性, 通过相关性分析, 尝试解释不同菌株成膜能力差异的原因。
2.3.1细胞疏水性
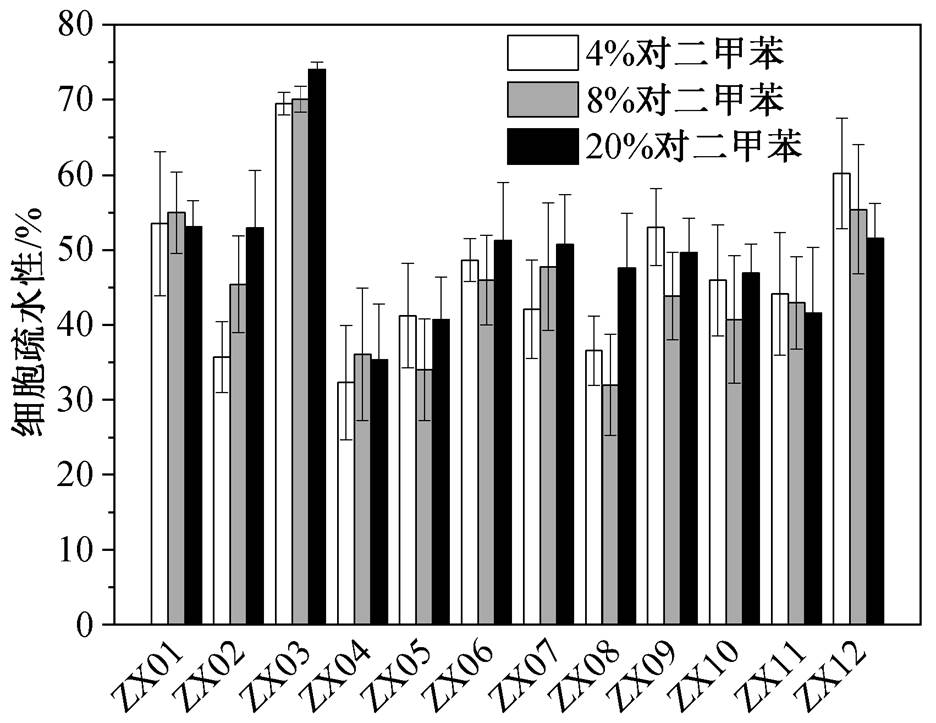
有研究报道, 疏水性能够增进细胞表面的黏附性[38], 进而促进成膜过程的初始黏附, 因此推测强疏水性细菌比强亲水性细菌具有更高的成膜量[39-40]。如图 7 所示, ZX03 的疏水性最大, 达到70%以上, ZX12 和 ZX01 次之, 这 3 株菌属于强疏水性菌株; ZX04, ZX08 和 ZX05 疏水性都在 50%以下, 即表现相对亲水性。对成膜量和细胞疏水性做 Pearson 相关分析, 结果显示相关系数并不显著, 即二者不具有显著的相关关系。
细胞疏水性只是影响细菌黏附能力的因素之一, 成膜过程还与材料表面的物化特征密切相关。研究报道的细胞疏水性与成膜量之间的关系也存在不同结论: Cerca 等[41]发现一株 M10 菌株具有最高的细胞表面疏水性, 却在亲水的玻璃表面具有最高成膜量; Pompilio 等[40]虽然发现细胞表面疏水性与初始黏附量及成膜量都存在正相关关系(Pearson 相关系数分别为 0.668 和 0.532), 但有一株疏水性为7.2%的亲水性菌株 SM72 却具有最高成膜量。本研究也得到相似的结果, 证明细胞表面疏水性并非总与成膜量保持正相关关系。
2.3.2胞外蛋白与胞外多糖分泌
经 24 h 培养后, 12 株菌 EPS 提取液中的蛋白含量测定结果如图 8(a)所示, ZX09 和 ZX05 的胞外蛋白分泌量最高, ZX02 和 ZX07 的胞外蛋白分泌量远低于其他菌株。由图 8(b)可知, ZX08, ZX09, ZX10, ZX11 和 ZX12 这 5 株菌都具有较强的胞外多糖分泌能力, 其中 ZX10 的胞外多糖浓度达到 200mg/L 以上。对各株菌(除去成膜量异常高的 ZX08)的 24h 成膜量与胞外蛋白、胞外多糖分别做 Pearson 相关性分析, 结果显示: 成膜量与胞外蛋白分泌量的Pearson 相关系数 r=0.771 (P= 0.005), 二者具有显著的正相关关系(图 8(c)); 成膜量与胞外多糖分泌量的 Pearson 相关系数 r=0.605 (P=0.048), 二者同样具有显著的正相关关系(图 8(d))。这表明胞外蛋白和胞外多糖的分泌与细菌生物膜的形成能力相关, 蛋白或多糖分泌量越多, 成膜量越大。
EPS 是支撑生物膜整体架构、保证细菌抗性的重要基质物质[11], 对生物膜的形成至关重要。作为EPS 的重要组成成分, 胞外多糖与蛋白的分泌能力直接关系到生物膜结构的构建。从具体机制上讲, EPS 不仅可以促进微生物细胞的黏附和聚集, 也参与生物膜形态的调控。Ma 等[42]发现, 在 P.aerugin-osa PAO1 生物膜黏附阶段, Psl 多糖促进细胞与材料表面以及细胞间的相互作用, 且在后续生物膜的形成过程中对保持生物膜结构起重要作用。他们还发现, Psl 多糖参与形成的生物膜在结构上更加紧凑[43]。这些都说明 EPS 的分泌能力与生物膜的形成密切相关, 与本实验的结果一致。
2.3.3运动能力
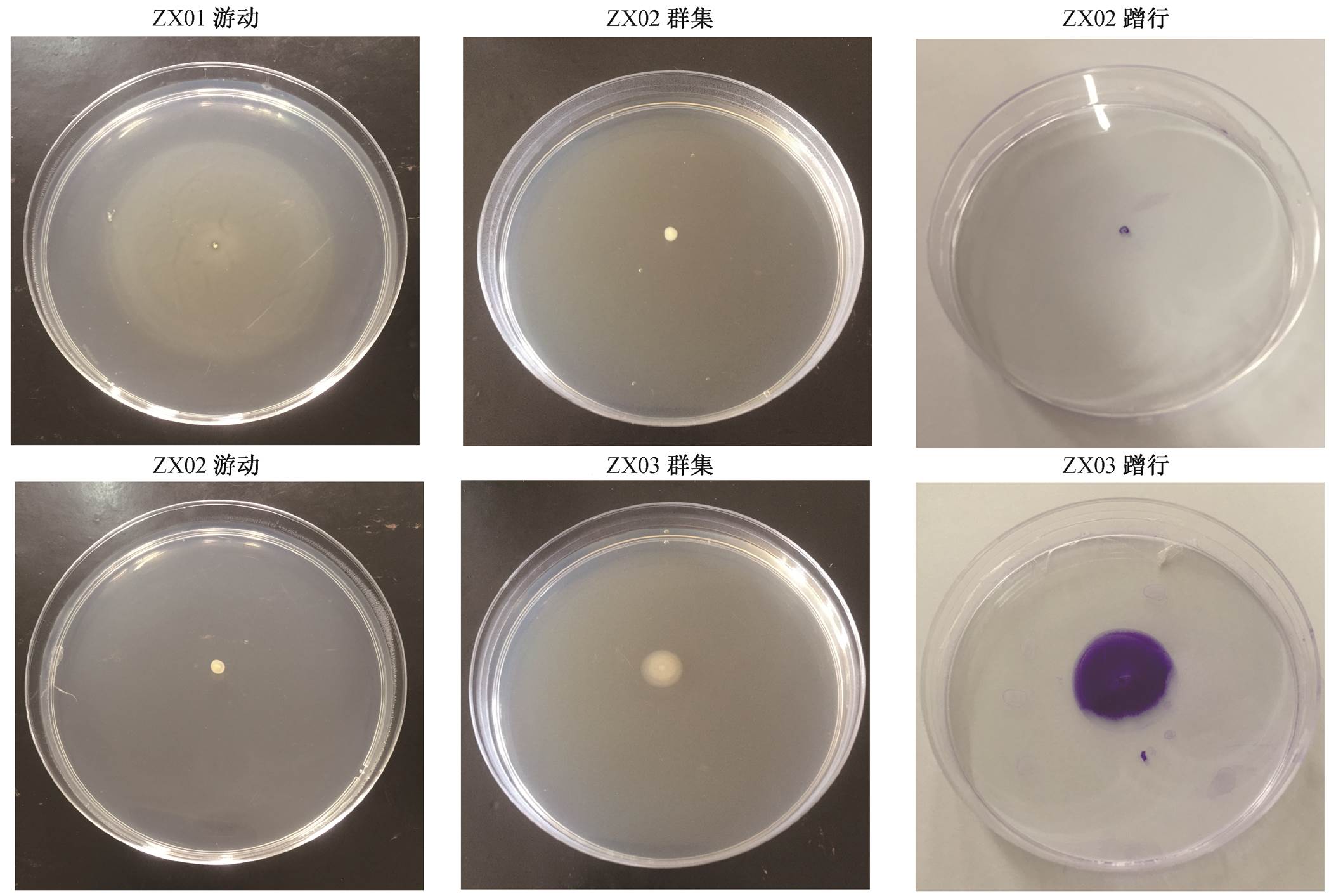
细菌的运动能力直接关系到其在固液界面的活动能力。一般认为, 具有强运动能力的菌株, 往往能迅速地与材料表面发生初始黏附, 继而增殖、扩张, 较快速地形成生物膜。运动能力通常分为游动能力、群集运动能力、滑行(gliding or sliding)能力、蹭行能力及穿刺运动(darting)能力[44], 其中游动和群集运动能力依靠鞭毛进行, 蹭行运动能力与菌毛(如 type IV pili)有关。如图 9(a)所示, 24h 时ZX09 和 ZX11 的游动范围最广, 游动直径大于 5cm, 运动形态呈靶心状; ZX02, ZX05, ZX06 和ZX07 几乎没有发生游动。48h 时, 各株菌的游动直径都出现不同程度的增长, 但 24h 时几乎没有发生游动的几株菌在 48h 时的游动直径依然很小, 说明这几株菌几乎不具备游动能力。这也符合相应菌属本身的特征: ZX02 和 ZX07 属于普遍不具备运动能力的节杆菌属; 其余菌株属于假单胞菌属, 一般都具有运动能力。在群集运动的测试中, 12 株菌运动直径都很小, 几乎都不具备群集运动能力(图 9(b))。在依靠菌毛进行的蹭行运动中, ZX02 和ZX07 两株节杆菌的运动直径很小, 几乎不具备蹭行运动能力(图 9(c))。图 10 展示一些运动能力测试结果的照片。
对成膜量(除成膜量异常高的 ZX08 外)与游动能力、蹭行运动能力分别进行 Pearson 相关分析, 结果发现: 成膜量与游动能力的 Pearson 相关系数r=0.608 (P=0.047), 即二者具有显著的正相关关系(图 9(d)); 而成膜量与蹭行运动能力之间无明显的相关关系。由此, 推测由鞭毛介导的游动能力在假单胞菌属的各株细菌的生物膜形成过程中发挥了一定的作用。O’Toole 等[45]发现, 野生型 P. aeruginosa菌株先在 PVC 表面形成单层黏附细胞, 后在此基础上形成微群落; 而鞭毛缺陷型菌株几乎不能发生细胞初始黏附, 表明鞭毛对细菌在材料表面形成单层细胞起到重要作用。Barken 等[46]也发现, 由于缺乏鞭毛介导的运动能力, fliM 基因突变的鞭毛缺陷型 P. aeruginosa 菌株不能形成蘑菇状生物膜上的帽状二级结构。上述研究结果说明, 鞭毛在细菌细胞的初始黏附阶段和生物膜结构的形成阶段都发挥作用, 从而在机制上解释了本实验的结果
。
3 结论
本研究从焦化废水处理系统中分离得到的 12 株吡啶降解菌都具有较高的吡啶降解活性。以 Pseu-domonas sp. ZX01 和 Arthrobacter sp.ZX07 为代表, 它们的吡啶降解过程符合零级反应动力学模型, 同时受温度、pH 和初始吡啶浓度的影响显著。菌株 ZX01 和 ZX07 降解吡啶的适宜温度范围是 30~ 35oC, 最适温度是 35oC; 适宜 pH 范围是 5.0~9.0, 最适 pH 是 7.0; 在初始吡啶浓度为 100~2000mg/L范围内, 均能较快速地开始降解过程, 最终降解率可以达到 100%。
12 株吡啶降解菌的生物膜形成能力差异明显: 菌株 ZX08, ZX03, ZX09, ZX10, ZX11 和 ZX12 的成膜能力强, 其中 ZX08 的成膜能力更是远超其他菌株; ZX02, ZX04 和 ZX07 这 3 株菌的成膜能力相对较弱。不同菌株形成生物膜的具体特征也有差异, 如形成的位置等。
胞外蛋白分泌量、胞外多糖分泌量和由鞭毛参与的游动能力与这 12 株吡啶降解菌的生物膜形成能力之间存在显著的正相关关系, 这些特征可能在生物膜形成过程中发挥重要的作用; 而细胞疏水性与生物膜形成能力之间无明显的相关性。
参考文献
[1]Ning P, Bart H J, Jiang Y, et al. Treatment of organic pollutants in coke plant wastewater by the method of ultrasonic irradiation, catalytic oxidation and activated sludge. Separation and Purification Technology, 2005, 41(2): 133-139
[2]Xie R, Wu M, Qu G, et al. Treatment of coking waste-water by a novel electric assisted micro-electrolysis filter. Journal of Environmental Sciences, 2018, 66 (4): 165-172
[3]Wu C H, Huang H J. Toxicity and anaerobic bio-degradability of pyridine and its derivatives under sulfidogenic conditions. Chemosphere, 1998, 36(10): 2345-2357
[4]Sims G K, Sommers L E, Konopka A. Degradation of pyridine by Micrococcus luteus isolated from soil. Applied and Environmental Microbiology, 1986, 51 (5): 963-968
[5]Kim M K, Singleton I, Yin C R, et al. Influence of phenol on the biodegradation of pyridine by freely suspended and immobilized Pseudomonas putida MK1. Letters in Applied Microbiology, 2006, 42(5): 495-500
[6]Bai Y, Sun Q, Zhao C, et al. Microbial degradation and metabolic pathway of pyridine by a Paracoccus sp. strain BW001. Biodegradation, 2008, 19(6): 915-926
[7]孙庆华, 柏耀辉, 赵翠, 等. Shinella zoogloeoides BC026 对吡啶的降解特性研究. 环境科学, 2008, 29(10): 2938-2943
[8]晋婷婷, 任嘉红, 张晖, 等. 一株吡啶高效降解菌的鉴定及其降解特性. 生态环境学报, 2016, 25(7): 1217-1224
[9]Zhang J, Wen D, Zhao C, et al. Bioaugmentation accelerates the shift of bacterial community structure against shock load: a case study of coking wastewater treatment by zeolite-sequencing batch reactor. App-lied Microbiology and Biotechnology, 2014, 98(2): 863-873
[10]Zhao B, Ran X C, Tian M, et al. Assessing the performance of a sequencing batch biofilm reactor bioaugmented with P. stutzeri strain XL-2 treating ammonium-rich wastewater. Bioresource Technology, 2018, 270: 70-79
[11]Branda S S, Vik Å, Friedman L, et al. Biofilms: the matrix revisited. Trends in Microbiology, 2005, 13(1): 20-26
[12]Atkinson S, Williams P. Quorum sensing and social networking in the microbial world. Journal of the Royal Society Interface, 2009, 6(40): 959-978
[13]Wu Y, Ding Y, Cohen Y, et al. Elevated level of the second messenger c-di-GMP in Comamonas testos-teroni enhances biofilm formation and biofilm-based biodegradation of 3-chloroaniline. Applied Microbio-logy and Biotechnology, 2015, 99(4): 1967-1976
[14]Kaplan J B, Velliyagounder K, Ragunath C, et al. Genes involved in the synthesis and degradation of matrix polysaccharide in Actinobacillus actinomyce-temcomitans and Actinobacillus pleuropneumoniae biofilms. Journal of Bacteriology, 2004, 186(24): 8213-8220
[15]Van Houdt R, Michiels C W. Role of bacterial cell surface structures in Escherichia coli biofilm forma-tion. Research in Microbiology, 2005, 156(5/6): 626-633
[16]Shrout J D, Chopp D L, Just C L, et al. The impact of quorum sensing and swarming motility on Pseudo-monas aeruginosa biofilm formation is nutritionally conditional. Molecular Microbiology, 2006, 62(5): 1264-1277
[17]Desrousseaux C, Sautou V, Descamps S, et al. Modification of the surfaces of medical devices to prevent microbial adhesion and biofilm formation. Journal of Hospital Infection, 2013, 85(2): 87-93
[18]Zhao C, Wen D, Zhang Y, et al. Experimental and mathematical methodology on the optimization of bacterial consortium for the simultaneous degradation of three nitrogen heterocyclic compounds. Environ-mental Science & Technology, 2012, 46(11): 6205-6213
[19]Sezonov G, Joseleau-Petit D, D’Ari R. Escherichia coli physiology in Luria-Bertani broth. Journal of Bacteriology, 2007, 189(23): 8746-8749
[20]Christensen G D, Simpson W A, Younger J J, et al. Adherence of coagulase-negative staphylococci to plastic tissue culture plates: a quantitative model for the adherence of staphylococci to medical devices. Journal of Clinical Microbiology, 1985, 22(6): 996-1006
[21]O’Toole G A. Microtiter dish biofilm formation assay. Journal of Visualized Experiments, 2011, 47: e2437
[22]Heilmann C, Gerke C, Perdreau-Remington F, et al. Characterization of Tn917 insertion mutants of Staphylococcus epidermidis affected in biofilm for-mation. Infection and Immunity, 1996, 64(1): 277-282
[23]Tielen P, Strathmann M, Jaeger K E, et al. Alginate acetylation influences initial surface colonization by mucoid Pseudomonas aeruginosa. Microbiological Research, 2005, 160(2): 165-176
[24]Dubois M, Gilles K A, Hamilton J K, et al. Colori-metric method for determination of sugars and related substances. Analytical Chemistry, 1956, 28(3): 350-356
[25]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utili-zing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1/2): 248-254
[26]Rashid M H, Kornberg A. Inorganic polyphosphate is needed for swimming, swarming, and twitching moti-lities of Pseudomonas aeruginosa. Proceedings of the National Academy of Sciences, 2000, 97(9): 4885-4890
[27]俞蓉, 赵翠, 刘江江, 等. 脱氮副球菌 W12 在游离生长与附着生长条件下对吡啶去除作用的研究. 环境科学, 2010, 31(4): 1053-1058
[28]宋秀兰, 冀文侃, 张栋, 等. 固定化胶质红环菌降解吡啶的研究. 南京理工大学学报, 2008, 32(4): 522-525
[29]赵翠, 孙庆华, 柏耀辉, 等. 副球菌 BW001 的生理特性及其对吡啶的降解. 环境污染与防治, 2008, 30(11): 17-22
[30]张浩, 刘玉香, 呼婷婷, 等. 一株苯胺降解菌的分离及其降解特性. 环境工程学报, 2015, 9(12): 6154-6160
[31]Cao Y M, Xu L, Jia L Y. Analysis of PCBs degrada-tion abilities of biphenyl dioxygenase derived from Enterobacter sp. LY402 by molecular simulation. New Biotechnology, 2011, 29(1): 90-98
[32]Li J, Cai W, Cai J. The characteristics and mechani-sms of pyridine biodegradation by Streptomyces sp. Journal of Hazardous Materials, 2009, 165(1/2/3): 950-954
[33]Shen J, Zhang X, Chen D, et al. Kinetics study of pyridine biodegradation by a novel bacterial strain, Rhizobium sp. NJUST18. Bioprocess and Biosystems Engineering, 2014, 37(6): 1185-1192
[34]Fujishige N A, Kapadia N N, De Hoff P L, et al. Investigations of Rhizobium biofilm formation. FEMS Microbiology Ecology, 2006, 56(2): 195-206
[35]熊富忠, 赵小希, 廖胤皓, 等. 材料表面特征对生物膜形成的影响及其应用. 微生物学通报, 2018, 45(1): 155-165
[36]Gomes L C, Moreira J M R, Simões M, et al. Biofilm localization in the vertical wall of shaking 96-well plates. Scientifica, 2014: Article ID 231083
[37]Moreira J M R, Teodósio J S, Silva F C, et al. Influence of flow rate variation on the development of Escherichia coli biofilms. Bioprocess and Biosystems Engineering, 2013, 36(11): 1787-1796
[38]Absolom D R. The role of bacterial hydrophobicity in infection: bacterial adhesion and phagocytic inges-tion. Canadian Journal of Microbiology, 1988, 34(3): 287-298
[39]Takahashi H, Suda T, Tanaka Y, et al. Cellular hydrophobicity of Listeria monocytogenes involves initial attachment and biofilm formation on the surface of polyvinyl chloride. Letters in Applied Microbiology, 2010, 50(6): 618-625
[40]Pompilio A, Piccolomini R, Picciani C, et al. Factors associated with adherence to and biofilm formation on polystyrene by Stenotrophomonas maltophilia: the role of cell surface hydrophobicity and motility. FEMS Microbiology Letters, 2008, 287(1): 41-47
[41]Cerca N, Pier G B, Vilanova M, et al. Quantitative analysis of adhesion and biofilm formation on hydro-philic and hydrophobic surfaces of clinical isolates of Staphylococcus epidermidis. Research in Micro-biology, 2005, 156(4): 506-514
[42]Ma L, Jackson K D, Landry R M, et al. Analysis of Pseudomonas aeruginosa conditional Psl variants reveals roles for the Psl polysaccharide in adhesion and maintaining biofilm structure postattachment. Journal of Bacteriology, 2006, 188(23): 8213-8221
[43]Ma L, Wang S, Wang D, et al. The roles of biofilm matrix polysaccharide Psl in mucoid Pseudomonas aeruginosa biofilms. FEMS Immunology & Medical Microbiology, 2012, 65(2): 377-380
[44]Henrichsen J. Bacterial surface translocation: a sur-vey and a classification. Bacteriological Reviews, 1972, 36(4): 478-503
[45]O’Toole G A, Kolter R. Flagellar and twitching moti-lity are necessary for Pseudomonas aeruginosa biofilm development. Molecular Microbiology, 1998, 30(2): 295-304
[46]Barken K B, Pamp S J, Yang L, et al. Roles of type IV pili, flagellum-mediated motility and extracellular DNA in the formation of mature multicellular struc-tures in Pseudomonas aeruginosa biofilms. Environ-mental Microbiology, 2008, 10(9): 2331-2343
Investigation on Pyridine-Degrading Performances and Biofilm-Forming Properties of 12 Pyridine-Degrading Bacterial Strains
ZHAO Xiaoxi1, XIONG Fuzhong1, WEN Donghui1,†, LI Qilin2
1. College of Environmental Sciences and Engineering, Peking University, Beijing 100871; 2. College of Civil and Environmental Engineering, Rice University, Texas 77005; † C222orresponding author, E-mail: dhwen@pku.edu.cn
Abstract Choosing pyridineas the target pollutant, the pyridine-degrading performances and biofilm-forming properties of 12 pyridine-degrading bacterial strains, isolated from a coking wastewater treatment plant, were investigated. The results show that all the 12 strains had high degradation activity of pyridine. For two efficient degrading strains, Pseudomonas sp. ZX01 andArthrobacter sp. ZX07, the optimal temperature and pH to degrade pyridine were 35ºC and 7.0, respectively. Pyridine with initial concentration ranged in 100 to 2000 mg/L could be completely degraded by either strain. Furthermore, the biofilm-forming abilities of the 12 strains were significantly different. The cellular properties of extracellular protein secretion, extracellular polysaccharide secretion, and flagella-mediated swimming motility were identified to have significant positive correlations with their biofilm-forming capacities. Our study provides scientific references for constructing a degrading-biofilm system for refractory wastewater treatment.
Key words pyridine-degrading bacteria; environmental factors; biofilm; extracellular polymeric substances
doi: 10.13209/j.0479-8023.2019.088
国家自然科学基金(51378019, 51529801)资助
收稿日期: 2018-12-13;
修回日期: 2019-06-14