表1 采样点信息
Table 1 Information of sampling sites
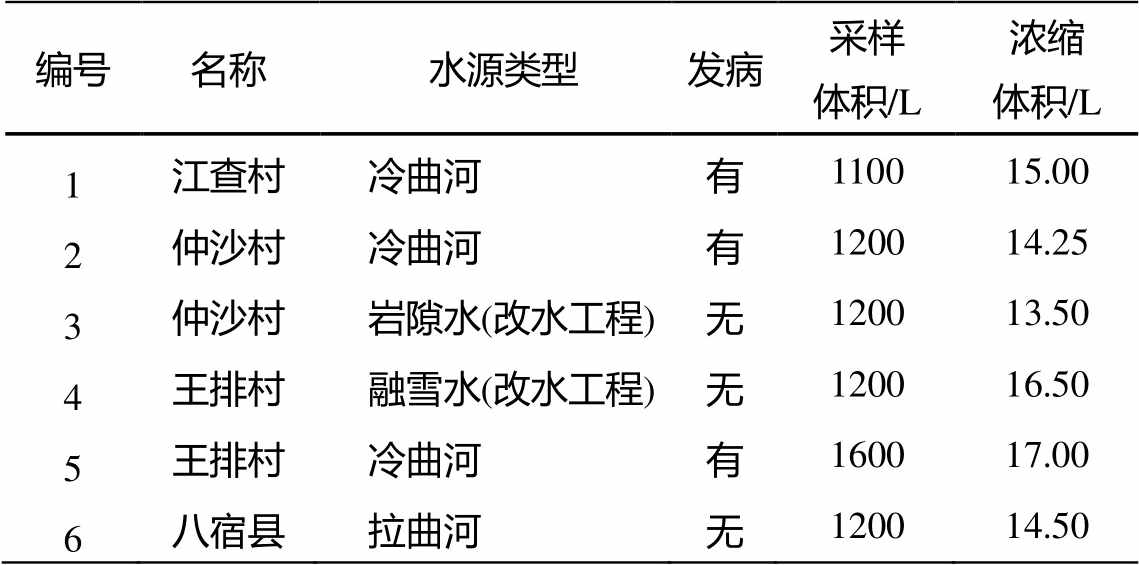
编号名称 水源类型发病采样体积/L浓缩体积/L 1江查村冷曲河有110015.00 2仲沙村冷曲河有120014.25 3仲沙村岩隙水(改水工程)无120013.50 4王排村融雪水(改水工程)无120016.50 5王排村冷曲河有160017.00 6八宿县拉曲河无120014.50
摘要 基于荧光平行因子分析法(PARAFAC), 对西藏昌都大骨节病病区与非病区饮水及沉积物中腐殖质进行研究。腐殖质总有机碳含量在病区和非病区样本间未表现显著差异。PARAFAC 识别出 5 个荧光成分: 成 分1 为类氧化醌, 成分 2 为类色氨酸, 成分 3 为陆地源类腐殖质, 成分 4 为类还原醌, 成分 5 为类酪氨酸。病区水中富里酸(FA)的成分 1 (p<0.10)、成分 4 (p<0.05)以及水中胡敏酸(HA)的成分 4 (p<0.10)等类醌成分含量高于非病区, 并且存在显著差异。对比水中腐殖质醌氧化还原系统在病区和非病区之间的差异, 发现还原醌形态的差异大于氧化醌形态, FA 醌系统的差异大于 HA 醌系统。虽然 HA 中还原醌含量较高, 但 HA 在水中的碳含量很低, 对大骨节病影响较弱, 在病区与非病区之间差异较小。沉积物中腐殖质还原醌含量较高, 且与水中腐殖质存在一定的相互转化关系, 但在病区和非病区之间未表现显著差异。深入了解腐殖质不同组分以及醌的不同氧化还原形态在病区与非病区之间的差异, 对病区改水工程有重要意义。
关键词 三维荧光光谱; 平行因子分析; 大骨节病; 富里酸; 胡敏酸; 醌氧化还原系统
大骨节病(Kaschin-Beck disease, KBD)是在中国广泛分布的一种地方性流行病, 可导致关节肿大和骨骼变形。20 世纪 60—80 年代间, 该病大范围地流行, 患病人数达到 200 万[1]。改革开放以来, 随着经济条件的提升, 通过退耕还林(还草)、改水工程和村落迁居等措施, 该病的流行情况减轻, 目前在全国范围内得到控制[2–3]。但其病因尚不明确。通常认为大骨节病是一种多因素导致的疾病, 饮水中的有机物和粮食中的真菌毒素都是大骨节病的致病因素, 其致病机制是其活性含氧基团在有氧条件下产生的氧自由基造成的损伤和异常, 环境低硒则是本病的生物地球化学条件[1,4]。
醌是天然有机质(natural organic matter, NOM) 中的主要活性含氧基团。醌氧化还原系统是由醌、半醌和氢醌三类分子组成的可逆氧化还原体系。醌得一电子形成半醌, 半醌得一电子形成氢醌, 半醌分子中存在一个未成对电子, 为半醌自由基。在自然环境下, 这 3 种分子一般同时存在于腐殖质中, 其中醌和半醌分子组成还原醌形态, 半醌和氢醌分子组成氧化醌形态。在过去对大骨节病地区腐殖质性质的研究中, 由于表征及分析方法落后, 仅通过电子顺磁共振发现半醌自由基的含量在病区与非病区间存在显著差异[1], 通过红外、紫外和荧光等手段均未发现其他结构证据存在显著差异[5–6]。但是, 仅仅研究醌氧化还原系统中的一类分子是不够的, 应当对整个系统进行研究。
平行因子分析法使三维荧光光谱得到进一步的发展, 近年来在腐殖质的研究中广泛应用[7–8]。平行因子分析法通过 Matlab 程序, 对多个荧光激发发射矩阵(excitation-emission matrix, EEM)的集合进行成分提取, 得到相对独立的荧光成分进行分析, 从而获得精确的结构信息。醌氧化还原系统是腐殖质结构中普遍存在的发光基团, 通过对比标准醌类物质的荧光光谱, 可以识别多个氧化醌或还原醌荧光成分[9], 说明荧光平行因子分析法是表征腐殖质醌系统的有效手段。
本研究采集大骨节病病区与非病区饮水及沉积物样品, 通过 XAD-8 树脂法分离其中的胡敏酸和富里酸, 用三维荧光光谱平行因子分析法对腐殖质中的醌氧化还原系统进行研究, 对比腐殖质不同组分以及醌不同形态与大骨节病的关系。
采样站点为西藏自治区昌都市大骨节病地区的3 个病区与 3 个非病区, 具体信息见表 1 和图 1。采样区域位于昌都市八宿县境内, 地形为高山峡谷, 四周均为雪山, 河水主要源自山顶融雪水。
采样站点中, 6 号站点八宿县城为非病区, 其他 5 个站点位于 3 个村落, 其中江查村为病区。仲沙村和王排村过去为病区, 经过改水工程后成为非病区。在改水工程前, 仲沙村 654 人中有 240 人发病, 在改水工程后仅有 1 人新发病。王排村在改水工程后无人新发病。从仲沙村和王排村改水工程前、后的饮用水源分别采集样品。
3 号站点的水源为岩隙水, 取自冷曲河上游支流。其他站点水源均源自山顶融化的雪水, 其中 1, 2 和 5 号站点的水源为冷曲河干流, 6 号站点的水源为冷曲河下游较大支流——拉曲河, 4 号站点的水源为新辟渠道从山顶引下的雪水, 采样点在村内新建渠道末端。除 2 号站点外, 水质均清澈。2 号站点在仲沙村桥下, 水质发青浑浊, 河岸边有垃圾。
2015 年 12 月, 从每个站点采集表层沉积物 2kg (0~10cm), 水样 1100~1600L。水样在当地进行预处理, 首先用 0.5μm 的过滤柱(聚乙烯, 盖雅环保, 深圳)过滤, 然后用钠型离子交换树脂(Dowex 50WX8, 西格玛, 美国)去除高价金属离子。最后, 将水样用定制的反渗透装置(鹏达源环保, 深圳)浓缩至13.50~17.00 L。
表1 采样点信息
Table 1 Information of sampling sites

编号名称 水源类型发病采样体积/L浓缩体积/L 1江查村冷曲河有110015.00 2仲沙村冷曲河有120014.25 3仲沙村岩隙水(改水工程)无120013.50 4王排村融雪水(改水工程)无120016.50 5王排村冷曲河有160017.00 6八宿县拉曲河无120014.50
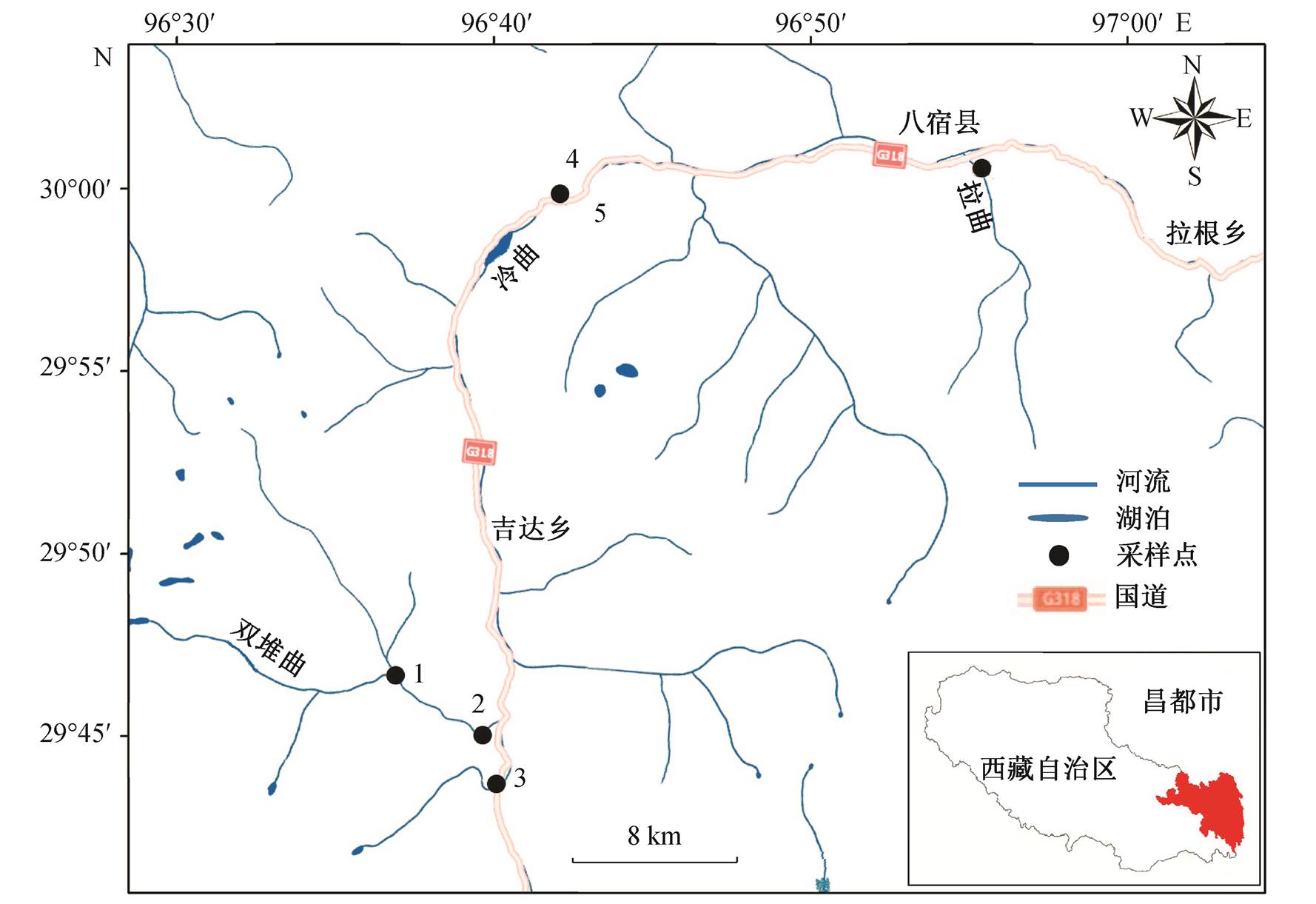
图1 采样站点位置
Fig. 1 Locations of sampling sites
沉积物用自封袋密封, 浓缩水样用塑料瓶保存。样品置于放有冰袋的泡沫箱中冷藏运输。到达实验室后, 浓缩水样于 4ºC 冷藏, 沉积物于−20ºC冷冻保存。
使用 XAD-8 树脂提纯分离腐殖质组分。为避免树脂中溶解性总有机碳(dissolved organic carbon, DOC)的干扰, 将树脂先用 NaOH 溶液反复浸提数日, 然后用甲醇索式提取 24 小时后保存在甲醇中。使用前, 将树脂用超纯水、酸和碱等清洗至DOC浓度低于0.1 mg/L[10–11]。
参照 Ma 等[12]的方法提取浓缩水样中腐殖质。首先, 将浓缩水样用 0.45μm 滤膜(聚醚砜, 津腾, 天津)用过滤后酸化至 pH=1, 静置过夜。然后, 将溶液用 0.45μm 滤膜过滤, 再用 NaOH 溶液洗脱滤膜, 洗脱液为胡敏酸(humic acid, HA)。将滤液用 NaOH 溶液调节至 pH=2 后, 通过 XAD-8 树脂柱吸附, 没有被吸附的流出液为亲水物质(hydrophilic matter, HYI)。用 NaOH 溶液反向洗脱树脂柱, 洗脱液为富里酸(fulvic acid, FA)。
根据国际腐殖酸协会推荐的方法, 对沉积物中的腐殖质进行提取[13]。首先将沉积物晾干, 研磨过2mm 筛, 然后用 HCl 溶液提取, 得到 FA1。在氮气保护下, 将酸提取后的沉积物用 NaOH 溶液提取, 得到 FA2 和 HA 的混合物。将混合物酸化至 pH=1, 静置过夜, 离心分离 HA (沉淀)和 FA2 (上清液)。在pH=1 的条件下, FA1 和 FA2 分别通过 XAD-8 树脂吸附, NaOH 溶液洗脱。将洗脱液合并后, 再次通过树脂吸附洗脱, 得到 FA。
为保证组分分离流程的稳定性, 提取实验采用3 个平行样。从水和沉积物中共分离出 5 类组分, 分别命名为 A-HA (aquatic-HA), A-FA, A-HYI, S-HA (sediment-HA)和S-FA。
使用总有机碳(total organic carbon, TOC)分析仪(Multi N/C 3100, 耶拿, 德国), 对水和沉积物中各组分的有机碳含量进行测定, 测定方法依据国家标准HJ 501—2009。
使用荧光光谱仪(F-7000, 日立, 日本)测试所有腐殖质组分, 得到激发发射矩阵图(EEM)。样品测试前调节 pH 值为 7[14], 以避免 pH 对荧光的影响, 用超纯水稀释至 254nm 紫外吸收(UV254)低于 0.10 cm−1, 以消除内滤效应[15]。波长参数: 激发波长为200~450nm, 间隔 5nm; 发射波长为 220~550nm, 间隔 1nm。所有样品扣除超纯水空白, 用三角插值法去除瑞丽散射和拉曼散射[16], 荧光强度用超纯水的拉曼峰面积校正[17]。
使用 Stedemon 等[18]开发的 DOMFluor 程序包, 在 Matlab2007 中进行 PARAFAC 分析。程序包主要包括以下功能: 识别并去除异常样品; 计算不同因子数模型的残差和; 将 EEM 集合一分为二单独分析检验有效性等。PARAFAC 分析的原理是使用交替最小二乘法来实现三线性模型(荧光强度、激发波长和发射波长)的分解, 使残差平方和达到最小, 进而从分解模型中提取独立的荧光成分[19]。
饮水中天然有机质含量与沉积物中可提取腐殖质含量分析结果见图 2。饮水中 DOC 含量为 0.22~ 0.44mg/L, 远远低于通常天然水体的有机质含量(1~100mg/L)[20–22], 且天然有机质的 3 个组分含量大小顺序为 A-HA
沉积物中可提取的腐殖质碳含量在 0.003%~ 8.27%之间, 除 4 号站点外, 其他站点的 FA 含量均远低于 HA。4 号站点的可提取腐殖质碳含量远低于其他站点, 仅占 0.003%, 这可能是由于 4 号站点是新辟渠道, 沉积物腐殖化时间短, 腐殖化程度低,腐殖质较少, 形成速率较慢的 HA 含量更少。3 号站点可提取腐殖质的碳含量为 8.27%, 远高于其他站点, 由于其水源类型为岩隙水, 沉积物包含较多的裂隙岩碎粒, 推测其裂隙岩为腐殖化程度极高的泥煤或褐煤, 腐殖质含量较高。其他站点中, 1 , 2和 5 号均位于冷曲河干流, 6 号位于冷曲河下游的较大支流拉曲河, 环境条件相似, 因而腐殖质含量比较接近, 在 0.03%~0.51%之间。
腐殖质各组分的 TOC 含量均未在病区与非病区样本间表现显著差异, 表明腐殖质碳含量与大骨节病无显著关系, 应当研究腐殖质的特性在病区与非病区样本间的差异。
利用 PARAFAC 模型[18]对 90 个 EEM 的集合(6个站点的 5 类组分及 3 个平行样)进行分析, 最终提取出 5 个荧光成分。各成分的 EEM 图和激发发射载荷图见图 3, 其最大激发波长、发射波长及所对应的物质类型列于表 2。从图 3 可以看出, 成分 4有 3 个峰, 其他成分均有两个峰, 说明荧光成分是多个荧光基团的混合物。这是由于腐殖质结构复杂, 同一腐殖质分子中含有多个荧光基团。
通常可以依据激发波长(Ex)与发射波长(Em), 将天然有机质的 EEM 图划分为 5 个区域[26], 分别对应不同的荧光素, 如图 4 所示: 区域 I 和 II 为芳香蛋白, 区域 III 为类富里酸, 区域 IV 为溶解微生物代谢产物, 区域 V 为类胡敏酸。其中, 区域 III 和V是腐殖化结构的荧光素, 区域 I, II 和 IV 是一些未腐殖化结构的荧光素。因此, 本文识别出的荧光成分1, 3 和 4 均为腐殖化荧光素, 其中成分 1 和 3 包括类富里酸和类胡敏酸荧光素, 成分 4 主要为类胡敏酸荧光素, 表明成分 4 反映的 HA 信息更多。成分 2 和 5 为未腐殖化荧光素, 成分 2 主要是溶解微生物代谢产物, 成分 5 主要是芳香蛋白。
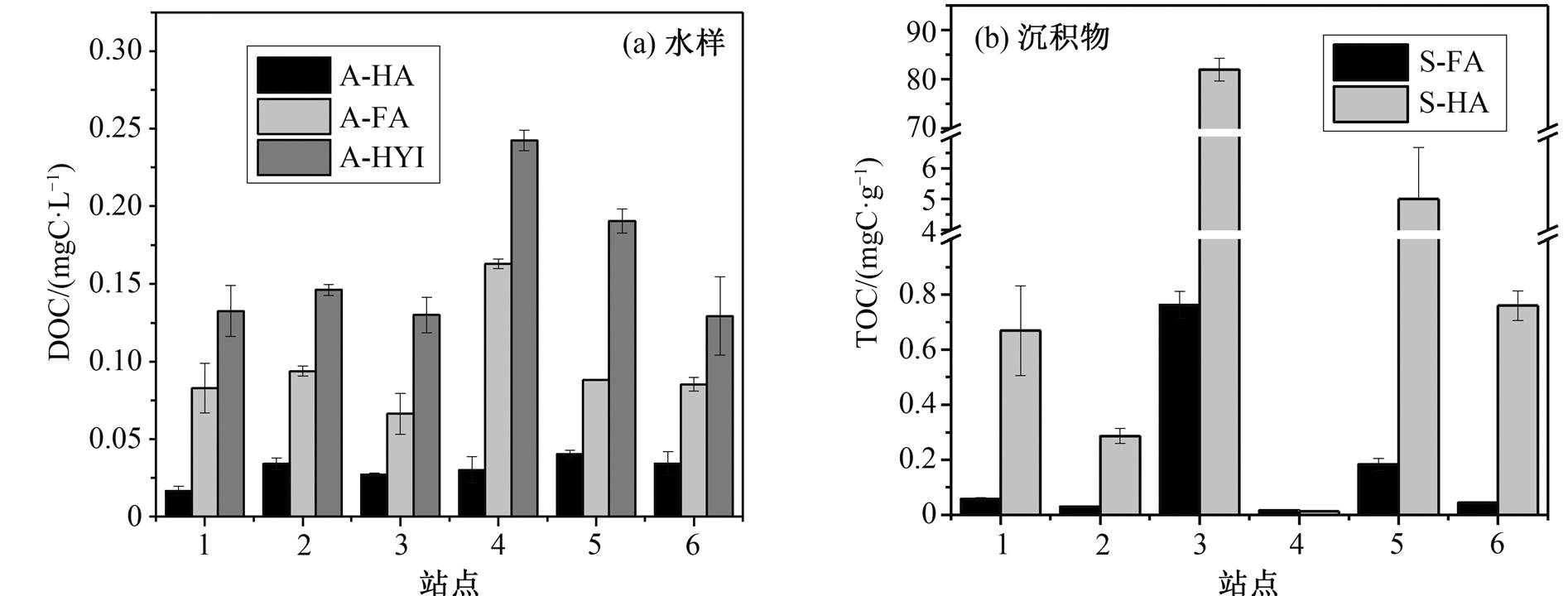
图2 水和沉积物中的有机质含量
Fig. 2 Content of organic matters in water and sediment
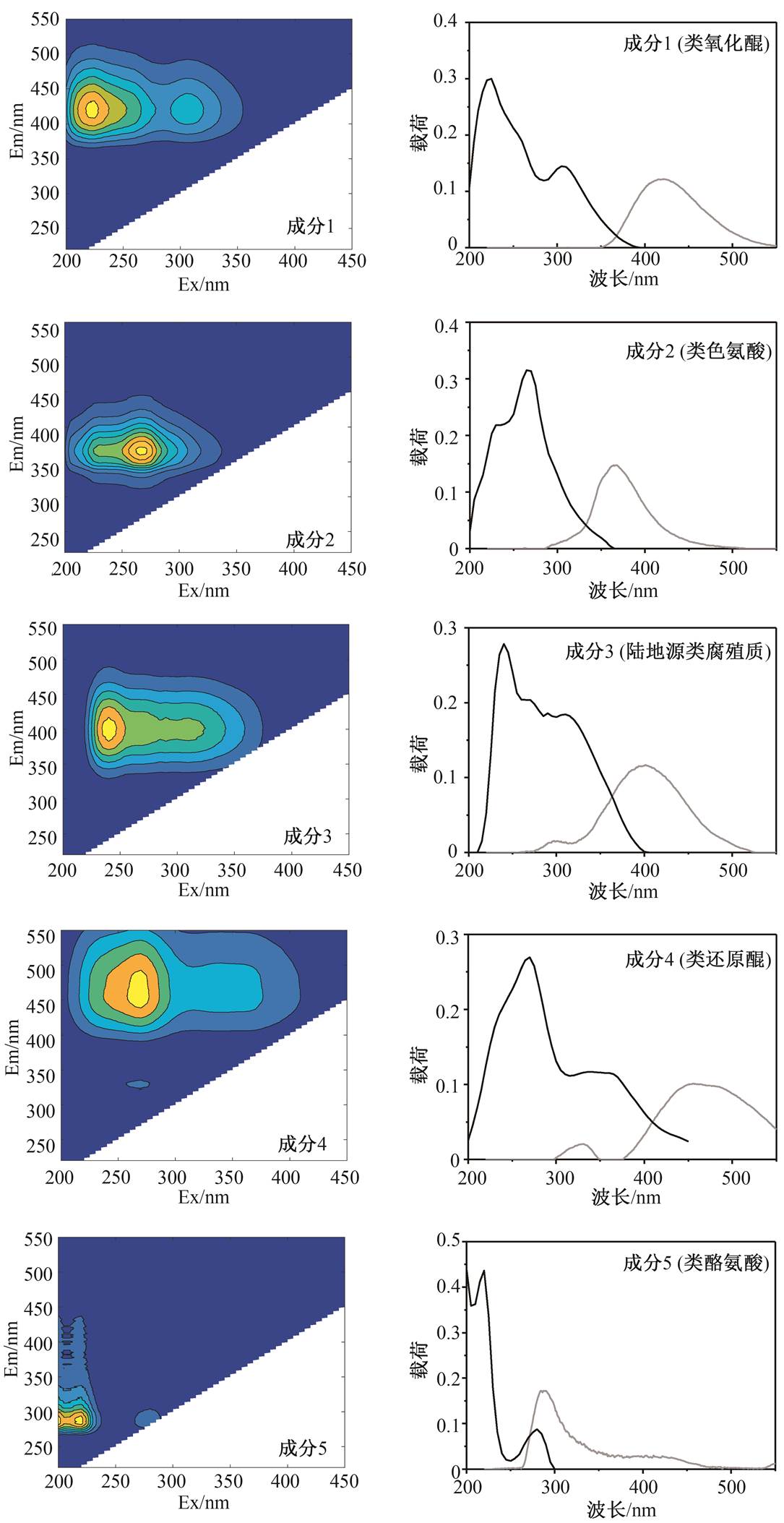
图3 荧光成分EEM图与载荷图
Fig. 3 EEM and loadings of fluorescence components
表2 5个荧光成分特征
Table 2 Characteristics of five fluorescence components

荧光成分Ex/nmEm/nm 主要荧光峰区域物质类型 1220 (310)425类富里酸、类胡敏酸类氧化醌 2230 (270)370溶解微生物代谢产物与芳香蛋白类色氨酸 3245 (310)400类富里酸、类胡敏酸陆地源类腐殖质 4270 (350)335 (460)类胡敏酸类还原醌 5220 (280)290芳香蛋白类酪氨酸
说明: 括号中为第二高的激发或发射波长。
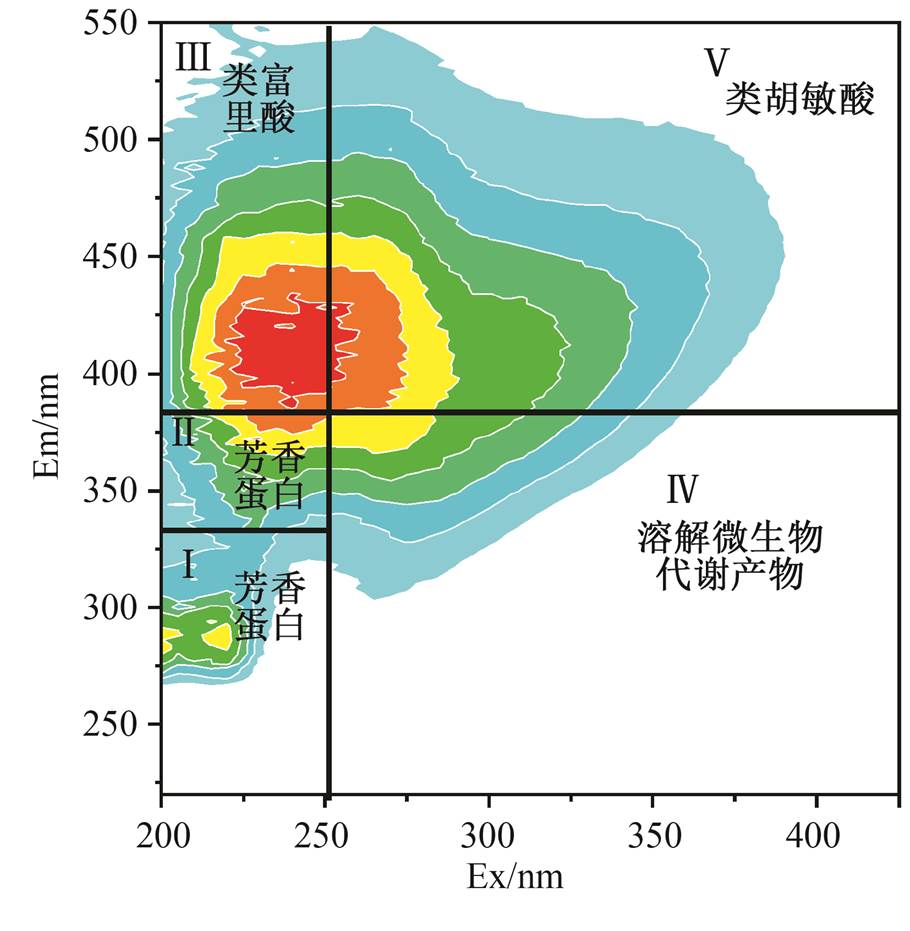
图4 荧光光谱五分区位置
Fig. 4 Location of five regions for EEM
参照文献[9,27–28], 进一步确定荧光成分的物质类型, 结果见表 2。两个未腐殖化荧光素中, 成分 2 为类色氨酸, 成分 5 为类酪氨酸。3 个腐殖化荧光素中, 成分 1 为类氧化醌荧光素, 成分 3 为陆地源类腐殖质荧光素, 成分 4 为类还原醌荧光素, 其在区域 IV 的较弱吸收可能是类酚荧光素, 这是由于氢醌和半醌分子都含有酚结构[14], 另一方面可能是由于微生物还原使氧化醌转变为还原醌[29], 因而含有少量溶解微生物代谢产物。大部分腐殖化荧光素可以归结到不同形态的类醌荧光素[9], 表明醌氧化还原系统是腐殖化结构中的主要发光基团。Cory 等[9]识别出的 13 个荧光成分中, 有 3 个荧光类氧化醌成分和 4 个荧光类还原醌, 本文识别出的荧光成分中类醌成分的数量及比例与之相似。
将腐殖质各荧光成分的强度用 DOC 标准化处理, 以使分析单位腐殖质中的荧光成分强度, 如图 5 所示。可以看出, 在水中, 未腐殖化荧光素占主体(成分 2 和 5), 腐殖化荧光素占比较低(成分 1, 3 和 4), 其中成分 4 占比最低, 说明当地天然有机质中腐殖化结构的占比不高, 且还原醌含量较低。与水中 FA 相比, HA 的腐殖化荧光成分强度较低, 这是由于 HA 分子量更高, 发光基团过于积聚, 产生内部淬灭作用所致[14]。Cory 等[9]研究的湖泊水体DOM 和 FA 中类醌成分占荧光总强度的 50%左右, 高于本研究的 FA(约 30%), 这与 2.1 节中对本研究地区水体腐殖化进程缓慢的分析结果一致。
考虑到未腐殖化荧光成分的占比较高, 为更清楚地分析腐殖化荧光成分之间的关系, 绘制 3 个腐殖化荧光成分的百分比柱状图(图 6)。可以看出, HA的成分 3 占比高于 FA, 说明 HA 中非醌荧光素在腐殖化荧光素中的含量高于 FA。这是由于 HA 氧化程度低于 FA[30], 含氧结构相对较少, 因而非醌结构在腐殖化结构中的含量较高。与 FA 相比, HA 的成分 1 占比较低, 成分 4 占比稍高, 说明 HA 中还原醌含量稍有提高, 氧化醌含量相对降低。这也是由于其氧化程度低, 因此醌氧化还原系统的还原程度高, 与成分 4 反映 HA 信息更多的结果一致。
表 3 列出病区和非病区腐殖质中类醌成分的DOC 标准化荧光强度, 可以看出, 水中 FA 的荧光成分 1 (p<0.10)和成分 4 (p<0.05)以及 HA 的成分 4 (p<0.10)在大骨节病病区样品中的强度高于非病区样品, 并且表现出显著性差异, 表明在水中腐殖质中, 组成醌氧化还原系统的醌类物质含量与大骨节病存在显著关系。成分 4 的显著性高于成分 1, 说明还原醌形态在病区与非病区样本间的差异大于氧化醌形态。这是由于还原醌比氧化醌的自由基含量更高[29], 因此还原醌能提供更多的半醌自由基, 从而起到更强的致病作用。FA 显著性高于 HA, 表明FA 在病区与非病区之间差异大于 HA。在 HA 中, 还原醌在醌氧化还原系统中含量较高, 但由于 HA 溶解度较低, 在水中的 DOC 含量很低, 因此对大骨节病的影响较弱。
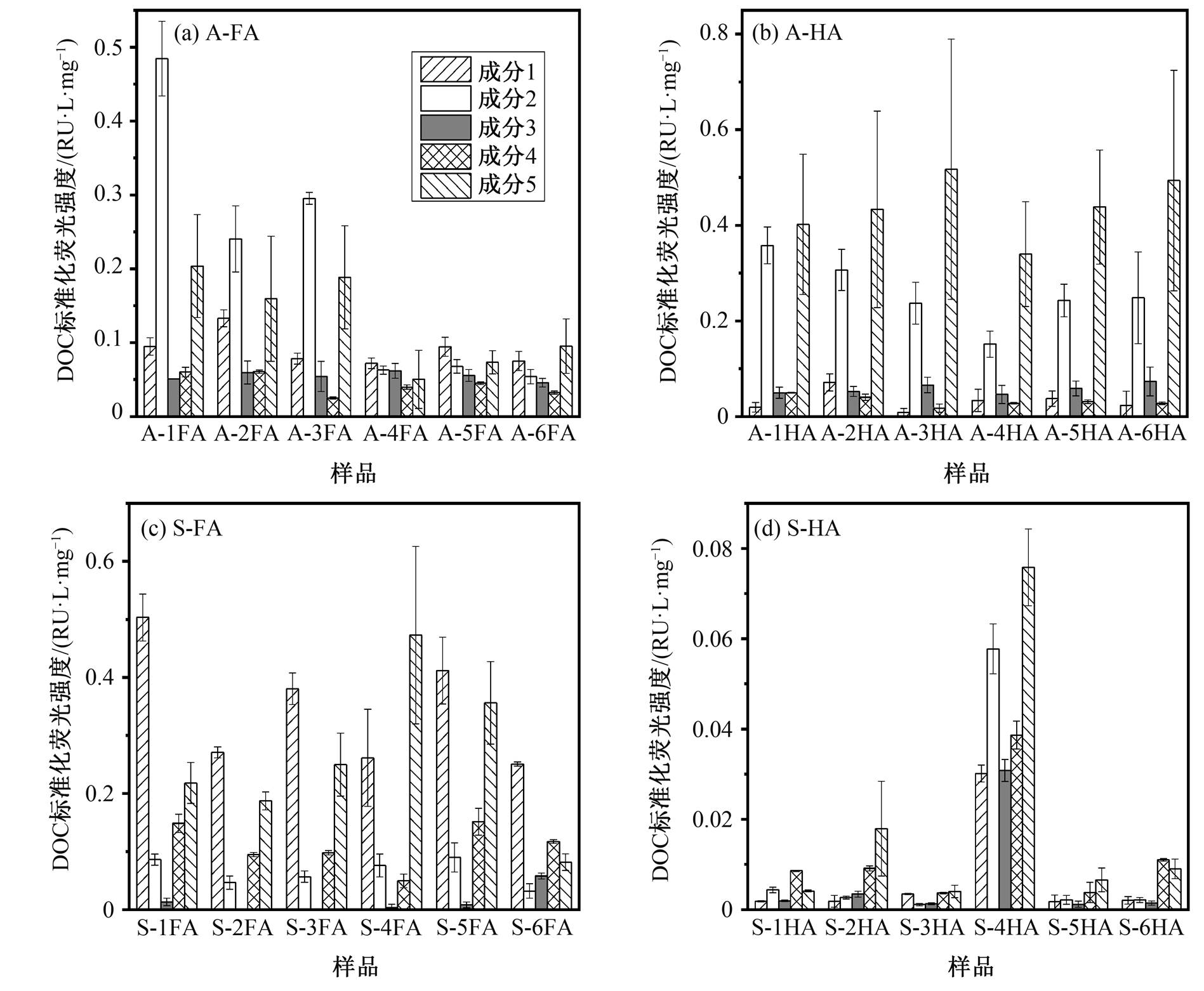
图5 腐殖质荧光成分的DOC标准化荧光强度
Fig. 5 DOC normalized fluorescence intensities of humic substances
从图 5 可以看出, 沉积物腐殖质中腐殖化荧光成分占主体, 与水中腐殖质未腐殖化成分占主体相反, 表明沉积物腐殖质腐殖化程度高于水中腐殖质。沉积物中 HA 荧光强度远低于 FA, 这一方面是由于 HA 的内部猝灭效应, 另一方面是由于腐殖质停留时间越长, 荧光强度越弱[14], 而 HA 的停留时间可达上千年, 远长于 FA。4 号站点 HA 荧光强度远高于其他样品, 说明其停留时间短于其他 HA; FA 中仅 4 号站点 FA 的成分 5 占比大于成分 4, 说明其腐殖化程度稍低, 验证了之前对 4 号站点沉积物腐殖质腐殖化程度低、停留时间短的推测。4 号站点 FA 与其他站点差别较小, 是由于 FA 形成速率快于 HA, 新的改水渠道已经形成并沉积一定含量的 FA。除腐殖化程度较低的 4 号站点外, 沉积物中 FA 的类醌成分占荧光总强度的 60%左右, 大于水中 FA 和文献[9]中水样的研究结果, 这是由于沉积物中腐殖质腐殖化程度高, 醌类结构含量高。
从图 6 可以看出, 沉积物腐殖质的成分 3 占比极低, 水中腐殖质的成分 3 占比大于沉积物腐殖质, 表明沉积物腐殖质中醌类在腐殖化结构中含量较高, 腐殖化程度高于水中腐殖质。HA 中成分 3 的含量略大于 FA, 这与水中腐殖质情况一致, 说明水和沉积物两相中 HA 的非醌结构在腐殖化结构中的含量均高于 FA。沉积物 FA 中成分 1 强度远高于成分4, HA 则相反, 表明 FA 中类醌荧光素主要为类氧化醌, HA 中类醌荧光素主要为类还原醌, HA 中还原醌形态在整个醌氧化还原系统中的含量远高于FA。
从表 3 可以看出, 沉积物中 FA 与 HA 荧光成分的强度均未在病区与非病区样本间表现显著差异, 说明沉积物中腐殖质与大骨节病没有直接关系。尽管沉积物腐殖质中的醌氧化还原系统的含量较高, 且两相间腐殖质通过沉积和再悬浮等作用相互迁移转化, 但在病区与非病区之间差异性不显著, 对大骨节病的影响较小。
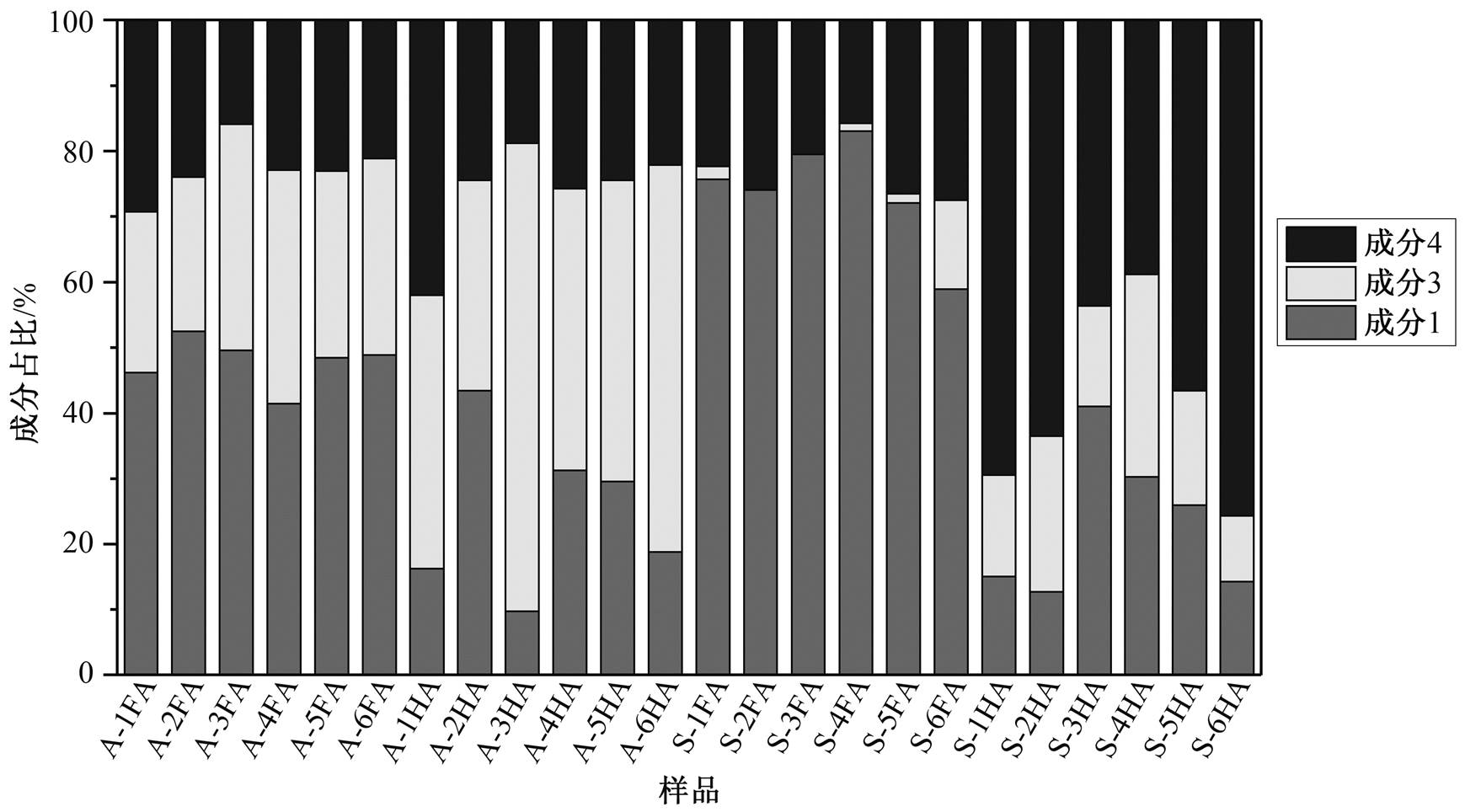
图6 腐殖质中腐殖化荧光成分百分比
Fig. 6 Percent of humified fluorescence components in humic substances
表3 腐殖质中类醌成分DOC标准化荧光强度在病区与非病区间的差异
Table 3 Difference of quinone-like components between endemic and disease-free areas
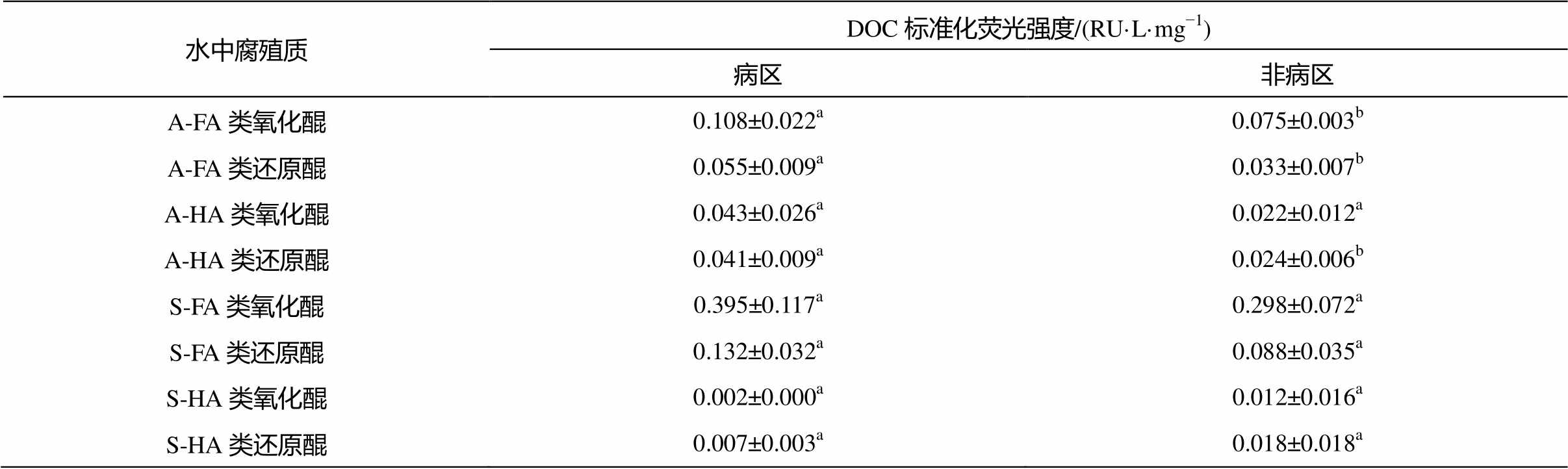
水中腐殖质DOC标准化荧光强度/(RU·L·mg−1) 病区非病区 A-FA类氧化醌0.108±0.022a0.075±0.003b A-FA类还原醌0.055±0.009a0.033±0.007b A-HA类氧化醌0.043±0.026a0.022±0.012a A-HA类还原醌0.041±0.009a0.024±0.006b S-FA类氧化醌0.395±0.117a0.298±0.072a S-FA类还原醌0.132±0.032a0.088±0.035a S-HA类氧化醌0.002±0.000a0.012±0.016a S-HA类还原醌0.007±0.003a0.018±0.018a
说明: a和b表示数据在统计学意义上的分组。
水及沉积物中腐殖质各组分通过沉积、再悬浮和再溶解等作用相互转化, 图 7 显示各组分之间相互转化的相关关系。类还原醌成分/腐殖化成分这一比值在水中 FA 与 HA 之间、沉积物中 FA 与HA 之间显著正相关。除去 3 号和 4 号站点后, 水中FA 与沉积物中 FA 之间类还原醌成分/腐殖化成分的值, 水中 HA 与沉积物 HA 之间类醌成分/腐殖化成分的值, 均呈显著负相关关系, 表明同一站点腐殖质各组分间腐殖化程度具有一致性。
各站点水源主要来自融雪水, 3 号站点虽为岩隙水, 但其含压水层源自附近融雪水地表水体, 因而各站点的水质比较接近。沉积物性质差别较大, 3 号站点的沉积物可能包含较多的褐煤, 与其他沉积物来源差别较大。4 号站点的沉积物来源与其他站点相似, 但由于沉积时间较短, 腐殖化程度远低于其他站点。因此, 在分析水与沉积物两相间腐殖质相互转化关系时, 需去除 3 号和 4 号站点。
由于接触氧气的程度不同, 水中腐殖质易被氧化, 而沉积物中腐殖质受微生物还原作用为主[29]。水中 FA 在腐殖化过程中, 未腐殖化结构主要形成氧化醌, 因而还原醌及非醌在腐殖化结构中占比相对减少, 沉积物 FA 中非醌腐殖化结构几乎为零, 其进一步腐殖化的过程主要是氧化醌逐渐被还原。因此, 腐殖化程度越高, 类还原醌/腐殖化成分的值在水体 FA 中越低, 在沉积物 FA 中越高。HA 中元素组成与 FA 存在差异, HA 的氧化程度低于 FA[14]。水中 HA 在腐殖化过程中, 氧化醌形成较少, 未腐殖化结构主要形成非醌腐殖化结构。沉积物中 HA的进一步腐殖化主要包括非醌转化为醌和氧化醌转化为还原醌这两个同时存在的过程。因此, 腐殖化程度越高, 类醌成分(或类还原醌成分)/腐殖化成分的值在水体 HA 中越低, 在沉积物 HA 中越高。
本研究选取大骨节病地区水及沉积物中腐殖质作为研究对象, 进行 TOC 含量测定及荧光平行因子分析, 发现水及沉积物中腐殖质 TOC 含量均未在病区与非病区之间表现出显著差异,而荧光成分表现出显著差异。
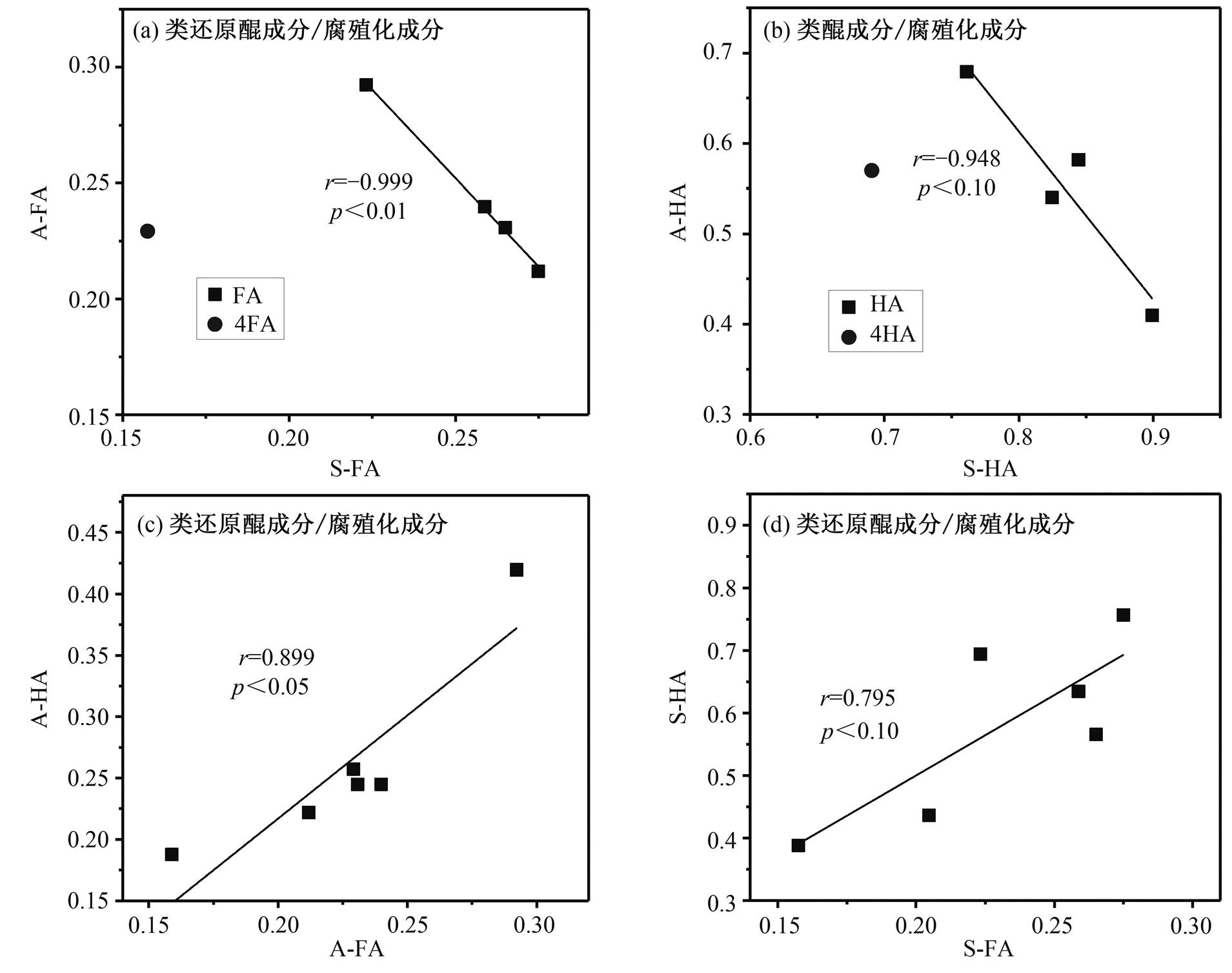
图7 腐殖质组分间相互转化关系
Fig. 7 Relationship of transformation between fractions of humic substances in water and sediment
病区水中 FA 的类还原醌荧光成分(p<0.05)、类氧化醌荧光成分(p<0.10)以及 HA 的类还原醌荧光成分(p<0.10)强度高于非病区样本, 并且存在显著差异, 表明水中腐殖质的醌氧化还原系统含量与大骨节病存在显著关系。对比水中腐殖质醌氧化还原系统在病区和非病区之间的差异, 发现还原醌形态的差异大于氧化醌形态, FA醌系统的差异大于HA醌系统。
沉积物中腐殖质的醌氧化还原系统在腐殖化结构中含量高于水中腐殖质, 且与水中腐殖质在一定程度上相互转化, 但未在病区与非病区间表现出显著差异, 表明沉积物中腐殖质对大骨节病没有直接的影响。
FA 和 HA 中醌类物质组成比例存在差异。FA氧化程度高, 醌氧化还原系统的含量高于 HA。HA还原性高, 还原醌含量较高, 但水中 HA 由于 DOC含量很低, 对大骨节病的影响较弱, 在病区与非病区之间差异较小。
研究结果对分析大骨节病流行地区饮用水源是否有致病风险以及改水工程的实施具有指导意义。
参考文献
[1]Peng A, Yang C, Rui H, et al. Study on the pathogenic factors of Kashin-Beck disease. Journal of Toxicology & Environmental Health, 1992, 35(2): 79–90
[2]刘运起, 刘辉, 刘宁, 等. 中国大骨节病病情监测结果分析与未来流行趋势的估计. 中国地方病防治杂志, 2011, 26(4): 259–264
[3]黄慧, 李富忠, 杨小静, 等. 四川省 32 县大骨节 病控制和消除评价结果分析. 预防医学情报杂志, 2017, 33(4): 355–360
[4]Winterbourn C C, French J K, Claridge R F C. Supe-roxide dismutase as an inhibitor of reactions of semi-quinone radicals. Febs Letters, 1978, 94(2): 269–272
[5]王治伦. 大骨节病 4 种病因学说的同步研究. 西安交通大学学报(医学版), 2005, 26(1): 1–7
[6]王文华, 王子健. 大骨节病病区环境中的有机物. 中国地方病防治杂志, 1990, 5(1): 9–11
[7]He W, Hur J. Conservative behavior of fluorescence EEM-PARAFAC components in resin fractionation processes and its applicability for characterizing dissolved organic matter. Water Research, 2015, 83: 217–226
[8]Kennedy M J, Gandomi A H, Miller C M. Coagulation modeling using artificial neural networks to predict both turbidity and DOM-PARAFAC component remo-val. Journal of Environmental Chemical Enginee- ring, 2015, 3(4): 2829–2838
[9]Cory R M, Mcknight D M. Fluorescence spectroscopy reveals ubiquitous presence of oxidized and reduced quinones in dissolved organic matter. Environmental Science & Technology, 2005, 39(21): 8142–8149
[10]Leenheer J A. Comprehensive approach to preparative isolation and fractionation of dissolved organic car-bon from natural waters and wastewaters. Environ-mental Science & Technology, 1981, 15(5): 578–587
[11]Thurman E M, Malcolm R L. Preparative isolation of aquatic humic substances. Environmental Science & Technology, 1981, 15(4): 463–466
[12]Ma H Z, Yin Y J, Allen H E. Characterization of isolated fractions of dissolved organic matter from natural waters and a wastewater effluent. Water Re-search, 2001, 35(4): 985–996
[13]Swift R S. Organic matter characterization // Swift R S, Sparks D L, Page A L, et al. Methods of soil analysis. Part 3. chemical methods. Madison, WI: Soil Science Society of America, 1996: 1018–1020
[14]Sierra M M, Giovanela M, Parlanti E, et al. Fluorescence fingerprint of fulvic and humic acids from varied origins as viewed by single-scan and excitation/emission matrix techniques. Chemosphere, 2005, 58(6): 715–733
[15]Sanchez N P, Skeriotis A T, Miller C M. Assessment of dissolved organic matter fluorescence PARAFAC components before and after coagulation-filtration in a full scale water treatment plant. Water Research, 2013, 47(4): 1679–1690
[16]Zepp R G, Sheldon W M, Moran M A. Dissolved organic fluorophores in southeastern US coastal waters: correction method for eliminating Rayleigh and Raman scattering peaks in excitation-emission matrices. Marine Chemistry, 2004, 89(1): 15–36
[17]Lawaetz A J, Stedmon C A. Fluorescence intensity calibration using the Raman scatter peak of water. Applied Spectroscopy, 2009, 63(8): 936–940
[18]Stedmon C A, Bro R. Characterizing dissolved organic matter fluorescence with parallel factor analysis: a tutorial. Limnology & Oceanography Methods, 2008, 6(11): 572–579
[19]金鑫, 金鹏康, 孔茜, 等. 基于PARAFAC分析的二级出水 DOM 臭氧化特性研究. 中国环境科学, 2015, 35(2): 427–433
[20]Holbrook R D, Yen J H, Grizzard T J. Characterizing natural organic material from the Occoquan Water-shed (Northern Virginia, US) using fluorescence spec-troscopy and PARAFAC. Science of the Total Envi-ronment, 2006, 361(1/2/3): 249–266
[21]Carstea E M, Baker A, Bieroza M, et al. Characteri-sation of dissolved organic matter fluorescence pro-perties by PARAFAC analysis and thermal quenching. Water Research, 2014, 61(18): 152–161
[22]Wei H, Jin H. Conservative behavior of fluorescence EEM-PARAFAC components in resin fractionation processes and its applicability for characterizing dis-solved organic matter. Water Research, 2015, 83(44): 217–226
[23]李胜伟, 赵松江, 曹楠, 等. 壤塘县大骨节病饮水性致病因素分析及改水模式探索. 中国地质, 2010, 37(3): 594–599
[24]彭安, 杨春林, 何闰根, 等. 大骨节病病区饮水中自由基的测定. 环境化学, 1988, 7(5): 12–17
[25]王强, 龙耀庭, 陆妙琴, 等. 大骨节病区饮用水中小分子有机化合物的分离及自由基的测定. 环境化学, 1989, 8(2): 44–48
[26]Chen W, Westerhoff P, Leenheer J A, et al. Fluore-scence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter. Environmental Science & Technology, 2003, 37(24): 5701–5710
[27]Stedmon C A, Markager S, Bro R. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy. Marine Che-mistry, 2003, 82(3/4): 239–254
[28]Stedmon C A, Markager S. Resolving the variability in dissolved organic matter fluorescence in a tempe-rate estuary and its catchment using PARAFAC ana-lysis. Limnology & Oceanography, 2005, 50(2): 686–697
[29]Scott D T, Mcknight D M, Blunt-Harris E L, et al. Quinone moieties act as electron acceptors in the reduction of humic substances by humics-reducing microorganisms. Environmental Science & Techno-logy, 1998, 32(19): 2984–2989
[30]Whitby L M, Schnitzer M. Humic and fulvic acids in sediments and soils of agricultural watershed. Cana-dian Journal of Soil Science, 1978, 58(2): 167–178
Characteristics of Humic Substances in KBD-Affected Region of Changdu, Tibet Based on PARAFAC of Fluorescence
Abstract Humic substances (HS) in Kaschin-Beck disease (KBD) affected regions were analyzed based on parallel factor analysis (PARAFAC) of fluorescence. Total organic carbon content of HS did not show significant difference between endemic and disease-free areas. Five fluorescence components were identified with PARAFAC, i.e. component 1 (oxidized quinone-like), component 2 (tryptophan-like), component 3 (terrestrial humic-like), component 4 (reduced quione-like) and component 5 (tyrosine-like). Component 1 (p<0.10), component 4 (p<0.05) of aquatic fulvic acid (FA) and component 4 (p<0.10) of aquatic humic acid (HA) in endemic areas showed higher content than disease-free areas. Lager differences of the quinone redox system in aquatic HS between endemic and disease-free areas exhibited in reduced quinone state than that in oxidized quinone state, and in FA than that in HA. HA showed higher content of reduced quinone than FA, but smaller differences between endemic and disease-free areas for its weaker influence on KBD due to extremely low carbon content in drinking water. Sediment HS showed mutual transformation with aquatic HS and higher content of reduced quinone, but no significant diffe-rences between endemic and disease-free areas. Intensive understanding on the differences of different fractions of HS and different state of quinone between endemic and disease-free areas can help guiding water improvement project in endemic areas.
Key words three-dimensional fluorescence spectrum; parallel factor analysis; Kaschin-Beck disease (KBD); fulvic acid; humic acid; quinone redox system
doi: 10.13209/j.0479-8023.2019.031
国家自然科学基金(51579003)和流域生态工程学学科建设项目(深发改[2017]542号)资助
收稿日期: 2018–05–14;
修回日期: 2018–05–31