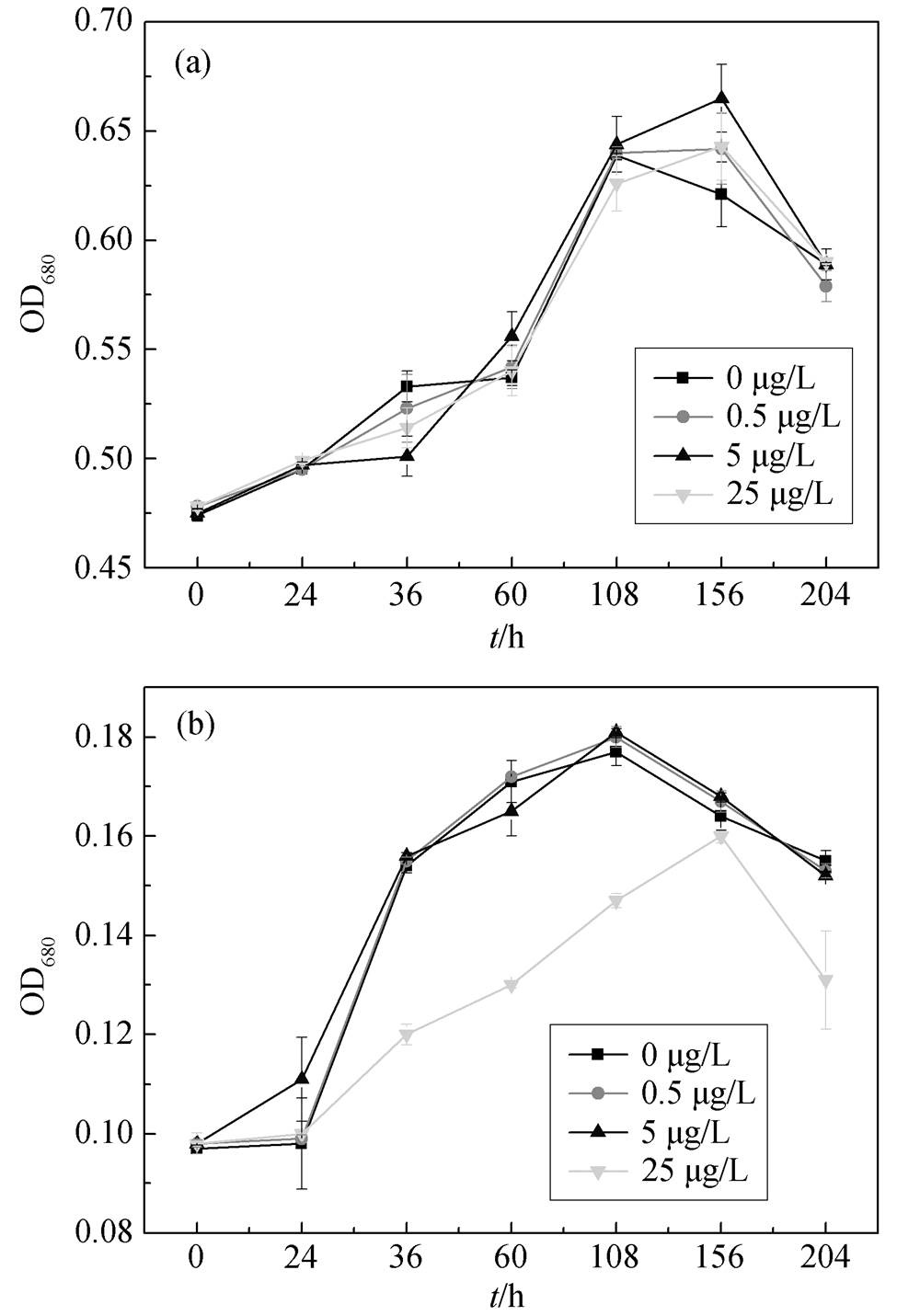
图1 不同HgCl2浓度对塔玛亚历山大藻(a)和锥状斯式藻(b)生长的影响
Fig. 1 Growth curves of Alexandrium tamarens (a) and Scrippsiella trochoidea (b) at different concen-tration of HgCl2
摘要 研究塔玛亚历山大藻(Alexandrium tamarens)和锥状斯式藻(Scrippsiella trochoidea)两种赤潮藻对海水中汞的富集和甲基化的影响, 探讨赤潮藻对硫铁还原地杆菌 Geobacter sulfurreducens PCA(G.sulfurreducens PCA)汞生物甲基化的抑制作用。实验结果表明, 不同种类藻对汞的耐受性不同, 高浓度 HgCl2 (≥25 μg/L)抑制锥状斯式藻的生长, 而对塔玛亚历山大藻的影响较小。两种藻均可有效地富集无机汞, 但直接进行汞甲基化的效果不显著。FTIR 分析发现, 藻细胞表面分泌的大量羧基、氨基和羟基等官能团是富集汞的主要位点。汞-藻-菌实验中, 当 HgCl2 初始浓度为 10 ug/L 时, G.sulfurreducens PCA 驱动的汞生物甲基化效率可达 (6.38±0.4)%, 在 G.sulfurreducens PCA 与塔玛亚历山大藻共存的实验组中, 汞甲基化效率为 (1.04±0.44)%, G.sulfurreducens PCA 与锥状斯式藻的实验组中汞甲基化效率低至 (0.76±0.05)%, 两种赤潮藻的加入抑制了 G. sulfurreducens PCA的汞生物甲基化。
关键词 汞; 甲基化; 锥状斯式藻; 塔玛亚历山大藻; 硫铁还原地杆菌PCA
汞是一种分布广泛的全球性剧毒污染物, 以元素汞(Hg0)、无机汞(Hg+和 Hg2+)和有机汞等多重形态赋存于大气、海洋、河流、湖泊以及陆地等生态系统中[1]。不同化学形态汞的毒性和生物可利用性不同, 且在水生生态系统中可相互转化[2]。毒性最高的甲基汞(MeHg)可通过水生食物网进行生物累积, 严重危害水生生物、陆地生物和人类健康[3]。人类活动增加了全球环境中的汞污染。我国是人为排放汞最多的国家, 排放量达到 500~700t/a[4], 因此研究汞的迁移转化对控制汞污染危害具有重要意义。
汞在水环境中迁移转化时, 甲基化作用和去甲基化作用同时发生。甲基化过程主要分为生物甲基化和非生物甲基化, 其中生物甲基化过程占主要部分[5]。生物甲基化过程中起主要作用的菌种包括硫酸盐还原菌(sulfate-reducing bacteria, SRB)[6]、铁还原菌(iron-reducing bacteria, IRB)和产甲烷菌[7], 其中铁还原地杆菌 G. sulfurreducens PCA 是一种典型的汞甲基化细菌, 能够将无机汞转化为 MeHg[8–9]。影响汞甲基化过程的因素包括微生物种类、pH、氧化还原电位、温度[10]、含硫化合物[11]、溶解性有机物[12]和汞的生物可利用性, 这些因素对汞甲基化反应的影响不是孤立的, 通常是多种因素的综合作用。
水体富营养化对水生生态系统中汞的生物地球化学过程有重要影响[13]。在富营养化的水体中, N和 P 等无机营养盐大量增加, 造成藻类爆发式增长, 大量消耗水中的溶解氧, 改变水体的氧化还原条件、pH 和温度等水质参数。在这种缺氧还原性的水体中, 铁和锰等金属被还原, 底泥中的磷酸盐和重金属等沉积型物质被释放, 进一步促进水体底层厌氧性还原环境的形成, 影响水体中汞的化学形态及生物可利用性, 进而影响MeHg的产生[14–15]。在厌氧环境中, 硫酸盐还原菌和铁还原菌的生境得到改善, 有可能促进汞甲基化反应。
随着我国海水养殖业规模的扩大, 海水养殖环境恶化, 饵料和排泄物等进入水体, 加速富营养化, 导致赤潮频繁发生。但是, 目前针对水体中浮游植物大规模繁殖对汞化学循环影响的相关研究集中在淡水生态系统, 关于海洋赤潮对汞地球化学行为影响的研究鲜有报道。本文探讨两种海洋赤潮藻——塔玛亚历山大藻和锥状斯式藻对汞的富集以及对汞甲基化的影响, 以期为研究海洋富营养化对汞的生物地球化学迁移影响提供实验依据。
主要仪器: 智能光照培养箱(宁波江南 GXZ型); 厌氧工作站(Don Whitely ScientificDG250); UV-2600 型号紫外–可见分光光度计(日本 Shimadzu);总汞(THg)和甲基汞(MeHg)测定所用检测仪器来自 Brooks Rand (美国), 包括汞形态气相裂解模块、MODEL III 型原子荧光光度计和 TDM-II 型解吸附模块; SHZ-82 型水浴恒温振荡器(中国江苏金怡仪器有限公司); HV-25 型高压灭菌锅(日本Hirayama); 傅里叶变换红外光谱仪(Fourier Transform Infrared Spectrometer, FTIR, 美国Perkin Elmer Spectrum 100)。
主要试剂: 氯化汞(分析纯)购自泰州市友联化工有限公司, 四乙基硼酸钠(分析纯)和溴酸钾(分析纯)购自北京百灵威科技有限公司, 冰乙酸(优级纯) 购自上海阿拉丁生化科技股份有限公司。
1.2.1PCA菌培养基制备
实验使用的汞甲基化微生物铁还原菌为 G. sulfurreducens PCA, 购自中国科学院广州能源研究所。菌株 G. sulfurreducens PCA 培养基为改良的NBF培养基, 1L 培养基包含的成分为 0.04g CaCl2.2H2O,0.1 g MgSO4.7H2O, 1.8 g NaHCO3, 0.5 g Na2CO3. H2O, 2.04 g NaAC.3H2O, 0.42 g KH2PO4, 0.22 g K2HPO4, 0.2 g NH4Cl, 0.38 g KCl, 0.36 g NaCl, 0.0214 g氨三乙酸NTA, 0.001 g MnCl2·4H2O, 0.003 g FeSO4·7H2O, 0.0017 g CoCl2·6H2O, 0.002 g ZnSO4·7H2O, 0.0003 g CuCl2·2H2O, 0.00005 g AlK(SO4)2·12H2O, 0.00005 g H3BO3, 0.0009 g Na2MoO4·2H2O, 0.0011 g NiSO4·6H2O, 0.0002 g Na2WO4·2H2O, 生物素和叶酸各 0.00003g, 对氨基苯甲酸、泛酸、硫辛酸、烟酸、硫胺素和核黄素各0.00075g, 维生素 B120.0000015g, 盐酸吡哆醇0.00015 g, 1 mL 1 mmol/L Na2SeO4。
G. sulfurreducens PCA 为厌氧微生物, 因此需要对 NBF 培养基进行厌氧处理。将配置好的培养基放入厌氧工作站除氧 2 小时, 之后塞紧瓶盖取出密封, 120°C高压灭菌 20 分钟。
1.2.2藻类的培养基制备
研究所用锥状斯式藻Scrippsiella trochoidea 和塔玛亚历山大藻Alexandrium tamarens来自清华大学深圳研究生院海洋科学与技术学部, 培养基为f/2[16]培养基。
1.2.3细胞浓度检测
利用紫外分光光度计测定细菌的 OD600 和藻类的 OD680 值, 进行生长情况分析。
1.2.4总汞和甲基汞检测
水样 THg 测定步骤: 在水样中加入 0.5% (体积比)BrCl溶液, 密封, 将水体中各种形态的汞氧化成二价汞, 放置 24小时以上。测样前, 每 100mL样品加入 200μL 25% NH2OH·HCl, 反应 30分钟, 去除游离态卤素。取水样至气泡瓶, 加入 100μL SnCl2, 将二价汞全部还原成零价汞, 打开氮气阀门, 金管富集吹扫出的零价汞, 氮气吹扫 15分钟后, 将金砂管组装至原子荧光测汞仪, 上机检测。
水样 MeHg 测定方法: 参照蒸馏乙基化结合GC-CVAFS 法测定[17], 最低检出限为 0.009 ng/L。取 45mL 水样至 Teflon 蒸馏瓶, 盖紧瓶盖。接收瓶中加入 5.0 mL 超纯水, 接收瓶外部全程处于冰水混合物中。通 N2, 当水样被蒸出 80%~85%时, 将蒸馏液全部倒入反应瓶中, 用 CVAFS 法测定。
1.2.5 藻体FTIR分析
取溴化钾载体与藻体样品(样品与载体的质量比为 1:100)置于玛瑙研钵中, 充分磨细, 混匀, 装模, 然后将模具置于压片机上抽真空加压 2 分钟, 把样品压制成 0.1~1.0 mm厚的透明薄片, 置于红外光谱仪的样品室中进行测试。仪器的分辨率设定为 4cm–1, 扫描范围为 4000~500cm–1, 扫描次数为16 次, 得到FTIR谱图。
1.2.6 元素含量分析
藻类培养基经过 0.45mm 膜过滤后, 藻体中的CHNS/O 含量采用 CHNS/O 元素分析仪测定, 滤液中的可溶性有机物(dissolved organic matter, DOM)含量采用总有机碳(total organic carbon, TOC)分析仪检测。
采用 2.5L 的硼硅玻璃培养瓶, 将两种藻分别接种至海水配置的 f/2 灭菌培养基中(1.0 L), 培养至稳定期(塔玛亚历山大藻 OD680≈0.475, 锥状斯式藻OD680≈0.098)后, 加入不同浓度的 HgCl2 溶液, 实验组培养基中 HgCl2 浓度分别为 0.5, 5 和 25μg/L, 对照组不加入 HgCl2, 每个浓度设置 3 个平行组, 光照周期为 12 L:12 D, 光照强度为 5000 lx, 培养温度为(25±1)°C。实验周期为 9 天, 每日摇晃 2~3 次, 随机调换培养瓶的位置, 分别在加入 HgCl2后的 0, 12, 36, 60, 108, 156 和 204 h取样, 检测藻体密度、藻体元素含量以及溶液中 DOM, THg 和 MeHg 浓度的变化。
在无菌操作条件下, 将 PCA 菌接种至装有 100 mL NBF 培养基的 250 mL厌氧培养瓶中, 于振荡培养箱中培养 48h 后, 依次加入不同浓度的 HgCl2溶液, 实验组培养基中 HgCl2 的初始浓度为 5, 10, 50, 100 和 200μg/L, 对照组中 HgCl2浓度为 0μg/L, 每个浓度设置 3 个平行组, 37℃恒温避光振荡培养。培养时间为 7 天, 分别在第 0, 24, 48, 72, 96 和144 h 取样, 样品经 0.22μm 的聚醚砜(PES)过滤膜过滤后, 检测溶液中 THg 和 MeHg 的量。
采用 2.5L 的硼硅玻璃培养瓶, 将两种藻分别培养至稳定期后加入 HgCl2 溶液, 使培养基中 HgCl2浓度为 100μg/L。36h 时达到富集平衡后, 分别取出 50, 100 和 250mL 藻液, 离心备用。用 250mL 厌氧培养瓶培养 95mL PCA 菌至稳定期(约 48h, OD600 ≈0.60), 离心后的藻用 5mL 除氧灭菌后的NBF 培养基溶解, 用注射器注入厌氧培养瓶中, 摇匀, 设置 3个平行组, 培养时间为 7 天, 分别在第 0, 24, 48, 72, 96 和 144h 取样, 样品经 0.22μm 聚醚砜(PES)过滤膜过滤, 检测溶液中 THg 和 MeHg 的变化。
所有实验均在厌氧工作站中进行, 培养液经过N2:CO2 (体积比为 80:20, 气体流速为 0.50L/min)脱氧 30 分钟, 严格控制溶解氧浓度。
高浓度 Hg2+对藻类的生长具有一定的抑制作用, 不同藻类对汞毒性的抵抗能力也不相同。如图1 所示, 在本研究所用的 HgCl2浓度范围(0~25μg/L)内, 塔玛亚历山大藻(图 1(a))的藻体生长情况良好, 与对照组没有显著差异。在培养期间, 塔玛亚历山大藻一直表现出旺盛的生长和繁殖能力, 表明塔玛亚历山大藻对汞的毒性具有很强的耐受性。当HgCl2浓度≤ 5μg/L 时, 锥状斯式藻(图 1(b))的藻体生长情况良好, 与对照组没有显著差异。但是, 当HgCl2 浓度达到 25μg/L, 培养 12h 后, 藻密度一直处于较低水平, 表明藻体的生长速率较低, 锥状斯式藻的生长明显受到汞的抑制, 到达稳定期所需的时间也大大增加, 藻密度总量也略有下降。因此, 不同种类的藻对汞的耐受性不同, 塔玛亚历山大藻对汞毒性的耐受能力高于锥状斯式藻。

图1 不同HgCl2浓度对塔玛亚历山大藻(a)和锥状斯式藻(b)生长的影响
Fig. 1 Growth curves of Alexandrium tamarens (a) and Scrippsiella trochoidea (b) at different concen-tration of HgCl2
2.2.1 藻对汞形态的影响
图 2 显示, 在 THg 浓度水平高达 25μg/L (>0.1μg THg/L 的海水水质标准[18])的富汞培养基中, 所有藻类培养体系内均无 MeHg 生成。在初期的 12h 内, MeHg 浓度相对较高(1~2ng/L)。在后续实验中, MeHg 的浓度不断降低, 且 Hg2+ (THg)向 MeHg的转化率持续低于 1‰。上述实验结果表明, 在不同藻密度和 HgCl2 浓度下, 塔玛亚历山大藻和锥状斯氏藻生长均对汞甲基化过程影响甚微, 汞污染主要以无机形态存在。
图 2(a)和(b)分别表示初始 HgCl2 浓度为 5 和 25 μg/L 时, 塔玛亚历山大藻培养基中 THg 的浓度变化。0h 时, 无藻组、低密度藻组和高密度藻组培养基中的 THg 浓度依次降低, 即游离态 Hg2+的浓度随着藻密度的增高而降低。当时间推移至 36h, 富集反应逐渐达到平衡, THg 浓度不再明显变化。平衡时, 溶液中 THg 浓度分别为 200 和 800ng/L, 仅为初始浓度的 3%~4%, 表明塔玛亚历山大藻对汞具有较强的富集作用。
图 2(c)和(d)分别表示锥状斯式藻培养基中不同初始浓度的 THg 随时间的形态分布变化。0h 时, 无藻组溶液中 THg 浓度明显高于低密度藻组和高密度藻组, 并且藻密度越高, 水中总汞浓度越低。36h后, 溶液中 THg 浓度趋于平衡, 维持在 500 和2500ng/L左右, 约为初始浓度的 10%, 表明汞主要以结合态被富集在藻体中。
对比锥状斯式藻和塔玛亚历山大藻培养体系中的 THg 浓度可知, 藻类受 HgCl2 胁迫的影响程度与其细胞特性紧密相关。由于细胞中藻类纤维素含量较高[19–22], 塔玛亚历山大藻具有更多捕获汞的功能性连接基团(如硫醇基团)[23], 导致游离态 Hg2+浓度略低于锥状斯式藻培养体系。此外, 塔玛亚历山大藻的生长几乎没有受到 Hg 的抑制, 能够保持良好的生物活性和对无机汞的富集能力。因此, 塔玛亚历山大藻能从被污染的海水中有效地富集无机汞。
2.2.2 藻对汞的富集机理
在本实验的 HgCl2 污染条件下, 溶液中 THg 和MeHg 浓度的下降主要是由于藻体官能团对汞的结合作用。通过测定两种藻富集 Hg2+前后的 FTIR 图谱, 有助于定性地解析藻体官能团在汞富集过程的作用。如图 3 所示, 塔玛亚历山大藻位于 3301cm–1处的吸收峰蓝移到 3320 cm–1, 这是由于藻细胞中羟基上的孤对电子与 Hg2+离子发生相互作用; 1415cm–1 处的吸收峰蓝移到 1443cm–1, 主要是由 C==O的结构改变所致; 1236cm–1 和 1161cm–1 处的羟基振动峰吸收峰消失, 说明在富集过程中, 氨基及羟基的孤对电子对可能参与了和 Hg2+的螯合反应; 1153cm–1 出现 C—H 变形振动和 C—N—C 的伸缩振动峰, 可见藻细胞中的酚羟基和氨基对汞富集有一定的贡献。图 3 中, 锥状斯式藻富集汞后, 没有出现新的吸收峰, 但是吸收峰强度整体减弱。其中, O—H 和N—H 受 Hg2+离子影响, 吸收峰由 3309cm–1 蓝移至3347cm–1, 这是由于羟基上具有孤对电子的 O 与汞离子发生作用。此外, C—H 变形振动峰 1442 cm–1红移到 1423 cm–1, 可能产生—OCH3基团。
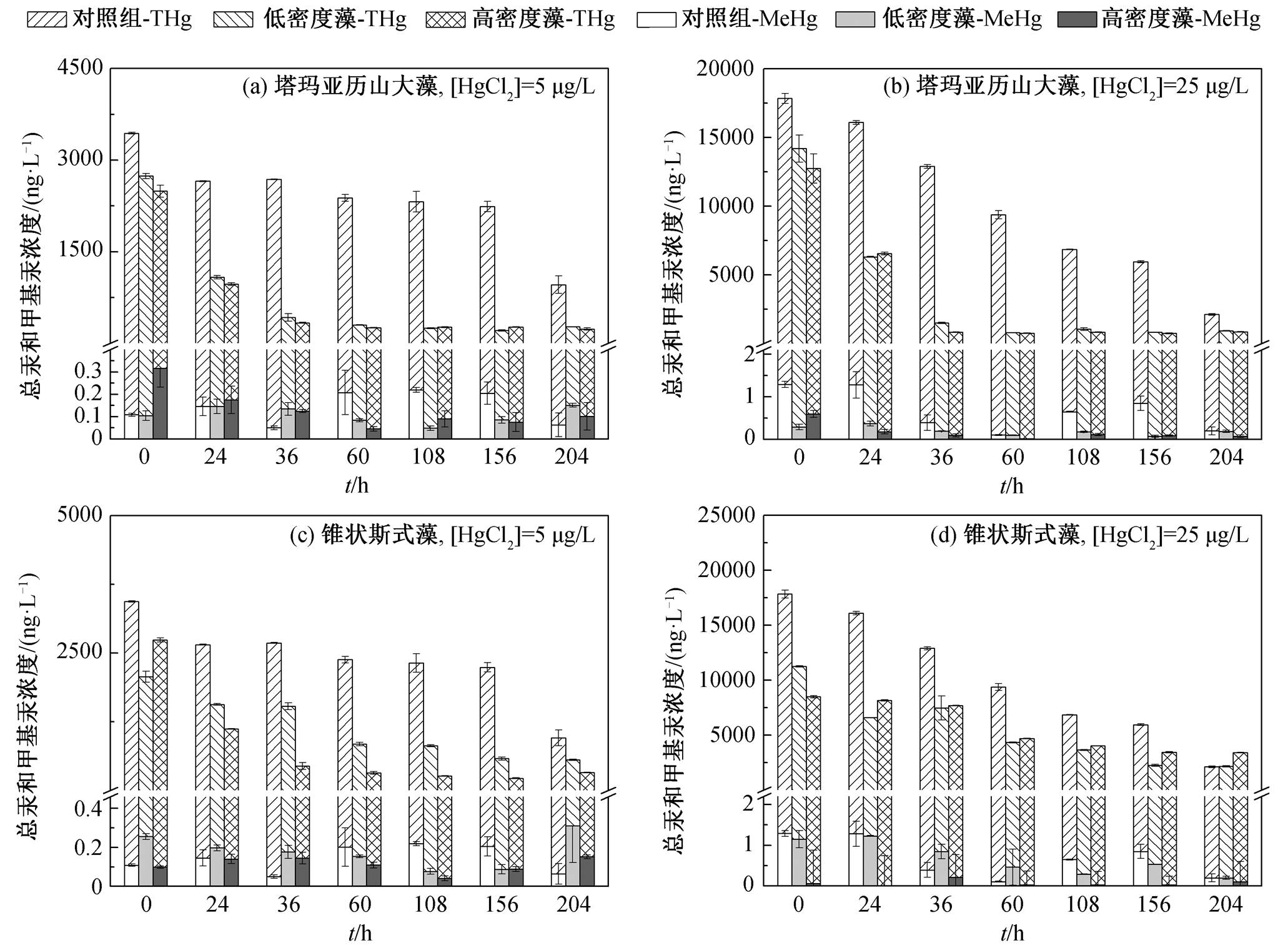
图2 塔玛亚历山大藻和锥状斯式藻培养体系中THg和MeHg的浓度分布
Fig. 2 THg and MeHg concentrations in Hg-containing culture for Alexandrium tamarens and Scrippsiella trochoidea
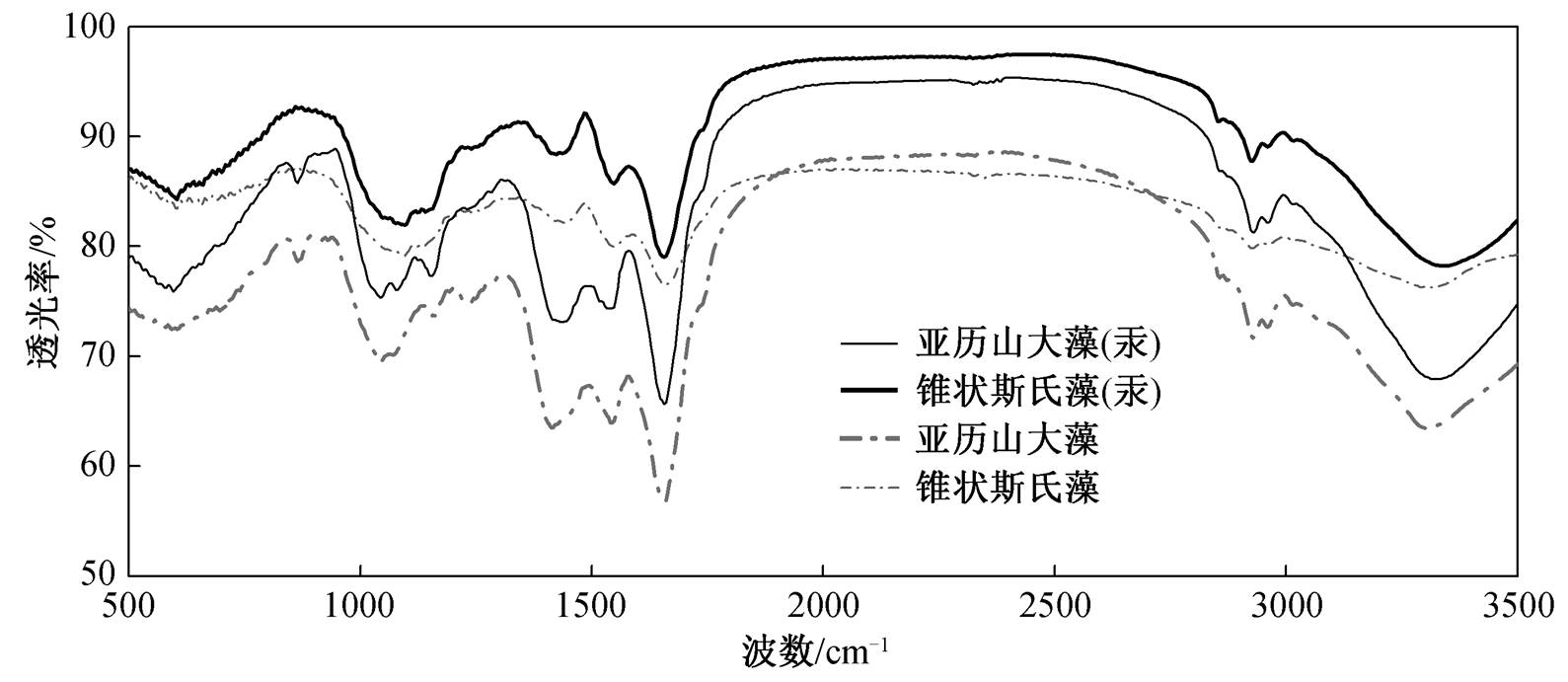
图3 塔玛亚历山大藻和锥状斯式藻富集前后的FTIR谱图
Fig. 3 FTIR spectra of Alexandrium tamarens and Scrippsiella trochoidea before and after adsorption
以 2928 cm–1 处—CH3 中 C—H 特征吸收峰的吸光度(A2928)为基准, 表征每个谱图中特征峰强度 A 相对于 A2928 的比值(A/A2928), 针对吸收强度发生变化的特征峰, 进行汞–藻反应的半定量分析。由表 1可知, 两种赤潮藻的官能团的特征峰 A/A2928 值均有所变化, 说明藻对汞胁迫产生一定的应激性反应。塔玛亚历山大藻富集Hg2+后, O–H 和 N–H 的伸缩振动吸收峰值 A3320/A2928 和 C—O 的伸缩振动吸收峰值 A1160/A2928 减弱, 说明 Hg 与该类含 C, N 或 O 结构之间的作用导致官能团数量减少。A1544/A2928处的—N—H (酰胺 II 带)和 A1656/A2928 处的—C—N (酰胺 I带)吸收峰值略有增加, 表明在 Hg 的刺激作用下, 塔玛亚历山大藻可能合成或分泌了一定的氨基酸、蛋白质和多肽类物质来络合或固定 Hg2+, 以减轻汞污染对自身的毒害作用。锥状斯氏藻富集 Hg2+后, 代表 O—H/N—H 振动峰的 A3320/A2928 值低于藻体本身, 说明—OH 基官能团与 Hg 发生了明显的交互作用, 使得藻细胞含有的—OH 数量下降。1656 cm–1和 1544 cm–1 处的酰胺 II 带吸收峰强度减弱, 可能是由细胞壁上的 N—H 基团减少、蛋白质含量下降所致。另外, 多糖环结构的—C—C 或 C—O 伸缩振动峰 A1160/A2928和 A1200/A2928、—CH 弯曲或—C—C、—C—O 的伸缩振动峰 A1044/A2928 比值均有所下降, 反映锥状斯氏藻对汞污染较弱的耐受能力。由于吸收峰强度较弱, FTIR 图谱未能明确含 S 基团(如–SH)的存在。元素分析显示, 藻体中 C, N, S和O 的含量分别为 (11.79±1.14)%, (1.69±0.21)%, (1.52± 0.48)%和( 81.41±1.23)%, 表明可能存在大量的含碳、氧基团和少量含氮、硫基团, 这些基团在汞富集过程中发挥重要作用。
表1 FTIR半定量分析结果
Table 1 Half-quantitative analysis results of FTIR spectra
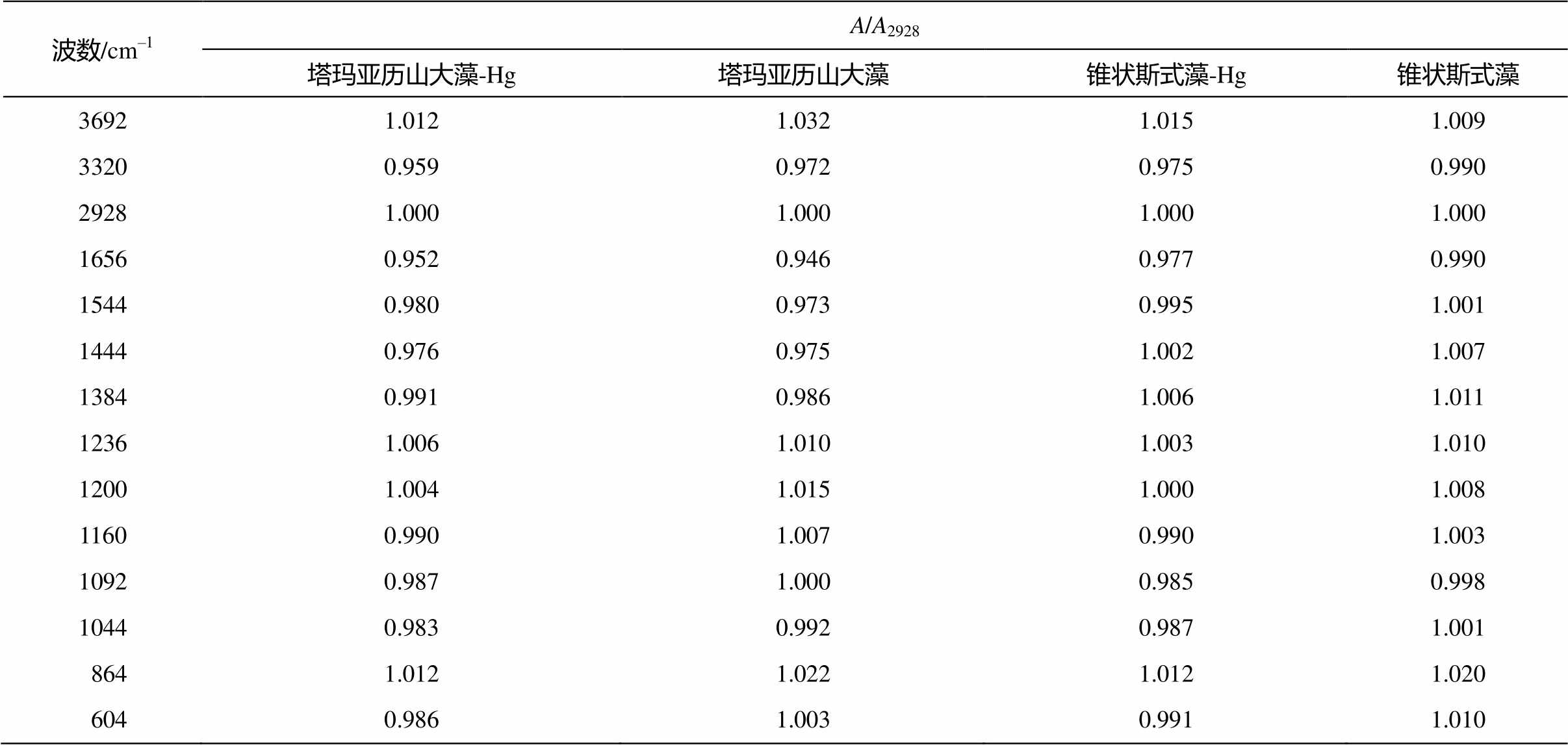
波数/cm–1A/A2928 塔玛亚历山大藻-Hg塔玛亚历山大藻锥状斯式藻-Hg锥状斯式藻 36921.0121.0321.0151.009 33200.9590.9720.9750.990 29281.0001.0001.0001.000 16560.9520.9460.9770.990 15440.9800.9730.9951.001 14440.9760.9751.0021.007 13840.9910.9861.0061.011 12361.0061.0101.0031.010 12001.0041.0151.0001.008 11600.9901.0070.9901.003 10920.9871.0000.9850.998 10440.9830.9920.9871.001 8641.0121.0221.0121.020 6040.9861.0030.9911.010
综上所述, 两种藻细胞表面存在多种官能团, 能够通过多种途径与汞相互作用。在维持原有主体结构的同时, 藻细胞主要利用含 O 和 N 的基团(如羧基(R—COOH)、酚基(R—OH)、氨基(R—NH—R, R—NH2)和羰基(—C== O)等)影响汞的形态分布和生态毒性。
2.3.1 汞浓度对PCA菌汞甲基化效率的影响
G. sulfurreducens PCA 是能够进行生物汞甲基化的主要微生物, 本文研究不同的 HgCl2 浓度(0, 5, 10, 50, 100和200μg/L)对G. sulfurreducens PCA的汞甲基化效率的影响。接种 G. sulfurreducens PCA 菌种并培养 144h 后, 溶液中生成的 MeHg 含量达到稳定值。初始 HgCl2 浓度对 G. sulfurredu-cens PCA 的生物汞甲基化效率的影响如图 4 所示。在 HgCl2 浓度从 5μg/L 上升至 10μg/L 时, MeHg 的转化率由(5.1±0.01)%上升至(6.38± 0.4)%; HgCl2的浓度超过 10μg/L 后, MeHg 转化率开始下降, HgCl2浓度达到 200μg/L 时, MeHg 的转化率仅为(3.41± 0.3)%。原因可能是由于微生物主要通过细胞内部的酶促反应进行汞甲基化[24], 而高浓度汞对 G sulfurreducens PCA 的生理活性产生一定程度的抑制作用[25]。实验结果表明, 水环境中较低浓度的 Hg2+更有利于汞甲基化效率的提高[26]。
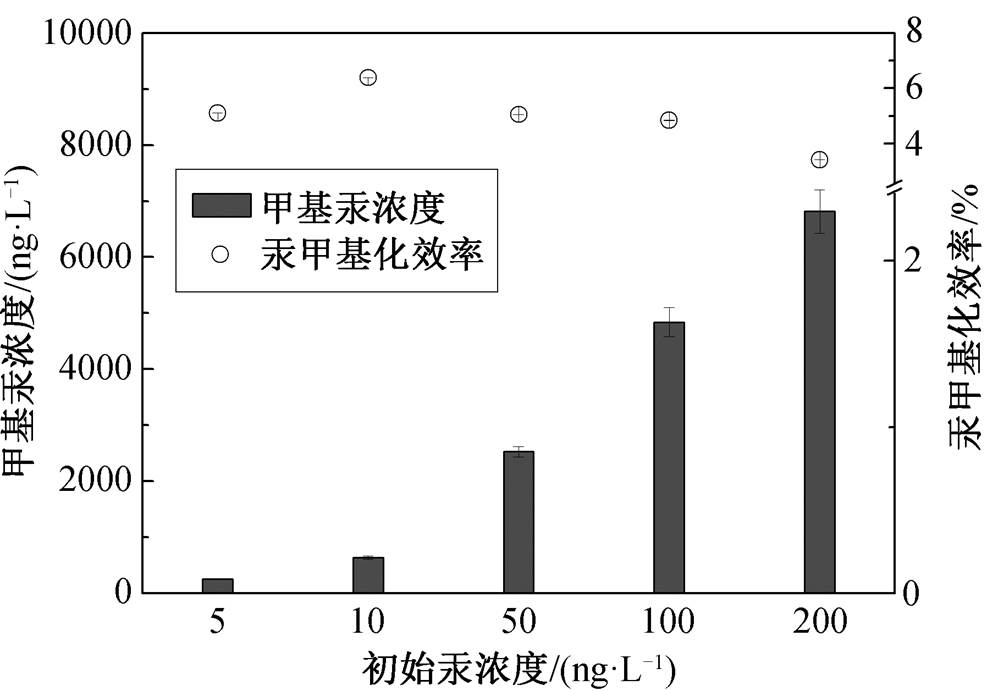
图4 不同HgCl2浓度对PCA菌汞甲基化的影响
Fig. 4 Effect of initial HgCl2 concentration on Hg methy-lation efficiency by G. sulfurreducens PCA
2.3.2 藻对PCA菌汞甲基化的影响
向上述 G.sulfurreducens PCA 培养基中分别加入 50, 100 和 250mL 富集 Hg2+的塔玛亚历山大藻和锥状斯式藻, 在汞–藻–菌复合体系中, 随着藻体的死亡, Hg2+缓慢释放, 溶液中 THg 和 MeHg 含量不断升高, MeHg 浓度在 168h 时达到最大值。但是, 与无藻组(汞甲基化效率约为 6.0%)相比, 汞甲基化效率显著下降(低于 2.0%), 如图 5 所示。塔玛亚历山大藻实验组, 加入 50mL 藻体的汞甲基化效率为(1.55±0.14)%, 加入 250mL 藻体的汞甲基化效率只有(1.04±0.44)%; 锥状斯式藻实验组, 加入 50mL 藻体的汞甲基化效率为 (1.91±0.14)%, 加入 250mL 藻体的汞甲基化效率仅 (0.76±0.05)%。实验结果表明, 藻类的加入能显著地抑制 G. sulfurreducensPCA 的汞甲基化效率, 藻类的相对浓度越高, 汞的生物甲基化效率越低。原因可能在于除藻类表面官能团的富集作用外, 藻细胞(10~250 mL)向溶液中释放的DOM(0.25~5.0 mg/L)对汞的亲和力也较强[27], 可以在竞争吸附过程中结合大量 Hg2+, 进而抑制 G. sul-furreducens PCA的汞生物甲基化。
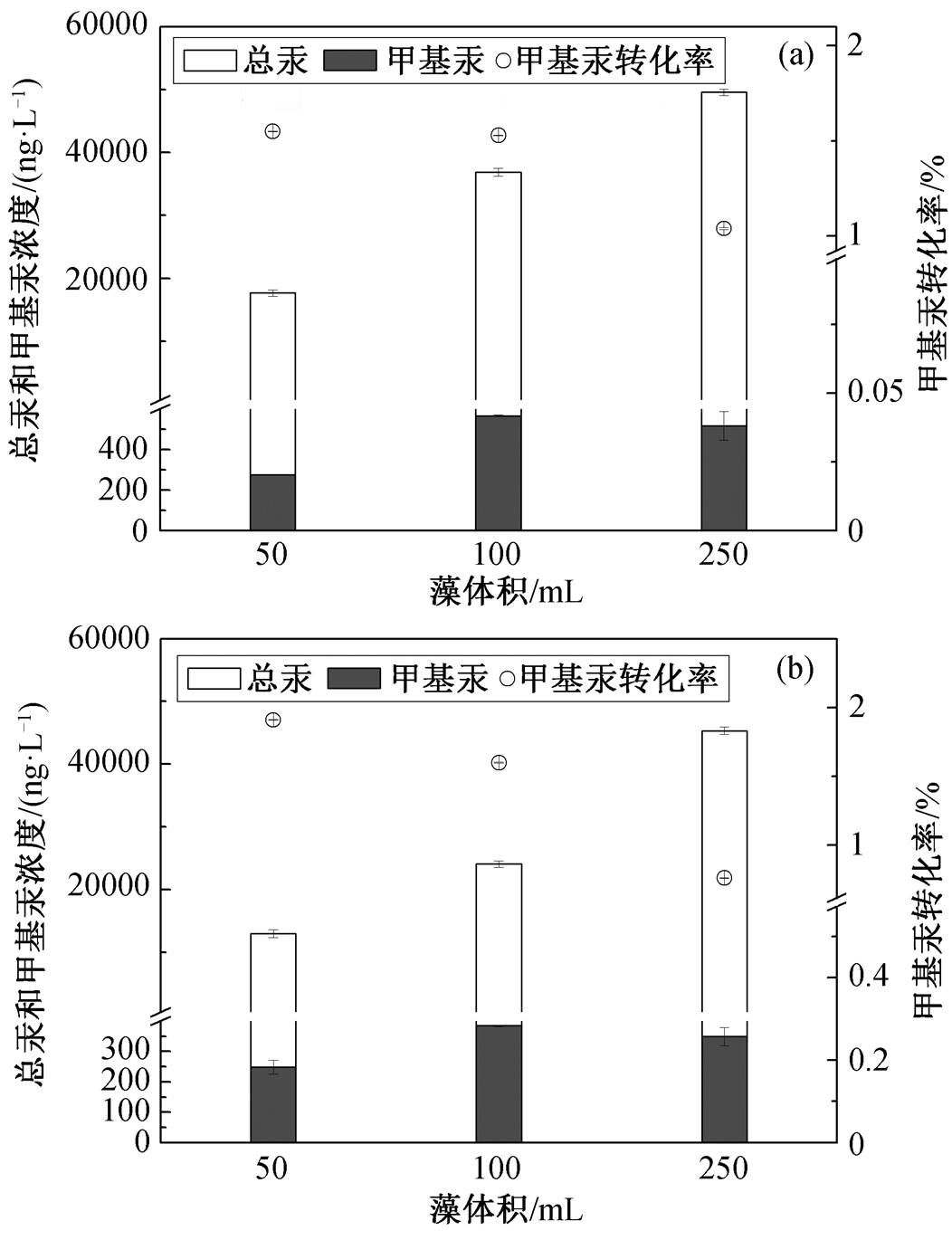
图5 塔玛亚历山大藻(a)和锥状斯式藻(b)对 PCA 菌汞甲基化的影响
Fig. 5 Effect of Hg-rich algaeAlexandrium tamarens (a) and Scrippsiella trochoidea (b) on Hg methylation effici-ency by G. sulfurreducens PCA
综上所述, 藻类对降低汞生物甲基化的生态风险具有一定的积极作用。与被富集固定的无机Hg2+相比, MeHg 具有更强的神经毒性, 对环境生物和人类的健康威胁更大, 通过引入适量的营养物质, 刺激大量藻类生长, 可以在水环境中短期内实现抑制MeHg 的生成, 同时减少游离 Hg2+的释放。但是, 目前对在自然水环境中使用藻类作为生物富集剂消除汞污染的研究鲜有报道, 未来还需针对富汞藻类的后续处理等问题开展研究。
本文研究两种赤潮藻(塔玛亚历山大藻和锥状斯式藻)对汞富集和汞甲基化的影响, 得到如下主要结论。
1)锥状斯式藻的生长会受到较高浓度([HgCl2]≥25μg/L)汞的抑制, 而塔玛亚历山大藻对汞毒性的耐受性较高。
2)汞–藻实验中, 两种赤潮藻均没有显著影响Hg2+向 MeHg 的转化; 两种赤潮藻对 Hg2+ 具有较强的富集作用, 主要通过含 C, O 和 N 的官能团以及释放 DOM 来影响汞的形态分布。
3)汞–藻–菌实验中, 两种赤潮藻的引入抑制了G. sulfurreducens PCA 菌的汞甲基化效率, 藻的添加量越高, MeHg的转化率越低。
参考文献
[1]Zhang L, Wong M H. Environmental mercury conta-mination in China: sources and impacts. Environment International, 2007, 33(1): 108–121
[2]Ullrich S M, Tanton T W, Abdrashitova S A. Mercury in the aquatic environment: a review of factors affec-ting methylation. Critical Reviews in Environmental Science and Technology, 2001, 31(3): 241–293
[3]Li W C, Tse H F. Health risk and significance of mercury in the environment. Environmental Science and Pollution Research, 2015, 22(1): 192–201
[4]Streets D G, Hao J M, Wu Y, et al. Anthropogenic mercury emissions in China. Atmospheric Environ-ment, 2005, 39(40): 7789–7806
[5]Celo V, Lean D R, Scott S L. Abiotic methylation of mercury in the aquatic environment. Sci Total En-viron, 2006, 368(1): 126–137
[6]Bravo A G, Bouchet S, Guédron S, et al. High methylmercury production under ferruginous condi-tions in sediments impacted by sewage treatment plant discharges. Water Research, 2015, 80: 245–255
[7]Gilmour C C, Podar M, Bullock A L, et al. Mercury methylation by novel microorganisms from new environments. Environmental Science & Technology, 2013, 47(20): 11810–11820
[8]Zhao L, Chen H, Lu X, et al. Contrasting effects of dissolved organic matter on mercury methylation by Geobacter sulfurreducens PCA and Desulfovibrio desulfuricans ND132. Environmental Science & Tech-nology, 2017, 51(18): 10468–10475
[9]Lin H, Morrell-Falvey J L, Rao B, et al. Coupled mercury–cell sorption, reduction, and oxidation on methylmercury production by Geobacter sulfurredu-cens PCA. Environmental Science & Technology, 2014, 48(20): 11969–11976
[10]Yang Z, Fang W, Lu X, et al. Warming increases methylmercury production in an Arctic soil. Envi-ronmental Pollution, 2016, 214: 504–509
[11]Berndt M E, Rutelonis W, Regan C P. A comparison of results from a hydrologic transport model (HSPF) with distributions of sulfate and mercury in a mine-impacted watershed in northeastern Minnesota. Jour-nal of Environmental Management, 2016, 181: 74–79
[12]Mazrui N M, Jonsson S, Thota S, et al. Enhanced availability of mercury bound to dissolved organic matter for methylation in marine sediments. Geo-chimica et Cosmochimica Acta, 2016, 194: 153–162
[13]Pickhardt P C, Fisher N S. Accumulation of inorganic and methylmercury by freshwater phytoplankton in two contrasting water bodies. Environmental Science & Technology, 2007, 41(1): 125–131
[14]Gray J E, Hines M E. Biogeochemical mercury methylation influenced by reservoir eutrophication, Salmon Falls Creek Reservoir, Idaho, USA. Chemical Geology, 2009, 258(3/4): 157–167
[15]Regnell O, Tunlid A, Ewald G, et al. Methyl mercury production in freshwater microcosms affected by dis-solved oxygen levels: role of cobalamin and micro-bial community composition. Canadian Journal of Fi-sheries & Aquatic Sciences, 1996, 53(7): 1535–1545
[16]Guillard R R L, Ryther J H. Studies of marine planktonic diatoms: I. Cyclotella nana Hustedt, and Detonula confervacea (Cleve) Gran. Canadian Journal of Microbiology, 1962, 2(8): 229–239
[17]蒋红梅, 冯新斌, 梁琏, 等. 蒸馏–乙基化 GC-CVAFS 法测定天然水体中的甲基汞. 中国环境科学, 2004, 24(5): 57–60
[18]440/5-84-026, Water Quality for Mercury [S]. Washing-ton DC: Office of Water, US Environmental Protection Agency, 1985
[19]Vázquez G, González-álvarez J, Freire S, et al. Removal of cadmium and mercury ions from aqueous solution by sorption on treated Pinus pinaster bark: kinetics and isotherms. Bioresource Technology, 2002, 82(3): 247–251
[20]Zeroual Y, Moutaouakkil A, Zohra D F, et al. Bio-sorption of mercury from aqueous solution by Ulva lactuca biomass. Bioresource Technology, 2003, 90 (3): 349–351
[21]Cain A, Vannela R, Woo L. Cyanobacteria as a bio-sorbent for mercuric ion. Bioresource Technology, 2008, 99(14): 6578–6586
[22]Carro L, Anagnostopoulos V, Lodeiro P, et al. A dynamic proof of mercury elimination from solution through a combined sorption–reduction process. Bio-resource Technology, 2010, 101(23): 8969–8974
[23]Gu B, Bian Y, Miller C L, et al. Mercury reduction and complexation by natural organic matter in anoxic environments. Proceedings of the National Academy of Sciences, 2011, 108(4): 1479–1483
[24]Benoit J M, Gilmour C C, Heyes A, et al. Geoche-mical and biological controls over methylmercury production and degradation in aquatic ecosystems. Biogeochemistry of Environmentally Important Trace Elements, 2003, 835: 262–297
[25]邹嫣, 司友斌, 颜雪, 等. Geobacter sulfurreducens对汞的甲基化及其影响因素研究. 环境科学, 2012, 33(9): 3247–3252
[26]Hollweg T A, Gilmour C C, Mason R P. Mercury and methylmercury cycling in sediments of the mid-Atlantic continental shelf and slope. Limnology and Oceanography, 2010, 55(6): 2703–2722
[27]Zhao L, Chen H, Lu X, et al. Contrasting effects of dissolved organic matter on mercury methylation by Geobacter sulfurreducens PCA and Desulfovibrio desulfuricans ND132. Environmental Science & Tech-nology, 2017, 51(18): 10468–10475
Study on the Effect of Two Red-Tide Algae on Mercury Biocondensation and Methylation
Abstract The effect of two red-tide algae of Alexandrium tamarens and Scrippsiella trochoidea on mercury (Hg) adsorption and methylation were investigated. The inhibitory effect of two algae on biomethylation of Geobacter Sulfurreducens (G. sulfurreducens) PCA were demonstrated. The growth of Scrippsiella trochoidea was inhibited under exposure to high concentration of HgCl2 (≥25 μg/L), but less affecting Alexandrium tamarens. Significant adsorption of Hg2+ was observed onto algal cells, whilst negligible amount of methylmercury (MeHg) was produced by two algae directly. FTIR spectra revealed that hydroxyl, carboxyl and amino groups were major binding sites for Hg2+ adsorption. In Hg-algae-bacteria tests, at initial HgCl2 concentration of 10 μg/L, a maximum mercury methylation efficiency of (6.38±0.4)% was obtained by pure G. sulfurreducens PCA culture as a control, but the efficiency reduced to (1.04±0.44)% with G. sulfurreducens PCA and Alexandrium tamarens coexisting, and a much lower efficiency of (0.76±0.05)% was detected with G. sulfurreducens PCA and Scrippsiella trochoidea coexisting. These results suggested that two red-tide algae inhibited mercury biomethylation of G. sulfurreducens PCA.
Keywords mercury; methylation; Scrippsiella trochoidea; Alexandrium tamarens; Geobactersul furreducens PCA
doi: 10.13209/j.0479-8023.2019.047
国家自然科学基金(51679002)、深圳市基础研究项目(JCYJ20180503182122539, JCYJ20160330095549229)和流域生态工程学学科建设资金(深发改[2017]542号)资助
收稿日期: 2018–05–02;
修回日期: 2019–04–19