
 补水组样方
补水组样方  对照组样方
对照组样方
图1 研究样地
Fig. 1 Location of study area
摘要 以陆化导致的退化秋茄林为研究对象, 通过周期性补水实验, 从沉积物的理化性质和植物生理指标的变化, 探明补水对秋茄成林的修复效果。主要结果如下: 1)补水后沉积物的含水量、pH、盐度、总氮和有机质含量总体上高于对照组, 补水改善了沉积物的营养和盐度条件; 2)补水修复显著提高植物的净光合速率、水分利用效率和叶绿素 a 含量(P<0.05), 降低胞间 CO2 浓度, 有效地改善退化秋茄林的光合作用状态, 增强秋茄叶片吸收和转化光能的能力; 3)对照组植物光系统Ⅱ(PSⅡ)最大荧光效率(Fv/Fm)显著低于 0.8 (常用阈值), 说明陆域化的秋茄林已处于光抑制状态; 但补水后 Fv/Fm 显著提高(P<0.01), 接近 0.8, 说明植物健康状态得到显著改善; 4)补水提高秋茄叶片 PSⅡ反应中心的光化学效率, 显著改善双光系统间激发能分配的失衡状态, 有效降低天线色素热耗散, 光能分配趋于高效, 提高了叶片光能的光化学利用效率。研究结果表明, 周期性补水是陆域化的退化红树林生境改善的有效修复方法。
关键词 深圳湾; 秋茄; 补水修复; 叶绿素荧光; 光合参数
红树林是生长在热带亚热带海岸潮间带的木本植物群落[1], 具有防浪护堤、保护生物多样性以及净化环境等多种重要的生态功能[2]。红树植物的健康生长需要适宜的淹水环境(淹水深度和频率)[3–5]和盐度[6–8]。在全球气候变暖导致海平面上升的大背景下, 红树林促淤造陆的生态功能能够缓解海平面上升带来的影响[9]。然而, 受沿海地区海岸工程、填海等人为活动影响[10–11], 红树林沉积物的淤积速度加快, 显著地改变了红树林生境的水文条件, 可能对红树林群落的正常生长和发育产生潜在威胁[12–13]。
华侨城湿地是深圳湾滨海湿地生态系统的重要组成部分, 具有较高的生态系统服务价值[14–15]。20世纪 90 年代末, 深圳湾填海造陆时留下约 128 万m2 的滩涂, 形成一个大湖区。2000 年以后, 滨海大道和白石路相继通车, 该湖区也一分为二成北湖和南湖。北湖有成片的天然红树林生长, 并保留大面积的滩涂, 即华侨城湿地[14]。目前, 对华侨城湿地水位的调控仅限于在候鸟迁徙季节调低水位, 为鸻鹬类提供活动场所, 湿地水位总体上仍较低[16]。华侨城湿地北湖岸边为红树林湿地(优势种为秋茄Kandelia obovata), 随着底泥的淤升, 红树林生境陆化严重, 红树植物长势变差。秋茄为红树科秋茄属植物, 是我国境内天然分布最广的红树植物[1], 一般适生于淹水条件适宜的中潮带[17]。现有文献中主要通过室内控制实验来研究秋茄幼苗对淹水时间[4,18]、淹水梯度[5]和盐度梯度[6]等的响应, 而对野外条件下生境的改变对秋茄成株影响的关注不足。
对红树林湿地修复的研究主要关注植被恢复, 尤其是育苗技术和宜林地的选择[2], 对退化红树林湿地生境修复技术的研究有限, 且现有研究多以行政和法制监督的政策建议为主[19]。本文以深圳华侨城湿地陆化退化的秋茄成林为研究对象, 通过周期性补水, 模拟秋茄林的淹水生境, 从沉积物的理化性质和植物生理参数(植物光合参数、叶绿素含量及叶绿素荧光参数)的变化, 探明补水对秋茄成林的修复效果, 为陆域化的退化红树林生态修复提供基础数据。
本研究样地位置如图 1 所示。深圳华侨城湿地(113°58'01''—113°59'50'' E, 22°31'13''—22°32'05'' N)位于珠江口东岸, 深圳湾北岸, 毗邻福田红树林自然保护区和深圳湾公园, 与香港米埔自然保护区和香港湿地公园隔海相望, 是深圳湾湿地生态系统的重要组成部分。华侨城湿地总面积为 69 万 m2, 水域面积为 50 万 m2[14], 是 20 世纪 90 年代末深圳湾填海工程完成后形成的人工内陆湖, 通过箱涵与深圳湾海水相连。该地区属于南亚热带季风气候区, 气候温和, 雨量充沛, 日照时间长。年平均温度约为 22.7℃, 极端最高温为 38.7℃, 极端最低温为 0.2℃, 年均降雨量为 1926.7 mm, 干湿季节明显, 5—9 月为雨季[20–21]。侨城湿地红树林优势种为秋茄, 约占 1.65 hm2, 冠层整齐, 平均树高约 7 m; 林下灌木稀少, 有零星分布的桐花树(Aegiceras cornicu-latum); 林缘分布有许树(Cle-rodendrum inerme)、卤蕨(Acrostichum aureum)和老鼠簕(Acanthus ilici-folius)[15]。

 补水组样方
补水组样方  对照组样方
对照组样方
图1 研究样地
Fig. 1 Location of study area
2017 年 4 月, 在侨城湿地研究区域秋茄林内(位置见图 1)设置 10m×10m 的 3 个补水组样方和 3 个对照组样方。通过湿地调查和无人机航拍, 在秋茄林周边的湖区水面寻找合适的补水点, 并构建水泵提升与水带输送的水环境提升系统。泵站系统功率为 4kW, 电压为 380V, 出水口内径为 5cm。输送系统是长约 300m 的水带(内径为 5cm), 将华侨城湿地自然水体的海水周期性输送到秋茄林, 用于恢复秋茄林的周期性水淹生境。输水口设置在各样地中心。补水水位以淹没底泥表面 1cm 为标准, 补水 4 小时后水位可降低至原来的水平(低于底泥表面 5cm)。补水周期为 9 个月。根据深圳市的气候特点调整补水频次, 在 2017 年 4—10 月(雨季), 每月的 15 日和 30 日进行补水, 每次补水 6 小时; 在 2017 年 11 月—2018年 2 月(旱季), 每月的 7 日、14 日、21 日和 28日补水一次, 每次补水 6 小时。补水水质参数为 pH=6.77, 氧化还原电位为 399mV, 电导率为 20.1mS/cm, 浊度为 29.5NTU, 溶解氧为4.32mg/L, 总固体溶解度为 11.9mg/L, 盐度为11.4‰。
2018 年 2 月, 于补水的前一天, 在深圳湾华侨城湿地的秋茄林补水组和对照组的各 3 个样方内, 用 PVC 管(内径为 7.5 cm, 长度为 60cm)随机采集3个 30cm 深的沉积柱样[22]。以 5cm 间隔进行分样, 各样方内的 3 个沉积柱样分别混匀, 共获得 36 份沉积物样品, 当天运回实验室进行分析。取一定量的沉积物鲜样称取其重量, 然后在 75°C 烘干 24 小时, 研磨, 过筛备用。用 pH 计(sarturis PB-10, 德国)测定沉积物的 pH 值(土水比为 1:1.25), 用电导率法测定(土水比为 1:5)(Laboratory Benchtop Meters, 中国)盐度, 用微波消解–纳氏试剂分光光度法测定沉积物中总氮[23]。沉积物有机质含量采用 Cambar-della 等[24]的方法测定, 即将 10g自然晾干的沉积物在马弗炉中以 550℃ 燃烧 5 小时后, 按质量损失的百分比计。
1.4.1 叶绿素含量测定
选取补水组和对照组中典型的成株秋茄成熟叶片, 每个样方内各设置 3 个重复, 采用丙酮提取–紫外分光光度比色法[25]测定秋茄叶片叶绿素 a、叶绿素 b 和类胡萝卜素的含量。
1.4.2 光合参数测定
在晴天 9:00—11:00am 光照充足时, 选择补水组和对照组的秋茄成熟叶片(植株从下往上第 3 或第 4 片成熟叶片), 使用 Li-6400 便携式光合仪(LI-COR 公司, 美国)测定光合指标[26], 包括净光合速率(Pn, μmol/(m2s))、蒸腾速率(E, mmol H2O/(m2s))、胞间CO2浓度(Ci, μmol CO2/(m2s))和气孔导度(Gs, mmol/(m2s)), 每个叶片重复测定 3次。计算叶片的水分利用效率 WUE=Pn/E。
1.4.3 叶绿素荧光参数测定
在晴朗无云天气, 使用 Li-6000XT 便携式光合作用系统的荧光检测系统(LI-COR 公司, 美国)测定补水组和对照组秋茄成熟叶片的叶绿素荧光参数(取平均值)。测定时, 先将叶片暗适应 30分钟, 测定初始荧光(F0)和最大荧光(Fm), 之后进行光适应的参数测定, 包括稳态荧光(Fs)、光适应下最大荧光(Fm')以及光适应下初始荧光(F0')。初始荧光(F0)表征光系统Ⅱ(PSⅡ)反应中心全部开放(即原初电子受体(QA)全部氧化)时的荧光水平[27], 最大荧光(Fm)是 PSⅡ反应中心完全关闭时的荧光产量, 是荧光的最大可能值[28]。
对光合荧光参数做进一步分析, 获得本研究所需参数。在暗适应条件下, 计算叶片 PSⅡ最大光化学效率: Fv/Fm =(Fm–F0)/Fm, 反映PSⅡ最大光能转换潜力[29]。在光活化条件下, 计算反应中心有效光化学效率: Fv'/Fm'=(Fm'–F0')/Fm', 反映光适应下(有热耗散时) PS Ⅱ的最大光能转换潜力; 计算 PS Ⅱ实际光化学效率: ΦPSⅡ=(Fm'–Fs)/Fm', 反映吸收光能用于光化学的部分; 计算 PS Ⅱ的光合电子传递速率(electron transport rate): ETR=ΦPSⅡ×PAR×0.84×0.5 (PAR 为光合有效辐射), 反映植物光能传递的效率[30];计算光化学猝灭系数: qP=(Fm'–Fs)/(Fm'–F0'), 反映PS Ⅱ反应中心的开放程度[31]; 计算非光化学淬灭系数: NPQ=(Fm–Fm')/Fm', 反映植物吸收的光能中用于热耗散的部分[28]。
根据 Braun 等[32]的公式计算两个光系统间激发能的分配系数: PSⅠ激发能的分配系数 α=f/(1+f), PS Ⅱ激发能分配系数 β=1/(1+f), 其中 f=(Fm'–Fs)/ (Fm'–F0'), 光系统Ⅰ和Ⅱ间激发能分配的不平衡性用 β/α–1 表示。根据 Demmig-Adams 等[33]的方法, 计算吸收光能用于 PS Ⅱ反应中心光化学反应的相对份额: P=(Fm'–F0')/Fm'×qP×100%; 计算用于反应中心非光化学耗散的相对份:Ex=(Fm'–F0')/Fm'×(1–qP)×100%; 计算天线热耗散的相对份额:D=[1–(Fm'–F0') /Fm']×100%。
所测数据用 3 次重复的平均值及标准误差(SE)表示, 采用 SPSS 20.0 软件完成数据处理及统计分析, 采用 Excel 2016 软件绘图。补水组与对照组差异的显著性采用 t 检验法分析(P<0.05)。采用单因素方差分析法(ANOVA, Duncan 检验法)进行不同深度沉积物的理化参数的差异显著性分析(P< 0.05)。
如表 1 所示, 补水组沉积物的平均含水量、pH、盐度、总氮和有机质含量总体上高于对照组, 补水组表层pH和总氮显著高于对照组(P < 0.05)。说明补水修复在一定程度上提高了底泥含水量和pH, 促进沉积物盐分和营养物质的积累, 改善沉积物的营养条件。随深度增加, 所有实验组沉积物的含水率均显著增加, 总氮显著减少(P<0.05); 沉积物 pH 有降低趋势, 盐度呈增加趋势, 但差异不显著。对照组的有机质含量随深度增加有升高趋势, 而补水组相反。
补水组和对照组秋茄叶片的光合参数特征如图2 所示。补水组秋茄叶片的净光合速率(Pn)和水分利用效率(WUE)分别为 5.47±0.46μmol/(m2s)和7.27±2.18 mmolCO2/molH2O, 显著高于对照组的2.13±1.25μmol/(m2s)和 2.87±1.95mmolCO2/molH2O (P<0.05)。补水组秋茄叶片的胞间 CO2 浓度为356.80±10.54μmol CO2/(m2s), 显著低于对照组的387.27±14.53μmol CO2/(m2s)(P<0.05)。说明经补水修复, 秋茄叶片的光合作用能力升高, 同化作用增强。
如图 4 所示, 补水组和对照组的叶绿素 b 含量分别为 0.45±0.04 mg/g 和 0.39±0.05 mg/g, 类胡萝卜素含量分别为 0.11±0.08 mg/g 和 0.10±0.03 mg/g; 补水组的叶绿素 a 含量为 1.00±0.06 mg/g, 显著高于对照组 0.26±0.04 mg/g (P<0.001)。结果表明, 补水处理显著促进了秋茄叶片叶绿素 a 的合成, 在一定程度上恢复了秋茄叶片的光合作用能力。
表1 对照组和补水组秋茄林底泥理化性质
Table 1 Physicochemical properties of Kandelia obovata between control and water supply group
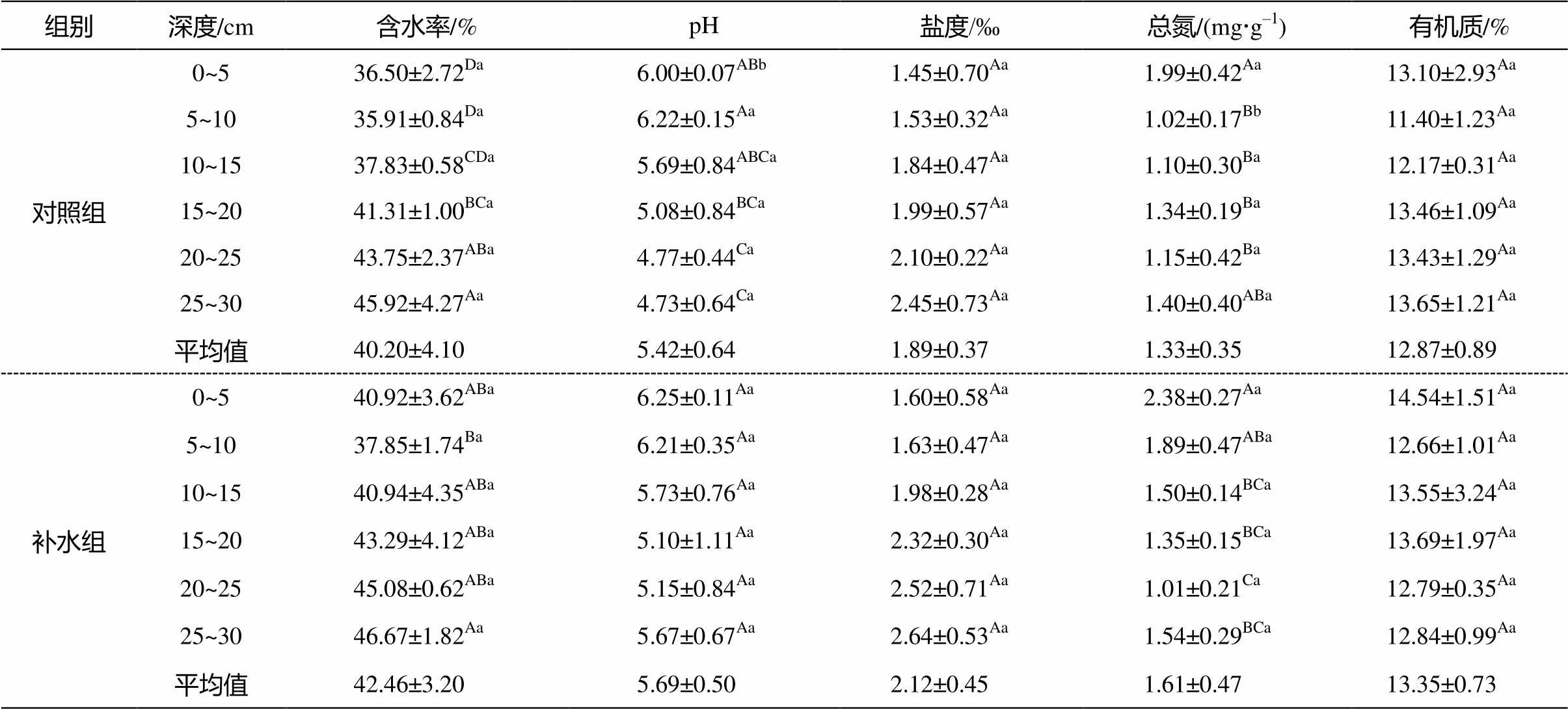
组别深度/cm含水率/%pH盐度/‰总氮/(mgg–1)有机质/% 对照组0~536.50±2.72Da6.00±0.07ABb1.45±0.70Aa1.99±0.42Aa13.10±2.93Aa 5~1035.91±0.84Da6.22±0.15Aa1.53±0.32Aa1.02±0.17Bb11.40±1.23Aa 10~1537.83±0.58CDa5.69±0.84ABCa1.84±0.47Aa1.10±0.30Ba12.17±0.31Aa 15~2041.31±1.00BCa5.08±0.84BCa1.99±0.57Aa1.34±0.19Ba13.46±1.09Aa 20~2543.75±2.37ABa4.77±0.44Ca2.10±0.22Aa1.15±0.42Ba13.43±1.29Aa 25~3045.92±4.27Aa4.73±0.64Ca2.45±0.73Aa1.40±0.40ABa13.65±1.21Aa 平均值40.20±4.105.42±0.641.89±0.371.33±0.3512.87±0.89 补水组0~540.92±3.62ABa6.25±0.11Aa1.60±0.58Aa2.38±0.27Aa14.54±1.51Aa 5~1037.85±1.74Ba6.21±0.35Aa1.63±0.47Aa1.89±0.47ABa12.66±1.01Aa 10~1540.94±4.35ABa5.73±0.76Aa1.98±0.28Aa1.50±0.14BCa13.55±3.24Aa 15~2043.29±4.12ABa5.10±1.11Aa2.32±0.30Aa1.35±0.15BCa13.69±1.97Aa 20~2545.08±0.62ABa5.15±0.84Aa2.52±0.71Aa1.01±0.21Ca12.79±0.35Aa 25~3046.67±1.82Aa5.67±0.67Aa2.64±0.53Aa1.54±0.29BCa12.84±0.99Aa 平均值42.46±3.205.69±0.502.12±0.451.61±0.4713.35±0.73
说明: 大写字母表示各指标在不同深度间差异显著, 小写字母表示对照组和补水组间差异显著(P<0.05)。n=3。
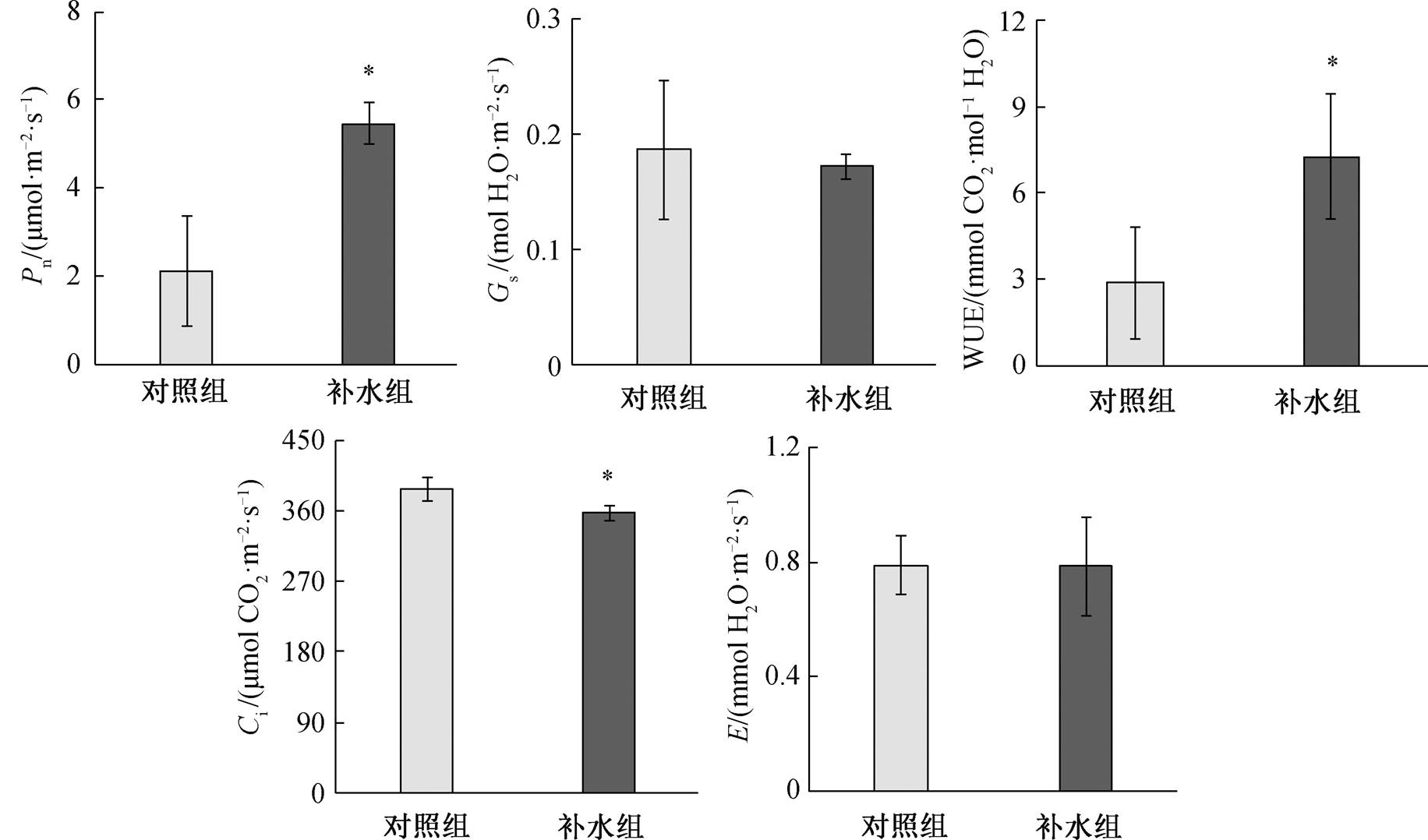
*表示对照组和补水组间差异显著(P<0.05)
图2 对照组和补水组秋茄叶片的光合参数特征
Fig. 2 Characteristics of photosynthetic parameters of leaves of Kandelia obovata between control and water supply group
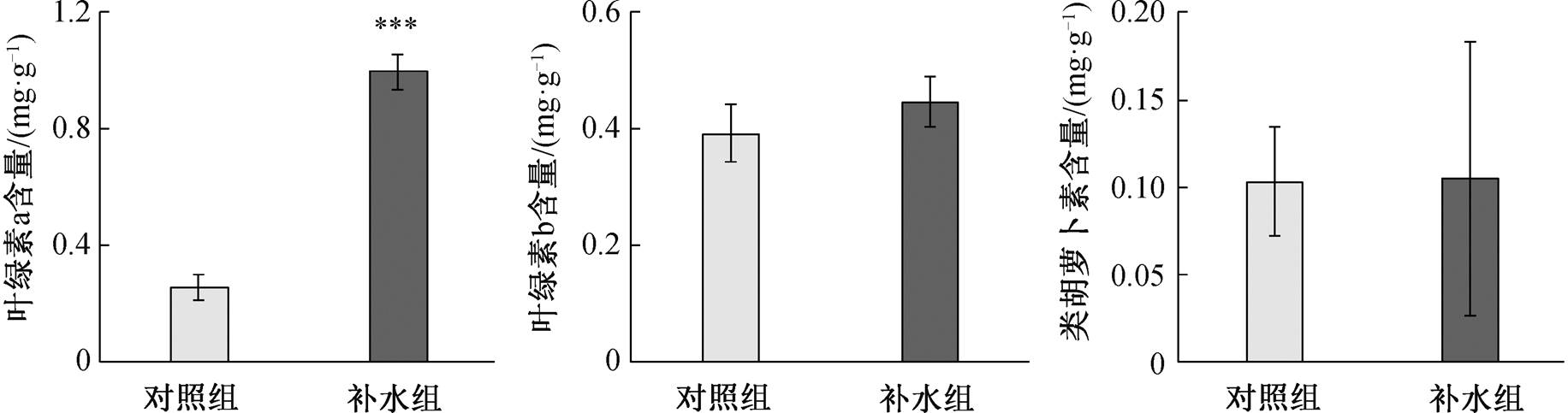
***表示对照组和补水组间差异显著(P<0.001)
图3 对照组和补水组秋茄叶片叶绿素含量特征
Fig. 3 Chlorophyll content in leaves of Kandelia obovata between control and water supply group
由图 4 可知, 补水组的 Fv/Fm 接近 0.8, 但对照组显著低于该数值。与对照组相比, 补水后秋茄叶片 F0 显著降低(P<0.05), NPQ 有降低趋势; Fv/Fm, Fv'/Fm', ΦPSⅡ, ETR 和 qP 显著提高(P<0.05), 且 Fm有增加趋势。
补水后, 秋茄叶片 PSⅡ激发能分配系数 β 和激发能分配不平衡系数 β/α–1 均低于对照组, 而 PSⅠ激发能分配系数高于对照组, 如图 5 所示。补水后秋茄叶片 PSⅡ吸收的光能用于光化学反应的份额(P)显著高于对照组(P<0.05), 用于天线热耗散的份额(D)显著低于对照组(P<0.05), 反应中心非光化学耗散份额(EX)稍低于对照组。补水组光能分配 D> P>EX; 对照组光能分配D>EX>P。
红树林的宜林海洋环境指标包括温度、盐度、沉积物性质、潮汐浸淹和波浪能[34]。本研究通过对比秋茄林补水组与对照组的沉积物理化特征, 探究影响研究区域红树林衰退的环境指标。红树林生境陆化后, 不仅淹水条件改变, 同时沉积物的盐度随着降雨的稀释作用而降低, 淹水条件改变和盐度降低可能是该区红树植物秋茄健康状况退化的主要原因。研究表明, 盐度过低(4‰~8‰)会抑制秋茄幼苗的生长, 而适宜的盐度(15‰~20‰)有助于秋茄幼苗生物量的积累[6], 且使得秋茄光系统Ⅱ的电子传递能力最强(15.60‰~20.08‰), 有利于光合器官对光能的吸收和转化, 具有更高的光合效率[7]。与本研究区毗邻的受周期性淹水的福田红树林内沉积物盐度和含水率分别为 2‰~3‰[35]和(44.77±3.90)%~ (65.72%±1.51)% [36], 本研究中对照组沉积物盐度和含水率分别为 (1.90±0.37)‰和(40.20±4.10)%, 低于正常红树林区。补水后侨城湿地沉积物的含水率、pH、盐度、总氮和有机质含量总体高于对照组, 说明补水修复在一定程度上提高了底泥含水量和 pH, 促进沉积物盐分和营养物质的积累, 改善沉积物的营养条件。补水后沉积物盐度更接近退化前的生境条件(福田红树林区生境条件), 利于秋茄成株的生长。此外, 红树林湿地多为贫营养生境[37], 本研究中补水修复提高了底泥总氮和有机质含量, 且随深度增加营养物质(如总氮)显著减少, 在毗邻的福田红树林中营养物质的垂直分布也具有同样特点[38], 这可能是由于周期性的补水处理使水体中的营养物质被吸附蓄积在沉积物中的原因。
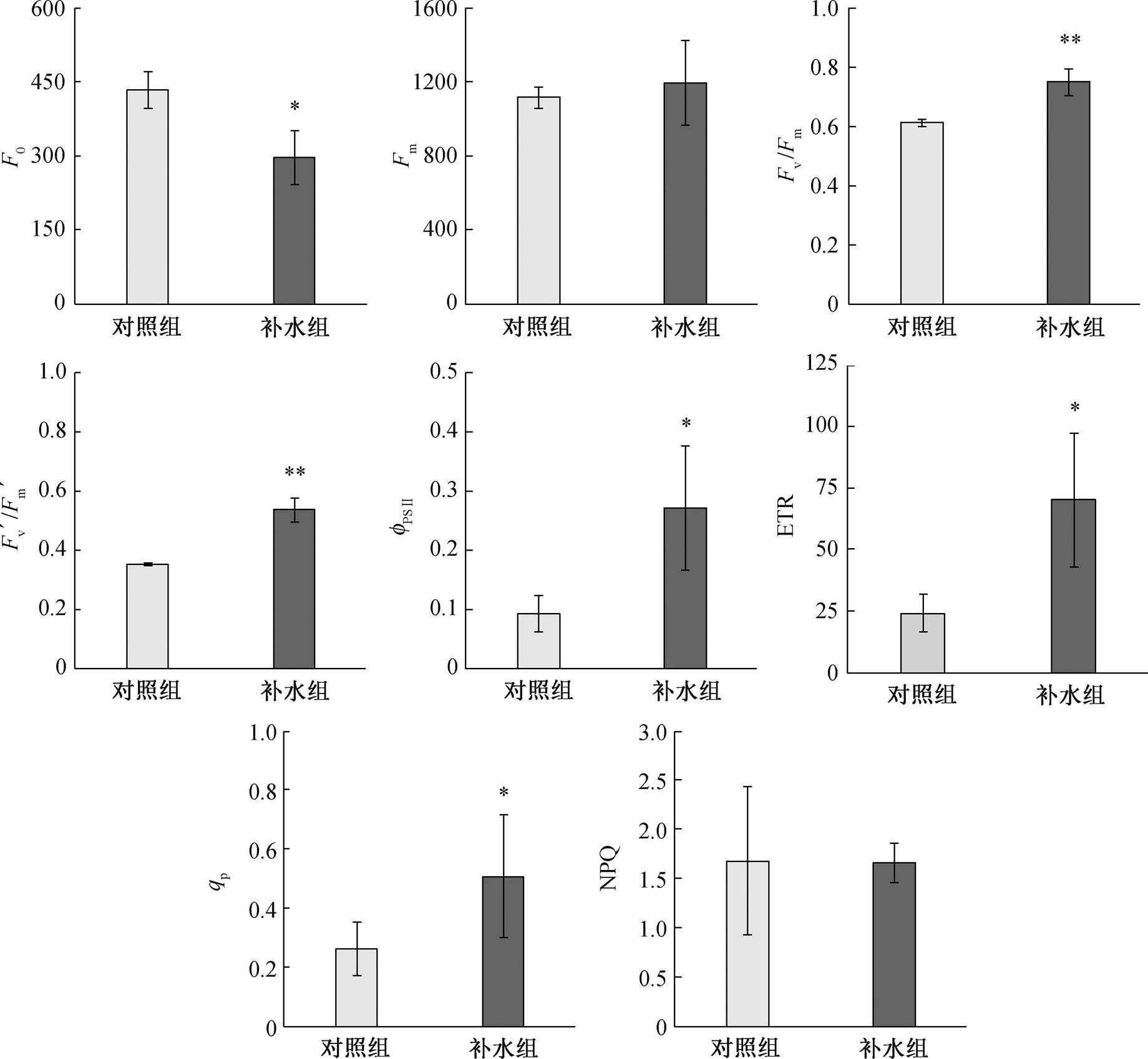
*和**表示对照组与补水组间差异显著, *为P<0.05, **为P<0.01
图4 对照组和补水组秋茄叶片的光化学效率特征
Fig. 4 Characteristics of Photochemical efficiency of Kandelia obovata between control and water supply group
水分条件会影响多种植物的光合作用, 如草本植物水稻[39]、茳芏[40]和木本植物山核桃[41]等。干旱胁迫会降低山核桃的 Pn, Gs 和 E, 促使 WUE的升高, 复水处理后各项指标得到不同程度的恢复[41]。导致光合速率下降的因素包括气孔限制和非气孔限制。气孔限制是由于叶片气孔开度下降导致 Ci下降; 非气孔限制则是 CO2 溶解度下降并不断积累, 引起叶肉光合能力下降。本研究中, 陆域化的退化秋茄成林 Pn 显著降低, 补水后 Pn 和 WUE 显著增加; 补水后 Ci 显著降低, 但气孔导度和蒸腾速率与对照组的差异不显著。说明补水处理有效地改善了陆化秋茄林的光合作用, 并且非气孔限制是导致退化秋茄成林光合速率下降的主要原因。
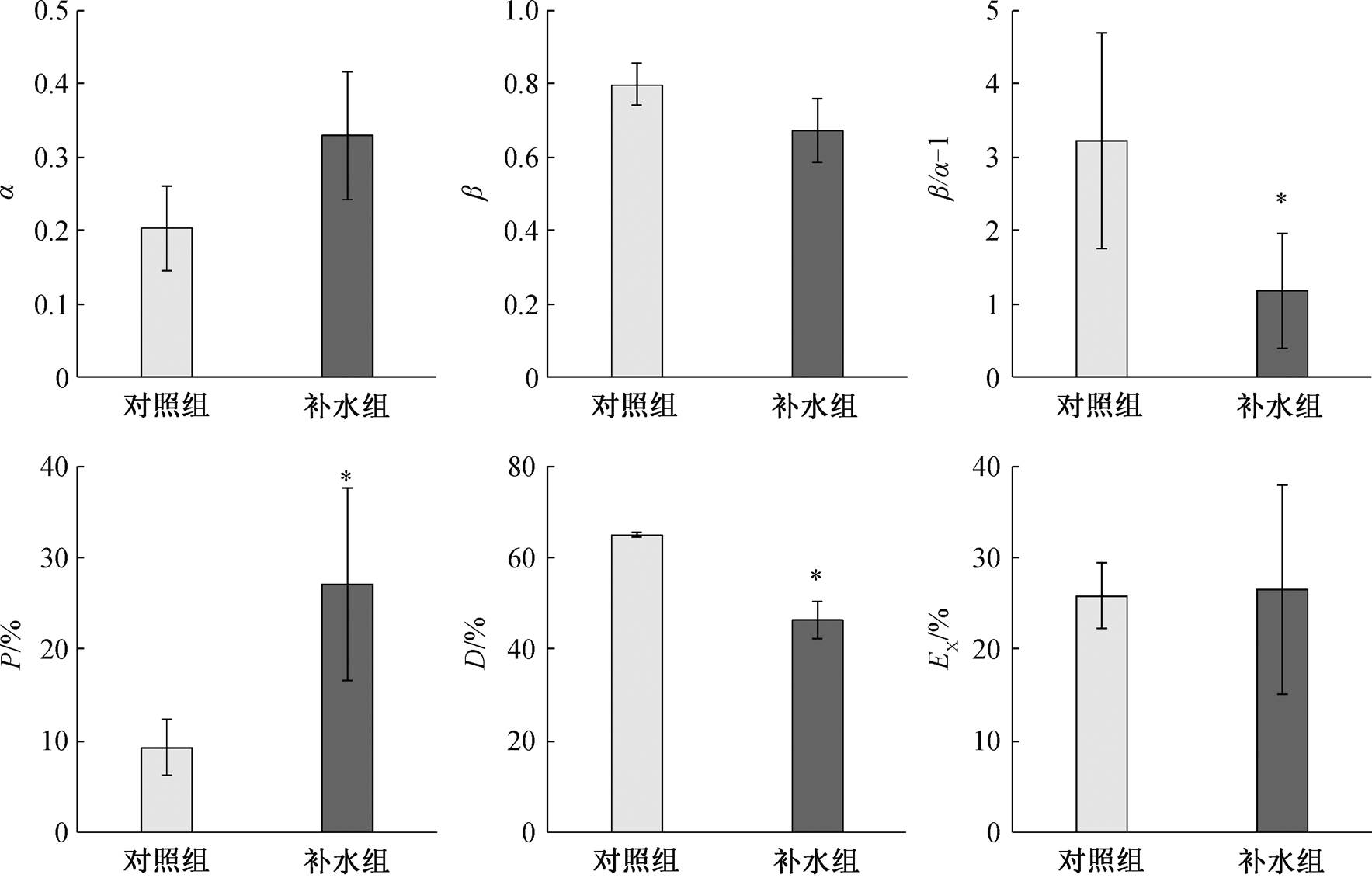
*表示对照组和补水组间差异显著(P<0.05)
图5 对照组和补水组中秋茄叶片的光能分配特征
Fig. 5 Characteristics of leaf excited energy distribution of Kandelia obovata between control and water supply group
叶绿素是植物进行光合作用的主要色素, 可将吸收的光能转化成化学能, 其含量显著地影响叶片吸收和利用光能的能力[42]。叶绿素 b 和类胡萝卜素具有吸收和传递光能的作用, 叶绿素 a 则具有吸收和转化光能的作用[43]。水分胁迫常导致植物叶绿素和类胡萝卜素含量降低[42–43], 水分条件改善后, 叶绿素含量有所回升[44]。部分植物在水分胁迫下叶绿素 a 比叶绿素 b 更敏感, 更容易被分解破坏[45]。本研究中, 陆域化的退化秋茄成林叶片的叶绿素 a含量显著下降, 补水后叶绿素 a 含量显著增加, 叶绿素 b 和类胡萝卜素含量差异不显著, 说明生境陆域化对秋茄叶绿素 a 的损害程度大于叶绿素 b, 补水可有效地提高秋茄叶片的叶绿素含量水平, 增强秋茄叶片吸收和转化光能的能力。对红树植物桐花树的研究发现, 盐度会影响其叶绿素含量, 即盐度最低的样地(7.95‰~10.00‰)比其他样地具有更高的叶绿素 a、叶绿素 b 和胡萝卜素含量[46]。本研究中, 补水修复后盐度虽有增加, 但对秋茄成株叶绿素含量具有促进作用, 这可能是由于不同种红树植物最适生长的盐度条件不同, 值得进一步研究。
叶绿素荧光分析法是一种研究光合作用机制和探测光合生理状况的技术[47]。任何环境因子对光合作用的影响都可以通过叶绿素荧光动力学参数快速、灵敏且无损伤地反映出来[48–49]。在适当的暗适应期后, 测量得到的 Fv/Fm 是表征植物胁迫响应的有效指标之一[50]。在正常状态下, 植物的 Fv/Fm值约为 0.80~0.84, 并与光合作用的最大量子产量相关[30,51]。本研究中, 对照组植物的 Fv/Fm 显著低于 0.8, 说明陆化秋茄林已处于光抑制状态; 补水后 Fv/Fm 显著提高(P<0.05), 接近 0.8, 表明红树植物健康状态有显著的改善。此外, Fm 和 Fv/Fm 的降低是植物发生光抑制的重要特征, Fv/Fm降低的同时, 若伴随 F0 升高, 则可确定 PSⅡ反应中心已经遭到破坏[52]。水分胁迫导致植物叶片 Fm和 Fv/Fm降低的同时, 会引起 F0 升高[53–55]。本研究中, 与对照组相比, 补水后秋茄叶片 F0 显著降低, Fv/Fm 显著提高(P<0.05), 且 Fm 有增加的趋势, 说明周期性补水可以有效地缓解生境陆域化对红树植物叶片 PSⅡ反应中心的损伤, 避免光抑制的发生。
水分胁迫通常会降低叶片的 Fv'/Fm'、ΦPSⅡ和ETR[27,53–54], 复水后这些指标可得到有效的改善[27]。水分胁迫使得小麦的 qP 变小, 表明反应中心开放程度降低, 从 PSⅡ氧化侧向 PSⅡ反应中心的电子流动受到抑制[56]。当 PSⅡ反应中心天线色素吸收过量的光能时, 若不能及时消耗, 将会使光合机构失活或破坏, 所以非光化学淬灭是一种自我保护机制, 对光合机构起一定的保护作用[28]。随着土壤相对含水量减少, 春茬番茄的 ΦPSⅡ, ETR 和 qP 降低, NPQ 显著升高, 表明叶片在 PSⅡ反应中心的光化学效率降低, 用于非化学反应的能量增加, 叶片发生光抑制以及光损伤的程度增加[53]。本研究中, 与对照组相比, 补水后秋茄叶片的 Fv'/Fm', ΦPSⅡ, ETR和 qP 均显著增加(P<0.05), 说明补水组秋茄叶片 PSⅡ反应中心开放程度增加(qP增加), PSⅡ反应中心光能转化效率和非环式电子传递效率均增强, 暗反应的碳同化积累能量增加, 提高了秋茄叶片 PSⅡ的光化学效率以及叶片光能光化学利用, 减轻过剩光能对光合机构的损伤。同时, NPQ 有减弱趋势, 但差异并不显著, 说明补水对 PSⅡ非辐射能量耗散的改善不是保护光合机构的主要机制。
通过状态转换调节的激发能均衡分配是 PSⅡ和 PSⅠ高效运转、协调完成线性电子传递的前提[57]。状态1使激发能较多地分配给 PSⅡ, 使 PSⅡ能量过剩的程度增大, 从而加重了光抑制; 状态2 的作用恰好相反[58]。随着土壤相对含水量减少, 春茬番茄叶片双光系统间激发能分配不平衡偏离系数(β/α–1)会显著升高[53]。本研究中, 与对照组相比, 补水后秋茄叶片的 β 和 β/α–1 降低, α 升高, 说明补水后叶片双光系统间激发能分配失衡状态显著改善, 光合机构向状态2的转换良好, PSⅡ激发能压力减小, 进而缓解因激发能压力升高而导致的 PSⅡ损伤, 促进光合作用的高效运行。此外, 激发能的耗散方式主要包括反应中心光化学利用份额(P)、反应中心耗散份额(EX)和天线热耗散份额(D)。本研究中, 补水处理组秋茄叶片 P 值显著增加, 而 D值显著下降, 但EX差异不显著, 说明补水处理促进吸收光能向光化学反应的分配增加。随着土壤相对含水量减少, 春茬番茄叶片吸收光能用于进行光化学反应的份额(P)降低, 而天线热耗散份额(D)显著升高[53]。这些结果说明, 因 P 值降低导致 PSⅡ过剩光能累积, 使天线色素依赖 NPQ 保护机制耗散的激发能(D 值)增加。同时, 在 PSⅡ, 因反应中心的关闭(或失活), 使已传递到反应中心的激发能不能用于光化学反应(P 降低), 继而迫使反应中心耗散份额(EX)增加,诱发 PSⅡ产生过量的 ROS, 可能直接损伤反应中心色素和结构蛋白, 严重制约 PSⅡ的运转[59]。
本研究以陆化导致的华侨城湿地退化秋茄林为研究对象, 通过周期性补水实验, 从沉积物理化性质和植物生理指标的变化, 探明补水对秋茄成林的修复效果, 主要结果如下。
1)补水后红树林沉积物的含水量、pH、盐度、总氮和有机质含量总体上高于对照组, 周期性的补水修复改善了秋茄林沉积物的营养和盐度条件。
2)补水修复显著地提高秋茄的 Pn、WUE 和叶绿素 a 含量, 降低 Ci, 有效地改善退化秋茄成林的光合作用状态, 增强秋茄叶片吸收和转化光能的能力。
3)对照组秋茄 PSⅡ的最大荧光效率(Fv/Fm)显著低于 0.8, 说明陆化秋茄林已处于光抑制状态; 补水后 Fv/Fm显著提高, 接近 0.8, 表明秋茄健康状态显著改善。
4)补水后秋茄叶片 PSⅡ反应中心开放程度增加(qP增加), PSⅡ反应中心光能转化效率和非环式电子传递效率均增强; 补水修复可以改善双光系统间激发能分配的失衡状态, 降低天线色素热耗散(D), 从而提高叶片的光化学利用效率。
致谢 柴民伟博士在实验设计和补水系统搭建方面提供帮助,徐丽、公媛、丁欢、刘畅和吴思颉同学在补水实验实施过程中提供帮助,华侨城湿地工作人员协助准备实验场地,在此表示感谢。
参考文献
[1]林鹏. 中国红树林生态系. 北京: 科学出版社, 1997: 342
[2]李娜, 陈丕茂, 乔培培, 等. 滨海红树林湿地海洋生态效应及修复技术研究进展. 广东农业科学, 2013(20): 157–160
[3]游惠明. 秋茄幼苗对盐度、淹水环境的生长适应. 应用生态学报, 2015, 26(3): 675–680
[4]廖宝文, 邱凤英, 谭凤仪, 等. 红树植物秋茄幼苗对模拟潮汐淹浸时间的适应性研究. 华南农业大学学报, 2009, 30(3): 49–54
[5]何斌源, 赖廷和, 王文卿, 等. 梯度淹水胁迫下全日潮海区秋茄幼苗的生长和生理反应. 海洋通报, 2007, 26(2): 42–49
[6]曾德华, 吴金华, 刘俊, 等. 不同盐度对秋茄幼苗生物量的影响. 热带林业, 2017, 45(3): 4–6
[7]吴敏兰, 王果, 陈立松, 等. 漳江口优势红树植物秋茄叶绿素荧光特性对盐度环境的响应. 泉州师范学院学报, 2013, 31(2): 84–89
[8]黄冠闽. 不同盐度梯度下互花米草与秋茄的光合特性比较研究. 福建林业, 2017(6): 42–45
[9]Lovelock C E, Cahoon D R, Friess D A, et al. The vulnerability of Indo-Pacific mangrove forests to sea level rise. Nature, 2015, 526: 559–563
[10]王初升, 黄发明, 于东升, 等. 红树林海岸围填海适宜性的评估. 亚热带资源与环境学报, 2010, 5(1): 62–67
[11]Duan H B, Zhang H, Huang Q F, et al. Characteriza-tion and environmental impact analysis of sea land reclamation activities in China. Ocean & Coastal Ma-nagement, 2016, 130: 128–137
[12]刘春杉, 张彤辉, 陈玮哲. 珠江口海域围填海演进过程与问题分析研究. 海洋开发与管理, 2017(3): 33–37
[13]谢丽, 王芳, 刘惠. 广东省围填海历程及其环境影响研究. 江苏科技信息, 2015(24): 67–70
[14]徐桂红, 吴苑玲, 杨琼. 华侨城湿地生态系统服务功能价值评估. 湿地科学与管理, 2014, 10(2): 9–12
[15]昝启杰, 许会敏, 谭凤仪, 等. 深圳华侨城湿地物种多样性及其保护研究. 湿地科学与管理, 2013, 9(3): 56–61
[16]胡先琼, 龚煜翔. 侨城湿地的生态修复. 中国农村水利水电, 2011(7): 55–56
[17]黄运挺. 福建省滨海秋茄红树林栽培技术探讨. 林业勘察设计, 2007(2): 133–135
[18]陈鹭真, 王文卿, 林鹏. 潮汐淹水时间对秋茄幼苗生长的影响. 海洋学报(中文版), 2005, 27(2): 141–147
[19]Tang T T S, Tran N B, Nguyen N A. 越南义安省沿海红树林保护与修复方法探析. 法制与经济, 2016(12): 154–156
[20]姜刘志, 李常诚, 杨道运, 等. 福田红树林自然保护区生态环境现状及保护对策研究. 环境科学与管理, 2017, 42(11): 152–155
[21]卢群, 曾小康, 石俊慧, 等. 深圳湾福田红树林群落演替. 生态学报, 2014, 34(16): 4662–4671
[22]Chai M W, Li R L, Tam N F Y, et al. Effects of mangrove plant species on accumulation of heavy metals in sediment in a heavily polluted mangrove swamp in Pearl River Estuary, China. Environmental Geochemistry and Health, 2018, 41(1): 1–15
[23]古昌红. 微波消解—纳氏试剂分光光度法测定土壤中总氮. 重庆工商大学学报(自然科学版), 2010, 27(6): 613–616
[24]Cambardella C A, Gajda A M, Doran J W, et al. Estimation of particulate and total organic matter by weight loss-on-ignition // Lal R, Kimble J M, Follett R F, et al. Assessment methods for soil carbon. Boca Raton: Lewis Publishers, 2001: 349–359
[25]李玲. 植物生理学模块实验指导. 北京: 科学出版社, 2009: 37–38
[26]Tang Y P, Sun X, Wen T, et al. Implications of terminal oxidase function in regulation of salicylic acid on soybean seedling photosynthetic performance under water stress. Plant Physiology and Biochemis-try, 2017, 112: 19–28
[27]宋莉英, 孙兰兰, 舒展, 等. 干旱和复水对入侵植物三裂叶蟛蜞菊叶片叶绿素荧光特性的影响. 生态学报, 2009, 29(7): 3713–3721
[28]张守仁. 叶绿素荧光动力学参数的意义及讨论. 植物学通报, 1999, 16(4): 444–448
[29]谢春, 周长芳, 龙水云, 等. 挺水植物与浮叶植物光合荧光特性的差异. 生态学报, 2018, 38(7): 2493–2502
[30]张国盛, 郝蕾, 闫子娟, 等. 6 种树种叶片叶绿素荧光动力学参数对土壤水分变化的响应. 生态学杂志, 2017, 36(11): 3079–3085
[31]Genty B, Briantais J, Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. Biochimica et Biophysica Acta, 1989, 990(1): 87–92
[32]Braun G, Malkin S. Regulation of the imbalance in light excitation between Photosystem II and Photo-system I by cations and by the energized state of the thylakoid membrane. Biochimica et Biophysica Acta (BBA)—Bioenergetics, 1990, 1017(1): 79–90
[33]Demmig-Adams B, Adams W W, Barker D H, et al. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation. Physiologia Plantarum, 1996, 98 (2): 253–264
[34]张乔民, 隋淑珍, 张叶春, 等. 红树林宜林海洋环境指标研究. 生态学报, 2001, 21(9): 1427–1437
[35]程珊珊, 沈小雪, 柴民伟, 等. 深圳湾红树林湿地不同生境类型沉积物的重金属分布特征及其生态风险评价. 北京大学学报(自然科学版), 2018, 54(2): 1–10
[36]Chai M W, Shen X X, Li R L, et al. The risk assessment of heavy metals in Futian mangrove forest sediment in Shenzhen Bay (South China) based on SEM-AVS analysis. Marine Pollution Bulletin, 2015, 97(1/2): 431–439
[37]Reef R, Feller I C, Lovelock C E. Nutrition of mang-roves. Tree Physiology, 2010, 30(9): 1148–1160
[38]乔永民, 谭键滨, 马舒欣, 等. 深圳红树林湿地沉积物氮磷分布与来源分析. 环境科学与技术, 2018, 41(2): 34–40
[39]丁国华, 马殿荣, 杨光, 等. 耐旱杂草稻幼苗光合系统对干旱胁迫的响应. 生态学报, 2016, 36(1): 226–234
[40]张林海, 曾从盛, 仝川. 氮输入和水淹对闽江河口短叶茳芏光合特性的影响. 环境科学学报, 2017, 37(6): 2368–2378
[41]杨标, 刘壮壮, 彭方仁, 等. 干旱胁迫和复水下不同薄壳山核桃品种的生长和光合特性. 浙江农林大学学报, 2017, 34(6): 991–998
[42]王平荣, 张帆涛, 高家旭, 等. 高等植物叶绿素生物合成的研究进展. 西北植物学报, 2009, 29(3): 629–636
[43]蔡倩, 孙占祥, 郑家明, 等. 水分胁迫对幼龄仁用杏叶片光合特性的影响. 北方园艺, 2016(9): 28–32
[44]张红萍, 李明达. 水分胁迫后复水对豌豆叶片叶绿素含量的影响. 干旱地区农业研究, 2016, 34(2): 177–181
[45]赵静, 张世民, 张雷, 等. 水分胁迫对棉花叶绿素含量的影响. 天津农业科学, 2017, 23(6): 5–8
[46]吴敏兰, 陈立松, 吴锦城, 等. 漳江口桐花树叶片光合色素含量和叶绿素荧光参数与盐度的关系. 应用海洋学学报, 2014, 33(3): 326–330
[47]Baker N R. Chlorophyll fluorescence: a probe of photosynthesis in vivo. Annual review of plant bio-logy, 2008, 59: 89–113
[48]刘雷震, 武建军, 周洪奎, 等. 叶绿素荧光及其在水分胁迫监测中的研究进展. 光谱学与光谱分析, 2017, 37(9): 2780–2787
[49]胡丰姣, 黄鑫浩, 朱凡, 等. 叶绿素荧光动力学技术在胁迫环境下的研究进展. 广西林业科学, 2017, 46(1): 102–106
[50]Murchie E H, Lawson T. Chlorophyll fluorescence analysis: a guide to good practice and understanding some new applications. Journal of Experimental Bo-tany, 2013, 64(13): 3983–3998
[51]Bjorkman O, Demmig B. Photon yield of O2 evolution and chlorophyll fluorescence characteristics at 77 K among vascular plants of diverse origins. Planta, 1987, 170(4): 489–504
[52]Takahashi S, Murata N. How do environmental stresses accelerate photoinhibition?. Trends in Plant Science, 2008, 13(4): 178–182
[53]高方胜, 王磊, 徐坤. 土壤相对含水量对不同茬口番茄叶片 PSⅡ光化学活性和光能分配影响. 核农学报, 2017, 31(5): 1005–1013
[54]赵湘江, 王妍, 田昆. 清香木叶片光合荧光特性对土壤水分胁迫的响应. 干旱区资源与环境, 2015, 29(1): 83–88
[55]耿东梅, 单立山, 李毅, 等. 土壤水分胁迫对红砂幼苗叶绿素荧光和抗氧化酶活性的影响. 植物学报, 2014, 49(3): 282–291
[56]王可玢, 许春辉, 赵福洪, 等. 水分胁迫对小麦旗叶某些体内叶绿素 a 荧光参数的影响. 生物物理学报, 1997, 13(2): 123–128
[57]Rochaix J D. Regulation and dynamics of the light-harvesting system. Annual Review of Plant Biology, 2014, 65(1): 287–309
[58]Yokono M, Murakami A, Akimoto S. Excitation energy transfer between photosystem II and photosys-tem I in red algae: larger amounts of phycobilisome enhance spillover. Biochimica et Biophysica Acta (BBA)—Bioenergetics, 2011, 1807(7): 847–853
[59]李亮. 水杨酸在黄瓜(Cucumis sativus L.)幼苗应答低温胁迫中的作用机制[D]. 北京: 中国农业科学院, 2013
Experimental Study on Ecological Restoration of Degraded Mangroves
Abstract Taking Kandelia obovata forest as the research object, through periodical replenishment experiment, the improvement of physicochemical properties of the sediments and the plant physiological indicators were used to ascertain the repair effect of water supplemnet on K. obovata. The main results were as follows. 1)The water content, pH, salinity, total nitrogen and organic matter content of sediments in the hydration group were higher than those in the control group, indicating that water supplement improved the nutrient conditions and salinity of the sediment. 2)Water supplementation significantly increased net photosynthetic rate, water use efficiency, and chlorophyll a content(P<0.05), while decreased intercellular CO2 concentration, indicating that water repleni-shment effectively improved the photosynthesis status and promoted the absorption and transformation of light energy for K. obovata. 3)The maximum fluorescence efficiency(Fv/Fm)of the photosystem II(PS II)in the control group was significantly lower than 0.8 (common threshold), indicating that the degraded K. obovata forest was in the photoinhibitory state, while Fv/Fmwas significantly increased after water supplementation (P<0.01), approaching 0.8, indicating a significant improvement in plant health status. 4)Water supplementation improved the photo-chemical efficiency of the PS II reaction center of K. obovate and significantly improved the imbalance of the excitation energy distribution between the two-optical systems. Moreover, water supplementation also effectively reduced the heat dissipationof the antenna pigments and made the distribution of light energy tend to be efficient, thus increasing the foliar photochemical utilization efficiency. In summary, periodic replenishment is an effective method for the rehabilitation of land-based degraded mangroves.
Key words Shenzhen Bay; Kandelia obovata; water replenishment; chlorophyll fluorescence; photosynthetic parameters
doi: 10.13209/j.0479-8023.2019.046
广东省海洋科技攻关项目“广东省典型海湾红树林生态调查与生态保护模式研究”、深圳市科创委科技攻关项目(JSGG20170824 110218769)和侨城湿地项目(华娱合字2017第65号)资助
收稿日期: 2018–07–17;
修回日期: 2018–08–05