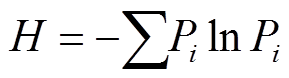 , i为物种数。
, i为物种数。摘要 以华北落叶松(Larix principis-rupprechtii)人工林幼龄林为研究对象, 设置 3 个梯度的氮添加水平(0, 20和 50 kg N/(ha·a), 即 N0, N20 和 N50), 研究氮添加对人工林草本植物群落特征及地上生产力的影响, 得到以下结果。1)氮添加改变了土壤微环境, 降低土壤温度、显著地增加土壤水分。2)氮添加在一定程度上促进落叶松人工林草本植物群落的生长(P>0.05)。与对照组(N0)相比, 植物群落总盖度在 N20 和 N50 样方中分别增加6.83%和 15.03% (2014 年), 或 9.80%和 12.94% (2016 年), 但草本植物地上生物量的累积无显著变化; 群落总盖度和地上生物量与土壤含水量显著正相关(P<0.05)。3)氮添加对落叶松人工林草本植物群落的多样性和均匀度无显著影响, 但是低浓度氮添加(即 N20)显著地增加单位面积内物种的丰富度(2014 年单位面积内物种丰富度在 N20 样方中增加 23.33%, P<0.05)。4)氮添加对不同植物功能群的影响不同, 其中氮添加促进蓼科和莎草科植物的生长, 抑制禾本科和菊科植物的生长, 对豆科植物无影响, 说明温带落叶松人工林草本植物群落对氮沉降的响应敏感, 氮添加在一定程度上促进草本植物的生长, 同时氮添加改变了草本植物不同功能群间的竞争力。
关键词 氮添加; 华北落叶松人工林; 草本植物; 群落结构; 地上生物量
自工业革命以来, 由于化石燃料的燃烧、化肥使用量的成倍增加及不合理使用等人为活动, 使得陆地生态系统中的氮沉降显著增加, 目前全球平均氮沉降量已经高达 63Tg/a (1Tg=1012g), 为工业革命前的 3.6 倍[1]。在过去 30 年, 由氮沉降增加引起的陆地生态系统结构和功能变化备受关注[2]。陆地生态系统的植物群落特征和地上生产力与氮沉降的增加有密切联系[3–6]。
有关氮沉降对陆地生态系统的植物群落特征和地上生产力影响的研究结果不尽相同, 有的研究发现氮沉降的增加促进植物的生长, 提高植物群落地上生物量的累积[7–8]; 另有研究发现氮沉降抑制植物的生长, 加剧陆地生态系统的退化[9–10]; 也有研究认为氮沉降对植物的生长无影响[11]; 还有研究发现氮添加降低植物群落的多样性[12–13],或对植物群落的多样性无影响[14–15]。这表明氮沉降对陆地生态系统的植物群落特征和地上生产力的影响有较大的不确定性[10,15–16]。因此, 研究氮沉降对陆地生态系统的植物群落特征和地上生产力影响的机理, 对准确地评估陆地生态系统结构和功能的变化具有重要意义[10,17]。
影响植物群落特征及地上生产力的因素众多, 研究显示, 氮沉降的增加会改变植物个体或功能群的竞争力[2,5–6]。氮沉降不仅能够直接影响植物个体或功能群的生长, 还能够通过改变土壤中的有效氮、有效磷[2,5–6]、pH 值[18]、微生物的群落结构[19]和凋落物的分解速率[20]等诸多因素间接地影响植物生长。氮沉降对植物群落特征及地上生产力的影响还取决于植物的特性, 例如, 喜氮植物可以通过植物较高的氮素利用率, 迅速地繁殖成为优势种, 而原有的优势植物由于施氮作用, 极有可能出现衰退甚至灭绝[2,21]。氮沉降的增加对植物群落特征及地上生产力的影响还取决于植物群落所在生态系统的氮限制状况[4,22], 例如, 氮添加能够缓解草原生态系统的氮限制状态, 使草本植物得以旺盛生长, 促进草本植物生物量的累积[23], 而在氮饱和的热带和亚热带生态系统中, 氮添加对草本植物生长没有影响或抑制[6,10,24]。
近年来, 关于氮沉降对森林生态系统的结构和功能影响的研究主要针对天然林或人工林的乔木及灌木, 对人工林林下草本植物群落的关注较少[5,25]。林下草本植物是森林生态系统的重要组成部分[26],尽管林下植物在森林总生物量中只占很小的比例, 但其不仅影响群落演替和生态功能的稳定[27], 而且为林下动物提供栖息地和食物来源[28], 促进养分循环[29], 因而林下植被的作用不可忽略。人工林是世界上森林生态系统的重要组成部分, 其面积呈逐年增加的趋势, 且我国人工林面积居世界首位[30]。人工林增加了全球的碳汇, 减缓了全球变暖[31], 对全球陆地生态系统的碳平衡至关重要。20 世纪 80 年代, 由于集约经营水平的提高, 乔木层植物种类单一, 人工林生态系统结构简单, 养分分解归还速率慢, 出现土壤肥力衰退等生态问题[32], 人们开始重视对人工林林下植被群落多样性的研究。落叶松是华北地区分布最广的主要森林生态树种, 多为人工林[33]。因此, 本研究以华北落叶松人工林生态系统为研究对象, 设置长期外源氮添加处理, 探究氮沉降对落叶松人工林草本植物群落特征和地上生产力的影响, 目的是探究氮沉降对落叶松人工林草本植物群落特征及地上生产力的影响及其关键环境要素, 为温带森林生态系统应对未来氮沉降的增加提供基础数据。
本文研究地点位于河北省塞罕坝机械林场的北京大学生态试验站(地理坐标为 42°04′—42°36′N, 116°53′—117°38′E; 海拔 1500m)。塞罕坝机械林场是我国三北防护林体系的一部分, 已发展成我国最大人工林种植基地, 主要包括华北落叶松(Larix principis-rupprechtii)林和樟子松(Pinus sylvestris var. mongolica)林。塞罕坝地处我国暖温带向温带的过渡地带, 由半湿润气候向半干旱气候过渡, 冬季冷而长(11—3 月), 春夏季较短。近 40 年长期气象观测数据显示, 全年平均气温为–1.4℃, 1 月和 7月平均气温分别为 21.8℃和 16.2℃, 全年平均降水量为450 mm, 无霜期为 81 天。一般从 11 月开始降雪, 次年 4 月初冰雪开始融化。主要草本物种有羊草(Leymus chinensis)、硬质早熟禾(Poa sphond ylodes)、黑麦草(Lolium perenne L)、山蒿(Artemisia brachy-loba)、狭叶青蒿(Artemisia dacunculus L)和委陵菜(Potentilla chinensis Ser)。
本次实验选取华北落叶松幼龄林(15 年生), 于2009 年 8 月建立面积为 100m×100m 的实验样地, 并用铁丝网围护, 减少人为和动物活动的干扰。样地划分为 9 个小样方, 每个小样方的面积为 20m× 20m, 各样方之间留 10m 宽的隔离带, 以防互相干扰。从 2010 年 5 月开始, 在样地中设置 3 个梯度的氮肥处理, 包括对照(无氮肥添加, N0)、低氮处理(20kgN/(ha·a), N20)和高氮处理(50kgN/(ha·a), N50), 每个处理重复 3 次。在生长季(5 月—10 月)的每个月月初对土壤进行喷施(共 6次)。本实验选择的氮肥为尿素, 为了保证尿素与土壤层有充足的接触时间, 在施肥过程中参考天气预报安排施肥日期, 确保施氮后第二天无雨。利用 EM50 (Decagon, 美国)连续监测生长季期间的土壤温度和土壤湿度, 每 30 分钟记录一次数据。
分别在 2014 和 2016 年植物生长旺季(8 月初)进行群落的样方调查。在每个样方中随机抛掷 1 m×1m 的样方框, 为了避免边缘效应, 样方距边缘的距离大于 50cm, 用丝线均匀地分成 10×10 个 100cm2 的栅格, 确认群落的总盖度及每个物种的盖度。用直尺量取 5 株植物的高度求平均值, 数出样方中每种植物的个体数。8 月中旬(生长旺盛期)在每个样方内取 1m×1m 的面积, 齐地面剪草, 收割地上生物量, 在 65℃烘干至恒重并称重。为了避免边缘效应, 只在样方的中心区域取样。为了便于比较, 将所有物种划分为 7 个功能群: 蔷薇科、禾本科、菊科、豆科、莎草科、蓼科和其他杂草。
采用以下指标衡量氮添加对植物群落的影响。
1)丰富度 S=单位面积样方中出现的物种数。
2)重要值 P=(相对盖度+相对数量+相对高度)×100/3。
3)多样性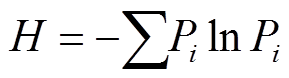 , i为物种数。
, i为物种数。
4)均匀度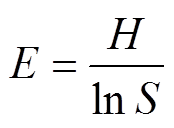 。
。
采用双因素方差分析(two-way ANOVA with Turkey’s test)法进行统计分析, 分别检验施氮处理、年际作用及其交互作用对群落总盖度、物种丰富度、物种多样性和物种均匀度的影响。采用单因素方差分析(one-way ANOVA with Turkey's test)法检验施氮处理对群落的物种丰富度、群落盖度、地上生物量、物种多样性和物种均匀度的影响。采用线性回归方法分析土壤温度和土壤水分与地上生物量和植物群落盖度的关系。以上分析均在 SPSS 18.0中进行, 差异显著性水平设定0.05。
2014 年, 5 和 6 月的月平均土壤水分大于 7, 8和9 月(图 1)。2016 年, 土壤含水量的变化趋势呈单峰曲线, 7 月最高(图 1)。2014 和 2016 年, 土壤温度在 7 月达到整个生长季的峰值。氮添加显著地增加了土壤含水量(P<0.05), 降低了土壤温度(P>0.05)。在 2014 年的生长季, 与对照相比, 土壤温度在 N20和 N50 样方中分别降低 0.47℃ 和 0.98℃(P>0.05), 土壤水分分别增加 1.48%和 2.21%(P<0.05)。在2016 年, 与对照相比, 土壤温度在 N20 和 N50 样方中分别降低 0.36℃和 0.85℃(P>0.05), 而土壤水分分别增加 1.15% (P>0.05)和 1.79% (P<0.05)。
如表 1 所示, 经过 N20 和 N50 两个梯度氮添加处理, 落叶松人工林草本植物群落物种组成与对照样地中未发生显著的变化。2014 年共出现 24 个物种, 在 N20 样地内, 氮添加后多了物种苔草(Carexspp)和山韭(Allium thunbergii), 少了物种细叶蓼(Polygonum taquetii)和华北蓝盆花(Scabiosa tschi-liensis), 同时氮添加导致 16 个物种的重要值上升, 7 个物种的重要值下降, 其中狭叶青蒿、华北岩黄耆(Hedysarum gmelinii)的重要值增加最显著, 而山蒿和硬质早熟禾的重要值显著下降。在 N50 样地内, 氮添加后多了物种苔草, 少了物种龙牙草(grimonia pilosa)、苣荬菜(Sonchus arvensis)、细叶蓼和水杨梅(Adina rubella), 同时氮添加使 9 个物种的重要值上升, 13 个物种的重要值下降, 其中狭叶青蒿的重要值显著增加, 山蒿(Artemisia brachyloba)的重要值显著降低。对照样地内, 由山嵩、硬质早熟禾、黑麦草(Lolium perenne)和羊草占优势的群落物种组成, 经 N20 氮添加处理后, 演变为由狭叶青蒿、黑麦草和羊草共同占绝对优势的群落物种组成, 经过N50 氮添加处理后, 又演变为由狭叶青蒿和硬质早熟禾占优势的群落物种组成。
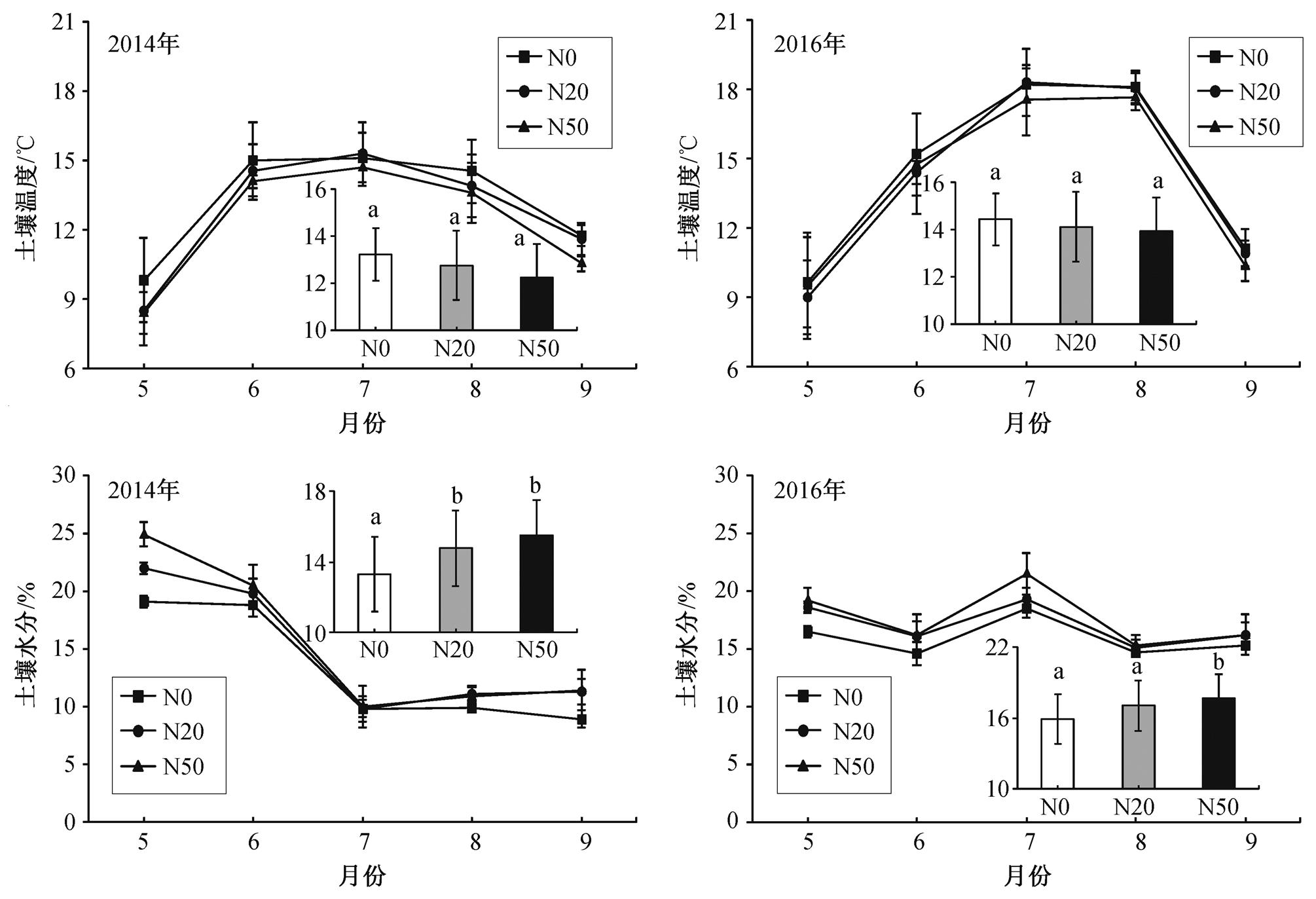
不同小写字母表示同一年不同氮添加处理间差异显著(P<0.05), 相同字母表示差异不显著。下同
图1 氮添加对土壤温度和土壤水分的影响
Fig. 1 Influence of nitrogen addition on soil temperature and soil moisture
2016 年, 共出现 36 个物种, 在 N20 样地内氮添加后多了物种叉分蓼(Polygonum divaricatum)、华北岩黄耆和簇茎石竹(Dianthus repens), 少了物种播娘蒿(Thalictrum aquilegifolium)、黑麦草和糖芥(Erysimum bungei), 同时氮添加使 19 个物种的重要值上升, 17 个物种的重要值下降, 其中山蒿的重要值显著降低, 委陵菜的重要值增加最显著。在N50 样地内, 氮添加后, 多了物种叉分蓼和华北岩黄耆, 少了物种山韭和毛萼麦瓶草(Silene repens), 同时氮添加的 15 个物种的重要值上升, 20 个物种的重要值下降, 其中龙牙草和翼茎风毛菊(Saussurea alata)的重要值显著增加, 羊草的重要值显著降低。对照样地内, 由狭叶青蒿和羊草占优势的群落物种组成, 经 N20 氮添加处理后, 演变为由羊草和委陵菜占绝对优势的群落物种组成, 经过 N50 氮添加处理后, 又演变为由狭叶青蒿和羊草占优势的群落物种组成。
如表 2 所示, 氮添加对落叶松人工林草本植物的群落盖度、多样性及均匀度无显著影响(P>0.05), 而对物种丰富度有显著影响(P<0.05), 且物种丰富度存在显著的年际差异(P<0.001)。在 2014 年, 与对照相比, 植物群落总盖度在 N20 和 N50 样方中分别增加 6.83%和 15.03% (P>0.05, 图 2(a)), 而氮添加没有显著改变植物群落的多样性和均匀度(P>0.05, 图 2(c)和(d))。与之相反, 物种丰富度在 N20 中显著的增加 23.33% (P<0.05, 图 2(b)), 而植物群落的物种丰富度在 N50 中无显著的变化(P>0.05, 图 2(b))。在 2016 年, 与对照相比, 植物群落总盖度在 N20和 N50 样方中分别增加 9.80%和 12.94%(P>0.05, 图 2(a)), 而氮添加对植物群落物种丰富度、多样性和均匀度均无显著影响(P>0.05, 图2(b), (c)和(d))。
不同植物功能群对氮添加的响应不一致(图3)。在 2014 年, 莎草科、蔷薇科和豆科植物的相对盖度在 N20 样方中分别增加 0.44%, 2.11%和 1.11%, 禾本科、菊科和蓼科植物的相对盖度分别减少3.94%, 1.83%和 0.22%; 蓼科、莎草科和菊科植物的相对盖度在 N50 样方中分别增加 2.33%, 1.11%和 8.72%, 禾本科、豆科和蔷薇科植物的相对盖度分别减少 3.16%, 0.33%和 2.61%。在 2016 年, 莎草科、蔷薇科、蓼科和豆科植物的相对盖度在 N20样方中分别增加 3.02%, 7.30%, 1.94%和 0.77%, 禾本科和菊科植物的相对盖度分别减少 4.18%和4.16%; 莎草科、蔷薇科、蓼科和豆科植物的相对盖度在 N50样方中分别增加 5.38%, 2.74%, 3.94%和0.07%, 禾本科和菊科植物的相对盖度分别减少0.61%和 1.94%。
表1 氮添加对落叶松人工林草本植物群落重要值的影响
Table 1 Responses of the important values of herbaceous community to nitrogen addition in Larix principis-rupprechtii plantation
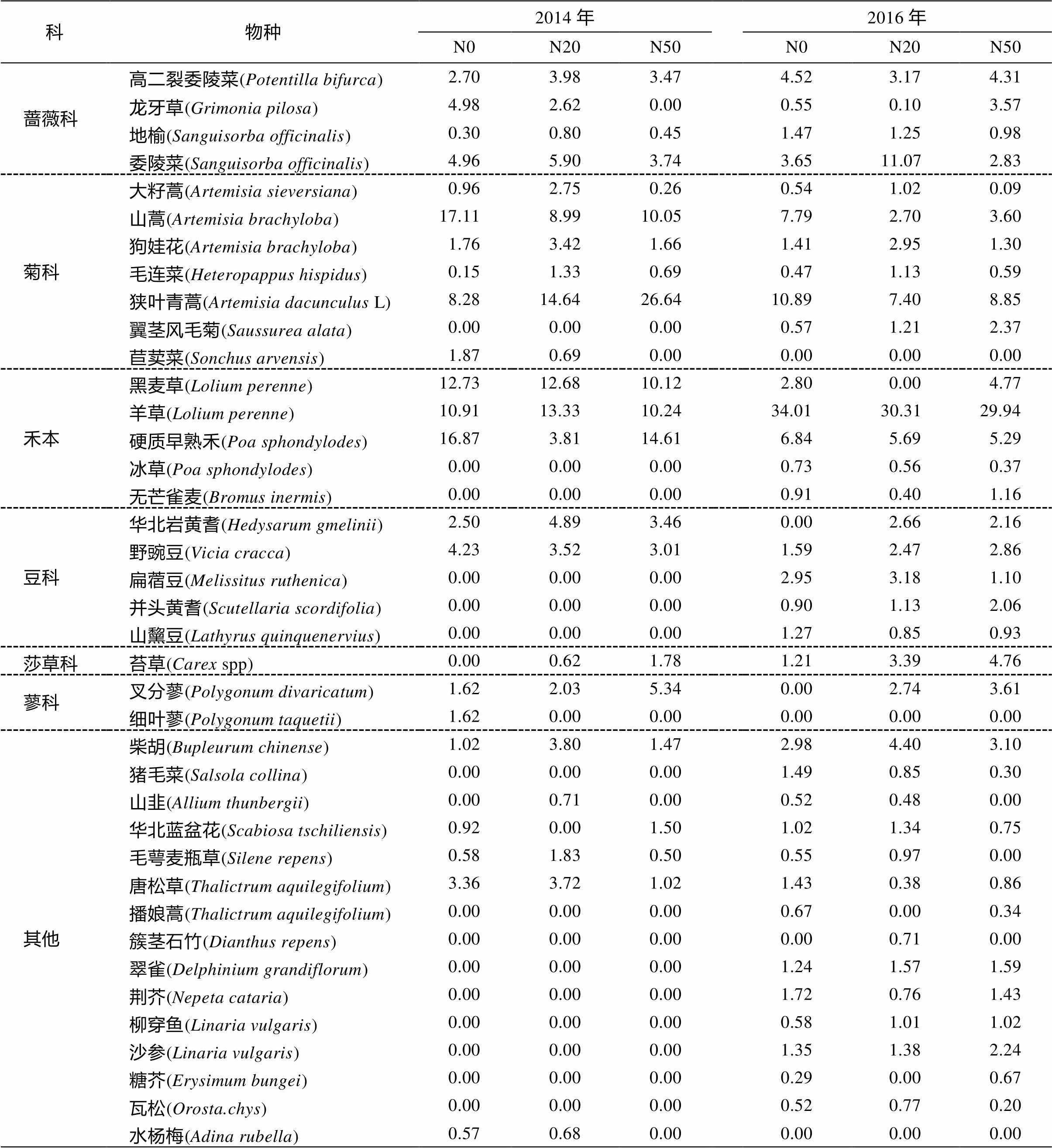
科物种2014年2016年 N0N20N50N0N20N50 蔷薇科高二裂委陵菜(Potentilla bifurca)2.703.983.474.523.174.31 龙牙草(Grimonia pilosa)4.982.620.000.550.103.57 地榆(Sanguisorba officinalis)0.300.800.451.471.250.98 委陵菜(Sanguisorba officinalis)4.965.903.743.6511.072.83 菊科大籽蒿(Artemisia sieversiana)0.962.750.260.541.020.09 山蒿(Artemisia brachyloba)17.118.9910.057.792.703.60 狗娃花(Artemisia brachyloba)1.763.421.661.412.951.30 毛连菜(Heteropappus hispidus)0.151.330.690.471.130.59 狭叶青蒿(Artemisia dacunculus L)8.2814.6426.6410.897.408.85 翼茎风毛菊(Saussurea alata)0.000.000.000.571.212.37 苣荬菜(Sonchus arvensis)1.870.690.000.000.000.00 禾本黑麦草(Lolium perenne)12.7312.6810.122.800.004.77 羊草(Lolium perenne)10.9113.3310.2434.0130.3129.94 硬质早熟禾(Poa sphondylodes)16.873.8114.616.845.695.29 冰草(Poa sphondylodes)0.000.000.000.730.560.37 无芒雀麦(Bromus inermis)0.000.000.000.910.401.16 豆科华北岩黄耆(Hedysarum gmelinii)2.504.893.460.002.662.16 野豌豆(Vicia cracca)4.233.523.011.592.472.86 扁蓿豆(Melissitus ruthenica)0.000.000.002.953.181.10 并头黄耆(Scutellaria scordifolia)0.000.000.000.901.132.06 山黧豆(Lathyrus quinquenervius)0.000.000.001.270.850.93 莎草科苔草(Carexspp)0.000.621.781.213.394.76 蓼科叉分蓼(Polygonum divaricatum)1.622.035.340.002.743.61 细叶蓼(Polygonum taquetii)1.620.000.000.000.000.00 其他柴胡(Bupleurum chinense)1.023.801.472.984.403.10 猪毛菜(Salsola collina)0.000.000.001.490.850.30 山韭(Allium thunbergii)0.000.710.000.520.480.00 华北蓝盆花(Scabiosa tschiliensis)0.920.001.501.021.340.75 毛萼麦瓶草(Silene repens)0.581.830.500.550.970.00 唐松草(Thalictrum aquilegifolium)3.363.721.021.430.380.86 播娘蒿(Thalictrum aquilegifolium)0.000.000.000.670.000.34 簇茎石竹(Dianthus repens)0.000.000.000.000.710.00 翠雀(Delphinium grandiflorum)0.000.000.001.241.571.59 荆芥(Nepeta cataria)0.000.000.001.720.761.43 柳穿鱼(Linaria vulgaris)0.000.000.000.581.011.02 沙参(Linaria vulgaris)0.000.000.001.351.382.24 糖芥(Erysimum bungei)0.000.000.000.290.000.67 瓦松(Orosta.chys)0.000.000.000.520.770.20 水杨梅(Adina rubella)0.570.680.000.000.000.00
表2 氮添加和年际及其交互作用对植物群落盖度、物种丰富度、多样性及均匀度的影响(F值)
Table 2 Effects of nitrogen addition (N), year (Y) and their interactive effects (N × Y) on plant community coverage, species richness, Shannon-Wiener diversity index and Pielou evenness index(F value)
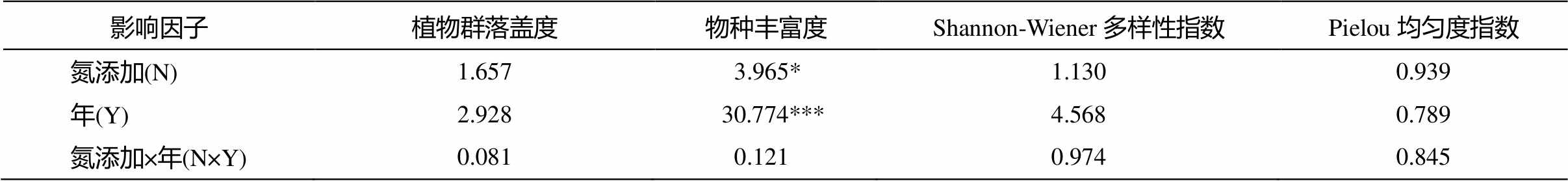
影响因子植物群落盖度物种丰富度Shannon-Wiener多样性指数Pielou均匀度指数 氮添加(N)1.6573.965* 1.1300.939 年(Y)2.92830.774***4.5680.789 氮添加×年(N×Y)0.0810.1210.9740.845
注: ***, **和*分别表示P<0.001, P<0.01和P<0.05的差异性。
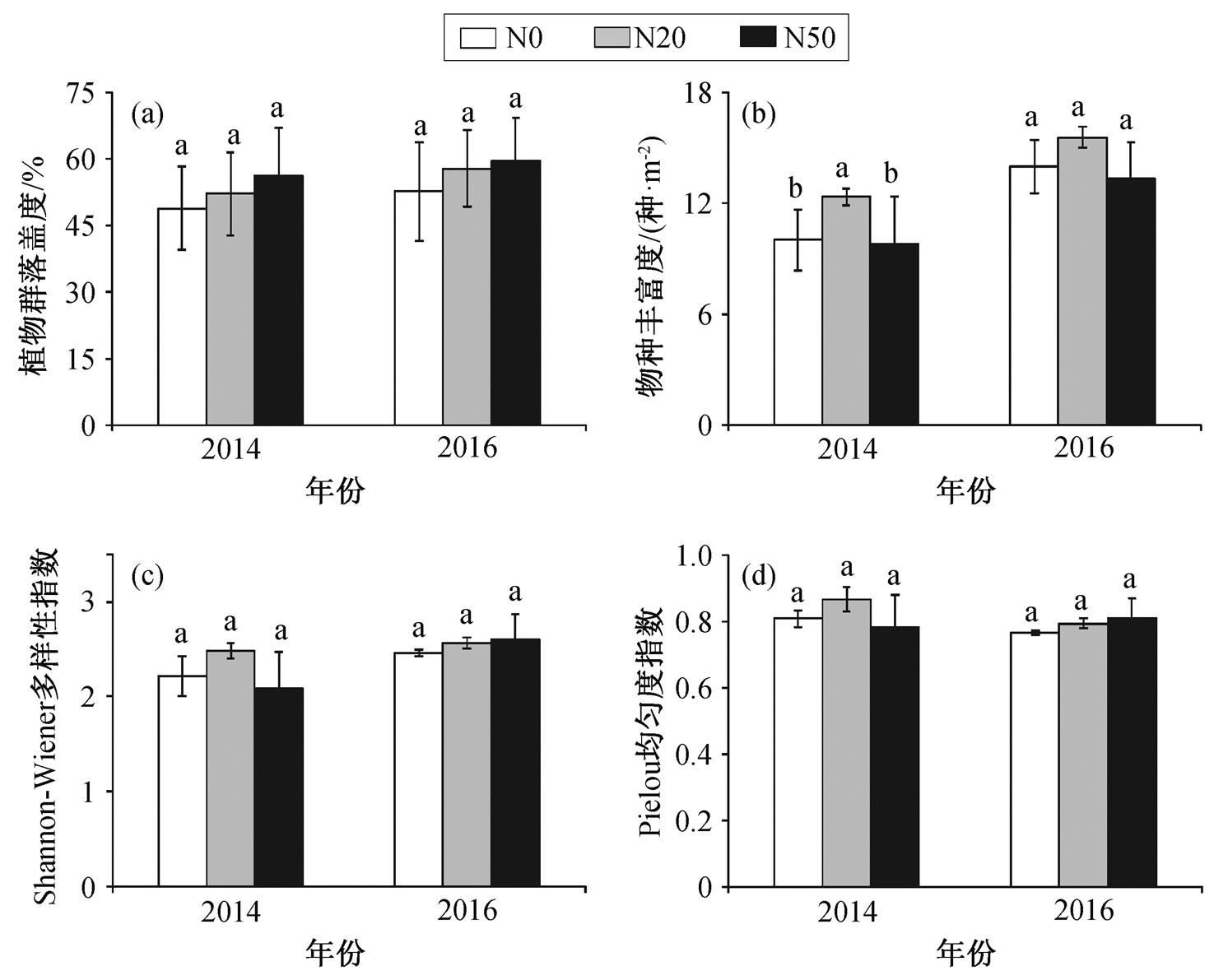
图2 氮添加对植物群落盖度、物种丰富度、多样性及均匀度的影响
Fig. 2 Influence of nitrogen addition on plant community coverage, species richness, Shannon Wiener diversity index and Pielou evenness index

图3 氮添加对植物功能群相对盖度的影响
Fig. 3 Influence of nitrogen addition on relative coverage of plant functional groups
氮添加对落叶松人工林草本植物群落地上生物量的累积无显著影响(图 4)。在 2014 年, 植物群落地上生物量在 N20 和 N50 样方中分别增加 12.96%和 27.36% (P>0.05); 在 2016 年, 植物群落地上生物量在N20样方中减少4.14%, 而在 N50样方中增加6.72% (P>0.05)。这说明氮添加在一定程度上促进了落叶松人工林草本植物群落地上生物量的累积。
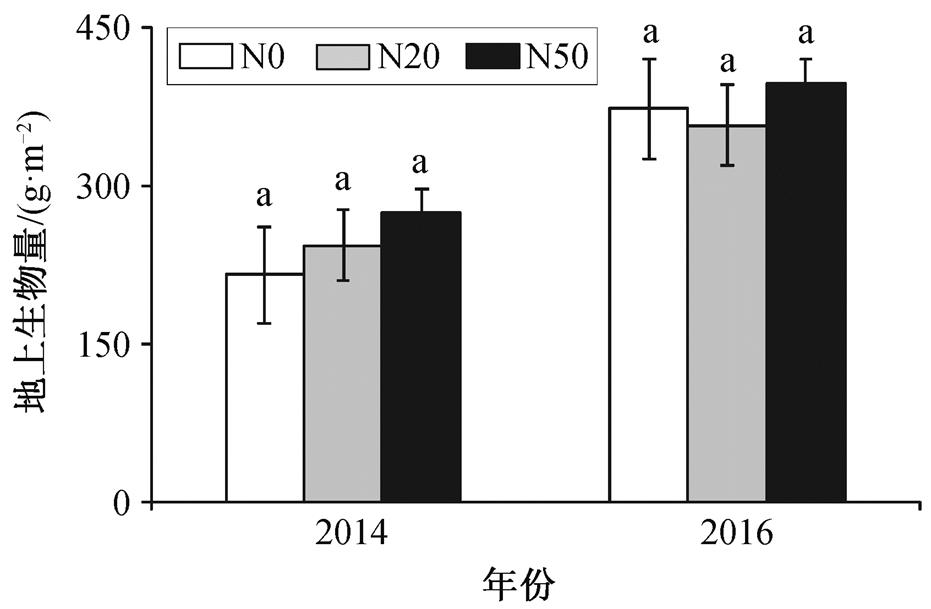
图4 氮添加对植物群落的地上生物量的影响
Fig. 4 Influence of nitrogen addition on aboveground biomass of plant community
线性回归分析结果表明, 植物群落盖度与土壤水分显著正相关(P<0.01, R2=0.46, 图 5(b)), 而与土壤温度无显著相关性 (图 5(a)), 说明土壤水分越高, 落叶松幼龄林草本植物群落的总盖度越大。地上生物量与土壤水分显著正相关(P<0.01, R2=0.68, 图5(d)), 而与土壤温度无显著相关性(图 5(c)), 说明土壤水分越高, 落叶松人工林草本植物群落的地上生物量累积越多。
本研究中, 不同氮添加强度(N20 和 N50)均没有明显地改变落叶松幼林草本植物群落的物种组成(表 1), 但 N20 显著地增加了单位面积内物种的丰富度, 而 N50 无显著影响(图 2(b)), 原因是在氮限制的温带森林生态系统中, 施氮改变了植物群落中物种间的资源竞争力[2,5–6], 主要体现在落叶松幼林草本植物群落的物种重要值变化上。其中, 低强度氮添加(N20)导致重要值升高的数多于降低的物种数, 而高强度氮添加(N50)中物种重要值升高的物种数少于降低的物种数, 且两个氮添加处理下建群种的重要值均减小(表 1), 进而导致单位面积内物种的丰富度在 N20 显著增加, 而在 N50 无显著变化。
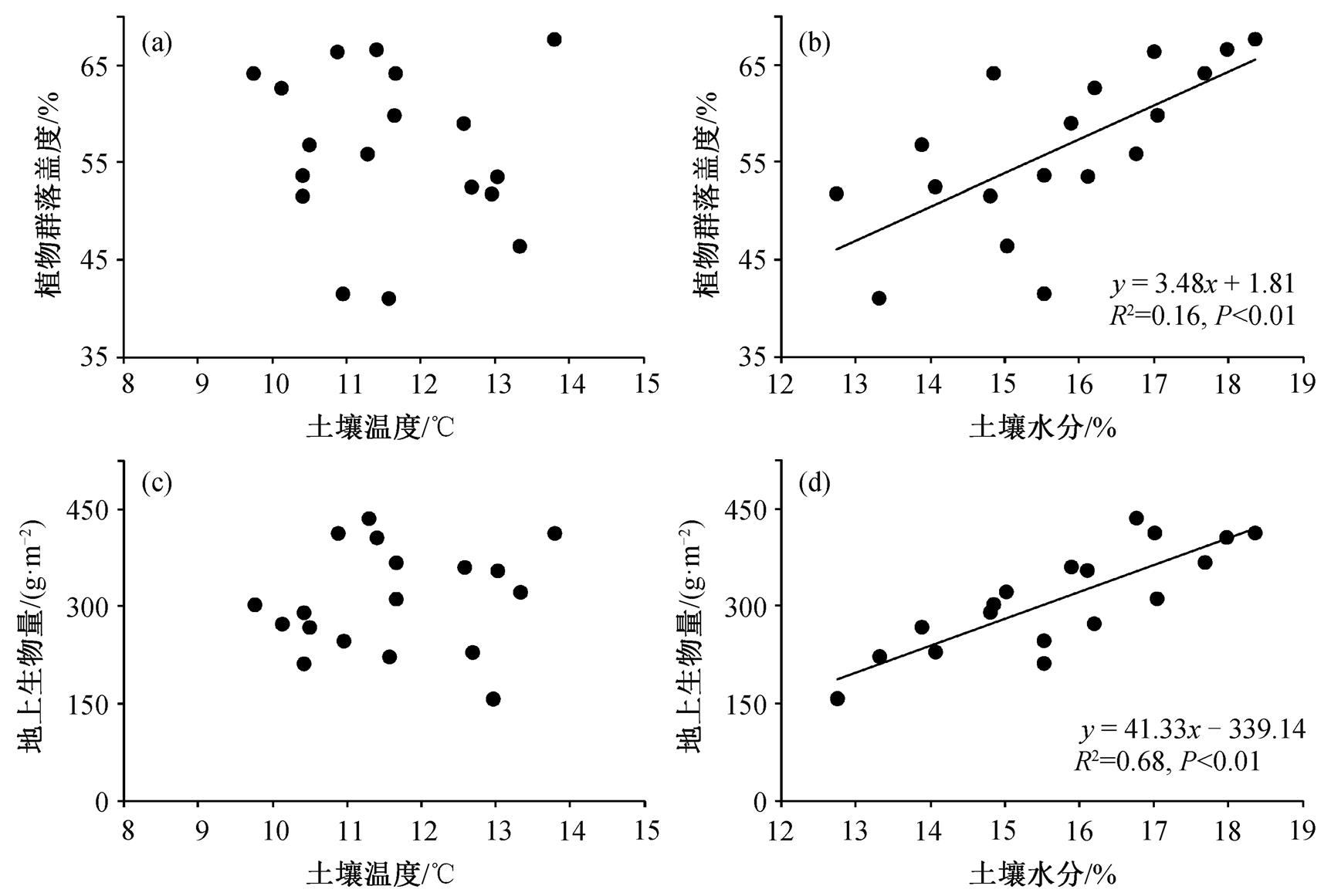
图5 植物群落盖度和地上生物量与土壤温度、土壤水分的关系
Fig. 5 Correlations between soil temperature, soil moisture and aboveground biomass and plant community coverage
光的有效性是影响林下植物生长的关键驱动因素[5,34–35], 而光对植被的影响在很大程度上取决于土壤中的 N 水平[5]。本研究中, 氮添加没有显著地改变落叶松人工林草本植物群落的物种多样性和均匀度, 这与 Ma 等[35]对温带森林生态系统中林下植被对氮添加的研究结果一致。可能原因是在氮限制的温带森林生态系统中, 氮添加增加了土壤中的有效氮, 促进物种的竞争, 使草本植物在没有氮限制的情况下能够充分地利用林下的光照[35], 促进其迅速生长[2], 提高了物种的多样性[36]; 同时林下植物多样性与土壤 pH 值的变化有密切的联系[6], 氮添加导致土壤酸化, pH 值下降, 抑制植物的生长, 降低了物种的多样性[37], 进而导致氮添加对落叶松林下草本植物的物种多样性无影响。
本研究中, 氮添加对落叶松幼林草本植物群落的总盖度无显著影响(图 2(a)), 但改变了草本植物群落内物种功能群的优势度, 其中氮添加促进了蓼科和莎草科植物的生长, 抑制了禾本科和菊科植物的生长, 而对豆科植物无影响(图 3)。对任何一个植物群落来说, 总有一些物种比另一些物种对氮添加的响应更敏感, 从而破坏种间竞争关系, 引起群落的优势种和组成改变[6,38–39]。莎草科植物施氮后盖度增加, 原因可能是莎草科植物(苔草)为多年生的草本植物, 具有发达的根系, 耐阴性好, 光限制较弱, 氮添加后增加了土壤中养分[35], 促进了莎草科植物的生长。氮添加增加了蓼科植物的盖度, 可能原因是蓼科植物处于草本群落上层, 氮添加缓解了氮限制, 蓼科植物茎粗叶大, 能够更好地利用林下的光照和土壤养分[4–5], 促进生长。同时, 氮添加使土壤养分的异质性下降, 草本植物组成主要向亲氮物种转变[17,39–40]。氮添加减少了禾本科和菊科的盖度, 原因可能是施氮增强了亲氮物种的竞争力, 而在整个草本植物群落中, 禾本科和菊科的竞争力在非氮限制状态下较弱, 进而导致其对林下光的竞争力减弱[14], 抑制生长。
本研究中, 不同氮添加强度对落叶松人工林草本植物群落地上生物量的累积无显著影响(图 4)。土壤水分是影响地上生物量累积的主要环境因子之一, 且土壤水分越多, 地上生物量越大(图 5(d))。氮限制是影响温带森林植被生长的主要因素之一[4,22], 氮添加在一定程度上满足了温带森林植被对有效氮的需求, 促进林下植被的光合作用[5], 进而促进林下草本植物群落地上生物量的累积[16]。土壤水分与林下草本植物群落的地上生物量显著正相关(图 5(d)), 施氮提高了土壤水分(图 1(c)和(d)), 进而促进了林下草本植物群落地上生物量的累积。与此同时, 土壤中磷的有效性与植被生产力有密切的联系[9–10], 氮添加可能导致土壤的酸化[18,41], 降低土壤中磷的有效性[18,41]和土壤酸性酶活性[41], 不利于土壤微生物和植被的生长[10,41–42], 进而抑制林下草本植物群落地上生物量的累积[9–10]。因此, 在温带森林生态系统中, 氮添加对草本植物群落生长的消极作用与对草本植物群落生长的促进作用共同导致氮添加对温带森林生态系统中草本植物群落地上生物量累积的影响, 进而导致氮添加对落叶松人工林草本植物群落地上生物量的累积无显著影响。
在全球变暖的背景下, 有大量的研究通过田间试验, 模拟陆地生态系统地上生物量对氮沉降的响应。毛晋花等[4]和 Li 等[43]发现, 氮添加在小于 60kg/(ha·a)的范围内有效地促进了植物的生长, 本研究与他们的结果一致, 表明低强度氮添加促进了落叶松人工林草本植物群落的生长。可能原因是低强度氮添加增加了土壤中的有效氮[29], 增强了植物的光合能力[5,34], 进而促进植物的生长[4,44]; 同时低强度地氮添加会缓解温带森林的氮限制状态[22], 促进植物的新陈代谢, 增强植物对矿物营养及水分的吸收和运输, 进而增加地上生物量的生产[45]。
氮沉降是影响陆地生态系统的重要进程, 本研究利用 3 个梯度的施氮水平(0, 20 和 50 kgN/(ha·a)), 研究氮添加对落叶松人工林草本植物群落特征及地上生物量的影响, 得出以下主要结论。
氮添加没有改变落叶松人工林草本植物群落的物种组成, 但低强度氮添加 (20 kgN/(ha·a))显著地提高了单位面积内物种的丰富度, 而高强度氮添加 (50kgN/(ha·a)) 无显著影响。氮添加没有显著地改变落叶松人工林草本植物群落的多样性和均匀度, 但在一定程度上促进了落叶松人工林草本植物群落的生长。氮添加对落叶松人工林草本植物群落的总盖度无显著的影响, 但改变了草本植物群落内物种功能群的优势度, 促进了蓼科和莎草科植物的生长, 抑制了禾本科和菊科植物的生长, 而对豆科植物无影响。综上所述, 我们认为温带森林生态系统中, 落叶松人工林草本植物群落对氮添加的响应敏感。以上结果可以为研究森林生态系统中人工林草本植被群落对氮沉降的响应提供基础数据。
参考文献
[1]Galloway J N, Dentener F J, Capone D G, et al. Nitrogen cycles: past, present, and future. Biogeoche-mistry, 2004, 70(2): 153–226
[2]Bobbink R, Hicks K, Galloway J, et al. Global as-sessment of nitrogen deposition effects on terrestrial plant diversity: a synthesis. Ecological Applications: A Publication of the Ecological Society of America, 2010, 20(1): 30–59
[3]Manning P, Newington J E, Robson H R, et al. Decoupling the direct and indirect effects of nitrogen deposition on ecosystem function. Ecology Letters, 2006, 9(9): 1015–1024
[4]毛晋花, 邢亚娟, 闫国永, 等. 陆生植物生物量分配对模拟氮沉降响应的 Meta 分析. 生态学报, 2018, 38(9): 1–11
[5]Walter C A, Raiff D T, Burnham M B, et al. Nitrogen fertilization interacts with light to increase Rubus spp. cover in a temperate forest. Plant Ecology, 2016, 217(4): 1–10
[6]Wu J, Liu W, Fan H, et al. Asynchronous responses of soil microbial community and understory plant com-munity to simulated nitrogen deposition in a sub-tropical forest. Ecology & Evolution, 2013, 3(11): 3895–3905
[7]Lebauer D S, Treseder K K. Nitrogen limitation of net primary productivity in terrestrial ecosystems is glo-bally distributed. Ecology, 2008, 89(2): 371–379
[8]Neff J C, Townsend A R, Gleixner G, et al. Variable effects of nitrogen additions on the stability and tur-nover of soil carbon. Nature, 2002, 419: 915–917
[9]Paoli G D, Curran L M. Soil nutrients limit fine litter production and tree growth in mature lowland forest of southwestern borneo. Ecosystems, 2007, 10(3): 503–518
[10]Baribault T W, Kobe R K, Finley A O. Tropical tree growth is correlated with soil phosphorus, potassium, and calcium, though not for legumes. Ecological Mo-nographs, 2012, 82(2): 189–203
[11]李化山, 汪金松, 刘星, 等. 模拟N沉降对太岳山油松人工林和天然林草本群落的影响. 生态学报, 2015, 35(11): 3710–3721
[12]Talhelm A F, Burton A J, Pregitzer K S, et al. Simulated nitrogen deposition reduces the abundance of dominant forest understory and groundcover plants. Forest Ecology & Management, 2013, 293: 39–48
[13]Lu X K, Mo J M, Glliam F S, et al. Effects of experimental nitrogen additions on plant diversity in an old-growth tropical forest. Global Change Biology, 2010, 16(10): 2688–2700
[14]Gilliam F S. Response of the herbaceous layer of forest ecosystems to excess nitrogen deposition. Journal of Ecology, 2006, 94(6): 1176–1191
[15]Concilio A L, Loik M E. Elevated nitrogen effects on Bromus tectorum dominance and native plant diver-sity in an arid montane ecosystem. Applied Vegeta-tion Science, 2013, 16(4): 598–609
[16]Thomas R Q, Canham C D, Weathers K C, et al. Increased tree carbon storage in response to nitrogen deposition in the US. Nature Geoscience, 2010, 3(1): 229–244
[17]Eilts J A, Mittelbach G G, Reynolds H L, et al. Re-source heterogeneity, soil fertility, and species diver-sity: effects of clonal species on plant communi- ties. American Naturalist, 2011, 177(5): 574–588
[18]Vitousek P M, Porder S, Houlton B Z, et al. Terre-strial phosphorus limitation: mechanisms, implica-tions, and nitrogen-phosphorus interactions. Ecologi-cal Applications, 2010, 20(1): 5–15
[19]Cusack D F, Silver W L, Torn M S, et al. Changes in microbial community characteristics and soil organic matter with nitrogen additions in two tropical forests. Ecology, 2011, 92(3): 621–632
[20]Van der Heiiden M G A, Bardgett R D, Straalen N M V. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosy-stems. Ecology Letters, 2008, 11(3): 296–310
[21]Gilliam F S. Hockenberry A W, Adams M B. Effects of atmospheric nitrogen deposition on the herbaceous layer of a central Appalachian hardwood forest. Journal of the Torrey Botanical Society, 2006, 133(2): 240–254
[22]Vitousek P M, Howarth R W. Nitrogen limitation on land and in the sea: how can it occur?. Biogeoche-mistry, 1991, 13(2): 87–115
[23]Xia J Y, Wan S Q. Global response patterns of terrestrial plant species to nitrogen addition. New Phytologist, 2008, 179(2): 428–439
[24]Galloway J N, Townsend A R, Erisman J W, et al. Transformation of the nitrogen cycle: recent trends, questions, and potential solutions. Science, 2008, 320: 889–892
[25]Takafumi H, Hiura T. Effects of disturbance history and environmental factors on the diversity and produ-ctivity of understory vegetation in a cool-temperate forest in Japan. Forest Ecology & Management, 2009, 257(3): 843–857
[26]Tchouto M G P, Boer W F D, Wilde J J F E D, et al. Diversity patterns in the flora of the Campo-Ma’an Rain Forest, Cameroon: do tree species tell it all?. Biodiversity & Conservation, 2006, 15(4): 1353–1374
[27]Royo A A, Carson W P. On the formation of dense understory layers in forests worldwide: consequences and implications for forest dynamics, biodiversity, and succession. Canadian Journal of Forest Research, 2006, 36(6): 1345–1362
[28]Hirao T, Murakami M, Kashizaki A. Importance of the understory stratum to entomofaunal diversity in a tem-perate deciduous forest. Ecological Research, 2009, 24(2): 263–272
[29]Nilsson M C, Wardle D A. Understory vegetation as a forest ecosystem driver: evidence from the northern Swedish boreal forest. Frontiers in Ecology and the Environment, 2005, 3(8): 421–428
[30]王大鹏, 王文斌, 郑亮, 等. 中国主要人工林土壤有机碳的比较. 生态环境学报, 2014, 23(4): 698–704
[31]Piao S L, Fang J Y, Ciais P, et al. The carbon balance of terrestrial ecosystems in China. Nature, 2009, 458: 1009–1013
[32]李国雷, 刘勇, 于海群, 等. 油松(Pinustabulae-formis)人工林林下植被发育对油松生长节律的响应. 生态学报, 2009, 29(3): 1264–1275
[33]于景金, 谷建才, 李校, 等. 塞罕坝落叶松人工林下植物多样性研究. 林业资源管理, 2008(5): 90–94
[34]Neufeld H S, Young D R. Ecophysiology of the herbaceous layer in temperate deciduous forests // Gilliam F S. The herbaceous layer in forests of eastern North America. 2nd ed. New York: Oxford University Press, 2014: 34–39
[35]Ma S, Verheyen K, Props R, et al. Plant and soil microbe responses to light, warming and nitrogen addition in a temperate forest. Functional Ecology, 2018, 32: 1293–1303
[36]Strengbom J, Näsholm T, Ericson L. Light, not nitrogen, limits growth of the grass Deschampsia flexuosa in boreal forests. Canadian Journal of botany, 2004, 82(4): 430–435
[37]鲁显楷, 莫江明, 董少峰. 氮沉降对森林生物多样性的影响. 生态学报, 2008, 28(11): 5532–5548
[38]Valladares F, Laanisto L, Niinemets U, et al. Shedding light on shade: ecological perspectives of understory plant life. Transactions of the Botanical Society of Edinburgh, 2016, 9(3): 237–251
[39]Beatty S W. Habitat heterogeneity and maintenance of species in understory communities // Gilliam F S. The herbaceous layer of forests in eastern North America, 2nd ed. New York: Oxford University Press, 2014: 215–232
[40]Small C J, Mccarthy B C. Spatial and temporal variability of herbaceous vegetation in an eastern deciduous forest. Plant Ecology, 2003, 164(1): 37–48
[41]Yang K, Zhu J, Gu J, et al. Changes in soil phos-phorus fractions after 9 years of continuous nitrogen addition in a Larix gmelinii plantation. Annals of Forest Science, 2015, 72(4): 435–442
[42]Hu Y L, Zeng D H, Liu Y X, et al. Responses of soil chemical and biological properties to nitrogen addi-tion in a Dahurian larch plantation in northeast China. Plant & Soil, 2010, 333(1/2): 81–92
[43]Li F, Chen B, Liang L, et al. Responses of tree and insect herbivores to elevated nitrogen inputs: a meta-analysis. Acta Oecologica, 2016, 77: 160–167
[44]Lau J A, Bowling E J, Gentry L E, et al. Direct and interactive effects of light and nutrients on the legume-rhizobia mutualism. Acta Oecologica, 2012, 39(2): 80–86
[45]Reef R, Slot M, Motro U, et al. The effects of CO2 and nutrient fertilisation on the growth and tempera-ture response of the mangrove avicennia germinans. Photosynthesis Research, 2016, 129(2): 159–170
Responses of Herbaceous Community Characteristics and Biomass to Nitrogen Addition in a Larix principis-rupprechtii Plantation
Abstract The research was conducted in a sapling Larix principis-rupprechtii, plantation set three nitrogen addition levels (0, 20 and 50 kg N/(ha·a), called N0, N20 and N50), in order to assess the influence of nitrogen addition on plant communities characteristics and above-ground biomass. The results showed that nitrogen addition altered soil micro-environment, reduced soil temperature and significantly increased soil moisture. Nitrogen addition partly promotes the growth of herb community (increased by 6.83% and 6.83% in N20 and N50 in 2014, respectively, compared with the control; while increased by 9.80% and 6.83% in N20 and N50 in 2016, respectively, P>0.05). The community coverage and aboveground biomass were significantly and positively correlated with soil moisture (P<0.05). The diversity and evenness had no significant response to nitrogen addition, but N20 significantly increases the species richness per area (significantly increased by 23.33% in N20 samples in 2014, P<0.05). Nitrogen addition exerted different influences on plant functional groups, i.e., nitrogen addition promoted the growth of polygonaceae and cyperaceae plants, restrained gramineae and compositae plants and had no influence of leguminous plants. The results suggested that herb communities are sensitive to nitrogen addition in temperate Larix principis-rupprechtiiplantations, and nitrogen addition partly promotes the growth of herb plants and changes competition among different herbaceous plants functional groups.
Key words nitrogen addition; Larix principis-rupprechtii plantations; herb plants; community structure; above-ground biomass
国家重点基础研究发展规划项目(2013CB956303)资助
收稿日期: 2018–05–01;
修回日期: 2018–06–21;
doi: 10.13209/j.0479-8023.2019.023
网络出版日期: 2019–03–26