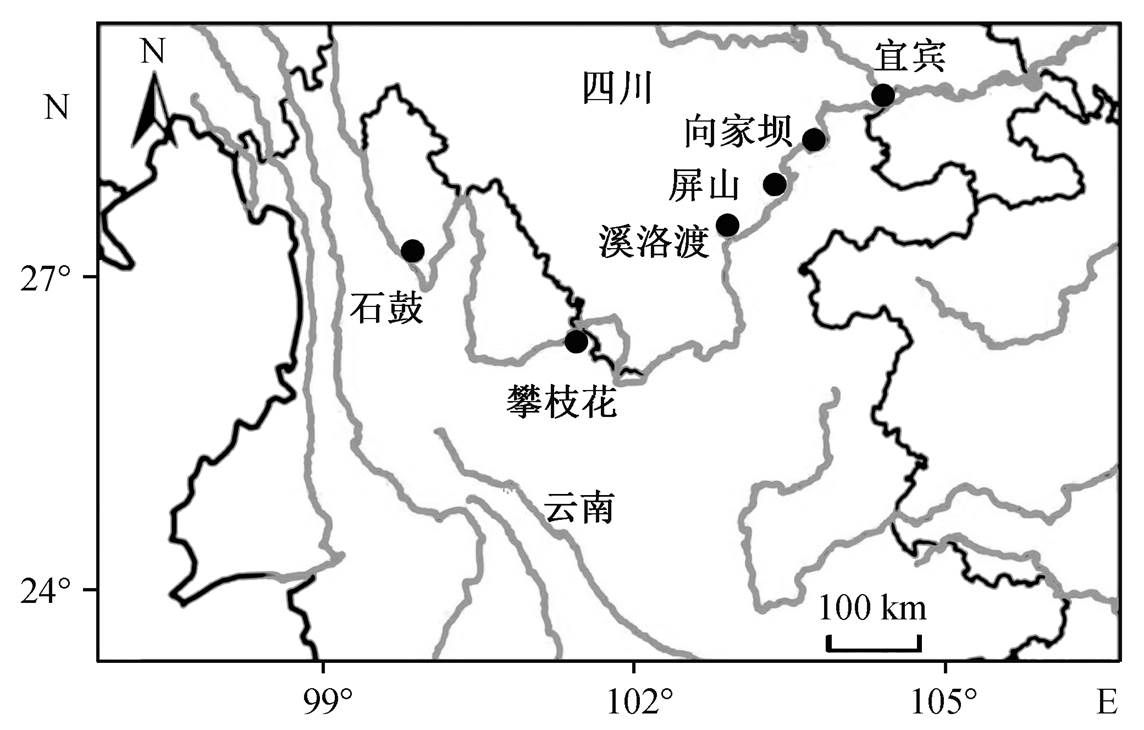
图1 采样点分布
Fig. 1 Distribution map of sampling sites
摘要 为研究金沙江典型河段浮游藻类的群落结构特征及主要影响因素, 于 2014 年秋季(10 月)在石鼓至宜宾江段布设 6 个断面进行浮游藻类群落监测。通过显微镜观察, 共鉴定出浮游藻类 6 门 30 属 52 种, 其中硅藻的物种数、细胞密度和生物量分别占 65.38%, 74.07%和 80.65%, 是优势门类。浮游藻类总细胞密度和生物量都呈现坝上逐渐降低、坝下逐渐升高的规律, 石鼓最高, 向家坝最低。多样性分析表明, 攀枝花的浮游藻类群落多样性最高, 溪洛渡和向家坝均较低。浮游藻类与环境因子的 RDA 分析表明, 总氮是影响浮游藻类群落结构的主要环境因子。优势属现存量与环境因子的相关性分析结果表明, 包括尖针杆藻Synedra acus和曲壳藻 Achnanthes sp.在内的 6 种硅藻与水位正相关, 与水温负相关, 是适合在低温下生活的藻类, 小环藻 Cyclotella sp.则适合在温度较高的环境中生长。网状空星藻 Coelastrum reticulatum、栅藻 Scenedesmus sp.、尖尾蓝隐藻 Chroomonas acuta和小环藻 Cyclotella sp.的现存量与总氮显著正相关, 能够指示水体中的氮浓度; 近缘桥弯藻 Cymbella affinis 和谷皮菱形藻Nitzschia palea的现存量与总磷呈显著正相关, 能够指示水体中的磷浓度。
关键词 金沙江; 浮游藻类; 硅藻; 群落结构; 环境因子
浮游藻类是河流生态系统中的重要初级生产者, 处于水生态系统食物链的始端, 能够通过食物链影响底栖动物和鱼类等消费者, 是物质代谢和能量循环的基础, 其正常生长和繁殖能产生跨营养级的效应, 因而对水生生态系统的平衡和稳定有重要意义[1]。单细胞浮游藻类是淡水生物水质评估中常用的物种之一, 不同的藻类通常具有不同的栖息地偏好。它们个体较小, 对环境的变化响应迅速, 分布广泛, 结构稳定, 某些藻类只在特定的环境中出现, 因此可以作为指示生物[2]。目前, 运用硅藻指示种监测水质的污染情况在国外开展比较多, 主要用于监测水体的富营养化、酸化程度以及有机物污染等[3–4]。与其他藻类和底栖动物相比, 硅藻通常对环境变化更敏感[5]。
金沙江是长江上游河段, 与嘉陵江在宜宾交汇。对长江上游干流及支流浮游藻类的研究较多, 但集中在嘉陵江[6–9]和三峡库区[10–11]。金沙江下游河段对我国长江经济带及西南地区的生态建设、经济发展都具有重要意义, “西电东送”工程中, 溪洛渡、向家坝、白鹤滩和乌东德四大水电站均分布在这一江段[12]。本研究在金沙江下游石鼓–宜宾典型河段布设 6 个采样断面, 从现存量、多样性和优势种等方面较全面地分析浮游藻类群落特征以及环境因子和人为活动对浮游藻类的影响。
金沙江指长江上游直门达到四川省宜宾市这一河段, 全长 3481 km, 流域面积 50.2 万 km2, 约占长江流域面积的 26%, 水位落差可达 3000 m, 水力资源丰富。金沙江地处青藏高原东部和横断山脉区, 南至滇北高原、东至四川盆地西南边缘。流域内气候变化显著, 每年 5—10 月西风带北撤, 受海洋性季风的影响, 降水相对丰沛, 并自东南向西北逐渐减少[13]。金沙江流急坎陡, 河床陡峻, 流水侵蚀力强, 是长江中下游干流泥沙的主要来源[14]。
本研究以浮游藻类群落为研究对象, 参照长江水利委员会水文局布设的国家基本水文站, 在金沙江干流设置 6 个采样断面, 从左到右依次为石鼓、攀枝花、溪洛渡、屏山、向家坝和宜宾(图 1), 采样时间为 2014 年秋季(10 月), 一周内完成所有采样断面的同步集水。
藻类定性样品采用 25#浮游生物网在水体表层呈“∞”形来回缓慢拖动(网内不得有气泡)捞取, 约3~5 分钟, 加 4%福尔马林固定, 实验室采用 10×40倍显微镜观察, 进行种属鉴定。定量样品等比例混合后, 在现场用鲁哥试剂固定, 带回实验室静置沉淀 48 小时后, 虹吸浓缩至 30mL, 在显微镜下利用浮游生物计数框行格法进行分类计数, 鉴定标准主要参考《中国淡水藻类》[15]。采用 Bbe 荧光法对藻类进行快速检测, 利用不同藻类受到相同波长单位强度激光照射时发出的荧光强度不同的特性, 测定水样中硅藻、绿藻、蓝藻和隐藻的细胞密度。采用 YSI-85 水质分析仪现场测定水温(WT)、溶解氧(DO)和 pH 值, 总氮(TN)、总磷(TP)和 BOD5等环境指标按照《地表水和污水检测技术规范》(HJ/T—2002)校准测定。

图1 采样点分布
Fig. 1 Distribution map of sampling sites
依据下式计算水样中的藻类密度:
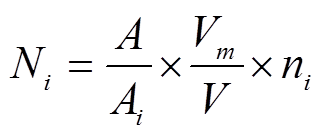 , (1)
, (1)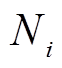 为每升水中第 i 种浮游硅藻的细胞数量(个/L), A为计数框的面积(400mm2),
为每升水中第 i 种浮游硅藻的细胞数量(个/L), A为计数框的面积(400mm2), 为计数面积(mm2),
为计数面积(mm2), 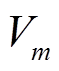 为 1L 水样经沉淀浓缩后的样品体积(30 mL), V为原样本水量(1L),
为 1L 水样经沉淀浓缩后的样品体积(30 mL), V为原样本水量(1L), 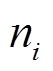 为每片计数得到的第 i 种硅藻的细胞数(个)。由于浮游藻类个体较小(尤其是绿藻和蓝藻), 难以直接称重, 因此根据浮游藻类的几何形状测量, 参照常见藻类细胞体积数据确定镜检藻种的实际体积, 最后按比重为 1 进行换算, 得到该藻种的生物量。
为每片计数得到的第 i 种硅藻的细胞数(个)。由于浮游藻类个体较小(尤其是绿藻和蓝藻), 难以直接称重, 因此根据浮游藻类的几何形状测量, 参照常见藻类细胞体积数据确定镜检藻种的实际体积, 最后按比重为 1 进行换算, 得到该藻种的生物量。
常用的物种多样性指数及其计算方式如下。
香农多样性指数(Shannon-Wiener index):
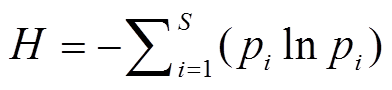 ; (2)
; (2)辛普森多样性指数(Simpson index):
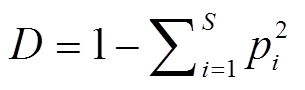 ; (3)
; (3)
玛格列夫丰富度指数(Marglef index):
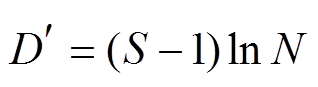 ; (4)
; (4)贝格–派克指数(Berger-Parker index):
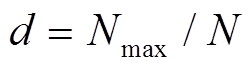 。 (5)
。 (5)
其中, pi为第 i个物种数量在全体物种数量中的比例, S 为物种总数目, N 为个体总数量, Nmax为优势种个体数量。
采用 SPSS18.0 及 R 语言软件对浮游藻类和环境因子数据进行 RDA 冗余分析和 Pearson 相关性分析, 采用 Origin2016 及 R 语言软件绘图。
通过定性和定量样本综合分析, 在金沙江 6 个站点检测出藻类 6 门 30 属 52 种, 其中包括硅藻 16 属 34 种, 占总物种数的 65.38%; 绿藻 6 属 9种, 占总物种数的17.30%; 甲藻 3 种, 占总物种数的 5.77%; 蓝藻和隐藻各 2 种, 各占总物种数的3.85%; 金藻仅有 1 种, 占总物种数的 1.92%; 祼藻仅有 1 种在定性样本中检出, 占物种数的 1.92%。由定量样本测定的浮游藻类物种组成及现在量见表 1。
通过定量样本分析, 得到浮游藻类在各站点的细胞密度和生物量分布, 如图2所示。
由图 2 可知, 金沙江石鼓–宜宾段的总藻细胞密度为 80×103~552×103个/L, 总藻生物量为 0.090~ 1.240 mg/L, 石鼓最高, 向家坝最低, 溪洛渡也较低, 略高于向家坝。从细胞密度来看, 优势藻种为硅藻中的小环藻、曲壳藻、尖针杆藻和等片藻, 分别占总细胞密度的平均比例为 23.96%, 22.46%, 5.25%和 3.49%; 隐藻中的尖尾蓝隐藻占 12.24%; 蓝藻中的颤藻占 4.57%; 绿藻中的网状空星藻占8.70%。由于不同藻类的细胞大小差异显著, 导致各物种的生物量大小排序与细胞密度不完全一致。从生物量来看, 优势藻种为硅藻中的曲壳藻、尖针杆藻、小环藻、近缘桥弯藻、谷皮菱形藻和异极藻, 分别占总生物量的平均比例为 20.61%, 12.84%, 11.58%, 8.71%和 4.08%; 隐藻中的尖尾蓝隐藻占7.99%, 甲藻中的薄甲藻占 3.75%; 蓝藻和绿藻细胞相对于硅藻和甲藻等细胞尺寸较小, 因此所占生物量比例都较低, 在 1%左右。
分别利用显微镜计数法与 Bbe 荧光法测定的硅藻、隐藻、绿藻和蓝藻细胞密度如图 3 所示。可以看出, 显微镜计数法与 Bbe 荧光法对硅藻的测定结果最接近, 在 6 个站点均有硅藻检出, 细胞密度测定值差异为 8%~57%; 隐藻次之, 在石鼓均未检出, 在其他 5 个站点均有检出, 在溪洛渡点显微镜记数法检出的隐藻更多, 在其他 4 个站点Bbe 检出的隐藻更多。两种方法对绿藻和蓝藻细胞密度的测定结果差异很大, 显微镜记数法仅在屏山点检出绿藻, 而 Bbe 荧光法在石鼓、攀枝花、向家坝和宜宾 4 个站点检出绿藻。除石鼓外, 其余站点的绿藻细胞密度都很小, 为 4×103~14×103个/L。同样地, 显微镜记数法仅在攀枝花点检出蓝藻, 且细胞密度仅为 160× 103个/L, Bbe 荧光法在 6 个站点均检出大量蓝藻, 细胞密度为 1299×103~3898×103个/L。
表1 金沙江典型河段浮游藻类组成
Table 1 Composition of phytoplankton of the typical section of Chin-sha River

门中文学名拉丁文名现存量 石鼓攀枝花溪洛渡屏山向家坝宜宾 硅藻长刺根管藻Rhizosolenia longiseta+ 扎卡四棘藻Attheya zachariasi+ 颗粒直链藻最窄变种Melosira granulata var. angustissima++ 模糊直链藻Melosira ambigua+ + 变异直链藻Melosira varians+ 小环藻Cyclotella sp.+++++++ ++ ++ 等片藻Diatoma sp.+++++ + 美丽星杆藻Asterionella formosa+ 钝脆杆藻Fragilaria capucina+ 肘状脆杆藻Fragilaria ulna+ 尖针杆藻Synedra acus+++ ++ + ++ 隐头舟形藻Navicula cryptocephala+ + + 放射舟形藻Navicula radiosa+ 异极藻Gomphonema spp.++ + + 窄异极藻Gomphonema angutatum + + 扁圆卵形藻Cocconeis placentula++ 曲壳藻Achnanthes sp.+++ +++ + ++ +++ 近缘桥弯藻Cymbella affinis++ 细小桥弯藻Cymbella pusilla++ 披针桥弯藻Cymbella delicatula+ —Cymbella minuta++ + 谷皮菱形藻Nitzschia palea+ + + 甲藻薄甲藻Glenodinium sp.+ 金藻分歧锥囊藻Dinobryon divergens+ 隐藻尖尾蓝隐藻Chroomonas acuta+ +++ ++ ++ + 卵形隐藻Cryptomonas ovata+ 蓝藻小席藻Phormidium tenue+++ 颤藻Oscillatoria sp.+++ 绿藻微小四角藻Tetraëdron minimum+ 网状空星藻Coelastrum reticulatum+++ 栅藻Scenedesmus sp.++
注: +表示存在, ++表示较多, +++表示很多(100个视野计数, 若统计到的细胞个数小于5则归为存在, 若为5~20则为较多, 若大于20则归为很多)。
各站点浮游藻类多样性指数如图 4 所示。可以看出, 在金沙江 6 个站点中, Shannon-Wiener, Simpson和 Marglef 指数的变化趋势较一致, 都在攀枝花达到峰值, 在溪洛渡和向家坝达到最低值。这 3 个指数的数值越高, 表明藻类群落多样性越高。Berger-Parker 指数侧重表示群落中优势种的作用, 在攀枝花达到最低, 变化趋势与其他 3 种指数不同。这一指数越高, 表示藻类群落中优势种的数目越多, 单一藻种所占比例越少, 而攀枝花检出的藻种总数较多, 因此优势属所占比例也较小。

图2 金沙江典型河段浮游藻类细胞密度和生物量
Fig. 2 Cell density and biomass of phytoplankton of the typical section of Chin-sha River
本研究中 6 个采样点的水温为 13.0~22.0℃, pH值为 8.27~8.40, 水体偏碱性, DO 为 1.2~2.4 mg/L, TN 为 0.69~1.76mg/L, TP 为 0.03~0.11mg/L, BOD5为 0.5~1.2mg/L, 水位为 264.2~1820.9m。通过 RDA冗余分析确定藻类群落受特定环境因子影响的规律, 结果如图 5 所示。
RDA 分析第一轴和第二轴分别解释了 39.93%和 26.41%的藻类群落差异, 共解释 66.34%的差异, 可见环境因子对金沙江典型河段浮游藻类群落的解释度相对较高。从图 5 可以看出, TN 对藻类群落结构影响最大(R2=0.893, p<0.01)。为了获得藻类种属与环境因子之间的关系, 选取细胞密度或生物量平均占比>1%的优势物种与环境因子进行相关性分析, 结果如图6所示。
由图 6 可知, 不同种的藻类对环境因子的响应有所不同。尖针杆藻、异极藻、等片藻、曲壳藻及两种桥弯藻的细胞密度与水位显著正相关, 与水温显著负相关。水位越高, 气温和水温就越低, 因此这些藻类可能适合在低温条件下生长。相反, 小环藻与水温正相关。近缘桥弯藻和谷皮菱形藻与总磷显著正相关, 对磷营养盐的响应更强; 小环藻、尖尾蓝隐藻及两种绿藻网状空星藻和栅藻则与总氮呈较显著的正相关关系, 对氮营养盐的响应更强。此外, 尖尾蓝隐藻和模糊直链藻都与 pH 显著正相关, 各藻类优势属对溶解氧和 BOD5 都没有明显的相关性。
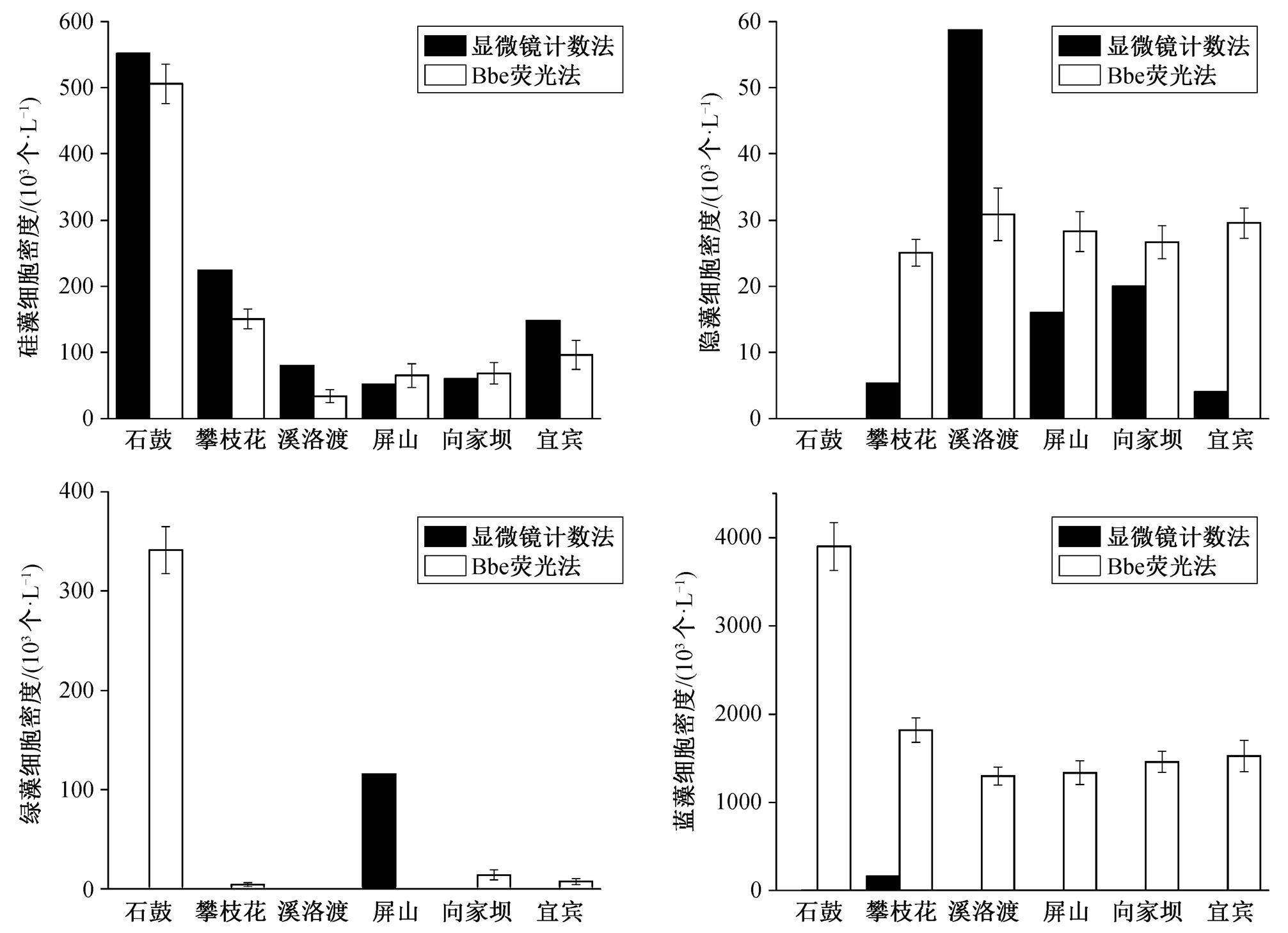
图3 显微镜计数法与Bbe荧光法对比
Fig. 3 Comparison of cell density measured by microscopy and Bbe fluorescence
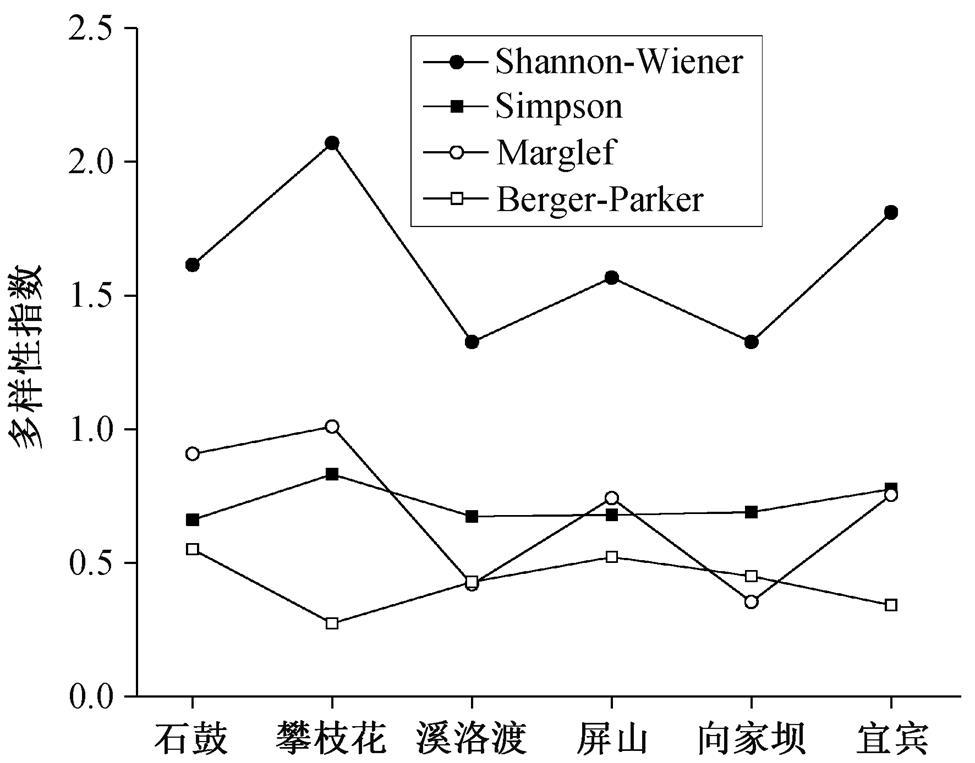
图4 金沙江典型河段浮游藻类多样性指数
Fig. 4 Diversity index of phytoplankton of the typical section of Chin-sha River
龚廷登等[16]对金沙江水富断面浮游植物进行研究, 发现藻类 127 种。余海英[17]对金沙江水富段进行调查, 发现浮游植物 201 种, 浮游植物的数量和生物量均表明金沙江水体呈贫营养型。刘佳等[18] 2009 年发现浮游植物 110 种。与之相比, 本次调查发现藻类 52 种, 种类相对较少。2010—2011 年金沙江水富段藻类平均生物量为 0.11mg/L, 藻类细胞平均密度为 31.4×103 个/L[16]。本研究发现 2014 年石鼓–宜宾段藻类平均生物量为 0.402mg/L, 细胞平均密度为 251×103 个/L, 远高于之前的研究结果。2010—2011 年的藻类群落中, 硅藻门种群密度和生物量最大[16], 占绝对优势, 其平均数量和平均生物量分别占浮游植物总平均数和总平均生物量的 75.83%和 73.81%, 与本研究的结果(74.07%和80.65%)一致。在所有已知调查结果中, 金沙江段的主要藻类优势类群相同, 均为硅藻。因此, 通过年际变化可知, 金沙江流域浮游植物的种类有所下降, 现存量有所上升, 但是群落格局未发生显著的变化。
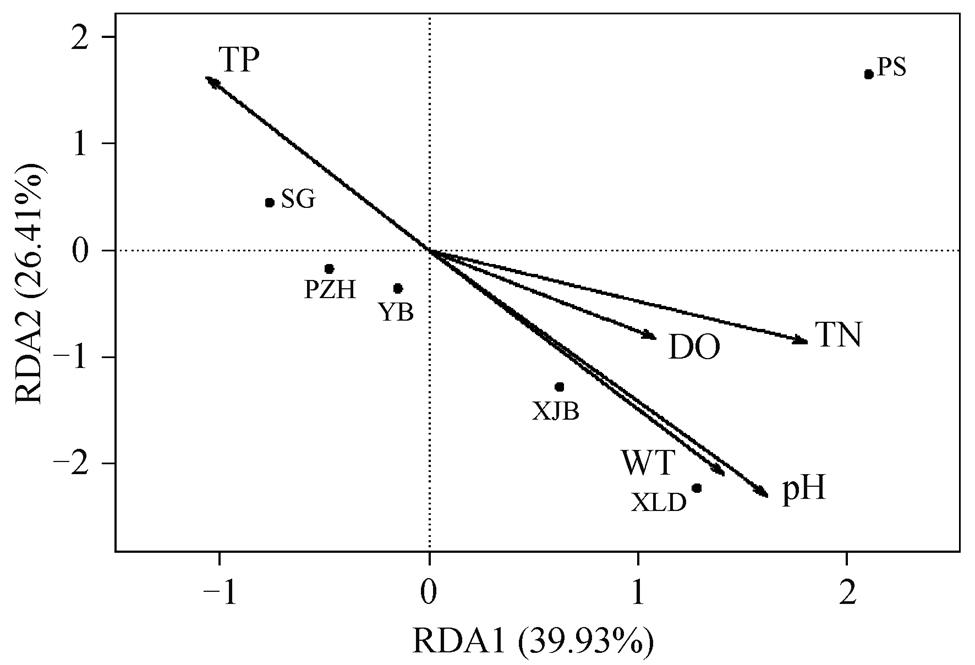
图5 浮游藻类群落与环境因子的RDA分析
Fig. 5 RDA analysis of phytoplankton community and environment factors

图6 藻类优势种细胞密度与环境因子相关性热图
Fig. 6 Correlation between dominant algae species and environment factors
Bbe 在线藻类分析仪可对微藻的叶绿素荧光物质进行持续不断地实时测量, 与湿化学叶绿素分析法和显微镜鉴定计数法相比, 这种测量方法能节约很多备样时间。荧光法是一种在自然环境中快速判断其叶绿素含量的测试方法, 对硅藻等细胞较大藻类的测定准确度很高, 并且更适合测定绿藻、蓝藻等细胞较小、不易观察的藻类。但是, 此方法只能得到硅藻、绿藻和蓝藻等门级别的总细胞密度, 无法得知藻类种属的信息, 适用于简单的藻类环境监测。目前, 藻类在线检测仪已应用于大型水源地的藻类调查[19]。
近年来, 浮游藻类群落结构一直是许多实验的研究对象, 特别是其在环境因子限制下的竞争与生长规律[20–22]。研究表明, 浮游硅藻的主要生长调节因子是湍流、小气候、温度、营养物质(硅、磷、氮和铁)和生物相互作用等[23], 浮游硅藻群落被认为在湍流期或在低光照、低温和非极度贫营养的水体环境中是特别好的竞争者[24]。在对金沙江硅藻2010—2011 年的历史研究中, 优势种属包括肘状针杆藻、等片藻、谷皮菱形藻、新月桥弯藻、中间异极藻、凸出舟形藻和克洛脆杆藻等[16], 但本研究发现小环藻、曲壳藻在细胞密度和生物量两方面都在硅藻中占据优势地位, 说明金沙江的硅藻群落中发生了优势物种的演替变化。
温度是藻类生长和光合作用等生命活动的重要影响因素[25–26], 并且水温对气温响应迅速, 因此在海拔较高、气温较低的高原地区生长的藻类大多能在低温条件下生长[27], 本研究中尖针杆藻、异极藻、等片藻、曲壳藻、细小桥弯藻和披针桥弯藻与温度负相关。然而, 小环藻与水温显著正相关(R2= 0.838, p<0.05)。研究表明, 小环藻 Cyclotella rososs, Cyclotella tripartita 和 Cyclotella bodanica var. 适合在 18~21℃生长[28]。因此, 在秋季金沙江下游水温较高、营养较为充足的水环境中, 小环藻更易大量繁殖, 占据群落优势。
pH 值反映水体的酸碱度, 常常影响浮游藻类的群落结构及分布规律[29–30]。王珺等[31]发现在 pH为 8.5 的条件下, 直链藻细胞密度出现最大值, Liu等[32]也发现在大型水库中尖尾蓝隐藻与 pH 正相关, 与本文的研究结果一致。但是, 也有研究认为藻类对水体 pH 有较强的缓冲能力, 因而初始pH不同对藻类生长的影响不明显[33]。
溶解氧可以改变河流中的养分状态, 因此对藻类有一定的影响[34]。夏季温度较高, 水体中的溶解氧含降低, 且藻类的大量繁殖也会加剧溶解氧不足的情况; 冬季气温较低, 且生物活动减缓, 水体中的溶解氧相对较高。向蓉等[35]对汝溪河浮游硅藻功能群特征的研究表明, 在枯水期, 菱形藻属和针杆藻属与溶解氧呈正相关关系, 因此在枯水期水体溶解氧较高的条件下形成优势类群。本研究中各优势种属与溶解氧都没有显著的相关关系, 说明在金沙江石鼓–宜宾段, 秋季水体溶解氧对大多数藻类的生长没有显著影响。
氮磷营养盐会影响藻类群落的构建, 在浮游植物营养盐动力学的研究中, 应用最广的是 Redfield比例, 即藻类对营养物质的吸收基本上按照 C:N:P =106:16:1 的化学计量比[36]。在淡水中, N/P 比通常高于 16:1, 显示为 P 限制的情况更多[37]。金沙江石鼓–宜宾段氮磷比在石鼓和宜宾分别为 6.3 和 13.9, 低于 Redfield 比, 其他 4 个站点都高于此值。研究表明, 硅藻的丰富度和物种组成沿着氮磷等营养元素的浓度梯度在河流中分布[38]。Winter 等[39]用硅藻作为河流总氮、总磷浓度的指示生物。在意大利的 Picentino 河, 在河流受富营养化以及有机污染的河段, 对营养及有机污染高度敏感的敏感种类消失[40]。本研究发现小环藻与 TN 显著正相关, 有研究表明小环藻能很好地指示长江中下游湖泊富营养化的发生[41], 在丹麦、瑞典、德国等国家的一些富营养和重富营养化湖泊中以优势种群出现[42–43]。近缘桥弯藻和谷皮菱形藻与总磷呈显著的正相关关系, 这两种硅藻适合生活在经常性搅动的浑浊浅水中。近缘桥弯藻是低营养浓度下的敏感物种[44], 在巴西的 Gravataí 河里, 谷皮菱形藻能指示水体的有机污染和富营养化[38]。徐婷婷等[45]通过实验研究氮磷对谷皮菱形藻的影响, 发现增加磷含量有助于该藻生长, 其效果有一定的限度, 最适磷浓度为0.5 mg/L。
浮游藻类数量与空间分布不仅受到水温、pH 和营养盐等的限制, 可能还受到水文条件的影响。大坝对浮游藻类的影响显著, 王柱[46]的研究表明, 三峡首次实验性蓄水引起嘉陵江出口段总藻密度下降, 优势藻种增加。彭成荣等[47]研究三峡大坝拦蓄洪水的过程对藻类群落的影响, 表明洪水调度所营造的动态水位使得靠近大坝的支流生境受到强烈冲击和破坏, 导致藻类种类和生物量的降低。本研究中溪洛渡和向家坝两个采样点的藻类细胞密度分别为 149×103 和 80×103个/L, 生物量分别为 0.119 和0.090 mg/L, 均低于其他站点, 藻类 Shannon 多样性指数、Simpson 多样性指数和 Marglef 多样性指数也相对较低, 可见不论从数量还是结构稳定性上, 大坝对浮游植物群落都有不利影响。
2014 年秋季, 在金沙江石鼓–宜宾典型河段 6个站点检测出藻类 6 门 30 属 52 种, 硅藻占据群落优势。从细胞密度来看, 优势藻种为小环藻、曲壳藻、尖针杆藻、等片藻、尖尾蓝隐藻、颤藻及网状空星藻; 从生物量来看, 优势藻种为硅藻中的曲壳藻、尖针杆藻、小环藻、近缘桥弯藻、谷皮菱形藻、异极藻、尖尾蓝隐藻及薄甲藻。
通过显微镜计数法测定藻类细胞密度, 结果为硅藻>蓝藻>绿藻>隐藻,Bbe 荧光法测定结果为蓝藻>硅藻>绿藻>隐藻, 两种方法对硅藻的测定结果最接近, 对蓝藻和绿藻的测定结果差异较大。
整体上看, 总氮对浮游藻类群落结构的影响较大。不同优势种的藻类对环境因子的响应不同, 尖针杆藻、异极藻、等片藻、曲壳藻和两种桥弯藻与水位正相关, 与水温负相关, 小环藻则与水温正相关。尖尾蓝隐藻和模糊直链藻与 pH 正相关。小环藻、尖尾蓝隐藻、网状空星藻和栅藻与总氮正相关, 近缘桥弯藻和谷皮菱形藻与总磷正相关, 能够指示水体的营养状况。
大坝对浮游藻类的现存量和群落多样性都有不利影响, 人为活动对浮游藻类的干扰较明显。
参考文献
[1]Field B, Behrenfeld J, Randerson T, et al. Primary production of the biosphere: integrating terrestrial and oceanic components. Science, 1998, 281: 237–240
[2]Feio J, Almeida P, Craveiro C, et al. A comparison between biotic indices and predictive models in stream water quality assessment based on benthic dia-tom communities. Ecological Indicators, 2009, 9(3): 497–507
[3]Gevrey M, Rimet F, Park S, et al. Water quality assessment using diatom assemblages and advanced modelling techniques. Freshwater Biology, 2004, 49 (2): 208–220
[4]Tan Xiang, Zhang Quanfa, Burford A, et al. Benthic diatom based indices for water quality assessment in two subtropical streams. Frontiers in Microbiology, 2017, 8: 1–10
[5]Stevenson J. An introduction to algal ecology in freshwater benthic habitats. Amsterdam: Elsevier, 1996
[6]张智, 宋丽娟, 郭蔚华. 重庆长江嘉陵江交汇段浮游藻类组成及变化. 中国环境科学, 2005, 25(6): 695–699
[7]曾婷. 重庆长江嘉陵江浮游藻类分布特征及水质状况研究[D]. 重庆: 重庆大学, 2008
[8]郭蔚华, 侯亚芹, 龙天渝, 等. 嘉陵江出口段藻类生长与氮磷相关性分析. 土木建筑与环境工程, 2008, 30(4): 125–128
[9]马永红, 曾燏, 任丽萍, 等. 嘉陵江四川段藻类植物群落结构及水质评价. 应用生态学报, 2012, 23 (9): 2573–2579
[10]周广杰, 况琪军, 胡征宇, 等. 三峡库区四条支流藻类多样性评价及“水华”防治. 中国环境科学, 2006, 26(3): 337–341
[11]龙天渝, 刘腊美, 郭蔚华, 等. 流量对三峡库区嘉陵江重庆主城段藻类生长的影响. 环境科学研究, 2008, 21(4): 104–108
[12]刘刚, 沈镭, 孙尚志, 等. 金沙江下游梯级电站开发影响区域的资源开发与产业可持续发展. 长江流域资源与环境, 2007, 16(5): 565–570
[13]莫逸群. 金沙江概况. 人民长江, 1983(5): 72–74
[14]潘久根. 金沙江流域的河流泥沙输移特性. 泥沙研究, 1999(2): 46–49
[15]胡鸿钧, 魏印心. 中国淡水藻类. 北京: 科学出版社, 2006
[16]龚廷登, 杨伟阶, 何滔, 等. 金沙江水富段水生生物的群落结构及水质监测. 淡水渔业, 2014, 44(4): 25–34
[17]余海英. 长江上游珍稀、特有鱼类国家级自然保护区浮游植物和浮游动物种类分布和数量研究[D]. 重庆: 西南大学, 2008
[18]刘佳, 徐亮, 张秋劲, 等. 四川省水体富营养状况时空分布调查. 中国环境监测, 2012, 28(5): 6–8
[19]裘一鸣, 王静雅. 藻类在线监测仪的应用. 净水技术, 2017, 36(2): 7–9
[20]孙慧慧, 刘西汉, 孙西艳, 等. 莱州湾浮游植物群落结构与环境因子的时空变化特征研究. 海洋环境科学, 2017, 36(5): 662–669
[21]胡俊, 郑金秀, 池仕运, 等. 苏皖交界河网区浮游植物群落结构及其与环境因子关系的研究. 长江流域资源与环境, 2017, 26(2): 282–288
[22]胡忠军, 莫丹玫, 周小玉, 等. 千岛湖浮游植物群落结构时空分布及其与环境因子的关系. 水生态学杂志, 2017, 38(5): 46–54
[23]Malviya S, Scalco E, Audic S, et al. Insights into global diatom distribution and diversity in the world’s ocean. Proceedings of the National Academy of Sci-ences of the United States of America, 2016, 113(11): 1516–1525
[24]Kireta R, Reavie D, Sgro V, et al. Planktonic and periphytic diatoms as indicators of stress on great rivers of the United States: testing water quality and disturbance models. Ecological Indicators, 2012, 13 (1): 222–231
[25]张曼, 曾波, 张怡, 等. 温度变化对藻类光合电子传递与光合放氧关系的影响. 生态学报, 2010, 30 (24): 7087–7091
[26]胡正峰, 张磊, 邱勤, 等. 温度条件对澎溪河藻类生长的影响. 江苏农业科学, 2010(2): 384–386
[27]裴国凤, 刘国祥, 胡征宇. 云南高原湖泊沿岸带底栖藻类群落的分布. 植物科学学报, 2008, 26(4): 373–378
[28]Pienitz R, Smol P, Birks B. Assessment of freshwater diatoms as quantitative indicators of past climatic change in the Yukon and Northwest Territories, Ca-nada. Journal of Paleolimnology, 1995, 13(1): 21–49
[29]汪星, 李利强, 郑丙辉, 等. 洞庭湖浮游藻类功能群的组成特征及其影响因素研究. 中国环境科学, 2016, 36(12): 3766–3776
[30]邢爽, 巴秋爽, 杨晓清, 等. 夏季挠力河国家级自然保护区水体中藻类群落结构及其影响因素研究. 湿地科学, 2017, 15(4): 546–551
[31]王珺, 邢诒炫, 陈国华, 等. 不同生态因子对直链藻生长的影响. 热带生物学报, 2010, 1(3): 220–223
[32]Liu Hongbo, Li Yanhua, Leng Feng, et al. Stage Variation of phytoplankton and environmental factors in a large drinking water reservoir: from construction to full operation. Water Air & Soil Pollution, 2016, 227(9): 352–357
[33]许海, 刘兆普, 袁兰, 等. pH 对几种淡水藻类生长的影响. 环境科学与技术, 2009, 32(1): 27–30
[34]王小艺, 唐丽娜, 刘载文, 等. 城市湖库蓝藻水华形成机理. 化工学报, 2012, 63(5): 1492–1497
[35]向蓉, 李巧玉, 喻燚, 等. 汝溪河浮游硅藻功能群特征及其与环境因子相关性分析. 环境科学, 2017, 38(8): 3290–3301
[36]Plaxton C, Lambers H. Annual Plant reviews volume 48: phosphorus metabolism in plants. New York: John Wiley and Sons, 2015
[37]Peñuelas J, Poulter B, Sardans J, et al. Human-induced nitrogen-phosphorus imbalances alter natural and managed ecosystems across the globe. Nature Communications, 2013, 4(1): 2934–2944
[38]Salomoni E, Rocha O, Callegaro L, et al. Epilithic diatoms as indicators of water quality in the Gravataí River, Rio Grande do Sul, Brazil. Hydrobiologia, 2006, 559(1): 233–246
[39]Winter G, Duthie C. Epilithic diatoms as indicators of stream total N and total P concentration. Journal of the North American Benthological Society, 2000, 19 (1): 32–49
[40]Giorgio A, Bonis D, Guida M. Macroinvertebrate and diatom communities as indicators for the biological assessment of river Picentino (Campania, Italy). Ecological Indicators, 2016, 64: 85–91
[41]Dong Xuhui, Yang Xiangdong, Wang Rong. Diatom indicative species of eutrophication of the lakes in the middle and lower reach regions of Yangtze River. China Environmental Science, 2006, 26(5): 570–574
[42]Bradshaw G, Anderson J. Validation of a diatom-phosphorus calibration set for Sweden. Freshwater Biology, 2001, 46(8): 1035–1048
[43]Schönfelder I, Gelbrecht J, Schönfelder J, et al. Relationships between littoral diatoms and their che-mical environment in northeastern German lakes and rivers. Journal of Phycology, 2002, 38(1): 66–89
[44]Femmer R. Algal community characteristics and res-ponse to nitrogen and phosphorus concentrations in streams in the Ozark Plateaus, Southern Missouri, 1993-95 and 2006-07. American Journal of Medical Genetics, 2011, 78(2): 155–159
[45]徐婷婷, 路建周, 靳萍, 等. 温度、光照和氮磷浓度对谷皮菱形藻生长的影响. 淡水渔业, 2014, 44 (3): 39–44
[46]王柱. 三峡大坝蓄水对春季嘉陵江出口段藻类的影响[D]. 重庆: 重庆大学, 2010
[47]彭成荣, 陈磊, 毕永红, 等. 三峡水库洪水调度对香溪河藻类群落结构的影响. 中国环境科学, 2014, 34(7): 1863–1871
Community Structure Characteristics of Phytoplankton and Their Relationship with Environmental Factors in the Typical Section of Chin-sha River
Abstract To study the community structure characteristics and main influencing environment factors of phytoplankton in the Shigu-Yibin section of Chin-sha River, six sites were set up in the autumn of 2014 to monitor planktonic algae communities. A total of 52 species of 6 phyla, 30 genera of algae were identified through microscopy. Diatoms were dominant species, which accounted for 65.38%, 74.07%, and 80.65% by species numbers, cell density, and biomass respectively. The total algal density and biomass of phytoplankton decreased at the dam and gradually increased under the dam. They were the highest in Shigu and the lowest in Xiangjiaba. The diversity of phytoplankton communities in Panzhihua was the highest, and that of Xiluodu and Xiangjiaba were much lower. The redundancy analysis (RDA) showed that total nitrogen was the main factor affecting the phytoplankton community structure. The correlation between the dominant species and the environmental factors showed that six diatoms, including Synedra acus and Achnanthes sp., were positively correlated with water level and negatively correlated with water temperature, indicating that they were suitable for low temperatures, while Cyclotella sp. was suitable for growing at high temperature. Coelastrum reticulatum, Scenedesmus sp., Chroomonas acuta and Cyclotella sp.werepositively correlated with total nitrogen, while Cymbella Affinis and Nitzschia palea were positively correlated with total phosphorus, which demonstrated that they could indicate corresponding nutrients in water.
Key words Chin-sha River; phytoplankton; diatom; community structure; environmental factors
国家重点研发计划(2016YFC0402102)资助
收稿日期: 2018–04–20;
修回日期: 2018–05–21;
doi: 10.13209/j.0479-8023.2019.022
网络出版日期: 2019–05–10