水库底泥氮释放及其好氧微生物脱氮研究
谢民争1,2 陈倩2,† 党晨原2 潘柏岳2 安芮2 吴哲3 周明3
1.深圳市重金属污染控制与资源化重点实验室, 北京大学深圳研究生院环境与能源学院, 深圳 518055; 2.北京市新型污水深度处理工程技术研究中心, 北京大学环境工程系, 北京 100871; 3.长江水利委员会水文局汉江水文水资源勘测局, 襄阳 441022
摘要 以丹江口水库为例, 考察水库底泥在不同温度、扰动和曝气等条件下, 总氮、硝氮、氨氮和亚硝氮的释放规律。设置模拟反应器, 探究高效好氧脱氮微生物强化消除水库底泥内源氮污染的效果, 并运用高通量测序技术, 分析高效好氧脱氮微生物对底泥微生物群落结构的影响。结果表明, 温度升高会减少氨氮的释放, 增加硝氮和亚硝氮的积累; 水体扰动会加速底泥中氮素释放, 且上覆水中的氮素释放累积量与扰动速度成正比; 溶解氧对底泥氮素释放有显著影响, 曝气处理可以明显地降低底泥中总氮和硝氮的释放及其在水体中的累积。在反应器中底泥–上覆水界面投加高效好氧脱氮微生物 Pseudomonas stutzeri(PCN-1)后, 反应器内各种形态的氮素都出现先上升、后下降的趋势; 在反应器运行的第 65 天, 底泥释放的总氮和硝氮的去除率分别高达 75.87%和 79.96%, 底泥内源氮污染得到有效的控制。对比投加菌株前后的微生物群落结构, 发现底泥中Proteobacteria, Bacteroidetes 和 Spirochaetes的相对丰度明显增加, PCN-1 强化脱氮处理能够改变底泥的微生物群落结构。
关键词 内源氮污染; 底泥氮释放; 理化因素; 微生物强化; 高效脱氮
水库是重要的淡水来源, 也是我国主要的饮用水水源地, 在 2016 年《全国重要饮用水水源地名录》公布的 618 个各类型水源地中, 水库型水源地有 270 个, 占全部重要饮用水源地的 43.7%。底泥是水库污染物的主要蓄积场所和水生生态系统中的重要组成部分, 在整个水体系统的物质循环过程中既充当“汇”的角色, 也充当“源”的角色。近年来, 随着输入型外源污染(点源和面源)逐渐得到控制, 底泥中氮、磷等营养盐的释放成为水库水质恶化的主要原因[1–4]。然而, 对大多数水库而言, 水体总氮超标引起的水体富营养化现象普遍存在[5–8]。学者们对河流和湖泊的高浓度营养盐释放规律和机理已进行大量的研究[9–14], 通过考察 pH、温度、曝气和扰动等因素, 研究底泥氮、磷等营养盐的释放通量及释放速率, 但对营养盐浓度低的水库鲜有涉及。
目前, 针对底泥内源污染的原位控制技术主要包括物理控制技术、化学控制技术和生物修复技术。物理控制技术工程量大, 成本高, 容易造成二次污染等问题[15]。化学控制技术虽然耗能低, 投资小, 但化学药剂的投加可能引起二次污染和其他污染物异常释放[16]。生物修复技术具有清洁、投资少、修复效果可持续性好等优点, 备受关注[17]。生物修复技术利用生物体(主要是微生物的代谢活动)来降解污染物, 使环境中污染物的毒性降低或消除。对于微污染水库的修复, 研究者们常采用原位微生物修复技术, 即通过加入微生物所需营养物质来提高生物活性, 或添加实验室培养的有特殊亲和力的微生物来加快环境修复[15]。
本研究以丹江口水库为例, 研究底泥释放特征和规律, 阐明不同环境条件下底泥中氮素的释放量和赋存状态, 为后续微生物修复技术的选取提供基础数据。在此基础上, 选取合适的微生物菌种, 通过反应器模拟实验, 研究微生物强化对底泥内源氮污染的修复效果; 基于高通量测序的方法, 探究菌种投加对反应器底泥中微生物群落结构的影响。
1 材料与方法
1.1 样品采集与处理
本研究所用的沉积物样品取自丹江口水库白渡滩村断面(32°53′55′N, 111°30′40′E), 于 2016 年 7 月对采样点的底泥及上覆水进行现场监测和采集。样品采集完毕后, 对其进行密封和避光处理, 运回实验室, 置于 4℃冰箱内保存。底泥经均化处理后, 用于理化性质的分析和后续实验。上覆水水样经0.45μm 滤膜过滤后, 直接测定其理化指标。上覆水和底泥的基本理化性质如表 1 所示。
1.2 实验方法
在底泥氮素释放的实验中, 向 500mL 棕色广口瓶中加入约 125mL 均化好的底泥样品和 375mL 上覆水水样(泥水比为 1:3), 按照表 2 的模拟条件开展实验。通过封口膜密封反应瓶、充分曝气和不做处理来模拟低溶解氧、高溶解氧和自然状态 3 种实验条件。每隔 24 小时用注射器采集 15mL 水样, 用于总氮、硝氮、氨氮和亚硝氮的测定。每组实验设置两个平行样。
表1 上覆水和底泥的基本理化性质
Table 1 Basic physicochemical properties of overlying water and sediments
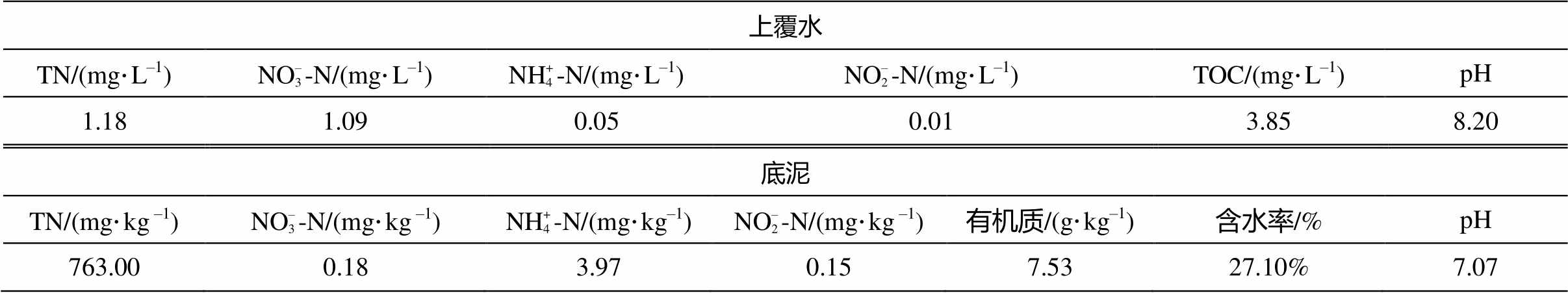
上覆水 TN/(mg·L–1)NO– 3-N/(mg·L–1) NH+ 4-N/(mg·L–1)NO– 2-N/(mg·L–1) TOC/(mg·L–1) pH 1.181.090.050.013.858.20 底泥 TN/(mg·kg –1)NO– 3-N/(mg·kg –1)NH+ 4-N/(mg·kg–1)NO– 2-N/(mg·kg –1)有机质/(g·kg–1)含水率/%pH 763.000.183.970.157.5327.10%7.07
表2 底泥氮素释放室内模拟实验设计
Table 2 Simulated experiments on nitrogen release from sediments
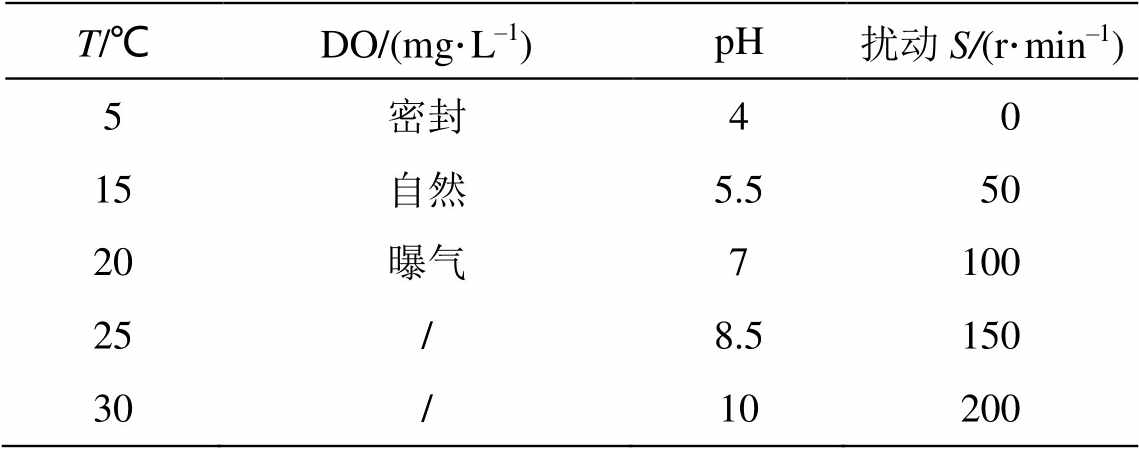
T/℃DO/(mg·L–1)pH扰动S/(r·min–1) 5密封40 15自然5.550 20曝气7100 25/8.5150 30/10200
在高效脱氮微生物强化消除内源氮污染的实验中, 以体积为 12L 的有机玻璃柱为反应装置, 反应系统不密封, 装置高 400mm, 内径为 100mm(图 1)。将混合均匀的底泥平铺于反应器底部, 底泥厚度约为 100mm, 用虹吸法向反应器中注入深度约为 300mm的上覆水水样(约 9L), 反应器的运行条件依据氮素释放规律的实验结果确定。实验开始时, 在反应器底泥–水界面投加好氧反硝化菌 PCN-1, 投加量约为 168mg/kg 底泥, 在反应器的底泥–水界面处设置取样口, 每天取 50mL 水样, 用于总氮、硝氮、氨氮、亚硝氮和总有机碳(TOC)等指标的测定, 同时测定反应器中 pH 和溶解氧(DO)的值。反应器连续运行 65 天, 在实验开始(0d, 记为 R0)和强化稳定(33d, 记为 R33)两个时间点各取一组泥样, 置于–20℃保存, 以备微生物总 DNA 的提取。
1.3 分析方法
按照国家标准方法 HJ634—2012, HJ668—2013和 HJ666—2013, 使用采样流动注射分析仪(SAN++8505, SKALAR, 荷兰)测定水样和泥样中的硝氮、氨氮、亚硝氮以及水样中的总氮。使用凯氏定氮仪(K9860, 海能仪器, 中国)测定泥样中的总氮, 采用重铬酸钾容量法测定泥样中的有机质。使用总有机分析仪(TOC-V CPN, Shimadzu, 日本)测定水样的TOC。
采用土壤 DNA 快速提取试剂盒(Fast DNA® Spin Kit for Soil, MP, 美国)提取底泥样品中的DNA, 并对提取好 DNA 模板的 16SrRNA 的 V3-V4 区进行扩增, 引物为 338F (ACTCCTACGGGAGG CAGCAG)和 806R (GGACTACHVGGGTWTCTAAT), 扩增条件为: 95℃预变性 2min; 95℃变性 30s, 53℃退火 20s, 72℃延伸 60s, 共进行 30 个循环; 72℃延伸 5min。经过琼脂糖凝胶电泳成像确认后, 将PCR 产物送至上海美吉生物科技有限公司, 利用Illumina Miseq 平台进行测序, 参考 Liu 等[18]的方法, 并对下机原始数据进行质量控制、序列拼接和OTU (operational taxonomic unit)聚类, 将 OTU 代表序列与GreenGenes 16S rRNA Bacteria (13.5)数据库进行比对, 获得物种信息。
1.4 底泥氮化合物的累积释放通量计算
底泥氮化合物的累积释放通量计算公式如下:
式中, 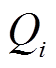 表示第 i 次取样时底泥氮化合物的释放累积量(mg/dm2), V表示每次采样体积(L), Ci 表示第 i次取样时营养物的浓度(mg/L), Vi 表示第 i次取样时反应装置中剩余水样的体积(L), A 表示反应瓶的横截面积(dm2)。
表示第 i 次取样时底泥氮化合物的释放累积量(mg/dm2), V表示每次采样体积(L), Ci 表示第 i次取样时营养物的浓度(mg/L), Vi 表示第 i次取样时反应装置中剩余水样的体积(L), A 表示反应瓶的横截面积(dm2)。
2 结果与讨论
2.1 不同理化因素对底泥氮素释放的影响
2.1.1温度对底泥氮素释放的影响
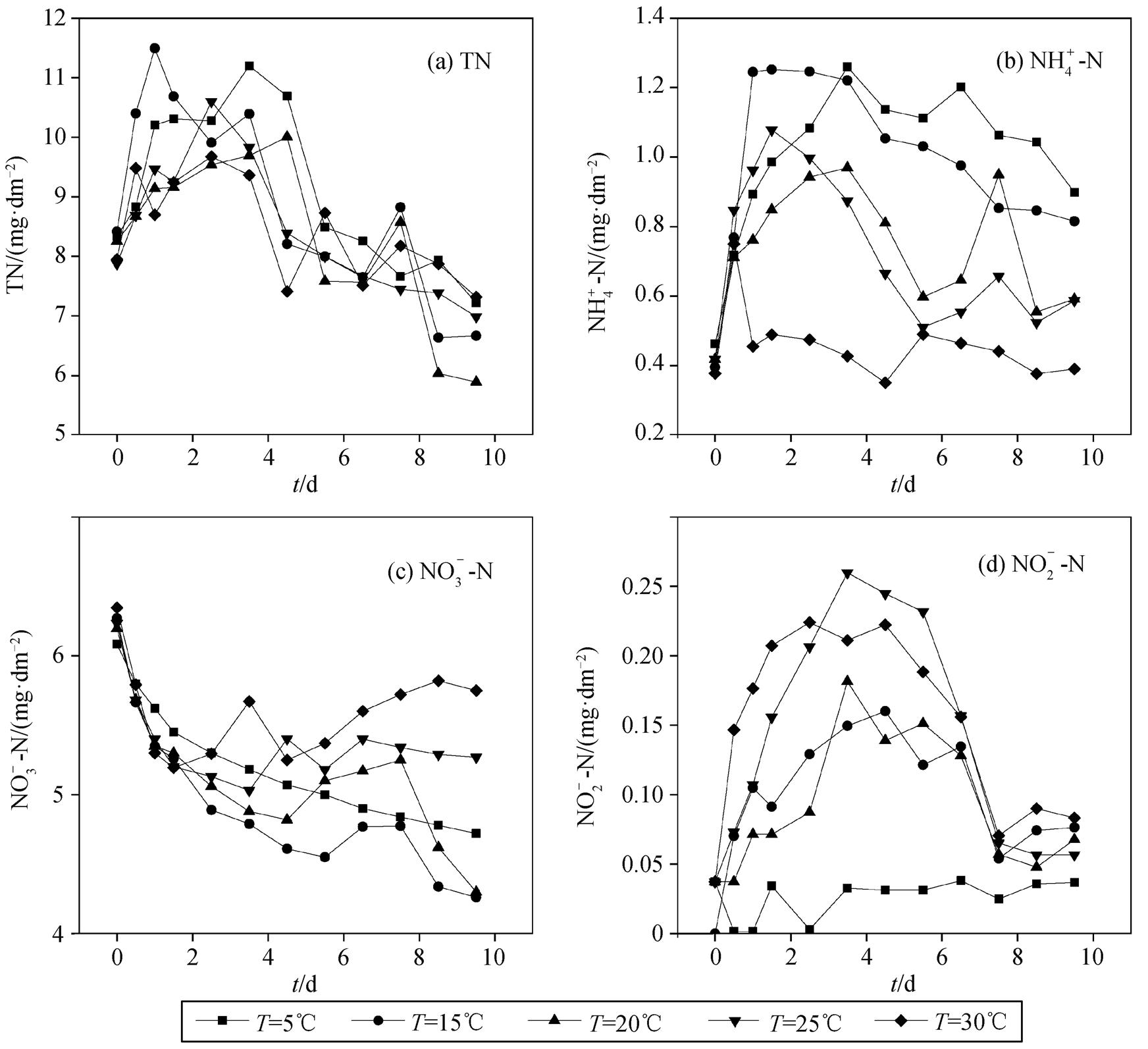
本实验研究了 5 种温度条件下底泥氮素的释放累积过程(图 2)。从图 2 可以看出, 温度对底泥氮素释放总量的影响不大, 但对氮素形态的影响较显著。随着温度升高, 底泥中硝氮的释放累积量不断增加, 在 30℃条件下硝氮累积量达到最高, 实验结束时累积量是 15℃条件下的 2.08 倍。与硝氮的累积过程不同, 氨氮的累积与温度成反比。当温度为30℃时, 氨氮基本上维持初始水平; 当温度为 5℃时, 氨氮的最大累积量可达 1.30 mg/dm2。图 2(d)表明当温度为 5℃时, 亚硝氮的释放基本上被抑制; 当温度为 25℃时, 亚硝氮累积量最高。
底泥–水界面主要以氨氮和硝氮的形态释放氮素[19]。硝氮的累积是底泥释放、硝化和反硝化共同作用达到动态平衡的过程[20]。一方面, 提高温度会促使底泥中微生物矿化活动更活跃, 增加氮素向水体中扩散的能力; 另一方面, 温度升高会提高硝化细菌的活性, 增加硝化反应速率, 加快氨氮向硝氮的转化[21]。在 30℃时, 上覆水中氨氮的积累量最少, 可能是由于此时硝化作用较强, 大部分氨氮快速转化为硝氮; 在 5℃条件下, 微生物活动微弱, 底泥释放的氨氮被细菌消耗的速率慢, 导致其积累量增加。余荣台[22]在研究赣江城市河段的沉积物释放氮素规律时也发现, 随着温度升高, 氨氮向硝氮的转化速度加快。因此, 提高温度会促进底泥中硝氮的积累, 但会减少氨氮的释放。
2.1.2扰动对底泥氮素释放的影响
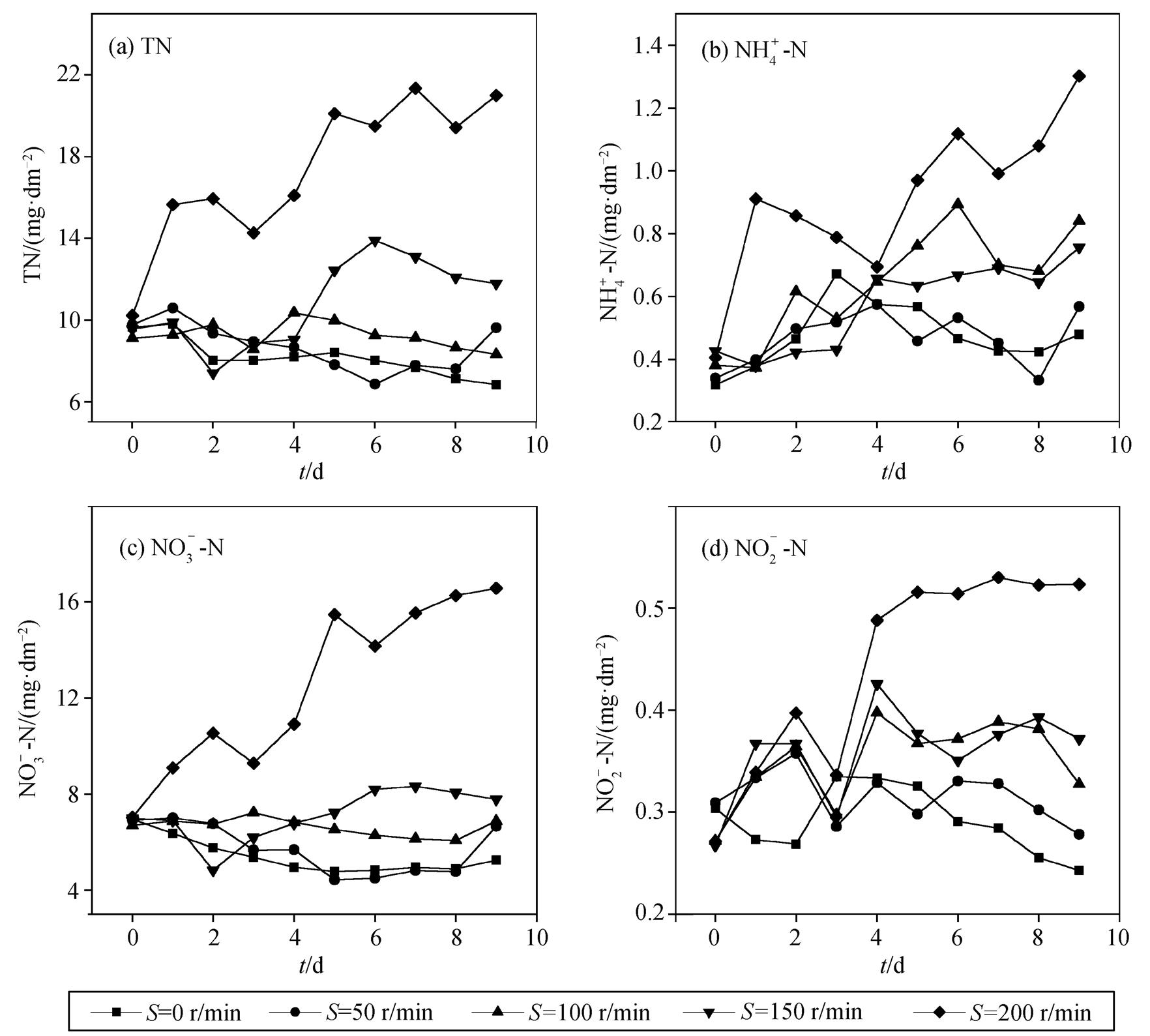
图 3 为不同搅拌速度造成的扰动对底泥氮素释放过程的影响。由图 3 可知, 不同程度的扰动条件下底泥氮素释放规律基本上一致, 氮素累积量与搅拌速度成正比。在不同扰动条件下, 氮素释放累积量均表现为高速(200 r/min)>中速(100, 150 r/min)>低速(0, 50 r/min)。实验结束时, 总氮、硝氮、氨氮和亚硝氮的最大累积量分别是最低累积量的 3.1, 3.2, 2.7 和 2.2 倍。高速搅拌对底泥氮素释放影响最显著, 随着实验进行, 各氮素总体上都呈上升趋势; 中速搅拌对底泥氮素积累影响远低于高速搅拌, 底泥中氮素释放累积量较少; 低速搅拌对底泥氮素释放的影响不大, 其氮素的释放规律与水体静置时相似。
研究表明, 扰动可通过改变水–泥界面环境来影响底泥中污染物的释放。一方面, 搅动促使底泥再悬浮, 增加污染物在水–泥界面的传质速率, 同时也加速底泥间隙水中的高浓度污染物扩散到上覆水中。另一方面, 扰动可以提高水体中的溶解氧, 从而提高硝化细菌的活性, 促进硝氮的累积[22]。在实验启动的前两天, 泥–水界面中的氮素浓度差对底泥氮素释放起主要作用, 随着实验的进行, 扰动通过上述两种方式的共同作用促使氮素的持续累积。在实验后期, 总氮和硝氮分别在 20 和 16mg/dm2 左右波动, 这可能是底泥和悬浮物中的氮素向上覆水的释放与上覆水中的氮素向底泥和悬浮物的沉积和吸附达到动态平衡, 氮素释放达到饱和状态[23]。姜永生等[24]和代政等[25]研究扰动对湖泊水库沉积物中营养盐释放的影响时发现, 扰动促使上覆水中氮素浓度增加 54.4%~230.8%, 本研究中总氮浓度增加105.5%, 与文献[24–25]的结论基本上一致。综上所述, 扰动有利于底泥中氮素释放且其释放累积量与搅拌速度成正比, 这可能是在雨季水体交换速率大时, 水库水体中氮素浓度较高的原因之一。
2.1.3溶解氧对底泥氮素释放的影响
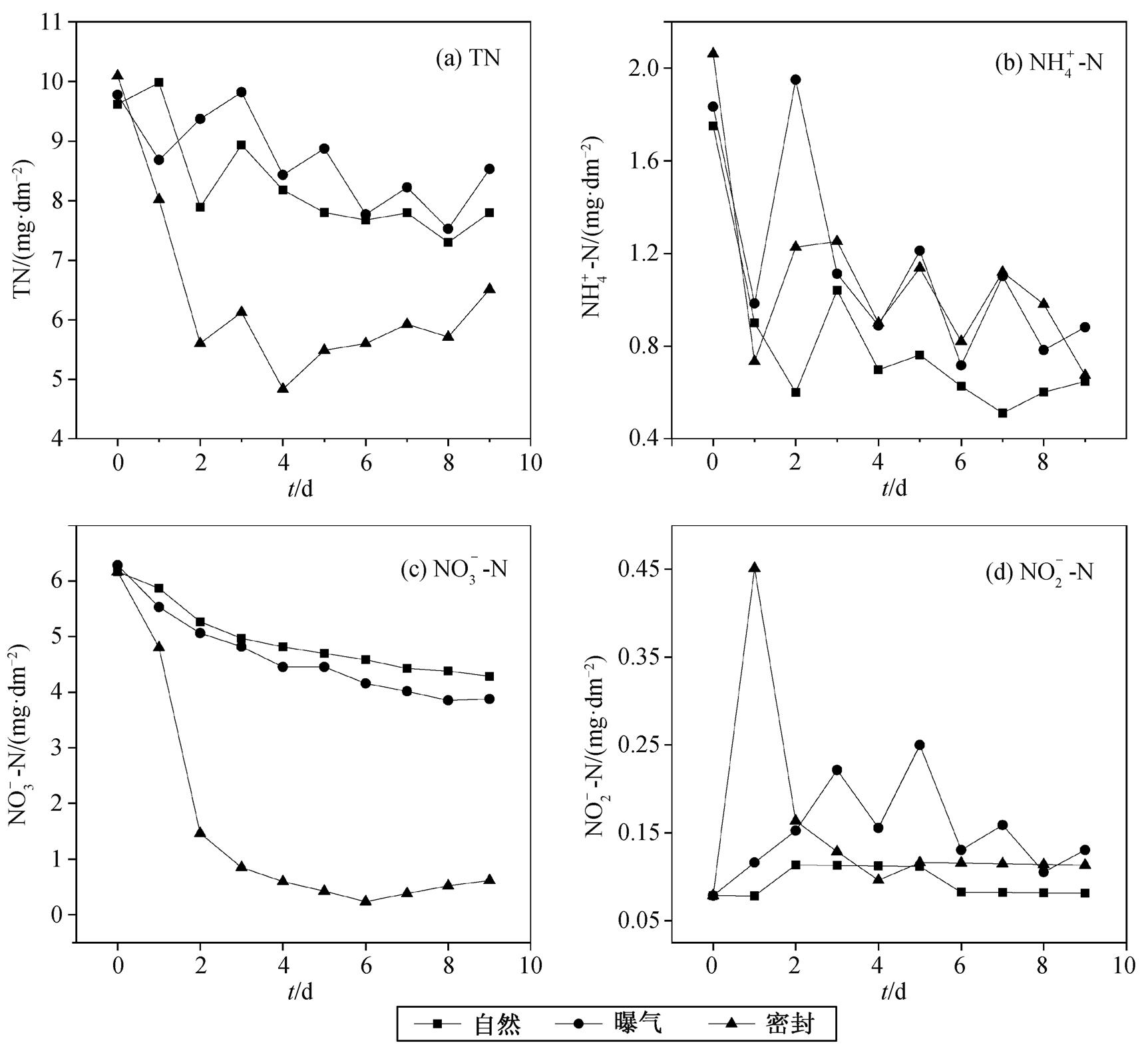
不同溶解氧条件对底泥氮素释放过程的影响如图 4 所示。可以看出, 溶解氧含量显著地影响底泥氮素的释放与累积。实验启动的前两天, 在密封条件下, 底泥的总氮和硝氮累积量迅速降低, 它们的最大降解率分别可达 52.03%和 96.17%。在自然状态和曝气状态下, 底泥中总氮和硝氮的释放规律相近, 但曝气状态下总氮积累量高于自然状态, 硝氮则相反。底泥中氨氮和亚硝氮的释放受溶解氧的影响较少。与扰动影响机制类似, 溶解氧(曝气驱动)对底泥氮素累积释放过程的影响是通过改变微生物活性和产生泥水扰动实现的[20]。曝气复氧改变了底泥–上覆水界面的氧化还原环境, 加速有机质的矿化[26], 同时曝气可能会引起沉积物颗粒悬浮, 促使附着其表面的氮素加快释放。
上述结果表明, 丹江口水库底泥中释放的氮素以硝酸盐氮为主, 在较高的温度(25℃)、中高速的扰动(100 r/min)和高溶解氧水平(开放系统搅动水体)下, 硝酸盐氮释放量较高。因此, 在后续消除内源氮的研究中, 选取具有较宽氧气耐受能力(0~4 mg/L)的好氧反硝化菌 Pseudomonas stutzeri(PCN-1)进行微生物强化消除内源氮污染实验。
2.2 微生物强化消除底泥内源氮污染
2.2.1微生物强化对上覆水水质理化性质的影响
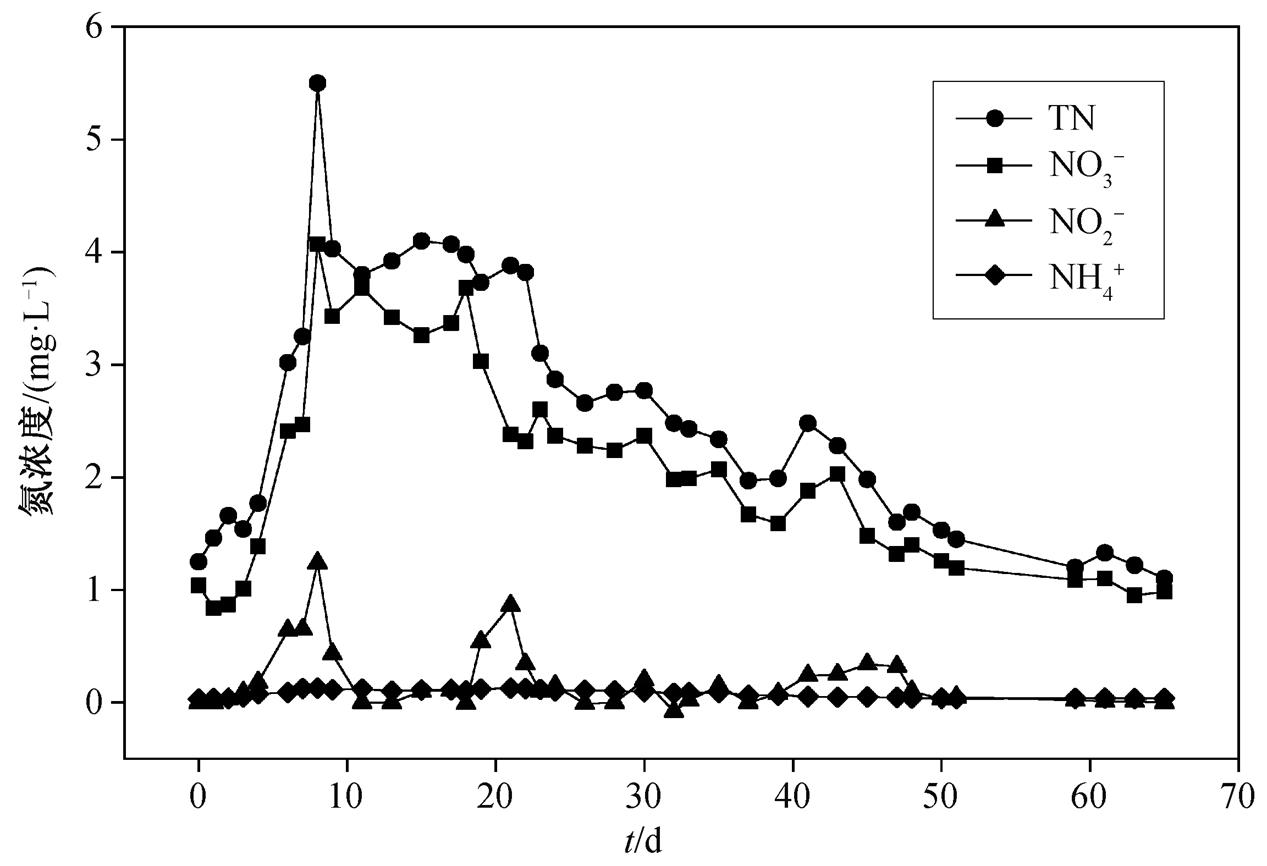
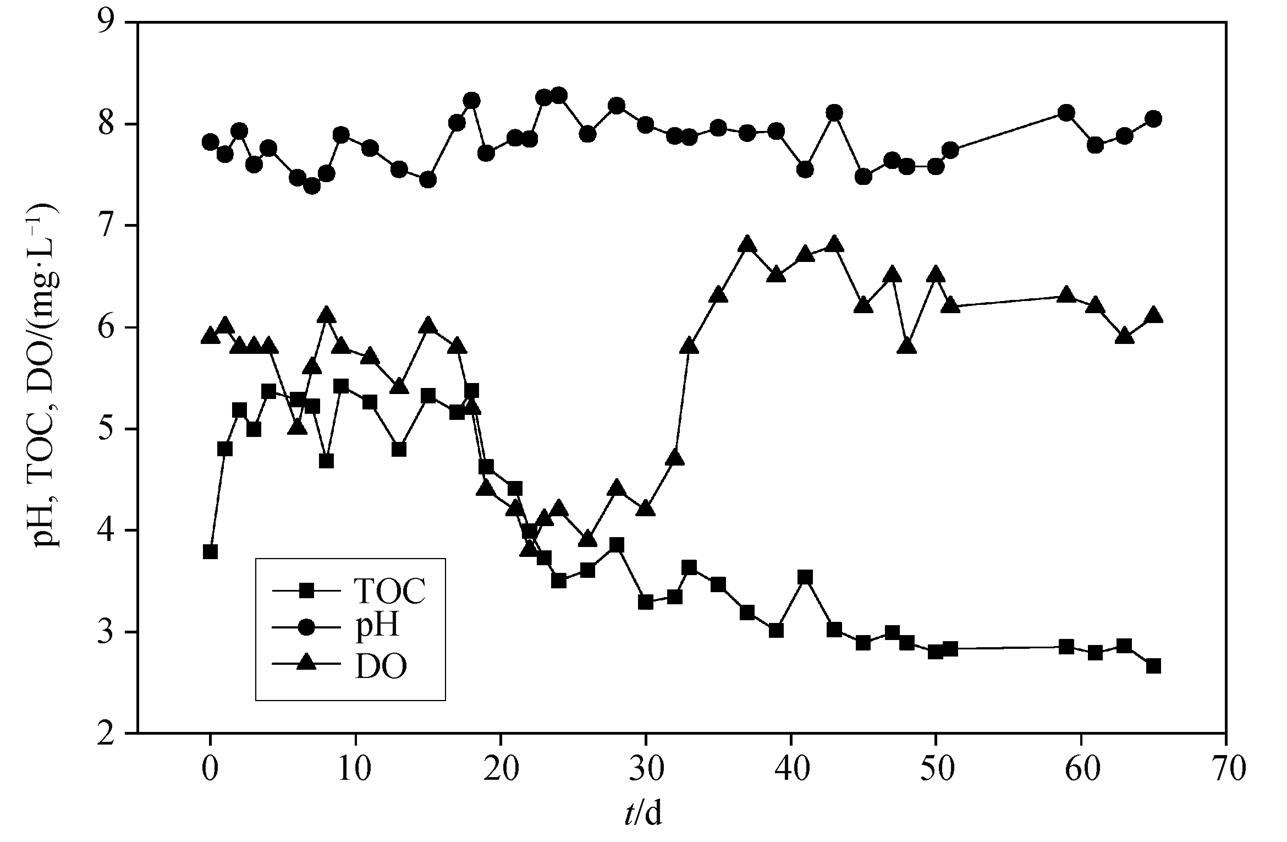
好氧条件下上覆水中氮素以及 TOC, DO 和 pH变化情况如图 5 和 6 所示。根据各项指标的变化规律, 本实验分为 4 个阶段: 底泥内源氮释放(0~8d); 好氧微生物驯化(9~18d); 好氧微生物强化稳定(19~33d); 内源氮污染消除(34~65d)。在第一阶段, 各种形态的氮素都出现迅速的累积, 其中总氮、硝氮、亚硝氮和氨氮的最大累积量分别高达 5.50, 4.07, 1.24 和 0.127mg/L, 此结果与 2.1.2 节的结果相近, 主要是底泥与上覆水之间存在氮素浓度差而引起底泥内源氮素释放的结果。在第二阶段, 由于氮素释放已达到饱和状态, 但好氧脱氮微生物仍处于适应期和驯化期, 未发挥显著作用, 因此, 上覆水中总氮、硝氮和氨氮基本上维持稳定。在第三阶段, 好氧脱氮微生物强化的效果逐渐显现, 开始快速利用水中 TOC 和 DO 进行反硝化作用, 因而反应器中总氮和硝氮的积累量都显著地降低。最后一个阶段, 体系中营养物质的减少使得好氧微生物代谢能力逐渐降低, 体系中的 DO 不断回升。实验结束时, 上覆水中的氮素都实现高效的脱除, 总氮和硝氮去除率分别为 75.87%和 79.96%。文献[27–30]研究了自然条件下底泥内源氮污染的消除情况, 结果表明, 总氮去除效率仅能达到 20%~35%, 说明本研究中 PCN- 1对底泥内源氮污染的消除有显著的强化作用。
由图 6 可知, 在实验启动的前 8 天, TOC 浓度不断上升, 这是搅拌过程使底泥中的腐殖质等有机物扩散至水体中所致[31]。第 19 天, 上覆水中 TOC 和DO 都明显地下降, 说明反应器中的好氧脱氮菌PCN-1 正通过快速消耗氧气和碳源来进行反硝化作用。随着实验的进行, TOC 浓度不断降低, 最终浓度为 2.66 mg/L。第 32 天, 反应器中的溶解氧开始回升, 这可能是由于随着上覆水氮素的浓度降低, 微生物活动减弱, 氧气消耗量减少, 促使水体中溶解氧的含量不断上升。
2.2.2微生物强化对微生物群落结构的影响
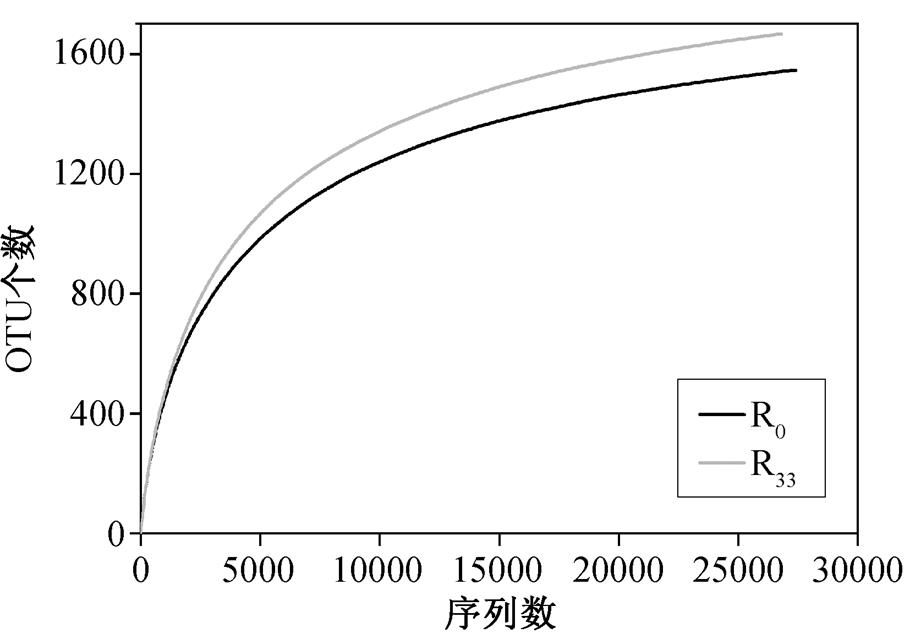
经序列过滤和去除嵌合体序列的优化后, 初始泥样(R0)和最终泥样(R33)分别得到优化序列 50281和 50949 条, 序列平均长度为 476bp; 将优化序列与GreenGenes 16S rRNA Bacteria(13.5)数据库比对, 在 97%的相似性下聚类, 分别获得 1546 和1667 个 OTU。采用对测序序列进行随机抽样的方法, 将抽到的序列数与它们所代表的数目构建稀释性曲线(图 7)。从图 7 可以看出, 两个样品的稀释曲线随测序序列增加而趋于平坦, 说明两个样品获取了绝大多数样本信息, 基本上能够反映底泥中的微生物群落结构组成[32]。
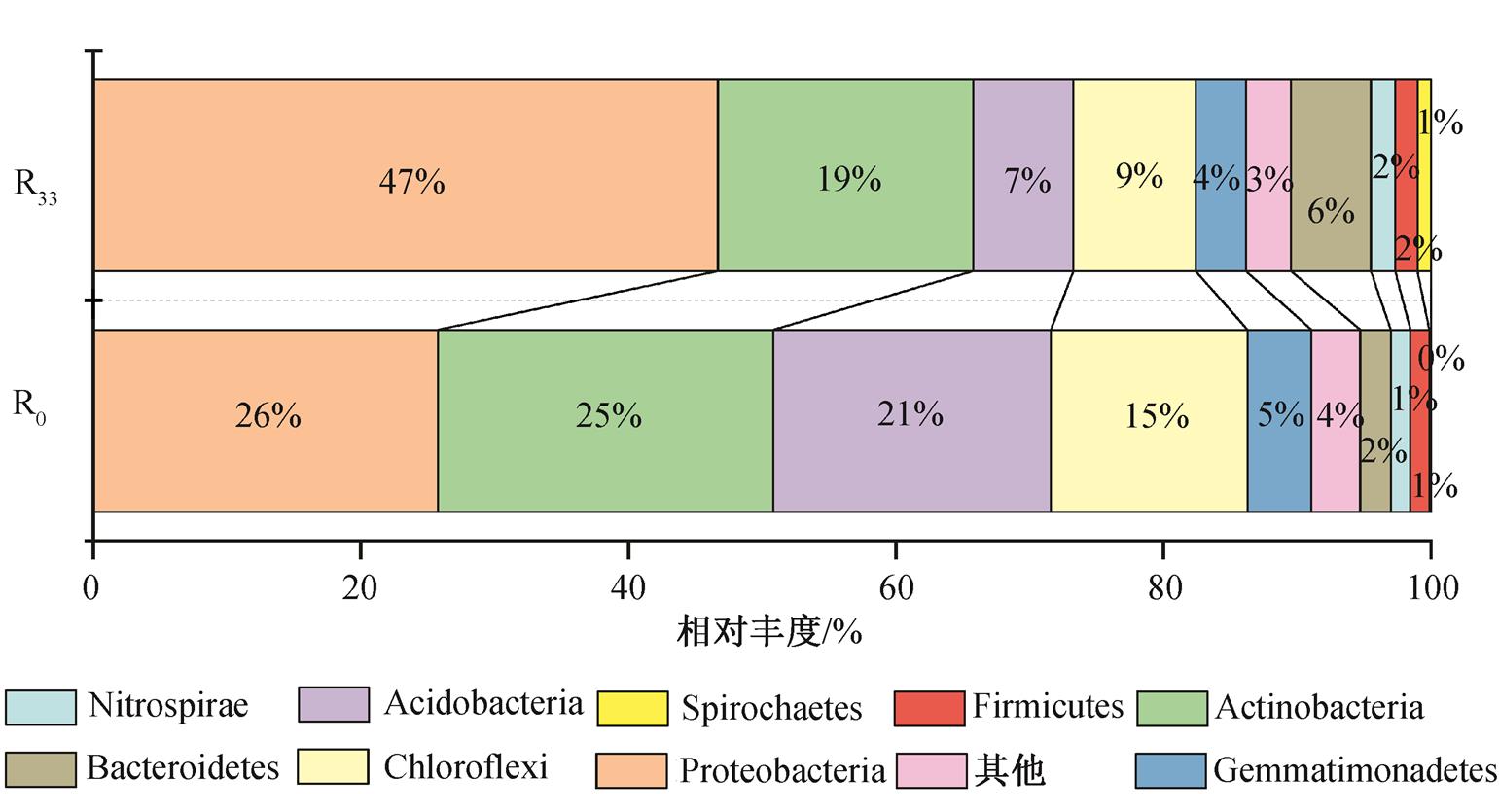
将相对丰度小于 1%的菌门合并到其他类群, 对R0和 R33 两个样品以门水平进行微生物群落结构分析(图 8), 可知两个样品的优势菌门较为一致, 主要包含 Proteobacteria(变形菌门)、Actinobacteria(放线菌门)、Acidobacteria(酸杆菌门)、Chloroflexi(绿弯菌门)、Gemmatimonadetes(芽单胞菌门)、Bacteroidetes(拟杆菌门)、Nitrospirae(硝化螺旋菌门)、Firmicutes(厚壁菌门)和 Spirochaetes(螺旋体门)等类群, 且前 4 种类群占比最大, 相对丰度约占总比例的 82.4%~86.3%。其中, 单个类群平均丰度的大小依次为变形菌门(36.21%)>放线菌门(22.08%)>酸杆菌门(14.12%)>绿弯菌门(11.92%)。两个样品的物种相对丰度差异分析表明, R33 中变形菌门、拟杆菌门和螺旋体门3类物种的相对丰度大于 R0, 其余门类微生物相对丰度与 R0 相比, 差异不大或有所降低。
变形菌门是细菌中最大的一个门, 普遍存在于土壤、活性污泥和沼气池中, 其中包含很多自由生活的菌类, 如 β-变形菌中无机化能类、可以氧化氨的Nitrosomonas(亚硝化单胞菌属)以及 γ-变形菌中的Vibrionaceae(弧菌科)和Pseudomonadaceae(假单胞菌科)等, 它们对生物的脱氮过程都有重要的作用[33]。本实验中, 投加的 PCN-1 菌就属于变形菌门中的Pseudomonas(假单胞菌属)。由图 8 可知, 变形菌门是底泥微生物群落中的绝对优势菌门, 其相对丰度占总比例的 25.74%~46.69%, 实验前后变形菌门的占比增加 20.95%, 说明 PCN-1 强化显著地提高了变形菌门的相对丰度, 在消除底泥内源氮污染过程中可能起主导作用。许多研究表明, 拟杆菌、硝化螺旋菌、厚壁菌和螺旋体 4 个门类是污水处理厂活性污泥中的优势菌种, 与污水处理过程中碳、氮、磷等营养物质的循环密切相关[18,34–35]。本研究中, 这 4 个菌门仅占底泥微生物群落总比例的5.29%~10.48%, 实验前后相对丰度变化较小, 它们可能对底泥–上覆水体系中氮素脱除起到一定程度的协同作用。
Chen 等[34]在 SBR 反应器中应用 PCN 系列菌种对城镇生活污水进行生物强化处理, 发现菌种投加后改善了活性污泥的微生物群落结构, 使处理后的污水实现一级 A 达标排放。Zheng 等[36]探究 PCN-1 菌的反硝化特性时发现, PCN-1 菌可以显著地增强活性污泥的反硝化能力, 降低废水处理过程中NO 和 N2O 的排放量。因此, 本文中反硝化作用的增加可能也与微生物群落结构的变化相关。菌种投加后, 改变了原有的微生物群落结构, 进而带来反硝化作用的增强。另一方面, 研究表明, 未经微生物强化的系统中, 底泥氮释放的去除率仅为35%[27–30]。本实验中微生物强化后对水体底泥释放的总氮去除率高达 75%, 说明微生物在促进底泥内源氮的消除方面起主要作用。上述分析结果表明, 微生物投加后群落结构的改变可能是反硝化作用增强的主要原因。
3 结论
1)底泥氮素释放室内模拟实验结果表明, 温度上升促进底泥中硝氮和亚硝氮的释放, 但抑制底泥中氨氮的释放; 扰动有利于底泥中氮素释放, 扰动速度与释放量成正比; 溶解氧对底泥氮素释放有显著影响, 曝气处理可以明显地降低底泥总氮和硝氮的释放和积累。
2)微生物强化消除底泥内源氮污染的实验结果显示, 经好氧脱氮微生物 PCN-1 强化后, 沉积物–上覆水体系对底泥释放的总氮和硝氮去除率分别高达 75.87%和 79.96%, 实现水体中碳和氮的高效同步去除。
3)对实验前后底泥微生物群落结构分析可知, PCN-1 菌强化改变了底泥中微生物的群落结构, 提高了底泥中 Proteobacteria, Bacteroidetes 和 Spiro-chaetes 的相对丰度, 从而增强了沉积物–上覆水体系的反硝化作用, 显著地降低了底泥引起的内源氮 污染。
致谢 本研究得到刘树枫、王佳文、谢卫萍和尤明涛同学的帮助, 表示衷心感谢。
参考文献
[1]Zhao H, Li Z, Wang S, et al. Features and influencing factors of nitrogen and phosphorus diffusive fluxes at the sediment-water interface of Erhai Lake. Environ-mental Science & Pollution Research International, 2018, 25(2): 1–10
[2]Brito D, Ramos T B, Gonçalves M C, et al. Integrated modelling for water quality management in a eutro-phic reservoir in south-eastern Portugal. Environ-mental Earth Sciences, 2018, 77(2): 40–60
[3]Cavalcante H, Araujo F, Noyma N P, et al. Phosphorus fractionation in sediments of tropical semiarid reser-voirs. Science of the Total Environment, 2018, 619: 1022–1029
[4]Nowlin W H, Evarts J L, Vanni M J. Release rates and potential fates of nitrogen and phosphorus from sedi-ments in a eutrophic reservoir. Freshwater Biology, 2005, 50: 301–302
[5]Li T, Chu C, Zhang Y, et al. Contrasting eutrop-hication risks and countermeasures in different water bodies: assessments to support targeted watershed management. International Journal of Environmental Research & Public Health, 2017, 14(7): 695–713
[6]Mi C X. Study on pollution status of nitrogen and phosphorus in typical reservoirs in Liaoning Province. Advanced Materials Research, 2013, 777: 420–423
[7]Marselina M, Burhanudin M. Trophic status assess-ment of saguling reservoir, Upper Citarum Basin, Indonesia. Air Soil & Water Research, 2017, 10(38): 1–8
[8]Cunha D G F, Lima V F D M, Néri A M, et al. Uptake rates of ammonium and nitrate by phytoplankton communities in two eutrophic tropical reservoirs. International Review of Hydrobiology, 2017, 102(2): 125–134
[9]He J, Deng W, Chen C, et al. Ammonia nitrogen adsorption and release characteristics of surface sedi-ments in Dianchi Lake, China. Environmental Earth Sciences, 2015, 74(5): 3917–3927
[10]Liang Z, Liu Z, Zhen S, et al. Phosphorus speciation and effects of environmental factors on release of phosphorus from sediments obtained from Taihu Lake, Tien Lake, and East Lake. Toxicological & Environmental Chemistry Reviews, 2015, 97(3/4): 335–348
[11]Wang J, Wang S, Jin X, et al. Ammonium release characteristics of the sediments from the shallow lakes in the middle and lower reaches of Yangtze River region, China. Environmental Geology, 2008, 55(1): 37–45
[12]Fukuhara H, Sakamoto M. Enhancement of inorganic nitrogen and phosphate release from lake sediment by tubificid worms and chironomid larvae. Copenhagen. 1987, 3(48): 312–320
[13]Li Y, Zhou Y, Zhou Z, et al. Effects of sustained-release composite on the oxygen levels and sediment phosphorus fractions of an urban river in Shanghai. Environmental Technology, 2014, 35: 2176–2182
[14]Kang M, Peng S, Tian Y, et al. Effects of dissolved oxygen and nutrient loading on phosphorus fluxes at the sediment–water interface in the Hai River Estuary, China. Marine Pollution Bulletin, 2018, 130: 132–139
[15]Shi X, Ma W X, Li X, et al. Typical reservoir pollution source analysis // Huang T, Cheng Y, Cong H, et al. Water Pollution and Water Quality Control of Selected Chinese Reservoir Basins. Cham: Springer, 2016: 95–130
[16]薄涛, 季民. 内源污染控制技术研究进展. 生态环境学报, 2017, 26(3): 514–521
[17]柴蓓蓓. 水源水库沉积物多相界面污染物迁移转化与污染控制研究[D]. 西安: 西安建筑科技大学, 2012
[18]Liu T, Liu S, Zheng M, et al. Performance assessment of full-scale wastewater treatment plants based on sea-sonal variability of microbial communities via high-throughput sequencing. PLOS ONE, 2016, 11(4): 1–15
[19]李辉, 潘学军, 史丽琼, 等. 湖泊内源氮磷污染分析方法及特征研究进展. 环境化学, 2011, 30(1): 281–292
[20]陶玉炎, 耿金菊, 王荣俊, 等. 环境条件变化对河流沉积物“三氮”释放的影响. 环境科学与技术, 2013, 36(6L): 41–44
[21]孙志高, 刘景双. 湿地土壤的硝化-反硝化作用及影响因素. 土壤通报, 2008, 39(6): 1462–1467
[22]余荣台. 城市内河沉积物硝态氮释放行为的模拟研究. 环境工程学报, 2014, 8(7): 2870–2874
[23]罗玉兰. 城市内河沉积物营养盐污染特性及释放规律研究[D]. 南京: 河海大学, 2007
[24]姜永生, 李晓晨, 邢友华, 等. 扰动对东平湖表层沉积物中氮磷释放的影响. 环境科学与技术, 2010, 33(8): 41–44
[25]代政, 祁艳丽, 唐永杰, 等. 上覆水环境因子对滨海水库沉积物氮磷释放的影响. 环境科学研究, 2016, 29(12): 1766–1772
[26]张亚楠. 东昌湖表层沉积物氮赋存形态及其释放研究[D]. 青岛: 中国海洋大学, 2013
[27]周成. 湖泊受污底泥营养物释放机理及水质影响试验研究[D]. 武汉: 武汉大学, 2017
[28]魏全源. 微生物对水库沉积物氮释放的影响研究[D]. 西安: 西安建筑科技大学, 2009
[29]李薇. 溶解氧水平对富营养化水体底泥氮磷转化影响的研究[D]. 南京: 南京理工大学, 2014
[30]黄廷林, 杨凤英, 柴蓓蓓, 等. 水源水库污染底泥不同修复方法脱氮效果对比实验研究. 中国环境科学, 2012, 32(11): 2032–2038
[31]黄建军. 城市河道底泥营养盐释放及化学修复研究[D]. 天津: 天津大学, 2009
[32]杨浩, 张国珍, 杨晓妮, 等. 16S rRNA 高通量测序研究集雨窖水中微生物群落结构及多样性. 环境科学, 2017, 38(4): 1704–1716
[33]林燕, 张焕杰, 刘曦, 等. 固定反硝化菌强化人工湿地处理低污染水研究. 农业环境科学学报, 2016, 35(11): 2154–2162
[34]Chen Q, Ni J, Ma T, et al. Bioaugmentation treatment of municipal wastewater with heterotrophic-aerobic nitrogen removal bacteria in a pilot-scale SBR. Bio-resource Technology, 2015, 183: 25–32
[35]范军辉, 郝瑞霞, 朱晓霞, 等. 温度对 SCSC-S/Fe复合系统脱氮除磷及微生物群落特性的影响. 环境科学, 2017, 38(5): 2012–2020
[36]Zheng M, He D, Ma T, et al. Reducing NO and N2O emission during aerobic denitrification by newly isolated Pseudomonas stutzeri PCN-1. Bioresource Technology, 2014, 162: 80–88
Study on Nitrogen Release from Reservoir Sediments and Nitrogen Removal by Aerobic Microorganism
XIE Minzheng1,2, CHEN Qian2,†, DANG Chenyuan2, PAN Boyue2, AN Rui2, WU Zhe3, ZHOU Ming3
1. Shenzhen Key Laboratory for Heavy Metal Pollution Control and Reutilization, School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055; 2. Beijing Engineering Research Center for Advanced Wastewater Treatment, Department of Environmental Engineering, Peking University, Beijing 100871; 3. Hydrology and Resources Survey Bureau of the Hanjiang River, Hydrology Bureau of the Yangtze River Water Conservancy Commission, Water Xiangyang 441022
Abstract This study focuses on the Danjiangkou reservoir, and investigates the release regulation of total nitrogen, nitrate, nitrite and ammonia from sediments as a function of temperature, perturbation and aeration conditions. Moreover, a simulation reactor was set up to explore the elimination of endogenous nitrogen pollution through high-efficient aerobic denitrification microorganism augmentation. Effects of high-efficient aerobic denitrification microorganisms on the microbial community structure in the sediments was also evaluated by means of high-throughput sequencing technology. The results indicated that increasing temperature could promote the release of nitrate and nitrite from sediments, while inhibiting the release of ammonium. Disturbances of water was beneficial to nitrogen release from sediments, and the nitrogen amount accumulated in the overlying water was proportional to the agitation speed. Concentrations of dissolved oxygen had great effects on the nitrogen release from sediments. It was found that the aeration treatment significantly reduced the release of total nitrogen and nitrite from sediments, and the subsequent accumulation in water. After addition of the a high-efficient aerobic denitrification bacteria Pseudomonas stutzeri (PCN-1) into the simulation reactor, concentrations of all the forms of nitrogen in the reactor increased at first and then decreased. On the 65th day of the experiment, removal rates of total nitrogen and nitrate released from sediments were as high as 75.87% and 79.96% respectively, suggesting effective control of the endogenous nitrogen. The relative abundance of Proteobacteria, Bacteroidetes and Spirochaetes in sediments was significantly increased after PCN-1 addition, so the microbial community structure in the sediments was changed by microbial augmentation treatment with PCN-1 as well.
Key words endogenous nitrogen pollution; nitrogen release from sediments; physical and chemical factors; microbial augmentation; high-efficient denitrification
† Corresponding author, E-mail: qianchen@pku.edu.cn
国家自然科学基金(51539001)资助
收稿日期: 2018–04–17;
修回日期: 2018–04–27;
doi: 10.13209/j.0479-8023.2019.018
†通信作者, E-mail: qianchen@pku.edu.cn
网络出版日期: 2019–05–09



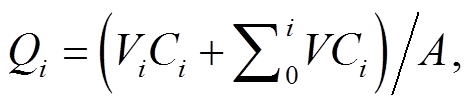
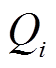 表示第 i 次取样时底泥氮化合物的释放累积量(mg/dm
表示第 i 次取样时底泥氮化合物的释放累积量(mg/dm