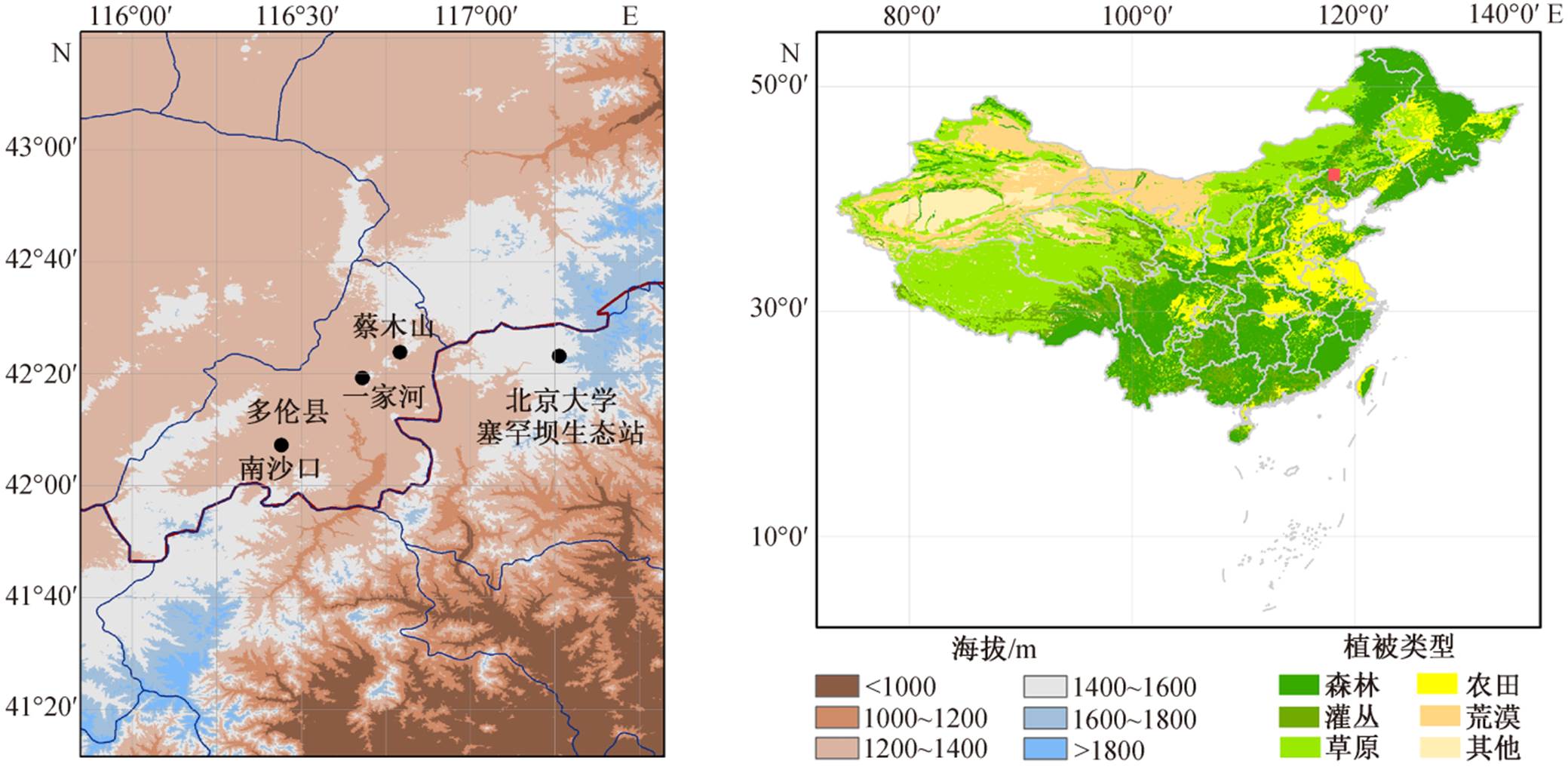
图1 研究区位置
Fig. 1 Location of study site
摘要 为探究干旱林线区不同树种非结构性碳水化合物(NSC)的季节格局以及生物因素(树种)和非生物因素(气候)在其中的作用, 选取内蒙古高原东南缘 4 种典型乔木(樟子松、白桦、小叶杨和华北落叶松)作为研究对象, 对其生长季叶片、树干中的可溶性糖、淀粉及总非结构性碳水化合物的浓度进行比较。结果表明: 不同功能型树种 NSC 各组分浓度具有相似的季节格局(生长季初期短暂上升, 生长季旺期持续下降, 生长季末期由于生长减缓而逐渐回升), 说明气候因素在 NSC 季节动态中起主导作用。不同树种 NSC 季节均值总体上具有显著差异(p<0.05), 白桦 NSC 各组分含量均高于樟子松, 体现生物因素的影响。更加干旱的局地气候条件使得樟子松 NSC 含量高于小叶杨及华北落叶松, 说明干旱林线 NSC 含量影响因子的复杂性。叶片可溶性糖及 TNC 含量高于树干, 而淀粉含量低于树干, 这与植物不同器官的功能差异有关。
关键词 非结构性碳水化合物(NSC); 季节格局; 干旱林线; 小叶杨; 樟子松; 白桦; 华北落叶松
干旱胁迫是森林面对的主要非生物胁迫之一, 会限制树木的生长, 导致树木的碳平衡失调[1–3]。近几十年来, 全球气候变化导致的升温和干旱加剧, 干旱主导的树木死亡事件频发, 并且大多发生在干旱林线区[4–6]。虽然关于树木如何响应干旱已经有广泛的讨论[5,7], 但具体的生理学适应机制还存在较多疑点。
非结构性碳水化合物(non-structural carbohyd-rates, NSC)是参与植物生命代谢的重要物质, 主要包括可溶性糖和淀粉[1], 是树木遭受环境胁迫时生长所需及灾后恢复的重要能量来源[4]。树木体内的 NSC 含量能较好地表征其碳供应状态, 有助于理解树木死亡的生理机制[8]。NSC 也是树木体内供需平衡的重要衡量指标, 其季节动态对于理解树木干旱胁迫下的适应机制具有重要意义[9–10]。目前关于树木 NSC 季节格局的讨论主要基于对树木幼苗的控制实验[11–13], 对于不同功能型树种成年林的野外观测研究相对匮乏。由于对干旱气候下非结构性碳水化合物的季节动态认识有限, 所以关于水分亏缺条件下的 NSC 积累是一个主动的过程还是被动的过程尚存在争论[14]。
干旱林线区的树木会周期性地遭受水分胁迫, 对不同尺度的水分亏缺响应敏感[15]。中国北方的干旱林线区存在巨大的水分梯度差异, 拥有不同功能型的树种组成, 使得这一区域成为探究不同功能型树木对干旱适应策略的理想区域。本研究在生长季对内蒙古高原东南缘干旱林线区的主要树种樟子松(Pinus sylvestris var. mongolica)、白桦(Betula platyphylla)、华北落叶松(Larix principis-rupprechtii)和小叶杨(Populus simonii)进行野外连续采样, 通过比较不同功能型树种叶片及树干组织的 NSC 季节动态, 尝试认识内蒙古高原东南缘干旱林线区不同功能型乔木 NSC 的季节格局、在不同器官间的分配格局及其积累是否存在差异。由于白桦、华北落叶松和小叶杨会周期性地经历落叶期, 而 NSC 又是树木休眠期呼吸及发芽期生长的重要能量来源[1], 所以本文研究结果有助于认识在干旱胁迫下生物因素(如树种)和非生物因素(如气候)在树木非结构性碳积累过程中的作用。本文提出如下假说: 如果气候因素主导非结构性碳的积累, 那么不同功能型乔木间 NSC 的季节动态不存在显著差异; 如果生物因素主导, 则不同功能型乔木间 NSC 的季节动态存在显著差异。
研究区位于内蒙古高原的东南缘, 锡林郭勒盟多伦县(115.30—116.55°E, 41.45—42.39°N)(图 1), 地处阴山山麓东端, 浑善达克沙地南端, 北与克什克腾旗毗邻, 南与河北省围场县接壤。该地区海拔约 1150m, 年均降水量约 365mm(图 2), 四季降水分配不均, 多集中在夏季, 6—8 月降水量占全年的65%~70%。年均蒸发量高达 1750mm, 约为年均降水量的 4.5 倍。历年平均气温为 1.6℃, 一月平均气温为–12.9℃, 7 月平均气温 21.0℃, 5 月底到 9 月中旬为生长季。主要土壤类型为栗钙土, 占全县土地面积的 70.26%, 其次为风沙土, 占 16.67%。该地区位于东亚季风的尾闾区, 大陆性气候显著, 植被生长季较短, 植被类型为温带森林到温带草原的过渡类型[16], 对气候变化反应敏感。

图1 研究区位置
Fig. 1 Location of study site
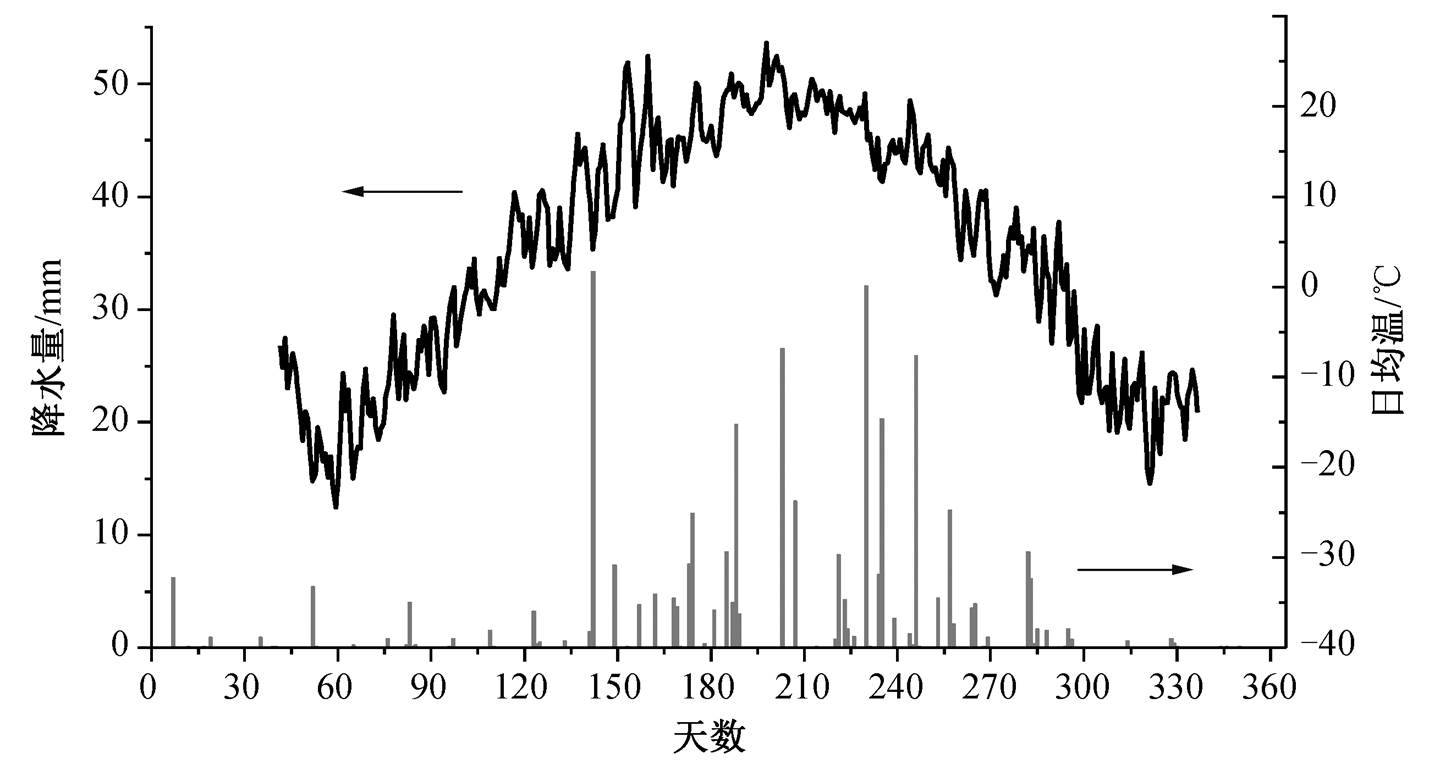
图2 研究区2017年的年际降水量及温度变化
Fig. 2 Precipitation and temperature variation of study site in 2017
表1 样地及样木基本信息(平均值±标准误差, n=3)
Table 1 Basic characteristics of the sampled trees and sites (mean±SE, n=3)
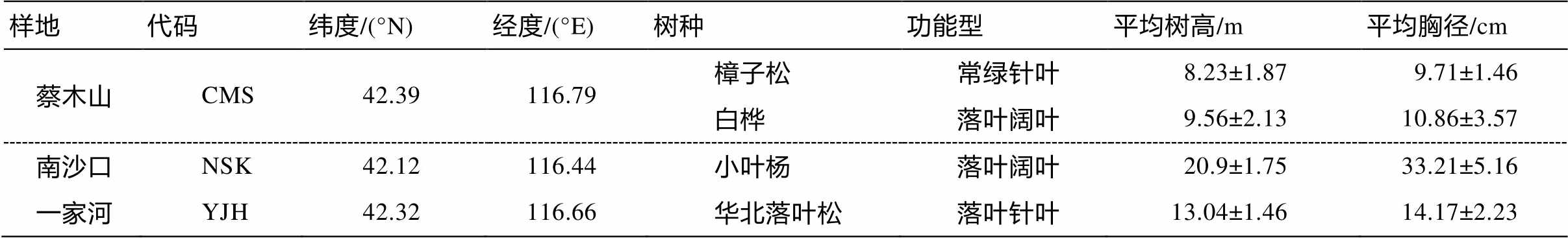
样地代码纬度/(°N)经度/(°E)树种功能型平均树高/m平均胸径/cm 蔡木山CMS42.39116.79樟子松常绿针叶8.23±1.879.71±1.46 白桦落叶阔叶9.56±2.1310.86±3.57 南沙口NSK42.12116.44小叶杨落叶阔叶20.9±1.7533.21±5.16 一家河YJH42.32116.66华北落叶松落叶针叶13.04±1.4614.17±2.23
本研究选取不同功能型树种樟子松、白桦、小叶杨和华北落叶松为研究对象(表 1)。为了减小立地条件的影响, 每个树种分别随机选取 3 株胸径与树高相近的健康优势木。分别在 2017 年的 5—9 月对 3 个样地树种的树叶和树干取样 9 次, 每次间隔约 15 天。采样的具体时间参照当地树种的物候规律, 每次取样 3 天内完成。
为避免冠层差异, 选取冠层中部的树叶代表整个树冠。取样时, 人工爬至冠层高度, 用枝剪在树冠中部随机剪取长势良好的树枝, 然后将所取枝条上的叶片摘下, 编号后装入自封袋中保存。用内径为 5mm 的生长锥在每株样木胸高处(距地面 1.4m)钻取树芯样品。每次取样时, 钻取位置均轻微向左侧(或右侧)轻微挪动, 避免与上次取样部位重合。取样部位留下的树洞用黄油填满, 避免病原体侵袭, 将样品编号装袋保存。
所有样品获取后两小时内用微波炉(1min, 600W)进行高温杀青, 使酶变性[17], 然后带回实验室烘干研磨, 过 100 目筛, 在 65℃恒温箱内烘干至恒重, 每个样品混匀后常温密封保存, 用作 NSC 分析。
采用改进的苯酚–浓硫酸法测定可溶性糖和淀粉的浓度[18]。
标准曲线的绘制: 将蔗糖(分析纯)在 80℃恒温箱中烘至恒重, 用万分之一天平称取 0.1000g 样品, 加少量蒸馏水, 溶解后转入 100mL 容量瓶, 得到蔗糖标准液; 取 6 支 10mL 离心管, 用蒸馏水将蔗糖标准液定容至不同浓度(定容体积为 1mL), 然后分别加入 0.5mL 28%的苯酚溶液, 再缓慢加入 2.5mL 浓硫酸, 摇匀显色 30 分钟。以空白为参照, 用紫外可见分光光度计(T6 新世纪, 北京普析通用仪器有限责任公司)在 485nm 波长下比色测定吸光值。测得蔗糖浓度在 10~100μg/mL(对应光密度为0.13~1.72)范围内, 与 485nm 的光密度有最好的线性关系, 超出这个范围的蔗糖浓度与所测光密度线性拟合度不达标(实验过程中需要调整样品浓度, 使其测定光密度值在 0.13~1.72 之间)。
可溶性糖的提取: 用万分之一天平称取研磨后的样品若干, 为了让测定的吸光值控制在标线限度内, 称取树干样品 0.0200 g, 叶片样品 0.0100 g。将样品放入 10mL 离心管, 加入 1mL80%酒精抽提过夜。以 5000rpm离心 10 分钟, 吸取上清液至离心管。在残渣中加入酒精, 离心后, 上清液一并倒入10mL 离心管, 定容至 8mL。由于不同部位可溶性糖含量不同, 为了让吸光值在标线限度内, 叶片样品抽取 0.5mL 样液, 树干样品抽取 1.0mL 样液, 不足 1.0mL的用酒精补足。
淀粉的提取: 将上述提取后的残渣, 加入 1mL盐酸于沸水中煮 1.5 小时, 然后以 5000rpm 离心 10 分钟, 吸取上清液至离心管, 用酒精定容至 8 mL。最后, 抽取0.2 mL样液用于测定。
淀粉和可溶性糖的测定: 在待测溶液中加入0.5mL 28%的苯酚溶液和 2.5mL 浓硫酸溶液, 震荡混匀, 显色 30 分钟后, 采用紫外可见分光光度计(T6 新世纪, 北京普析通用仪器有限责任公司), 在485nm 波长下测定吸光值, 再根据蔗糖的标准曲线计算可溶性糖和淀粉的浓度。计算公式为
可溶性糖含量(%) = (C·VT)/(V1·W),
式中, C 为光度计显示的数值(μg), VT为提取液体积(mL), V1 为吸取样品液体积(mL), W 为选取的鲜叶重量(g)。
本文将 TNC (total non-structural carbohydrates) 定义为可溶性糖与淀粉之和, 即 TNC=可溶性糖+淀粉。采用方差分析(ANOVA)和 Tukey–Kramer HSD检验, 多重比较不同树种、采样时间和组织中NSC浓度和含量差异的显著性。所有统计分析均采用SPSS 20.0 (SPSS Inc., Chicago)完成。所有图均在Origin 8.0 (Origin Lab, North-ampton MA)中完成。
不同功能型树种的叶片 NSC 各组分含量以及树干的淀粉和 TNC 均表现出明显的季节性波动, 而树干的可溶性糖含量没有明显的季节性变化(图3)。樟子松、白桦、华北落叶松及小叶杨的叶片NSC 含量呈现相似的季节格局: 生长季初期短暂上升, 在 6 月达到峰值; 随着生长速率加快,NSC 逐渐下降, 在生长季中期(7 月初)达到最低值, 随后由于生长速率减缓逐渐回升, 樟子松的回升幅度明显小于其他树种。不同树种的树干 NSC 含量亦呈现生长季先上升后下降、生长季末期小幅上升的趋势, 但树干 NSC 上升趋势明显滞后于叶片 NSC。
不同功能型树种虽有相似的季节格局, 但其波动幅度存在明显的差异(图 3)。方差分析结果显示, 除树干可溶性糖外, 不同树种叶片及树干可溶性糖、淀粉及 TNC 含量差异显著(p<0.05, 表 2), 叶片可溶性糖含量白桦与小叶杨显著高于樟子松及落叶松, 且差异显著(图 4, p<0.05), 叶片淀粉含量为白桦>樟子松>小叶杨>华北落叶松, 且差异显著(图 4, p<0.05), 叶片 TNC 含量为白桦>小叶杨>樟子松>落叶松, 差异显著(图 4, p<0.05); 树干淀粉及 TNC 均表现为白桦>樟子松>小叶杨>华北落叶松, 树干可溶性糖含量均小于 1%, 且差异不显著。樟子松、白桦、小叶杨及华北落叶松可溶性糖含量均为叶片>树干, 淀粉含量为叶片<树干, TNC 含量叶片>树干, 且差异显著(图 5, p<0.05)。
常绿针叶树种(樟子松)、落叶阔叶树种(白桦、小叶杨)及落叶针叶树种(华北落叶松)具有相似的非结构性碳水化合物季节格局: 在结束休眠期后, NSC 含量出现短暂的上升, 随着生长速率的加快, NSC 含量逐渐降低, 并在夏初达到最低峰值; 生长季后期随着生长的减缓, NSC 含量逐渐回升, 这与文献[8,19–20]总结的温带树种 NSC 季节格局一致。非结构性碳水化合物是一种源汇平衡的产物[1], 树木在结束休眠期迎来夏初降水后, 叶片开始进行光合作用, 而此时生长速率缓慢, 因此碳同化产物积累, NSC 含量增加。随着生长速率升高, 碳同化速率逐渐低于碳消耗速率, NSC 含量降低并达到最低值。对于落叶树种, 非结构性碳库是休眠期维持性呼吸及生长季前期展叶最主要的物质来源之一[21], 落叶树种发芽期需要消耗大量的 NSC 储量用于生长代谢[22–23]。对于常绿针叶树种, 生长季中期 NSC 含量的快速下降可能是由强烈的碳汇过程(如生长、传输和抵御环境胁迫)导致。许多研究表明, 在树木受到环境胁迫时, NSC 库可以帮助树木进行灾后重建和修复, 在碳同化量无法满足需求时作为碳源, 支持树木各项代谢过程[4,9,20,24–25]。本研究区的早春干旱胁迫也许就是生长季非结构性碳水化物下降的重要诱因之一。生长季后期的非结构性碳水化合物含量回升可能是树木为了应对冬季低温而形成的一种适应机制, 树木体内储存的 NSC 可以帮助植物在面对低温胁迫时进行渗透调节[26–28]。樟子松的回升趋势明显低于其他树种, 生长季后期的 NSC 含量趋于稳定, 可能是由于与其他树种截然不同的叶物候所致, 常绿针叶树种的老龄针叶是重要的 NSC 库[29], 与落叶树种相比, 常绿树种早春的光合作用可以大大地缓解生长季的碳供给压力。树干 NSC 波动趋势滞后于叶片 NSC, 可能是由碳源过程(如光合作用)与碳汇过程(如转运和生长)的不同步造成的, 尤其在降水季节变率较大的地区(如干旱林线区)[4,30]。
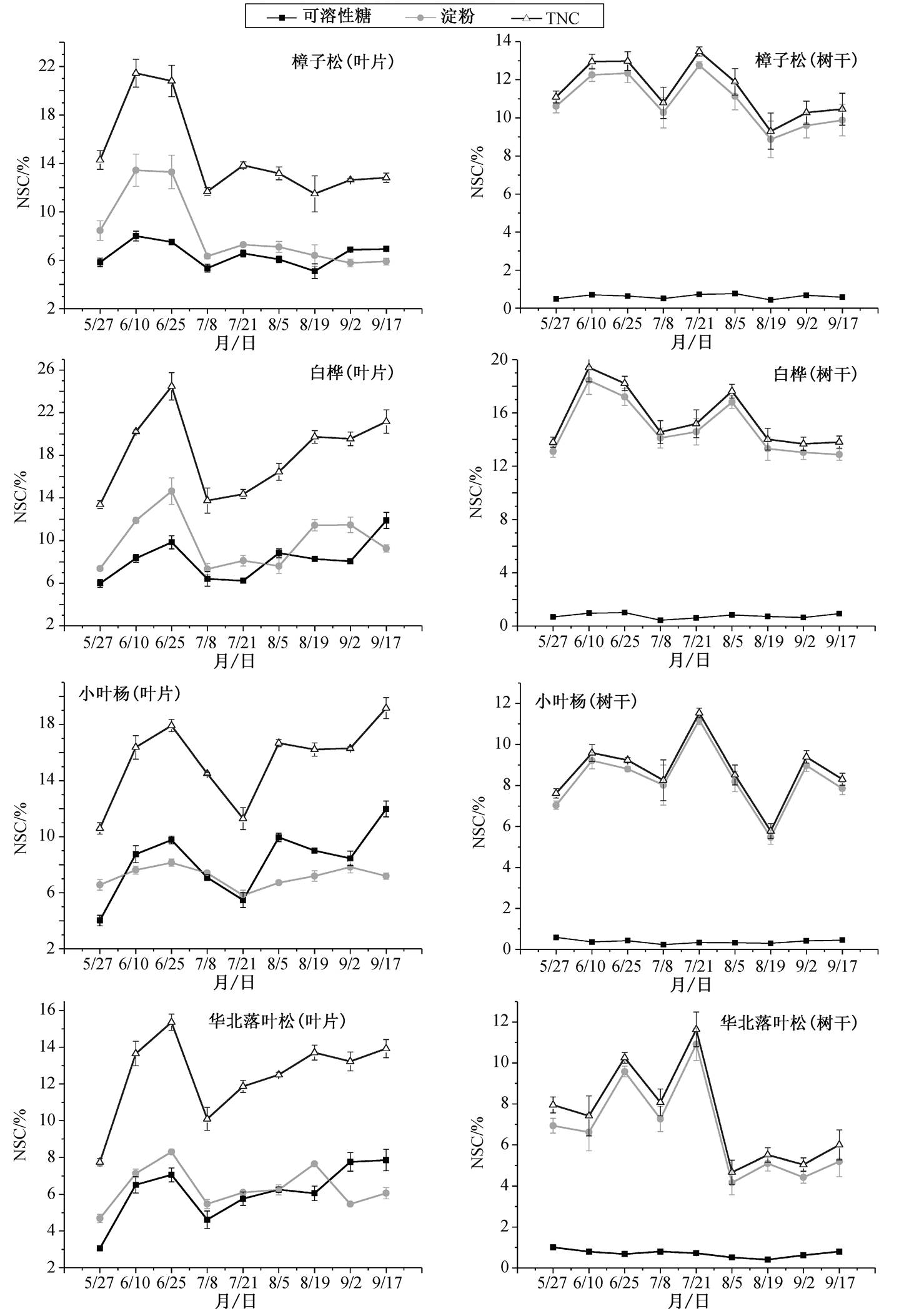
NSC = mean ± SE, n=3
图3 不同树种非结构性碳水化合物的季节动态
Fig. 3 Seasonal NSC dynamics of different functional types
表2 不同树种非结构性碳水化合物各组分浓度影响因子方差分析
Table 2 MANOVA for effects of species and sampling dates on the NSC concentrations

器官影响因子 Df可溶性糖淀粉TNC FpFpFp 叶片树种346.715p<0.0549.492p<0.0569.988p<0.05 季节827.518p<0.0523.805p<0.0540.207p<0.05 树种×季节244.701p<0.055.762p<0.056.673p<0.05 树干树种361.164p=0.65203.716p<0.05206.516p<0.05 季节87.724p<0.0515.877p<0.0516.239p<0.05 树种×季节244.905p<0.053.178p<0.053.400p<0.05
注: p<0.05表明差异显著。
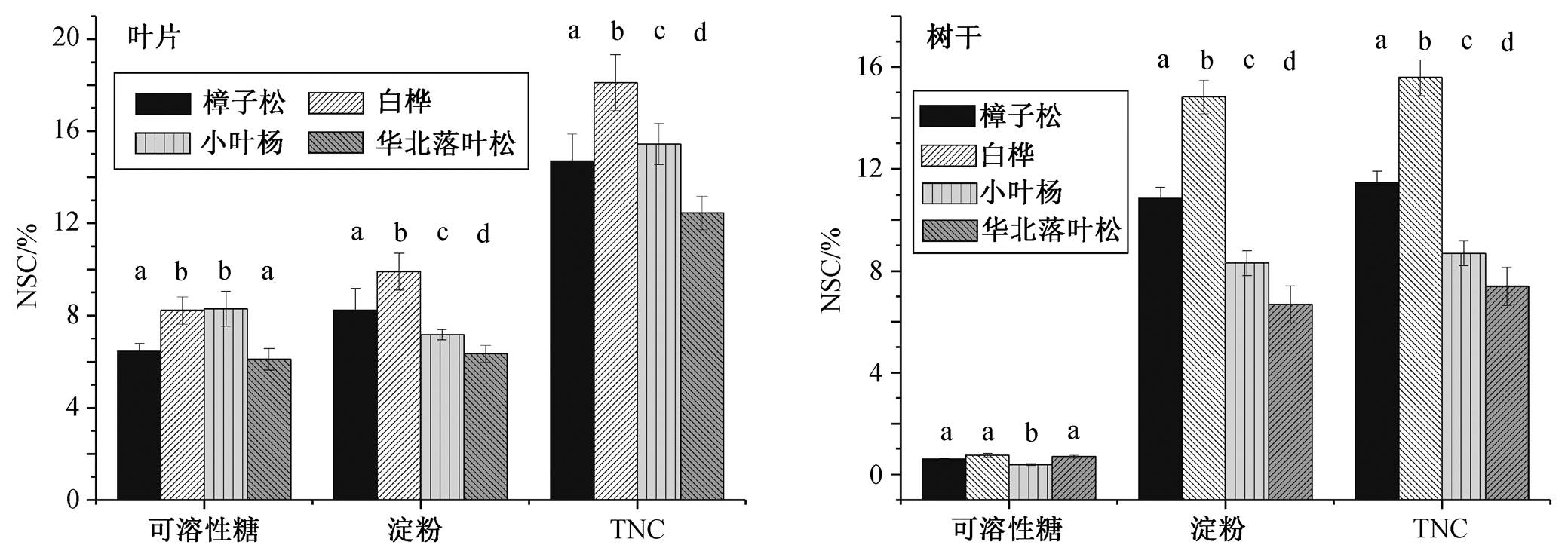
a, b, c和d表示显著性差异组别(α=0.05)
图4 不同树种叶片及树干非结构性碳水化合物的季节均值比较
Fig. 4 Comparison between the NSC concentrations of different trees for each tissue and site
虽然不同功能型树种具有相似的季节格局, 但NSC 浓度却存在显著差异, 本研究中, 白桦叶片及树干 NSC 均显著大于樟子松, 与文献[8]的结果一致。经典观点认为落叶树种比常绿树种拥有更高的 NSC 库[1,8], 落叶阔叶树种由于叶面积的季节性更替, 需要储存更多的 NSC 来弥补光合面积减少所带来的同化产物缺失[31], 特别是抵御非生长季的低温胁迫[28]。关于针阔混交林的研究也发现, 落叶阔叶树种(红枫)的 NSC 浓度约为 24mg/g, 而常绿针叶树种(云杉)的 NSC 浓度还不到 20mg/g[20]。本研究中华北落叶松的叶片及树干 NSC 均低于樟子松, 小叶杨树干NSC 低于樟子松, 叶片 NSC 大于樟子松, 可能是因为樟子松取样地点比华北落叶松及小叶杨取样地点的水分条件更恶劣。控制实验结果表明, 在相对干旱的条件下, 树木会积累更多的 NSC 用于支撑植物生长[13], 关于木本植物 NSC 动态的研究也认为, 落叶树种NSC 含量高于常绿树种并不是绝对的[4]。
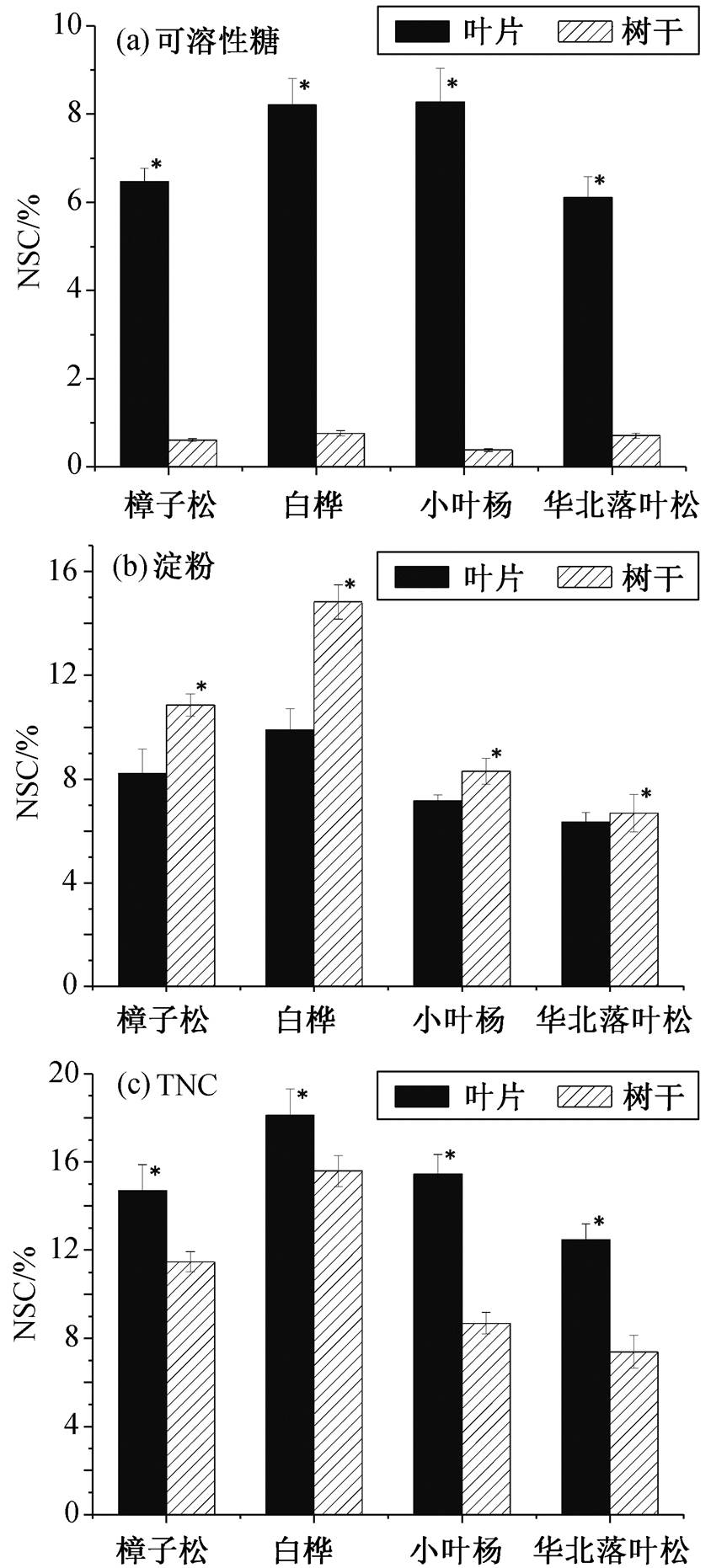
*表示差异显著(p<0.05)
图5 不同树种可溶性糖、淀粉及TNC含量在叶片及树干木质部的分布
Fig. 5 Distribution patterns of NSC in tree different species between leaf and stem
不同树种叶片及树干的 NSC 各组分含量明显不同。与树干相比, 叶片中的可溶性糖及 TNC含量更高, 淀粉含量更低。叶片是树木主要的碳同化器官, 作为“碳源”提供碳水化合物以供植物生长[9]。本研究中叶片可溶性糖及 TNC 高于树干, 与文献[22]的结果一致, 叶片 NSC 浓度反映的是一种短期的源–汇波动[33], 较高的代谢速率以及需要时刻保持正常的细胞膨压, 使其 NSC 组成由可溶性糖含量主导[34]。作为主要的“碳汇”, 树干是树木重要的碳储存器官, 由于其木质化比例较高, NSC 主要以淀粉的形式储存, 所以表现出树干淀粉含量高于叶片淀粉。
干旱林线区的不同功能型树种(樟子松、白桦、小叶杨和华北落叶松)NSC 具有相似的季节变化格局, 表明气候因素在 NSC 季节变化中起主导作用。不同功能型的树种, 其非结构性碳水化合物季节均值差异显著, 总体上落叶树种比常绿树种拥有更高的 NSC 库, 说明生物因素主要影响 NSC 各组分含量。本研究中, 华北落叶松的叶片及树干 NSC均低于樟子松, 小叶杨树干 NSC 低于樟子松, 叶片NSC 大于樟子松, 可能与局地气候有关, 说明干旱林线树木 NSC 积累的复杂性。叶片和树干 NSC含量差异显著, 叶片可溶性糖及 TNC 含量大于树干, 而叶片淀粉含量小于树干, 与不同器官间的功能差异有关。
参考文献
[1]Kozlowski T T. Carbohydrate sources and sinks in woody-plants. Botanical Review, 1992, 58(2): 107–222
[2]Barbaroux C, Breda N, Dufrene E. Distribution of above-ground and below-ground carbohydrate reser-ves in adult trees of two contrasting broad-leaved species (Quercus petraea and Fagus sylvatica). New Phytologist, 2003, 157(3): 605–615
[3]Bansal S, Germino M J. Carbon balance of conifer seedlings at timberline: relative changes in uptake, storage, and utilization. Oecologia, 2008, 158(2): 217–227
[4]Martinez-Vilalta J, Sala A, Asensio D, et al. Dynamics of non-structural carbohydrates in terrestrial plants: a global synthesis. Ecological Monographs, 2016, 86 (4): 495–516
[5]Allen C D, Macalady A K, Chenchouni H, et al. A global overview of drought and heat-induced tree mortality reveals emerging climate change risks for forests. Forest Ecology and Management, 2010, 259 (4): 660–684
[6]Hartmann H. Will a 385 million year-struggle for light become a struggle for water and for carbon?—How trees may cope with more frequent climate change-type drought events. Global Change Biology, 2011, 17(1): 642–655
[7]Mcdowell N, Pockman W T, Allen C D, et al. Mechanisms of plant survival and mortality during drought: why do some plants survive while others succumb to drought?. New Phytologist, 2008, 178(4): 719–739
[8]Hoch G, Richter A, Korner C. Non-structural carbon compounds in temperate forest trees. Plant Cell and Environment, 2003, 26(7): 1067–1081
[9]Chapin F S, Schulze E D, Mooney H A. The ecology and economics of storage in plants. Annual Review of Ecology and Systematics, 1990, 21: 423–447
[10]Hoch G. Cell wall hemicelluloses as mobile carbon stores in non-reproductive plant tissues. Functional Ecology, 2007, 21(5): 823–834
[11]Bonicel A, Haddad G, Gagnaire J. Seasonal-variations of starch and major soluble sugars in the different organs of young poplars. Plant Physiology and Bio-chemistry, 1987, 25(4): 451–459
[12]Sauter J J, Wellenkamp S. Seasonal changes in con-tent of starch, protein and sugars in the twig wood of Salix caprea L. Holzforschung, 1998, 52(3): 255–262
[13]Piper F I, Fajardo A. Carbon dynamics of Acerpseudoplatanus seedlings under drought and complete darkness. Tree Physiology, 2016, 36(11): 1400–1408
[14]Dietze M C, Sala A, Carbone M S, et al. Nonstruc-tural Carbon in Woody Plants. Annual Review of Plant Biology, 2014, 65: 667–687
[15]Liu H, Park Williams A, Allen C D, et al. Rapid warming accelerates tree growth decline in semi-arid forests of Inner Asia. Global Change Biology, 2013, 19(8): 2500–2510
[16]印婧婧, 郭大立, 何思源, 等. 内蒙古半干旱区树木非结构性碳、氮、磷的分配格局. 北京大学学报(自然科学版), 2009, 45(3): 519–527
[17]Li H, Hoch G, Körner C. Source/sink removal affects mobile carbohydrates in Pinus cembra at the Swiss treeline. Trees, 2002, 16(4): 331–337
[18]Buysse J, Merckx R. An improved colorimetric me-thod to quantify sugar content of plant-tissue. Journal of Experimental Botany, 1993, 44(10): 1627–1629
[19]Barbaroux C, Breda N. Contrasting distribution and seasonal dynamics of carbohydrate reserves in stem wood of adult ring-porous sessile oak and diffuse-porous beech trees. Tree Physiology, 2002, 22(17): 1201–1210
[20]Richardson A D, Carbone M S, Keenan T F, et al. Seasonal dynamics and age of stemwood nonstruc-tural carbohydrates in temperate forest trees. New Phy-tol, 2013, 197(3): 850–861
[21]Dickson R E. Carbon and nitrogen allocation in trees. Annales Des Sciences Forestieres, 1989, 46: S631–S647
[22]Landhausser S M, Lieffers V J. Seasonal changes in carbohydrate reserves in mature northern Populus tremuloides clones. Trees-Structure and Function, 2003, 17(6): 471–476
[23]Breda N, Huc R, Granier A, et al. Temperate forest trees and stands under severe drought: a review of ecophysiological responses, adaptation processes and long-term consequences. Annals of Forest Science, 2006, 63(6): 625–644
[24]Hartmann H, Ziegler W, Kolle O, et al. Thirst beats hunger-declining hydration during drought prevents carbon starvation in Norway spruce saplings. New Phytologist, 2013, 200(2): 340–349
[25]Dickman L T, Mcdowell N G, Sevanto S, et al. Carbohydrate dynamics and mortality in a pinon-juniper woodland under three future precipitation scenarios. Plant Cell And Environment, 2015, 38(4): 729–739
[26]潘庆民, 韩兴国, 白永飞, 等. 植物非结构性贮藏碳水化合物的生理生态学研究进展. 植物学通报, 2002, 19(1): 30–38
[27]Gaudet D A, Laroche A, Yoshida M. Low tempera-ture-wheat-fungal interactions: a carbohydrate con-nection. Physiologia Plantarum, 1999, 106(4): 437–444
[28]Kozlowski T T, Pallardy S G. Acclimation and adaptive responses of woody plants to environmental stresses. Botanical Review, 2002, 68(2): 270–334
[29]Fischer C, Holl W. Food reserves of scots pine (Pinus-sylvestris L.). 1. seasonal changes in the ca-rbohydrate and fat reserves of pine needles. Trees-Structure and Function, 1991, 5(4): 187–195
[30]Piispanen R, Saranpää P. Variation of non-structural carbohydrates in silver birch (Betula pendula Roth) wood. Trees, 2001, 15(7): 444–451
[31]Fajardo A, Piper F I, Pfund L, et al. Variation of mobile carbon reserves in trees at the alpine treeline ecotone is under environmental control. New Phyto-logist, 2012, 195(4): 794–802
[32]Sala A, Woodruff D R, Meinzer F C. Carbon dyna-mics in trees: feast or famine?. Tree Physiol, 2012, 32(6): 764–775
[33]Fajardo A, Piper F I, Hoch G. Similar variation in carbon storage between deciduous and evergreen treeline species across elevational gradients. Annuals of Botany, 2013, 112(3): 623–631
[34]Sala A, Mencuccini M. Ecosystem science: plump trees win under drought. Nature Climate Change, 2014, 4(8): 666–667
Seasonal Patterns and Their Determinants of Non-structural Carbohydrates in Different Tree Species at Xeric Timberline
Abstract To examine the seasonal patterns of non-structural carbohydrates (NSC) in different tree species and the roles of biotic (tree species) and abiotic (climate) factors on these patterns at xeric timberline, the authors monitored seasonal patterns of non-structural carbohydrates in four different tree species (Pinus sylvestris var. mongolica, Betula platyphylla, Populus simonii andLarix principis-rupprechtii) in southeastern Inner Mongolian Plateau of China. The results show that tree species with different foliar habit types have broadly similar seasonal non-structural carbohydrates (NSC) patterns (NSC concentration increased at the beginning of the growing season, and reduced in summer because of high growth rate, then increased slowly in the end), which suggests a climatic determination. Significant differences (p<0.05) in NSC concentrations are observed between four tree species. NSC concentration in birch is significant higher than that in pine, reproducing the pattern that deciduous species have higher NSC pool than ever green ones, which suggests a biotic determination. Due to the relatively drier climates, NSC concentration in larch and poplar turn to be lower than that in pine, implying a combined effect of both biotic and abiotic factors. The sugar and TNC (total non-structural carbohydrates) concentrations in leaf are significantly higher than those in stem, but the starch concentration in leaf is lower, which is consistent with the different roles of leaf and stem.
Key words non-structural carbohydrate (NSC); seasonal pattern; xeric timberline;Populus simonii; Pinus sylvestris var. mongolica; Betula platyphylla; Larix principis-rupprechtii
国家自然科学基金(41790422, 41530747)资助
收稿日期: 2018–04–12;
修回日期: 2018–05–07;
doi: 10.13209/j.0479-8023.2019.016
网络出版日期: 2019–03–22