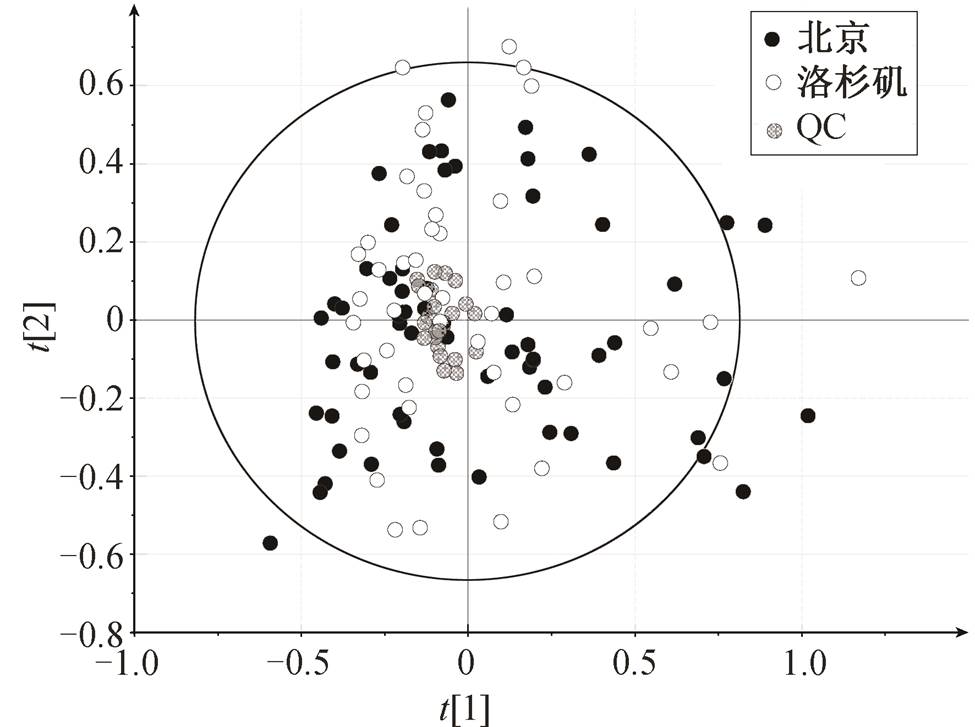
图1 基于GC-MS数据的PCA得分
Fig. 1 PCA score plot based on GC-MS data
摘要 采用定组设计, 以 14 名洛杉矶加州大学–北京大学交换学生为受试者, 建立基于气相色谱–质谱联用的尿液非靶向代谢组学方法, 采用包括(正交)偏最小二乘回归判别分析在内的多种统计方法识别差异物质, 并基于色谱–质谱信息进行结构鉴定。通过固定站点监测数据评价研究期间两地的大气污染物暴露, 采用混合效应线性模型探索污染物与指征氧化损伤的生物标志物间的关联。结果表明, 两地的暴露变化与人体能量代谢、氧化损伤、肠胃菌群、蛋白质与 RNA 代谢(可能涉及细胞凋亡)等通路变化之间可能存在关联, 受试者尿液中的尿囊素、胱氨酸和假尿嘧啶水平在北京显著上升。当以尿囊素作为指征机体急性氧化损伤的标志物时, 其变化与 0~96 小时的 PM2.5 、0~24 小时的 CO、24~48 小时的 NO2、48~72 小时的 O3 以及 24~72 小时的SO2 暴露有较强的相关性。结果表明北京与洛杉矶间大气污染物暴露的差异可能导致受试者体内氧化损伤负担发生变化, 同时体内可能产生抗氧化损伤的生理活动, 例如通过调动能量代谢通路抵御氧化还原失衡造成的氧化损伤负担。
关键词 代谢组学; 生物标志物; 氧化损伤; 大气污染物; 混合效应模型
近年来, 随着经济的快速发展和城市化进程的加快, 大气污染日益严重, 对人体健康造成的危害已经成为社会热点问题。根据最新全球疾病风险负担评估, 2013 年大气污染相关因素贡献的伤残调整生命年比例达到 3.1%, 逼近吸烟因素造成的危害[1], 表明大气污染物已成为影响人群健康的重要风险因子。国际癌症研究机构根据流行病学和毒理学的大量研究结果, 于 2013 年首次将大气颗粒物列为可导致肺癌的 I 类致癌物[2]。
流行病学与毒理学研究积累了大量关于大气污染物对人体可产生不良健康影响的统计学证据和毒理通路假说。流行病学研究虽然明确了大气污染物暴露与呼吸系统、心血管系统[3]以及癌症等疾病发生率和死亡率[4–5]相关, 但其选取的健康终点往往偏向慢性生理指征, 尚不足以描述环境污染物健康效应的实际机制, 尤其在早期生物学事件和急性效应方面。毒理学研究结果主要着眼于炎症和氧化损伤相关的通路, 研究方法主要通过动物或细胞实验进行短期高剂量暴露的毒理学实验, 其结论机制外推至人体的长期低剂量暴露时, 存在较大的不确定性。基于实际人群的真实大气污染物暴露的健康效应研究目前相对较少, 缺乏针对大气污染物的特异性生物标志物。
在现有大气污染物暴露的环境健康研究设计中, 常以职业暴露人员、动物实验和细胞实验为主, 且暴露剂量远高于真实大气。研究人员往往先验地设定健康效应靶点, 这种实验设计可能导致实验结果不显著, 预期效应特异性不强, 或局部指标对健康效应机制的讨论不够全面和系统。上述问题是环境健康研究领域的难点, 而基于人体生物样品的代谢组学方法为破解这些难题提供了一条可能的途径。
代谢组学通过检测环境污染物暴露刺激后人体内源性代谢物应答水平的变化, 从整体层面揭示机体对外界刺激的反应[6–7], 是研究污染物暴露早期健康效应的强力工具[8]。基于高通量高灵敏度的仪器分析技术, 非靶向代谢组学可以全面地反映所有代谢小分子的变化情况, 有利于发现与环境污染物暴露相关的早期生物学事件的标志物。
本研究将短期迁徙人群研究与定组研究相结合, 建立基于气相色谱-质谱联用仪(gas chromatogr aphy-mass spectrometry, GC-MS)技术的尿液代谢组学分析方法, 分析研究对象在洛杉矶和北京地区的尿液中内源性代谢物水平变化, 以评价受试者的健康状态。同时, 筛选识别与大气污染物暴露密切相关的代谢物作为潜在的生物标志物, 通过对这些标志物生物学意义的阐释, 探索大气污染物暴露的早期生物学效应。在识别的生物标志物基础上, 结合污染物浓度数据, 建立污染物暴露与健康效应生物标志物的定量联系。本研究有助于认识大气污染物的健康效应, 为污染物暴露人群的健康风险评价提供科学依据。
实验中所用的甲醇、水、异丙醇、氯仿和吡啶等溶剂购自美国 Thermo Fisher Scientific 公司, 均为色谱纯或类似级别。1%三甲基氯硅的 N-甲基-N-(三甲基硅烷基)三氟乙酰胺[N-methyl-N-(trimethyl-silyl)trifluoroacetamide with 1% Trimethylchlorosi-lane, MSTFA+1%TMCS]和甲氧胺盐酸盐等衍生试剂、C8–C30 脂肪酸甲酯和全氘代肉豆蔻酸等内标物质以及尿囊素和 L-胱氨酸等标准样品购自美国Sigma-Aldrich 公司, 纯度均大于 98%。脲酶(Type III, Jack bean, 34000U/g)亦购自 Sigma-Aldrich公司。
采用定组设计, 招募 14 名美国洛杉矶加州大学到北京大学的暑期交换学生为受试对象, 其中男性9 名, 女性 5 名, 年龄为 20~25 岁, 身体质量指数为17.0~25.8 kg/m2, 均不吸烟。受试者均被告知研究的具体流程和风险, 并签署知情同意书。研究经过洛杉矶加州大学和北京大学的伦理审批。
本研究涵盖的时间范围为 2014 年 6—11 月。第一次尿液样品采集在洛杉矶进行(6 月 9 日—13 日); 受试者于 6 月 15 日由洛杉矶前往北京, 在京期间进行 5 次尿液采样(分别在 6 月 30 日、7 月 14 日、7 月 28日、8 月 12 日和 8 月 26 日); 受试者于 9 月 15—18日返回洛杉矶, 之后进行 3 次尿液采样(分别在 10月 14 日, 10 月 22 日和 11 月 14 日)。使用聚丙烯离心管收集受试者中段晨尿约 10mL, 于-30ºC 冰箱 中冷冻保存, 待所有样品收集完成后统一进行分析。
分析前从冰箱中取出尿液样本, 室温下解冻。每个尿样以 3000r/min 离心 10 分钟以去除沉淀。取100μL 上清液于 EP 管中, 加入 50μL 脲酶溶液(含约100U 脲酶), 37ºC 孵育 1 小时以去除尿素。然后, 加入 700μL 冰甲醇淬灭酶反应并沉淀蛋白, 加入 50μL 300μg/mL 全氘代肉豆蔻酸作为内标。以 3000r/min 离心 10 分钟去除沉淀后, 将上清液转移到尖底小瓶中, 在真空离心浓缩仪中浓缩至干。加入 50μL 10mg/mL 的甲氧胺盐酸盐吡啶溶液, 并将反应小瓶放入 60ºC 恒温振荡器, 以 500r/min 振荡反应16 小时完成肟化反应, 然后加入 50μLMSTFA+1% TMCS, 并于 60ºC 恒温振荡器中以 500r/min 反应 3小时, 进行硅烷化反应。反应结束后降至室温, 取 50μL 衍生液加入 GC 进样小瓶, 加入 400μL 正己烷稀释, 并于 4 小时内进行分析。在 QC 样品中加入 C8–C30 的脂肪酸甲酯作为保留时间参考物质, 用于目标物质的辅助定性。
使用安捷伦 7890A-5975CGC-MS 进行样品分析。采用不分流进样, 进样口温度为 250ºC, 进样量为 1μL。载气为高纯氦气, 流速为 1.0mL/min。使用 30m 的 Rtx-5 色谱柱(内径 0.25mm, 膜厚 0.25μm)。升温程序如下: 初始温度 60ºC 保持 1min,以 10ºC/min 升温至 100ºC,以 5ºC/min 升温至145ºC,以2.5ºC/min 升温至 195ºC,以 8ºC/min 升温至 310ºC并保持 3min。质谱采用电子轰击电离(EI)源; 全扫描模式, 扫描质荷比范围为 50~600amu。
随机选取 6 个样品, 辅以 1 个质量控制(quality control, QC)样品和 1 个空白水样编为一组, 进行前处理。QC 样品制备方法: 从所有尿液样本(共 109例)各取 50μL 混合, 并以 100μL 分装。空白样品为纯水。根据所有 QC 样本评价实验结果的平行性。
将 GC-MS 谱图文件通过安捷伦工作站 Chem-Station 软件转换成 AIA 格式。在 R 软件(2.7.2 版)中运行 XCMS(1.21.1 版)、Biobase(2.0.1 版)和 Multtest(1.20.0 版)程序包, 运行 XCMS 的峰提取、峰对齐和峰匹配等程序, 进行峰的识别与提取, 即对所有 AIA 格式的谱图文件中可稳定重复测量的质谱峰的平均保留时间和峰面积等数据进行收集, 导出tsv 格式的高维数据阵列。数据提取的准确性经手动提取任意荷质比质谱峰面积进行验证。为避免实验中引入外来试剂信号以及不同样品浓度不同带来的含量变化, 在 Excel 2013 上进行必要的滤噪和归一化后, 最终获得含 109 个实际样本和 22 个 QC 样本的 csv 格式代谢物变量数据阵列, 并导入 SIMCA-P 13.0 软件(瑞典 Umetrics 公司)进行统计分析。
将含有荷质比、保留时间和丰度的三维数据阵列分别进行中心化(mean-centered)和标度化(unit va-riance)处理[9], 以消除各物质因数量级不同而导致统计权重发生变化。在多元统计分析中, 首先用无监督的主成分分析(principal component analysis, PCA)考察全部样本的代谢模式分布情况和可能的分组, 然后采用有监督的偏最小二乘判别分析(partial least squares discriminant analysis, PLS-DA)和正交偏最小方差判别分析(orthogonal projections to latent structures discriminant analysis, OPLS-DA), 进一步解析对分组贡献较大的变量, 尝试寻找最相关的差异代谢变量。为了验证模型的有效性, 采用与OPLS-DA 模型相同主成分数的 PLS-DA 模型进行7 次循环交互验证, 以保证模型没有过度拟合。
各变量的贡献使用变量权重(variable important in projection, VIP)衡量, 以 VIP>1.0 和变量与模型的偏相关系数(partial correlation, pcorr)大于 0.5 为阈值, 筛选差异的代谢物变量。差异代谢物变量的单维统计检验采用 Wilcoxon-Mann-Whitney 检验法, 以 p<0.05 作为在单维上有差异的标准。同时满足VIP>1.0, pcorr>0.5 和单维统计 p<0.05 的变量即为在统计学上表现显著性的差异代谢物。Wilcoxon-Mann-Whitney 检验在 SPSS 20.0 完成。
对于经过交互验证的差异代谢变量, 基于保留时间和质谱信息, 使用 NIST (National Institute of Standards and Technology)质谱数据库和 Feihn 代谢物数据库进行结构鉴定, 部分关键物质进一步通过相应的标准样品进行最终定性。
大气污染数据来自美国环保署的洛杉矶站点(北纬 34.067°, 西经 118.227°)和北京大学站点(北纬39.989°, 东经 116.302°), 包括细颗粒物即 PM2.5 质量浓度、CO、NO/NO2/NOX、SO2、O3 以及温度和相对湿度(RH)等, 时间分辨率均为 1 天。基于本研究重复测量的定组设计特点, 采用混合线性模型, 将大气污染物暴露水平与识别的健康效应指标进行关联。暴露效应关系采用单污染物模型:
Eij =α+β·Pollutantij +(α0j+β0j·Pollutantij +εij),
其中, Eij 表示第 i 个受试者在第 j 次随访中指示健康效应的生物标志物水平; α 为固定效应项, 代表大气污染物暴露原因之外的人群生物标志物的平均水平; α0j 为随机效应项, 代表人群生物标志物平均水平的变异和离散程度, 这种不确定性可能来自个体易感性和两地区的其他因素(饮食、行为及其他暴露差异); β 为固定效应项, 代表大气污染物暴露的效应参数; β0j 是随机效应项, 代表污染物暴露效应参数的变异和离散程度, 这种不确定性可能来自污染物浓度不同时健康效应机制不同; εij 为残差项; Pollutantij 代表第 i 个受试者在第 j 次随访中的污染物暴露值。该模型主要通过逐步引入随机效应项来解释残差, 进而对固定效应项进行更准确的估计。
利用 GC-MS 分析方法, 对北京地区(以下称“暴露组”)和洛杉矶地区(以下称“对照组”)的尿液衍生样品进行分析。如图 1 所示的主成分分析结果中, 所有 QC 样本的分布相对集中, 均在第一主成分和第二主成分的 2 个标准差以内(2SD 第一主成分=0.657t[1], 2SD 第二主成分=0.532t[2]), 说明样本前处理和 GC-MS分析性能良好且稳定, 观测到的样本间代谢物差异主要来自样本自身。
为获得最显著的组间分离效果[10], 采用 OPLS-DA 模型进行有监督的统计分析, 结果如图 2 所示。北京与洛杉矶样本的分离效果良好, 模型中26.8%的变量(R2X)可解释暴露与对照组之间 65.5%的差异(R2Y), 其中第一主成分 3.9%的变量可用于解释暴露与对照组之间 15.5%的差异。经过交叉有效性验证后, 模型的评价预测能力为 32.4%(Q2cum), 小于 50%, 表明模型的预测能力有待提高。

图1 基于GC-MS数据的PCA得分
Fig. 1 PCA score plot based on GC-MS data
在 PLS-DA 统计模型中, 采用 V-plot 获取模型偏相关性 pcorr>0.5 和分组贡献权重较大(VIP>1)的变量。对这些变量进行辅助统计分析, 在单维统计上以 Wilcoxon-Mann-Whitney 检验的 p<0.05 为标准加以验证, 从而确定最终的差异变量, 结果如表 1 所示。共筛选出 20 组含特征荷质比信息的差异代谢变量, 通过 NIST 标准质谱库和 Feihn 代谢物数据库, 定性出其中 13 种差异代谢物, 其中重要的尿囊素和胱氨酸通过标准品进行最终确认。
本研究筛选识别了与氧化损伤相关的差异代谢物尿囊素和 L-胱氨酸, 同一受试者二者的浓度丰度之间的相关系数为 0.71(p<0.05, Pearson 相关; 浓度数据经对数转化), 相关性较高。北京的尿样中尿囊素和 L-胱氨酸丰度均显著高于洛杉矶(p<0.05), 说明被试人群在北京地区时的氧化损伤负担比洛杉矶地区大。
如图 3(a)所示, 尿囊素的前体物尿酸在体内经自由基氧化转变为尿囊素[11–13]。作为嘌呤的最终代谢产物, 尿酸是生命体液中的一种常见组分。与其他动物相比, 人类和高等灵长类体液中的尿酸浓度较高, 这种现象源于进化中的基因沉默[14]。基于本身的还原能力和体液中的较高浓度, 尿酸贡献了人体体液中 35%~65%的抗氧化能力[15], 是人类和高等灵长类体内重要的抗氧化物质。有研究表明, 尿囊素浓度独立于尿酸水平[16], 这表明尿囊素不受身体内严密的生化负反馈调节, 只经过自由基氧化生成, 在体内不可逆地还原为尿酸。尿囊素的物质性质相对稳定, 受解冻、制备和储存等过程的影响较小, 逐渐作为新兴的氧化损伤标志物进入研究者的视野[17–18]。因此, 尿液中的尿囊素浓度在一定程度上反映人体内自由基氧化损伤的负担程度。
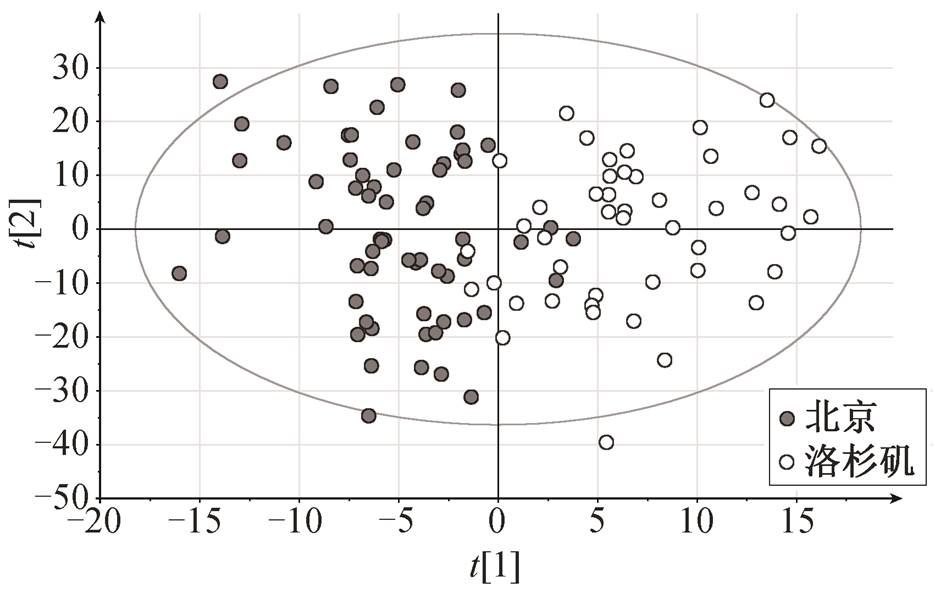
图2 基于GC-MS数据的OPLS-DA得分
Fig. 2 OPLS-DA score plot based on GC-MS data
表1 代谢组学鉴定结果
Table 1 Metabonomics identification results

保留时间/minm/z非参检验的p值VIP北京与洛杉矶相比定性结果 11.44174, 2480.011.31↑L-甘氨酸a 12.76204, 218, 2780.0051.41↑L-丝氨酸a 14.463210.0011.19↑NI 16.58189, 205, 217, 307, 3200.0051.33↑L-苏糖醇a 17.531820.0013.66↑NI 19.97164, 179, 232, 281, 2960.031.69↑4-羟基苯乙酸a 23.042960.051.5↑NI 23.42129, 189, 204, 2770.011.57↑木糖醇a 26.54105, 206, 2360.0012.14↓马尿酸a 27.572180.061.58↓3-甲基-3-组氨酸a 28.89431, 4460.0021.56↑尿囊素b 30.993330.021.33↑NI 33.84268, 342, 3700.0032.01↑胍基琥珀酸a 34.15191, 305, 318, 3930.021.81↓肌醇a 38.283410.0011.2↑硬脂酸a 39.51146, 266, 4110.011.9↑L-胱氨酸b 40.34217, 357, 4240.031.3↑假尿嘧啶a 43.884630.031.59↑NI 43.93259, 349, 4370.011.43↑蔗糖a 50.554080.0013.48↑NI
注: a表示利用NIST和Feihn数据库进行匹配结果; b表示在数据库匹配的基础上, 利用标准样品进行最终验证; NI表示未能定性的物质。
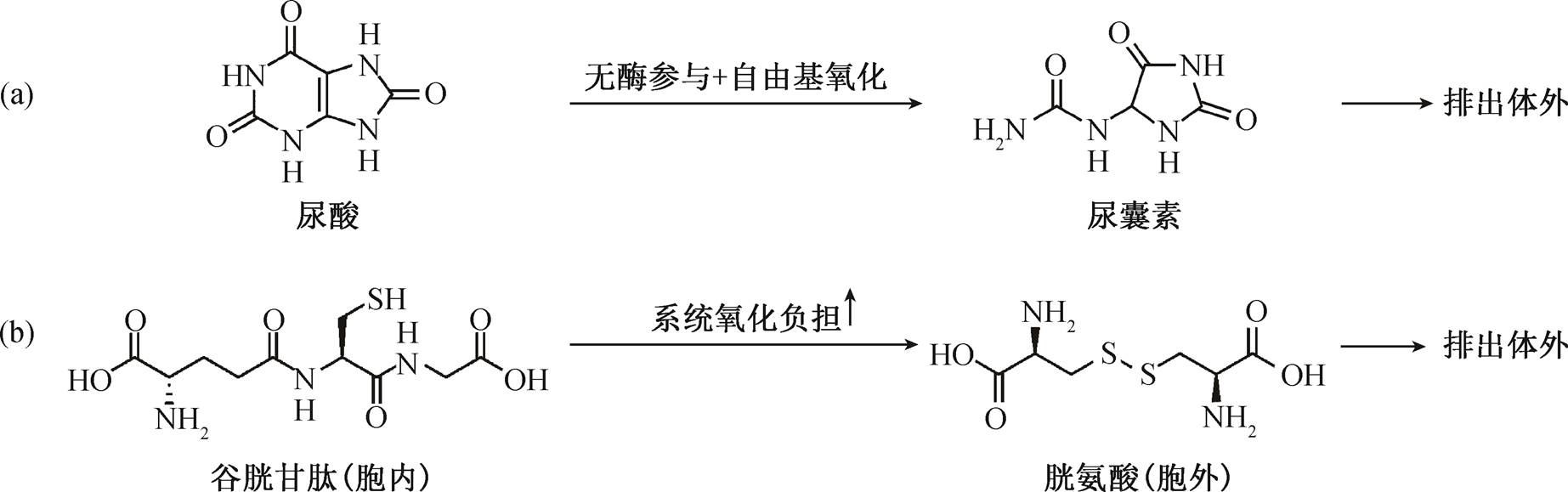
图3 两条重要的转化通路——尿酸经自由基氧化转变为尿囊素(a)以及谷胱甘肽转化为L-胱氨酸形式(b)并排出体外
Fig. 3 Two important transformation pathways in human body — transformation of uranic acid transformed into allantoin through free radical oxidation (a) and transformation of Glutathione to L-Cystine, which could be excreted by L-Cystine (b) in vitro
L-胱氨酸是人体含硫氨基酸代谢通路的重要组成部分, 是半胱氨酸和谷胱甘肽排出体外的主要形式。人体的硫醇/二硫化平衡主要由胞外的半胱氨酸/胱氨酸(Cysteine/Cystine, CyS/CySS)和胞内的谷胱甘肽/谷胱甘肽氧化型构成(Glutathione/ Gluta-thione Oxidized, GSH/GSSG), 半胱氨酸经血液循环被转运至各个器官和细胞[19], 完成对蛋白质的维持和修复工作[20], 在肝脏以谷胱甘肽的形式储存[21–23], 并参与体液的氧化还原调控。在氧化损伤负担升高时, 肝脏会释放谷胱甘肽进行还原调节[24]。人体的硫醇/二硫化平衡能够反映体内的氧化还原状态以及氧化损伤负担情况, 氧化损伤负担影响细胞表面相关蛋白的氧化还原状态, 从而影响蛋白质的功能, 最终导致细胞的功能发生变化, 进而引发细胞增殖和凋亡[25]。半胱氨酸和胱氨酸比例在胞内外不同, 其跨膜转运由相关转运蛋白调控。如图 3(b)所示, 从胞内到胞外, 从体内到体外, 胱氨酸的相对含量逐渐升高, 半胱氨酸的相对含量逐渐降低[26]。因此, 尿液中较高的胱氨酸浓度在一定程度上反映人体内氧化损伤的负担程度。
能量代谢通路是重要的次级代谢通路之一。尿液中能量代谢相关的差异代谢物包括氨基酸类物质(L-甘氨酸和 L-丝氨酸)、糖类和多元醇类(肌醇、苏糖醇、木糖醇和蔗糖等)等。除了合成蛋白质之外, 氨基酸还可以通过转氨作用脱掉 α-氨基生成有机酸, 在分解代谢后作为三羧酸循环的底物而提供能量来源[27]。糖类和多元醇类物质是能量循环中重要的底物, 作为戊糖的代表, 木糖醇的变化意味着可能涉及戊糖磷酸化途径, 其通路的激活与烟酰胺腺嘌呤二核苷酸磷酸(Nicotinamide Adenine Dinu-cleotide Phosphate, NADPH)的生成直接相关[27]。暴露组样品中, 上述物质含量的变化可能意味着能量代谢通路受到影响, 但也不排除来自饮食的影响。
假尿嘧啶是一种修饰核苷, 常见于 Trna (Trans-fer Ribonucleic Acid)和核糖体中。由于假尿嘧啶从RNA 中降解游离后不能重复用于 RNA 合成[28], 因此是监测 RNA 降解的标志物, 也常用于估计蛋白和细胞的更迭量[29–30], 即细胞增殖和凋亡的总和。假尿嘧啶与运动中劳损产生的细胞损伤和蛋白质分解有关[31]。3-甲基组氨酸主要分布在肌肉蛋白中, 在肌肉分解时, 和其他氨基酸一同释放, 但 3-甲基组氨酸无法与 tRNA 结合, 所以不再参与蛋白质合成, 可以作为肌肉蛋白分解的指标[32]。本研究中假尿嘧啶与 3-甲基组氨酸的变化趋势相反, 可以推断RNA 的更迭可能与运动无关, 而是反映了细胞的凋亡情况。
此外, 对羟基苯乙酸和马尿酸均为指示肠胃菌群功能的代谢物, 这两种代谢产物的变化表明, 在北京和洛杉矶不同的环境下, 被试者肠胃菌群可能受饮食或其他环境因素的影响而发生变化。
对上述结果进行总结, 如图 4 所示, 本研究发现的差异代谢物主要涉及能量代谢、蛋白质代谢、肠胃菌群和氧化损伤等生物学信息通路。代谢组学假说可能基于如下过程展开: 洛杉矶与北京的大气污染物暴露不同, 可能导致被试者体内氧化损伤负担发生变化, 进而导致体内细胞的生存状态发生一定的改变, 部分细胞在氧化损伤的冲击下凋亡, 同时体内产生抗氧化损伤的生理活动, 例如通过调动能量代谢通路抵御氧化还原失衡造成的氧化损伤负担; 同时饮食和环境的变化也可能改变被试者的共生肠胃菌群生存状态和涉及能量代谢通路的营养物质摄入。
如上所述, 本研究发现受试者在北京和洛杉矶的急性氧化损伤负担存在差异。为了考察氧化损伤标志物与大气污染物暴露的潜在关联性, 我们建立了尿样采集前 0~4 天(效应滞后天数)的站点监测数据与尿囊素丰度的混合线性效应模型, 将完成至少6 次随访的受试者纳入模型。在该模型中, 污染物浓度经过标准化转化为标准 Z 值(Z-score), 尿囊素丰度亦经对数化处理以实现正态分布。模型选用共5 天的环境数据, 以便考察急性效应因变量(对数化尿囊素丰度)与不同污染物种自变量(污染物标准化浓度)和时间(效应滞后天数)的相关性, 其中固定效应部分为污染物暴露效应斜率参数 β 乘以污染物物种自变量和常数项人群平均水平 α, 随机效应的变异和离散程度来源限定为北京和洛杉矶的大气环境差异、个体间差异和污染物浓度, 结果如图 5 所示。
在该模型中采用暴露前 0~4 天的污染物浓度的标准Z值与对数化尿囊素丰度建立相关关系。从混合线性效应模型中可以看出, 尿囊素与 0~96 小时的 PM2.5 暴露关系紧密; 与 24 小时之内的 CO 暴露、24~48 小时的 NO2 暴露、48~72 小时的 O3 暴露以及 24~72 小时的 SO2 暴露也有较强的相关性, 且各污染物与氧化损伤均表现出正效应或正边际效应。该模型在一定程度上反映了大气环境污染物与急性系统氧化损伤存在可能的时间效应关系和成分效应关系。但是, 需要指出, 由于污染物处于混合状态, 部分相关性可能来自自变量之间的共线性。
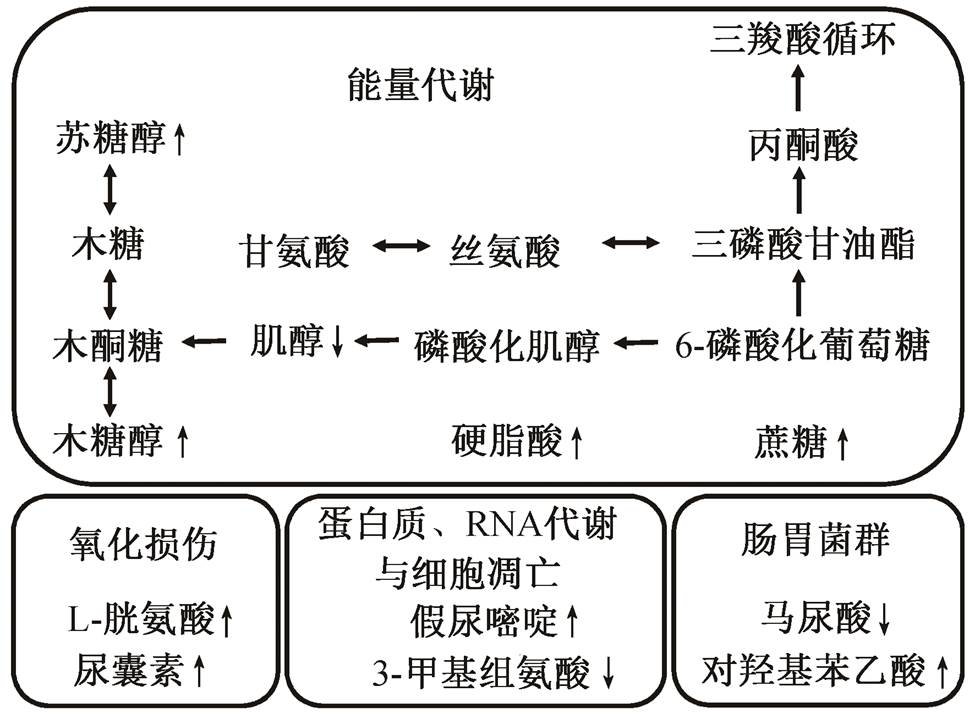
图4 大气污染物导致代谢通路变化的机制假设
Fig. 4 A proposed mechanism on altered metabolic pathways in response to air pollutants
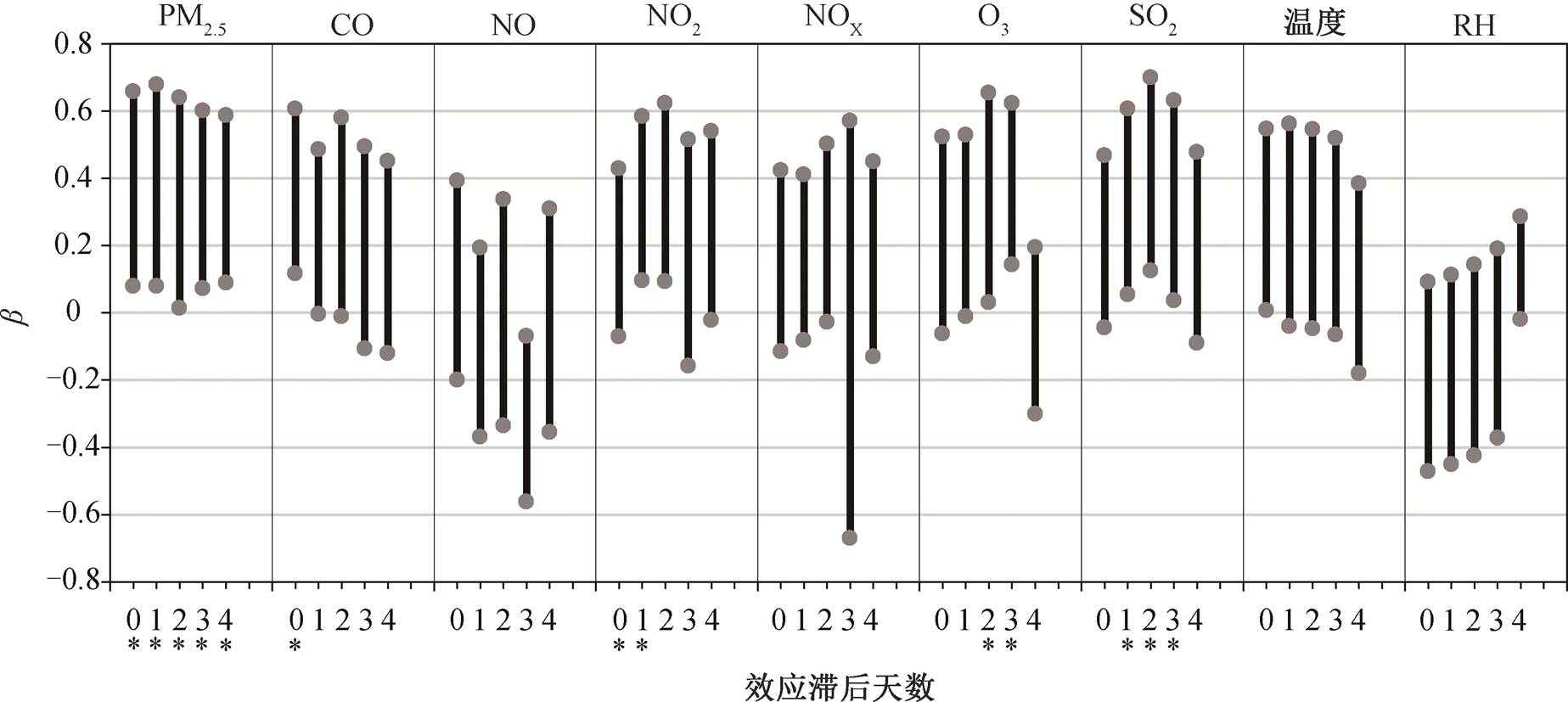
*表示β>0且p<0.05
图5 不同污染物在不同暴露时间窗的氧化损伤效应强度
Fig. 5 Oxidation damage effect intensity of different pollutants at different exposure time windows
本文以真实迁徙人群为研究对象, 建立基于GC-MS 的尿液代谢组学分析方法, 分析人群尿液中内源性代谢物水平在洛杉矶和北京的变化, 探索大气污染物暴露的早期生物学效应,建立污染物暴露与健康效应生物标志物的定量联系, 得到如下结论。
1)检出尿液中 13 种差异代谢物, 包括苏糖醇、木糖醇、蔗糖、甘氨酸、丝氨酸、硬脂酸、肌醇、3-甲基组氨酸、假尿嘧啶、尿囊素、胱氨酸、马尿酸和对羟基苯乙酸等。这些差异代谢物与人体能量代谢、氧化损伤、肠胃菌群、蛋白质与 RNA 代谢等通路变化有关, 其中指征机体氧化损伤的尿囊素和 L-胱氨酸水平在北京显著上升。
2)当以尿囊素为指征机体急性氧化损伤的标志物时, 其变化与 0~96 小时的 PM2.5 暴露、0~24 小时的 CO 暴露、24~48 小时的 NO2暴露、48~72 小时的 O3 暴露以及 24~72 小时的 SO2 暴露有较强的相关性。
致谢 感谢北京大学-洛杉矶加州大学理工联合研究所(JRI)对本研究给予的支持。
参考文献
[1]Forouzanfar M H, Alexander L, Anderson H R, et al. Global, regional, and national comparative risk assess-ment of 79 behavioural, environmental and occupa-tional, and metabolic risks or clusters of risks in 188 countries, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013. The Lancet, 2015, 386: 2287–2323
[2]Loomis D, Grosse Y, Lauby-Secretan B, et al. The carcinogenicity of outdoor air pollution. Lancet Onco-logy, 2013, 14(13): 1262–1263
[3]Peters A, Dockery D W, Muller J E, et al. Increased particulate air pollution and the triggering of myocar-dial infarction. Circulation, 2001, 103(23): 2810–2815
[4]Dockery D W, Pope C A, Xu X, et al. An association between air pollution and mortality in six US cities. New England Journal of Medicine, 1993, 329(24): 1753–1759
[5]Pope III C A, Thun M J, Namboodiri M M, et al. Particulate air pollution as a predictor of mortality in a prospective study of US adults. American Journal of Respiratory and Critical Care Medicine, 1995, 151(1): 669–674
[6]Nicholson J K, Lindon J C, Holmes E. “Metabo-nomics”: understanding the metabolic responses of li-ving systems to pathophysiological stimuli via mul-tivariate statistical analysis of biological NMR spec-troscopic data. Xenobiotica, 1999, 29(11): 1181–1189
[7]Nicholson J K, Connelly J, Lindon J C, et al. Meta-bonomics: a platform for studying drug toxicity and gene function. Nature reviews. Drug Discovery, 2002, 1(2): 153–161
[8]Bundy J G, Davey M P, Viant M R. Environmental metabolomics: a critical review and future perspec-tives. Metabolomics, 2009, 5(1): 3–21
[9]Bijlsma S, Bobeldijk I, Verheij E R, et al. Large-scale human metabolomics studies: a strategy for data (pre-) processing and validation. Analytical Chemis-try, 2006, 78(2): 567–574
[10]Wagner S, Scholz K, Sieber M, et al. Tools in meta-bonomics: an integrated validation approach for LC-MS metabolic profiling of mercapturic acids in human urine. Analytical Chemistry, 2007, 79(7): 2918–2926
[11]Grootveld M, Halliwell B. Measurement of allantoin and uric acid in human body fluids: a potential index of free-radical reactions in vivo?. Biochemical Jour-nal, 1987, 243(3): 803–808
[12]Kaur H, Halliwell B. Action of biologically-relevant oxidizing species upon uric acid: identification of uric acid oxidation products. Chemico-Biological Interac-tions, 1990, 73(2/3): 235–247
[13]Halliwell B, Whiteman M. Measuring reactive species and oxidative damage in vivo and in cell culture: how should you do it and what do the results mean?. Bri-tish Journal of Pharmacology, 2004, 142(2): 231–255
[14]Wu X W, Lee C C, Muzny D M, et al. Urate oxidase: primary structure and evolutionary implications. Pro-ceedings of the National Academy of Sciences of the United States, 1989, 86(23): 9412–9416
[15]Ames B N, Cathcart R, Schwiers E, et al. Uric acid provides an antioxidant defense in humans against oxidant-and radical-caused aging and cancer: a hypo-thesis. Proceedings of the National Academy of Sci-ences of the United States, 1981, 78(11): 6858–6862
[16]Kand'ár R, Žáková P, Mužáková V. Monitoring of antioxidant properties of uric acid in humans for a consideration measuring of levels of allantoin in plasma by liquid chromatography. Clinica Chimica Acta, 2006, 365(1): 249–256
[17]Berthemy A, Newton J, Wu D, et al. Quantitative determination of an extremely polar compound allan-toin in human urine by LC-MS/MS based on the se-paration on a polymeric amino column. Journal of Pharmaceutical and Biomedical Analysis, 1999, 19 (3): 429–434
[18]Tolun A A, Zhang H, Il’yasova D, et al. Allantoin in human urine quantified by ultra-performance liquid chromatography–tandem mass spectrometry. Analyti-cal Biochemistry, 2010, 402(2): 191–193
[19]Ganapathy V, Ganapathy M E, Leibach F H. Intestinal transport of peptides and amino acids. Current Topics in Membranes, 2000, 50: 379–412
[20]Jones D P, Carlson J L, Mody V C, et al. Redox state of glutathione in human plasma. Free Radical Biology and Medicine, 2000, 28(4): 625–635
[21]Fukagawa N K, Ajami A M, Young V R. Plasma methionine and cysteine kinetics in response to an intravenous glutathione infusion in adult humans. American Journal of Physiology-Endocrinology and Metabolism, 1996, 270(2): E209–E214
[22]Raguso C A, Ajami A M, Gleason R, et al. Effect of cystine intake on methionine kinetics and oxidation determined with oral tracers of methionine and cysteine in healthy adults. The American Journal of Clinical Nutrition, 1997, 66(2): 283–292
[23]Raguso C A, Regan M M, Young V R. Cysteine kine-tics and oxidation at different intakes of methionine and cystine in young adults. The American Journal of Clinical Nutrition, 2000, 71(2): 491–499
[24]Stipanuk M H. Sulfur amino acid metabolism: path-ways for production and removal of homocysteine and cysteine. Annual Review of Nutrition, 2004, 24: 539–577
[25]Go Y M, Jones D P. Cysteine/cystine redox signaling in cardiovascular disease. Free Radical Biology and Medicine, 2011, 50(4): 495–509
[26]Park Y, Ziegler T R, Gletsu-Miller N, et al. Postpran-dial cysteine/cystine redox potential in human plasma varies with meal content of sulfur amino acids. The Journal of Nutrition, 2010, 140(4): 760–765
[27]Xia K, He X, Dai Q, et al. Discovery of systematic responses and potential biomarkers induced by ochra-toxin: a using metabolomics. Food Additives Con-taminants: Part A, 2014, 31(11): 1904–1913
[28]Weissman S, Eisen A Z, Lewis M, et al. Pseudouri-dine metabolism III. Studies with isotopically labe-led pseudouridine. The Journal of Laboratory and Cli-nical Medicine, 1962, 60(1): 40–47
[29]Sander G, Hülsemann J, Topp H, et al. Protein and RNA turnover in preterm infants and adults: a compa-rison based on urinary excretion of 3-methylhistidine and of modified one-way RNA catabolites. Annals of Nutrition and Metabolism, 1986, 30(2): 137–142
[30]Schöch G, Topp H, Held A, et al. Interrelation be-tween whole-body turnover rates of RNA and pro-tein. European Journal of Clinical Nutrition, 1990, 44 (9): 647–658
[31]Chorell E, Moritz T, Branth S, et al. Predictive meta-bolomics evaluation of nutrition-modulated metabolic stress responses in human blood serum during the early recovery phase of strenuous physical exercise. Journal of Proteome Research, 2009, 8(6): 2966– 2977
[32]Tashiro T. Contribution by skeletal muscle to whole-body protein catabolism in critical illness: usefulness of urinary 3-methylhisitidine excretion. Nutrition, 1998, 14(9): 708–710
A Preliminary Metabolomics Study on Air Pollution Associated Acute Biomarkers of Health Effect Based on a Migration Panel between Los Angeles and Beijing
Abstract A panel study was conducted between Los Angeles and Beijing with 14 healthy young subjects of exchange students from University of California Los Angeles. Urine samples were collected repeatedly and analyzed with a metabolomics approach based on gas chromatography-mass spectrometry (GC-MS) to investigate the markers of early biological response. Multivariate statistical analyses were applied to screen the significantly changed metabolites, which were further identified based on GC-MS signals. Meanwhile, concentrations of ambient air pollution in the communities where subjects lived were cited from monitoring stations, and a linear mixed-effects model was used to estimate the association between oxidative damage biomarkers and concentration of gaseous pollutants and PM2.5. The results indicated that these discriminating metabolites between Los Angeles and Beijing were related to energy metabolism, oxidative damage, gastrointestinal flora, metabolism of protein and RNA (such as cell apoptosis). Effect of oxidative damage especially stood out in Beijing, with allantoin as well as L-cystine and pseudouridine as significantly changed biomarkers. The results also showed a potential positively association between allantoin and PM2.5 in prior 0–96 h, CO in prior 0–24 h, NO2 in prior 24–48 h, O3 in prior 48–72 h, and SO2 in prior 24–72 h. These evidences might suggest that the different pollution between Los Angeles and Beijing could change the oxidative burden, and body might relieve this burden through energy metabolism in return.
Key words metabolomics; biomarkers; oxidative damage; ambient air pollution; mixed-effects model
国家自然科学基金(41561144007)和国家重点基础研究发展计划(2015CB553401)资助
收稿日期: 2018–04–09;
修回日期: 2018–05–18;
doi: 10.13209/j.0479-8023.2019.014
网络出版日期: 2019–03–18