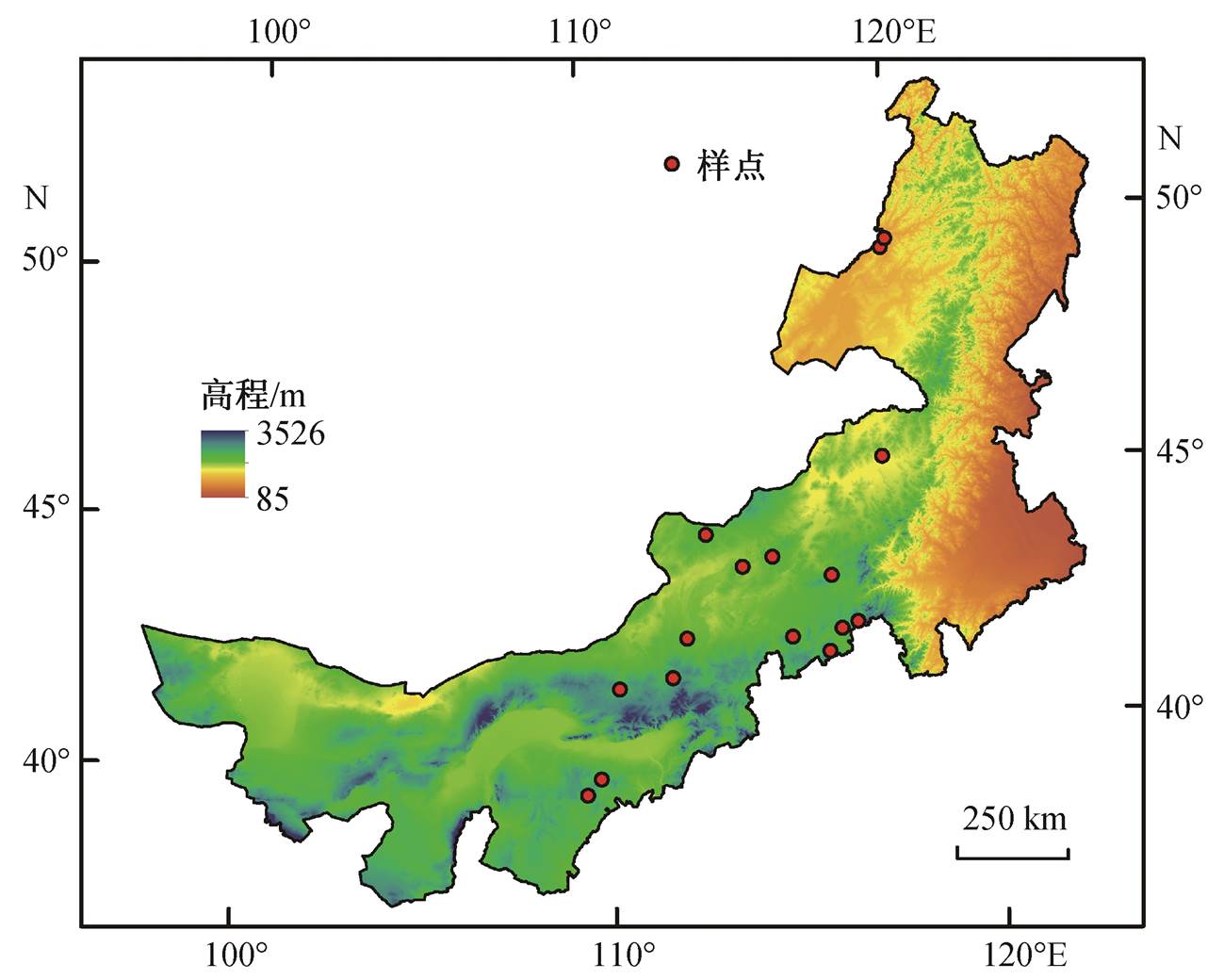
图1 研究样点的空间分布
Fig. 1 Locations of the sampling sites
摘要 在内蒙古草原沿水分梯度选择 16 个样点, 测定 22 种优势植物根的形态和构型属性, 分析 6 种植物根属性(直径、根长、比根长、组织密度、分支强度和分支比)的变异及其对 4 种环境因子(年均降雨量、年均温、土壤含碳量和土壤含氮量)的响应规律。结果表明: 1)不同物种间吸收根直径、组织密度和比根长的变异为 7, 9 和 15 倍, 根直径与侧根长度显著正相关, 与分支强度负相关; 2)吸收根和非吸收根对降水和土壤氮的适应方式具有明显的种间效应, 当利用不同根系属性组合刻画植物适应策略时, 由于随着环境变化, 不同物种根属性产生变异的程度和方向各不相同, 从而形成多样性的植物适应策略。
关键词 根功能属性; 生态策略; 多样性; 物种共存; 温带草原
根功能属性的种间和种内变异性是理解物种共存及生态策略的基础。在多样的环境中, 如果共存于同一群落不同物种间根的属性变异较大, 就能形成多样或互补性的资源获取策略, 从而降低竞争强度, 促进物种共存[1–2]。根功能属性的种内变异(即根的可塑性)是植物适应环境变化的重要方式,变异的大小和方向代表不同物种适应资源供应的能力, 决定物种的环境适应性及地理分布格局[3–5]。例如, 在温带草原, 根分支强度变异较大的物种能够更好地应对干旱, 因而在区域尺度上具有更广的空间分布[6]。植物根属性的种间和种内变异对预测植物空间分布至关重要[4,6–8]。
植物根有多级分枝系统, 不同级别的根系在形态和功能方面有很大的差异[9–11], 吸收细根是植物获取水分和养分资源的主要器官[10]。寿命长的森林木本物种根系至少有 5 个级别, 按功能模块研究根属性是较常用的研究方法[12]。对于寿命较短的草本植物, 如何划分根系模块是悬而未决的问题。通常认为, 一年生草本植物大多缺乏木质化次生结构, 而多年生的草本根可能具有木质化的构造[13]。目前, 大多数研究用单一形态指标(直径小于 1 或2mm)来区分吸收根[14], 忽略了不同物种、不同级别根系结构和功能上的异质性[9]。由于缺乏大尺度可对比的草本植物根属性数据, 使得人们对草本物种间、不同环境条件下根属性种内变化的基本格局和规律的理解缺乏深度。
本文按森林研究中的根功能划分单元, 将草原植物的一级和二级根归为吸收根, 主要执行资源的获取和吸收功能; 将三级根和四级根归为非吸收根, 主要执行资源运输、根结构支撑的功能[9]。本文按水分梯度在内蒙古草原设置 16 个样点, 以每个样点的优势物种为研究对象, 测定每个物种的根形态和构型属性, 旨在理解内蒙古草原区域尺度上不同物种的吸收根和非吸收根功能属性的种间变异, 同时探索同种植物的关键根功能属性对环境因子的响应规律, 进而揭示内蒙草原植物的物种养分获取策略和环境适应策略的多样性。
研究区域位于中国内蒙古自治区内(107°57′—119°23′E, 38°58′—50°10′N), 为温带大陆性季风气候。温度变化剧烈, 降水量少且分布不均, 光照强烈。研究区自东向西年均温从–4℃递增至 8℃, 降雨量由 450 mm 递减至 150 mm, 区内草原类型自西向东依次是荒漠草原、典型草原和草甸草原, 土壤类型自东北向西南依次为黑钙土、栗钙土和棕钙土[15]。
1.2.1 样地设置
本研究在内蒙古自治区内按降水梯度由东向西、由北向南设置 16 个样点(图 1 和表 1), 采集每个样点的优势物种, 整个区域共计 22 种不同的物种。我们从 22 个优势物种中选择分布在不同群落中的 5 个区域共有种——冷蒿(Artemisia frigida)、羊草(Leymus chinensis)、黄囊苔草(Carex korshinskvi)、冰草(Agropyron cristatum)和糙隐子草(Cleistogenes squarrosa)作为研究对象, 探讨这 5 个共有种的根系属性随环境因子的变化。冷蒿分布在苏尼特右旗、苏尼特左旗、四子王旗、阿巴嘎旗、正白旗、东胜和多伦县, 年均降雨量为 198~389mm; 黄囊苔草分布的样地为苏尼特左旗、阿巴嘎旗、东乌旗、八大关、多伦县和坝上, 年均降雨量为 223~433mm; 羊草分布在阿巴嘎旗、正白旗、东乌旗、伊金霍洛旗、额尔古纳旗、八大关、东胜和多伦县, 年均降雨量为 249~389mm; 冰草分布在苏尼特左旗、阿巴嘎旗、正白旗、锡林浩特和多伦县, 年均降雨量为 223~389mm; 糙隐子草分布在四子王旗、东乌旗和额尔古纳旗, 年均降雨量为227~368 mm。

图1 研究样点的空间分布
Fig. 1 Locations of the sampling sites
表1 16个样地的经纬度、气候特征及土壤理化性质
Table 1 Latitude and longitude, climatic and soil characteristics of the sixteen study sites

样点经度纬度年均温/ºC年均降雨量/mm土壤N含量/(g·m–2)土壤C含量/(g·m–2) 阿巴嘎114°56.81′44°01.99′124914.12126.93 八大关119°12′25.26″49°59′53.48″–236830.25 65.13 坝上117°08′45.56″42°33′54.43″0.643344.87 37.27 达茂110°25.09′41°36.97′4 26216.62 103.34 东胜109°48.17′39°50.80′6 38219.40 195.98 东乌118°24′44.88″45°47′24.78″0.6327 32.34 195.95 多伦A116°17′42°02′1389 13.02 118.46 多伦B116°40.79′42°27.98′0.6390 46.99 52.08 额尔古纳119°22′53.04″50°10′–2368 31.01 78.31 四子王111°53.93′41°46.62′4 22714.39 175.13 苏尼特右旗112°21.59′42°32.93′41987.10160.84 苏尼特左旗A113°06.92′44°35.43′120418.39 115.94 苏尼特左旗B114°04.23′43°53.38′2223 10.11 77.61 锡林浩特116°33.16′43°32.43′2329 21.33 80.95 伊金霍洛旗109°24.82′39°31.83′73578.82 124.65 正白115°17.20′42°23.67′3326 17.32 133.93
1.2.2 取样方法与数据测定
1) 植物根功能属性。对植株整体进行采集, 将植株下的土块整体挖出, 小心地除去根部的大块土壤, 在去离子水中清洗干净后, 将地下部分置于封口袋中, 放入–20℃冰箱冷冻保存。
在实验室, 洗去附着在根系上的浮土和杂质, 然后置于盛有去离子水的玻璃皿中, 按根序划分方法, 使用镊子对细根部分进行截断, 以便划分不同分支等级[10–11]进行测定。
根据木本植物定义, 认为具有较大潜在吸收功能和较高侵染率的前两级根是吸收根, 这类根缺乏次生生长, 具有完整的皮层组织, 较低的木栓化; 而吸收运输根的级别较高, 具有较大的中柱和直径比例, 发育完全的木质部导管, 次生发育完全, 高度木栓化, 周皮发育显著。
使用 Epson 数字化扫描仪(Expression10000)对划分类别后的各级个体根分别进行扫描, 然后用配套的 WinRHIZO (pro2004b)根系图像分析软件测定各级根的直径和根长。对扫描后的各级根单根数目进行人工计数后, 放入 45℃烘箱烘干 72 小时, 取出后称重, 并计算比根长和组织密度指标。对不同分支等级进行人工计数, 以便计算分支强度(n 级根的数量/n+1 级根的总长度)和分支比(n 级根的数量/n+1 级根的数量)这两种根构型指标。
2)土壤采样与数据测定。每块样地取 0~60cm深度的 3 个点, 0~20cm 深度内每 5cm 取一个土样, 20~60cm 深度内每 10cm取一个土样, 对所有样品先用 2mm 孔径的筛子筛出植物根系后, 再将土壤样品混合均匀。带回实验室后风干研磨, 过 0.15mm 孔径的筛, 然后使用元素分析仪(Elementar, Hanau, Germany)测定土壤全碳和全氮[16]。由于不同地区土壤密度的异质性非常大, 为了更准确地表征样地间土壤养分总量的差异, 本文将土壤碳氮浓度与土壤密度(土壤密度为原位土壤质量除以土壤体积)相乘, 得到 1m2内 0~20 cm 土层中的 C 和 N 的总含量。
3)气象数据。从中国气象局获取研究区各个气候监测站点多年的温度数据和降雨数据, 应用ArGIS 软件中的 Kriging 插值法, 计算年均降雨量(MAP)和年均温(MAT)。
对物种吸收根的每一个属性, 都计算其均值、最大值、最小值和变异系数(coefficient of variation, CV)。对物种根属性间的相关性、根属性与环境因子(年均降雨量、年均温、土壤碳含量和土壤氮含量)间的相关性, 采用 Pearson 相关分析法性进行分析。所有作图均对数值进行 log 转化后, 使用线性回归方法完成。上述数值分析皆使用 SPSS 23.0, 作图由 R 软件完成。
通过对比 22 个草原优势物种的根属性变化, 我们发现吸收根属性中, 直径变异达 67.52%, 最细的是旋花科的银灰旋花(Convolvulus ammannii)和莎草科的黄囊苔草(Carex korshinskvi), 直径为 0.09mm, 最粗的是石蒜科的细叶葱(Allium tenuissimum),直径为 0.58mm (图 2), 二者相差约 7 倍。单根长最小值(0.12cm, 黄囊苔草)与最大值(3.95cm, 细叶葱)相差 34 倍(表 2)。不同物种间的比根长变异为 74%, 从最小的物种野豌豆(Vicia sepium)到最大的物种黄囊苔草, 变异范围从 61.2m/g 至 909.0 m/g, 相差约15 倍(表 2)。组织密度变异达 74%, 从最小的物种大针茅(Stipa grandis)到最大的物种野豌豆, 变异范围从 0.08g/cm3 至 1.05g/cm3, 相差约 9 倍。变异最大的属性为分支强度, 变异系数高达 103.52% (表2), 从分支强度最小的物种细叶葱到最大的物种黄囊苔草, 变异范围从 0.46cm–1 至 16.5cm–1, 相差约 36 倍。分支比变异较小, 相差3倍。
吸收根直径与吸收根单根长显著正相关, 与分支强度负相关(图 3), 且与分支比和非吸收根根长显著负相关, 说明细根物种分支强度高, 侧根长度较小, 而粗根物种分支强度低, 侧根长度大。这种现象表明在资源获取过程中, 细根物种更依赖自身的侧根密度, 而粗根物种倾向于保持一定的侧根长度。
通过 4 个根属性(分支强度、分支比、直径和根长)的变化, 描述 5 个共有种(冷蒿、黄囊苔草、羊草、冰草和糙隐子草)对气候因子(年均温和年均降雨量)以及土壤因子(土壤 C 和 N 含量)的响应Pearson 相关性, 如表 3 所示。可以看出, 吸收根直径与其他根属性皆相关, 其中与吸收根长显著正相关, 与非吸收根长和分支比显著负相关性, 与分支强度负相关, 但与 4 个环境因子皆无相关性。非吸收根直径与根属性、环境因子皆无相关性。吸收根长与分支比显著负相关, 与年均降雨量正相关, 与土壤碳含量显著正相关。非吸收根长与年均降雨量和土壤氮含量皆正相关, 而与吸收根直径之外的其他根属性无相关性。分支比与环境因子缺乏显著的相关性。
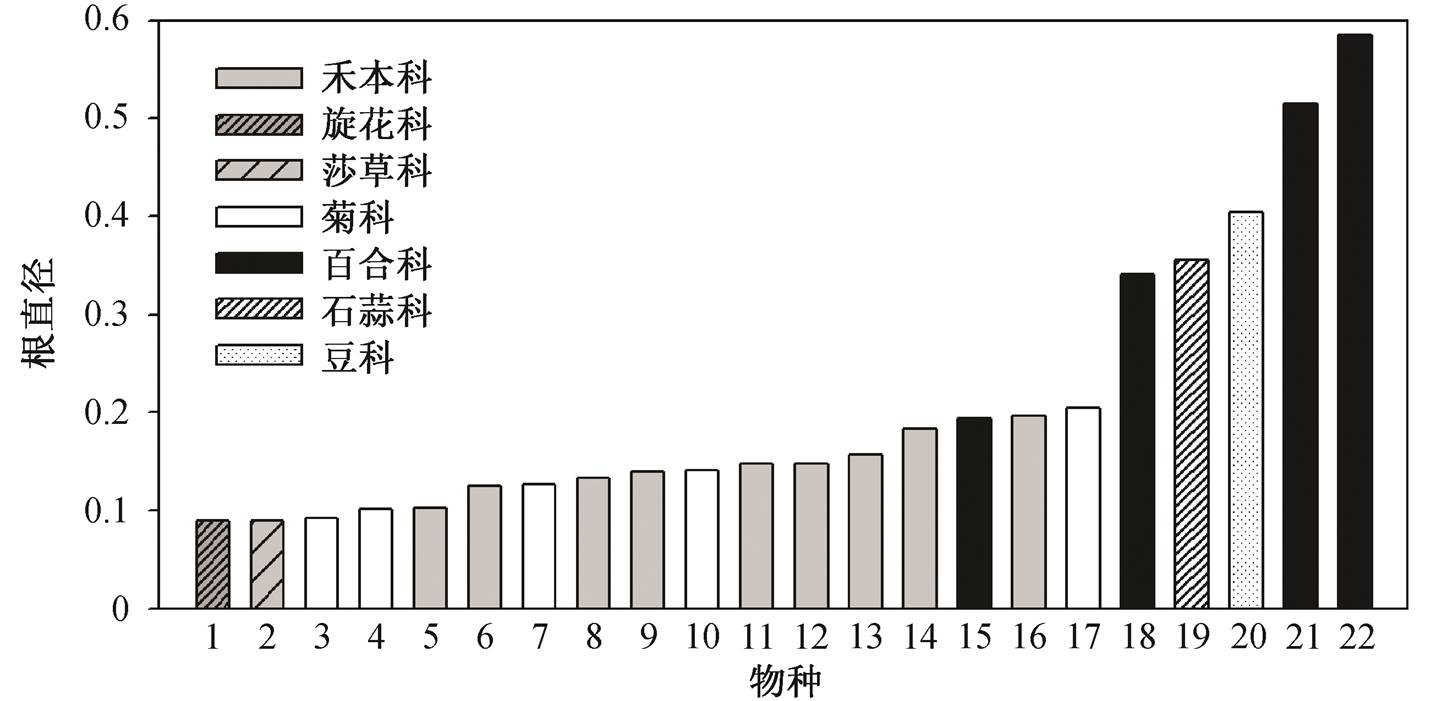
图2 22个草原物种的吸收根直径
Fig. 2 Root diameter of 22 species in grassland
表2 内蒙古草原22个物种的吸收根功能属性汇总
Table 2 Summary of the root traits for 22 grassland species in Inner Mongolia of China
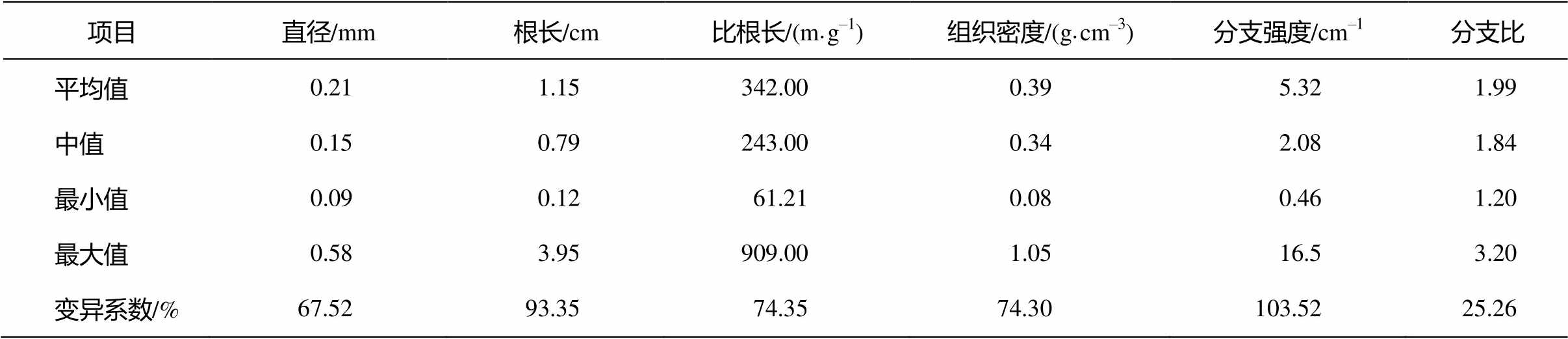
项目直径/mm根长/cm比根长/(m·g–1)组织密度/(g·cm–3)分支强度/cm–1分支比 平均值0.211.15342.000.395.321.99 中值0.150.79243.000.342.081.84 最小值0.090.1261.210.080.461.20 最大值0.583.95909.001.0516.53.20 变异系数/%67.5293.3574.3574.30103.5225.26
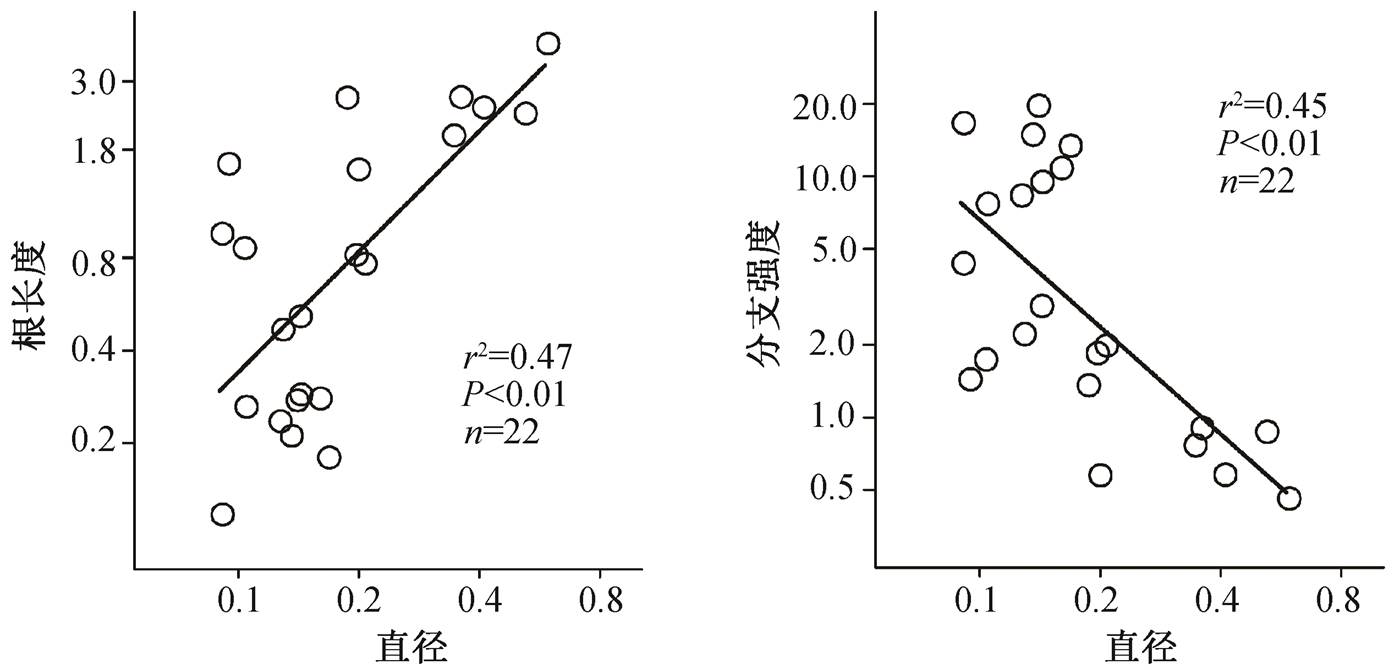
图3 22个草原物种吸收根直径与根长、分支强度间的关系
Fig. 3 Relationships between root diameter, root length and branching intensity of 22 grassland species
表3 内蒙古草原22个物种的根属性及其与环境因子的Pearson相关性
Table 3 Coefficients of Pearson’s correlation of the root traits and environmental factors for 22 grassland species in Inner Mongolia of China
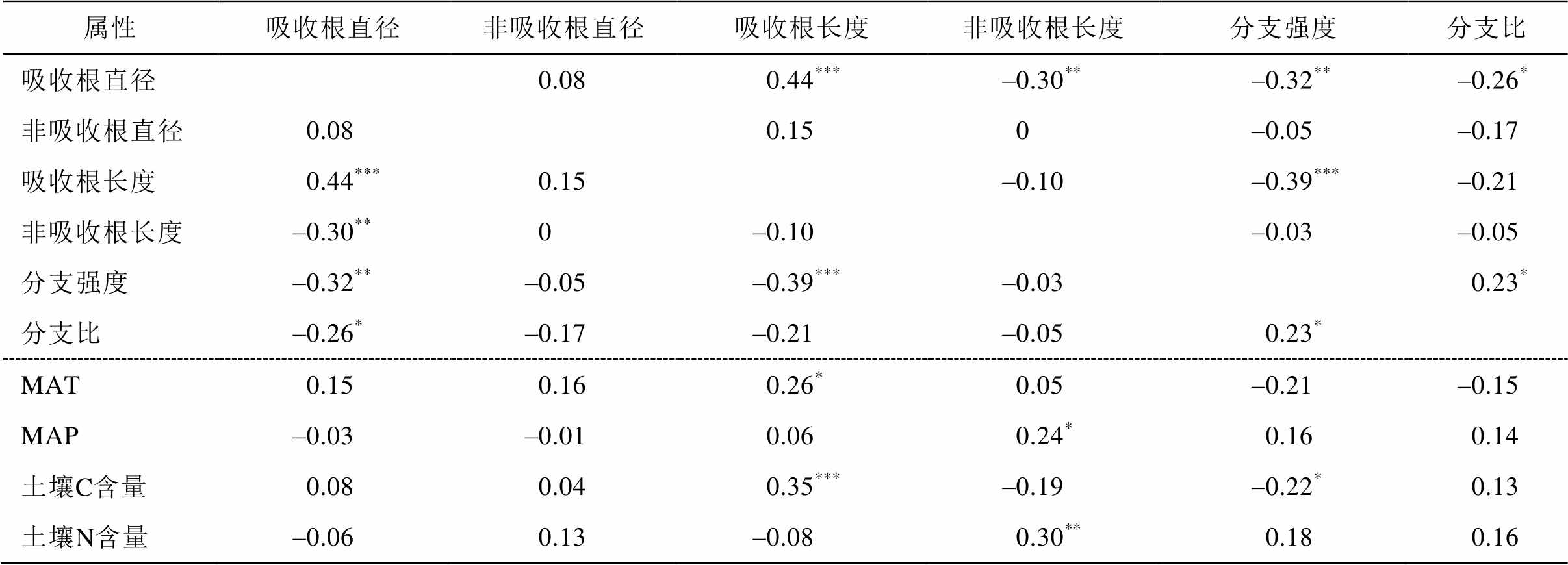
属性吸收根直径非吸收根直径吸收根长度非吸收根长度分支强度分支比 吸收根直径0.080.44***–0.30**–0.32**–0.26* 非吸收根直径0.080.150–0.05–0.17 吸收根长度0.44***0.15–0.10–0.39***–0.21 非吸收根长度–0.30**0–0.10–0.03–0.05 分支强度–0.32**–0.05–0.39***–0.030.23* 分支比–0.26*–0.17–0.21–0.050.23* MAT0.150.160.26*0.05–0.21–0.15 MAP–0.03–0.010.060.24*0.160.14 土壤C含量0.080.040.35***–0.19–0.22*0.13 土壤N含量–0.060.13–0.080.30**0.180.16
注: **表示在0.01水平(双侧)上显著相关, *表示在0.05水平(双侧)上显著相关。
物种对环境因子的响应存在多样性, 每一个物种在多个维度调节其根的构型、生物量和功能属性, 形成了植物适应策略的多样性(图 4)。
从图 4 可以看出, 冰草的吸收根与土壤氮和年降水量无关, 而非吸收根与土壤氮和年降水量有关。由于冷蒿的根构型较为特殊(轴根、基部茎木质化、非吸收根木质化程度高), 因此, 没有纳入相关性分析, 其吸收根直径与年均降雨量、年均温、土壤 C 含量和土壤 N 含量显著相关。黄囊苔草的非吸收根直径与土壤 N 含量和年均降雨量显著正相关。由于获取糙隐子草的地点相对较少, 非吸收根直径与土壤氮和年降水量显著负相关。草的吸收根和非吸收根直径均与年均降雨量和土壤氮含量无显著的相关性。
由表 4 可知, 在 4 个根系属性中, 糙隐子草通过改变根系分支强度以及吸收根和非吸收根的直径来适应变化, 其他 3 个群落共有种面对不同的环境因子时, 也采用完全不同的根系属性改变策略。这体现出物种属性响应环境因子的差异性, 同时可能代表非吸收根对环境也存在一定的响应。
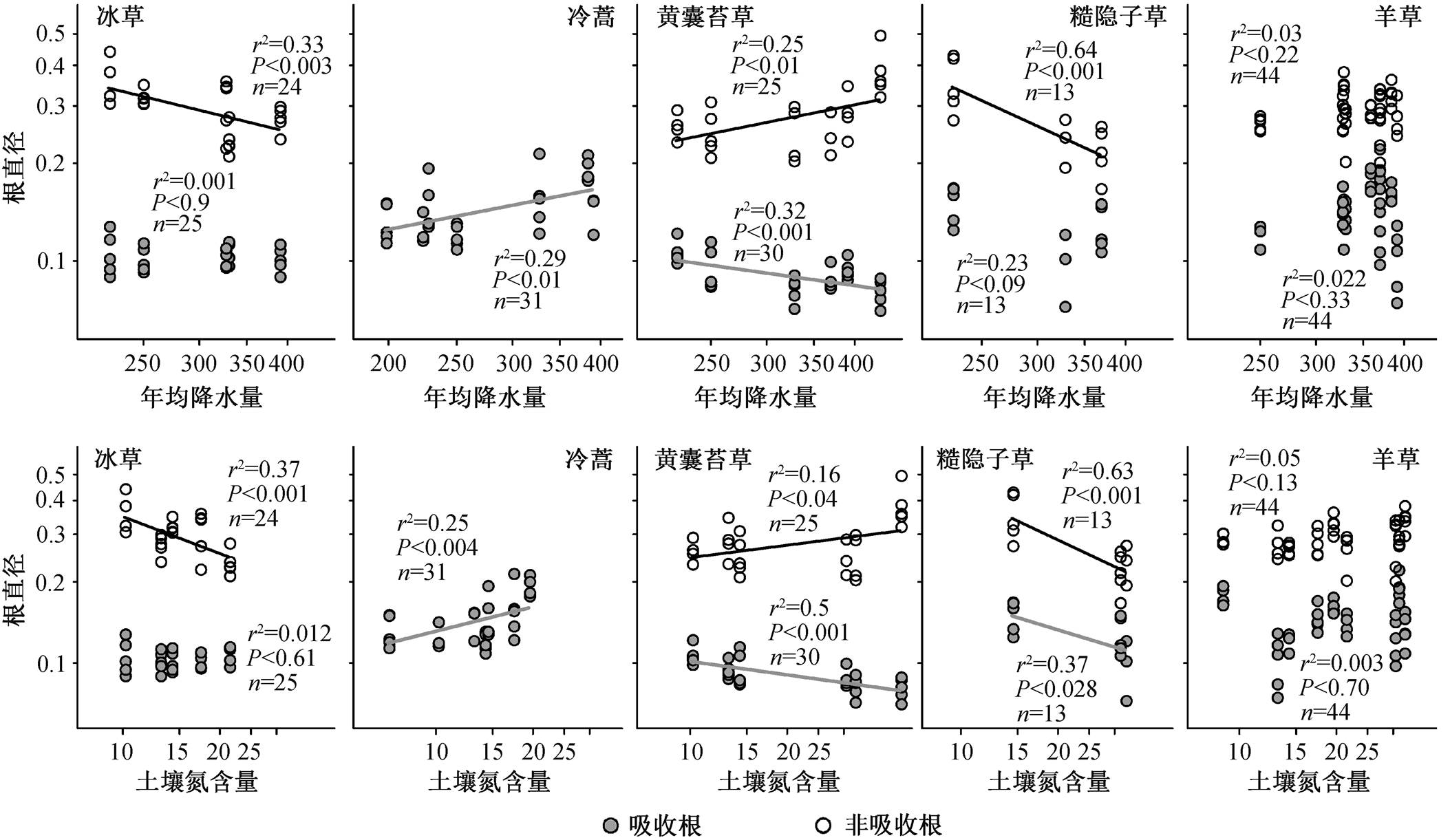
图4 5种植物吸收根和非吸收根直径对年均降水量和土壤氮含量之间的关系
Fig. 4 Correlations relationship between root diameter and environmental factors (MAP and Soil N) across five common species
表4 不同物种根属性与环境因子的相关性
Table 4 Coefficients of Pearson’s correlation in root functional traits and environmental factors across five species
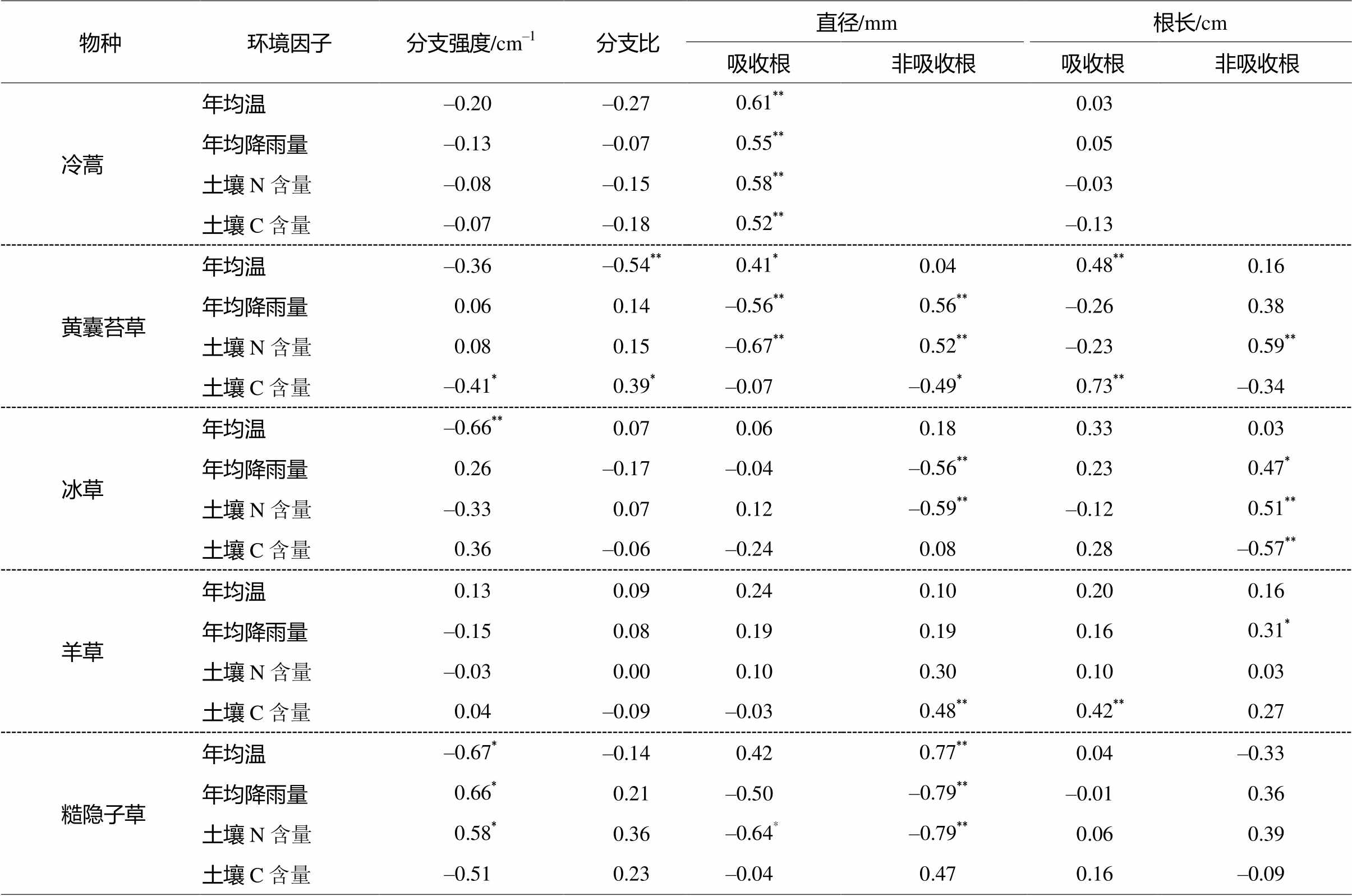
物种环境因子分支强度/cm–1 分支比直径/mm根长/cm 吸收根 非吸收根吸收根 非吸收根 冷蒿年均温–0.20–0.270.61**0.03 年均降雨量–0.13–0.070.55**0.05 土壤N含量–0.08–0.150.58**–0.03 土壤C含量–0.07–0.180.52**–0.13 黄囊苔草年均温–0.36–0.54**0.41*0.040.48**0.16 年均降雨量0.060.14–0.56**0.56**–0.260.38 土壤N含量0.080.15–0.67**0.52**–0.230.59** 土壤C含量–0.41*0.39*–0.07–0.49*0.73**–0.34 冰草年均温–0.66**0.070.060.180.330.03 年均降雨量0.26–0.17–0.04–0.56**0.230.47* 土壤N含量–0.330.070.12–0.59**–0.120.51** 土壤C含量0.36–0.06–0.240.080.28–0.57** 羊草年均温0.130.090.240.100.200.16 年均降雨量–0.150.080.190.190.160.31* 土壤N含量–0.030.000.100.300.100.03 土壤C含量0.04–0.09–0.030.48**0.42**0.27 糙隐子草年均温–0.67*–0.140.420.77**0.04–0.33 年均降雨量0.66*0.21–0.50–0.79**–0.010.36 土壤N含量0.58*0.36–0.64*–0.79**0.060.39 土壤C含量–0.510.23–0.040.470.16–0.09
注: **表示在 0.01 水平(双侧)上显著相关, *表示在0.05水平(双侧)上显著相关。
我们发现 22 种温带草原植物吸收根普遍较细, 比根长变异高达 15 倍(67~909m/g)(表 2), 表明根构建成本变化较大。与木本植物的根结构[10]相比, 绝大多数草原植物根直径较细, 例如羊草(直径为 0.14mm)和黄囊苔草(直径为 0.09mm)(表 2), 根可能只有几层细胞, 构建成本较低(比根长大), 单位根长碳投资较少, 且根组织密度较小(表 2), 理论上根寿命较短[17]。这种根的设计能较优地匹配脉冲式的降水资源, 能够在每次降水后迅速增殖吸收根(分支比较大), 吸收时空异质性较大的降水资源。草原水资源短缺(年均降水量为 198~433mm), 生长季相对较短, 绝大多草原植物吸收根的主要策略可能是大量生产低成本的吸收根[9], 生长季节结束时大量死亡[13],通过高效地根周转来竞争资源[14]。相比之下, 一些石蒜科植物的吸收根相对较粗(如山韭吸收根的直径为 0.58mm), 构建成本高(比根长小), 菌根侵染率高[18], 根系有一定的储藏功能, 生理化学调节水平较高[19], 其结构对脉冲式资源的响应不大敏感, 可能体现了粗根植物的耐受型生存策略。
近两年, 无论在物种水平还是群落水平上, 根系的多维度属性备受关注和认可[20–22]。对植物根属性变异和属性相关性的研究结果显示, 内蒙古草原典型植物吸收根直径变异约为 7 倍(表 2), 这种较大的属性变异性利于不同物种占据自己特有的生态位, 从而促进物种共存[23]。已有研究证明, 关键属性的协同变异会降低物种间对土壤水分养分资源的竞争[23], 并在群落内形成多样性的资源获取策略[24]。例如, 在获取土壤资源方面, 细根物种更依赖根系[25], 粗根物种更依赖菌根真菌[4]。本文的研究结果也显示种间吸收根的属性之间存在相关性, 如吸收根直径与单根长度显著正相关, 与分支强度显著负相关(图 3)。细根物种分支强度高, 吸收根较短, 表明细根物种更依赖自身的侧根增殖[25–26], 使得根系能够从根际范围内获取养分[27]; 粗根物种分支强度低, 根较长, 更倾向于增加侧根长度, 拓展资源斑块, 依靠真菌获取相对稳定的资源[28]。吸收根互补策略使得群落内的共存物种可以充分地利用有限的土壤资源和空间[4,26]。
吸收根和非吸收根对降水和土壤氮的响应具有明显的种间效应。具有根状茎的羊草吸收根和非吸收根几乎不响应水分和养分资源的变化, 而黄囊苔草和糙隐子草的根直径会有显著的响应, 但响应的趋势却不同(图 3)。本研究的初步结果表明物种对资源的响应方向和程度皆不相同, 难以找到根形态属性–资源相互作用的普遍规律。
在应对资源多重竞争的环境中, 同一种植物会对不同水分养分资源产生不同的响应。由于根具有开放性的特点, 草本根对环境的适应呈现较强的可塑性。植物根系在遇到资源斑块后, 会发生显著变化的特征, 包括形态可塑性、生理可塑性和寿命可塑性等[29−30]。根形态可塑性指根系选择性地在养分含量高的斑块中增殖更多的根[27], 包括原有根的伸长和新根的产生[30]。物种可在多个维度调节功能, 有的物种依赖生理代谢调节, 如遇到干旱时, 有的物种水通道的蛋白含量提高[31]; 有的靠形态可塑性调节, 物种降低根系分支强度来响应水分胁迫[6], 因此, 单凭对形态可塑性的认识, 难以全面地认识根对环境的响应。物种适应环境时, 在多个维度调节属性和属性组合, 体现了物种适应环境的策略多样性, 进而影响不同物种的空间分布和相对丰度[3]。
植物养分获取策略主要受物种科属的系统发育、植物功能型、根结构(包括根状茎)以及共生真菌等影响。不同科属的植物根构型和形态存在显著差异(图 2), 化学和菌根侵染及养分获取策略也有显著差异[4]。植物对养分的功能性获取策略同样至关重要, 禾草根系对氮的响应方式与非禾草完全不同[32]: 非禾草更容易受氮增加影响, 而禾草对土壤氮响应并不敏感[32]。禾草比非禾草、非豆科植物比豆科植物具有更高的养分利用效率[33]; 禾本科植物根际效应弱于灌木和豆科植物[34], 禾草的根含碳量低, 有较高碳氮比[33], 菌根侵染率低[4]。多年生的禾草之间根构型和对资源的响应方式也不同, 例如, 冰草和羊草对资源的响应方式不一样(图 4)。糙隐子草是 C4 植物, 随着土壤氮的增加, 根趋向变细(图 4), 意味着单位时间内根效率提高, 能够更好地配合地上部分的光合作用, 说明植物根叶功能也呈现一定的协同性, 高光效植物似乎对应需要吸收效率较高的吸收模块。石蒜科的根就不能忽视内生菌根, 根和菌根捕获资源的碳代价远高于根本身的碳代价[35]。养分获取策略差异导致不同根对资源响应的方式不同, 未来的研究中需要以物种为中心来探索生态策略, 理解植物如何响应环境, 从而更好地预测环境变化对物种的影响。
由于方法的限制, 目前根可塑性数据匮乏, 对根菌根复合体或部分如何响应水分和养分的认识存在较大的不确定性。物种的生态幅有很大差异, 如冷蒿可能出现在 200~300mm 降水区间, 而在 300~ 400 mm 降水区间羊草就较为常见。具体胁迫因子和程度不一样, 且区域空间数据获得样点的信息不足以反映土壤资源的斑块情况, 需要更多新的研究来跨物种和跨资源梯度地比较吸收根的可塑性, 分析根可塑性受多种资源和物理条件的调控机制, 如根构型、构建成本、菌丝效率、资源类型及供应水平、竞争、边际收益等[36–38]。
以黄囊苔草为例, 吸收根和非吸收根对降水和土壤氮的响应完全相反(图 3)。随着资源的增加, 吸收根的直径倾向于细, 而非吸收根直径倾向于粗(图 3), 意味着倾向于更多的小根枝获取养分, 表明不同级别的根在功能组织方式上具有一定的独立性, 并不完全是协同变异的。植物维管束系统是一个多级的分支构造, 已证实在叶脉中末端叶脉直径独立于叶片面积和主脉[39]; 一级根在发育上具有一定的独立性, Chen 等[40]也证实粗根与树干存在权衡, 而吸收细根与树干的权衡不明显。因此, 我们推断大多数物种吸收根和非吸收根对环境的响应存在一定的独立性(图 4)。
绝大多数草本植物只有 4 级根, 而木本植物的根一般不少于 5 级, 草本根构型与木本根构型显著不同。单一的根据根的级别来划分草本植物根系的方法可能存在一定的局限性, 因为草本植物的根级远低于木本植物, 且不同物种间各级别根系木质化的程度差异巨大。Sun 等[13]发现 7 种多年生的草本植物中的 3 个物种的各级别根的解剖结构都没有发生明显的木质化, 意味着这些植物所有级别的根都具有吸收功能。因此, 将森林物种根系分级方法直接简单地套用在草原植物根系研究上的做法值得商榷。特别是草原物种根的根构型较为复杂, 有些植物具有根状茎、鳞茎等[41], 有些植物主(轴)根系发育明显, 对不同级别根系的解剖结构–功能对应关系的研究还很缺乏, 未来要考虑根的整体构型, 准确地划分不同植物功能类群根的功能模块。
本文按水分梯度在内蒙古草原设置 16 个样点, 以每个样点的优势物种为研究对象, 测定每个物种的根形态和构型属性, 分析 6 种植物根属性(直径、根长、比根长、组织密度、分支强度和分支比)的变异及其对 4 种环境因子(年均降雨量、年均温、土壤含碳量和土壤含氮量)的响应规律, 得到如下结论: 1)草本植物根构建成本较低, 根直径与侧根长度显著正相关, 而与分支强度负相关; 2)吸收根和非吸收根对降水和土壤氮的响应具有明显的种间效应。
物种对多种环境因子的响应是复杂地, 不同物种根属性随资源变化的大小和方向各不相同。未来的研究中需要以物种为中心来探索养分获取策略, 理解植物如何响应高度异质性的资源, 更好地认识地下生态过程对全球变化的响应和适应。
参考文献
[1]Grime J P. Plant strategies, vegetation processes and ecosystem properties. Chichester: John Wiley & Sons, 2006
[2]Williams L J, Paquette A, Cavender-Bares J, et al. Spatial complementarity in tree crowns explains overyielding in species mixtures. Nature Ecology & Evolution, 2017, 1: 0063
[3]Laughlin D C, Messier J. Fitness of multidimensional phenotypes in dynamic adaptive landscapes. Trends in Ecology & Evolution, 2015, 30(8): 487–496
[4]Li Hongbo, McCormack M L, Guo Dali, et al. Diverse belowground resource strategies underlie plant spe-cies coexistence and spatial distribution in three gras-slands along a precipitation gradient. New Phytologist, 2017, 216(4): 1140–1150
[5]Freschet G T, Valverde-Barrantes O J, Tucker C M, et al. Climate, soil and plant functional types as drivers of global fine-root trait variation. Journal of Ecology, 2017, 105: 1082–1196
[6]Zhan A, Schneider H, Lynch J, et al. Reduced lateral root branching density improves drought tolerance in maize. Plant Physiology, 2015, 168(4): 1603–1615
[7]Kraft N J, Godoy O, Levine J M. Plant functional traits and the multidimensional nature of species coexistence. Proceedings of the National Academy of Sciences, 2015, 112(3): 797–802
[8]Kunstler G, Falster D, Coomes D A, et al. Plant functional traits have globally consistent effects on competition. Nature, 2016, 529: 204–207
[9]McCormack M L, Dickie I A, Eissenstat D M, et al. Redefining fine roots improves understanding of below-ground contributions to terrestrial biosphere processes. New Phytologist, 2015, 207(3): 505–518
[10]Guo Dali, Xia Mengxue, Wei Xing, et al. Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species. New Phytolo-gist, 2008, 180(3): 673–683
[11]Pregitzer K S, Deforest J L, Burton A J, et al. Fine root architecture of nine north American trees. Eco- logical Monographs, 2002, 72(2): 293–309
[12]Xia Mengxue, Guo Dali, Pregitzer K S. Ephemeral root modules in Fraxinus mandshurica. New Phyto- logist, 2010, 188(4): 1065–1074
[13]Sun Kai, McCormack M L, Guo Dali, et al. Fast-cycling unit of root turnover in perennial herbaceous plants in a cold temperate ecosystem. Scientific Reports, 2016, 6: 19698
[14]Jackson R B, Mooney H A , Schulze E D. A global budget for fine root biomass, surface area and nutrient contents. National Academy of Sciences, 1997, 94 (14): 7362–7366
[15]陈佐忠, 汪诗平. 中国典型草原生态系统. 北京: 科学出版社, 2000
[16]黄静, 曾辉, 熊艳梅, 等. 内蒙古温带草地低级根生物量格局及其与环境因子的关系. 北京大学学报(自然科学版), 2015, 51(5): 931–938
[17]Ryser P. The importance of tissue density for growth and life span of leaves and roots: a comparison of five ecologically contrasting grasses. Functional Ecology, 1996, 10(6): 717–723
[18]包玉英. 内蒙古草原和荒漠丛枝菌根共生多样性及其生态分布[D]. 呼和浩特: 内蒙古农业大学, 2004
[19]令狐昱慰, 李多伟. 石蒜属植物的研究进展. 亚热带植物科学, 2007, 36(2): 73–76
[20]Kramer-Walter K R, Bellingham P J, Millar T R, et al. Root traits are multidimensional: specific root length is independent from root tissue density and the plant economic spectrum. Journal of Ecology, 2016, 104: 1299–1310
[21]Weemstra M, Mommer L, Visser E J, et al. Towards a multidimensional root trait framework: a tree root review. New Phytologist, 2016, 211(4): 1159–1169
[22]Erktan A, Roumet C, Bouchet D, et al. Two dimensions define the variation of fine root traits across plant communities under the joint influence of ecological succession and annual mowing. Journal of Ecology, 2018: doi: 10.1111/1365-2745.12953
[23]Karst J, Marczak L, Jones M, et al. The mutualism-parasitism continuum in ectomycorrhizas: a quantita-tive assessment using meta-analysis. Ecology, 2008, 89(4): 1032–1042
[24]Lambers H, Raven J A, Shaver G R, et al. Plant nutrient-acquisition strategies change with soil age. Trends Ecology and Evolution, 2008, 23(2): 95–103
[25]Kong Deliang, Ma Chengen, Guo Dali, et al. Leading dimensions in absorptive root trait variation across 96 subtropical forest species. New Phytologist, 2014, 203(3): 863–872
[26]Liu Bitao , Li Hongbo , Guo Dali, et al. Complemen-tarity in nutrient foraging strategies of absorptive fine roots and arbuscular mycorrhizal fungi across 14 coexisting subtropical tree species. New Phytologist, 2015, 208(1): 125–136
[27]Robinson D, Hodge A, Griffiths B S, et al. Plant root proliferation in nitrogen-rich patches confers competi-tive advantage. Proceedings of the Royal Society B一Biological Sciences, 1999, 266: 431–435
[28]Eissenstat D M, Kucharski J M, Zadworny M, et al. Linking root traits to nutrient foraging in arbuscular mycorrhizal trees in a temperate forest. New Phytolo-gist , 2015, 208(1): 114–124
[29]Grime J. The role of plasticity in exploiting environ-mental heterogeneity // Caldwell M M, Pearcy R W. Exploitation of Environmental Heterogeneity by Plants: Ecophysiological Processes Above-and Below-ground, 1994: 1–19
[30]王鹏, 牟溥, 李云斌. 植物根系养分捕获塑性与根竞争. 植物生态学报, 2012, 36(11): 1184–1196
[31]Brunner I, Herzog C, Dawes M A, et al. How tree roots respond to drought. Frontiers in Plant Science, 2015, 6: 547
[32]Bai Wenming, Guo Dali, Tian Qiuying, et al. Diffe-rential responses of grasses and forbs led to marked reduction in below-ground productivity in temperate steppe following chronic N deposition. Journal of Ecology, 2015, 103: 1570–1579
[33]Tjoelker M G, Craine J M, Wedin D, et al. Linking leaf and root trait syndromes among 39 grassland and savannah species. New Phytologist, 2005, 167(2): 493–508
[34]杨阳, 刘秉儒. 荒漠草原不同植物根际与非根际土壤养分及微生物量分布特征. 生态学报, 2015, 35 (22): 7562
[35]Roumet C, Birouste M, Picon-Cochard C, et al. Root structure-function relationships in 74 species: evi-dence of a root economics spectrum related to car- bon economy. New Phytologist, 2016, 210(3): 815–826
[36]Freschet G T, Swart E M, Cornelissen J H. C. Integrated plant phenotypic responses to contrasting above- and below-ground resources: key roles of specific leaf area and root mass fraction. New Phytologist, 2015, 206(4): 1247–1260
[37]Hodge A. The plastic plant: root responses to hetero-geneous supplies of nutrients. New Phytologist, 2004, 162(1): 9–24
[38]Farley R A, Fitter A H. The responses of seven co-occurring woodland herbaceous perennials to localized nutrient-rich patches. Journal of Ecology, 1999, 87(5): 849–859
[39]Sack L, Scoffoni C, McKown A D, et al . Develop-mentally based scaling of leaf venation architecture explains global ecological patterns. Nature Communi-cations, 2012, 3: No. 837
[40]Chen Guangshui, Yang Yusheng, Robinson D. Alloca-tion of gross primary production in forest ecosys- tems: allometric constraints and environmental res-ponses. New Phytologist, 2013, 200(4): 1176–1186
[41]Cannon W A. A tentative classification of root sys- tems. Ecology, 1949, 30(4): 542–548
Root Traits Variation in Inner Mongolia Grassland of China
Abstract The authors measured root morphological and architectural traits of 22 different dominant plant species across 16 Inner Mongolia grassland sites along soil water gradients, and analyzed the response of these root traits (diameter, length, SRL, RTD, BrIntensity and BrRatio) to four environmental factors (MAT, MAP, Soil N and Soil C). The results showed that variation of absorptive root diameter, tissue density and specific root length among different species was 7, 9, and 15 times, respectively. There was a significant positive correlation between root diameter and lateral root length, but negative correlation between root diameter and root branching intensity. Responses of both absorptive and non-absorptive roots to precipitation and soil nitrogen were species-specific. When using different combinations of root traits to describe plant adaptation strategies, different species’ root traits respond to environmental changes with different degrees and direction of variation, resulting in a diversity of plant adaptation strategies.
Key words root functional traits; ecological strategy; diversity; coexistence of species; temperate grassland
doi: 10.13209/j.0479-8023.2019.003
收稿日期:2018–04–02;
修回日期:2018–05–17;
网络出版日期: 2019–03–09
中国科学院战略性先导科技专项(XDB15010401)、国家重点研发计划(2016YFC0501802)和国家自然科学基金(1822010)资助