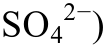 被直接还原为H2S的离子浓度、pH和氧化还原条件; 指出在地质体系中, 当CaCO3处于沉淀-溶解的边界时, 少量酸性流体的加入就会使沉淀转为溶解, 而当Ca2+和
被直接还原为H2S的离子浓度、pH和氧化还原条件; 指出在地质体系中, 当CaCO3处于沉淀-溶解的边界时, 少量酸性流体的加入就会使沉淀转为溶解, 而当Ca2+和 浓度升高时, 又达到新的沉淀-溶解平衡。H2S对CaCO3的溶蚀在深度约为1000 m时达到最佳效果, 长期、多次的TSR反应才能产生充足的酸性流体(即H2S), 这是溶蚀改造碳酸盐岩储层达到明显效果的必要条件。
浓度升高时, 又达到新的沉淀-溶解平衡。H2S对CaCO3的溶蚀在深度约为1000 m时达到最佳效果, 长期、多次的TSR反应才能产生充足的酸性流体(即H2S), 这是溶蚀改造碳酸盐岩储层达到明显效果的必要条件。在川东北的四川盆地下飞仙关组发现的高H2S天然气田中, H2S含量与储层孔隙度有一定的正相关性[1-2]。一般认为, 这些气田中的H2S是由硫酸盐热化学还原反应(thermochemical sulfate reduction,TSR)产生的。TSR反应是碳酸盐岩地层埋藏期储集性能改善的一种重要推力。Orr[3]在分析美国 Big Horn 盆地古生代原油地球化学参数的基础上, 首次提出油藏中很可能发生硫酸盐与原油的氧化还原反应。随后, 众多学者对TSR反应的机理、产物、启动温度和影响因素做了研究[2,4-9]。戴金星等[10-11]最早讨论我国含H2S天然气的分布特征、分类及成因;Machel[12]根据加拿大西部 Nisku 盆地中泥盆纪 TSR反应的产物鞍状白云石的流体包裹体、热成熟度和气体有机地球化学数据, 指出TSR反应发生的温度区间为125~145ºC, 并提出H2S溶蚀CaCO3的化学反应方程式; Worden等[13]发现在Abu Dhabi岩层中, 只有当储层温度高于140ºC时才能检测到含硫气体,并讨论了TSR反应对储层改造的影响; Zhang等[14]讨论了不同烷烃对TSR反应的影响; Tang等[15]认为TSR反应可以分为两个主要阶段: 启动阶段(也称引发阶段)和H2S自催化阶段。
TSR反应的产物之一H2S对碳酸盐岩有强烈的腐蚀溶解作用[1,2,5,16], 许多学者试图通过模拟实验重现这一过程。张水昌等[5]的模拟实验证明, TSR反应会引起烃类稳定碳同位素的富集、CO2含量和烃类气体干燥系数的增加。张单明等[19]通过碳酸盐岩-H2S平衡体系原位溶蚀模拟实验, 探讨了H2S对CaCO3的溶蚀作用及地质意义。虽然前人对TSR反应做了很多讨论, 但主要集中在地质观察和模拟实验两方面, 并且以定性为主, 对TSR反应的物理化学条件(酸度、氧化还原程度和离子浓度)尚未进行热力学的定量演算与论证。
TSR反应及后续的溶蚀反应分为两步: 1)在高温驱动下, 烃类对硫酸盐进行还原[7]:
2)生成的H2S对CaCO3进行溶蚀[12]:
本文根据上述化学反应式, 结合实际储层的地质条件, 拟定物理化学体系, 枚举其中可能发生的化学反应。通过绘制热力学相图, 探讨物理化学条件对反应的影响, 判断反应发生的方向, 求取反应发生的物理化学条件区间, 推测储层发生改造时的环境。
TSR反应以及后续的溶蚀反应本质上是化学反应。对于任意化学反应aA+bB=cC+dD, 能否自发进行的判据有许多, 常用的有以下3种。
1)标准平衡常数KΘ 与反应商J:
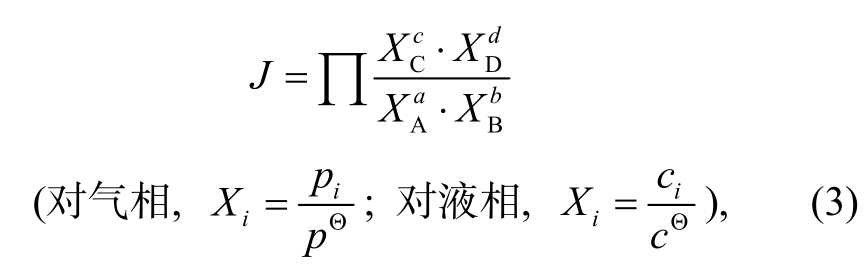
式中,X为组分的百分含量,p为气体分压,c为溶液中组分的浓度, 下角标i表示物相。反应平衡时的反应商J即为标准平衡常数KΘ。
2)吉布斯-亥姆霍兹方程和范特霍夫方程:

式中, ∆GΘ为标准吉布斯自由能变, ∆HΘ为标准焓变,∆SΘ为标准熵变, ∆G为非标准情况下的吉布斯自由能变,T为温度,R为气体常数,J为反应商。
3)电极电势与能斯特方程: 对于任意氧化还原反应,
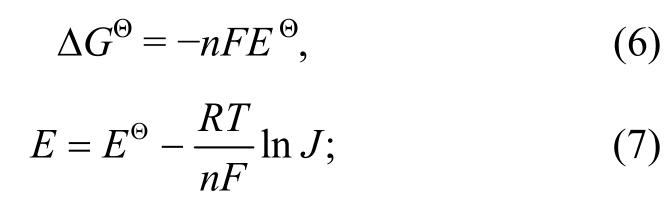
对于电极半反应aOx+ne-=bRed (Ox: 氧化态; Red:还原态),
式(7)和(8)中,E为电动势,EΘ为标准电动势,φ为电极电势,φΘ为标准电极电势,n为电极半反应中转移的电子数量,F为法拉第常数。根据电动势的定义
将任意两个不同的电极半反应组合, 可以得到完整的氧化还原反应。
以上3种判据通过方程互相联系, 相互等价, 都可以用来判断反应发生的方向和物理化学条件, 且判断结果一致。其中, 电极电势是最方便、最直观的判据, 并且在温度一定的情况下, 电极电势Eh是离子浓度(包括氢离子浓度, 即pH)的函数, 可以绘制成图, 一目了然。因此, 本文主要通过电极电势探讨离子浓度(包括pH)、温度和氧化还原条件对反应的影响。
多数情况下, 标准状况下电极半反应的电极电势有表可查, 但是某些电极半反应在标准状况下的电极电势以及所有反应在非标准状况下的电极电势无法查询, 需要利用吉布斯自由能来推算。
利用能斯特方程, 用吉布斯自由能∆GΘ推算任一电极半反应的标准电极电势φΘ的方法如下: 根据∆GΘ=-nFEΘ, 先求得任一完整的氧化还原反应的EΘ, 再用EΘ求取电极半反应的φΘ。对任一完整的氧化还原反应, 可以根据E=φ+-φ-, 将其分解为两个电极半反应。可将其中一个电极半反应设置为H+/H2电对半反应, 学术界将φΘ(H+/H2)的值规定为0,则目标电极半反应的φΘ就等于此时的EΘ, 因此通过EΘ求得任一电极半反应的φΘ。
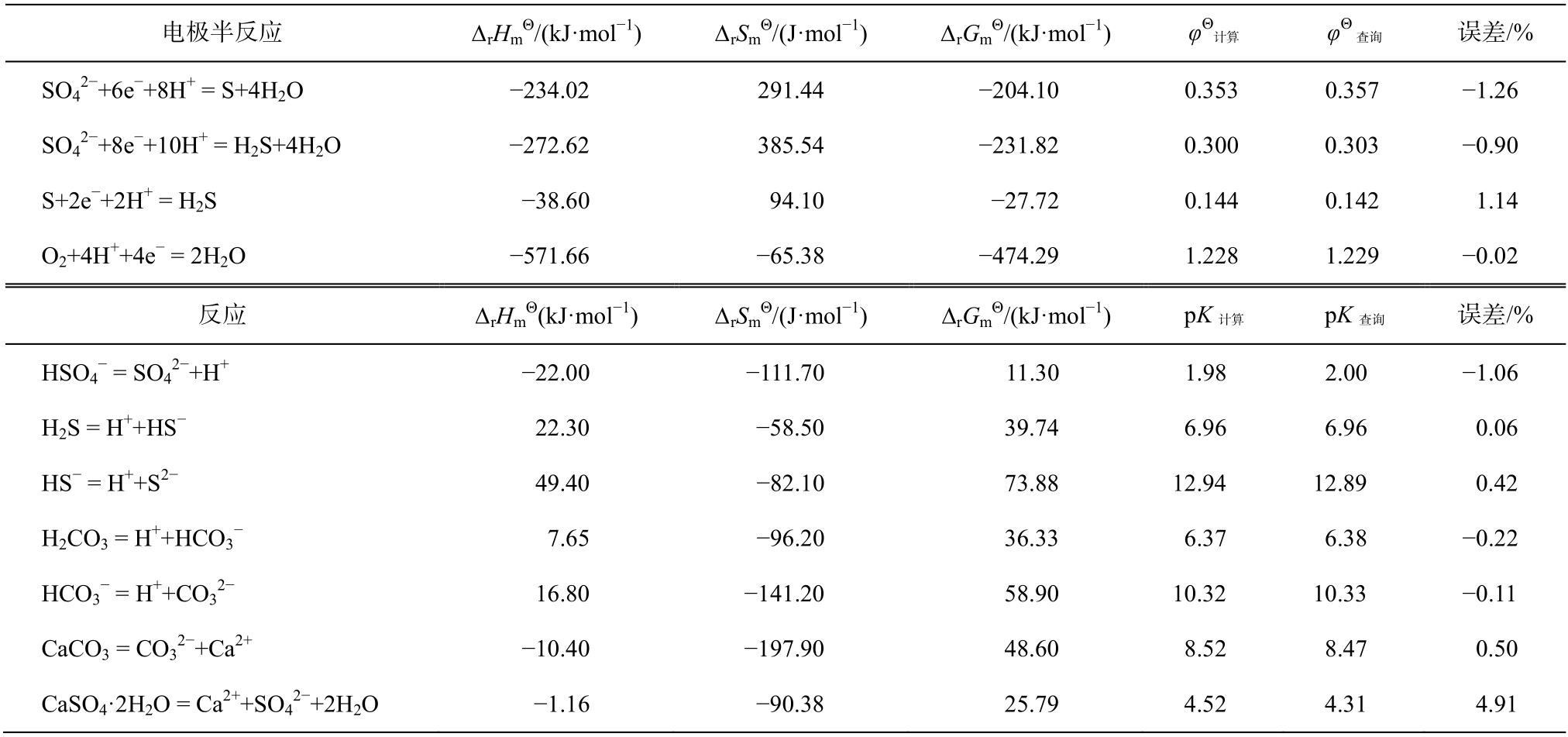
表1 电极电势和平衡常数(分别由吉布斯自由能推算和表中查询)对比
Table 1 Comparison of electrode potential and equilibrium constant (calculated by Gibbs free energy or inquired)
说明: ∆r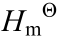 为标准霍布斯自由焓变; ∆r
为标准霍布斯自由焓变; ∆r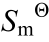 为标准熵变; ∆r
为标准熵变; ∆r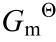 为标准吉布斯自由能变;
为标准吉布斯自由能变;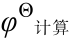 为计算得到的电极电势;
为计算得到的电极电势; 为查询得到的电极电势。
为查询得到的电极电势。
?
在标准状况下, 由吉布斯自由能推算得出的电极电势与表中直接查询得到的电极电势吻合程度很高(表1), 说明此方法是合理的。平衡常数同理。
在进行热力学分析并绘制相图时, 首先要明确研究对象的组分体系, 枚举其中可能存在的反应。在本文讨论的CaO-SO2-CO2-H2O四元体系中, 加上温度、压力和氧化还原条件, 共有7个自由度, 若完整绘制, 应该是七维相图。但是, 七维相图既不直观, 也难以绘制, 因此本文采取的方法是固定 7 个自由度中的 5 个, 从七维相图中截取二维截面的方法, 用绘制的二维相图来讨论。在选定体系后, 提供部分物理化学条件以减少自由度, 再将剩余的两个自由度分别设为横、纵坐标轴, 将物理化学方程投影成直线, 即成二维相图。
在地质体系中, 物质组成十分复杂。为了探索某些条件(如温度、离子浓度和氧化还原环境)对物理化学反应的影响, 需要设定一个相对封闭且稳定的体系, 并且根据实际储层的状况, 设定一定的物理化学条件。TSR反应和其后的溶蚀反应发生在以CaCO3为主要成分的碳酸盐岩中, 根据反应(1)和(2), 提炼出一个四元体系: CaO-SO2-CO2-H2O。
选定体系后, 需要枚举体系中存在的化学反应,部分列于表2, 其中包括非氧化还原反应和氧化还原反应。
2.2.1 非氧化还原反应
非氧化还原反应的方程都是pH和离子浓度的函数, 可以根据该反应的平衡常数列出, 包括3类:1)酸的电离反应; 2)固体的溶解反应; 3)固体被酸溶解的反应。
1)酸的电离反应。以HS 的电离为例:
的电离为例:

当[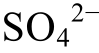 ]=[
]=[ ]时, pH=pK(HS
]时, pH=pK(HS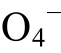 )。这说明:pH<pK(
)。这说明:pH<pK(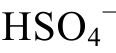 )时, 硫酸根主要以HS
)时, 硫酸根主要以HS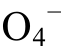 的形式存在;pH>pK(
的形式存在;pH>pK(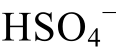 )时, 硫酸根主要以
)时, 硫酸根主要以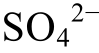 的形式存在;pH=pK(
的形式存在;pH=pK(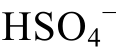 )时, 二者各占一半。
)时, 二者各占一半。
在Eh-pH相图中, 可据此绘出一条垂直于pH轴的直线, 作为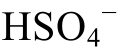 与
与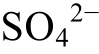 的分界线。其他酸与此同理。这些分界线决定了酸和酸根离子在液相的分布。在Eh-pH相图中, 酸的电离反应不涉及相变,只涉及离子形态的转变, 因此标记为虚线。当以其他物理化学条件作为横、纵坐标时, 也可以用相同的原则计算和绘制二维相图。
的分界线。其他酸与此同理。这些分界线决定了酸和酸根离子在液相的分布。在Eh-pH相图中, 酸的电离反应不涉及相变,只涉及离子形态的转变, 因此标记为虚线。当以其他物理化学条件作为横、纵坐标时, 也可以用相同的原则计算和绘制二维相图。
表2 体系中存在的化学反应枚举
Table 2 An enumeration of the chemical reactions in the system
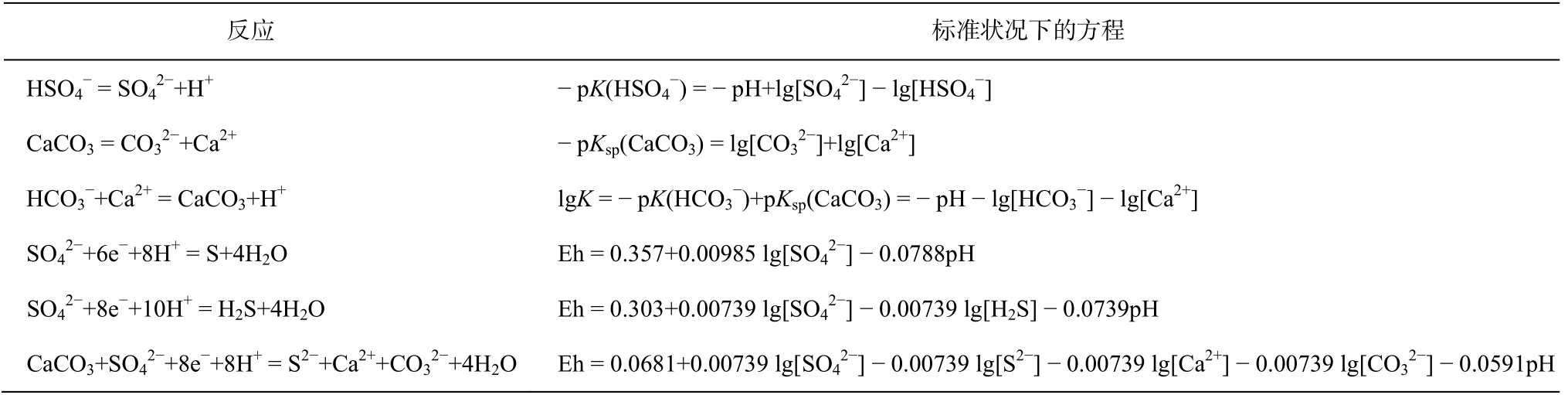
说明: 限于篇幅, 未全部列出。
?
2)固体的溶解反应。以CaCO3的溶解为例:
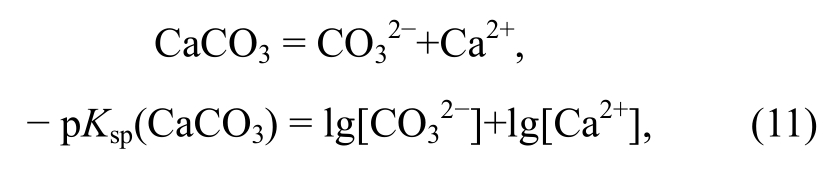
该反应表现为Ca2+浓度和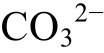 浓度的函数。由于该反应不涉及氧化还原条件和酸碱度的改变, 不随Eh和pH的变化而变化, 因此在Eh-pH相图中无须绘制, 但在其他相图(如以Ca2+或
浓度的函数。由于该反应不涉及氧化还原条件和酸碱度的改变, 不随Eh和pH的变化而变化, 因此在Eh-pH相图中无须绘制, 但在其他相图(如以Ca2+或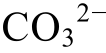 浓度作为横、纵坐标的相图)中需要绘制。其他固体同理。
浓度作为横、纵坐标的相图)中需要绘制。其他固体同理。
3)固体被酸溶解的反应。以CaCO3被酸溶解为例:
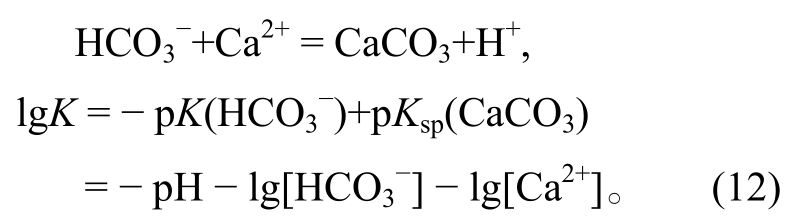
该反应不是氧化还原反应, 不涉及氧化还原条件的改变, 反应的平衡条件不随Eh的变化而变化。该反应的pH只与方程中的其他离子浓度有关, 当固定其他离子浓度时, 在Eh-pH相图中表现为垂直于pH轴的直线。其他固体被酸溶解的反应与此同理。在Eh-pH相图中, 这类反应涉及相变, 即线的一边是固相, 另一边是液相, 因此标记为实线。
对以上3种反应, 当pH被固定时, 也可以得到其他离子浓度之间的函数关系, 从而绘制其他离子与电极电势或离子之间的二维相图。
2.2.2 氧化还原反应
以 CaSO4被还原成 S 为例:
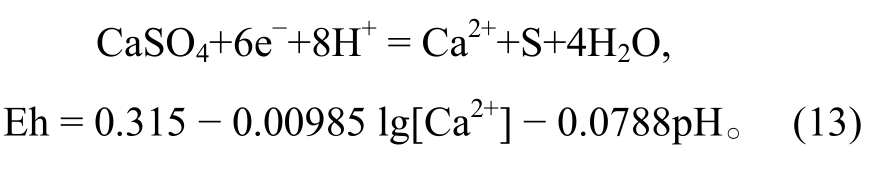
在氧化还原反应中, 反应的平衡受氧化还原条件、酸碱度和其他离子浓度共同控制。根据该反应的能斯特方程, Eh与pH以及其他离子浓度是函数关系, 当固定其他离子浓度时, 方程即变为Eh与pH的函数。Eh与pH为线性关系, 在Eh-pH图中表现为有一定斜率和截距的直线。在Eh-pH相图中, 这类反应同样涉及相变, 因此也标记为实线。
根据2.2.1节的讨论, 不同的酸根离子将在不同的pH条件下成为该酸在溶液中的主要形式并参与反应, 这将导致固体被酸溶解时以不同反应形式为主导。同样地, 变价元素不同价态的酸/酸根离子也将在不同氧化还原条件(Eh)下, 成为该元素在溶液中的主要形式并参与反应, 这将导致发生氧化还原反应时以不同的反应形式为主导。
当温度改变时, 在同样的酸碱度和氧化还原条件下, 酸/酸根离子的主要存在形式可以发生变化,相应的反应形式也发生变化。例如, 对于反应
常温下H2CO3的pKa1=6.38, H2S的pKa1=6.96, 当 pH>6.96时, H2S主要以HS-的形式存在, 此时H2CO3主要以HC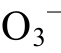 的形式存在, 此反应不存在。然而, 在200ºC时, H2CO3的pKa1=5.87, H2S的pKa1=5.52, 当5.52<pH<5.87时, H2S主要以HS-形式存在, H2CO3主要以H2CO3形式存在, 此时该反应是存在的。当固定Eh或pH时, 也可绘出其他离子相关的相图。
的形式存在, 此反应不存在。然而, 在200ºC时, H2CO3的pKa1=5.87, H2S的pKa1=5.52, 当5.52<pH<5.87时, H2S主要以HS-形式存在, H2CO3主要以H2CO3形式存在, 此时该反应是存在的。当固定Eh或pH时, 也可绘出其他离子相关的相图。
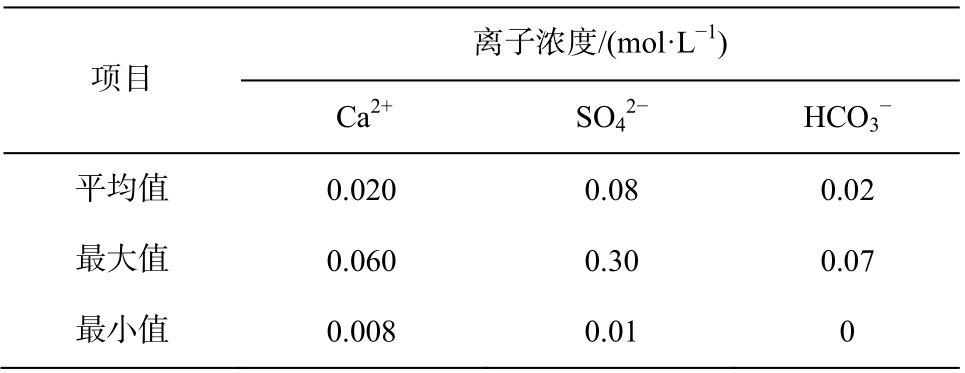
绘制Eh-pH相图时, 需要将坐标系之外其他离子的浓度固定。为使计算结果贴近实际情况, 本研究参考四川盆地飞仙关组高H2S气藏油田水的离子含量。
从表3可以知道, Ca2+浓度最高值是0.06 mol/L,最低值是0.008 mol/L;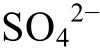 浓度值是0.3 mol/L, 最低值是0.01 mol/L;
浓度值是0.3 mol/L, 最低值是0.01 mol/L;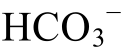 浓度最高值是0.07 mol/L,最低值是0 mol/L。另据, 常温下CaSO4的溶度积Ksp(CaSO4)=10-4.31, 通过计算, 可以得到其饱和溶液离子浓度为0.007 mol/L。可以看出, 3种离子浓度数量级相差不大, 为统一起见, 在计算并绘制EhpH相图时, 本文将各种离子浓度设为一致, 并分别讨论CaSO4饱和与不饱和的情况。因此, 后面需要固定离子浓度时, 将离子物料浓度的上限设定为0.01 mol/L, 下限设定为0.001 mol/L。
浓度最高值是0.07 mol/L,最低值是0 mol/L。另据, 常温下CaSO4的溶度积Ksp(CaSO4)=10-4.31, 通过计算, 可以得到其饱和溶液离子浓度为0.007 mol/L。可以看出, 3种离子浓度数量级相差不大, 为统一起见, 在计算并绘制EhpH相图时, 本文将各种离子浓度设为一致, 并分别讨论CaSO4饱和与不饱和的情况。因此, 后面需要固定离子浓度时, 将离子物料浓度的上限设定为0.01 mol/L, 下限设定为0.001 mol/L。
表3 四川盆地飞仙关组高H2S气藏油田水的离子浓度[22]
Table 3 Ion content of water in high H2S gas reservoir of Feixianguan formation in Sichuan Basin[22]
?
如前所述, 为了将七维相图降成二维相图, 需要固定5个自由度变量。在本文涉及的反应中, 压力P对反应平衡的影响较小, 一般设为固定值; 温度T则设3个不同的固定值分别加以讨论: 常温、100ºC和200ºC; 其余5个自由度包括氧化还原条件(Eh)和4种组分的离子浓度, 可以在讨论不同影响因素时, 固定其中任意3个自由度, 将剩下的两个自由度作为横、纵坐标来建立坐标系, 将表2中所有反应逐个绘制出来, 即得到二维相图。以下提到的离子浓度中,c表示离子的物料浓度, 包含其所有存在形式; 包含离子符号的方括号(如[Ca2+])表示该离子的平衡浓度, 只包含方括号中的离子存在形式。
3.1.1 相图的绘制
以图1(a)为例,T=298 K,c(Ca2+)=c(H2SO4)=c(H2S)=c(H2CO3)=0.001 mol/L, 在CaCO3沉淀区,[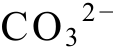 ]与[Ca2+]满足CaCO3溶解平衡的溶度积关系。竖线从上至下, 从左至右的反应方程式依次为:
]与[Ca2+]满足CaCO3溶解平衡的溶度积关系。竖线从上至下, 从左至右的反应方程式依次为:![]() H2S=H++HS-, 4)HS-=H++S2-; 斜线从上至下, 从左至右的反应方程式依次为:5)O2+4H++4e-=2H2O, 6)
H2S=H++HS-, 4)HS-=H++S2-; 斜线从上至下, 从左至右的反应方程式依次为:5)O2+4H++4e-=2H2O, 6)![]() 8)S+2e-+2H+=H2S, 9)
8)S+2e-+2H+=H2S, 9)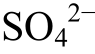 +8e-+10H+=H2S+4H2O,
+8e-+10H+=H2S+4H2O,![]() 8e-+10H+=HS-+Ca2++
8e-+10H+=HS-+Ca2++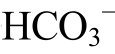 +4H2O, 12)CaCO3+
+4H2O, 12)CaCO3+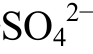
![]() +8e-+8H+=S2-+Ca2++
+8e-+8H+=S2-+Ca2++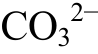 +4H2O, 14)H2-2e-=2H+。
+4H2O, 14)H2-2e-=2H+。
与图1(a)相比, 图1(b)和(c)只有温度发生了变化。
在图1(d)中,T=298 K,c(Ca2+)=c(H2SO4)=c(H2S)=c(H2CO3)=0.01 mol/L, 在CaCO3沉淀区,[CO32-]与[Ca2+]满足CaCO3溶解平衡的溶度积关系;在CaSO4沉淀区, [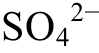 ]与[Ca2+]满足CaSO4溶解平衡的溶度积关系。
]与[Ca2+]满足CaSO4溶解平衡的溶度积关系。
与图1(d)相比, 图1(e)和(f)只有温度发生了变化。
从图1中任意一个图来看, 当pH降低时, 各类酸根离子容易捕获氢离子, 倾向于以未电离形式存在; 同时, CaCO3会转变为CaSO4, 最终CaSO4也进一步溶解, 即CaCO3稳定于碱性及中性环境, CaSO4稳定于弱酸性到中性环境。
对于TSR反应
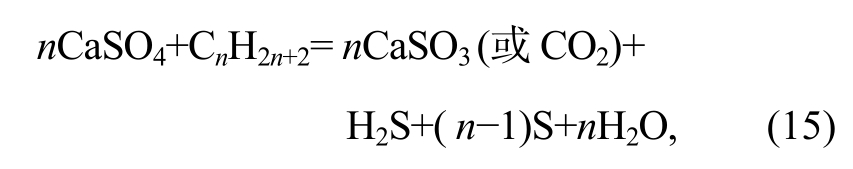
其核心是CaSO4+6e-+8H+=Ca2++S+4H2O和CaSO4+8e-+10H+=Ca2++H2S+4H2O两个半反应。图1中标记为粗线段。
当温度和离子浓度一定时, 增大酸性(降低pH)和还原性(降低Eh)将促使反应向H2S方向移动, 增大碱性(升高pH)和氧化性(升高Eh)将促使反应向CaSO4方向移动, 即酸性环境和还原性环境将促进TSR反应的发生。
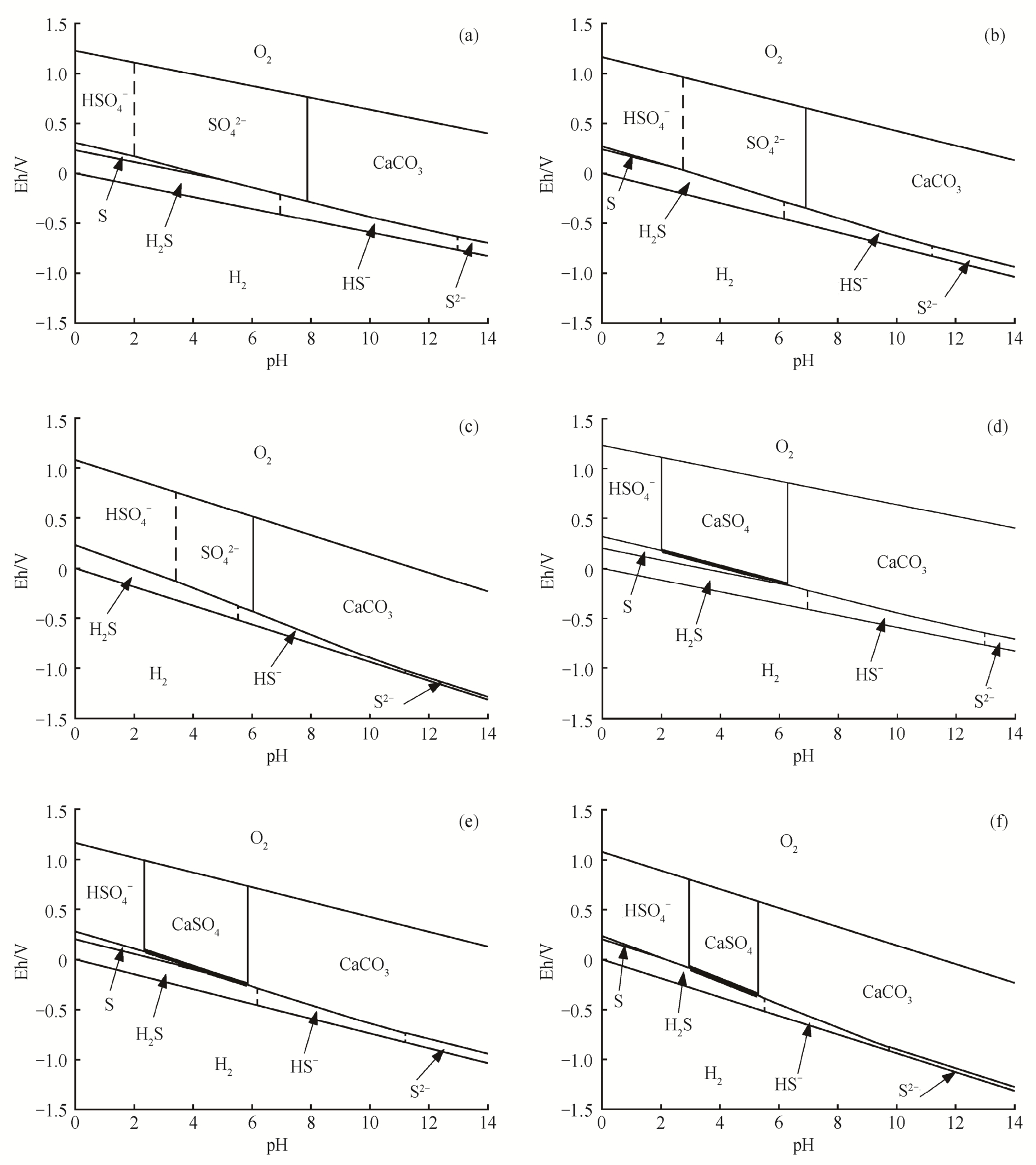
图1 不同温度和离子浓度下的CaO-SO2-CO2-H2O四元Eh-pH相图
Fig.1 Eh-pH phase diagrams of the CaO-SO2-CO2-H2O quaternary system in different temperatures and different ionic concentrations
(a)T=298 K,c=0.001 mol/L; (b)T=373 K,c=0.001 mol/L; (c)T=473 K,c=0.001 mol/L;(d)T=298 K,c=0.01 mol/L; (e)T=373 K,c=0.01 mol/L; (f)T=473 K,c=0.01 mol/L
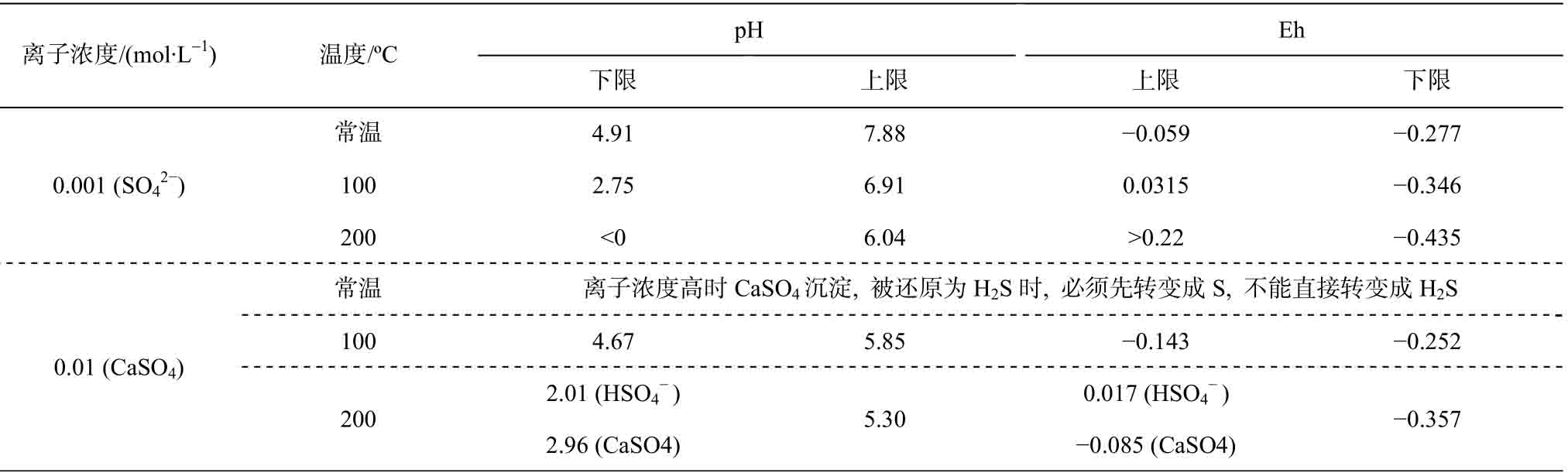
若不考虑动力学壁垒(超电势), 可由相图得到 直接向H2S转变(
直接向H2S转变( /H2S)的氧化还原条件和pH条件的上下限(表 4)。
/H2S)的氧化还原条件和pH条件的上下限(表 4)。
在某些情况下, 例如, 当温度为100℃, 离子浓度为0.01 M, pH<4.67, Eh>0.0315时,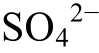 和CaSO4不能直接还原成H2S, 而必须先生成S, 然后生成H2S。Machel[12]在研究碳酸盐岩储层的成岩作用时,曾观察到单质S的存在, 这是上述计算结果的一个很好的例证。
和CaSO4不能直接还原成H2S, 而必须先生成S, 然后生成H2S。Machel[12]在研究碳酸盐岩储层的成岩作用时,曾观察到单质S的存在, 这是上述计算结果的一个很好的例证。
表4 不同温度下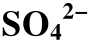 直接向H2S转变(
直接向H2S转变(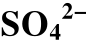 /H2S)的氧化还原条件和pH条件的上下限
/H2S)的氧化还原条件和pH条件的上下限
Table 4 Upper and lower of the REDOX conditions and pH of the reaction that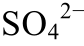 was directly converted to H2S (
was directly converted to H2S ( 4/H2S)at different temperatures
4/H2S)at different temperatures
?
对比 3 种不同温度下的相图可以看到, 当温度升高时, CaCO3的稳定区域略有扩大, CaSO4的稳定区域明显缩小, 即升温时CaSO4变得不稳定, 即使在酸碱度条件不变的情况下也趋于溶解或转变为CaCO3。升高温度时S的稳定区域缩小, 直至消失,说明高温有利于CaSO4或 直接转化为H2S。
直接转化为H2S。
3.1.2 烃类对TSR反应的影响
本文以CH4为例, 根据前人的实验数据[18,23],讨论TSR反应中的还原剂(烃类)的还原性。CH4的电极电势没有数据可查, 但可设计如下电极反应。
负极:
正极:
并且, 根据反应的吉布斯自由能求取电极电势。由此求得φΘ (H2CO3/CH4)=-0.584 V (常温),φΘ (H2CO3/CH4)=-0.655 V (100℃),φΘ (H2CO3/CH4)=-0.750 V (200ºC)。同理可求其他烃类的还原电极电势。
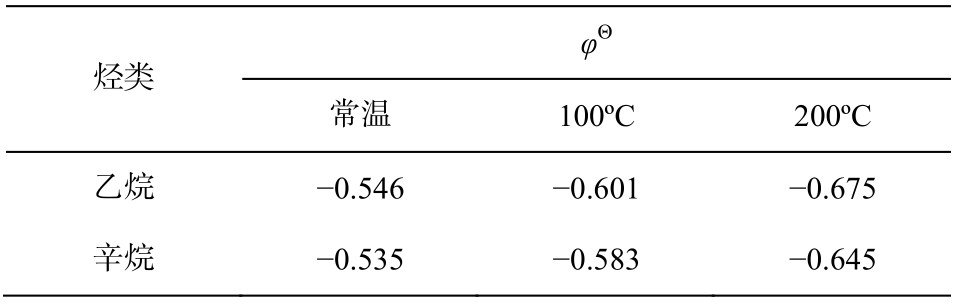
表5中, 乙烷和辛烷两个烃类的还原电极电势均远远低于对应温度下SO42- (CaSO4)直接生成H2S反应区间的Eh下限(表4), 说明包括甲烷、乙烷和辛烷在内的各种烷烃的还原性都很强, 足以将SO42-(CaSO4)直接还原成H2S。从表5还可以看出, 当烃类的碳原子数目增多时, 还原性略为减弱, 因此在烃类中, 甲烷是最强的TSR反应的还原剂。但是,有一些反应动力学的实验研究结果显示, 碳原子增多时, 烷烃从气态变为液态和固态, TSR反应所需要的活化能降低, 更容易发生反应[2,24]。
表5 乙烷和辛烷的标准电极电势
Table 5 Standard electrode potential of ethane and octane
?
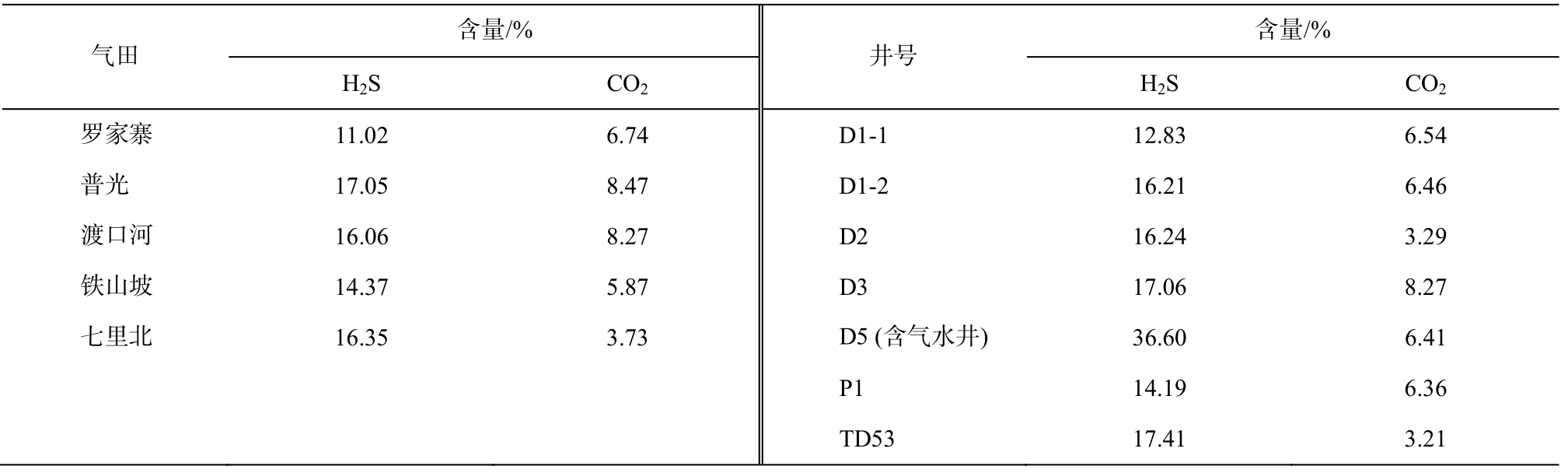
在四川盆地飞仙关组高H2S天然气藏中, 主要的酸性气体是CO2和H2S。根据表6, 将本研究要讨论的CO2含量设定为0%和5%, H2S含量在0%~30%之间。
对于下面这两个气体溶解反应:
根据范特霍夫方程, 可由溶解反应的吉布斯自由能∆r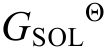 求得溶解反应的平衡常数
求得溶解反应的平衡常数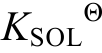 ; 同时根据地温梯度(30ºC/km)、地压梯度(10 kPa/m)与地层深度D的关系:
; 同时根据地温梯度(30ºC/km)、地压梯度(10 kPa/m)与地层深度D的关系:

可求得对应不同温度(常温、100ºC和200ºC)的地层深度D和压力P; 再根据压力P和气体含量的百分数w求得气体分压P(H2S)和P(C2O)。根据溶解反应的溶解平衡:
表6 四川盆地飞仙关组高H2S天然气中H2S含量与CO2含量[2,4]
Table 6 Content of H2S and CO2in the gas with high content of H2S of Feixianguan formation in Sichuan Basin[2,4]
?
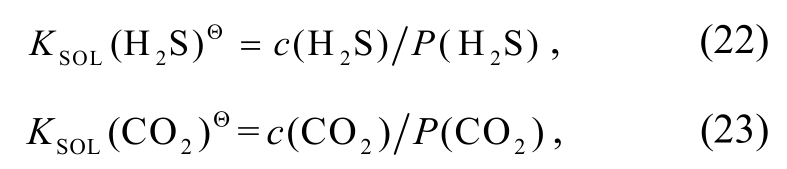
可计算H2S和CO2在溶液中的浓度c(H2S)和c(CO2):
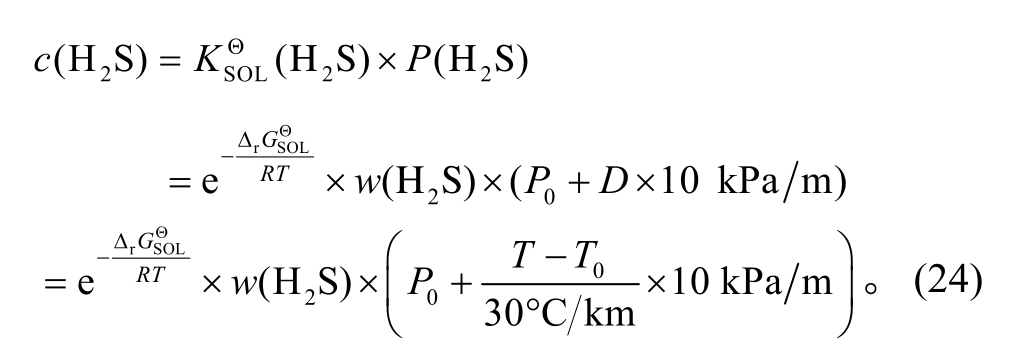
同理, 可求得c(CO2)。根据式(24), 可绘制c(H2S)-D相图(图2)。
根据电离反应
同样, 可由范特霍夫方程通过吉布斯自由能∆r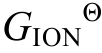 计算电离平衡常数
计算电离平衡常数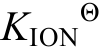 。再根据混合酸的pH计算公式
。再根据混合酸的pH计算公式
求取pH与深度D的函数关系:
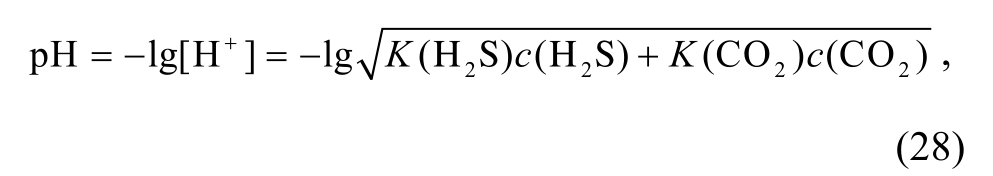
从而绘制pH-D相图(图3)。从图2和3可知, H2S在水中的溶解度随温度升高而减小, 随压力升高而增大,温度和压力对H2S在水中的溶解起相反的作用。在地质环境下, 随着地层深度的增加, 地层温度和压力均随之升高, 导致溶液中H2S浓度随深度增加先增后减。但是, 由于H2S的酸性随温度升高不断增强, 因此溶液的酸性也一直增强。

图2 H2S浓度(c(H2S))与深度(D)的关系
Fig.2 Relation diagram of the concentration of H2S (c(H2S))and depth (D)
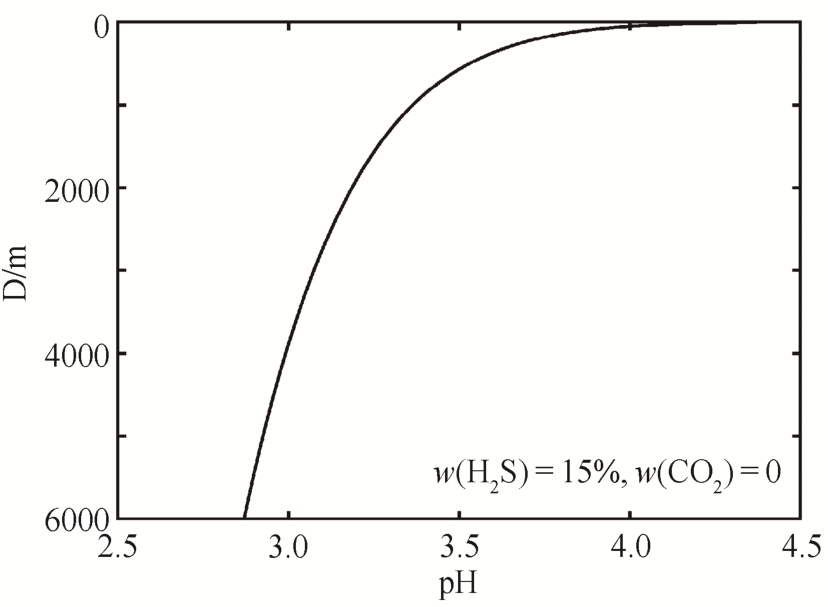
图3 pH与深度(D)的关系
Fig.3 Relation diagram of pH and depth (D)
 相图
相图为了讨论CaCO3和CaSO4在各种条件下的稳定性和溶解情况, 需要绘制Ca2+- 相图(图4)。绘制原理和方法参见2.2.1节。
相图(图4)。绘制原理和方法参见2.2.1节。
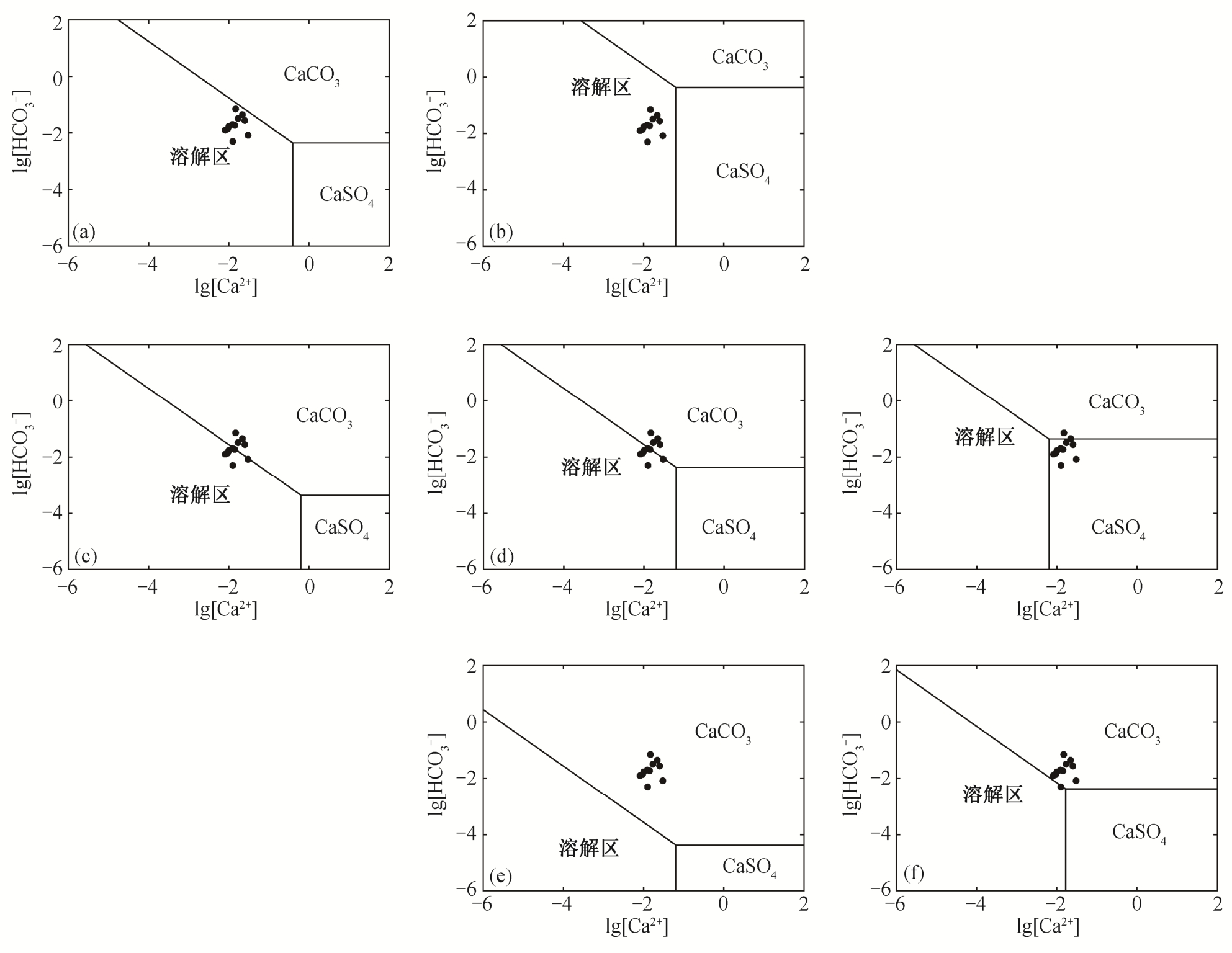
图4 Ca2+-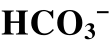 相图
相图
Fig.4 Phase diagram of Ca2+-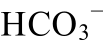
(a)pH=5, [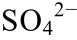 ]=0.01 mol/L,T=273 K; (b)pH=3, [
]=0.01 mol/L,T=273 K; (b)pH=3, [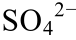 ]=0.01 mol/L,T=323 K; (c)pH=5, [
]=0.01 mol/L,T=323 K; (c)pH=5, [ ]=0.001 mol/L,T=323 K; (d)pH=5,
]=0.001 mol/L,T=323 K; (d)pH=5,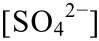 =0.01 mol/L,T=323 K; (e)pH=5, [
=0.01 mol/L,T=323 K; (e)pH=5, [ ]=0.1 mol/L,T=323 K; (f)pH=7,[
]=0.1 mol/L,T=323 K; (f)pH=7,[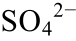 ]=0.01 mol/L,T=323 K; (g)pH=5, [
]=0.01 mol/L,T=323 K; (g)pH=5, [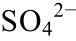 ]=0.01 mol/L,T=373 K
]=0.01 mol/L,T=373 K
从3个方向对比图4(a)~(g), 可以看出: 横向上,固定其他条件, 当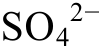 浓度升高时, CaCO3转化为CaSO4; 纵向上, 固定其他条件, 当pH值升高时,CaCO3沉淀; 斜向上, 固定其他条件, 当温度升高时, CaCO3沉淀。
浓度升高时, CaCO3转化为CaSO4; 纵向上, 固定其他条件, 当pH值升高时,CaCO3沉淀; 斜向上, 固定其他条件, 当温度升高时, CaCO3沉淀。
根据飞仙关组地层水的离子浓度值在图4中的投影点可知, CaCO3处于沉淀和溶解的边缘, 少量酸性流体的加入就会使其从沉淀转为溶解, 而当Ca2+和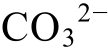 浓度升高时, 又能达到新的沉淀-溶解平衡。上述实例说明, 本文模型的计算结果与实际地质情况相符。
浓度升高时, 又能达到新的沉淀-溶解平衡。上述实例说明, 本文模型的计算结果与实际地质情况相符。
从图2~4可知, 当地层深度增加时, 体系的温度会升高, 溶液的pH值也降低。这两个因素对CaCO3的溶解起相反的作用。假设溶液中Ca2+和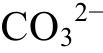 全部为H2S对CaCO3的溶解产物, 二者浓度相等, 溶液中Ca2+的量即是该pH条件下溶液能溶解的CaCO3的量, 根据CaCO3的溶解方程, 可以建立c(Ca2+)与pH的关系, 再根据pH与深度的关系(图3),绘制c(Ca2+)与深度的关系图(图5)。
全部为H2S对CaCO3的溶解产物, 二者浓度相等, 溶液中Ca2+的量即是该pH条件下溶液能溶解的CaCO3的量, 根据CaCO3的溶解方程, 可以建立c(Ca2+)与pH的关系, 再根据pH与深度的关系(图3),绘制c(Ca2+)与深度的关系图(图5)。
在不同H2S和CO2含量条件下,c(Ca2+)-D相图(图5)的形状都类似, 均是在深度为1000 m左右时,溶解作用达到最佳效果。
在得到上述结论后, 可以就H2S对碳酸盐岩储层的溶蚀作用做一个估算。当深度约为1000 m时,对于孔隙度为5%的1 m3碳酸盐岩, 如果其孔隙中充满浓度为0.75 mol/L的H2S溶液(对应H2S在气体中的含量为15%), 则CaCO3被溶解的体积为
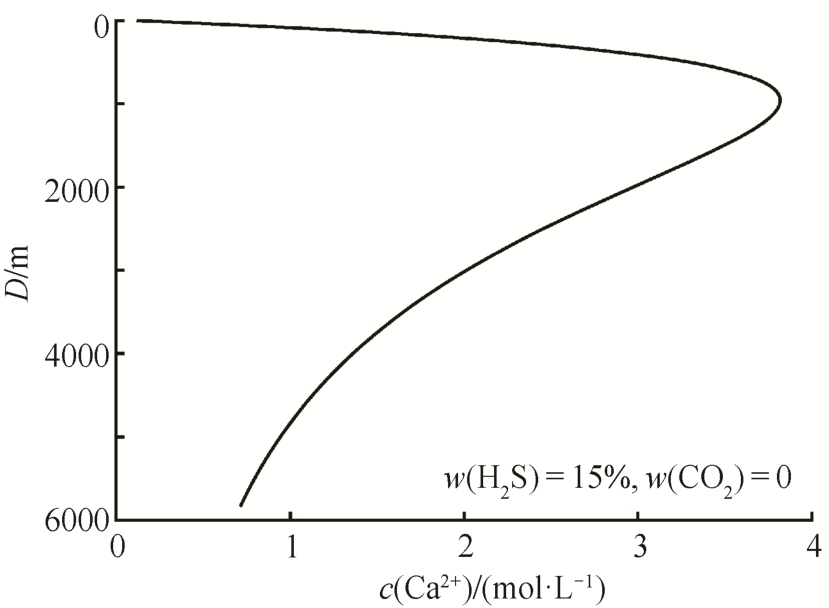
图5 一定浓度下的H2S溶液所能溶解的CaCO3量与深度的关系
Fig.5 Relation diagram of the amount of substance of CaCO3soluted by H2S
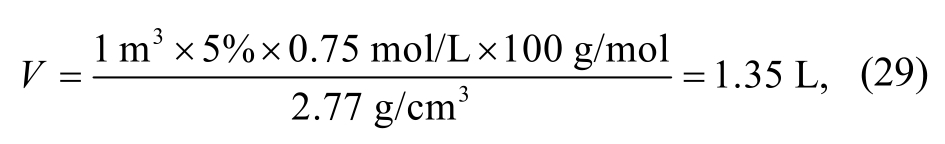
单次溶蚀孔隙度的增加幅度不到0.2%。然而, 在飞仙关组高H2S气藏的碳酸盐岩储层中, 孔隙度实际上达到10%, 甚至20%, 这意味着需要接受长期、多次和充足的流体注入。以体积为1 m3, 孔隙度为10%的碳酸盐岩储层为例, 假设其孔隙全部来自H2S的溶蚀, 而H2S全部由TSR反应生成, 那么需要的H2S为
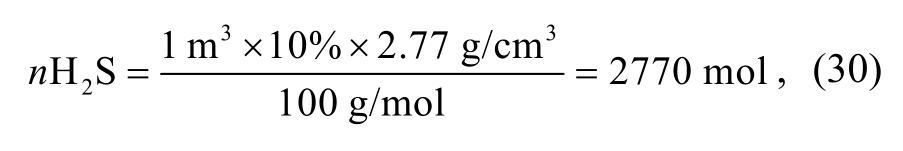
对应CaSO4体积为
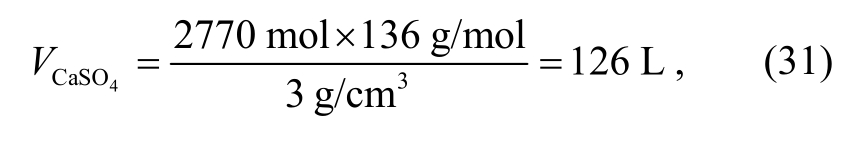
占上述假设的1 m3储层体积的12.6%。
根据地质观察, 碳酸盐岩储层一般很少含这么多的CaSO4。根据对高H2S气田的实际观察, 碳酸盐岩储层与CaSO4互层有利于TSR反应的发生, 即烃类与CaSO4层反应产生H2S而形成酸性流体, 经过运移, 注入碳酸盐岩储层的孔隙和裂缝中, 经过长期、多次和充足的改造后, 储层状况得到改善。
本文利用物理化学原理, 通过热力学计算, 绘制了热力学相图, 求取不同温度下CaSO4(或SO42-)被直接还原为H2S的物理化学条件, 定量地估算TSR反应的产物H2S对碳酸盐岩储层的溶蚀改造作用, 得到以下结论。
1)在温度为常温、100ºC和200ºC时, 以CH4为代表的烃类在弱酸性环境中将CaSO4直接还原成H2S的反应(即TSR反应)从热力学上讲是自发的, 增强酸性有利于这一反应的发生。
2)根据本文的模型推算, H2S对CaCO3的溶蚀效果在深度约为1000 m时达到最大。
3)长期、多次的TSR反应才能产生充足的酸性流体, 其后的溶蚀反应也才能对碳酸盐岩储层产生明显的改造效果。因此, 与碳酸盐岩储层互层的CaSO4有利于TSR反应和溶蚀反应的发生。
[1]朱光有, 张水昌, 梁英波, 等.TSR对深部碳酸盐岩储层的溶蚀改造——四川盆地深部碳酸盐岩优质储层形成的重要方式.岩石学报, 2006, 22(8): 2182‒2194
[2]朱光有, 张水昌, 梁英波, 等.四川盆地高含 H2S 天?然气的分布与 TSR 成因证据.地质学报, 2006, 80(8): 1208‒1218
[3]Orr W L.Changes in sulfur content and isotopic ratios of sulfur during petroleum maturation — study of Big Horn basin paleozoic oils.AAPG Bulletin, 1974,58(11): 2295‒2318
[4]王一刚, 窦立荣, 文应初, 等.四川盆地东北部三叠系飞仙关组高含硫气藏 H2S 成因研究.地球化学,2002, 31(6): 517‒524
[5]张水昌, 朱光有, 何坤.硫酸盐热化学还原作用对原油裂解成气和碳酸盐岩储层改造的影响及作用机制.岩石学报, 2011, 27(3): 809‒826
[6]Helgeson H C, Kirkham D H.Theoretical prediction of the thermodynamic behavior of aqueous electrolytes at high pressures and temperatures IV.American Journal of Science, 1981, 281: 1249‒1516
[7]Hill C A.H2S-related porosity and sulfuric acid oil-?field karst.Alburquerque: AAPG Special Volumes,1995: 301‒306
[8]?Hill C A.Sulfuric acid speleogenesis of carlsbad cavern and its relationship to hydrocarbons, Delaware basin, New Mexico and Texas.AAPG Bulletin, 1990,74(74): 1685‒1694
[9]Seewald J S.Organic-inorganic interactions in petroleum-producing sedimentary basins.Nature, 2003,426: 327‒333
[10]戴金星.中国含硫化氢的天然气分布特征、分类及其成因探讨.沉积学报, 1985, 3(4): 109‒120
[11]戴金星, 胡见义, 贾承造, 等.科学安全勘探开发高硫化氢天然气田的建议.石油勘探与开发, 2004,31(2): 1‒4
[12]Machel H G.Bacterial and thermochemical sulfate reduction in diagenetic settings — old and new insights.Sedimentary Geology, 2001, 140(1/2): 143‒175
[13]Worden R H, Smalley P C, Oxtoby N H.Gas souring by thermochemical sulfate reduction at 140°C.AAPG Bulletin, 1995, 79(6): 854‒863
[14]Zhang T, Amrani A, Ellis G S, et al.Experimental investigation on thermochemical sulfate reduction by H2S initiation.Geochimica et Cosmochimica Acta,2008, 72(14): 3518‒3530
[15]Tang Y, Ellis G S, Zhang T, et al.Effect of aqueous chemistry on the thermal stability of hydrocarbons in petroleum reservoirs.Geochmica et Cosmochimica Acta, 2005, 69(10): A559
[16]范明, 胡凯, 蒋小琼, 等.酸性流体对碳酸盐岩储层的改造作用.地球化学, 2009, 38(1): 20‒26
[17]罗厚勇, 王万春, 刘文汇.TSR模拟实验研究与地质实际的异同及可能原因分析.石油实验地质,2012, 34(2): 186‒192
[18]岳长涛, 李术元, 丁康乐, 等.甲烷和固态硫酸钙的热化学还原反应模拟实验初步研究.地球化学,2003, 32(6): 601‒605
[19]张单明, 秦善, 刘波, 等.碳酸盐岩‒H2S平衡体系原位溶蚀模拟实验及其地质意义.北京大学学报(自然科学版), 2015, 51(4): 745‒754
[20]张建勇, 刘文汇, 范明, 等.TSR 产物对碳酸盐岩储层是否具有改良作用——实验地质学的依据.海相油气地质, 2008, 13(2): 57‒61
[21]张建勇, 刘文汇, 腾格尔, 等.TSR对气态烃组分及碳同位素组成的影响——高温高压模拟实验的证据.石油实验地质, 2012, 34(1): 66‒70
[22]赵兴齐, 陈践发, 郭望, 等.川东北飞仙关组高含H2S 气藏油田水地球化学特征.中南大学学报(自然科学版), 2014(10): 3477‒3488
[23]Cai C, Xie Z, Worden R H, et al.Methane-dominated thermochemical sulphate reduction in the Triassic Feixianguan Formation East Sichuan Basin, China:towards prediction of fatal HS concentrations.Marine& Petroleum Geology, 2004, 21(10): 1265‒1279
[24]胡安平, Li Maowen, 杨春, 等.川东北高含硫化氢气藏中储层沥青的特征.石油学报, 2010, 31(2):231‒236
Physicochemical Estimation of Geochemical Conditions in TSR Reaction