大兴安岭森林土壤胞外酶活力的时空动态及其对潜在碳矿化的影响
左宜平1,2张馨月3曾辉1王娓2,†
1.北京大学深圳研究生院, 深圳 518055; 2.北京大学城市与环境学院, 北京 100871; 3.中国农业科学院, 北京 100081; †通信作者, E-mail: wangw@urban.pku.edu.cn
摘要为探索寒温带土壤胞外酶活力的时空动态, 并分析胞外酶对土壤潜在碳矿化速率的影响, 于夏季和冬季在大兴安岭采集3种植被(樟子松、白桦和落叶松)的森林土壤和落叶松林中3种地被层(草本、杜香和苔藓)的土壤, 分别测定与碳(β-葡萄糖苷酶、β-木糖苷酶和纤维二糖水解酶)、氮(N-乙酰-β-D-葡萄糖苷酶和亮氨酸氨基肽酶)、磷(酸性磷酸酶)代谢相关的6种胞外酶活力、潜在碳矿化速率和主要的环境因子。结果表明, 樟子松林和白桦林土壤冬季胞外酶活力均显著低于夏季, 而落叶松林则由于林下苔藓层土壤冬季显著增加胞外酶活力, 呈现不一致的规律。从夏季到冬季, 3种森林类型及3种地被层植物土壤一致地表现为磷限制减弱, 氮限制增强; 樟子松林和白桦林土壤均表现为能量限制增强, 养分限制减弱, 落叶松林土壤则由于苔藓层的相反趋势表现为夏季具有较强的能量限制, 冬季具有较强的养分限制。樟子松林和落叶松林土壤在冬季具有较强的潜在碳矿化速率, 而白桦林则相反, 夏季大于冬季。土壤潜在碳矿化速率受碳代谢酶和氮代谢酶的影响较大, 几乎不受磷酸酶的影响, 但土壤中氮磷元素的相对限制情况对有机碳分解的影响较大, 表现为磷比氮的限制增强, 土壤碳矿化速率减弱。
关键词土壤胞外酶; 潜在碳矿化速率; 季节动态; 森林类型; 地被植物
土壤胞外酶(extracellular enzyme, EE)广泛存在于土壤中, 是由植物根系及土壤微生物分泌到土壤中发挥催化作用的蛋白质[1–2]。胞外酶在土壤中具有不可替代的关键作用, 参与土壤中几乎所有的化学反应, 将微生物及植物无法吸收的大分子有机物降解为可吸收的小分子物质[3]。由于对环境变化的高度敏感性, 土壤胞外酶活力(extracellular enzyme activity, EEA)可以用来表征土壤中有机质的分解速率, 反映植物–土壤–微生物系统的变化[4]。同时, 在生态系统水平上, 胞外酶活力的矢量特征可用来表征微生物代谢的“能量相对于养分(C vs. nutrient)”与“磷相对于氮(P vs. N)”的限制情况[5–6]。
土壤中胞外酶的种类众多, 功能各异。不同的胞外酶之间既有明确的分工, 催化不同的反应阶段,也依靠协同作用, 共同维持生态系统的整体功能。近年来, 与碳代谢相关的β-1,4-葡萄糖苷酶(BG), 与氮代谢相关的N-乙酰-β-D-葡萄糖苷酶(NAG)和亮氨酸氨基肽酶(LAP), 以及与磷代谢相关的酸性磷酸酶(AP)被广泛研究[4,7], 原因在于这几种酶主要参与末端的催化反应, 可以反映土壤的碳氮磷代谢水平。在此基础上衍生出的土壤胞外酶活力的化学计量比(enzymatic stoichiometry)可用来表征土壤的能量及养分限制状况。有meta分析结果表明, ln(BG): ln(NAG+LAP):ln(AP)在全球尺度趋于1:1:1[7]。然而, 近期的研究指出, 不同生态系统及微生物群落的代谢途径有所差别, 仅使用BG酶, 无法全面地反映生态系统的碳代谢功能, 使用参与碳代谢的酶的综合活力来表征微生物群落的碳代谢功能更为合理[8–10]。
土壤胞外酶酶库的大小取决于胞外酶的生产、稳定和周转[11–12]。同时, 生物因素及土壤非生物因素都会对以上过程产生影响[13–14]。目前, 针对气候因素、植被类型、土壤理化性质和微生物群落结构对胞外酶的影响均有广泛的研究, 发现土壤胞外酶活力受环境因子和生物因子等多种因素的影响, 并且不同的自变量之间存在很强的交互作用[15–16]。季节动态涵盖多种环境指标及微生物特征的变化, 研究胞外酶活力的季节动态可以间接地反映微生物功能对气候及环境因子变化的综合响应[17–18]。由于不同研究区域之间的环境异性较大, 加上土壤胞外酶种类繁多, 目前关于土壤胞外酶活力的季节动态并没有获得一致的规律[19–21]。此外, 现有的胞外酶活力季节动态的研究较多地关注参与碳代谢的酶, 缺乏同一地区内不同功能的酶活力的季节动态的综合比较[22–23]。由于碳代谢的酶直接反映生态系统的能量流动情况, 而氮磷代谢的酶代表生态系统的养分循环能力, 因此有必要整合土壤中参与碳氮磷代谢的三类酶的季节动态来探索不同季节间微生物代谢的养分及能量限制情况。此外, 同一森林类型中, 不同地被植物之间土壤胞外酶活力的差异也很少被研究。
土壤呼吸是陆地生态系统与大气进行物质和能量交换的重要途径, 主要包括根系的自养呼吸以及微生物的异养呼吸[24–25]。其中, 微生物的异养呼吸过程伴随着土壤有机物的分解, 反映土壤的碳矿化速率[26]。作为土壤中几乎所有化学过程的催化剂, 土壤胞外酶在土壤有机质分解中的作用始终是研究的热点问题。从最初的酶分解模型(enzymedecay models, EDMs)认为“不同种类的胞外酶控制不同的物质分解”[27–28], 到后来的酶化学计量理论(enzyma-tic stoichiometry theory, EST)将多种胞外酶活力作为一个“土壤酶系统”来探究胞外酶的整体功能[1,7], 对胞外酶的研究已经取得明显的进展。但是, 由于EDMs和EST理论均未将微生物生物量和代谢活力纳入考量, 只表征胞外酶的分布现象, 尚难解释底物–酶–微生物(substrate-enzyme-microbe, SEM)之间的有机质分解机理[29]。以往对土壤胞外酶的研究多数局限在胞外酶的时空格局及影响因素上, 很少将胞外酶的格局与有机质分解相联系[14,30]。
大兴安岭作为我国唯一的寒温带森林草地交错带, 在时间尺度上, 具有鲜明的季节性气候变化, 为研究微生物功能对气候变化的响应提供了自然环境; 在空间尺度上, 大兴安岭森林类型丰富, 且在兴安落叶松林中具有灌丛、草本及苔藓等多种地被植物, 有利于研究在相同气候背景下, 地上植被对微生物特征的影响, 并能够补充对同一森林中不同地被植物下土壤胞外酶活力及潜在碳矿化速率是否存在显著差异的探讨。
本研究采集夏季和冬季大兴安岭樟子松林、白桦林、兴安落叶松林等3种不同的森林土壤, 以及落叶松林中的杜香、草本、苔藓等3种不同的地被层下土壤, 通过分析土壤胞外酶活力及土壤潜在碳矿化速率的时空动态, 研究季节、森林类型和地被植物对微生物群落功能的影响, 并探索胞外酶活力与土壤潜在碳矿化速率的关系。
1 材料与方法
1.1 研究区域概况
本研究的采样地点在黑龙江省大兴安岭地区呼玛县呼中林草交错带(E122°50′, N51°39′)。该区域为寒温带大陆性季风气候, 昼夜温差较大, 年均温为–2.8ºC, 最低温度为–52.3ºC, 无霜期90~110天, 年平均降水量为746mm。依据中国土壤系统分类(CST, 1999), 该区域的土壤类型主要有均腐土(Isohumosols)和淋溶土(Argosols)。森林类型主要有兴安落叶松林、樟子松林和白桦林; 植被类型主要有杜鹃(Rhododendron simsii)、白桦(Betulaplaty-phylla)、越桔(Vaccinium vitis-idaea)和杜香(Ledum palustre)。在研究区域内, 0~5cm的表层土壤有机质含量的整体水平为12.6%~23.1%, 土壤铵态氮的水平为11.9~23.1mg/kg, 硝态氮为0.16~0.48 mg/kg, 有效磷含量为2.45~7.71 mg/kg[31]。
1.2 研究方法
1.2.1 样地设置与样品采集
在研究区域内, 于2013年7月(夏季)和2013年12月(冬季)选取3种不同的森林类型, 分别是樟子松林(Pinus sylvestris)、白桦林(Betula platyphylla)和兴安落叶松林(Larixolgensis), 分别在其中划定100m×100m的实验区域, 并在实验区域内随机选取3个5m×5m的样方。其中, 白桦林和樟子松林无林下地被植物, 在每个样方内按照五点取样法采集0~20cm深度的土壤, 同一个样方中的5个样点土壤均匀混合备用; 兴安落叶松林中林下地被植物生长茂盛, 主要以杜香、草类和苔藓组成, 在每个样方中, 按照五点取样法分别取3种不同地被层下的土壤, 并将同种植被下的5个样点土壤分别混合均匀作为实验样本。采集的土壤立即用自封袋密封放入冰盒中, 运回实验室。所有土壤均过2mm孔径的网筛, 除去可见的根系及砾石后, 分两部分储存。一部分置于4ºC冷藏待用, 一部分置于-20ºC冷冻储存。土壤胞外酶的测定需在7天内完成[32]。落叶松林土壤的各项生物及非生物指标均以杜香、草本和苔藓等3种地被植物下土壤的平均值来表示。
1.2.2 土壤胞外酶活力测定
本研究共测定6种水解酶, 分别是与碳代谢相关的β-葡萄糖苷酶(β-1,4-glucosidase, BG)、β-木糖苷酶(β-1,4-xylosidase, XS)和纤维二糖水解酶(β-D-cellobiohydrolase, CB), 与氮代谢相关的N-乙酰-β-D-葡萄糖苷酶(N-acetyl-β-glucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及与磷代谢相关的酸性磷酸酶(acid phosphatase, AP)。不同胞外酶的功能详见表1。
表1 土壤胞外酶名称、缩写及其功能
Table 1 Full names, abbreviations and functions of soil extracellular enzymes
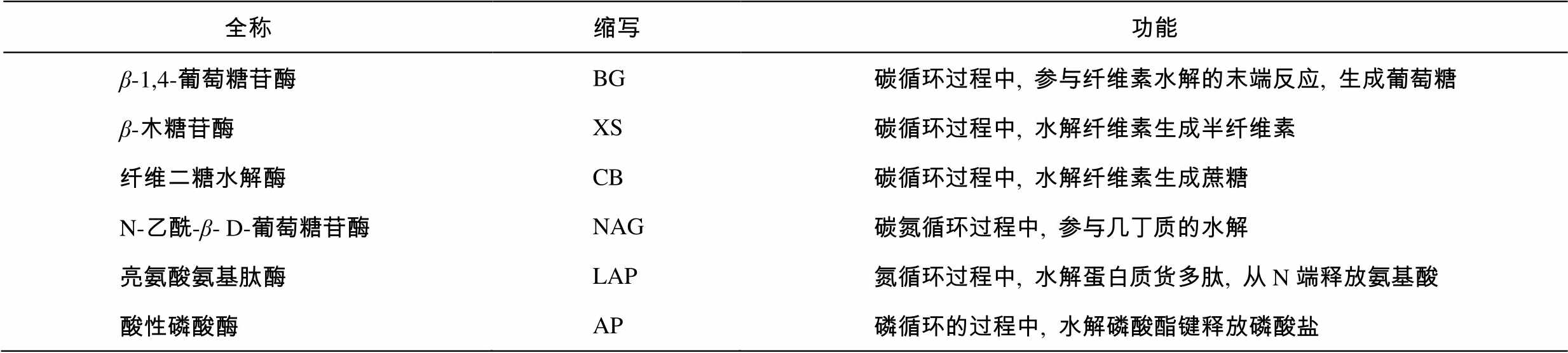
全称缩写功能 β-1,4-葡萄糖苷酶BG碳循环过程中, 参与纤维素水解的末端反应, 生成葡萄糖 β-木糖苷酶XS碳循环过程中, 水解纤维素生成半纤维素 纤维二糖水解酶CB碳循环过程中, 水解纤维素生成蔗糖 N-乙酰-β- D-葡萄糖苷酶NAG碳氮循环过程中, 参与几丁质的水解 亮氨酸氨基肽酶LAP氮循环过程中, 水解蛋白质货多肽, 从N端释放氨基酸 酸性磷酸酶AP磷循环的过程中, 水解磷酸酯键释放磷酸盐
酶活力的测定采用荧光法, 原理是4-甲基伞形酮(4-Methylumbelliferone, MUB)或7-氨基-4-甲基香豆素(7-Amino-4-methylcoumarin, MUC)在365nm波长处激发, 能在460nm处检测到荧光[33]; 当它们与酶代谢的产物结合后, 荧光特性会消失, 而在酶的水解作用下又会将其释放出来[34], 因此可以通过检测荧光量来表征酶的活力。测定流程如下: 称取2.75±0.01g的鲜土, 置于150mL的烧杯中, 加入91mLTris-Base缓冲液(调整为接近土壤pH:4.25~ 6.10), 在搅拌器上搅拌1分钟混合均匀; 用移液枪分别吸取200μL的土壤溶液和50μL底物(浓度为200μM)添加到微孔板中(每个样品设定6个重复), 随后放入25ºC恒温培养箱中培养3小时, 在酶标仪中进行读数。其中BG, CB, XS, NAG和AP的荧光读数可依据MUB的标准曲线(浓度范围: 0, 2.5, 5, 10, 25, 50, 100 μM)换算成MUB的浓度, LAP的荧光读数可依据MUC的标准曲线换算成MUC的浓度, 最后通过土壤干重和反应时间来计算水解酶的活力, 以nmol activity∙g−1dry soil∙h−1为单位来表示。
1.2.3 土壤潜在碳矿化速率的测定
土壤潜在碳矿化速率(即土壤微生物呼吸)采用实验室培养–碱液吸收法测定: 称取25±0.5g的鲜土, 置于连体瓶的锥形瓶一侧, 在试管一侧加入10mL 0.5 mol/L的NaOH溶液, 25ºC恒温培养3天, 利用盐酸滴定法测定NaOH溶液中吸收的二氧化碳量。通过计算, 可获得微生物在恒温培养期间的平均呼吸速率, 单位统一调整为mg C∙kg-1dry soil∙day-1和mg C∙g-1soil C∙day-1[35]。
1.2.4 土壤理化性质测定
土壤含水量的测定采用烘干称重法: 称取25± 0.5g土壤置于铝盒中, 烘干24小时以上至恒重, 测定烘干前后土壤的质量, 计算质量损失比即为土壤含水量。用pH计测定土壤的pH值:称取10±0.5g干土, 加入25mL去离子水, 在磁力搅拌器上搅拌均匀, 插入校准过的pH计(Denfer MP511, USA), 示数稳定后读数。土壤碳和氮含量采用元素分析仪测定(Vario EL Ⅲ, Elementar, Hanau, Germany), 土壤磷含量采用钼蓝比色法测定。不同森林植被和林下地被层土壤的理化性质见表2。
1.3 数据处理及统计分析
土壤胞外酶活力的矢量特征计算: 以碳代谢酶的活力占碳磷总酶活力的百分比作为X轴, 以碳代谢酶占碳氮总酶活力的百分比作为Y轴。在坐标轴上描出样点的坐标, 并连接(X,Y)与坐标轴的原点(0, 0), 获得一条以(0, 0)为起点, 以(X,Y)为终点的矢量线段。矢量的长度(vector length)用来表征能量相对于养分(C vs. nutrient)的限制, 矢量与X轴的夹角(vectorangle)用来表征磷元素相对于N元素(P vs. N)的限制程度[36]。计算公式如下:
表2 土壤理化性质
Table 2 Soil physiochemical properties
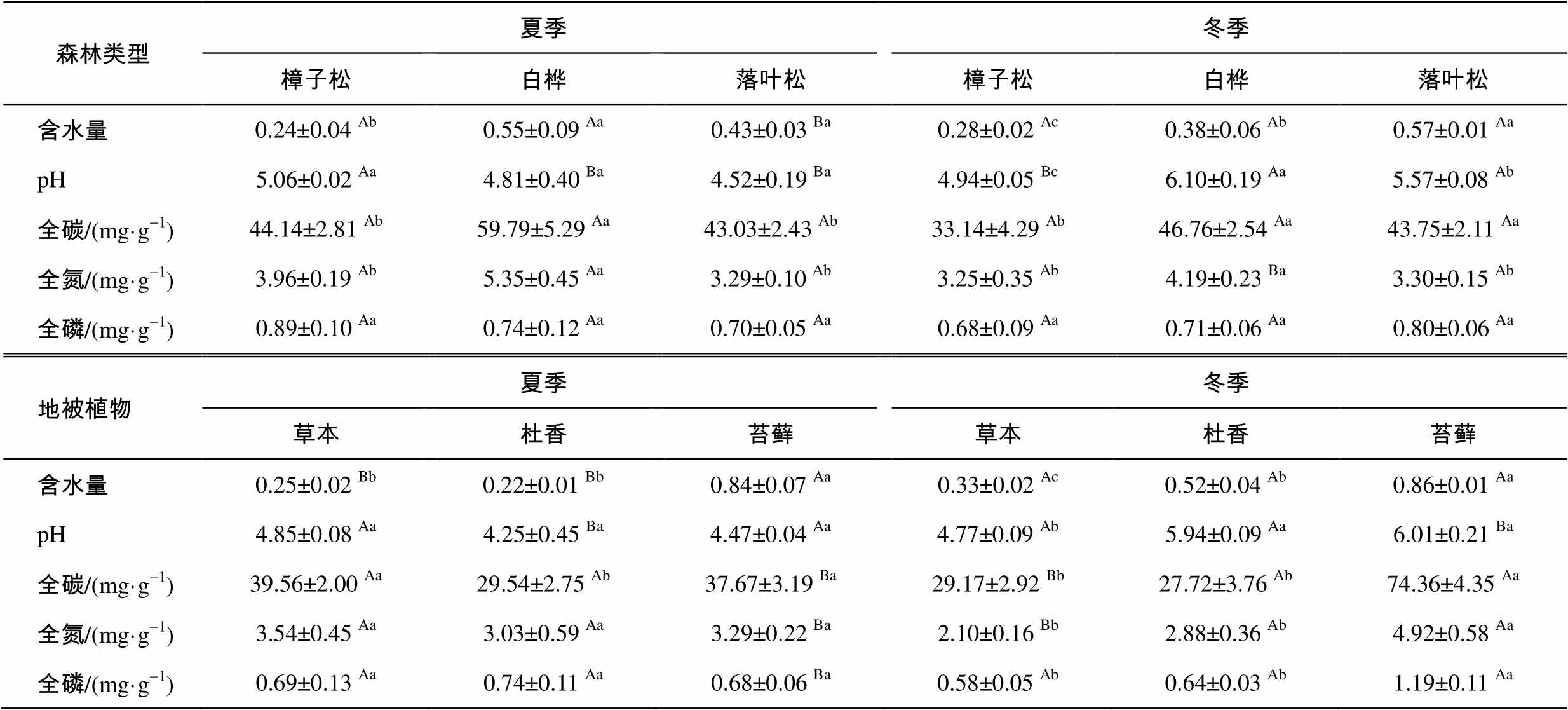
森林类型夏季冬季 樟子松白桦落叶松樟子松白桦落叶松 含水量0.24±0.04 Ab0.55±0.09 Aa0.43±0.03 Ba0.28±0.02 Ac0.38±0.06 Ab0.57±0.01 Aa pH5.06±0.02 Aa4.81±0.40 Ba4.52±0.19 Ba4.94±0.05 Bc6.10±0.19 Aa5.57±0.08 Ab 全碳/(mg·g-1)44.14±2.81 Ab59.79±5.29 Aa43.03±2.43 Ab33.14±4.29 Ab46.76±2.54 Aa43.75±2.11 Aa 全氮/(mg·g-1)3.96±0.19 Ab5.35±0.45 Aa3.29±0.10 Ab3.25±0.35 Ab4.19±0.23 Ba3.30±0.15 Ab 全磷/(mg·g-1)0.89±0.10 Aa0.74±0.12 Aa0.70±0.05 Aa0.68±0.09 Aa0.71±0.06 Aa0.80±0.06 Aa 地被植物夏季冬季 草本杜香苔藓草本杜香苔藓 含水量0.25±0.02 Bb0.22±0.01 Bb0.84±0.07 Aa0.33±0.02 Ac0.52±0.04 Ab0.86±0.01 Aa pH4.85±0.08 Aa4.25±0.45 Ba4.47±0.04 Aa4.77±0.09 Ab5.94±0.09 Aa6.01±0.21 Ba 全碳/(mg·g-1)39.56±2.00 Aa29.54±2.75 Ab37.67±3.19 Ba29.17±2.92 Bb27.72±3.76 Ab74.36±4.35 Aa 全氮/(mg·g-1)3.54±0.45 Aa3.03±0.59 Aa3.29±0.22 Ba2.10±0.16 Bb2.88±0.36 Ab4.92±0.58 Aa 全磷/(mg·g-1)0.69±0.13 Aa0.74±0.11 Aa0.68±0.06 Ba0.58±0.05 Ab0.64±0.03 Ab1.19±0.11 Aa
说明: 方差分析结果用字母标记法展示, 其中不同的大写字母表示同种森林类型(或地被植物)的土壤理化性质在夏季和冬季之间的差别,不同的小写字母表示同一季节内不同森林类型(或地被植物)的土壤理化性质之间的差异。
X= (BG+XS+CB)/[(BG+XS+CB)+AP],
Y= (BG+XS+CB)/[(BG+XS+CB)+(NAG+LAP)],
矢量长度= SQRT(X2+Y2),
矢量角度= DEGREES((ATAN2(X;Y))。
当酶活力的数据不满足正态分布时, 采用对数转换使数据达到正态分布, 以便进行后续的统计分析。重复测量方差分析用于分析季节和植被类型及其交互作用、季节和地被植物及其交互作用对土壤胞外酶、酶的矢量特征及土壤潜在碳矿化的影响。皮尔森相关分析用于分析土壤微生物学特征与非生物因子的相关关系。一般线性回归分析用于分析单一土壤理化性质及酶活力指标对土壤潜在碳矿化的影响。结构方程模型用于构建胞外酶活力对土壤潜在碳矿化影响的过程分析。数据分析采用SPSS22.0及Amos17.0, 使用Graphpad做图。
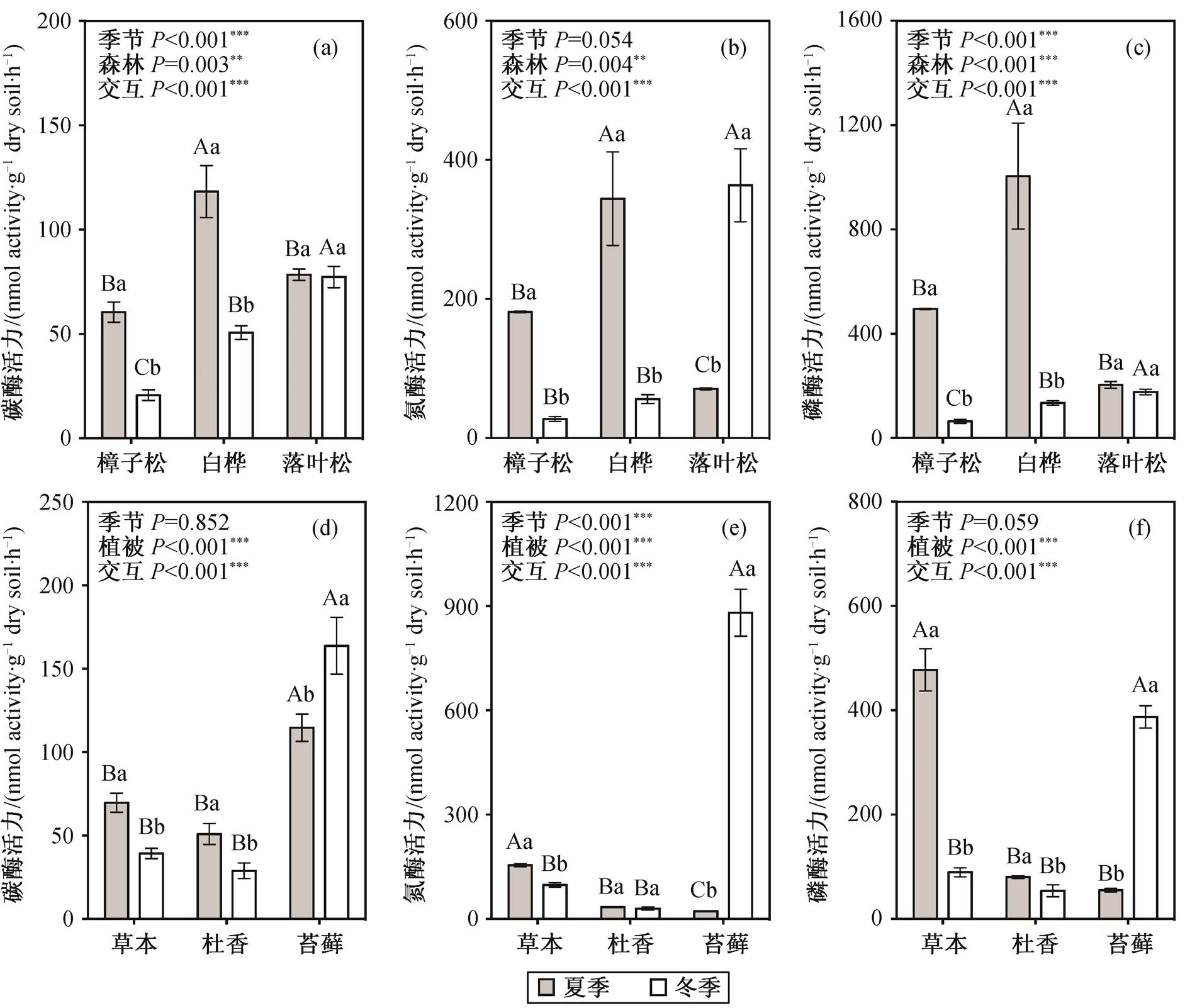
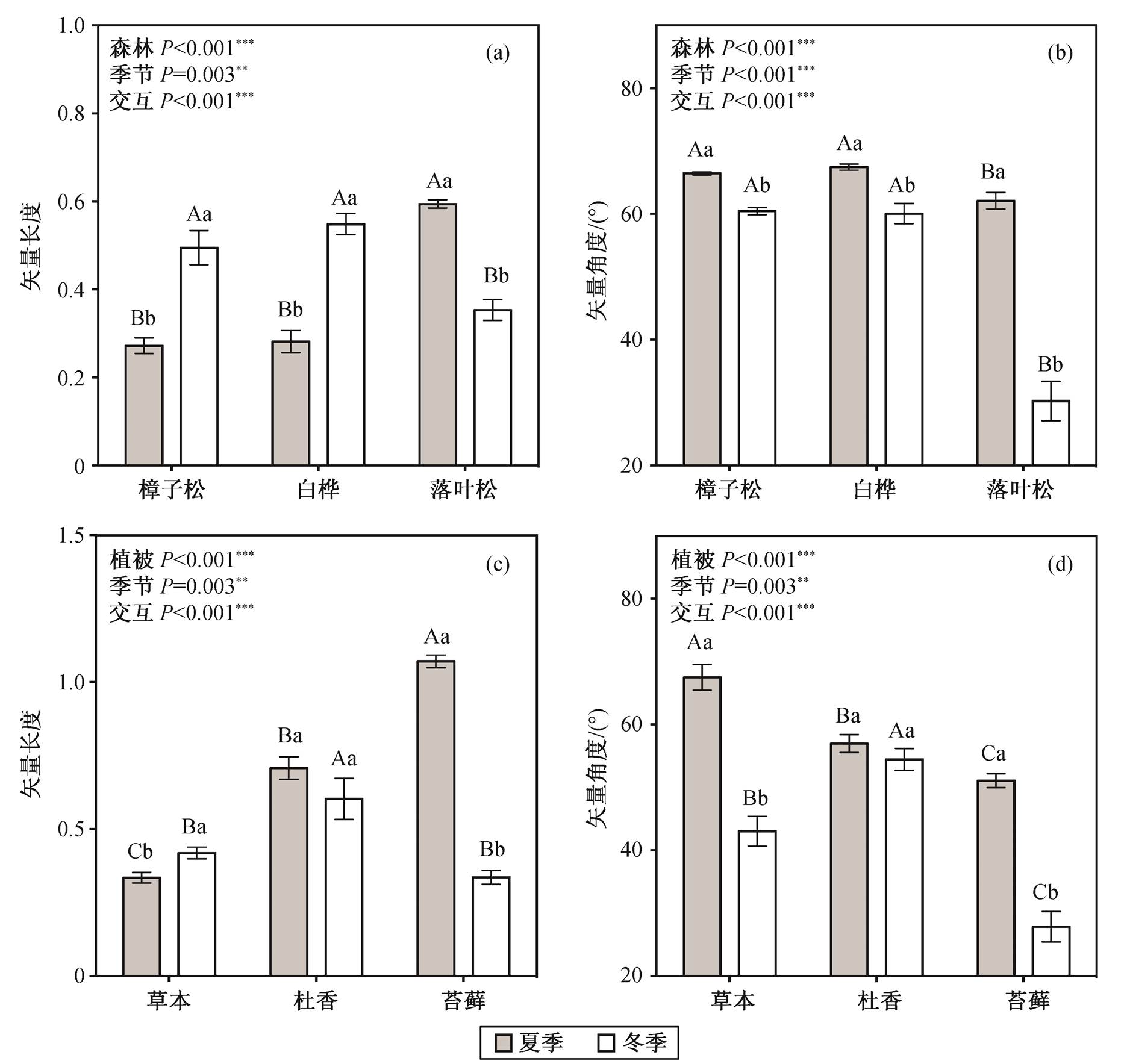
不同大写字母表示不同森林类型或不同林下地被层土壤之间差异的显著性, 不同小写字母表示同一森林类型或同一地被植物下不同季节之间差异的显著性(Duncan’s多重比较,P=0.05); 误差棒代表标准误差, **表示P<0.01, ***表示P<0.001
图1 不同森林类型下((a), (b)和(c))及落叶松林中不同地被植物下((d), (e)和(f))胞外酶活力的季节动态
Fig. 1 Variations in soil extracellular enzyme activities among three forests ((a), (b) and (c)) and three ground cover plants ((d), (e) and (f)) in summer and winter
2 结果与分析
2.1 土壤胞外酶活力与其矢量特征的时空动态
土壤胞外酶活力在3种森林类型间的差异在夏季和冬季有所不同, 具体表现为, 夏季三类酶的活力均表现为白桦林(Enzyme C = 118.3±12.5, Enzyme N = 344.5±67.3, Enzyme P = 1004.8±203.2)显著高于樟子松林和落叶松林, 而冬季则表现为落叶松林(Enzyme C=77.4±5.1, Enzyme N=363.6±52.5,Enzyme P=177.3±10.6)显著高于樟子松林和白桦林。在时间尺度上, 樟子松林和白桦林代谢碳、氮、磷的酶均表现为冬季显著低于夏季(P<0.05, 图1(a), (b)和(c))。落叶松林则呈现与之不同的季节动态: 碳代谢和磷代谢的酶的活力在夏季和冬季间无显著的季节差异(图1(a)和(c)); 氮代谢酶的活力表现为冬季显著高于夏季(图1(b))。重复测量的方差分析表明, 在研究区域内, 除氮代谢的酶在季节间差异不显著外(F=4.568;P=0.054), 森林类型和季节对三类土壤胞外酶活力均有显著的影响, 并且森林类型和季节间存在显著的交互作用(P<0.01)。
在落叶松林中, 夏季苔藓层的碳酶活力最高(114.7±8.2), 草本层的氮酶(115.1±4.0)以及磷酶(477.7±40.4)的活力最高。冬季三类酶的活力一致表现为苔藓层显著高于杜香和草本层(图1(d), (e)和(f))。胞外酶活力的季节动态在3种地被层间表现不一致: 草本层中参与碳、氮、磷代谢的胞外酶活力均表现为冬季显著低于夏季; 杜香层中碳磷酶的活力表现为冬季显著低于夏季, 氮酶的活力在两季节间无显著差别; 苔藓层则相反, 冬季胞外酶活力显著高于夏季(图1(d), (e)和(f))。不同地被植物和季节均对土壤胞外酶活力有显著影响, 且存在显著的交互作用。
土壤胞外酶活力的矢量图(图2)直观地展示了两个季节间不同森林植被及地被层下土壤微生物代谢的养分及能量限制情况。矢量线段的长度与“能量相对于养分(C vs. nutrient)”的限制程度正相关; 矢量线段与X轴的夹角与“磷相对于氮(P vs. N)”的限制程度正相关。图2中不同植被对应的矢量线段的差异可用来定性地判断不同样点间养分及能量限制情况的差异: 3种森林类型间, 无论夏季还是冬季, 樟子松林和白桦林的矢量图像很接近, 而落叶松林的矢量图像则偏离前两者(图2(a))。落叶松林中, 3种地被植物的土壤胞外酶活力矢量图在冬季和夏季均有明显的差别(图2(b))。
将矢量特征量化后发现: 落叶松的矢量长度夏季(0.59±0.01)显著高于樟子松和白桦, 冬季(0.35± 0.02)则显著低于后两者(图3(a))。樟子松林和白桦林酶活力的矢量长度均表现为冬季显著高于夏季; 落叶松林则相反, 冬季显著低于夏季。矢量角度在3种森林类型间均表现为冬季显著低于夏季, 并且落叶松林的矢量角度在两个季节中始终低于樟子松和白桦林(图3(b))。落叶松林中, 夏季苔藓层矢量长度(1.07±0.02)最高, 冬季杜香层矢量长度(0.60± 0.07)最高(图3(c))。3种地被层土壤胞外酶活力的矢量长度表现出不同的季节差异: 草本层冬季显著高于夏季(P<0.05), 杜香层冬夏无显著差异, 苔藓层冬季显著低于夏季(P<0.05)。矢量角度在3种林下植物间均表现为冬季低于夏季, 其中草本层和苔藓层的季节差异显著(P<0.05, 图3(d))。
皮尔森相关分析表明: 土壤含水量与碳代谢酶(F=0.746,P<0.01)和氮代谢酶(F=0.553,P<0.01)均有显著的相关关系, 而与磷代谢酶无显著的相关关系。土壤pH与氮代谢酶(F=0.416,P<0.05)有显著的相关关系, 而与碳代谢酶和磷代谢酶均无显著的相关关系。土壤碳、氮、磷含量及其化学计量比对三类酶活力均具有显著的影响。酶活力的矢量长度仅与土壤碳、氮含量有显著的负相关; 而矢量角度则与土壤含水量、pH、元素含量及比例均有相关关系(表3)。
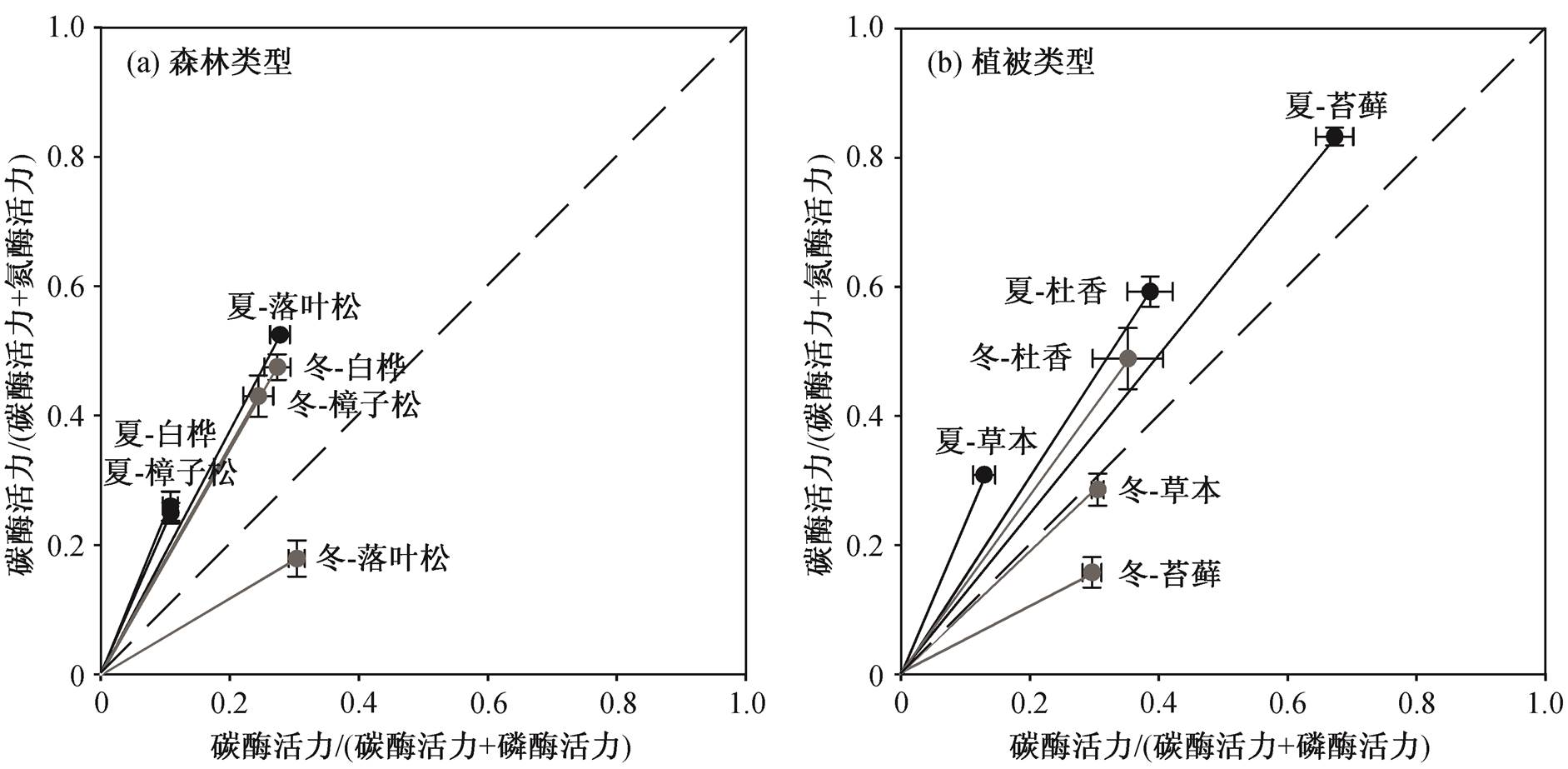
虚线为Y=X
图2 不同森林类型(a)及落叶松林中不同地被层下(b)土壤胞外酶活力的矢量图
Fig. 2 Vectors of soil extracellular enzyme activity among three forests (a) and three ground cover plants (b) in summer and winter
不同大写字母表示不同森林类型或不同林下地被层土壤之间差异的显著性, 不同小写字母表示同一森林类型或同一地被植物下不同季节之间差异的显著性(Duncan’s多重比较,P=0.05); 误差棒代表标准误差, **表示P<0.01, ***表示P<0.001
图3 冬季和夏季各森林类型((a), (b))及落叶松林下地被层((c), (d))的土壤胞外酶活力的矢量长度及矢量角度
Fig. 3 Variations in vector length and vector angle of soil extracellular enzyme activity in three forests ((a), (b)) and three ground cover plants ((c), (d)) in summer and winter
表3 土壤酶活力特征与土壤理化指标的皮尔森相关分析
Table 3 Pearson correlation coefficients between soil enzymatic indices and soil physiochemical properties
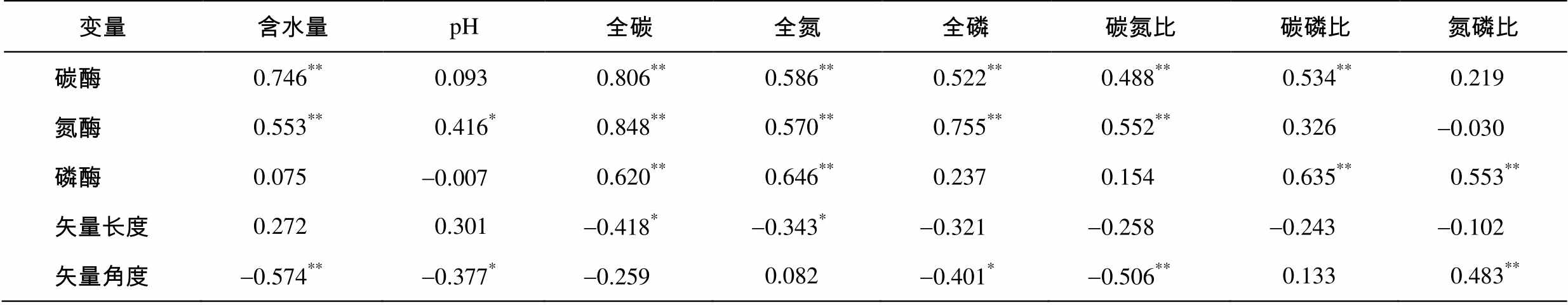
变量含水量pH全碳全氮全磷碳氮比碳磷比氮磷比 碳酶0.746**0.0930.806**0.586**0.522**0.488**0.534**0.219 氮酶0.553**0.416*0.848**0.570**0.755**0.552**0.326-0.030 磷酶0.075-0.0070.620**0.646**0.2370.1540.635**0.553** 矢量长度0.2720.301-0.418*-0.343*-0.321-0.258-0.243-0.102 矢量角度-0.574**-0.377*-0.2590.082-0.401*-0.506**0.1330.483**
注: *表示P<0.05, **表示P<0.01。
2.2 土壤潜在碳矿化速率的时空动态及影响因素
土壤潜在碳矿化速率在不同的森林中呈现不同的季节变化: 樟子松林冬夏无显著差别, 白桦林冬季显著低于夏季, 落叶松林则冬季显著高于夏季。两个季节间, 樟子松林的潜在碳矿化速率均处于最低水平(图4(a))。在落叶松林中, 3种地被层下的土壤潜在碳矿化速率均表现为冬季高于夏季, 并且苔藓层的土壤潜在碳矿化速率(夏季448.0±100.4, 冬季1358.3±150.9; 单位: mgC∙kg-1drysoil∙day-1)始终高于草本层和杜香层(图4(b))。与单位土壤干重的碳矿化速率相似, 单位土壤碳校正的碳矿化速率在本研究区域呈现相同的空间和季节分布格局(图4(c)和(d))。
单因素回归分析初步发现, 土壤潜在碳矿化速率与土壤含水量(R2=0.557,P<0.001)与pH值(R2= 0.154,P=0.018)有显著的回归关系, 与土壤碳酶(R2=0.559,P<0.001)、氮酶(R2=0.741,P<0.001)及酶活力的矢量角度(R2=0.598,P<0.001)有显著的回归关系, 而与土壤磷酶及矢量长度无显著关系(图5)。结构方程模型进一步构建以上因子对潜在碳矿化速率影响的过程机制: 一方面, 土壤含水量会直接影响土壤的碳矿化(P<0.001); 另一方面, 含水量通过影响碳酶活力来影响土壤酶活力的矢量特征, 进而调节土壤碳矿化速率。尽管土壤中碳、氮、磷的酶活力对土壤碳矿化均无显著的直接作用(P>0.05), 但通过影响酶活力的矢量特征而间接调控土壤的潜在碳矿化速率。
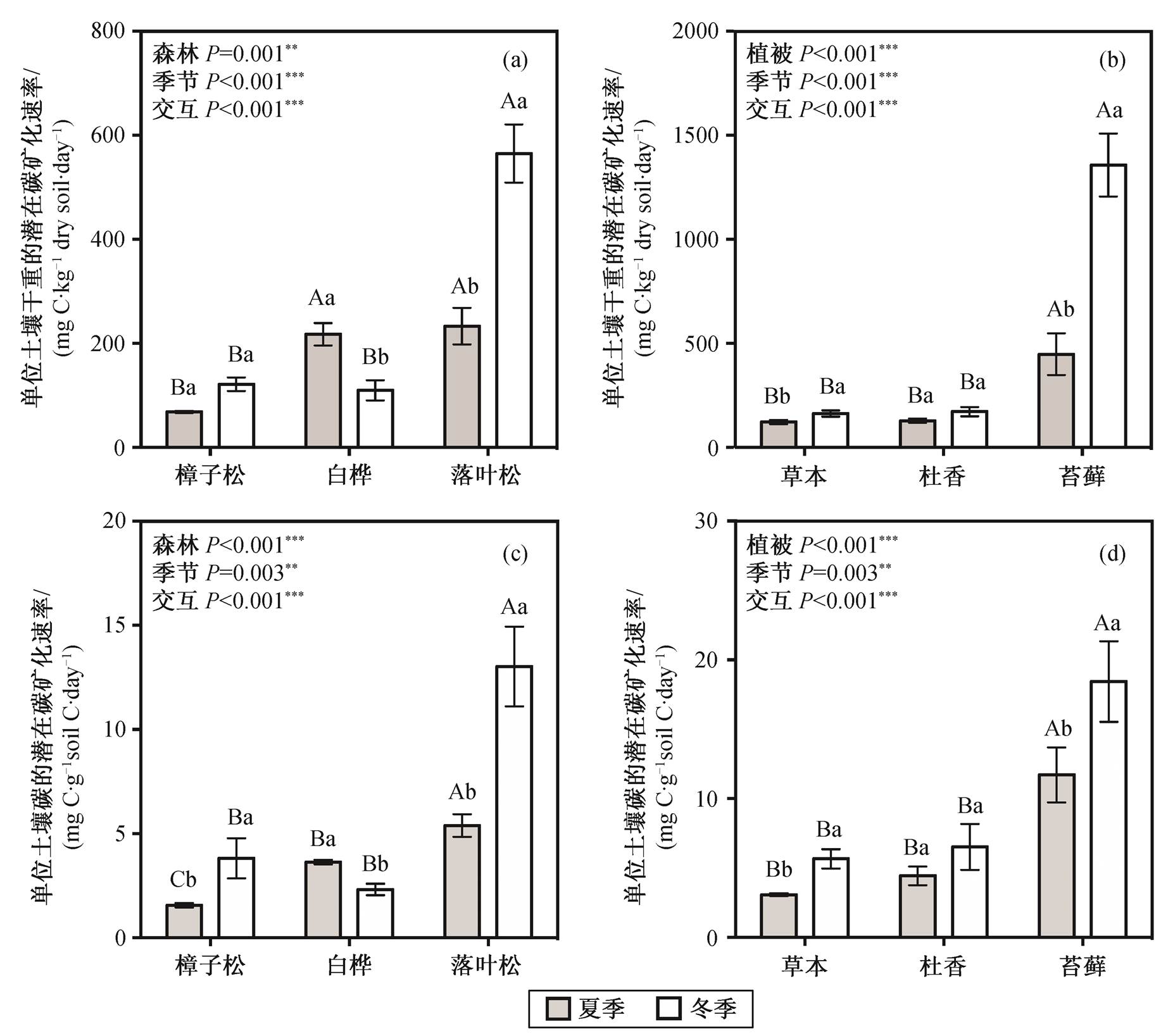
不同大写字母表示不同森林类型或不同林下地被层土壤之间差异的显著性, 不同小写字母表示同一森林类型或同一地被植物下不同季节之间差异的显著性(Duncan’s多重比较,P=0.05); 误差棒代表标准误差, **表示P<0.01, ***表示P<0.001
图4 3种森林类型间((a)和(c))及3种地被植物间((b)和(d))土壤潜在碳矿化速率的季节动态
Fig. 4 Seasonal and spatial variations in potential mineralization rate of soil organic carbon in three forests ((a) and (c)) and three ground cover plants ((b) and (d))
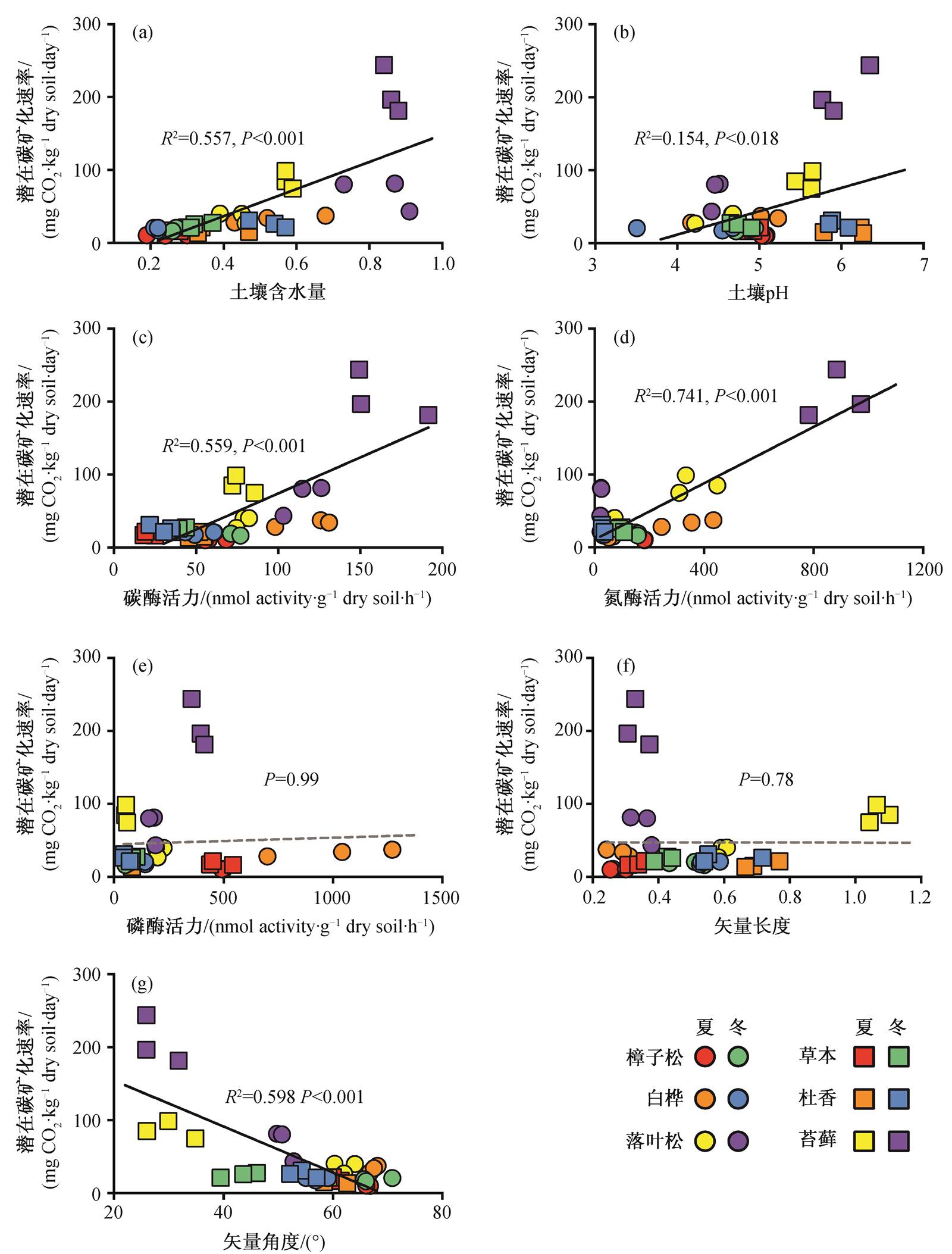
图5 土壤潜在碳矿化速率与土壤理化性质((a)和(b))及胞外酶活力指标((c), (d), (e), (f)和(g))的一般线性回归分析
Fig. 5 General linear regressions between soil potential carbon mineralization rate and soil physiochemical properties ((a), (b)) as well as enzymatic indices ((c), (d), (e), (f) and (g))
3 讨论
3.1 土壤胞外酶活力的时空动态
除落叶松林下的苔藓层中胞外酶活力出现冬季显著高于夏季外, 其他两种地被植物以及樟子松林和白桦林土壤均表现为冬季显著低于夏季。落叶松林中的季节差异不同于樟子松林和白桦林, 也是由于受到苔藓的影响而产生。除苔藓层外, 其他地被层下胞外酶活力冬季低于夏季的结果与已有的部分研究一致[37]。在环境相对恶劣的严寒冬季, 微生物会采用降低胞外酶的生产来减少能量的消耗生存策略[38]。此外, 尽管本研究区域冬季含水量未见明显的降低, 但冻土中的水分移动性差, 造成胞外酶合成的热点区域中底物运输受限制, 进而影响胞外酶的生产[39]。但是, 仍有研究得到与本研究中苔藓层土壤冬季胞外酶活力较高的相同结果, 例如, Puis-sant等[40]在亚高山地区的研究发现冬季水解酶的活力最高。这很可能是由于苔藓、地衣等植物多见于高山苔原生态系统中, 对寒冷环境具有相对更好的适应性, 对冬季的低温环境产生另外一种响应策略: 低温导致胞外酶降解底物的效率降低, 微生物反而会增加胞外酶的生产, 以保证原位土壤中的代谢活力[41–42]。以往的研究很少关注同种环境中不同植被下土壤胞外酶季节动态的差别。植物通过根系向土壤释放能量来源, 并从土壤中吸收养分[43–44]; 植物的凋落物中包含大量的纤维素、半纤维素、木质素等, 又是土壤重要的养分来源[45–46]。因此, 植物种类的不同会影响土壤中的能量和养分库, 进而对胞外酶的合成产生影响。本研究发现, 落叶松林中, 不同地被植物下土壤的胞外酶活力呈现不同的季节变化, 再一次表明植物对地下生态过程具有重要的调控作用。此外, 作为一种孢子繁殖的低级高等植物, 苔藓对生物地球化学循环的过程具有重要作用, 进而对生态系统产生强烈的影响[47]。本研究进一步证明, 苔藓可能会引起地下土壤中微生物群落结构的较大变化, 以至呈现不同的越冬策略, 产生与其他植物地下微生物过程不同的季节性规律。因此, 在土壤生态学的研究中, 应当考虑同一生态系统中不同地被植物下土壤微生物过程可能有所差异的情况。另外, 还应加强探索苔藓与其他植物代谢过程的区别, 进而深入理解植物–土壤–微生物之间的调节与反馈机制。
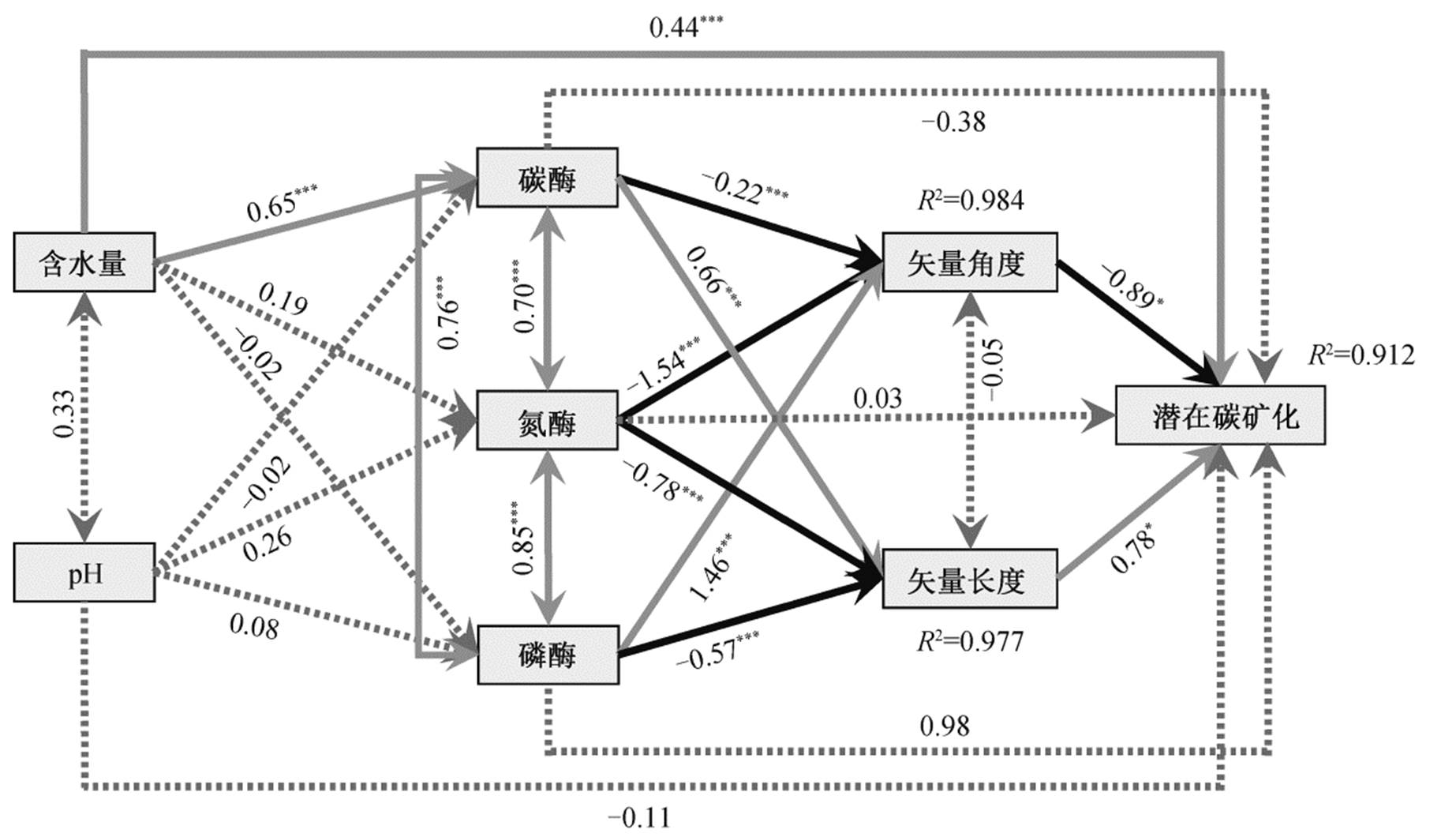
χ2=0.738,P=0.56, df=4; 灰色实线箭头表示显著的正向作用, 黑色箭头表示显著的负向作用, 虚线表示非显著的作用;
单箭头表示单一变量对因变量的单向作用, 双箭头表示两个相关变量之间的协方差, **表示P<0.05, ***表示P<0.001
图6 土壤含水量、pH和酶活力对潜在碳矿化速率影响的结构方程模型
Fig. 6 Structural equation modelling of soil moisture, pH, and enzymatic properties on potential carbon mineralization rate
本研究测定的两项土壤指标(含水量和pH)均与磷代谢的酶无显著的相关关系, 其中pH只与氮代谢的酶有显著的相关性(F=0.416,P<0.05), 如图6所示。这与以往大部分研究的结论“土壤pH对于胞外酶活力有重要影响”不相符[30,48], 但与近期在林草交错带上展开的胞外酶活力空间变化研究的结果一致[49]: 土壤pH对胞外酶活力的影响并不是最重要的。Baldrian[50]发现土壤pH通常在大于1km2的区域上才能表现出显著的影响力。已有的研究[12,14–15]发现, pH能够对土壤胞外酶活力产生显著的影响, 这些研究的共同特征是pH呈现较强的空间异质性, 而本研究是在小的研究区域内, 土壤pH在不同样点间相对稳定, 因此pH与胞外酶活力的相关性较弱。土壤胞外酶的潜在活力与土壤碳氮磷含量具有显著的相关关系, 证明在养分含量越高的土壤中, 胞外酶活力越强。
3.2 微生物代谢的养分及能量限制
通过土壤胞外酶活力的矢量图法[36]和资源分配学说[51], 可证明矢量的长度越长, 土壤对碳代谢的酶的投资越大, 反映能量的限制越大; 矢量的角度越小, 土壤对氮酶的投资相对于磷酶的投资越大, 反映土壤养分(Pvs.N)更趋向于氮限制。结合本研究的结果表明, 从夏季到冬季, 樟子松林和白桦林的矢量长度显著增加, 说明能量相对于养分的限制程度明显增加。落叶松林则相反, 能量对于养分的限制程度明显降低, 这是由苔藓在冬季的养分限制明显减弱造成的整体养分限制减弱。胞外酶活力的矢量角度在3种森林中以及落叶松林下的3种地被植物中均表现为冬季低于夏季, 并且除杜香层外, 季节差异均显著, 证明在研究区域内, 冬季的氮限制相对更强, 夏季的磷限制相对更强。结合土壤中元素含量的化学计量结果, 尽管矢量长度与土壤元素的碳氮比及碳磷比均未见显著的相关关系, 但相关系数均为负值, 也揭示微生物将生产更多的胞外酶来释放限制性较强的元素的趋势。相似地, 土壤胞外酶活力的矢量角度与氮磷比具有显著的正相关关系, 同样暗示胞外酶调节资源分配的过程: 土壤氮磷比较高时, 土壤资源呈现磷相对于氮的限制, 微生物会增加磷酶的分配, 以便满足代谢需求, 因此呈现更大的矢量角度。
土壤含水量、pH值均与矢量角度负相关, 表明随着土壤含水量的增加或pH的增加, 土壤养分的限制由氮限制的方向向磷限制的方向转化。这是由于含水量增加会加剧土壤无机盐的淋溶流失, 其中磷元素的流失尤其严重[14,52–53]。此外, 土壤中酸性磷酸酶活力随着pH值的增加而降低, 微生物对磷元素的需求促进了磷代谢的酶的生产[54]。
3.3 土壤潜在碳矿化速率的环境及生物调控
从整体上看, 除白桦林土壤冬季潜在碳矿化速率低于夏季外, 樟子松林及落叶松林的3种地被植物土壤中, 土壤潜在碳矿化速率均在冬季呈现更高的水平, 这与以往对积雪覆盖的亚高山生态系统的研究结果[26]相符合。从微生物群落及功能的角度分析, 土壤中微生物组成在冬季表现为真菌占优势,且真菌在土壤有机质分解过程中占主导作用[55]。白桦林的有机碳矿化速率在冬季却低于夏季, 这是由于只有白桦林土壤的含水量在冬季低于夏季, 含水量的降低会抑制底物的扩散速率[56], 同时减缓有机物的分解速率。
结合回归分析和结构方程模型的结果, 土壤潜在碳矿化速率与含水量呈显著的正相关关系, 这与以往的结果[57–58]一致。土壤含水量对碳矿化的影响一部分表现为含水量增加会提高反应物的扩散速率和微生物代谢水平, 直接提高反应的效率[56,59–60]。本研究进一步揭示, 含水量通过影响不同功能胞外酶的相对活力来影响矢量特征, 进一步对土壤碳矿化速率产生间接的作用。尽管土壤pH在单因素回归分析中表现出对碳矿化速率的显著影响, 但结构方程模型的结果却未检验出pH对碳矿化速率的直接影响路径。同时, 由于本研究中pH的波动范围较小, 尚未对酶活力产生显著的影响, 因此pH对碳矿化速率的影响较弱。由于酶活力的皮尔森相关分析已表明胞外酶活力与土壤元素含量具有很强的相关性及共线性(表3), 为避免分析结果中的解释因子作用冗余, 本研究在分析土壤碳矿化速率的结构方程模型中未纳入土壤元素含量的特征, 更侧重于探讨酶活力指标的影响。尽管与碳、氮、磷代谢相关的三类酶活力对碳矿化速率无显著的直接作用, 却能通过影响酶活力的矢量特征来影响碳矿化速率。这一结构方程模型的分析结果检验了土壤酶活力对土壤呼吸的影响过程, 揭示了矢量特征在预测土壤碳排放中的重要作用。
3.4 局限与展望
在以往的研究中, 室内培养法测定的土壤潜在碳矿化速率需用温度敏感度Q10校正才能反映冬季原位的土壤碳矿化水平[61]。本研究的重点在于探索环境因素(土壤含水量与pH值)和生物因素(胞外酶活力)对土壤有机碳分解的影响。并且, 胞外酶活力均是在25°C室内环境下测定, 因此未对冬季的土壤潜在碳矿化速率进行校正。这样, 尽管统一了酶活力和土壤碳矿化速率的测定温度, 却只能反映25°C下土壤潜在碳矿化速率, 无法模拟冬季原位的真实情况[24], 在分析冬季碳排放及调控机制方面尚有欠缺。在测定土壤碳矿化的过程中, 酸碱滴定法造成的手动测量误差较大, 虽然能够比较不同森林和植被层下土壤中碳矿化速率的相对大小, 但难以准确地表示真实水平。此外, 本研究重点在于探讨土壤酶活力对潜在碳矿化的影响, 没有将微生物的生物量纳入考量的影响因素。在结构方程模型的结果中, 尽管土壤碳矿化速率的91%能够被酶活力特征、含水量和pH共同解释, 但酶活力的被解释部分很小。在以后的研究中, 同时考虑微生物对酶活力的影响, 将会进一步推动对土壤碳矿化驱动机制的探索。
4 结论
本研究综合大兴安岭3种森林(樟子松林、白桦林、落叶松林)及落叶松林中3种地被植物(草本、杜香、苔藓)间土壤胞外酶活力和土壤潜在碳矿化速率的季节动态, 发现从夏季到冬季, 寒温带森林生态系统的胞外酶活力大部分呈现显著降低的趋势, 而苔藓层与此相反。从能量及养分限制的角度考虑, 研究区域整体上夏季养分限制较强, 冬季能量限制较强, 苔藓则相反; 所有的采样点一致表现为夏季磷限制较强, 冬季氮限制较强。此外, 土壤潜在碳矿化速率在冬季增强, 其中苔藓层的提升幅度最大。结构方程模型证明, 环境因子及酶活力能够通过影响酶活力的矢量特征来影响土壤潜在碳矿化速率。基于以上的结果, 本研究证明相同气候型的生态系统中及同一森林中不同林下植被土壤中可能存在胞外酶活力及化学计量的季节动态的差异, 其中苔藓的独特性在后续的研究中不可忽视。进一步地, 通过研究胞外酶活力与土壤潜在碳矿化速率, 发现胞外酶的矢量特征与土壤潜在碳矿化速率之间存在着显著的相关关系, 为进一步探寻土壤有机质分解的驱动机制提供了参考。
参考文献
[1]Sinsabaugh R L, Follstad Shah J F. Ecoenzymatic stoichiometry and ecological theory. Annual Review of Ecology Evolution & Systematics, 2012, 43(1): 313–343
[2]Allison S D, Vitousek P M. Extracellular enzyme activities and carbon chemistry as drivers of tropical plant litter decomposition. Biotropica, 2004, 36(3): 285–296
[3]Asmar F, Eiland F, Nielsen N E. Effect of extracellular-enzyme activities on solubilization rate of soil orga-nic nitrogen. Biology and Fertility of Soils, 1994, 17 (1): 32–38
[4]Dorodnikov M, Blagodatskaya E, Blagodatsky S, et al. Stimulation of microbial extracellular enzyme activities by elevated CO2depends on soil aggregate size. Global Change Biology, 2009, 15(6): 1603–1614
[5]Fanin N, Moorhead D, Bertrand I. Eco-enzymatic stoichiometry and enzymatic vectors reveal differen-tial C, N, P dynamics in decaying litter along a land-use gradient. Biogeochemistry, 2016, 129(1): 21–36
[6]Loeppmann S, Blagodatskaya E, Pausch J, et al. Enzyme properties down the soil profile — a matter of substrate quality in rhizosphere and detritusphere. Soil Biology & Biochemistry, 2016, 103: 274–283
[7]Sinsabaugh R L, Hill B H, Shah J J F. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment. Nature, 2009, 462: 795–798
[8]Amin B A Z, Chabbert B, Moorhead D, et al. Impact of fine litter chemistry on lignocellulolytic enzyme efficiency during decomposition of maize leaf and root in soil. Biogeochemistry, 2014, 117(1): 169–183
[9]Bell C, Carrillo Y, Boot C M, et al.Rhizosphere stoichiometry: are C:N:P ratios of plants, soils, and enzymes conserved at the plant species-level?. New Phytologist, 2014, 201(2): 505–517
[10]Loeppmann S, Blagodatskaya E, Pausch J, et al. Enzyme properties down the soil profile — a matter of substrate quality in rhizosphere and detritusphere. Soil Biology & Biochemistry, 2016, 103: 274–283
[11]Wallenstein M D, Weintraub M N. Emerging tools for measuring and modeling the in situ activity of soil extracellular enzymes. Soil Biology & Biochemistry, 2008, 40(9): 2098–2106
[12]Henry H A L. Soil extracellular enzyme dynamics in a changing climate. Soil Biology & Biochemistry, 2012, 47(47): 53–59
[13]Baldrian P, Merhautová V, Cajthaml T. Small-scale distribution of extracellular enzymes, fungal, and bacterial biomass in Quercus petraea forest topsoil. Biology and Fertility of Soils, 2010, 46(7): 717–726
[14]Xu Z, Yu G, Zhang X, et al. Soil enzyme activity and stoichiometry in forest ecosystems along the North-South Transect in eastern China (NSTEC). Soil Bio-logy & Biochemistry, 2017, 104: 152–163
[15]Burns R G, DeForest J L, Marxsen J, et al. Soil enzymes in a changing environment: current know-ledge and future directions. Soil Biology & Bio-chemistry, 2013, 58(2): 216–234
[16]Wiedermann M M, Kane E S, Potvin L R, et al. Interactive plant functional group and water table effects on decomposition and extracellular enzyme activity in Sphagnum, peatlands. Soil Biology & Biochemistry, 2017, 108: 1–8
[17]Pathan S I, Žifčáková L, Ceccherini M T, et al. Seasonal variation and distribution of total and active microbial community ofβ-glucosidase encoding genes in coniferous forest soil. Soil Biology & Bioche-mistry, 2017, 105: 71–80
[18]Yao H, Bowman D, Shi W. Seasonal variations of soil microbial biomass and activity in warm- and cool-season turfgrass systems. Soil Biology & Biochemis-try, 2011, 43(7): 1536–1543
[19]Löffler U C M, Cypionka H, Löffler J. Soil microbial activity along an arctic-alpine altitudinal gradient from a seasonal perspective. European Journal of Soil Science, 2008, 59(5): 842–854
[20]Baldrian P, Šnajdr J, Merhautová V, et al. Responses of the extracellular enzyme activities in hardwood forest to soil temperature and seasonality and the potential effects of climate change. Soil Biology & Biochemistry, 2013, 56: 60–68
[21]Steinweg J M, Dukes J S, Paul E A, et al. Microbial responses to multi-factor climate change: effects on soil enzymes. Frontiers in Microbiology, 2013, 4: 146
[22]Jassey V E J, Chiapusio G, Gilbert D, et al. Experimental climate effect on seasonal variability of polyphenol/phenoloxidase interplay along a narrow fen–bog ecological gradient in Sphagnum fallax. Global Change Biology, 2011, 17(9): 2945–2957
[23]Luo L, Gu J D. Seasonal variability of extracellular enzymes involved in carbon mineralization in sedi-ment of a subtropical mangrove wetland. Geomicro-biology Journal, 2015, 32(1): 68–76
[24]Hanson P J, Edwards N T, Garten C T, et al. Separating root and soil microbial contributions to soil respiration: a review of methods and observations. Biogeochemistry, 2000, 48(1): 115–146
[25]Bond-Lamberty B, Wang C, Gower S T. A global relationship between the heterotrophic and autotrophic components of soil respiration?. Global Change Bio-logy, 2004, 10(10): 1756–1766
[26]Zhang X, Wang W, Chen W, et al. Comparison of seasonal soil microbial process in snow-covered temperate ecosystems of northern china. PLoS One, 2014, 9(3): e92985
[27]Sinsabaugh R L. Enzymatic analysis of microbial patterns and processes. Biology & Fertility of Soils, 1994, 17(1): 69–74
[28]Jackson C R, Foreman C M, Sinsabaugh R L. Mic-robial enzyme activities as indicators of organic matter processing rates in a Lake Erie coastal wet-land. Freshwater Biology, 1995, 34(2): 329–342
[29]Moorhead D L, Rinkes Z L, Sinsabaugh R L, et al. Dynamic relationships between microbial biomass, respiration, inorganic nutrients and enzyme activities: informing enzyme-based decomposition models. Fron-tiers in Microbiology, 2013, 4: 223
[30]Peng X, Wang W. Stoichiometry of soil extracellular enzyme activity along a climatic transect in temperate grasslands of northern China. Soil Biology & Bioche-mistry, 2016, 98: 74–84
[31]宋利臣, 何平平, 崔晓阳. 重度林火对大兴安岭土壤生境因子的影响. 生态学杂志, 2015, 34(7): 1809–1814
[32]Zhang M, Teng Y, Xu Z, et al. Cumulative effects of repeated chlorothalonil application on soil microbial activity and community in contrasting soils. Journal of Soils and Sediments, 2016, 16(6): 1754–1763
[33]Freeman C, Liska G, Ostle N J, et al. The use of fluorogenic substrates for measuring enzyme activity in peatlands. Plant and Soil, 1995, 175(1): 147–152
[34]Marx M C, Wood M, Jarvis S C. A microplate fluori-metric assay for the study of enzyme diversity in soils. Soil Biology & Biochemistry, 2001, 33(12/13): 1633–1640
[35]Winkler J P, Cherry R S, Schlesinger W H. The Q10relationship of microbial respiration in a temperate forest soil. Soil Biology & Biochemistry, 1996, 28(8): 1067–1072
[36]Moorhead D L, Sinsabaugh R L, Hill B H, et al. Vector analysis of ecoenzyme activities reveal cons-traints on coupled C, N and P dynamics. Soil Bio-logy & Biochemistry, 2016, 93: 1–7
[37]Kaiser C, Koranda M, Kitzler B, et al. Belowground carbon allocation by trees drives seasonal patterns of extracellular enzyme activities by altering microbial community composition in a beech forest soil. New Phytologist, 2010, 187(3): 843–858
[38]Schimel J, Balser T C, Wallenstein M. Microbial stress-response physiology and its implications for ecosystem function. Ecology, 2007, 88(6): 1386–1394
[39]Davidson E A, Janssens I A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change. Nature, 2006, 440: 165–173
[40]Puissant J, Cécillon L, Mills R T E, et al. Seasonal influence of climate manipulation on microbial commu-nity structure and function in mountain soils. Soil Biology & Biochemistry, 2015, 80: 296–305
[41]Koch O, Tscherko D, Kandeler E. Temperature sensiti-vity of microbial respiration, nitrogen mineralization, and potential soil enzyme activities in organic alpine soils. Global Biogeochemical Cycles, 2007, 21(4): 497–507
[42]Bell T H, Klironomos J N, Henry H A L. Seasonal responses of extracellular enzyme activity and micro-bial biomass to warming and nitrogen addition. Soil Science Society of America Journal, 2010, 74(3): 820–828
[43]Gregory P J. Roots, rhizosphere and soil: the route to a better understanding of soil science?. European Journal of Soil Science, 2006, 57(1): 2–12
[44]Paterson E, Gebbing T, Abel C, et al. Rhizodeposition shapes rhizosphere microbial community structure in organic soil. New Phytologist, 2007, 173(3): 600–610
[45]Marschner P, Marhan S, Kandeler E. Microscale dis-tribution and function of soil microorganisms in the interface between rhizosphere and detritusphere. Soil Biology & Biochemistry, 2010, 49(6): 174–183
[46]Nannipieri P, Giagnoni L, Renella G, et al. Soil enzy-mology: classical and molecular approaches. Biology and Fertility of Soils, 2012, 48(7): 743–762
[47]Crowley K F, Bedford B L. Mosses influence phos-phorus cycling in rich fens by driving redox con-ditions in shallow soils. Oecologia, 2011, 167(1): 253–264
[48]Sinsabaugh R L, Lauber C L, Weintraub M N, et al. Stoichiometry of soil enzyme activity at global scale. Ecology Letters, 2008, 11(11): 1252–1264
[49]Banerjee S, Bora S, Thrall P H, et al. Soil C and N as causal factors of spatial variation in extracellular enzyme activity across grassland-woodland ecotones. Applied Soil Ecology, 2016, 105: 1–8
[50]Baldrian P. Distribution of extracellular enzymes in soils: spatial heterogeneity and determining factors at various scales. Soil Science Society of America Journal, 2014, 78(1): 11–18
[51]Waring B G, Weintraub S R, Sinsabaugh R L. Ecoen-zymatic stoichiometry of microbial nutrient acquisi-tion in tropical soils. Biogeochemistry, 2014, 117(1): 101–113
[52]Santiago L S, Eag S, Silvera K. Nutrient cycling and plant-soil feedbacks along a precipitation gradient in lowland Panama. Journal of Tropical Ecology, 2005, 21(4): 461–470
[53]Jost G, Dirnböck T, Grabner M T, et al. Nitrogen leaching of two forest ecosystems in a karst watershed. Water, Air, & Soil Pollution, 2011, 218(1): 633–649
[54]Turner B L. Variation in pH optima of hydrolytic enzyme activities in tropical rain forest soils. Applied & Environmental Microbiology, 2010, 76(19): 6485–6493
[55]Björk R G, Björkman M P, Andersson M X, et al. Temporal variation in soil microbial communities in Alpine tundra. Soil Biology & Biochemistry, 2008, 40(1): 266–268
[56]Ali R S, Ingwersen J, Demyan M S, et al. Modelling in situ, activities of enzymes as a tool to explain seasonal variation of soil respiration from agro-ecosystems. Soil Biology & Biochemistry, 2015, 81: 291–303
[57]Mariko S, Urano T, Asanuma J. Effects of irrigation on CO2and CH4fluxes from Mongolian steppe soil. Journal of Hydrology, 2007, 333(1): 118–123
[58]Yan L, Chen S, Huang J, et al. Differential responses of auto- and heterotrophic soil respiration to water and nitrogen addition in a semiarid temperate steppe. Global Change Biology, 2009, 16(8): 2345–2357
[59]Brockett B F T, Prescott C E, Grayston S J. Soil mois-ture is the major factor influencing microbial commu-nity structure and enzyme activities across seven bio-geoclimatic zones in western Canada. Soil Biology & Biochemistry, 2012, 44(1): 9–20
[60]Fierer N, Schimel J P. Effects of drying–rewetting frequency on soil carbon and nitrogen transformations. Soil Biology & Biochemistry, 2002, 34(6): 777–787
[61]Wang W, Peng S, Tao W, et al. Winter soil CO2efflux and its contribution to annual soil respiration in different ecosystems of a forest-steppe ecotone, north China. Soil Biology & Biochemistry, 2010, 42(3): 451–458
Spatiotemporal Dynamics of Soil Extracellular Enzyme Activity and Its Influence on Potential Mineralization Rate of Soil Organic Carbon in Forests of Daxing’an Mountain Range
ZUO Yiping1,2, ZHANG Xinyue3, ZENG Hui1, WANG Wei2,†
1. Shenzhen Graduate School, Peking University, Shenzhen 518055; 2. College of Urban and Environment, Peking University, Beijing 100871; 3. China Academy of Agricultural Sciences, Beijing 100081; † Corresponding author, E-mail: wangw@urban.pku.edu.cn
AbstractIn order to explore spatiotemporal dynamics of soil extracellular enzyme activity (EEA) and its influence on potential mineralization rate of soil organic carbon (SOC) of the Daxing’an Mountain range, soil samples of three forests (Pinus sylvestrisforest; Birch forest; Larch pine forest) and three ground cover plants in Larch forest (Grass; Ledum; Moss) were collected from Daxing’an Mountain range in summer and winter. Activities of six enzymes including carbon- (C) (β-1,4-glucosidase,β-1,4-xylosidase,β-D-cellobiohydrolase), nitrogen- (N) (N-acetyl-β-glucosaminidase, leucine aminopeptidase) and phosphorus- (P) (acid phosphatase) acquisition, potential mineralization rate of SOC and main environmental factors were analyzed and potential driving mechanisms were explored. Results showed that BothPinus sylvestrisforest and Birch forest exhibited significant higher activities of enzyme C, N and P in summer, however, Larch forest showed contrary seasonal dynamic with soil EEA of moss soil significantly higher in winter.From summer to winter, soils of three forests and three ground cover plants all experienced reduced P vs. N limitation. Besides, soils ofPinus sylvestrisforest and Birch forest both experienced increased C vs. nutrient limitation, however, Larch forest showed contrary seasonal dynamics with the existence of moss. InPinus sylvestrisforest and Larch forest, potential mineralization rate of SOC exhibited higher in winter while Birch forest showed contrary trend. Analysis showed that potential mineralization rate of SOC was influenced by enzyme C and enzyme N significantly, whereas little influenced by enzyme P. C vs. nutrient limitation had little correlation while P vs. N limitation had significant negative correlation with potential carbon mineralization rate.
Key wordssoil extracellular enzyme; potential carbon mineralization rate; seasonal dynamics; forest types; ground cover plants
中图分类号Q948
doi:10.13209/j.0479-8023.2018.089
国家自然科学基金(31222011, 31270363和31070428)资助
收稿日期:2017-12-29;
修回日期:2018-03-17;
网络出版日期:2018-11-04








